Похожие презентации:
Растворы. Концентрация растворов. Электролитическая диссоциация
1. 6.1. Растворы. Концентрация растворов. Электролитическая диссоциация
Глава 6.Растворы.
6.1. РАСТВОРЫ. КОНЦЕНТРАЦИЯ
РАСТВОРОВ. ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ
2.
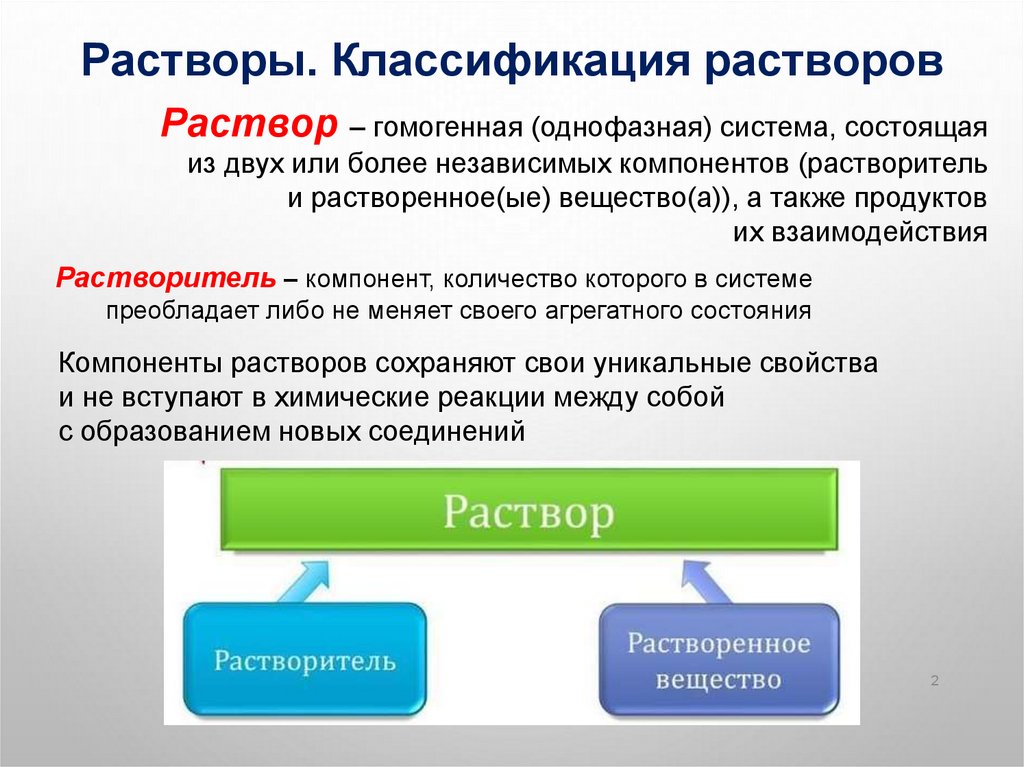
Растворы. Классификация растворовРаствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
Компоненты растворов сохраняют свои уникальные свойства
и не вступают в химические реакции между собой
с образованием новых соединений
2
3.
Растворы. Классификация растворовПо агрегатному состоянию:
Газообразные растворы
(Смесь газов)
воздух – это раствор
кислорода, паров воды,
углекислого газа (СО2) и
благородных газов в азоте
Жидкие растворы
1. растворы твердых веществ в
жидкостях:
соль+Н2О, сахар+Н2О , йод+Н2О
2. растворы газообразных веществ в
жидкостях:
лимонады, нашатырный
спирт
3. растворы жидкостей в жидкостях:
уксус, водка
3
4.
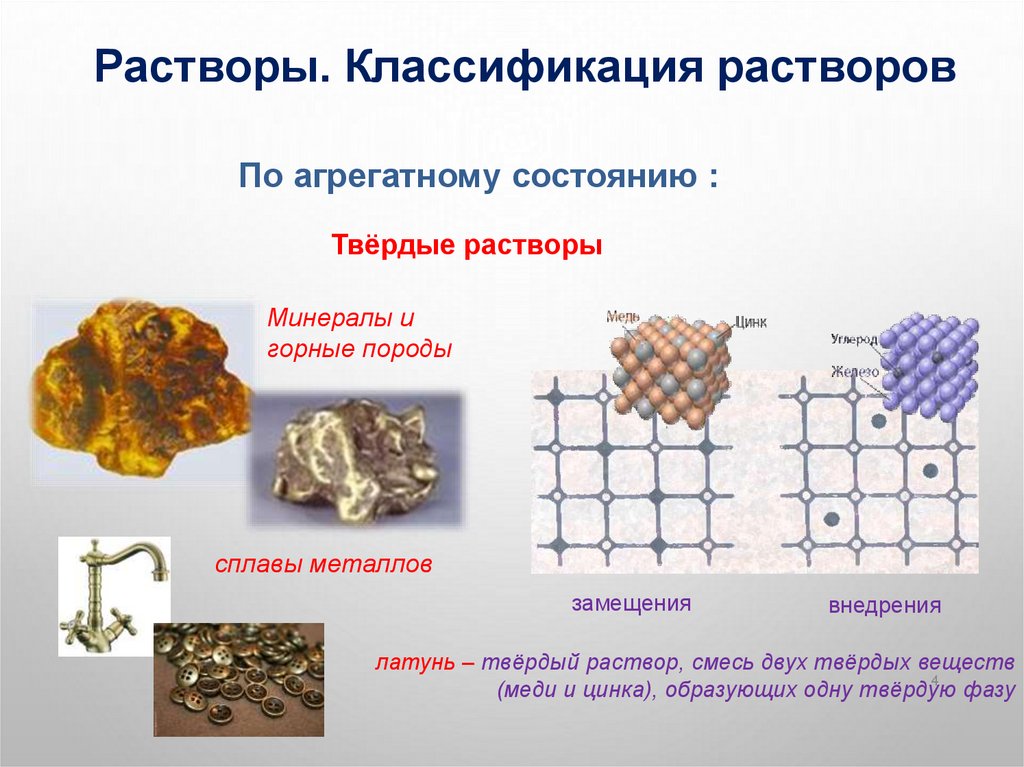
Растворы. Классификация растворовПо агрегатному состоянию :
Твёрдые растворы
Минералы и
горные породы
сплавы металлов
замещения
внедрения
латунь – твёрдый раствор, смесь двух твёрдых веществ
4
(меди и цинка), образующих одну твёрдую фазу
5.
Растворы. Классификация растворовПо относительным количествам растворенного
вещества:
разбавленные и концентрированные
По соотношению преобладания частиц,
переходящих в раствор и удаляющихся из раствора:
ненасыщенные, насыщенные и пересыщенные
Раствор
концентрация
которого
ниже
концентрации
насыщенного
раствора
называется
ненасыщенным
Насыщенный раствор – это
раствор, который находится в
равновесии с твёрдой фазой
растворенного
вещества
и
содержит
максимально
возможное
при
данных условиях количество
этого вещества
Пересыщенный
раствор - раствор,
в котором при данной
температуре
содержится большее
количество
растворенного
вещества,
чем
возможно
в
насыщенном
растворе
5
6.
Растворы. Классификация растворовПо размеру частиц:
Истинный раствор – однофазная система, образованная
не менее чем двумя компонентами (т.е. компоненты равномерно
распределены в системе на уровне атомов, молекул или ионов)
Коллоидный раствор – тонкодисперсная
(гетерогенная) система с размерами частиц
от 500 до 1 нм
при пропускании через него луча света
образуется светящаяся дорожка – конус
Эмульсия – дисперсная система, состоящая
из микроскопических капель жидкости
(дисперсной фазы), распределенных
в другой жидкости (дисперсионной среде
Суспензия или взвесь – это грубодисперсная
система с твёрдой дисперсной фазой и
жидкой дисперсионной средой
6
7.
Физические и химические процессы прирастворении
Физическая теория растворов – идея
индифферентности и подобия газовым системам
(Я.Вант-Гофф)
Процесс растворения является результатом диффузии, т.е.
проникновением растворенного вещества в промежутки
между молекулами растворителя, т.е. физическое явление
(Вант-Гофф, Аррениус, Оствальд)
Якоб Хендрик
Вант-Гофф
Химическая теория (Д.И.Менделеев)
Растворение является результатом химического
взаимодействия растворенного вещества с
молекулами растворителя, т.е. химическое явление
Сольватация – процесс взаимодействия
растворителя и растворённого вещества
7
Дмитрий Иванович
Менделеев
8.
Физические и химические процессы прирастворении
Механическая
смесь
Раствор
• переменность состава
• непрерывная, плавная
зависимость свойств от состава
Химическое
соединение
• однородность состава по всей фазе
• наличие
теплового
эффекта
при образовании
Физико-химическая теория растворов
8
9.
Физические и химические процессыпри растворении
Тепловой эффект, сопровождающий процесс растворения,
относящийся к 1 молю растворенного вещества называется
молярной теплотой растворения ∆Нраств.
∆Н1 > 0 – количество теплоты, затраченной на распределение частиц растворяемого
вещества среди молекул растворителя (процесс эндотермический)
∆Н2 < 0 – количество теплоты, выделяющейся при взаимодействии растворенного
вещества с молекулами растворителя и образование связей между ними
(тепловой эффект сольватации, процесс экзотермический)
для твёрдого вещества:
∆Н1 > 0 – энергия, необходимая для разрушения кристаллической решетки и
энергия необходимая для разрыва связей между молекулами
растворителя (процесс эндотермический)
В зависимости от преобладания первой или второй составляющих,
процесс растворения может быть экзотермическим или эндотермическим:
если │∆Н2│> │∆Н1│, процесс экзотермический и ∆Нраств. < 0
если │∆Н2│< │∆Н1│, процесс эндотермический и ∆Нраств. > 0
KOH
∆Нраств. = –55.65 кДж/моль
NH4NO3
∆Нраств. = 26.48 кДж/моль
9
10.
Способы выражения концентрацииКонцентрация – соотношение между количеством
растворенного вещества и растворителя или количеством
растворенного вещества и всего раствора
m
i
Способы выражения концентрации растворов
• Массовая доля ( ) – отношение массы растворенного
вещества к массе раствора
i
• Объемная доля ( ) – отношение объема растворенного
вещества к объему раствора
i
j
100
k
k 1
Xi
• Молярная доля (X) – отношение числа молей растворенного
вещества к сумме числа молей всех компонентов раствора
i
j
100
mk
k 1
i
j
100
k
k 1
• Молярная концентрация (молярность) (См, моль/л) – число моль
растворенного вещества в одном литре раствора
• Нормальная концентрация или молярная концентрация
эквивалента (нормальность) (Сн, моль экв/л) – число моль
эквивалентов растворенного вещества, содержащихся
в одном литре раствора
1 м р-р H2SO4 = 2 н р-р H2SO4
• Титр (СТ, мг/мл или г/мл) – масса растворенного вещества,
содержащаяся в одном миллилитре раствора
• Моляльность (Сm, моль/кг) – число моль растворенного вещества,
приходящееся на 1 кг растворителя
10
11.
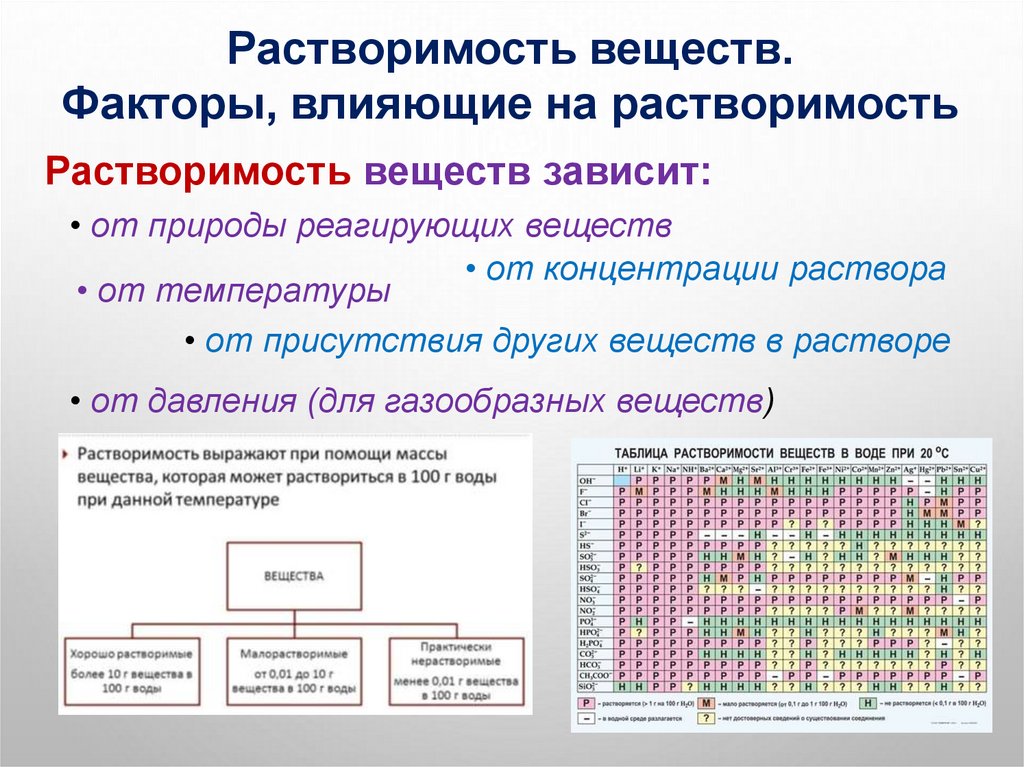
Растворимость веществ.Факторы, влияющие на растворимость
Растворимость веществ зависит:
• от природы реагирующих веществ
• от концентрации раствора
• от температуры
• от присутствия других веществ в растворе
• от давления (для газообразных веществ)
11
12.
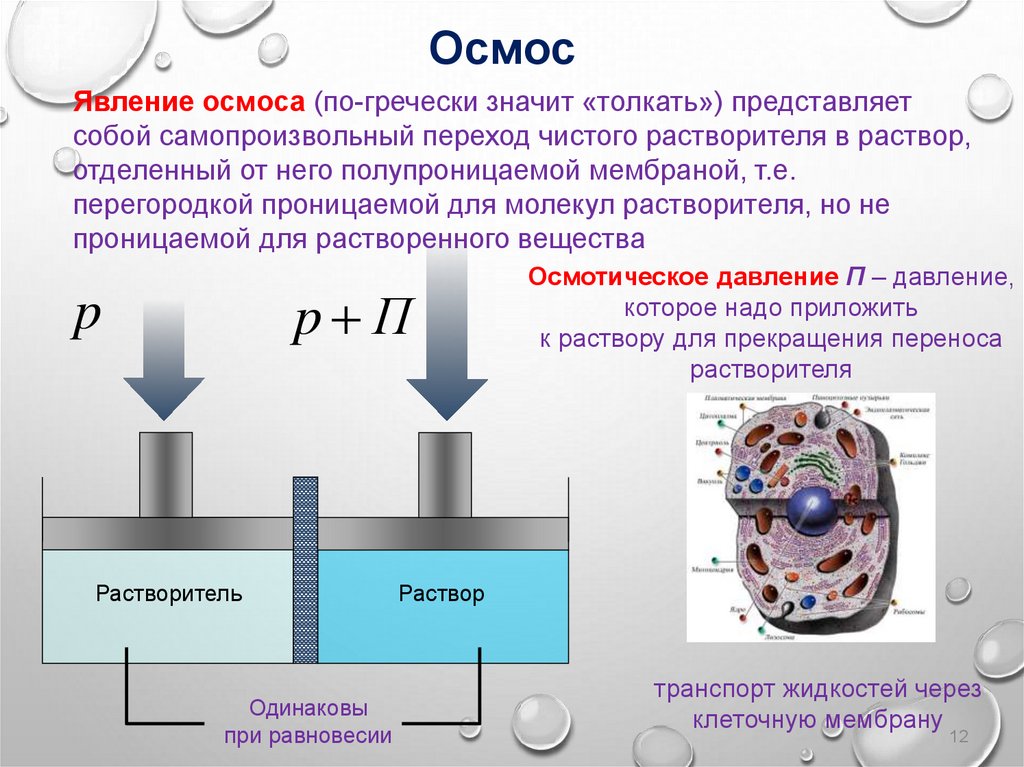
ОсмосЯвление осмоса (по-гречески значит «толкать») представляет
собой самопроизвольный переход чистого растворителя в раствор,
отделенный от него полупроницаемой мембраной, т.е.
перегородкой проницаемой для молекул растворителя, но не
проницаемой для растворенного вещества
p П
p
Растворитель
Одинаковы
при равновесии
Осмотическое давление П – давление,
которое надо приложить
к раствору для прекращения переноса
растворителя
Раствор
транспорт жидкостей через
клеточную мембрану
12
13.
Кристаллогидраты14.
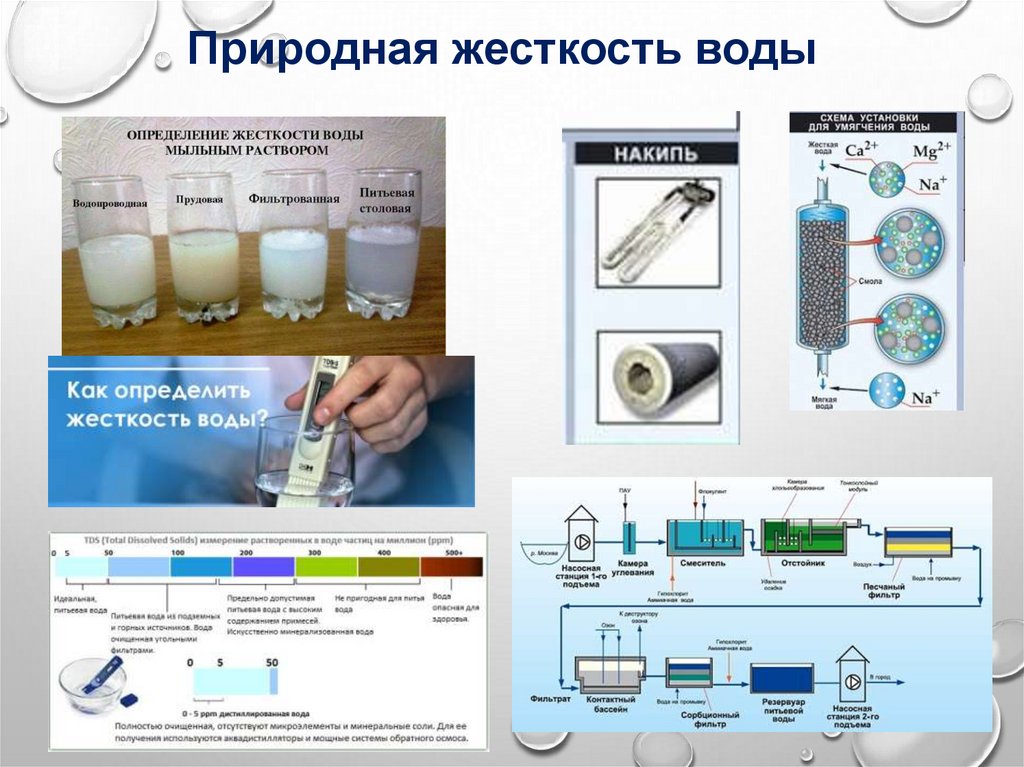
Природная жесткость воды15.
Природная жесткость воды16.
Минеральные воды17.
Растворы электролитовЭлектропроводность веществ
Электролиты
Неэлектролиты
вещества, растворы и расплавы
которых не проводят электрический ток
вещества, растворы и расплавы
которых проводят электрический ток
Газы
Cоли
O2, N2
неэлектролит
Органические
вещества
Метан
CH4
Na2SO4 ,
слабый электролит
сильный электролит
Кислоты
HCl,
Сахар C12H22O11
Оксиды
Щёлочи
KOH,
NO, Na2O
17
18. Количественная характеристика процесса диссоциации
КОЛИЧЕСТВЕННАЯ ХАРАКТЕРИСТИКАПРОЦЕССА ДИССОЦИАЦИИ
Отношение числа распавшихся молекул к
общему числу молекул в растворе
Сила электролита
19. Электролитическая диссоциация
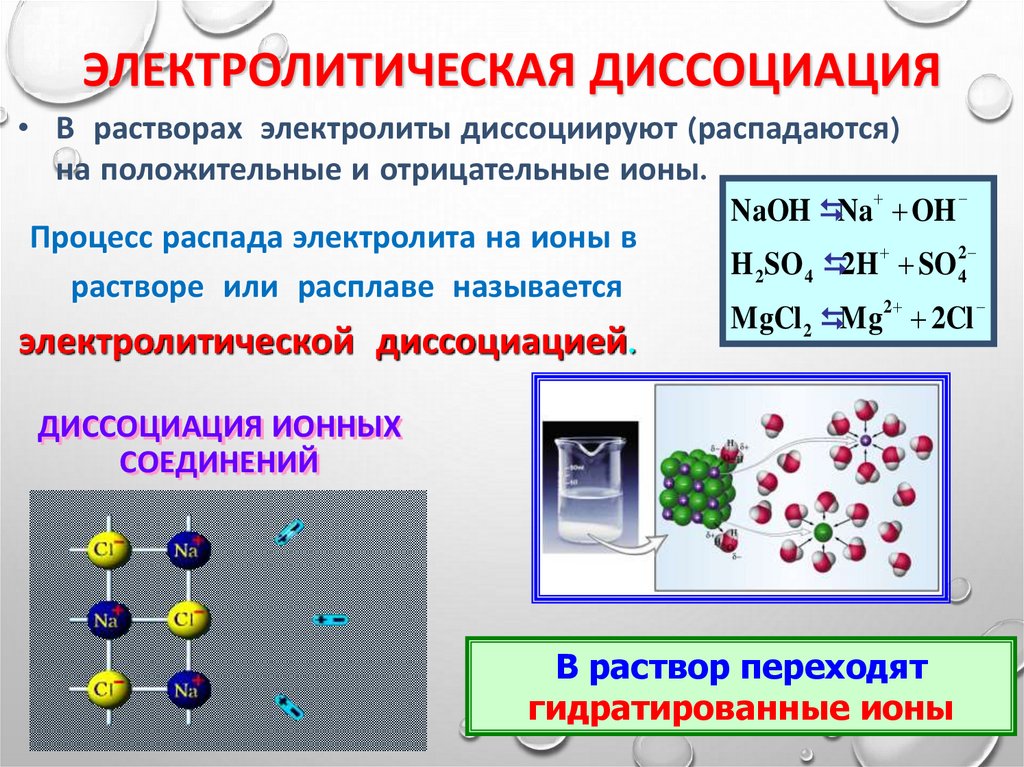
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ• В растворах электролиты диссоциируют (распадаются)
на положительные и отрицательные ионы.
Процесс распада электролита на ионы в
растворе или расплаве называется
электролитической диссоциацией.
NaOH Na OH
H 2SO 4 2H SO 42
MgCl 2 Mg2 2Cl
ДИССОЦИАЦИЯ ИОННЫХ
СОЕДИНЕНИЙ
В раствор переходят19
гидратированные ионы
20.
Условия протекания реакции ионногообмена
Реакции в растворах электролитов
протекают до конца если:
• Образуется или растворяется осадок;
NaCl AgNO 3 AgCl NaNO3
• Выделяется газ;
Cl Ag AgCl
K 2S 2HCl 2KCl H 2S
S 2 2H H 2S
• Образуется малодиссоциирующее
вещество (например Н2О)
KOH HCl KCl H 2O
OH
H
H 2O
21.
22.
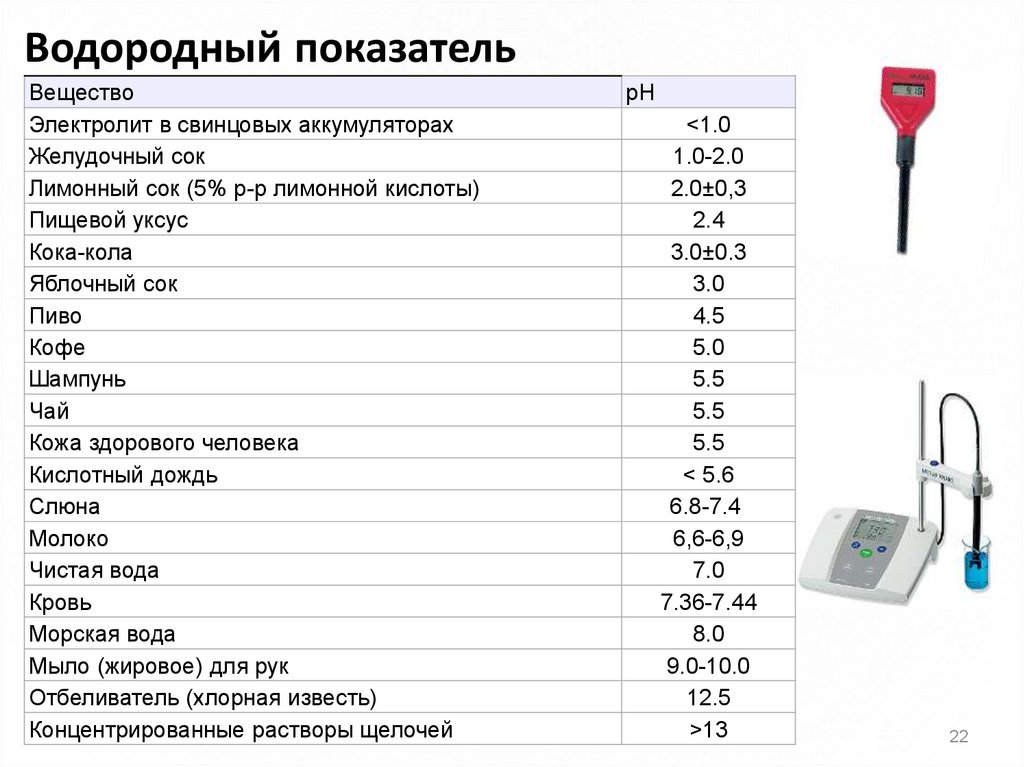
Водородный показательВещество
Электролит в свинцовых аккумуляторах
Желудочный сок
Лимонный сок (5% р-р лимонной кислоты)
Пищевой уксус
Кока-кола
Яблочный сок
Пиво
Кофе
Шампунь
Чай
Кожа здорового человека
Кислотный дождь
Слюна
Молоко
Чистая вода
Кровь
Морская вода
Мыло (жировое) для рук
Отбеливатель (хлорная известь)
Концентрированные растворы щелочей
pH
<1.0
1.0-2.0
2.0±0,3
2.4
3.0±0.3
3.0
4.5
5.0
5.5
5.5
5.5
< 5.6
6.8-7.4
6,6-6,9
7.0
7.36-7.44
8.0
9.0-10.0
12.5
>13
22
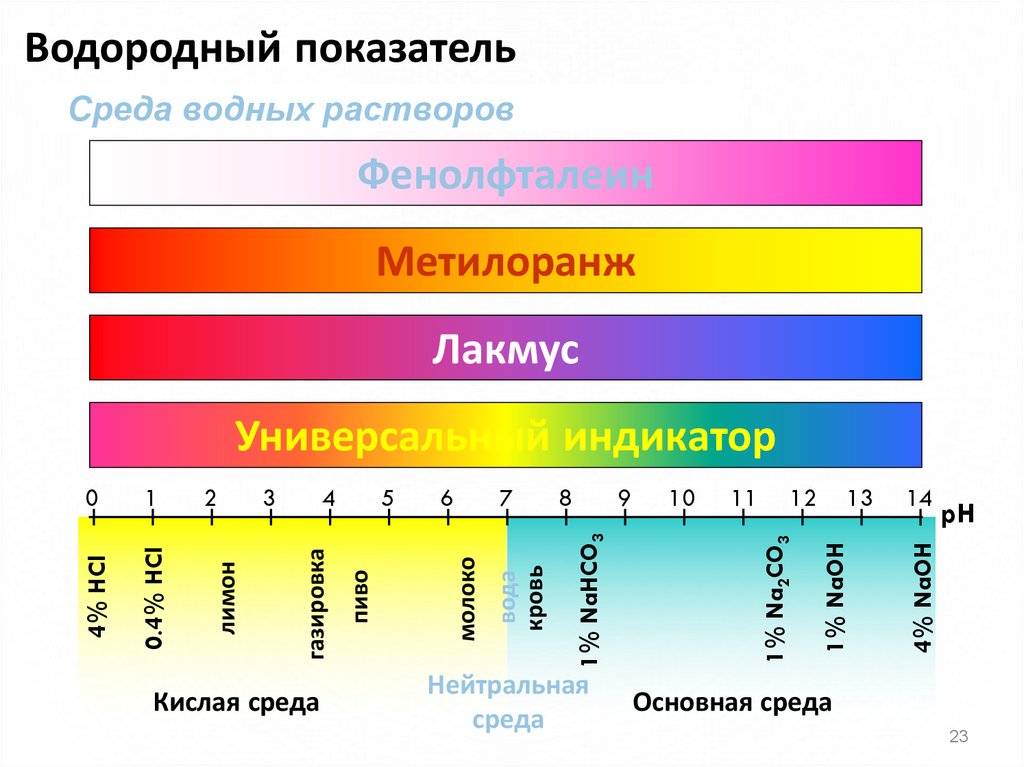
23.
Водородный показательСреда водных растворов
Фенолфталеин
Метилоранж
Лакмус
Кислая среда
8
9
Нейтральная
среда
10
11
12
13
14
pH
4% NaOH
7
1% NaOH
6
1% Na2CO3
5
1% NaHCO3
лимон
4
вода
кровь
0.4% HCl
3
молоко
2
пиво
1
газировка
0
4% HCl
Универсальный индикатор
Основная среда
23
24. Домашнее задание
• ЕРОХИН, Ю. М. ХИМИЯ ДЛЯ ПРОФЕССИЙ И СПЕЦИАЛЬНОСТЕЙ ТЕХНИЧЕСКОГО ИЕСТЕСТВЕННО-НАУЧНОГО ПРОФИЛЕЙ: УЧЕБНИК ДЛЯ СПО / Ю. М. ЕРОХИН, И. Б.
КОВАЛЕВА. - 5-Е ИЗД., СТЕР. - МОСКВА: АКАДЕМИЯ, 2018, 2019 - 496 С. (ПРОФЕССИОНАЛЬНОЕ ОБРАЗОВАНИЕ. ГР. ФИРО).
• § 6.1. «РАСТВОРЫ. КОНЦЕНТРАЦИЯ РАСТВОРОВ», СТР.121-131,
ВОПРОСЫ И ЗАДАНИЯ 1-7 СТР. 131, ПИСЬМЕННО 1,2
• § 6.2. «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ», СТР.131-139,
ВОПРОСЫ И ЗАДАНИЯ СТР. 139-140, ПИСЬМЕННО 2, 5А
















 Химия
Химия