Похожие презентации:
Химические источники тока
1.
Лекция 9Химические источники тока
Рассматриваемые вопросы:
1. Гальванический элемент Даниэля -Якоби. Электродные
процессы. Принцип работы.
2. Стандартный водородный электрод. Стандартный электродный
потенциал.
3. Уравнение Нернста. Определение электродного потенциала в
нестандартных условиях.
4. Определение ЭДС гальванического элемента.
5. Взаимосвязь константы равновесия со стандартным
потенциалом гальванического элемента.
6. Классификация электродов в электрохимии.
7. Металлические электроды.
8. Газовые электроды.
9. Редокс-электроды.
10. Электроды сравнения.
11. Некоторые практически значимые ХИТ.
2.
Гальванический элемент Даниэля-Якоби3.
Принцип работы гальванического элементаΔНрешетки > 0
ΔНгидратации < 0
В зависимости от величины значений данных энтальпий
на поверхности раздела фаз металл-раствор будет
преобладать один из процессов:
eсли |ΔНрешетки| > |ΔНгидратации|, то Меn+ + ne- → Me0
eсли |ΔНрешетки| < |ΔНгидратации|, то Ме0 - ne- → Men+
4.
Окислительно-восстановительныеПринцип работы гальванического элемента
реакции в
электрохимических системах
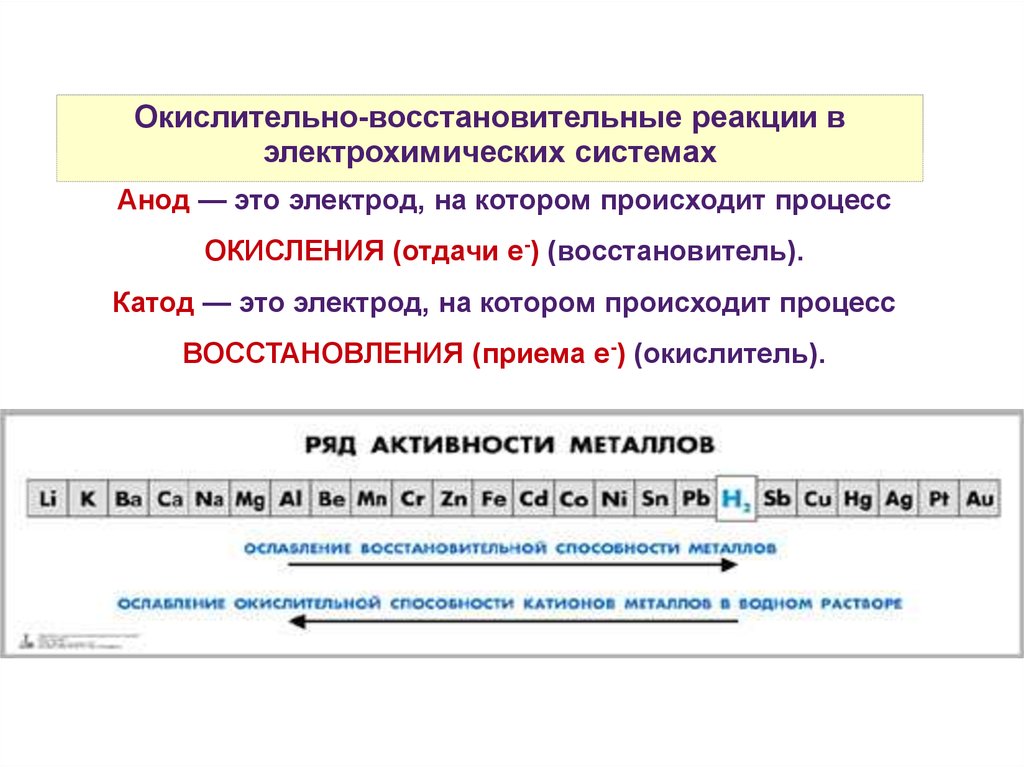
Анод — это электрод, на котором происходит процесс
ОКИСЛЕНИЯ (отдачи е-) (восстановитель).
Катод — это электрод, на котором происходит процесс
ВОССТАНОВЛЕНИЯ (приема е-) (окислитель).
5.
Принцип работы гальванического элемента6.
Двойной электрический слой7.
Гальванический элемент Даниэля-ЯкобиСхема гальванического элемента Даниэля-Якоби:
(-) Zn|Zn2+||Cu2+|Cu (+)
8.
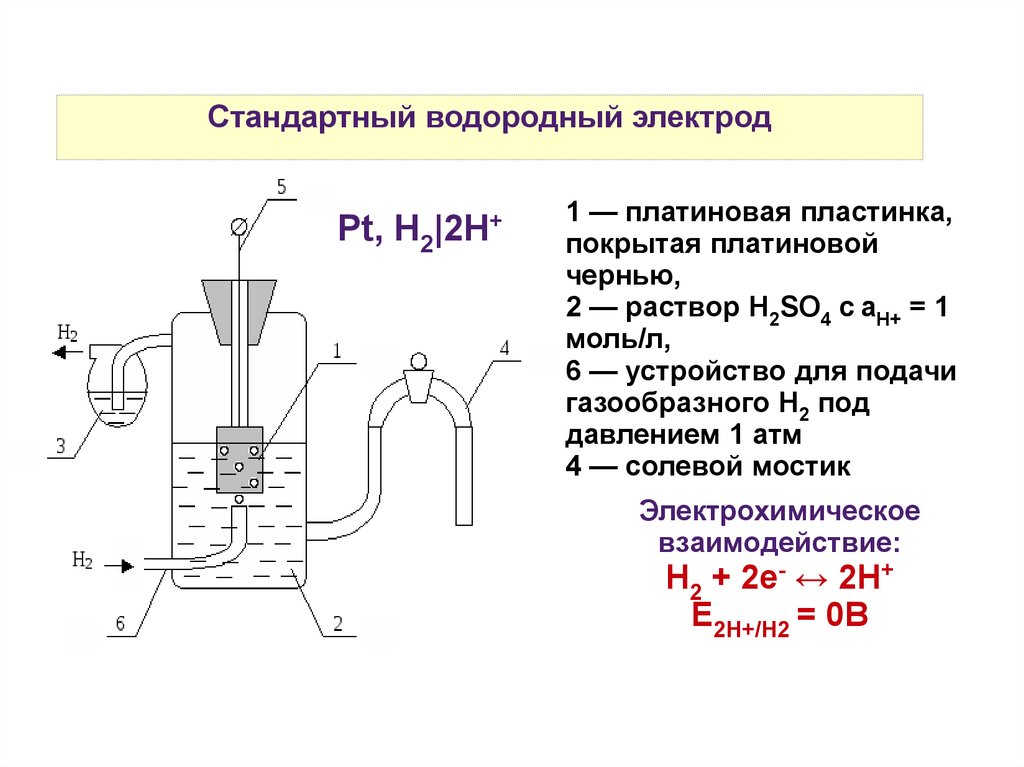
Стандартный водородный электродPt, H2|2H+
1 — платиновая пластинка,
покрытая платиновой
чернью,
2 — раствор H2SO4 c aH+ = 1
моль/л,
6 — устройство для подачи
газообразного H2 под
давлением 1 атм
4 — солевой мостик
Электрохимическое
взаимодействие:
Н2 + 2е- ↔ 2Н+
Е2Н+/Н2 = 0В
9.
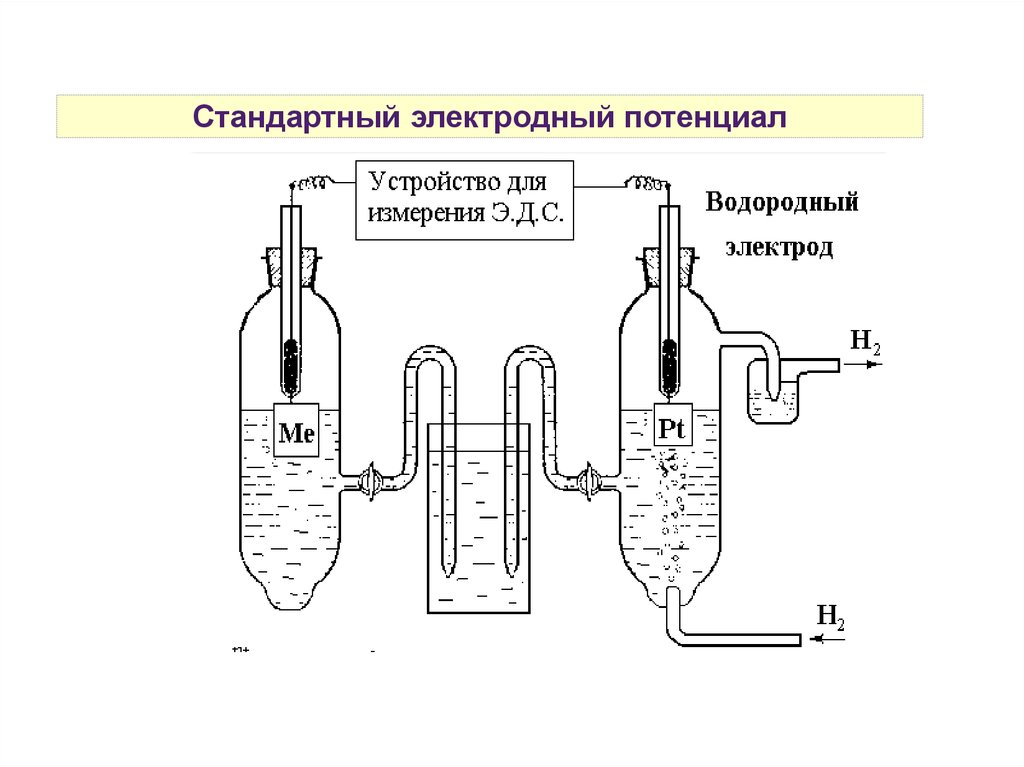
Стандартный электродный потенциал10.
Стандартный электродный потенциалДля определения потенциала
электрода, изучаемый электрод
ставится на место катода.
Стандартный электродный
потенциал Е0 (измеренный при ст.у.)
численно равен ЭДС
гальванического элемента,
содержащего в качестве электрода
сравнения стандартный
водородный электрод:
Е0 ox/red = Е0ГЭ — Е02Н+/Н2
11.
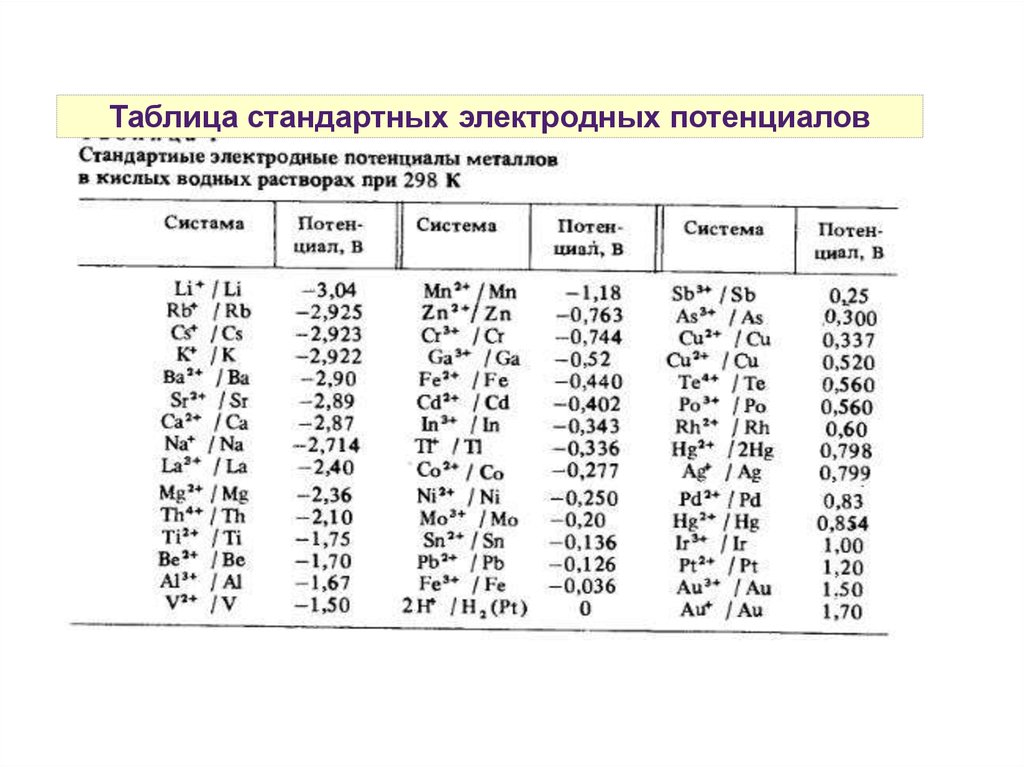
Таблица стандартных электродных потенциалов12.
Стандартный электродный потенциалПри составлении произвольного ГЭ, электрод с более
положительным потенциалом будет выполнять функции катода
(окислителя), а с более отрицательным — анода:
Е0 Zn2+/Zn = -0,76 В => анод
Е0 Cu2+/Cu = +0,34 В => катод
Е0ГЭ (ЭДС) = 0,34 - (-0,76) = 1,1В
Чем выше значение электродного потенциала redox-пары, тем
сильнее у неё выражены окислительные свойства.
Чем больше разность электродных потенциалов катода и
анода, тем ваше ЭДС (ЕГЭ) гальванического элемента.
13.
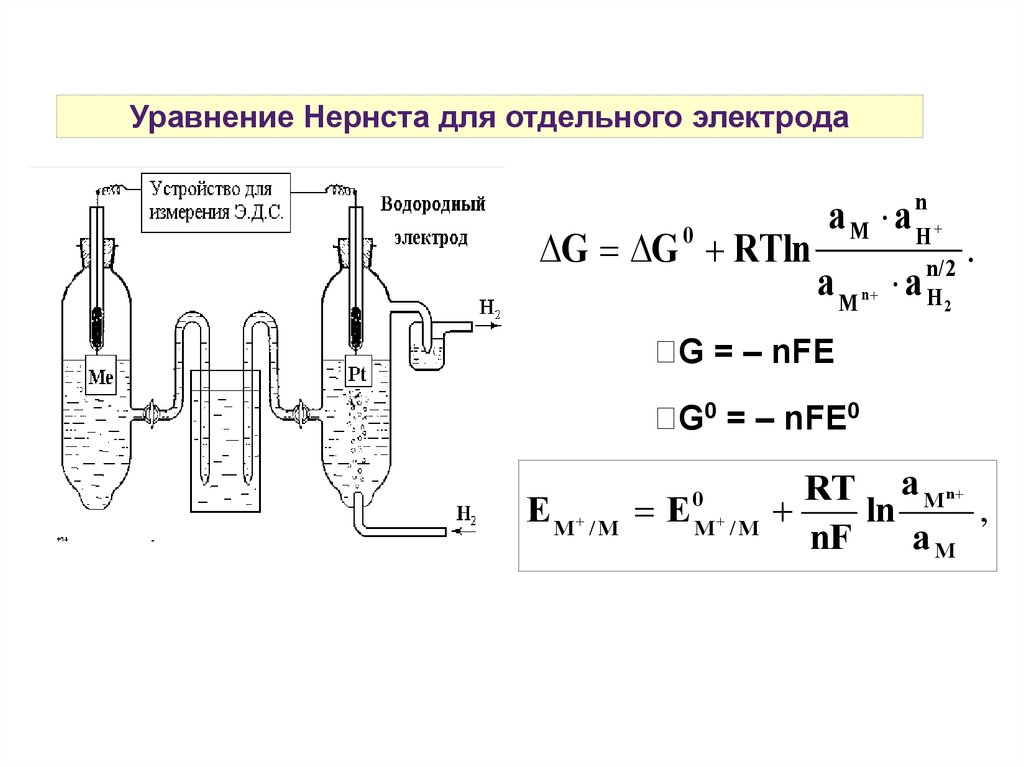
Уравнение Нернста для отдельного электродаВ нестандартных условиях потенциал электрода
определяют по уравнению Нернста.
(–) Pt , H2
2H+
(+)
Mn+
M
(–) H2 - 2e- → 2H+ | n/2
(+) Mn+ + ne- → M |
n/2H2 + Mn+ = nH+ + M
Изотерма Вант-Гоффа: n
G G RTln
0
a M a H
a M n a
n/2
H2
.
14.
Уравнение Нернста для отдельного электродаG G RTln
0
aM a
n
H
n/2
H2
a M n a
.
G = – nFE
G0 = – nFE0
EM /M E
0
M /M
RT a M n
ln
,
nF
aM
15.
Уравнение Нернста для отдельного электродаОбщий вид уравнения Нернста
для отдельного электрода:
Eоф/вф E
0
оф/вф
RT aоф
ln
.
nF
aвф
где аоф — активность окисленной формы;
авф — активность восстановленной формы;
После подстановки всех констант (Т = 298К) и ln → lg
получаем удобную форму:
Eоф/вф E
0
оф/вф
0,059 aоф
lg
.
n
aвф
16.
Уравнение Нернста для отдельного электродаЗадание: определить потенциал медного электрода,
молярная концентрация раствора CuSO4 в котором
составляет 0,1М, fa = 0,16, Е°Cu2+/Cu = 0,34В.
17.
Уравнение Нернста для гальванического элементаПроцесс идет в прямом направлении, если
GГЭ < 0 или ЕГЭ (ЭДСГЭ) > 0, т. к.
G = – nFE.
В стандартных условиях Е°ГЭ = Е°катода — Е°анода
Если Е°ГЭ ≈ 0 В, то используют разность не
стандартных, а реальных электродных потенциалов
(с учетом активностей потенциалоопределяющих ионов),
вычисленную по уравнению Нернста для
гальванического элемента.
18.
Уравнение Нернста для гальванического элементаЗадание: определить E0ГЭ и ЕГЭ для элемента ДаниэляЯкоби.
Пусть
aCu2+ = 0,01 моль/л,
аZn2+ = 0, 1 моль/л.
Е° Zn2+/Zn = -0,76 В => анод
Е° Cu2+/Cu = +0,34 В => катод
E 0эл
(-) Zn|Zn2+||Cu2+|Cu
(+)
E 0Cu2 /Cu E 0Zn2 /Zn 0,34 ( 0,76) 1,10B
Е0ГЭ = 1,1 В
19.
Уравнение Нернста для гальванического элемента(-) Zn|Zn2+||Cu2+|Cu
(+)
(-) Zn — 2e- → Zn2+
(+) Cu2+ + 2e- → Cu
Zn + Cu2+ → Zn2+ + Cu
0,059
E ECu 2 /Cu E Zn 2 /Zn (E
lg aCu 2 )
2
0,059
0,059 aCu 2
0
0
0
(E Zn 2 /Zn
lg a Zn 2 ) ECu 2 /Cu E Zn 2 /Zn
lg
;
2
2
a Zn 2
0
0
Cu 2 /Cu
0,059 aCu 2
E E
lg
.
2
a Zn 2
0
20.
Уравнение Нернста для гальванического элемента(-) Zn|Zn2+||Cu2+|Cu
2+(+)
2+
Zn + Cu → Zn +
Cu
В общем виде уравнение Нернста для гальванического
элемента имеет вид:
а исх в− в
0,059
Е ГЭ = Е +
⋅ lg
n
а продуктов
0
ГЭ
21.
Взаимосвязь константы равновесия Кр состандартным потенциалом гальванического элемента
Е0ГЭ
G0 = – RTlnКр
G0 = – nFE0
nFE0 = RTlnКр
RT
Е =
⋅ ln К р
nF
0
или
0,059
Е=
⋅ lg К р
n
0
22.
Взаимосвязь константы равновесия Кр состандартным потенциалом гальванического элемента
Е0ГЭ
G0 = – RTlnКр
G0 = – nFE0
nFE0 = RTlnКр
RT
Е =
⋅ ln К р
nF
0
или
0,059
Е=
⋅ lg К р
n
0
23.
Типы и роды электродовЭлектроды
С электрохимической
реакцией
1-го рода
-металлические
- газовые
- редоксэлектроды
2-го рода
Электроды
сравнения
Без
электрохимической
реакции
Ионоселективные
24.
Металлические электродыМеталл, погруженный в раствор своей соли
Me|Men+
Cu|Cu2+
Cu <=> Cu2+ + 2e-
Zn|Zn2+
Zn <=> Zn2+ + 2e-
E E
0
M n /M
0,059
lg a M n .
n
25.
Газовые электродыГазовый электрод состоит из инертного проводника
1-го рода (Pt, графит) и газа, находящегося в
контакте с раствором собственных ионов.
0,059 aCl 2
0
lg 2 ,
Pt, Cl2 |2Cl
Cl2 + 2e <=> 2Cl ECl /2Cl ECl /2Cl
2
2
2
aCl
Pt, H2 |2H+
H2 <=> 2H+ + 2e-
E 2H /H E
2
0
2H /H 2
a 2H
0,059
lg
.
2
aH 2
26.
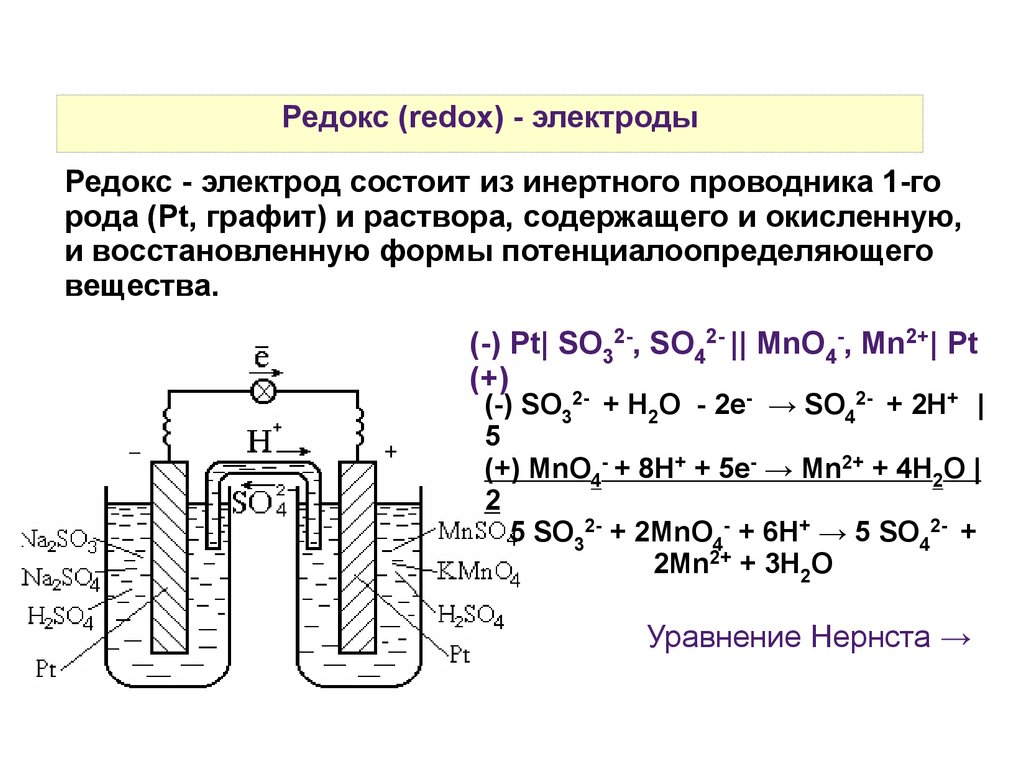
Редокс (redox) - электродыРедокс - электрод состоит из инертного проводника 1-го
рода (Pt, графит) и раствора, содержащего и окисленную,
и восстановленную формы потенциалоопределяющего
вещества.
(-) Pt| SO32-, SO42- || MnO4-, Mn2+| Pt
(+)
(-) SO32- + H2O - 2e- → SO42- + 2H+ |
5
(+) MnO4- + 8H+ + 5e- → Mn2+ + 4H2O |
2
5 SO32- + 2MnO4- + 6H+ → 5 SO42- +
2Mn2+ + 3H2O
Уравнение Нернста →
27.
Редокс (redox) - электроды(-) SO32- + H2O - 2e- → SO42- + 2H+ | 5
Е0 = 0,17В
(+) MnO4- + 8H+ + 5e- → Mn2+ + 4H2O | 2
Е0 = 1,51В
5 SO32- + 2MnO4- + 6H+ → 5 SO42- + 2Mn2+ + 3H2O
а исх в− в
0,059
Е ГЭ = Е +
⋅ lg
n
а продуктов
0
ГЭ
5
SO 32− .
2
MnO−4 .
а
a
a
0,059
Е ГЭ = (1,51− 0,17)+
⋅ lg
5
2
10
а SO a Mn
2− .
4
6
H+.
2+ .
28.
Электроды сравнения (2-го рода)Состоят из проводника 1-го рода — металла — покрытого
слоем труднорастворимой соли этого металла и опущенного в
насыщенный раствор, содержащий анион этой соли.
Пример: хлорсеребряный электрод ХСЭ.
Потенциал таких электродов не изменяется во время работы,
поэтому они могут выступать в роли электродов сравнения.
Е ХСЭ = Е
0
ХСЭ
− 0,059⋅ lg а С l
1− .
В уравнение Нернста таких электродов под знак
логарифма входят активности веществ, не
участвующих в электродном процессе.
29.
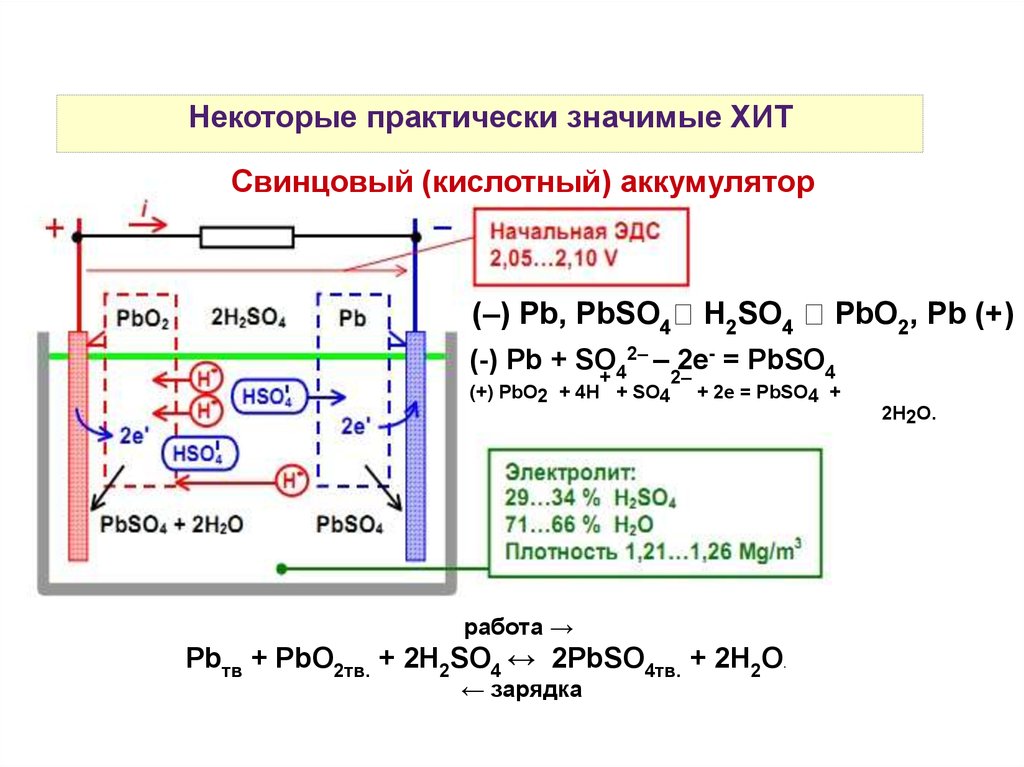
Некоторые практически значимые ХИТСвинцовый (кислотный) аккумулятор
(–) Pb, PbSO4
H2SO4
PbO2, Pb (+)
2– – 2е- = PbSO
(-) Pb + SO
4
+4
2–
(+) PbO2 + 4H + SO4
+ 2е = PbSO4 +
2H2O.
работа →
Pbтв + PbO2тв. + 2H2SO4 ↔ 2PbSO4тв. + 2H2O.
← зарядка
30.
Некоторые практически значимые ХИТСвинцовый (кислотный) аккумулятор
(–) Pb, PbSO4
H2SO4
PbO2, Pb (+)
работа →
Pbтв + PbO2тв. + 2H2SO4 ↔ 2PbSO4тв. + 2H2O.
← зарядка
Е св. акк.= 2,041+ 0,059⋅ lg
аH
2
аH
SO 4
2
O
Когда Есв.акк. = 1,85 В — требуется подзарядка
При Есв.акк. < 1,85 В — необратимая разрядка
31.
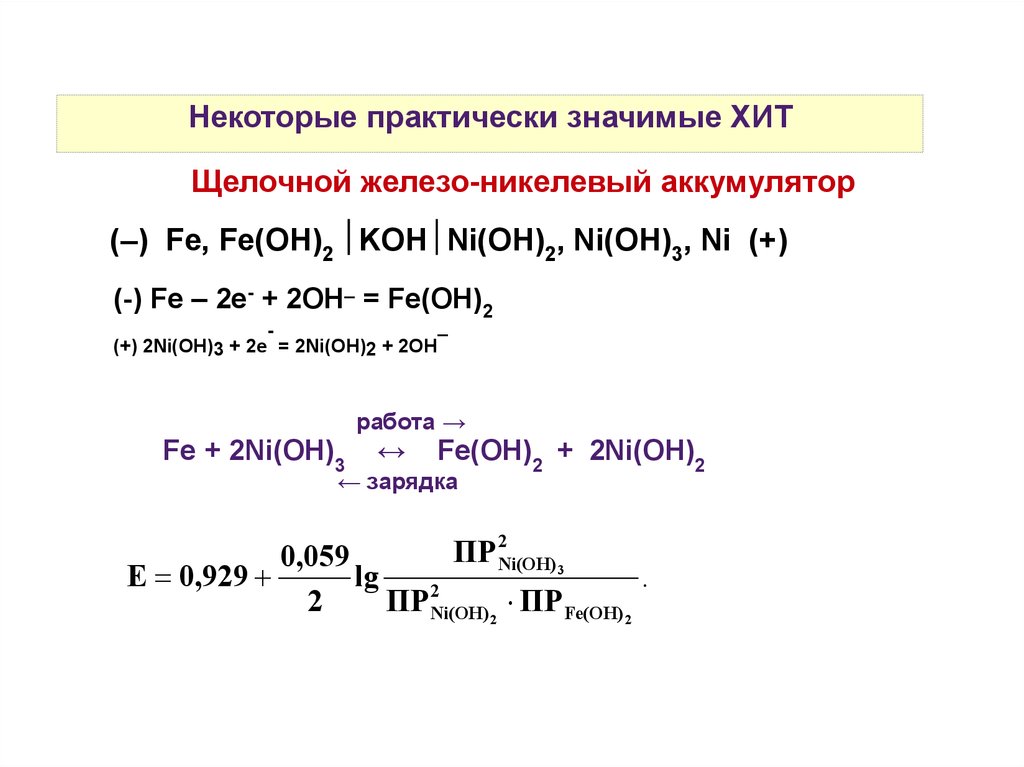
Некоторые практически значимые ХИТЩелочной железо-никелевый аккумулятор
(–) Fe, Fe(OH)2 KOH Ni(OH)2, Ni(OH)3, Ni (+)
(-) Fe – 2е- + 2OH– = Fe(OH)2
–
(+) 2Ni(OH)3 + 2е = 2Ni(OH)2 + 2OH
работа →
Fe + 2Ni(OH)3
↔
Fe(OH)2 + 2Ni(OH)2
← зарядка
ПР 2Ni(OH) 3
0,059
E 0,929
lg
.
2
2
ПР Ni(OH) 2 ПР Fe(OH) 2
32.
Некоторые практически значимые ХИТЛитий-ионный аккумулятор
33.
Спасибоза внимание!

























 Химия
Химия