Похожие презентации:
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
1.
ПЕРІОДИЧНИЙ ЗАКОН ІПЕРІОДИЧНА СИСТЕМА ХІМІЧНИХ
ЕЛЕМЕНТІВ Д.І.МЕНДЕЛЄЄВА.
БУДОВА АТОМА
2.
Мета відкритого заняття:• Навчальна: повторити і узагальнити основні поняття з теми,
закріпити вміння за електронною формулою атома
визначати хімічний символ елементу, положення його в
ПСХЕ, закріпити навички розв’язування вправ, роботи з
• лабораторним обладнанням;
• Розвиваюча:
вдосконалювати
вміння
аналізувати,
порівнювати, встановлювати причинно-наслідкові зв'язки,
застосовувати теоретичні знання для прогнозування;
стимулювати пізнавальну активність учнів, інтерес до
предмету;
• Виховна: формувати здоров’язберігаючу компетентність
(раціональне планування часу, розвиток наполегливості та
працелюбності, здатності обирати оптимальні рішення)
3.
Тип уроку: комбінований,урок узагальнення та
систематизації знань
• Методи, прийоми роботи:
практичні – розв’язування задач,
Обладнання: Портрет Д.І.Менделєєва,
вправ;
періодична система хімічних елементів
Д.І. Менделєєва, мультимедійне
• репродуктивні – програмоване
забезпечення (комп'ютер з монітором
навчання;
або мультімедіа проектором, колекція
відеофільмів, презентації, віртуальна • частково-пошукові - організація
хімічна лабораторія з ПСХЕ та
колективного обговорення,
довідковим матеріалом, програми
стимулювання вибору найбільш
електронні - хімічний рішебнік,
тестувальник) довідкові матеріали,
раціональних варіантів
картки із завданнями, інструкції;
вирішення проблемної ситуації;
реактиви: металевий натрій, магнієва
та алюмінієва стружка, ємності з водою, евристична бесіда,
фенолфталеїн, ложечка для спалювання• проблемно-пошукова практична
речовини, спиртівка.
робота дослідницького
характеру.
4.
Хід
заняття
І. Організаційний етап
ІІ. Повторення домашнього завдання
Виконання досліду з допомогою віртуальної лабораторії з хімії.
ІІІ. Актуалізація, конкретизація опорних знань. Експрес-іспит
IV. Повторення раніш вивченого матеріалу
“Мозкова атака»
Хімічний дизайн
V. Визначення типу в’язку за схемами (індивідуально)
VI. Повторення періодичного закону та періодичної системи елементів
VII. Контроль засвоєних знань з теми Хімічній звязок, будова атому та ПСЕ
VIII. Закріплення матеріалу
IX. Узагальнення і систематизація знань
Х. Домашнє завдання
ХІ. Підбиття підсумків уроку
5.
ДЗ. Задача на генетичнийзв'язок неорганічних речовин:
У ривок з роману Луи
Буссенару «Викрадачі
діамантів»
« Пожежа палала кілька годин
поспіль. Печера
перетворилася на справжню
піч для випалювання вапняку.
Нечуваної сили полум’я
обпалило весь вапняковий
шар, що являє собою
вуглекислу сіль кальцію
(карбонат кальцію). Під дією
вогню вапняк розклався …. І
утворилося саме те, що
називається негашеним
вапном.
6.
Злива, що осталасяпісля грози, залила всю
цю величезну масу
негашеного вапна. Вона
розбухла, почала з
невпинною силою
розпирати вугілля, що
стискало її і
відштовхувало у
напрямку до прірви….
Скали, дерева, скарб,
мумії – все щезло в
одну мить…»
7.
Завдання:а) Які хімічні процеси
відбулися в печері?
б) напишіть рівняння
відповідних реакцій.
в) сформулюйте
узагальнюючий
висновок про значення
взаємоперетворення
речовин.
8.
Вихідні речовини: вугілля, вапняк, вода, кисень,метан, вогонь
Кислотні оксиди
СН 4 + 2О2 =СО2 +2Н2О
С +О2 =СО2
Н2СО3 =СО2 +Н2О
СО2 +Н2О=Н2СО3
СО2 +СаО = СаСО3
СО2+ Са(ОН)2= СаСО3+Н2О
СО2 +С=2СО
Н2СО3+Са(ОН)2=СаСО3+2Н2О
СН 4 =С+2Н2
• СО+ 2Н2=СН3ОН
Основні оксиди
СаСО3=СаО + СО2
СаО+С=Са +СО
Са +О2 =СаО
СаО + Н2О=Са(ОН)2
СаО+Н2СО3 =СаСО3+ Н2О
Са+2Н2О= Са(ОН)2 +Н2
Са+ С= СаС 2
СаС 2+2H2O=C2H2+Ca(OH)2
СаО + 3C = СаС 2 + CO
Гіпотеза абіогенного синтезу О.А.
Опаріна
9.
Пам'ятаймо!• Хімічні речовини та продукти,
дорожньо будівельні матеріали на
їх основі, паливо, потребують
уваги, так як можуть
перетворюватись одна у одну. Це
може привести не тільки до
матеріальних збитків внаслідок
порчі продуктів та вантажів, але й
до небезпечних випадків на
виробництві та побуті,
забруднення навколишнього
середовища.
10.
Періодичний закон, періодична системаелементів Д.І. Менделєєва і будова атома.
Види хімічного зв’язку
• План заняття:
• 1. Періодичний закон та періодична система
елементів Д.І. Менделєєва
• 2. Будова атому
• 3. Електронна конфігурація атому
• 4. Утворення хімічного зв'язку та його типи
• 5.Характеристика елементів за будовою атомів
та положенням у ПСХЕ
11.
Заповіт Дмитрія Менделеева« Главный секрет жизни вот
какой: один человек – нуль,
вместе только люди. Поэтому
живите для других, начиная с
мамы, друг с друга, брата и
сестры… Сами трудясь, вы
сделаете всё и для близких, и для
себя, а если при труде успеха не
будет, будет неудача, не беда,
пробуйте ещё, сохраните
спокойствие, то внутреннее
обладание, которое делает
людей с волей, ясных и нужных
другим. Иного завета, лучшего
дать не могу. С ним живите, его
завещайте…»
12.
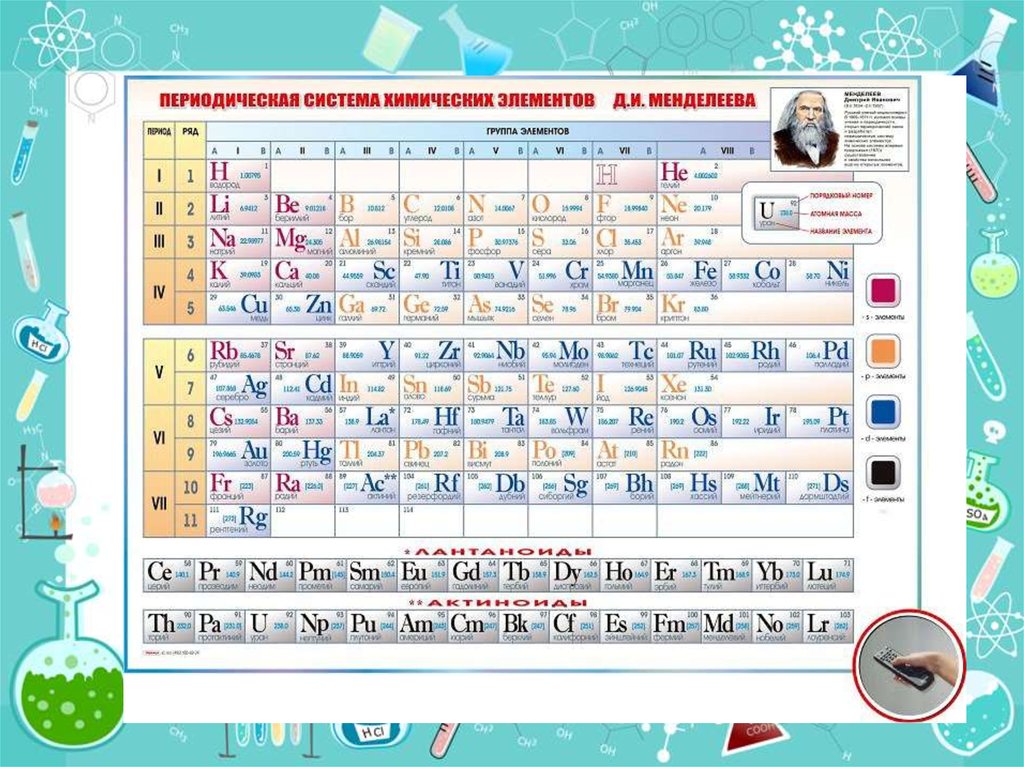
Періодичний закон.Періодична система
хімічних елементів
«Истина одна, а путей отыскания
много» Д.Менделєєв
Формулювання Періодичного закону,
яке було вперше введене Д. І.
Менделєєвим:
• Фізичні й хімічні властивості
елементів, що виявляються у
властивостях простих і складних
тіл, перебувають у періодичній
залежності від їх атомної маси.
Графічним зображенням
Періодичного закону Д. І.
Менделєєва є Періодична система
хімічних елементів.
13.
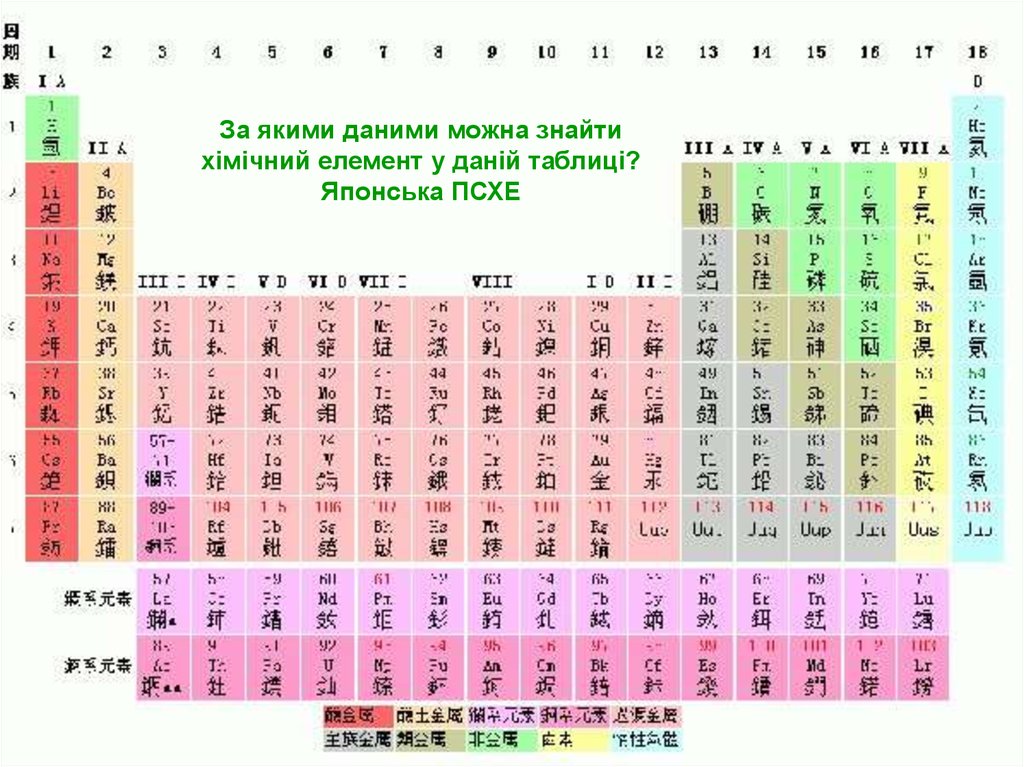
За якими даними можна знайтихімічний елемент у даній таблиці?
Японська ПСХЕ
14.
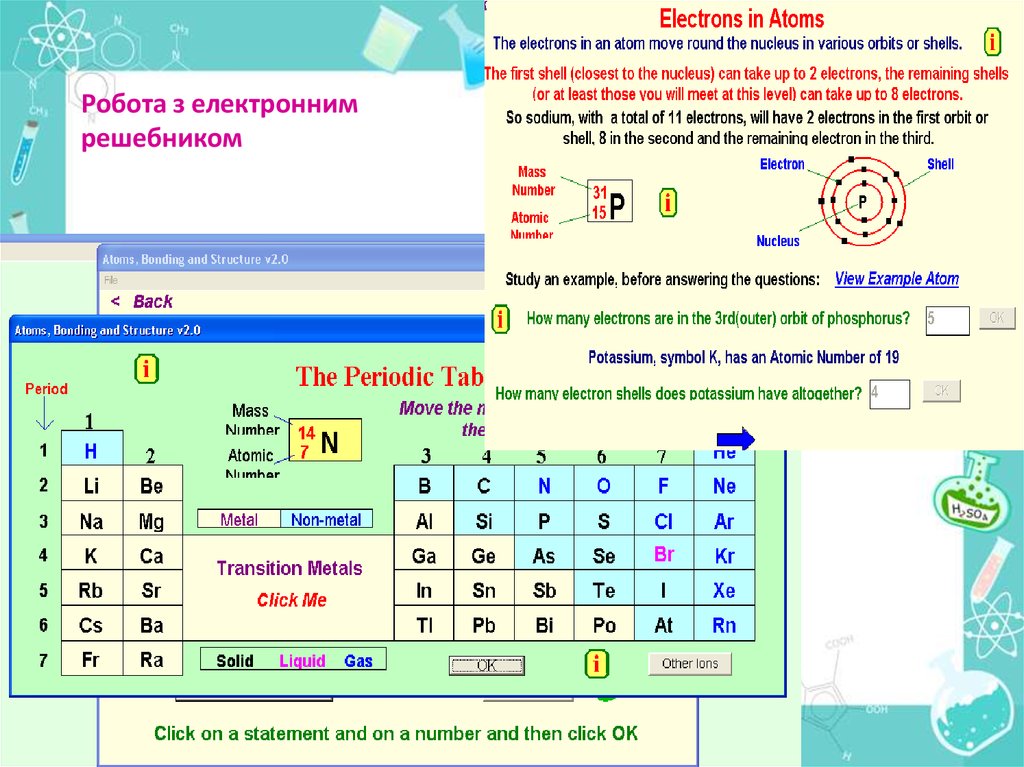
Інформацію про будову атома дає:Порядковий номер елементу
Номер групи
Номер періоду
Можна визначити, користуючись таблицею
Менделєєва:
Число протонів в атомі
Число нейтронів
Число електронів
Заряд ядра атома
Кількість енергетичних рівнів
Кількість електронів на зовнішньому рівні
15.
Теорія будови атомаАтом — це електронейтральна частинка, що складається з
позитивно зарядженого ядра, нейтральних часток
нейтронів і негативно заряджених електронів.
Ядра атомів складаються з елементарних частинок двох видів: протонів
(p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома
називається нуклонним числом
де А — нуклонне число, N — число нейтронів, Z — число протонів.
16.
Маси протона та нейтрона приблизнооднакові, їх приймають рівними 1
• Атоми з однаковим
зарядом ядра складають
хімічний елемент.
Ізотопи — атоми одного
й того ж елемента, які
мають різне нуклонне
число внаслідок різної
кількості нейтронів у
ядрі.
17.
He42He42
Число позитивно заряджених
протонів у ядрі дорівнює числу
негативно заряджених електронів
тобто атом у цілому
електронейтральний
18.
Порядковий номер елементу – загальне число електроніву атомі, які утворюють електронну оболонку атома.
• Порядковий номер елемента – кількість протонів у ядрі та заряд
ядра Z
• Електрони по різному притягуються до атома і утворюють
електронні шари або рівні.
• Номер періоду – кількість електронних шарів - n
• Кожний електронний шар складається з електронних орбіталей
певної форми. Кількість орбіталей визначається n2 А орбіталь
позначується клітинкою
• Не може бути більш ніж 2 електрони на одній орбіталі.
Позначаються неспарені електрони
спарені
• Кількість електронів на енергетичному рівні 2 n2
19.
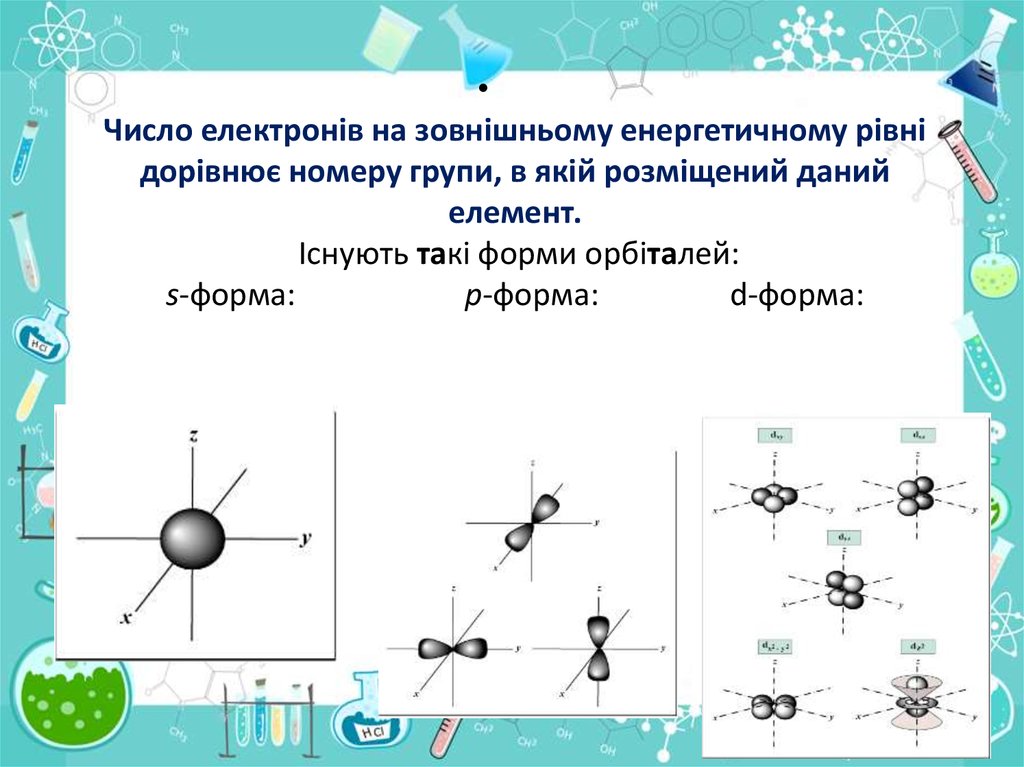
Число електронів на зовнішньому енергетичному рівні
дорівнює номеру групи, в якій розміщений даний
елемент.
Існують такі форми орбіталей:
s-форма:
p-форма:
d-форма:
20.
Простір навколо ядра, у якому найімовірнішеперебування електрона, називається орбіталлю.
• Електрон у атомі не рухається за певними
траєкторіями, а може перебувати в будь-якій частині
навколо ядерного простору, проте ймовірність його
перебування в різних частинах цього простору
неоднакова і має назву електронна хмара.
• Принцип найменшої енергії: в атомі кожний
електрон розташовується так, щоб його енергія
була мінімальною (що відповідає його найбільшому
зв’язку з ядром).
21.
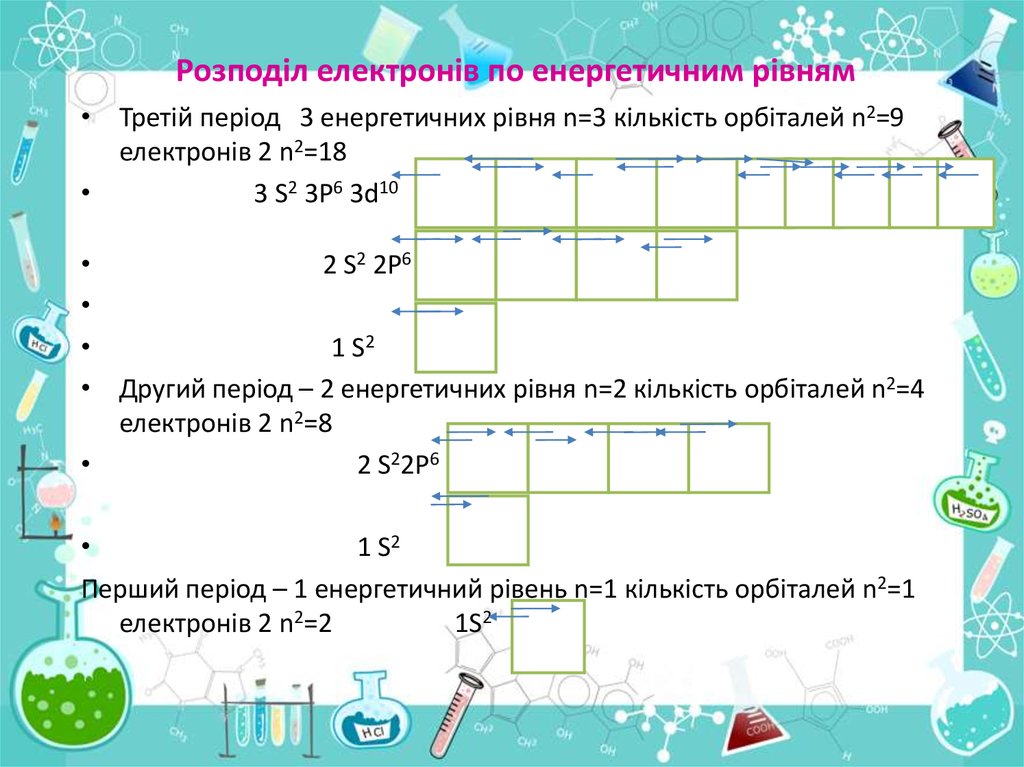
Розподіл електронів по енергетичним рівням• Третій період 3 енергетичних рівня n=3 кількість орбіталей n2=9
електронів 2 n2=18
3 S2 3P6 3d10
2 S2 2P6
1 S2
• Другий період – 2 енергетичних рівня n=2 кількість орбіталей n2=4
електронів 2 n2=8
2 S22P6
1 S2
Перший період – 1 енергетичний рівень n=1 кількість орбіталей n2=1
електронів 2 n2=2
1S2
22.
Електрони з однаковою формою електронної хмари утворюютьоднойменні енергетичні підрівні: s-, p-, d-, f- підрівні.
Кількість підрівнів на кожному енергетичному рівні дорівнює
номеру цього рівня.
23.
24.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f 145d10 6p6 7s2 5f14 6d10 7p625.
2Р26.
Подумайте:В ядрі атома 30 протонів та 35 нейтронів. Який порядковий номер та
відносна атомна маса елемента?
27.
28.
Знайти елементи забудовою їх
електронних шарів:
а) одного періоду
б) однієї групи
в) назвати наведені
елементи
• a)1S22S2
• b)1S22S22P3
• c)1S22S22P63S1
• d)1S22S22P63S2
29.
Знайти елементи за будовою їх електронних шарів:• а) одного періоду
• другого
• 1S22S2
• 1S22S22P3
• третього
б)однієї групи
Першої
1S22S1
1S22S22P63S1
Другої
• 1S22S22P63S1
• 1S22S22P63S2
1S22S2
1S22S22P63S2
30.
Робота з електроннимрешебником
31.
Типи хімічного зв'язкуЙонний зв’язок – зв’язок між йонами
32.
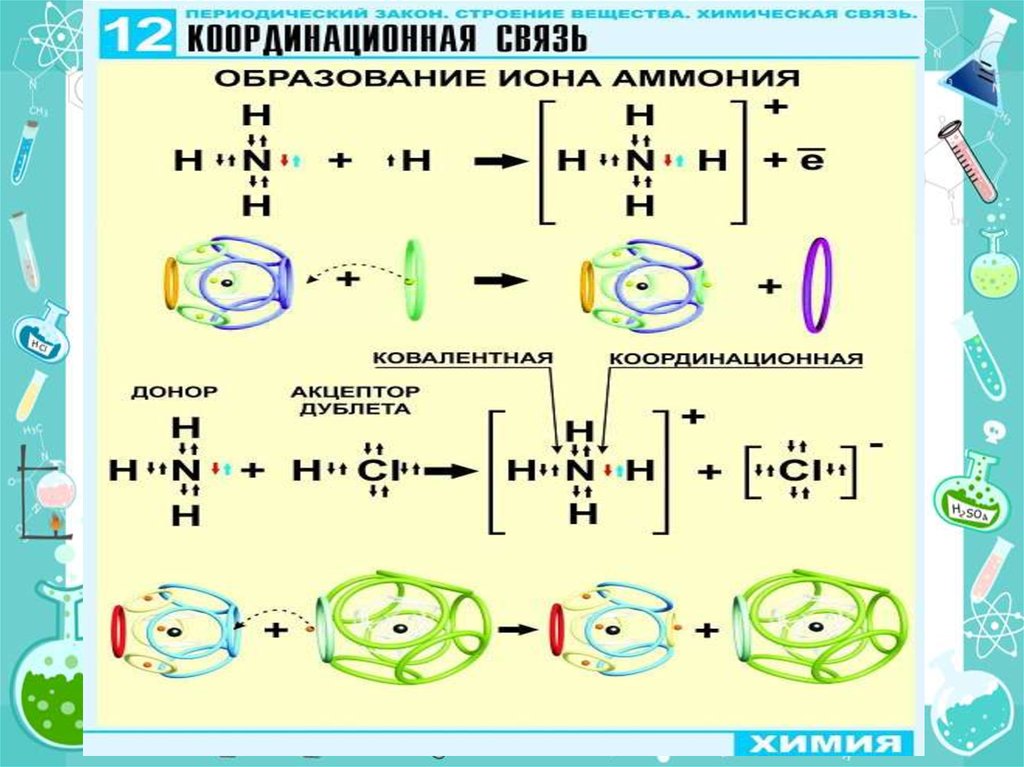
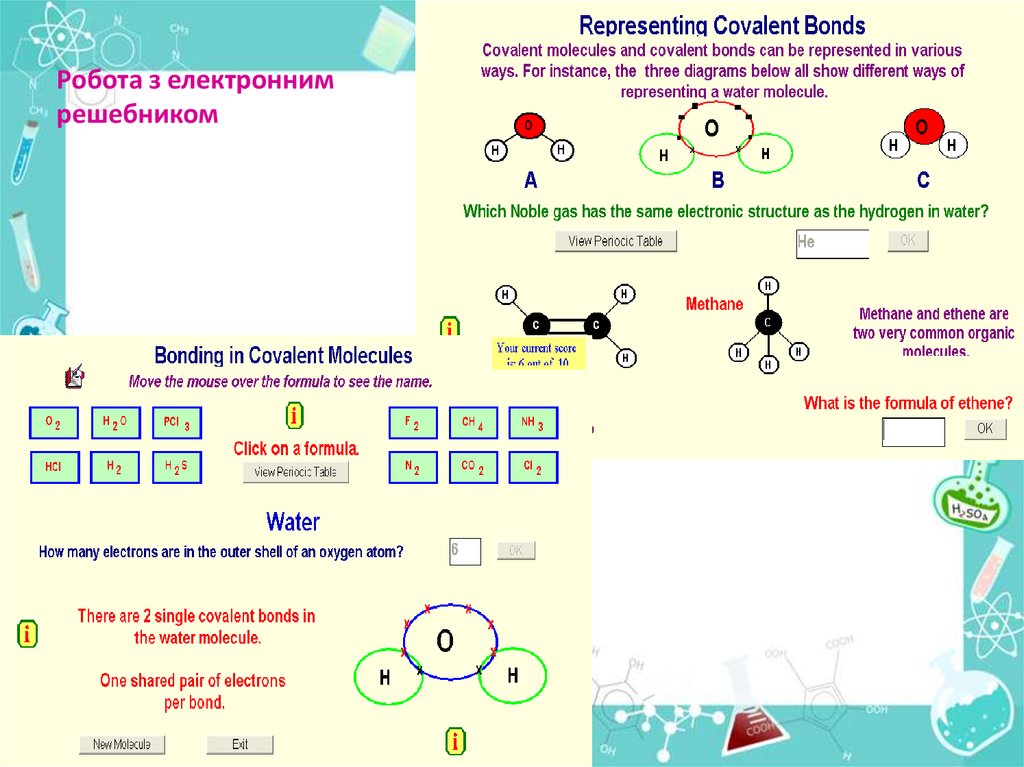
Утворення хімічного зв'язку та його типиКовалентний зв'язок
Ковалентний неполярний зв’язок
реалізується між однаковими атомами
неметалів за рахунок утворення загальних
електронних пар
33.
• В комплект презентации входятвидеофильмы, которые расположены на
сайте автора
• Иволга сайт химии и биологии
• В свободном доступе, бесплатно и без
регистрации!!
34.
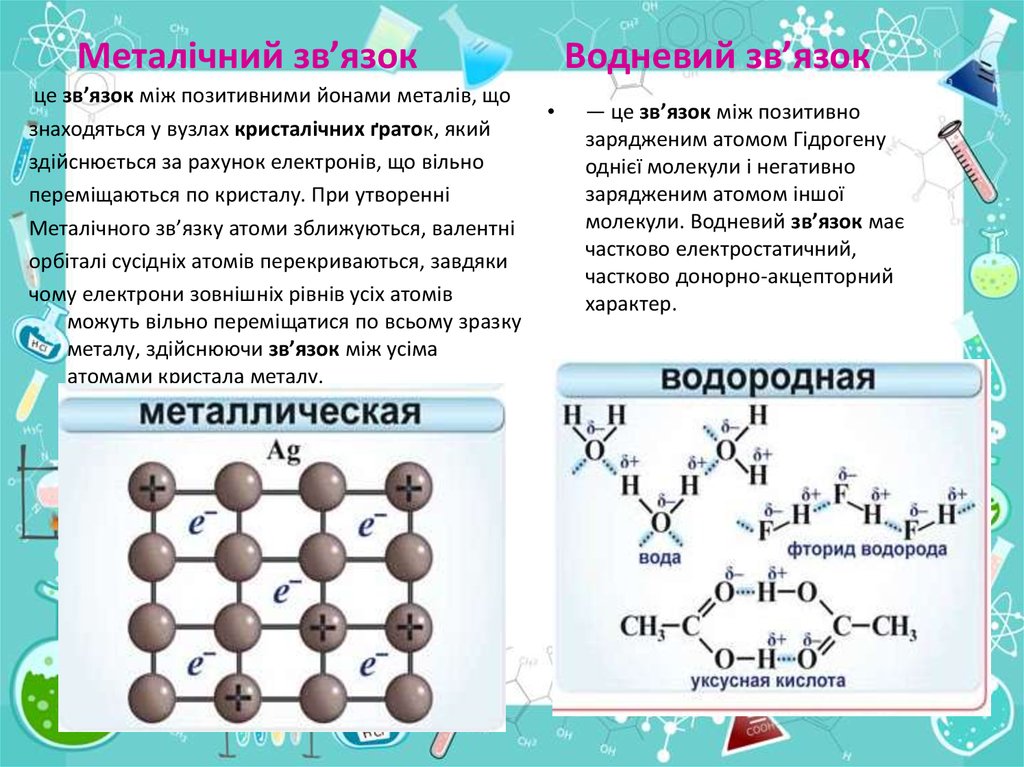
Металічний зв’язокце зв’язок між позитивними йонами металів, що
знаходяться у вузлах кристалічних ґраток, який
здійснюється за рахунок електронів, що вільно
переміщаються по кристалу. При утворенні
Металічного зв’язку атоми зближуються, валентні
орбіталі сусідніх атомів перекриваються, завдяки
чому електрони зовнішніх рівнів усіх атомів
можуть вільно переміщатися по всьому зразку
металу, здійснюючи зв’язок між усіма
атомами кристала металу.
Водневий зв’язок
— це зв’язок між позитивно
зарядженим атомом Гідрогену
однієї молекули і негативно
зарядженим атомом іншої
молекули. Водневий зв’язок має
частково електростатичний,
частково донорно-акцепторний
характер.
35.
36.
Робота з електроннимрешебником
37.
• Група - вертикальний стовпчик у таблиці Менделєєва, уякому розміщені подібні за властивостями хімічні елементи.
У короткоперіодному варіанті Періодичної системи кожна
група поділяється на підгрупи — головну (або А) і побічну (Б).
До складу головної підгрупи входять елементи великих і
малих періодів, а до складу побічних підгруп — тільки
великих
періодів
і
лише
метали.
У групах у головних підгрупах виявляється подібність
елементів (наприклад однакова вища валентність) та їхніх
сполук (наприклад загальні формули вищих оксидів і
водневих
сполук).
У групах із зростанням порядкового номера металічні
властивості елементів посилюються, а неметалічні
послаблюються.
38.
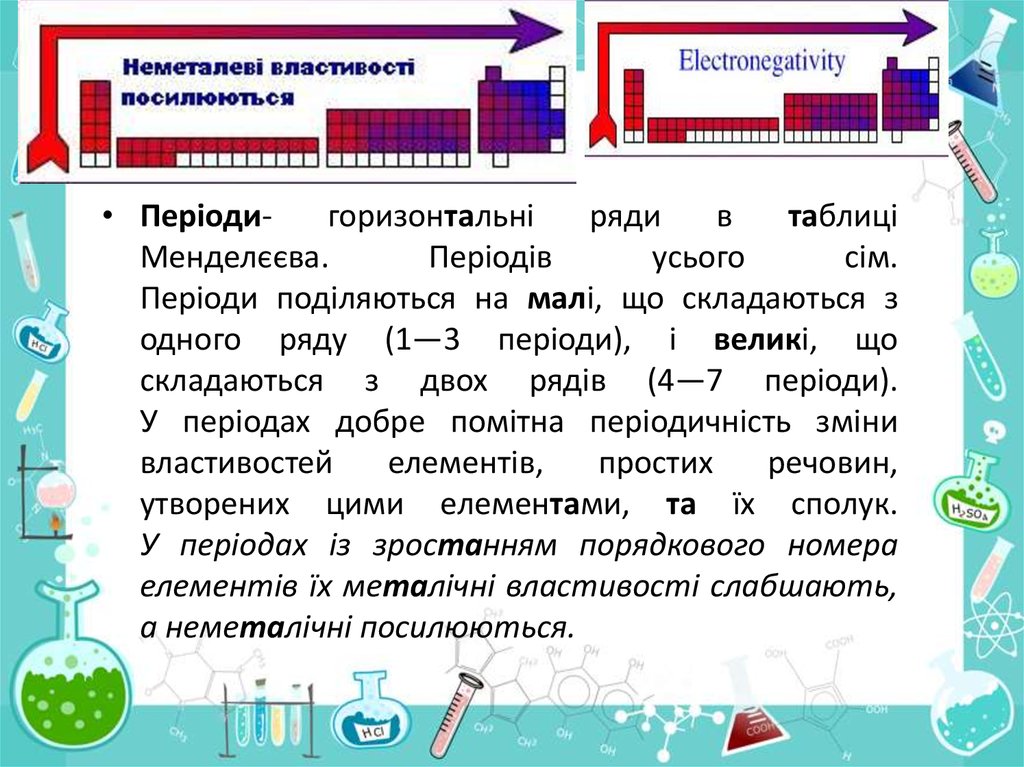
• Періодигоризонтальніряди
в
таблиці
Менделєєва.
Періодів
усього
сім.
Періоди поділяються на малі, що складаються з
одного ряду (1—3 періоди), і великі, що
складаються з двох рядів (4—7 періоди).
У періодах добре помітна періодичність зміни
властивостей
елементів,
простих
речовин,
утворених цими елементами, та їх сполук.
У періодах із зростанням порядкового номера
елементів їх металічні властивості слабшають,
а неметалічні посилюються.
39.
Фізичний зміст Періодичного законуВ атомах елементів із зростанням порядкового
номера відбувається збільшення кількості протонів у
ядрі й електронів, що обертаються навколо ядра.
При цьому періодично повторюється будова
зовнішнього
енергетичного
рівня.
Оскільки
властивості елементів багато в чому залежать від
числа електронів на зовнішньому енергетичному
рівні, то й вони періодично повторюються.
Сучасне формулювання Періодичного закону:
Властивості хімічних елементів, а також форми й
властивості сполук елементів перебувають у
періодичній залежності від заряду ядер їхніх
атомів.
40.
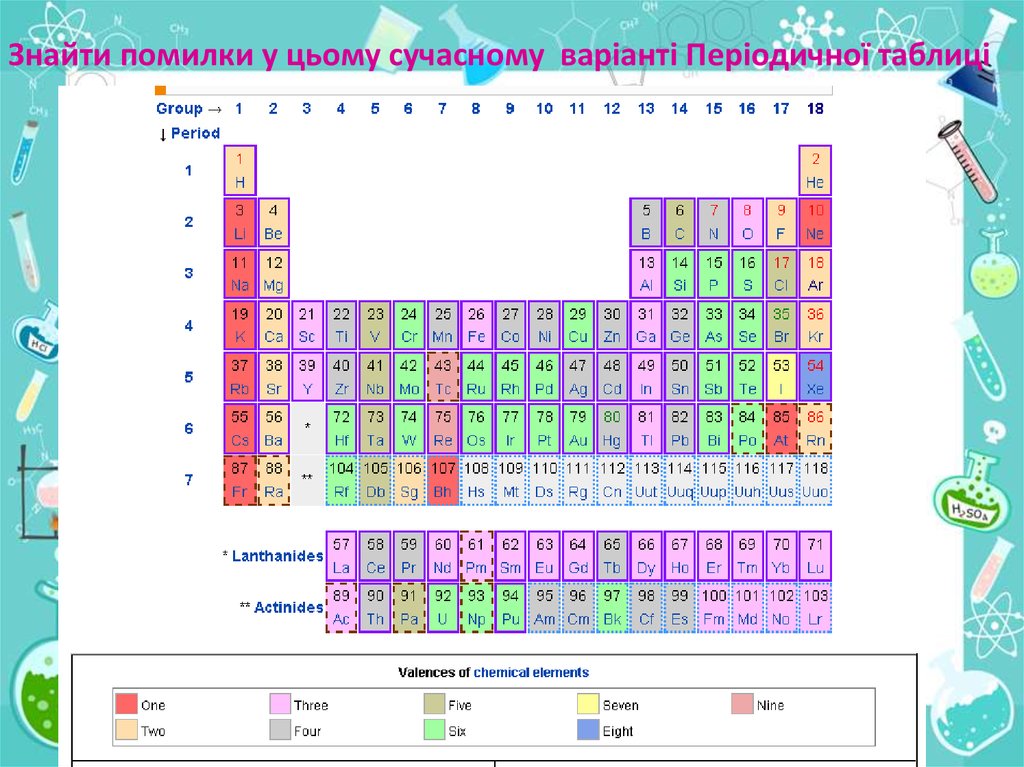
Знайти помилки у цьому сучасному варіанті Періодичної таблиці41.
ЕлектронегативністьЕлектронегативність — здатність атома притягати до
себе електрони інших атомів (маються на увазі валентні
електрони
зовнішнього
енергетичного
рівня).
Відносна електронегативність відповідає Періодичному
закону: у періодах із збільшенням номера елемента
вона
зростає,
у
групах
—
зменшується.
Чим більша відносна електронегативність, тим
сильніше елемент виявляє неметалічні властивості.
Неметали характеризуються великою відносною
електронегативністю, а метали — невеликою.
42.
43.
Самоперевірка44.
Вірні відповіді:Кожна вірна відповідь 1 бал!
45.
Контроль знань• а) Серед наведених електронних конфігурацій вкажіть ті, які не
можуть існувати: 1р3, Зр6, 5d2, 3р2, 5d2,3р7,2р4
• Поясніть свій вибір.
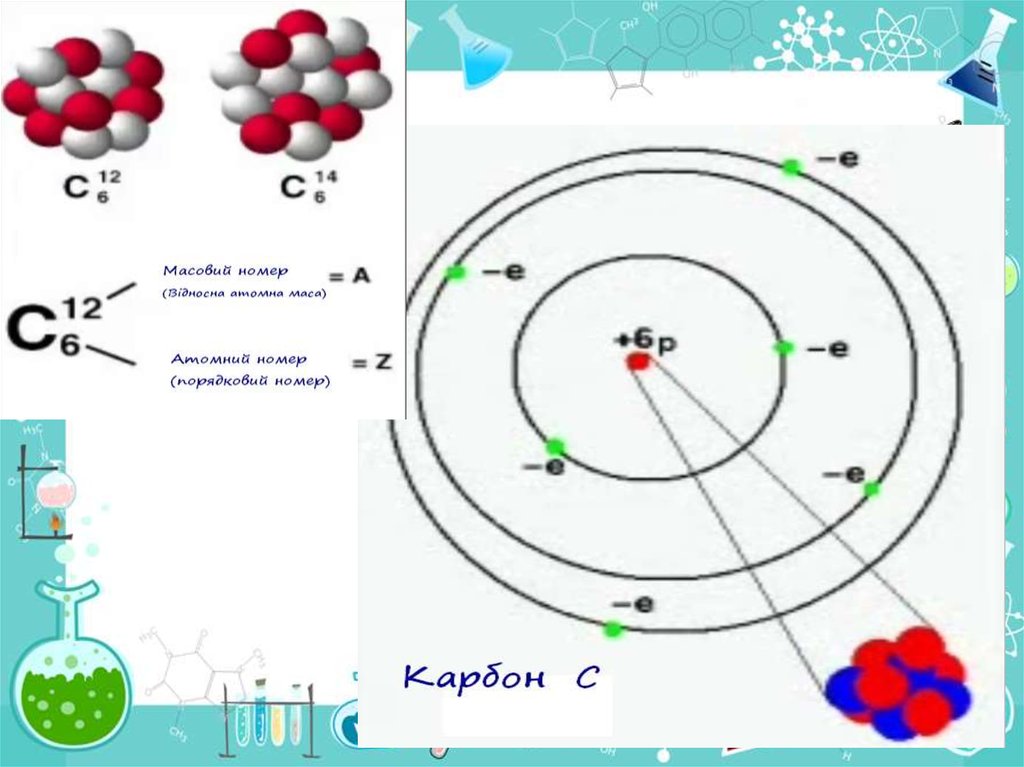
• б) Чим відрізняються за своїм складом ядра атомів наступних
ізотопів: С12 і С14. Що у них спільного?
• в) Виходячи з положення германію, молібдену в періодичній
таблиці, складіть формули їх водневих сполук та оксидів, що
відповідають їх вищій валентності.
• г) Перерахуйте всі можливі валентності атома хлору у збудженому
та незбудженому станах. Відповідь обґрунтуйте схемами розподілу
електронів по рівнях і підрівнях.
46.
Взаємоперевірка за зразком• Вірні відповіді для самоаналізу:
• А) 1р3 - на першому енергетичному рівні не
можуть бути Р-електрони
• 3р7 - загальна кількість р електронів не може бути
більш ніж 6
• Б) Спільне – 6 протонів та 6 електронів. Відмінне –
по 6 та 8 нейтронів у ядрах
• В) GeO2 MoO3 GeH4
47.
Валентності хлоруI
48.
ДОМАШНЄ ЗАВДАННЯ• Ярошенко О.Г. Хімія : Підручн. для 10кл
заг.осв. навч. закл. – К.: Грамота, 2010§ 2
стор. 18 завд. 1-3
• Буринська Н.М., Величко Л.П.: Хімія 11кл.
с. з. шк.- Київ; Ірпінь: ВТФ "Перун" 2000.
§24
49.
Д.Менделєєв- Російський Ленардо да ВинчиВ 7 августа 1887г., Д.И.Менделеев совершил самостоятельный полет для наблюдения солнечного
затмения на воздушном шаре «Русский», заполненном водородом. Д.И.Менделеев был не только
инициатором полета, но и пилотом и исследователем одновременно. Поднявшись над облаками
на высоту около 3 км, шар, гонимый ветром, пролетел над землей около 100 км. Воздушный
шар «Русский» на котором Медаль Академии аэростатической метеорологии совершил полет
которой, Д.И.Менделеев был награжден за свой полет, на аэростате «Русский» 7 августа 1887 г.
Во время этого полета ученый производил измерения с помощью приборов, находившихся в
корзине. Среди этих приборов был и сконструированный Менделеевым дифференциальный
барометр, служащий для определения высот. За этот полет он получил медаль Французской
академии аэронавтики.
50.
Д.И.Менделееву было отказано в одобрении строительства ледокола для
путешествия в высоких широтах Арктики. Передавая свой проект В.И.Ковалевскому,
Менделеев сказал: «Я много потратил труда, чтобы попытаться найти надежный
путь к Северному полюсу. Для нас это имеет огромное значение как ближайший
путь к Дальнему Востоку. Вот мой проект с необходимыми картами и графиками,
переписанный в несколько экземплярах. Вот вам один экземпляр моей работы,
поезжайте к великому князю Александру Михайловичу и попросите его помочь
мне так же, как он помогал адмиралу Макарову». Князь отнесся к проекту
несочувственно, не взял его и сказал, что такому дерзкому человеку, как
Менделеев, он помочь отказывается. В.И.Ковалевский вернулся от князя и с
большим огорчением сообщил Д.И.Менделееву о своей неудачной миссии. Тогда
же Менделеев, молча бросил все экземпляры своего проекта в камин.
Лишь в 1960-х годах проект был восстановлен по черновикам, хранившимся в
архиве Д.И.Менделеева. Испытания модели ледокола Менделеева показали, что по
ходовым качествам он не уступает современным ледоколам.







































 Химия
Химия








