Похожие презентации:
Алюминий, его физические и химические свойства
1. Алюминий, его физические и химические свойства.
Учебная презентациядля 9 класса
2. Домашнее задание. Допишите уравнения
Ca +O2=Mg + Cl2=
Ca + HOH =
Mg + TiO2=
Ca + V2O5 =
Ca + HOH =
3.
Император Наполеон ||| на банкетевелел подать для почтенных гостей
приборы из очень дорогого
серебристо-белого металла. А всем
прочим было обидно до слёз: им
пришлось пользоваться золотой и
серебряной посудой. Из чего были
изготовлены вилки?
4. Цели урока:
Изучить свойства металлов 3 А группы напримере алюминия.
Дать характеристику элемента по его
положению в периодической системе
химических элементов.
На основе строения атома рассмотреть его
физические и химические свойства, указать
области применения алюминия.
5. Из истории открытия
В период открытия алюминия металл был дороже золота.Англичане хотели почтить богатым
подарком великого русского химика
Д.И Менделеева, подарили ему
химические весы, в которых одна
чашка была изготовлена из золота,
другая - из алюминия. Чашка из
алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных,
но и промышленников и даже
императора Франции.
6. Физические свойства
ЦветМеталлический блеск
Агрегатное состояние
Отношение к воде
Плотность
Пластичность
Теплопроводность
Электропроводность
Температура плавления
Серебристо-белый
+
Твердый
Легкий 2,7 г/см3
+ толщина 0,01мм
Хорошо
Хорошо
660°С
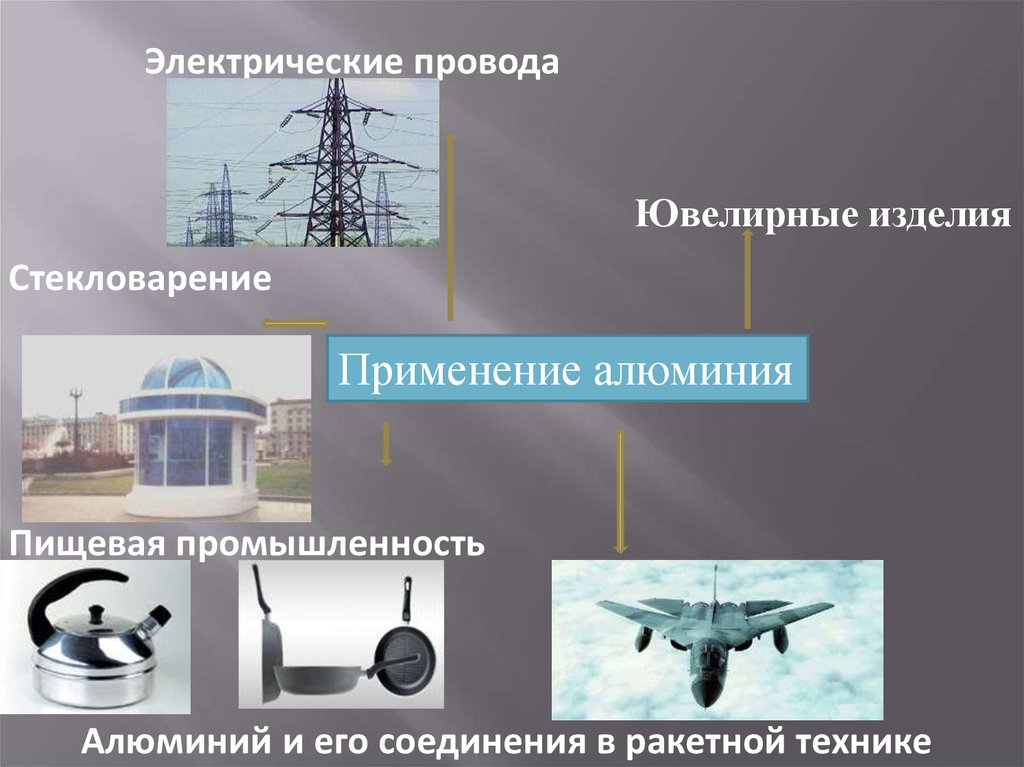
7.
Электрические проводаЮвелирные изделия
Стекловарение
Применение алюминия
Пищевая промышленность
Алюминий и его соединения в ракетной технике
8. Хабаровский завод строительных алюминиевых конструкций
9.
Периодическая система химических элементов Д.И.МенделееваПериоды Ряды
1
1
2
2
3
4
5
6
7
3
4
5
6
7
8
Группы элементов
I
II
III
IV
V
VII
VIII
Характеристика
27
0
Al
+13
1.
Впервые получен в 1825
году Гансом Эрстедом.
2.
В Периодической системе
расположен в 3 периоде,
IIIА-группе.
3.
В природе встречается
только в виде соединений.
4.
Серебристо-белый, легкий
металл. Обладает высокой
тепло- и
электропроводностью.
5.
Валентность: III.
Степень окисления: +3.
9
10
VI
10.
270
P = 13
e− = 13
Степень окисления +3
+13
2
3
8
1
3p
2
6
2p
2
1s 2
2s
3s
11. Химические свойства
Алюминий восстанавливает все элементы,находящиеся справа от него в
электрохимическом ряду напряжения
металлов, простые вещества – неметаллы
12. Химические свойства
Из сложных соединений алюминийвосстанавливает ионы водорода и ионы менее
активных металлов. Однако при комнатной
температуре на воздухе алюминий не
изменяется, поскольку его поверхность покрыта
защитной оксидной плёнкой.
13. Взаимодействие с неметаллами
Al + Br2=Al + S=
Al + C=
Al + O2=
14. Взаимодействие с кислотами
Al + HCl =Al + H2SO4=
Al +H3PO4 =
15. Взаимодействие со щелочами
Al + NaOH=Al + KOH =
16. Составьте следующие уравнения реакций:
Al + Br2 →Al + O2 →
KOH + Al(OH)3 →
HBr + Al(OH)3 →
17. Металл будущего
Вывод: Обладая такими свойствами каклёгкость, прочность, коррозионноустойчивость,
устойчивость к действию сильных химических
реагентов - алюминий нашёл большое занимают
в авиационном и космическом транспорте
применение во многих отраслях народного
хозяйства. Особое место алюминий и его
сплавы, электротехнике, а за ними будущее
нашей науки и техники.
18. Итоги урока
Алюминий – активный металл, но применяется вбыту т. к. на его поверхности образуется
оксидная плёнка.
Активный восстановитель, восстанавливает
металлы из оксидов, этот метод называется
алюмотермия.
Является активным металлом.
19. Домашнее задание
обязательное: прочитать §13, задание № 1 настр. 75;
дополнительное: задание № 3 на стр. 75;
творческое: создать презентацию на тему
«Алюминий».
20.
Сейчас прозвенит долгожданныйзвонок.
Увы, но к концу подошел наш урок.
Прошу, уберите рабочее место.
Давайте без слов, и пожалуй, без
жестов.
А я благодарность вам всем объявляю,
Проверив работы, в журнал выставляю
Отметки все ваши, надеюсь привычно
Что будут они «хорошо» и «отлично»
Большое спасибо я вам говорю
Мы цели достигли. Благодарю!



















 Химия
Химия








