Похожие презентации:
Химический элемент алюминий
1. Тема урока:
АЛЮМИНИЙ1
ПРЕЗЕНТАЦИИ ПО ХИМИИ
http://prezentacija.biz/
2.
Из глины я обыкновенной,И на редкость современный,
Не боюсь электротока,
Хозяйкам на кухне служу без срока,
Бесстрашно в воздухе лечу,
Мне все задачи по плечу.
Конструкции лёгкие из дюрали,
Не перечислить всех регалий,
Горжусь своим я именем
Зовусь я …
3.
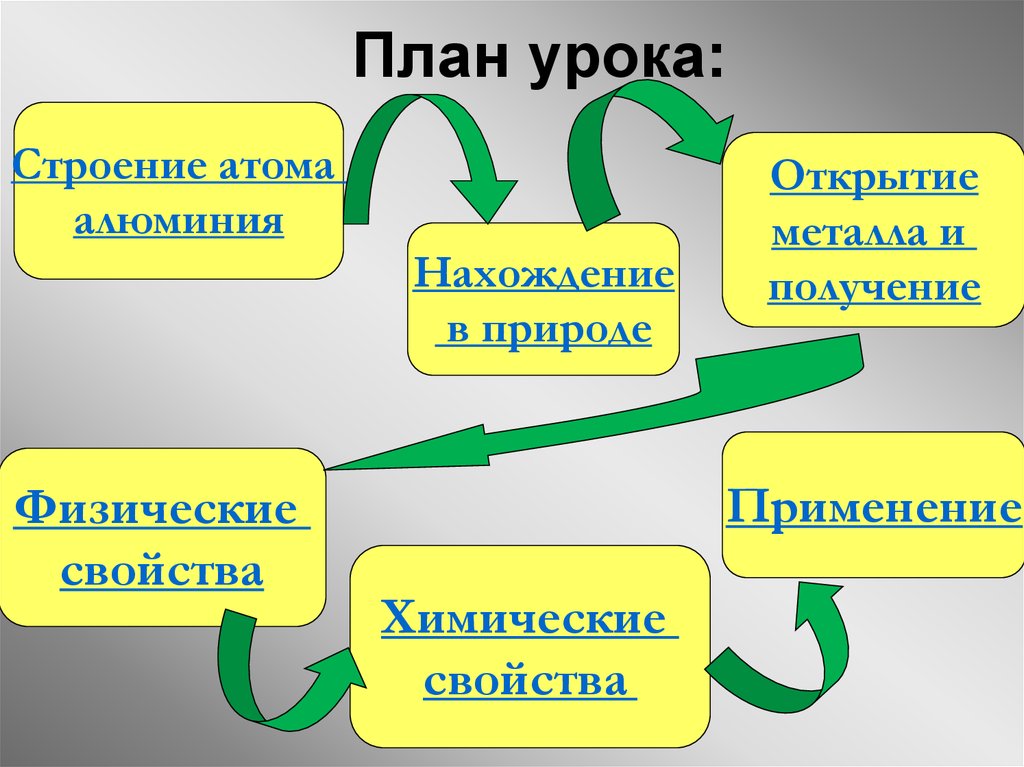
34. План урока:
Строение атомаалюминия
Нахождение
в природе
Физические
свойства
Открытие
металла и
получение
Применение
Химические
свойства
5.
Группы элементовI
1
1
2
2
3
3
4
4
5
6
5
7
8
6
9
7
Н
II
III
IV
V
VI
VII
VIII
1
1,008
Водород
Li
3
6,941
Литий
Be 9.0124 В
Бериллий
Вор
11 Mg 12 Al
Na22,9898
24.305
Натрий
К
Литий
19
39,098
Калий
5
10,811
13
26.981
Алюминий
С
Углерод
Si
Титан
Скандий
14
28,086
Кремний
20 Sc 21 Ti
Ca 40.078
44,956
Кальций
6
12,011
22
47.90
N
7
14.0067
Азот
P
15
30.974
Фосфор
V
23
50,942
Ванадий
О
8
15,999
Кислород
S
Сера
16
32,064
9
F
18.998
Фтор
17
Cl
35,453
Хлор
Цинк
Rb 85,4737 Sr
Рубидий
38
87,62
Стронций
Кадмий
39
Y
83,906
Иттрий
47 Cd 48 In
Ag 107.87
112.41
Серебро
Германий
Галлий
49
Индий
114.82
Zr
Мышьяк
40
91.22
Цирконий
Хром
55 Ba 56 57 *La 72 Hf
Cs 132,91
137.33 138.905
178.49
Барий
Цезий
79
196,99
Au
Золото
80
200,59
Лантан
Hg Tl
Ртуть
87 Ra 88
Fr 223.02
226,03
10 Франций
Радий
81
204,37
Таллий
89
227.03
Гафний
Резерфордий
Ne 20.1793
p
18
d
Неон
Ar
Аргон
39.948
Kr
Кобальт
Никель
36
83.80
Криптон
41 Mo 42 Te 43 Ru44 Rh 45 Pd 46
Nb 92.906
102.91
106.4
101,07
97.9064
95,94
Ниобий
Молибден
Сурьма
73
180.95
52
127.60
Теллур
Ta
Тантал
74
183.85
W
Вольфрам
Висмут
Понийт
*Ac 104
Rf 105
Db 106
Sg
261,11
262.11
263.12
Актиний
35
79,904
Бром
Дубний
Сиборгий
Рутений
Технеций
53
I
126.90
Йод
75
186.207
Астат
107
262.12
Родий
85
209.99
Палладий
54
Xe 131.30
Ксенон
76 Ir
Re Os190,2
Рений
83 Po 84 At
Pb 207.282 Bi 208.98
208.99
Свинец
s
Железо
Марганец
Селен
50 Sb 51 Te
Sn 116.71
121.75
Олово
Гелий
24 Mn 25 Fe26 Co 27 Ni 28
Cr 51,996
58.933
58.71
55,847
54,938
29 Zn 30 Ga 31 Ge 32 As 33 Se 34 Br
Cu 63,546
72.61
78.96
65,37
69,72
74.922
Медб
Не 4,0032
Осмий
77
192,22
Иридий
78
Pt195,09
Платина
Rn (222)86
Радон
108 Mt 109
Bh Hs265,132
266,14
Борий
Хассий
Мейтнерий
5
6.
Периодическая система химических элементовД.И.Менделеева
Периоды Ряды
1
1
2
2
3
3
4
4
5
6
5
7
8
6
9
7
10
Группы элементов
I
II
III
IV
V
VI
VII
VIII
Характеристика
27
0
Al
+13
Впервые получен в 1825 году
Гансом Эрстедом.
В Периодической системе
расположен в 3 периоде, IIIАгруппе.
В природе встречается только
в виде соединений.
Серебристо-белый, легкий
металл. Обладает высокой
тепло- и
электропроводностью.
Валентность: III.
Степень окисления: +3.
6
7.
7. Содержание в земной кореКислород - 49%
Кремний - 26%
Алюминий - 7%
Железо - 5%
Кальций - 4%
Натрий - 2%
Калий - 2%
Магний - 2%
Водород - 1%
Остальные - 2%
7
8.
Нахождение в природеАлюмосиликаты
Полевой шпат (ортоклаз) – K2O*Al2O3*6SiO2
Нефелин - Na2O * Al2O3 * 2SiO2
Каолин – Al2O3 * 2SiO2 * 2H2O
Корунд – Al2O3
Рубин (красный Cr+3)
Сапфир (синийTi+4, Fe+2, Fe+3)
Бокситы – Al2O3
Глинозем – Al2O3
8
9. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
АЛЮМОСИЛИКАТЫКОРУНД Al2O3 –
прозрачные кристаллы
10.
1. Из истории открытияВпервые Al был получен датским физиком Эрстедом Х.
в 1825 г. Название элемента происходит от лат.
алюмен, так в древности называли квасцы,
которые использовали для крашения
тканей (KAl(SO4)2 . 12H2O).
Позже в 1827 г. немецкий химик
Фридрих Велер получил алюминий
следующим способом:
t
AlCl3+3K
3KCl + Al
10
11.
1. Из истории открытияВ период открытия алюминия - металл
был дороже золота. Англичане хотели
почтить богатым подарком великого
русского химика Д.И Менделеева,
подарили ему химические весы, в
которых одна чашка была изготовлена
из золота, другая - из алюминия. Чашка
из алюминия стала дороже золотой.
Полученное «серебро из глины»
заинтересовало не только учёных, но и
промышленников и даже императора
Франции.
11
12.
Когда его открыли в 1825 году, он стоил в 1500раз дороже железа. Даже 30 лет спустя на его
слиток, демонстрировавшийся на Всемирной
выставке в Париже смотрели как на
драгоценность.
В 1852г. килограмм алюминия
стоил 1200 долларов –
дороже золота!
13.
К концу XX века алюминий стал намногодешевле , т.к.
Чарльз Холл изобрел способ получения
алюминия электролизом
14.
Чарлз Холл разработал электролитическийспособ получения алюминия
• Метод Холла позволил
получать сравнительно
недорогой алюминий в
больших масштабах.
Если с 1855 до 1890 г.
было произведено лишь
200 т алюминия, то за
следующее десятилетие
по новому методу – уже
28 тысяч тонн!
15.
Метод Чарлза Холла позволялполучать сравнительно недорогой
алюминий в больших масштабах –
началась эпоха алюминия…
16.
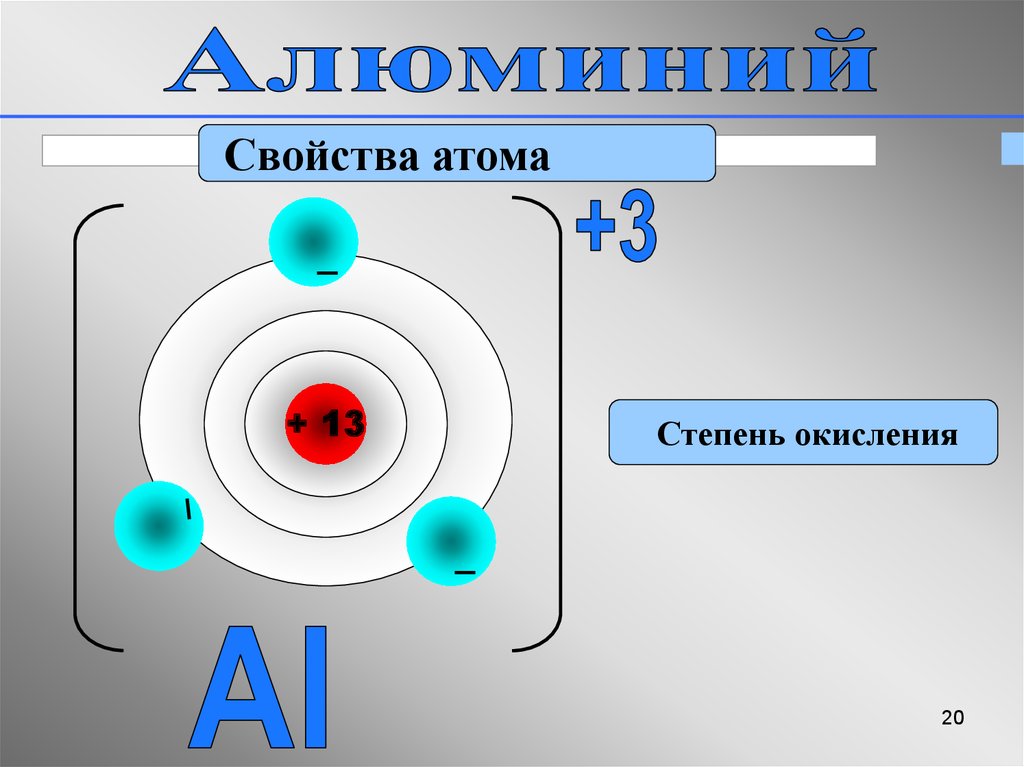
270
p = 13
e− = 13
n = 14
+13
2
3
8
1
3p
2
6
2p
3s
2
1s 2
2s
Краткая электронная запись:
16
17.
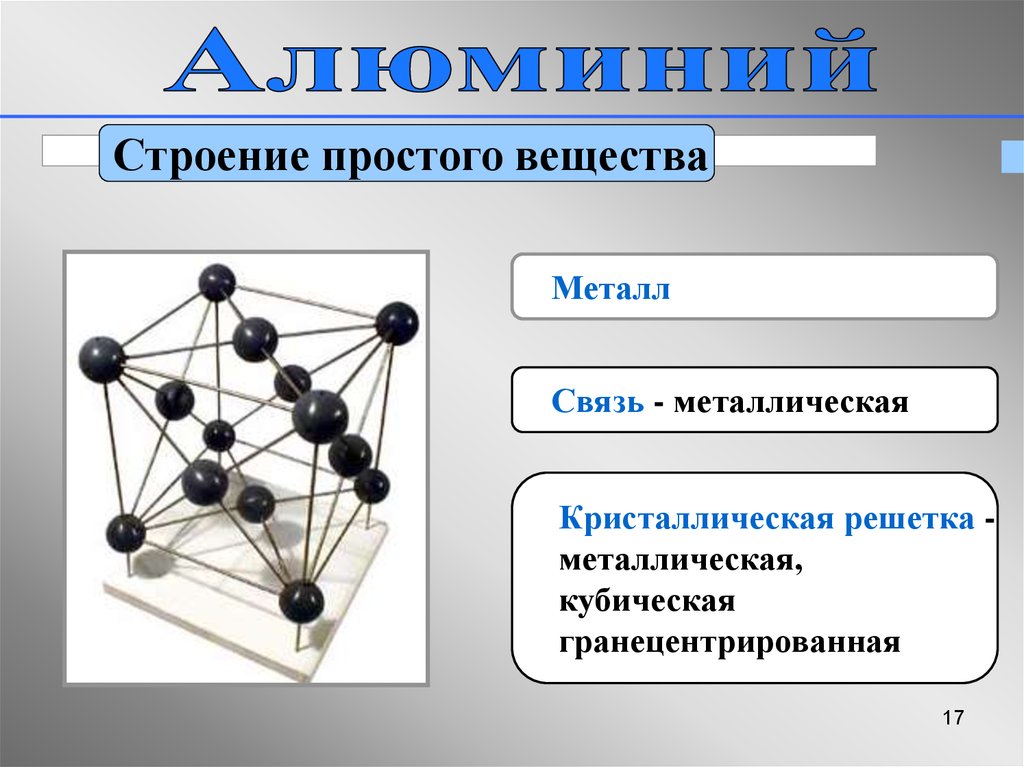
Строение простого веществаМеталл
Связь - металлическая
Кристаллическая решетка металлическая,
кубическая
гранецентрированная
17
18.
Физические свойстваЦвет – серебристо-белый
t пл. = 660°C.
t кип. ≈ 2450°C.
Электропроводный, теплопроводный
Легкий, плотность ρ = 2,6989 г/см3
Мягкий, пластичный.
18
19. Алюминий покрыт тонкой, прочной оксидной пленкой
tпл.Al2O3 = 2050 0Ctпл.Al = 660 0C
20.
Свойства атома+ 13
Степень окисления
20
21.
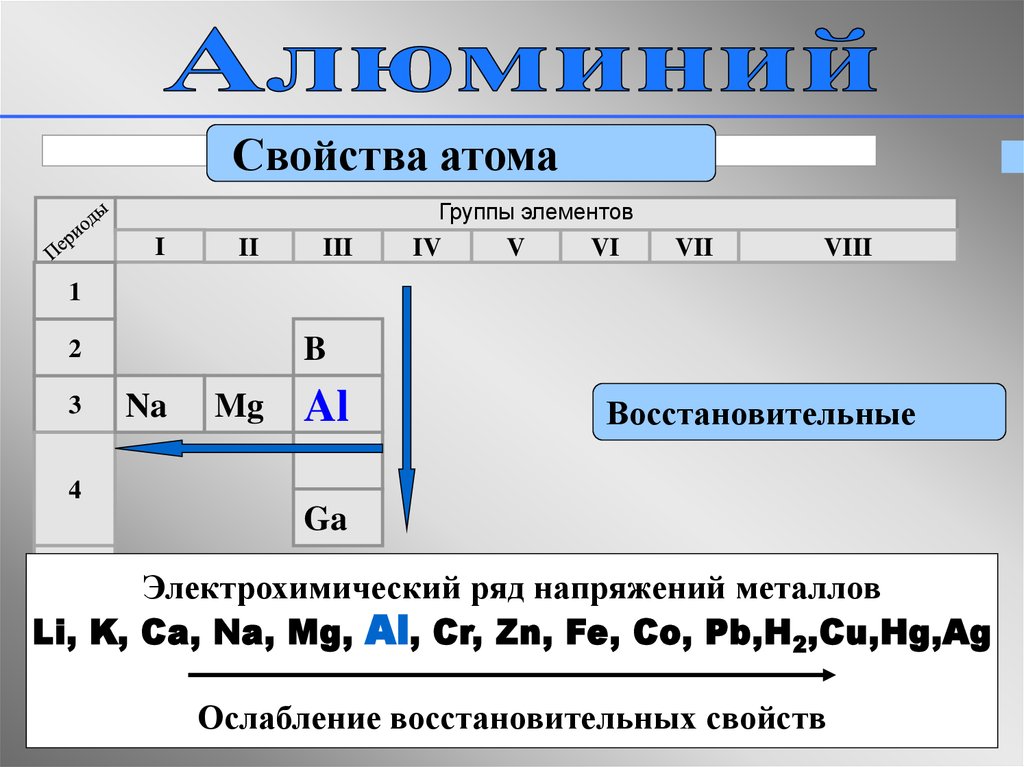
Свойства атомаГруппы элементов
I
II
III
IV
V
VI
VII
VIII
1
B
2
3
Na
Mg
Al
Восстановительные
4
Ga
Электрохимический ряд напряжений металлов
Li, K, Ca, Na, Mg, Al, Cr, Zn, Fe, Co, Pb,H2,Cu,Hg,Ag
5
Ослабление восстановительных свойств
21
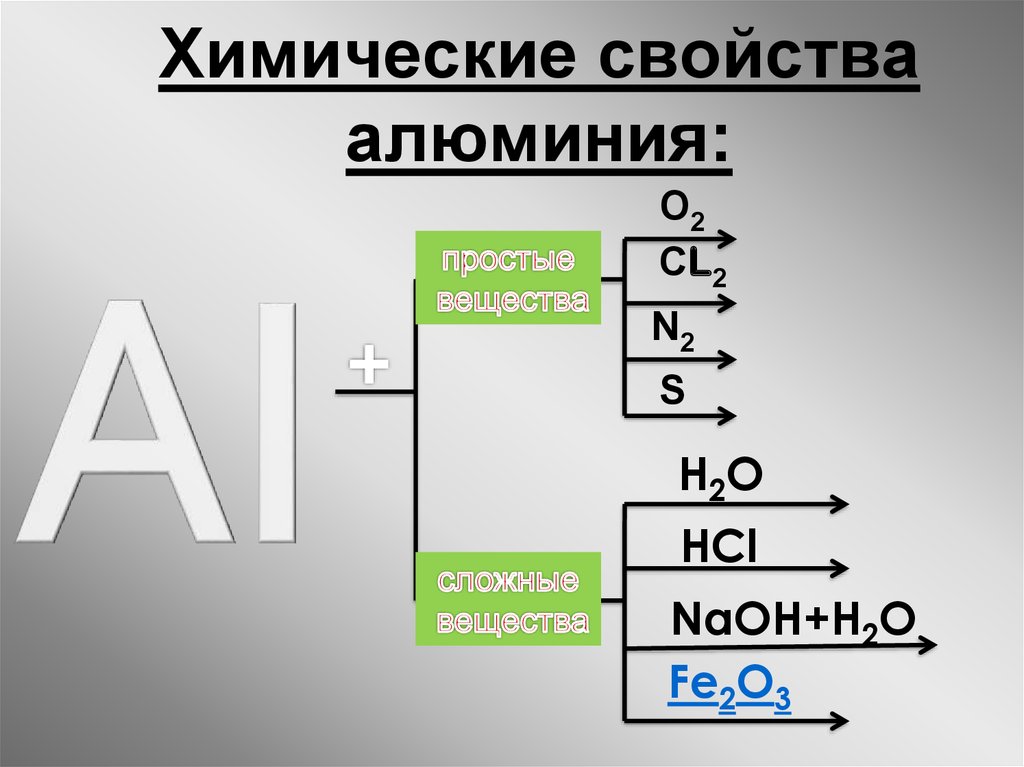
22. Химические свойства алюминия:
О2СL2
N2
S
H 2O
HCl
NaOH+H2O
Fe2O3
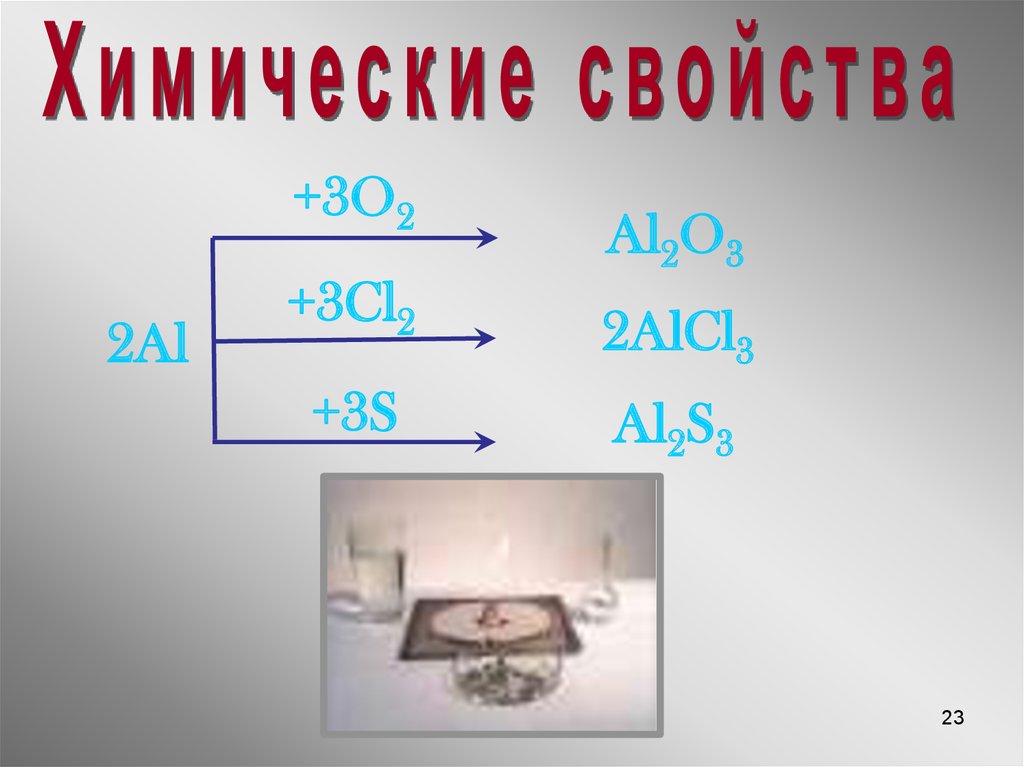
23.
+3O22Al
+3Cl2
+3S
Al2O3
2AlCl3
Al2S3
23
24. Химические свойства.
С водой:• 2Al + 3H2O = 2Al(OH)3 + 3H2
Почему алюминиевую посуду
используют в быту?
25. Алюминий – очень активный металл.
Однако при комнатной температуре навоздухе алюминий не изменяется,
поскольку его поверхность покрыта
очень прочной тонкой оксидной
плёнкой, которая защищает металл от
воздействия компонентов воздуха и
воды.
26. Алюминий без защиты
Лишенный оксиднойпленки, алюминий
активно
взаимодействует с
водой, а на воздухе
быстро окисляется, при
этом металл нагревается
и обрастает белой
«бородой» оксида
27. Химические свойства.
С кислотами:• соляной
• серной
• фосфорной
• 2Al + 6HCl = 2AlCl3 + 3H2
• 2Al + 3H2SO4 = Al2(SO4)3+ 3H2
• Al + H3PO4 = не возможно
28. Al + H3PO4 AlPO4 + H2
Al + H3PO4 AlPO4 + H2НО образуется нерастворимая
соль AlPO4.
Доступ кислоты H3PO4 к
алюминию невозможен.
Реакция прекращается.
29. Алюминий – нетипичный металл
2 Аl + 6 HCl = 2 AlCl3 +3 Н2↑алюминий хлорид
2 Аl + 2NaOH + 6 Н2О = 2 Na[Al(OH)4] + 3 H2↑
натрий алюминат
30. Химическая природа Al2O3
Al2O3 – амфотеренAl2O3 + 6 НCl = 2AlCl3 + 3 Н2О
Al2O3+2NaOH+6H2O = 2Na[Al(OH)4]+3H2↑
31. Почему алюминиевую кастрюлю не рекомендуется мыть с содой ?
Раствор содыобладает щелочной
реакцией, поэтому
алюминий может
постепенно просто
растворяться,
взаимодействуя со
щелочью
32. Химические свойства.
С растворами солей:• хлоридом железа (III)
• хлоридом натрия
• Al + FeCl3 = AlCl3 + Fe
• Al + NaCl = не возможно
33. Al + NaCl AlCl3 +Na
Al + NaCl AlCl3 +NaНо алюминий в электрохимическом
ряду напряжений металлов:
K Ca
Na Mg Al Zn Fe Pb H2 Cu Ag Hg Pt
находится правее натрия, а значит его
восстановительные свойства
меньше, чем у натрия.
Следовательно, алюминий не может
вытеснить натрий из его солей.
34. Алюминий может покраснеть …!!!
Алюминий покрылсямедным налетом в
растворе медного
купороса
2Аl + 3СиSO4 = Al2(SO4 )3 + 3 Cu
Al – является восстановителем
35.
Аl и в этой реакции «работает» как восстановитель2 Al + Fe2O3 = Al2O3 + 2 Fe
Это реакция алюминотермии
36.
Получение1825 год Х. Эрстед:
AlCl3 + 3K = 3KCl + Al :
Электролиз (t пл. = 2050°С) :
2Al2O3 = 4Al +3O2
Электролиз (в распл. криолите Na3AlF6, tпл.≈1000°С) :
2Al2O3 = 4Al +3O2
36
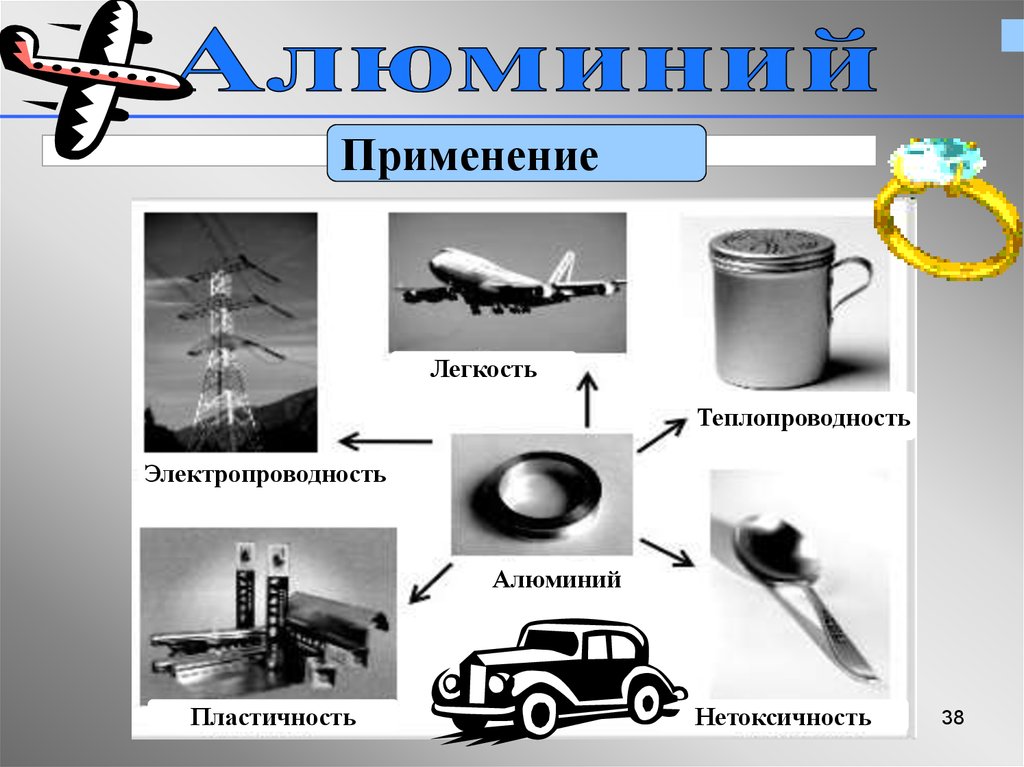
37. Применение алюминия
3738.
ПрименениеЛегкость
Теплопроводность
Электропроводность
Алюминий
Пластичность
Нетоксичность
38
39.
40. Алюминий – «крылатый металл»
• Входит в состав известных сплавов –дюралюминий, магналий, силумин,
используемых в самолетостроении
• Используемые свойства: легкость,
прочность, коррозионная стойкость
(устойчивость к воздуху и воде )
41. Алюминий и его сплавы широко применяют как конструкционный материал
42.
43.
Конструкционныесплавы в
архитектуре
городов
44.
45.
В том числе при изготовлениитранспортных средств
46.
47. Алюминий в электротехнике
Используемые свойстваВысокая электропроводность
Легкость
При одинаковом электросопротивлении
алюминиевый провод весит вдвое
меньше медного
48.
49.
Из алюминияделают линии
электропередач,
ёмкости, цистерны,
«серебряную»
краску.
50. Алюминий в быту
Используемые свойства:легкость,прочность,коррозионная
прочность, нетоксичность
51. Термит – смесь Fe3O4 с порошком Al.
При поджигании смеси происходитэнергичная реакция с выделением
большого количества теплоты, которой
достаточно для полного расплавления
получаемого железа.
8Al + 3Fe3O4 4Al2O3 + 9Fe
Этот процесс используют для сварки
стальных рельс.
52. Металл будущего
• Вывод: Обладая такими свойствами каклёгкость, прочность,
коррозионноустойчивость, устойчивость
к действию сильных химических
реагентов - алюминий нашёл большое
значение в авиационном и космическом
транспорте применение во многих
отраслях народного хозяйства. Особое
место алюминий и его сплавы
занимают в электротехнике, а за ними
будущее нашей науки и техники.
52
53.
Вставьте пропущенные слова1. Алюминий - элемент III группы, главной подгруппы.
2. Заряд ядра атома алюминия равен +13.
3. В ядре атома алюминия 13 протонов.
4. В ядре атома алюминия 14 нейтронов.
5. В атоме алюминия 13 электронов.
6. Атом алюминия имеет 3 энергетических уровня.
7. Электронная оболочка имеет строение 2е, 8е, 3е.
8. На внешнем уровне в атоме 3 электронов.
9. Степень окисления атома в соединениях равна +3 .
10.Простое вещество алюминий является металлом.
11.Оксид и гидроксид алюминия имеют амфотерный характер
53














































 Химия
Химия








