Похожие презентации:
Строение атома
1.
ХИМИЯМодуль 1
Строение вещества
лекция 1
Строение атома
Лектор к.х.н., доцент
Черняк Михаил Юрьевич
2.
Разделы лекционного курса3.
В V веке до нашей эры Левкипп и Демокритпервыми употребили слово «атом» для
обозначения мельчайших неделимых частиц
материи («атом» - atoms – по-гречески
значит «неделимый»)
"Если бы я хотел
читать, не зная букв бессмысленное дело.
Если бы я хотел
рассуждать о
естественных вещах,
не имея представлен
ия о
началах их, это было
бы столь же
бессмысленно".
М. В. Ломоносов
4.
Изучая атмосферу и движение воздуха, Дальтон пришел к выводу, противоречащему убеждениям ведущих химиков того времени, включая Лавуазье. Он обнар
ужил, что воздух является не неким проводящим растворителем, как принято б
ыло считать, а на самом деле представляет собой механическую систему из сме
си крошечных частиц. С этого и началась атомистическая теория Дальтона. Пол
ностью его идеи о строении вещества были сформулированы в «Новой системе
философии химии», выпущенные в трех томах (1808, 1810, 1827 года)
5.
М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов. Большую роль в развитии
атомистической теории сыграл выдающийся русский химик Д. И. Мен
делеев, разработавший в 1869 году периодическую систему элементов
, в которой впервые был поставлен вопрос о единой природе атомов.
6.
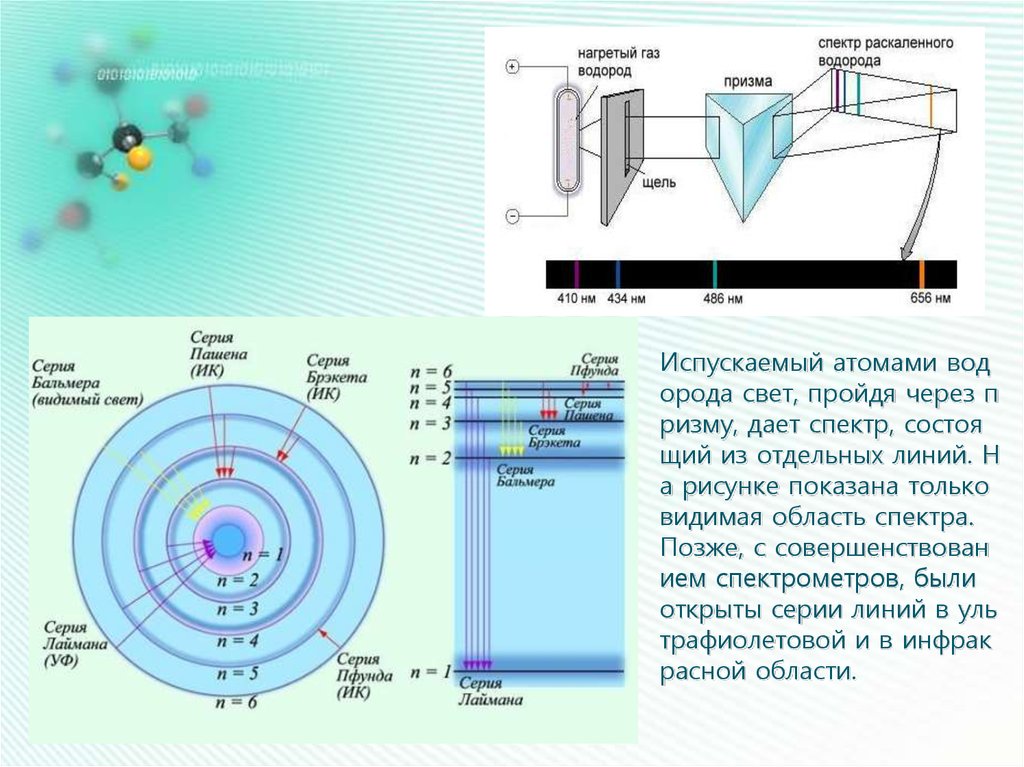
Испускаемый атомами водорода свет, пройдя через п
ризму, дает спектр, состоя
щий из отдельных линий. Н
а рисунке показана только
видимая область спектра.
Позже, с совершенствован
ием спектрометров, были
открыты серии линий в уль
трафиолетовой и в инфрак
расной области.
7.
Опыты Рентгена и БеккереляЗа открытие естественной радиоактивности Беккерель в 1903 г
оду был удостоен Нобелевской премии по физике, разделив е
е с Пьером и Марией Кюри
8.
Опыты Крукса и ТомсонаВращение вертушки с лопастями
под действием катодных лучей в
трубке Крукса. Этот опыт позволя
л предположить, что катодные лу
чи больше похожи не на обычны
й свет, а на поток микроскопичес
ких частиц, имеющих массу.
В 1897 году Дж. Дж. Томсон скон
струировал похожую трубку. При
бор Томсона для измерения откл
онения катодных лучей под дейст
вием электрического поля. 1 - от
рицательно заряженный электро
д (катод), 2 - положительно заря
женный электрод, 3 - отверстие,
4 и 5 - пластины электродов для
отклонения катодных лучей, 6 - ч
асть трубки, покрытая изнутри сл
оем вещества, светящимся под д
ействием катодных лучей, 7 - све
тящееся пятно
9.
Модели строения атомаСогласно модели Томсона, атом
представляет собой непрерывно
заряженный положительным зар
ядом шар радиусом порядка 1 А,
внутри которого около своих пол
ожений равновесия колеблются э
лектроны; суммарный отрицатель
ный заряд электронов равен пол
ожительному заряду шара, поэто
му атом в целом нейтрален. Чере
з несколько лет было доказано, ч
то представление о непрерывно
распределенном внутри атома по
ложительном заряде ошибочно.
10.
Планетарная модель атома Резерфорда11.
Постулаты Н. Бора12.
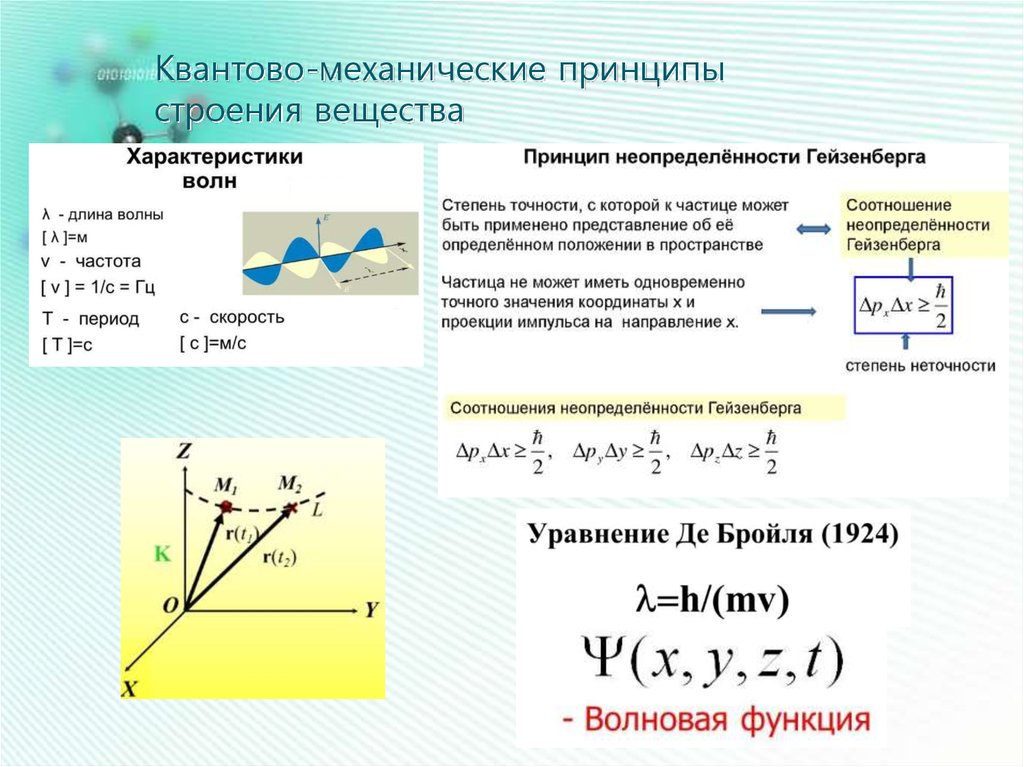
Квантово-механические принципыстроения вещества
13.
Виды графического представленияволновой функции
14.
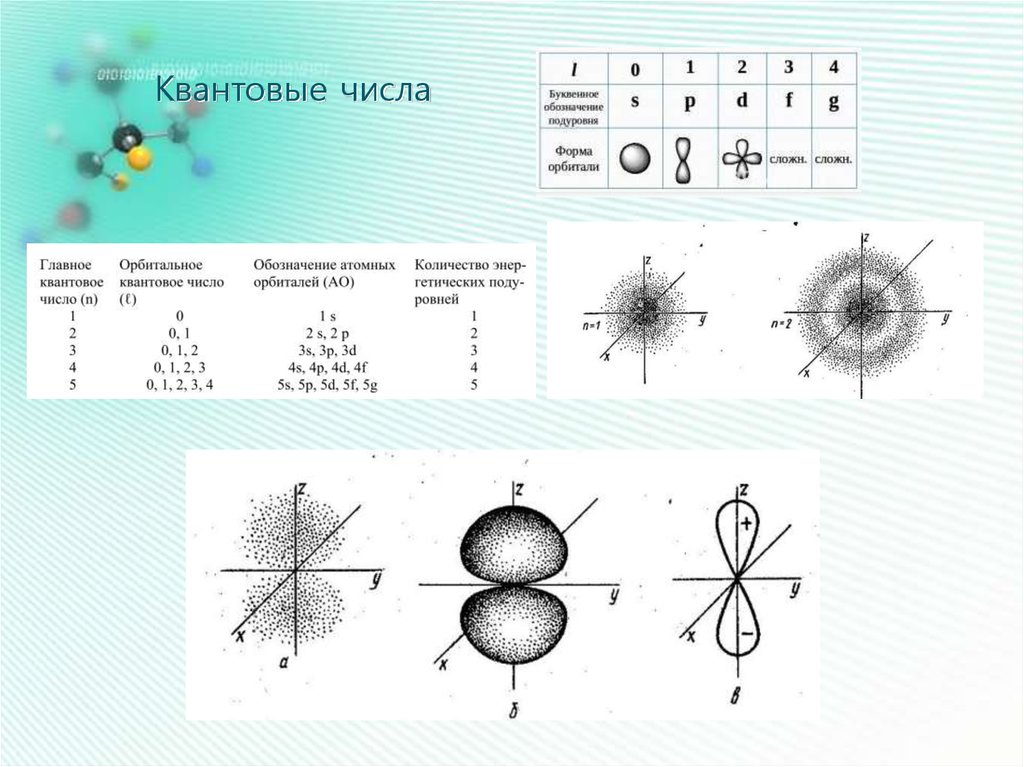
Квантовые числа15.
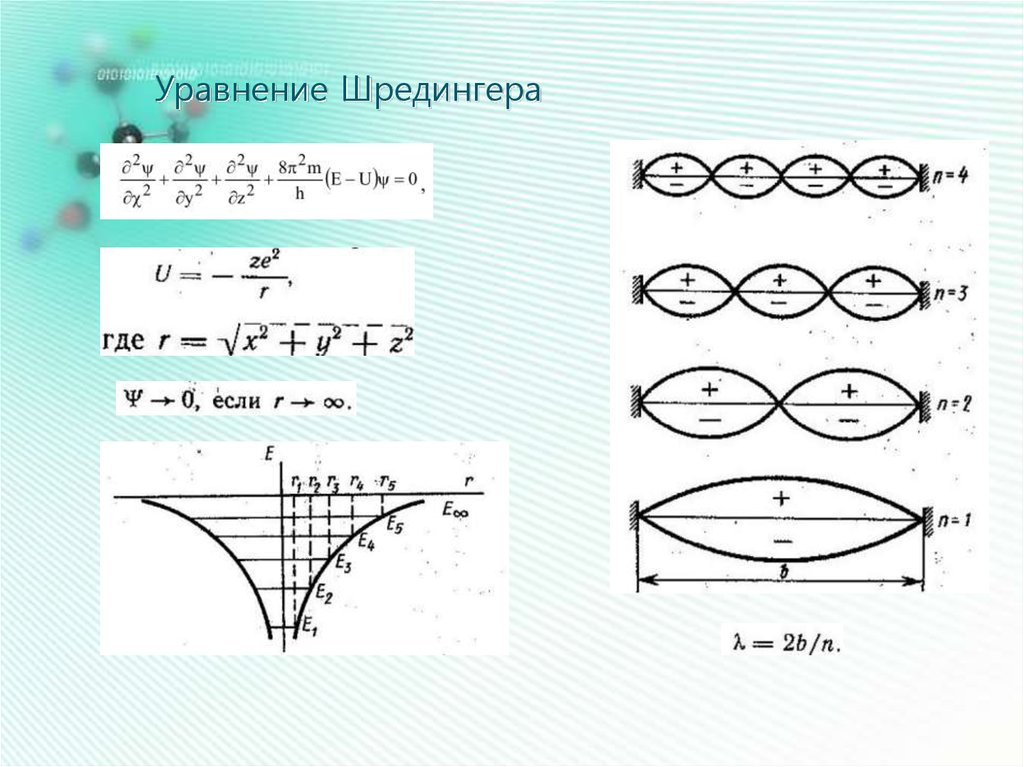
Уравнение Шредингера16.
Квантовые числа17.
Квантовые числаy
y
y
z
z
z
x
x
x
18.
Квантовые числаЭнергетический уровень
Подуровень
Число орбиталей
ml
ПУ
У
ПУ
У
1
2
2
K (n=1)
s (l=0)
0
1
L (n=2)
s (l=0)p (l=1)
M (n=3)
s (l=0)p (l=1)
d (l=2)
0
-1,0,+1
0
-1,0,+1
-2, -1, 0,+1,+2
0
-1,0,+1
-2, -1, 0,+1,+2
-3,-2,-1, 0,+1,+2,+3
1
3
1
3
5
1
3
5
7
N (n=4)
s (l=0)p (l=1)d
(l=2)f (l=3)
ПУ – подуровень, У – уровень
Максимальное число
электронов
4
9
16
2
6
2
6
10
2
6
10
14
8
18
32














 Химия
Химия








