Похожие презентации:
Обмен аминокислот
1. Лекция 7 Обмен аминокислот
2.
• С пищей в сутки поступает около 100 гбелков;
• Расщепление белков в процессе
пищеварения происходит под
действием протеолитических
ферментов;
• В конечном итоге пищевые белки
превращаются в аминокислоты 20
разновидностей.
3.
• Бόльшая часть аминокислотиспользуется для синтеза белков;
• Помимо синтеза белков аминокислоты
еще используются для синтеза различных
небелковых соединений, имеющих важное
биологическое значение;
• Так, из аминокислот синтезируется
глюкоза, азотистые основания,
небелковая часть гемоглобина - гем,
гормоны - адреналин и тироксин и очень
важные соединения, участвующие в
энергообеспечении мышечной работы –
креатин и карнитин.
4.
Часть аминокислот подвергаетсяраспаду и превращаются в конечные
продукты: CO2, H2O и NH3;
Распад начинается с реакций, общих
для большинства аминокислот:
Декарбоксилирование аминокислот
Дезаминирование аминокислот
Трансаминирование (переаминирование)
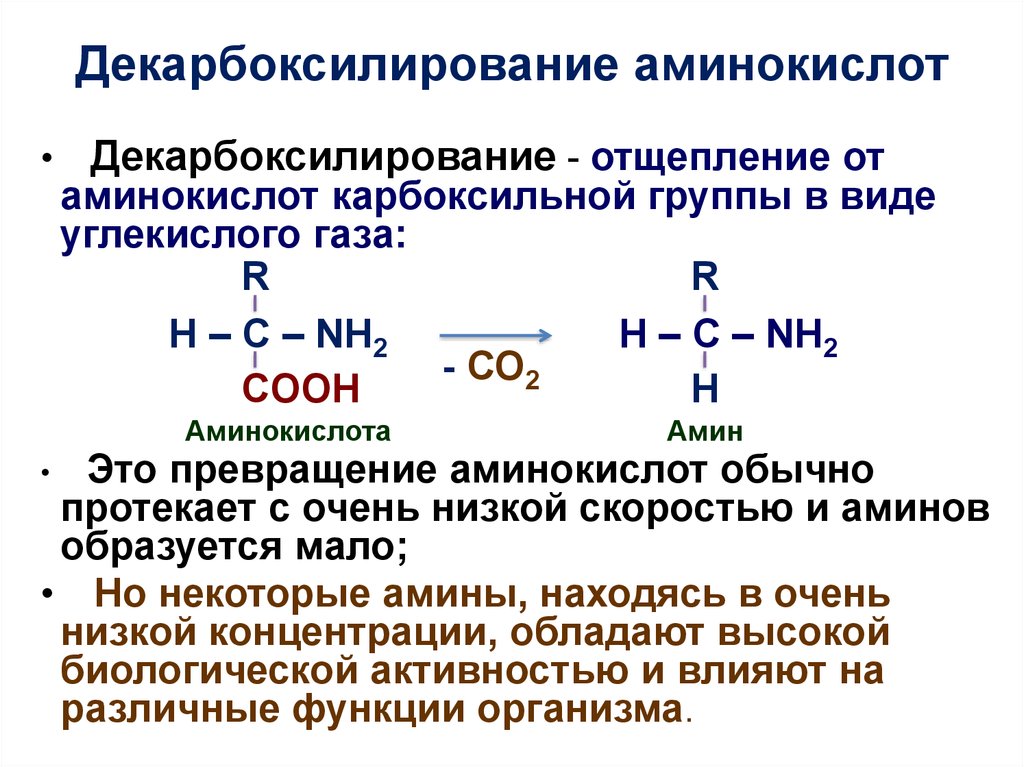
5. Декарбоксилирование аминокислот
Декарбоксилирование - отщепление от
аминокислот карбоксильной группы в виде
углекислого газа:
R
R
H – C – NH2
H – C – NH2
- СО2
COOH
H
Аминокислота
Амин
Это превращение аминокислот обычно
протекает с очень низкой скоростью и аминов
образуется мало;
• Но некоторые амины, находясь в очень
низкой концентрации, обладают высокой
биологической активностью и влияют на
различные функции организма.
6.
• Очень активным биогенным аминомявляется гистамин, образующийся при
декарбоксилировании аминокислоты
гистидина;
• Биологическая активность гистамина
проявляется в том, что под его
воздействием расширяются
кровеносные сосуды, в первую очередь,
мелкие, что приводит к снижению
кровяного давления; увеличивается
секреция желудочного сока;
• Кроме этого гистамин участвует в
формировании болевых ощущений и в
развитии аллергических реакций.
7.
• Однако серьезной опасности дляорганизма биогенные амины не
представляют, так как в организме
имеются ферменты, разрушающие и
обезвреживающие амины;
• Поэтому проявление биологической
активности аминов возможно лишь
при их значительной выработке или
при снижении активности ферментов,
вызывающих их детоксикацию.
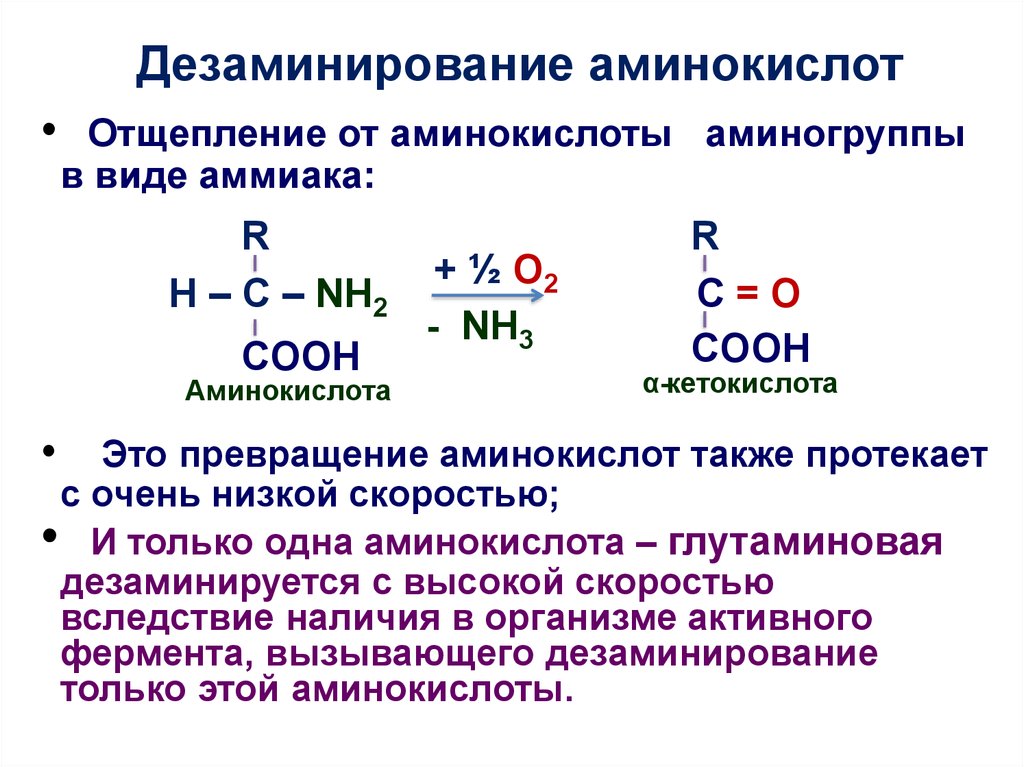
8. Дезаминирование аминокислот
Отщепление от аминокислоты аминогруппы
в виде аммиака:
R
H – C – NH2
COOH
Аминокислота
+ ½ О2
- NH3
R
C=O
COOH
α-кетокислота
• Это превращение аминокислот также протекает
с очень низкой скоростью;
• И только одна аминокислота – глутаминовая
дезаминируется с высокой скоростью
вследствие наличия в организме активного
фермента, вызывающего дезаминирование
только этой аминокислоты.
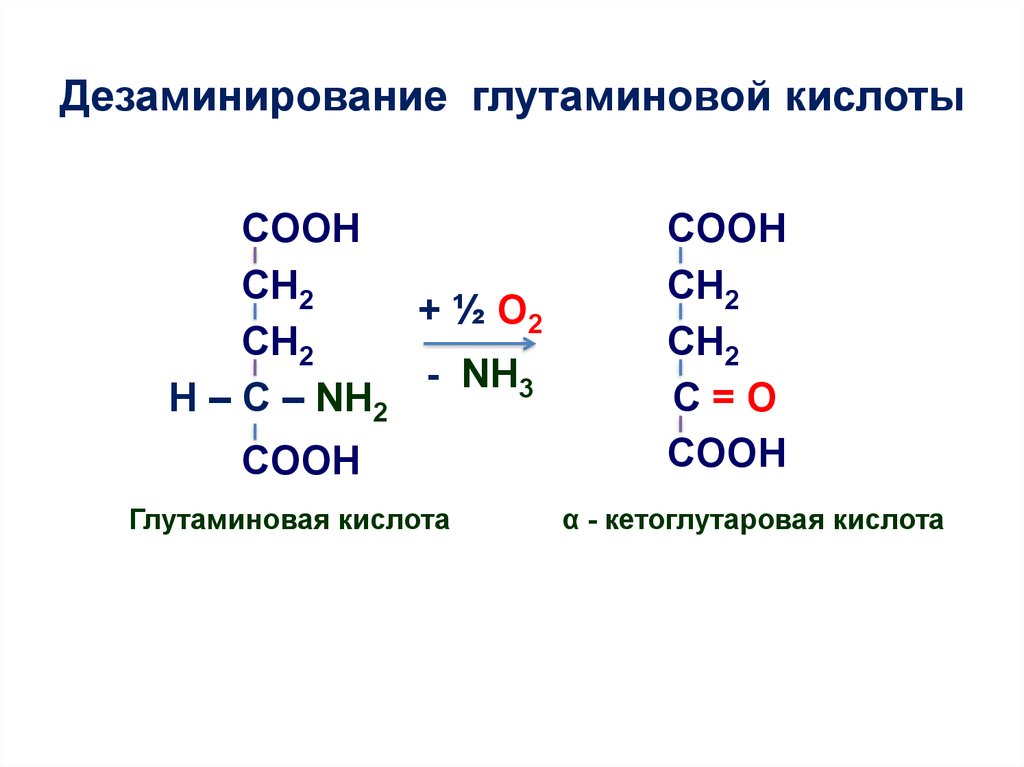
9. Дезаминирование глутаминовой кислоты
COOHCH2
+ ½ О2
CH2
- NH3
H – C – NH2
COOH
Глутаминовая кислота
COOH
CH2
CH2
C=O
COOH
α - кетоглутаровая кислота
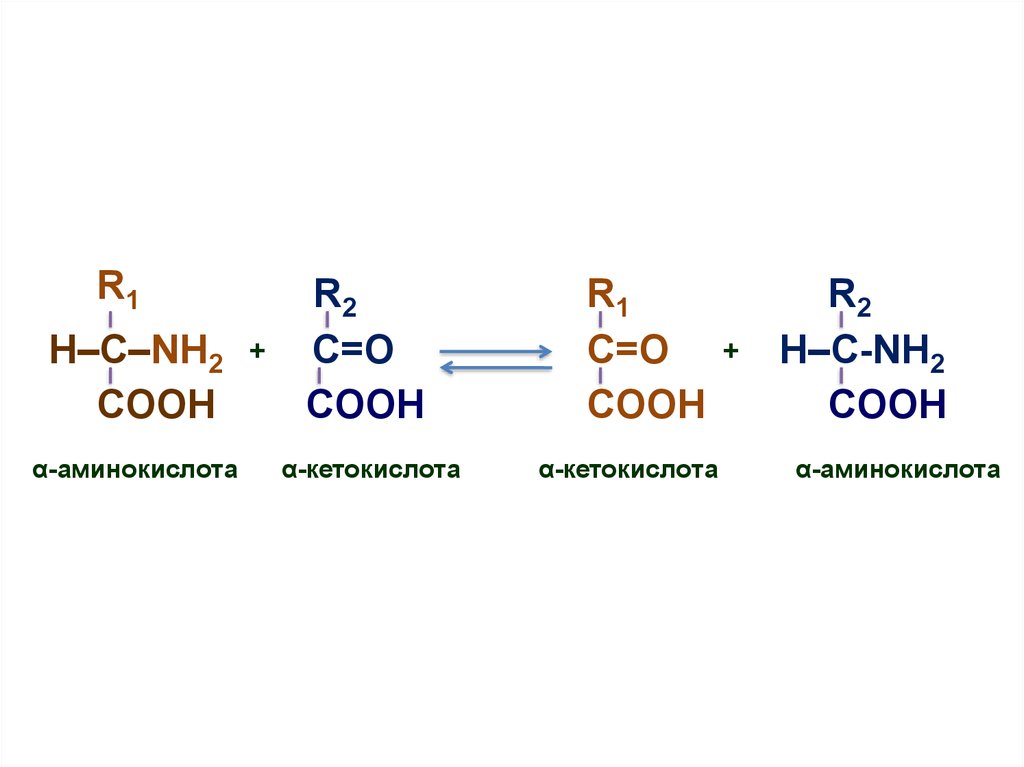
10. Трансаминирование (переаминирование)
• Реакция между аминокислотами и кетокислотами;• В ходе этой реакции ее участники
обмениваются функциональными
группами, в результате чего
аминокислота превращается
в -кетокислоту, а кетокислота
становится аминокислотой
11.
R1H–C–NH2
COOH
α-аминокислота
+
R2
C=О
COOH
α-кетокислота
R1
C=О
COOH
α-кетокислота
+
R2
H–C-NH2
COOH
α-аминокислота
12.
Трансаминированию подвергаютсявсе аминокислоты;
В этой реакции участвует
кофермент - фосфопиридоксаль,
для образования которого необходим
витамин В6 – пиридоксин;
Трансаминирование - это главное
превращение аминокислот в
организме, так как его скорость
значительно выше, чем у реакций
декарбоксилирования и
дезаминирования.
13.
Трансаминирование выполняет двеосновные функции:
а) За счет трансаминирования одни
аминокислоты могут превращаться в другие;
• При этом общее количество аминокислот
не меняется, но изменяется соотношение
между ними;
• С пищей в организм поступают
чужеродные белки, у которых аминокислоты
находятся в иных пропорциях по сравнению
с белками организма;
• Путем трансаминирования происходит
корректировка аминокислотного состава
организма.
14.
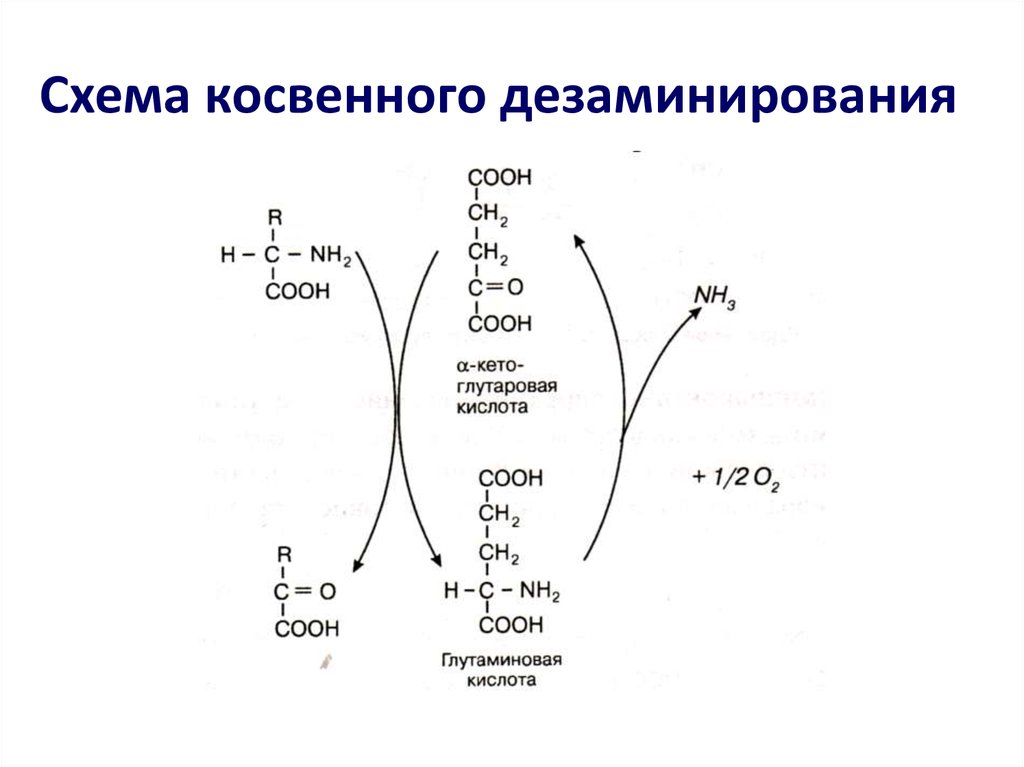
б) Трансаминирование является составнойчастью косвенного (непрямого)
дезаминирования аминокислот - процесса, с
которого начинается распад большинства
аминокислот;
• На первой стадии этого процесса
аминокислоты вступают в реакцию
трансаминирования с -кетоглутаровой
кислотой ( -кетокислота);
• Аминокислоты при этом превращаются
в -кетокислоты, а -кетоглутаровая кислота
переходит в глутаминовую кислоту
(аминокислота).
• На второй стадии появившаяся глутаминовая
кислота подвергается дезаминированию, от нее
отщепляется NH3 и снова образуется
-кетоглутаровая кислота.
15. Схема косвенного дезаминирования
16.
• Итоговое уравнение косвенногодезаминирования совпадает с
уравнением прямого дезаминирования:
R
+ ½ О2
H – C – NH2
- NH3
COOH
Аминокислота
R
C=O
COOH
α-кетокислота
• Однако у косвенного дезаминирования
скорость значительно выше, чем у
прямого, что обусловлено высокой
активность ферментов, катализирующих
обе стадии этого процесса.
17.
• Образовавшиеся -кетокислотыдалее подвергаются глубокому распаду
и превращаются в конечные продукты
CO2 и H2O;
• Для каждой из 20 кетокислот (их
образуется столько же, сколько
имеется видов аминокислот)
имеются свои специфические пути
распада;
18.
• Второй продукт косвенногодезаминирования аминокислот –
аммиак;
• Для организма аммиак является
высоко токсичным;
• Поэтому в организме имеются
молекулярные механизмы его
обезвреживания.
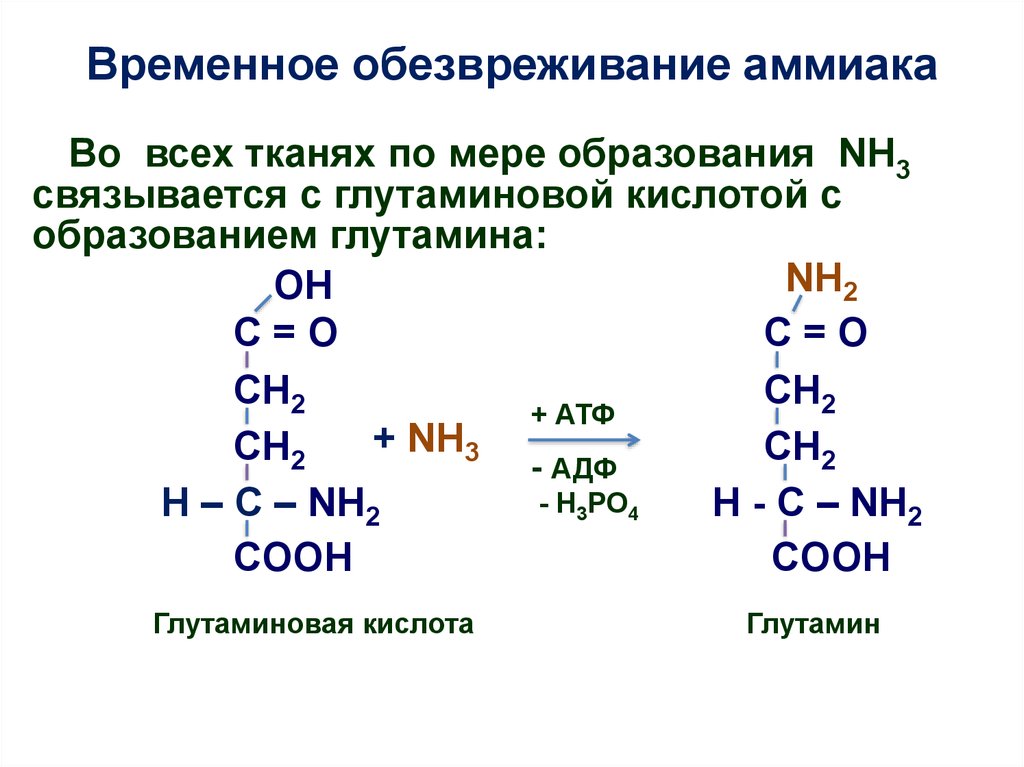
19. Временное обезвреживание аммиака
Во всех тканях по мере образования NH3связывается с глутаминовой кислотой с
образованием глутамина:
NH2
ОН
C=O
C=O
CH2
CH2
+ АТФ
+ NH3
CH2
CH
2
- АДФ
- Н3РО4
H – C – NH2
H - C – NH2
COOH
COOH
Глутаминовая кислота
Глутамин
20.
• С током крови глутамин поступает впечень, где распадается опять на
глутаминовую кислоту и NH3;
• Образовавшаяся глутаминовая
кислота с кровью снова поступает в
органы для обезвреживания новых
порций аммиака;
• Освободившийся аммиак, а также
углекислый газ в печени используются
для синтеза мочевины.
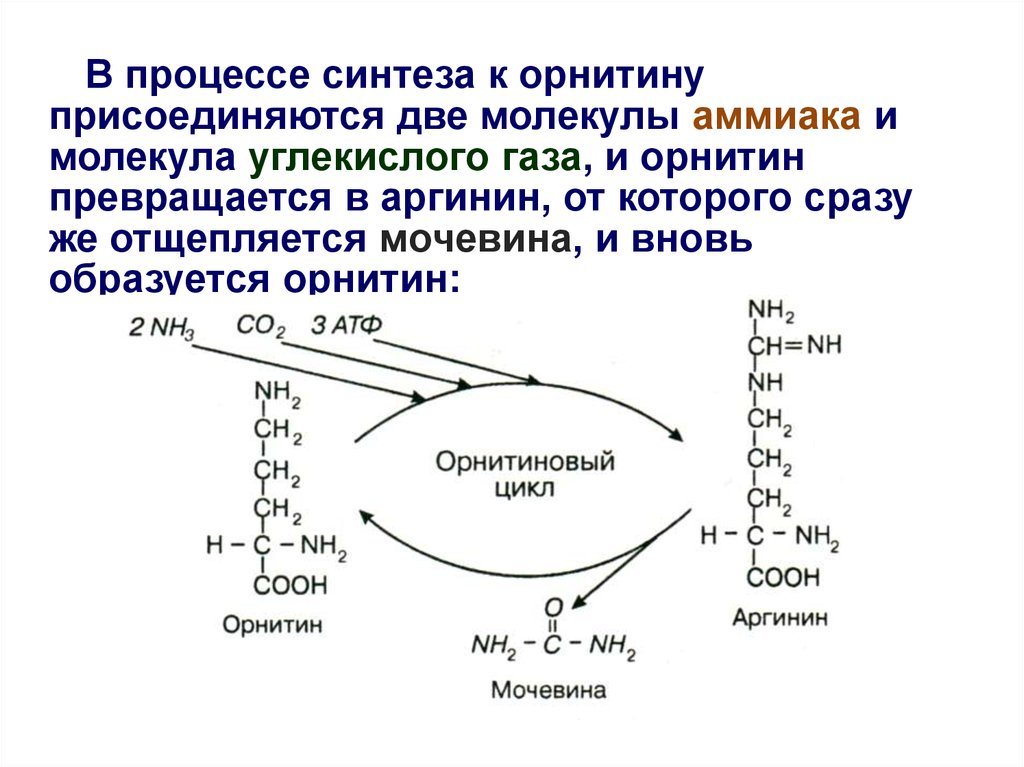
21.
• Синтез мочевины - циклический,многостадийный процесс, потребляющий
большое количество энергии;
• В синтезе мочевины очень важное участие
принимает аминокислота орнитин;
• Эта аминокислота не входит в состав
белков;
• Образуется орнитин из другой
аминокислоты – аргинина, которая
присутствует в белках;
• В связи с важной ролью орнитина синтез
мочевины получил название «орнитиновый
цикл».
22. В процессе синтеза к орнитину присоединяются две молекулы аммиака и молекула углекислого газа, и орнитин превращается в
аргинин, от которого сразуже отщепляется мочевина, и вновь
образуется орнитин:
23.
• Синтез мочевины – это окончательноеобезвреживание аммиака;
.
• Из печени с кровью мочевина
поступает в почки и выделяется с мочой;
• В сутки образуется 20-35 г мочевины;
• Выделение мочевины с мочой
характеризует скорость распада белков в
организме.
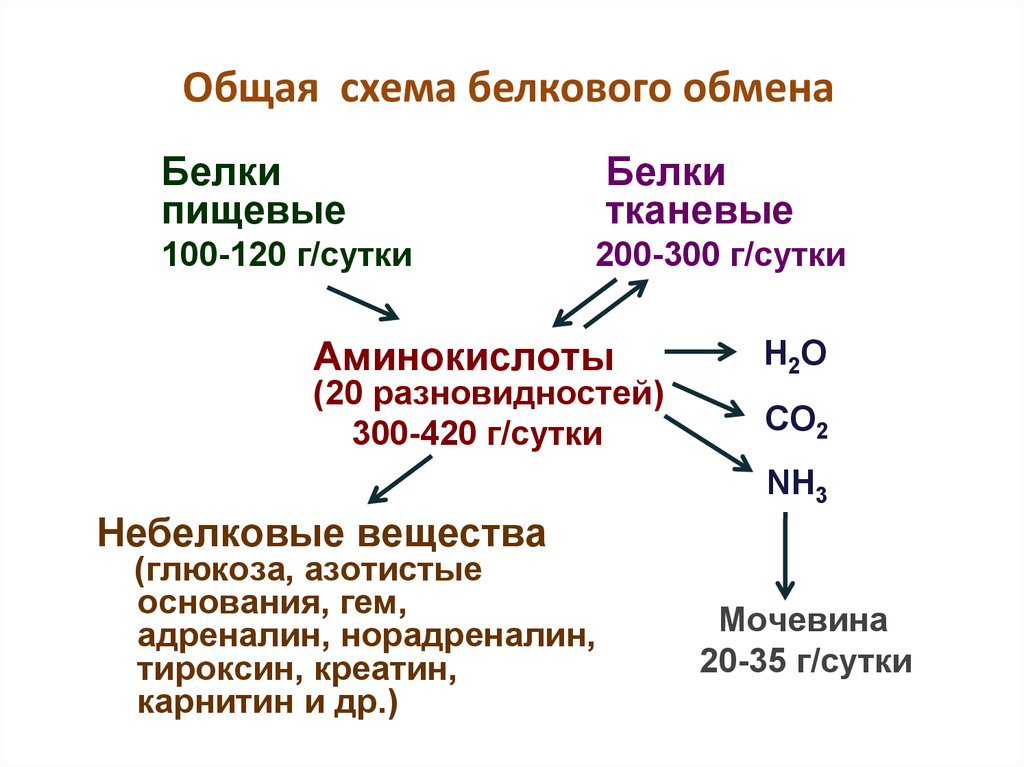
24. Общая схема белкового обмена
Белкипищевые
100-120 г/сутки
Белки
тканевые
200-300 г/сутки
Аминокислоты
(20 разновидностей)
300-420 г/сутки
Н2О
CО2
NH3
Небелковые вещества
(глюкоза, азотистые
основания, гем,
адреналин, норадреналин,
тироксин, креатин,
карнитин и др.)
Мочевина
20-35 г/сутки
25.
Тест 1Основным превращением аминокислот в
организме является реакция:
а)
б)
в)
г)
дезаминирования
декарбоксилирования
изомеризации
трансаминирования
26.
Тест 2В организме дезаминированию
преимущественно подвергается аминокислота:
а)
б)
в)
г)
аланин
глицин
глутаминовая кислота
цистеин
27.
Тест 3При декарбоксилировании аминокислот
образуется:
а) аммиак
б) ацетон
в) лактат
г) углекислый газ
28.
Тест 4В процессе трансаминирования
аминогруппа переносится:
а) от амина на аминокислоту
б) от амина на -кетокислоту
в) от аммиака на аминокислоту
г) от аминокислоты на - кетокислоту
29.
Тест 5При трансаминировании аминокислоты
превращаются:
а) в жирные кислоты
б) в кетокислоты
в) в молочную кислоту
г) в углекислый газ и воду
30.
Тест 6Биогенные амины в организме образуются
в реакции:
а) дезаминирования
б) декарбоксилирования
в) изомеризации
г) трансаминирования
31.
Тест 7Углекислый газ при распаде аминокислот
образуется путем:
а) дезаминирования
б) декарбоксилирования
в) окисления
г) трансаминирования
32.
Тест 8Аммиак образуется при дезаминировании:
а)
б)
в)
г)
аминокислот
ацетил-КоА
кетокислот
кетоновых тел
33.
Тест 9При временном обезвреживании аммиака
образуется:
а) глутамин
б) глутаминовая кислота
в) мочевая кислота
г) мочевина
34.
Тест 10Специфическим продуктом распада
белков является:
а) ацетоуксусная кислота
б) молочная кислота
в) мочевая кислота
г) мочевина
35.
Тест 11При обычном питании в сутки выделяется
мочевины:
а) 10-15 г
б) 20-30 г
в) 50-60 г
г) 90-100 г



























 Биология
Биология








