Похожие презентации:
Обмен белков. Общие пути обмена аминокислот
1. ОБМЕН БЕЛКОВ. ОБЩИЕ ПУТИ ОБМЕНА АМИНОКИСЛОТ
Кафедра биологической химии2.
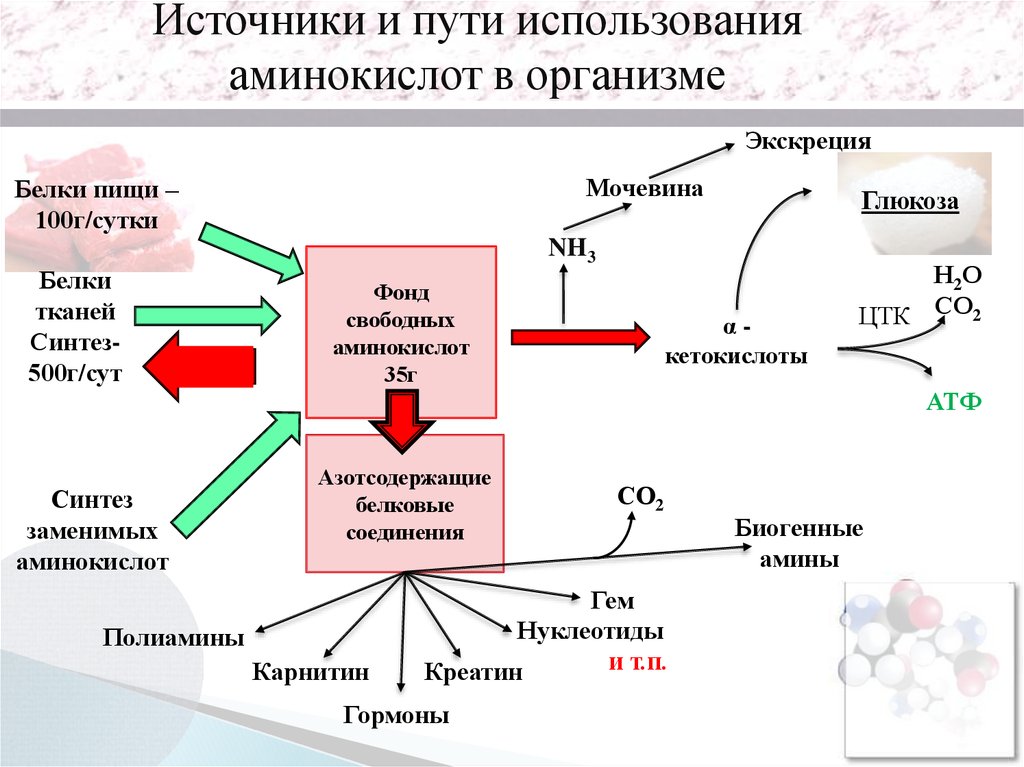
Источники и пути использованияаминокислот в организме
Экскреция
Мочевина
Белки пищи –
100г/сутки
Белки
тканей
Синтез500г/сут
Глюкоза
NH3
Фонд
свободных
аминокислот
35г
αкетокислоты
Н2О
ЦТК СО2
АТФ
Синтез
заменимых
аминокислот
Азотсодержащие
белковые
соединения
Полиамины
Карнитин
СО2
Гем
Нуклеотиды
и т.п.
Креатин
Гормоны
Биогенные
амины
3. Значение знаний путей обмена аминокислот
1.2.
3.
4.
5.
Из аминокислот построены белки;
Из
аминокислот
синтезируются
многие
биологически активные соединения;
Нарушение обмена аминокислот лежат в основе
патогенеза многих приобретенных и врожденных
заболеваний;
Широкое
использование
определения
содержания аминокислот, промежуточных и
конечных продуктов в биологических жидкостях
для диагностических целей;
Используются как лекарственные препараты.
4.
Показателем состояния белкового иаминокислотного
обмена
является
азотистый баланс
Азотистый баланс – разница между
количеством азота, поступающим с пищей, и
количеством азота выделяемого почками в виде
мочевины и аммонийных солей.
5.
Виды азотистого балансаПоложительный
(количество выделяемого азота меньше
поступающего) – у детей, выздоравливающих больных после
тяжелой болезни, лактация, при обильном белковом питании,
начальная стадия новообразования;
Отрицательный
(количество выделяемого азота
больше поступающего) – при тяжелых заболеваниях,
голодании, старении, распаде опухоли, малобелковое или
неполноценное питание;
Равный нулю (азотистое равновесие) –
здоровых взрослых людей при нормальном питании.
у
6. Полноценный белок: 1. набор незаменимых аминокислот; 2. соотношение аминокислот должно быть близким к их соотношению в белках человека.
1.Заменимые – Ала, Асп, Асн, Глу, Глн, Про, Гли, Сер – синтезируются внеобходимых количествах в организме;
2. Незаменимые – Вал, Лей, Иле, Мет, Фен, Три, Лиз, Тре – не
синтезируются в организме;
3. Частично заменимые – Гис, Арг – синтезируются в организме очень
медленно, в количествах не покрывающих потребностей организма, особенно в
детском возрасте;
4. Условно заменимые – Цис, Тир – синтезируются из незаменимых
аминокислот Мет и Фен (соответственно).
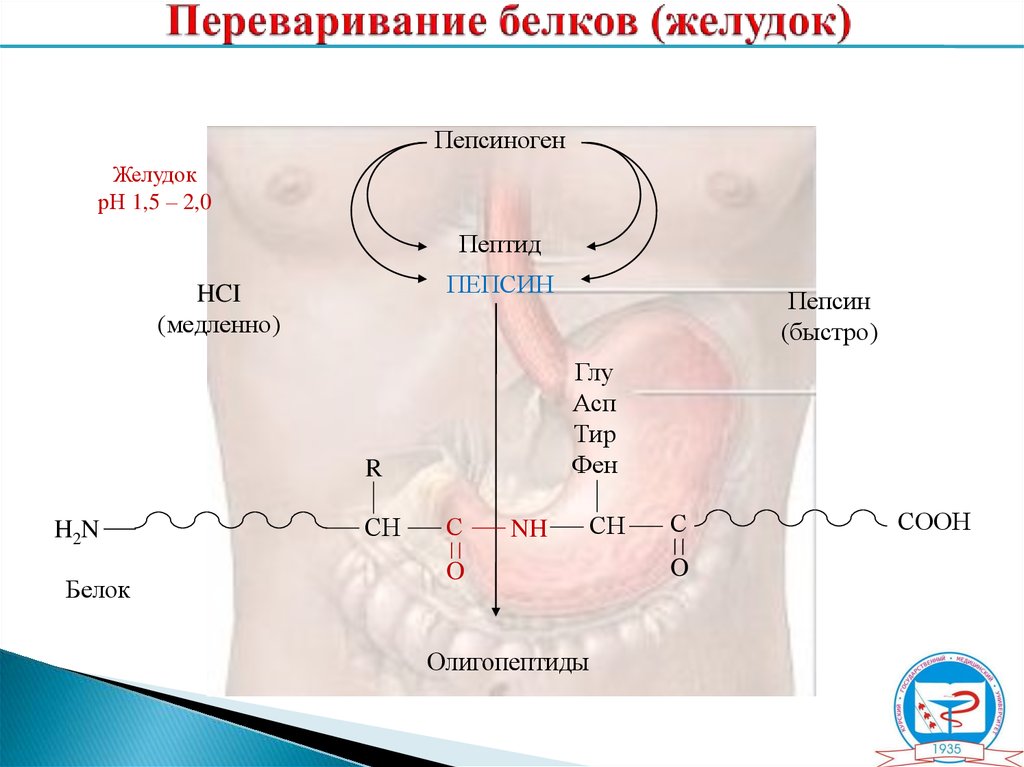
7. Переваривание белков в ЖКТ
ПепсиногенЖелудок
рН 1,5 – 2,0
Пептид
ПЕПСИН
HCI
(медленно)
Глу
Асп
Тир
Фен
R
H2N
Белок
СH
Пепсин
(быстро)
С
NH
O
Олигопептиды
СH
С
O
СООН
8. Переваривание белков (желудок)
Переваривание белков (тонкий кишечник)Трипсиноген
Энтеропептидаза
(медленно)
Трипсин
(быстро)
Пептид
ТРИПСИН
Прокарбоксипептидаза А, В
Химотрипсиноген
Пептид
Пептид
ХИМОТРИПСИН
Пептид
ЭЛАСТАЗА
Проэластаза
КАРБОКСИПЕПТИДАЗА А, В
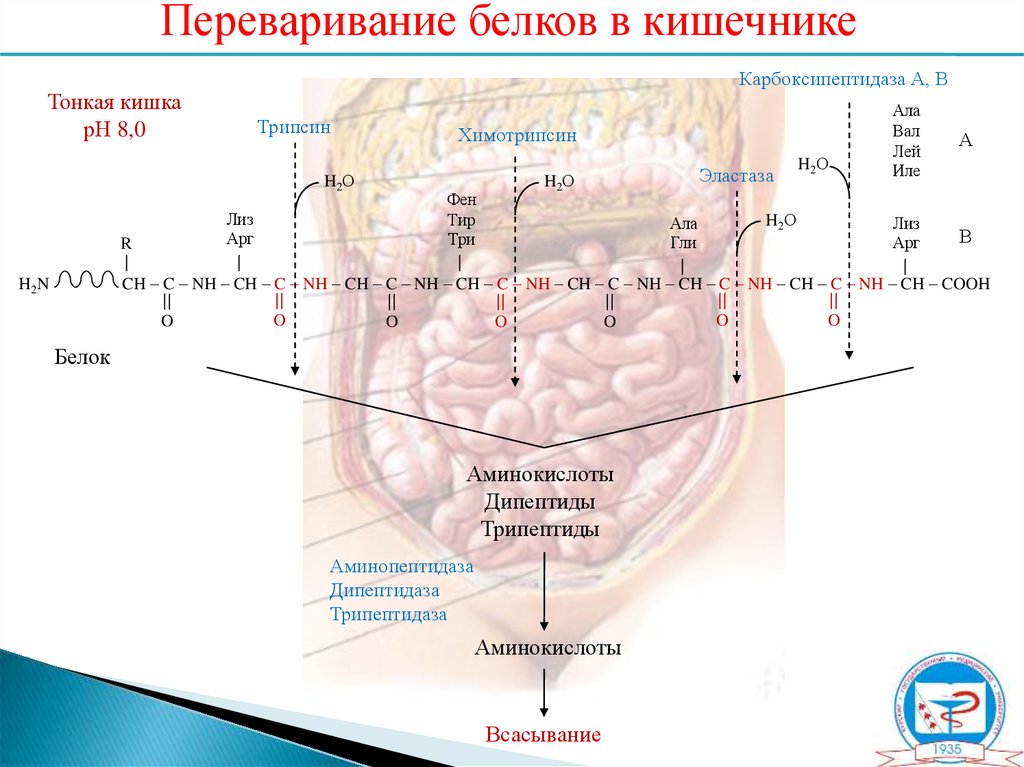
9.
Переваривание белков в кишечникеКарбоксипептидаза А, В
Тонкая кишка
рН 8,0
Трипсин
Химотрипсин
H2О
R
H2О
Фен
Тир
Три
Лиз
Арг
Эластаза
H2О
H2О
Ала
Гли
Ала
Вал
Лей
Иле
А
Лиз
Арг
В
CH – C – NH – CH – C – NH – CH – C – NH – CH – C – NH – CH – C – NH – CH – C – NH – CH – C – NH – CH – COOH
H2N
O
O
O
O
O
Белок
Аминокислоты
Дипептиды
Трипептиды
Аминопептидаза
Дипептидаза
Трипептидаза
Аминокислоты
Всасывание
O
O
10.
Осуществляется 5 транспортными системами(белки-переносчики) с затратой энергии:
1.
2.
3.
4.
5.
Аминокислоты с нейтральными радикалами.
С нейтральными разветвленными радикалами
(лей, илей, вал).
С катионным радикалом (лиз, арг).
С анионным радикалом (глу, асп);
Иминокислоты (про, опро).
Переносчики аминокислот 1-й, 5-й групп и мет
являются натрий-зависимыми
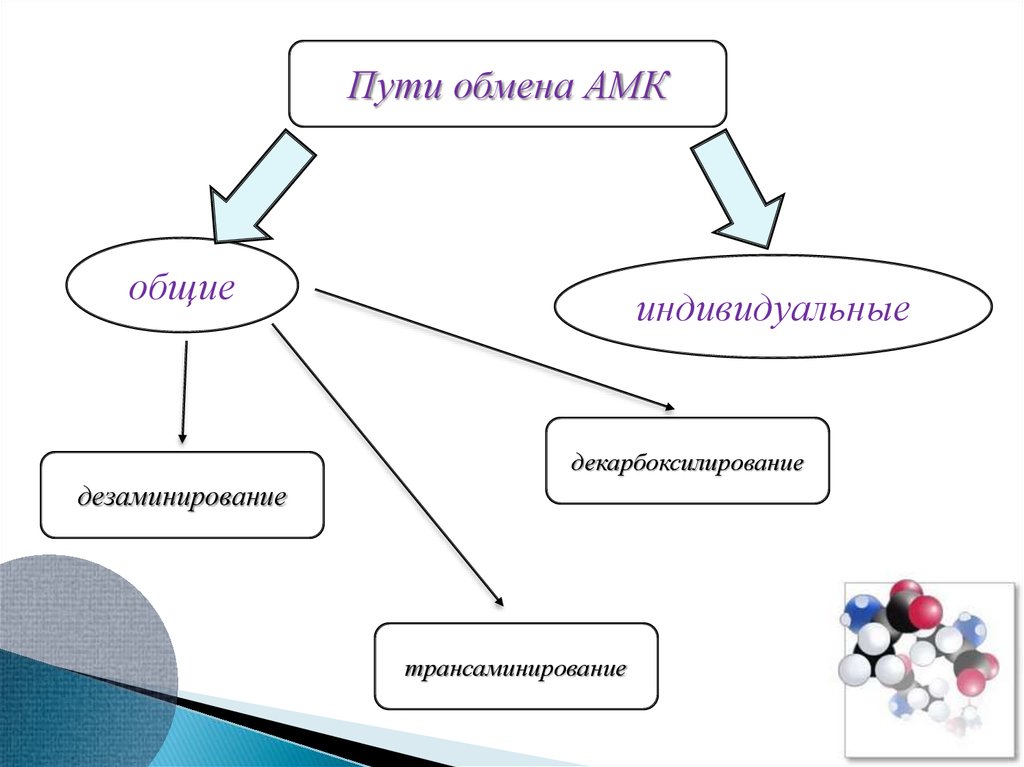
11. Мембранный транспорт аминокислот
Пути обмена АМКобщие
индивидуальные
декарбоксилирование
дезаминирование
трансаминирование
12.
Основные этапы катаболизма аминокислотДезаминирование – отщепление α-аминогруппы в виде молекулы аммиака
(кроме лизина и пролина)
H2N-CH-COOH
аминокислота
R
аммиак
NH3
О=С-СООН
R
α-кетокислота
Аммонийные
соли
Мочевина
ОПК
Глюкоза
(глюконеогенез )
Экскреция
Окисление до
СО2 и Н2О
Кетоновые
тела
(кетогенез)
Синтез
аминокислот
13.
Виды реакции дезаминирования1. Прямое:
1.1. Окислительное (ГЛУ);
1.2. Неокислительное (СЕР, ТРЕ, ГИС, ЦИС);
2. Непрямое (все остальные аминокислоты)
2.1. Окислительное (трансдезаминирование)
2.2. Неокислительное
14. Общие пути катаболизма аминокислот
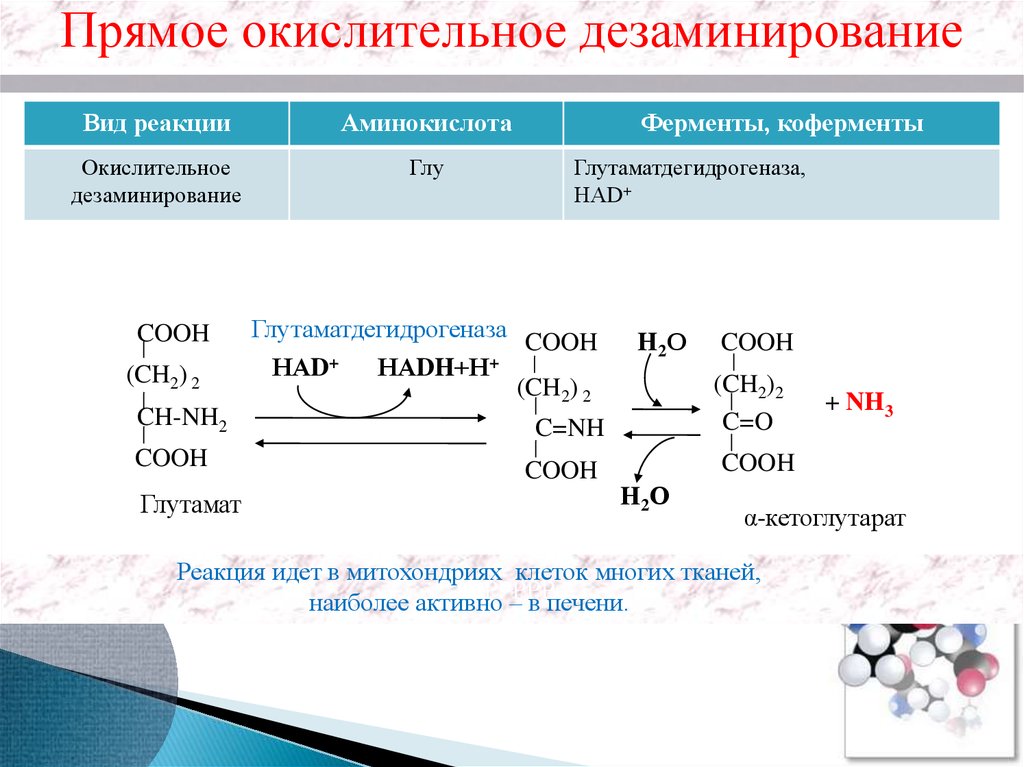
Прямое окислительное дезаминированиеВид реакции
Аминокислота
Окислительное
дезаминирование
Глу
COOH
(CH2) 2
CH-NH2
COOH
Глутамат
Ферменты, коферменты
Глутаматдегидрогеназа,
НАD+
Глутаматдегидрогеназа COOH
НАD+ НАDH+Н+
(CH2) 2
H2О
(CH2)2
C=O
C=NH
COOH
COOH
+ NH3
COOH
H2О
α-кетоглутарат
Реакция идет в митохондриях клеток многих тканей,
рРРРРРРр
наиболее активно
– в печени.
15.
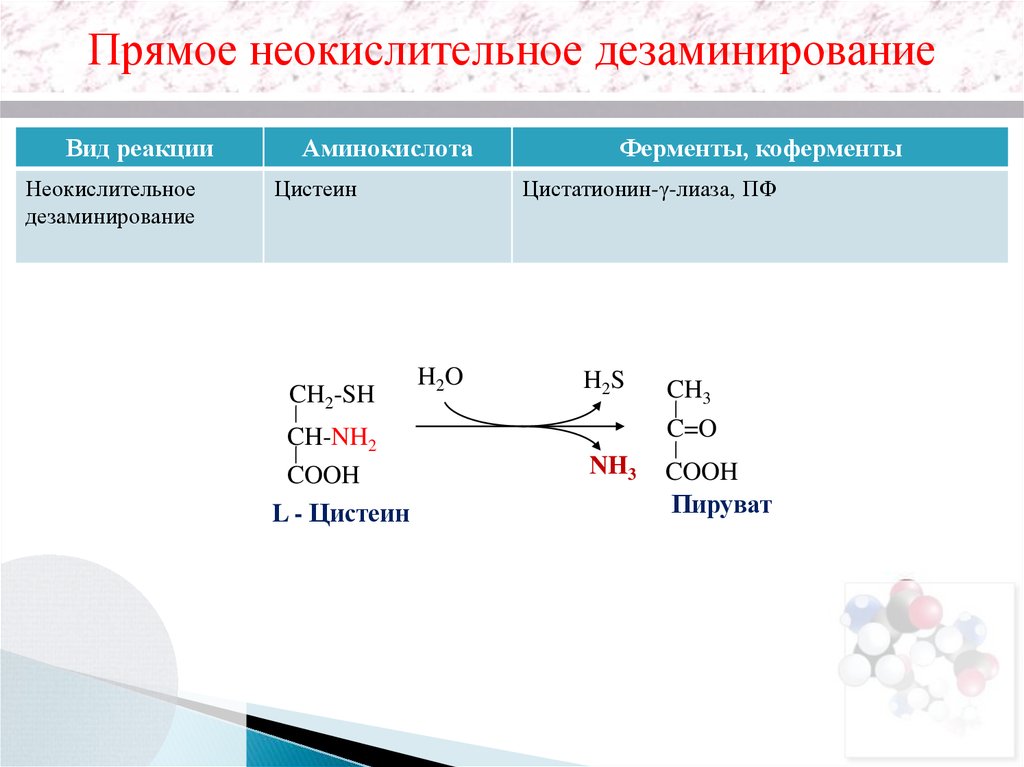
Прямое неокислительное дезаминированиеВид реакции
Неокислительное
дезаминирование
Аминокислота
Цистеин
CH2-SH
CH-NH2
COOH
L - Цистеин
Ферменты, коферменты
Цистатионин-γ-лиаза, ПФ
H2O
H2S
CH3
C=O
NH3
COOH
Пируват
16. Доказано существование 4 типов дезаминирования АМК
Прямое неокислительное дезаминированиеВид реакции
Неокислительное
дезаминирование
Аминокислота
Гис
Ферменты, коферменты
Гистидаза
-CH2-CH-COOH
NH2 гистидаза
N
NH
Гистидин
-CH=CH-COOH
N
NH
NH3
Уроканиновая
кислота
17. Доказано существование 4 типов дезаминирования АМК
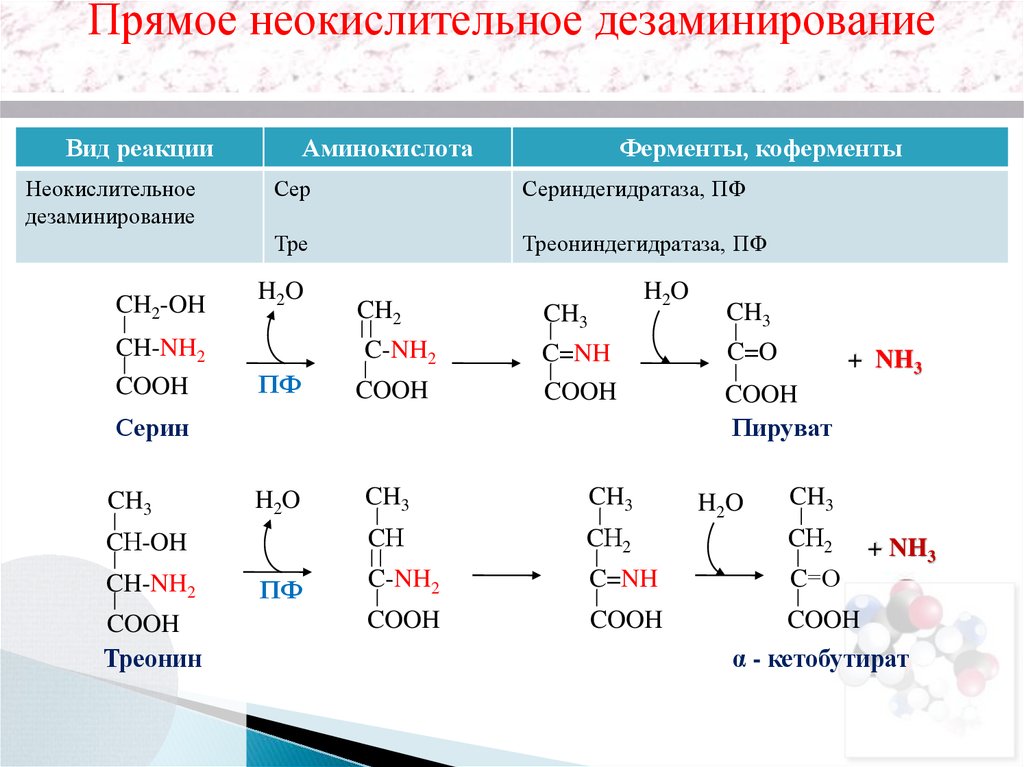
Прямое неокислительное дезаминированиеВид реакции
Неокислительное
дезаминирование
CH2-OH
CH-NH2
COOH
Аминокислота
Ферменты, коферменты
Сер
Сериндегидратаза, ПФ
Тре
Треониндегидратаза, ПФ
H2O
CH2
C-NH2
H2O
CH3
C=NH
COOH
COOH
Треонин
+ NH3
COOH
H2O
CH3
CH3
CН
CН2
CН2
C-NH2
C=NH
C=О
COOH
COOH
COOH
CН-OH
CH-NH2
C=O
ПФ
Серин
CH3
CH3
ПФ
COOH
Пируват
H2O
CH3
+ NH3
α - кетобутират
18.
Непрямое окислительное дезаминированиеАминокислота
NH3
α - кетоглутарат
НАDH+Н+
аминотрансфераза
1
2
глутаматдегидрогеназа
НАD+
α - кетокислота
глутамат
19.
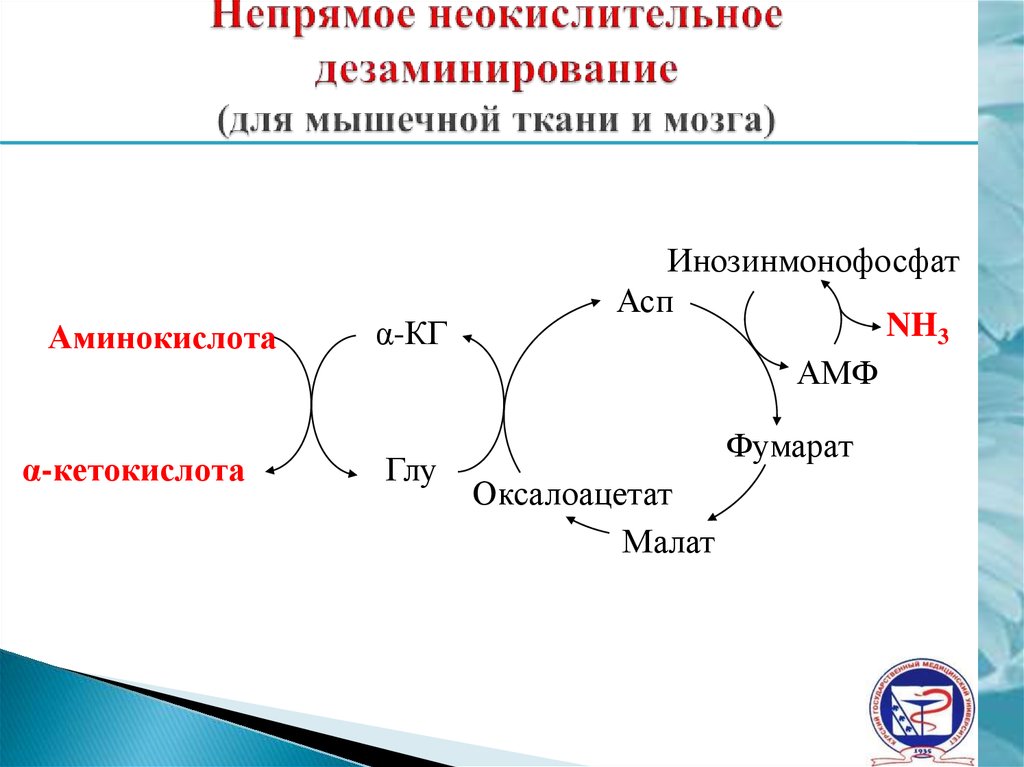
Аминокислотаα-кетокислота
α-КГ
Глу
Инозинмонофосфат
Асп
NH3
АМФ
Фумарат
Оксалоацетат
Малат
20.
Трансаминирование – реакция переноса аминогруппы с аминокислоты(донор) на α-кетокислоту (акцептор) с образованием новой α-кетокислоты и
аминокислоты
Вид реакции
Аминокислота
Ферменты, коферменты
Трансаминирование с αкетоглутаратом,
образование Глу
Большинство
аминокислота, кроме лиз,
тре, про
Трансаминаза,
фосфопиридоксаль
R1
R2
CH-NH2
COOH
Аминокислота
Асп
+
Ала
+
+
C=O
Аминтрансфераза
R1
C=O
R2
+
CH-NH
2
ПиридоксальCOOH фосфат (В6)
COOH
COOH
α-кетокислота
α-кетокислота Аминокислота
Аст
α-кетоглутарат
Оксалоацетат + Глу
Алт
α-кетоглутарат
Пируват
+ Глу
21.
Реакции трансаминирования выполняютважные физиологические функции:
• из α-кетокислот синтезируются аминокислоты,
необходимые для жизнедеятельности клеток;
• происходит перераспределение аминного азота в
тканях и органах;
• начинается катаболизм большинства аминокислот –
первая стадия непрямого дезаминирования.
22.
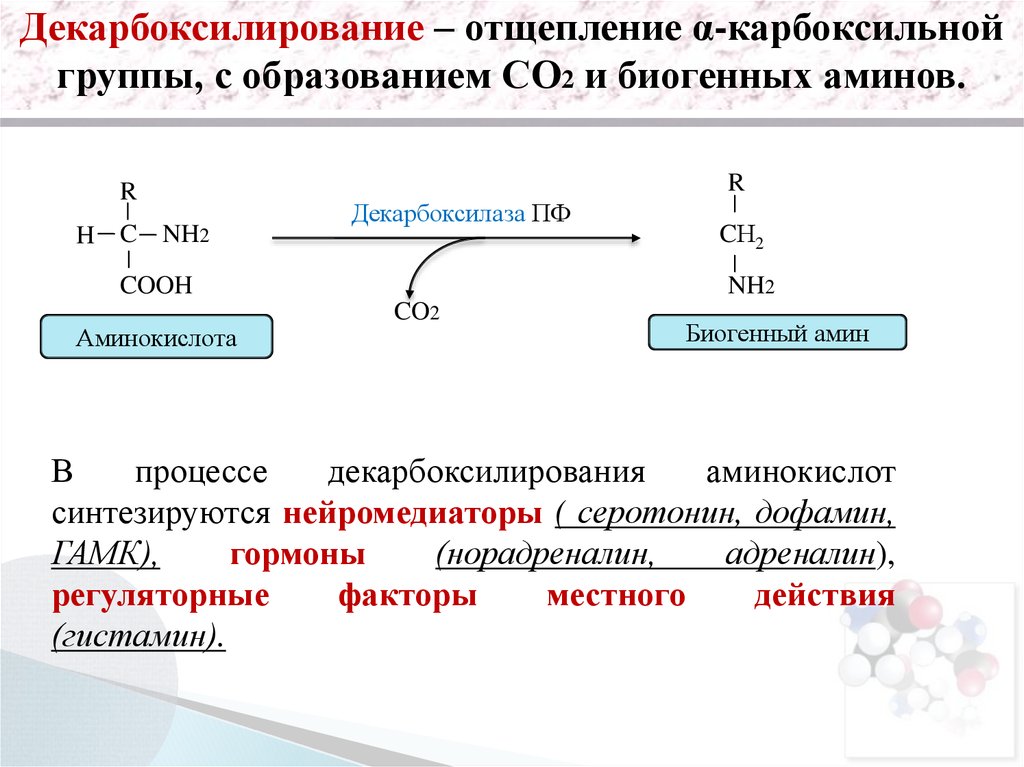
Декарбоксилирование – отщепление α-карбоксильнойгруппы, с образованием СО2 и биогенных аминов.
R
H C NH2
R
Декарбоксилаза ПФ
COOH
Аминокислота
CН2
NH2
CO2
Биогенный амин
В
процессе
декарбоксилирования
аминокислот
синтезируются нейромедиаторы ( серотонин, дофамин,
ГАМК),
гормоны
(норадреналин,
адреналин),
регуляторные
факторы
местного
действия
(гистамин).
23.
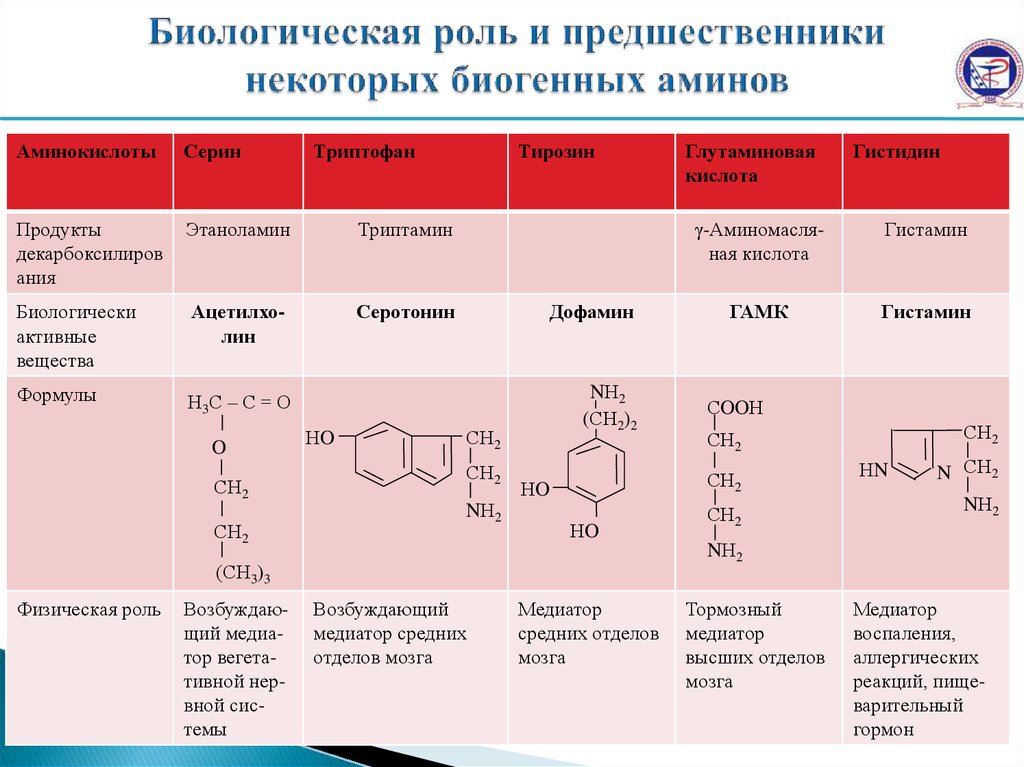
АминокислотыСерин
Продукты
декарбоксилиров
ания
Этаноламин
Триптамин
Биологически
активные
вещества
Ацетилхолин
Серотонин
Формулы
Н3С – С = О
O
СН2
СН2
Триптофан
НO
Тирозин
Дофамин
NН2
(СН2)2
СН2
СН2
NН2
НO
НO
Возбуждающий медиатор вегетативной нервной системы
Гистидин
γ-Аминомасляная кислота
Гистамин
ГАМК
Гистамин
СOOН
СН2
СН2
СН2
СН2
НN
N СН2
NН2
NН2
(СН3)3
Физическая роль
Глутаминовая
кислота
Возбуждающий
медиатор средних
отделов мозга
Медиатор
средних отделов
мозга
Тормозный
медиатор
высших отделов
мозга
Медиатор
воспаления,
аллергических
реакций, пищеварительный
гормон
24. Непрямое неокислительное дезаминирование (для мышечной ткани и мозга)
Обезвреживаниеаммиака в тканях
25. Реакция трансаминирования аминокислот
Источники и способы обезвреживания аммиака в разных тканяхБиогенные амины
Аминокислоты
Нуклеотиды
Гниение белков
Аммиак
Синтез
мочевины
(~25 г\сут)
Печень
Образование
Синтез
аланина
глутаминаамидирование Образование
аммонийных солей
Мышцы,
Мышцы,
(~ 0,5г\сут)
кишечник
мозг и
другие
Почки
ткани
Образование
глутамата –
восстановительное аминирование
Мозг
26.
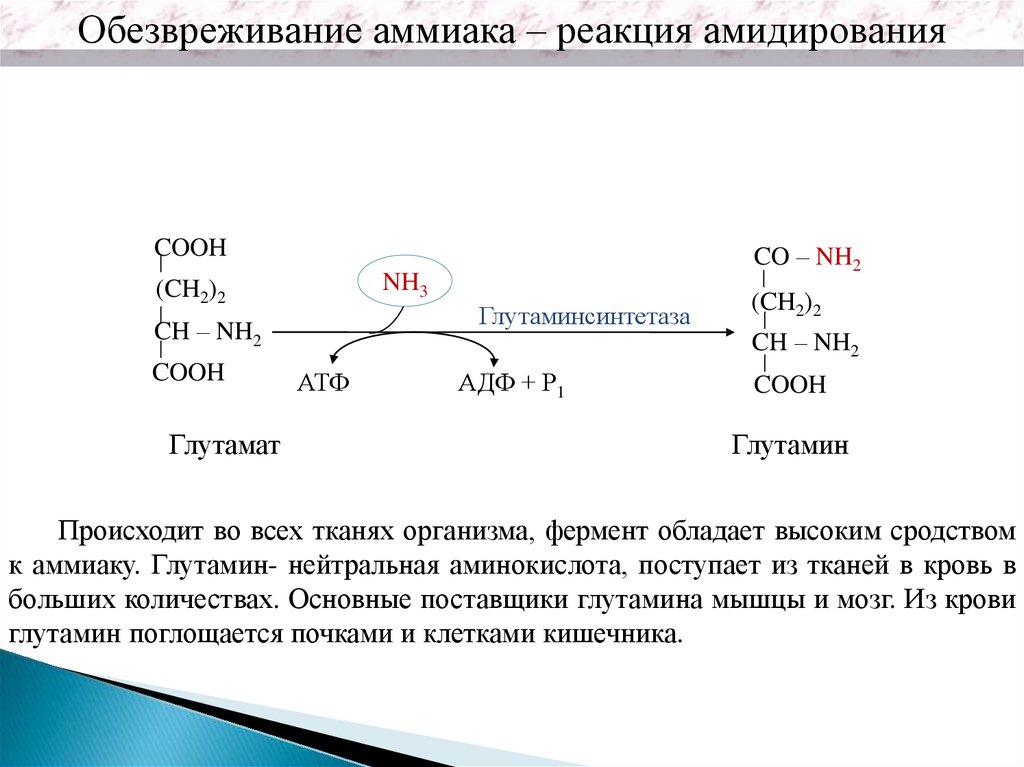
Обезвреживание аммиака – реакция амидированияCOOH
NH3
(CH2)2
Глутаминсинтетаза
CH – NH2
COOH
Глутамат
CO – NH2
АТФ
АДФ + Р1
(CH2)2
CH – NH2
COOH
Глутамин
Происходит во всех тканях организма, фермент обладает высоким сродством
к аммиаку. Глутамин- нейтральная аминокислота, поступает из тканей в кровь в
больших количествах. Основные поставщики глутамина мышцы и мозг. Из крови
глутамин поглощается почками и клетками кишечника.
27.
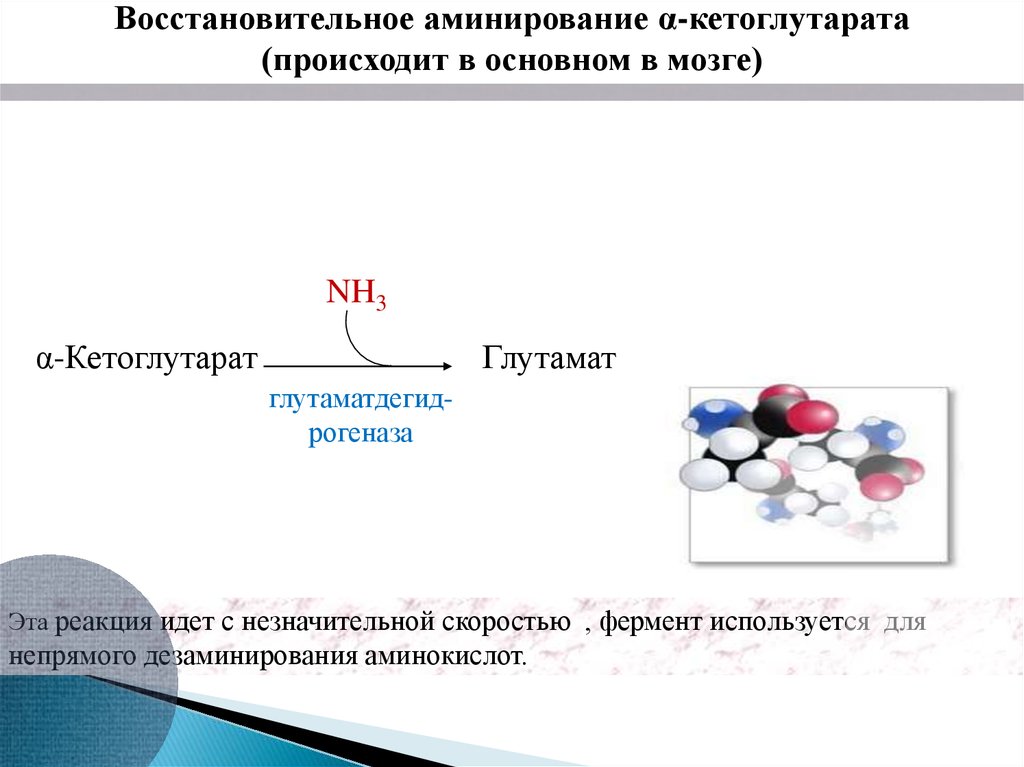
Восстановительное аминирование α-кетоглутарата(происходит в основном в мозге)
NH3
α-Кетоглутарат
Глутамат
глутаматдегидрогеназа
Эта реакция идет с незначительной скоростью , фермент используется для
непрямого дезаминирования аминокислот.
28. Биологическая роль и предшественники некоторых биогенных аминов
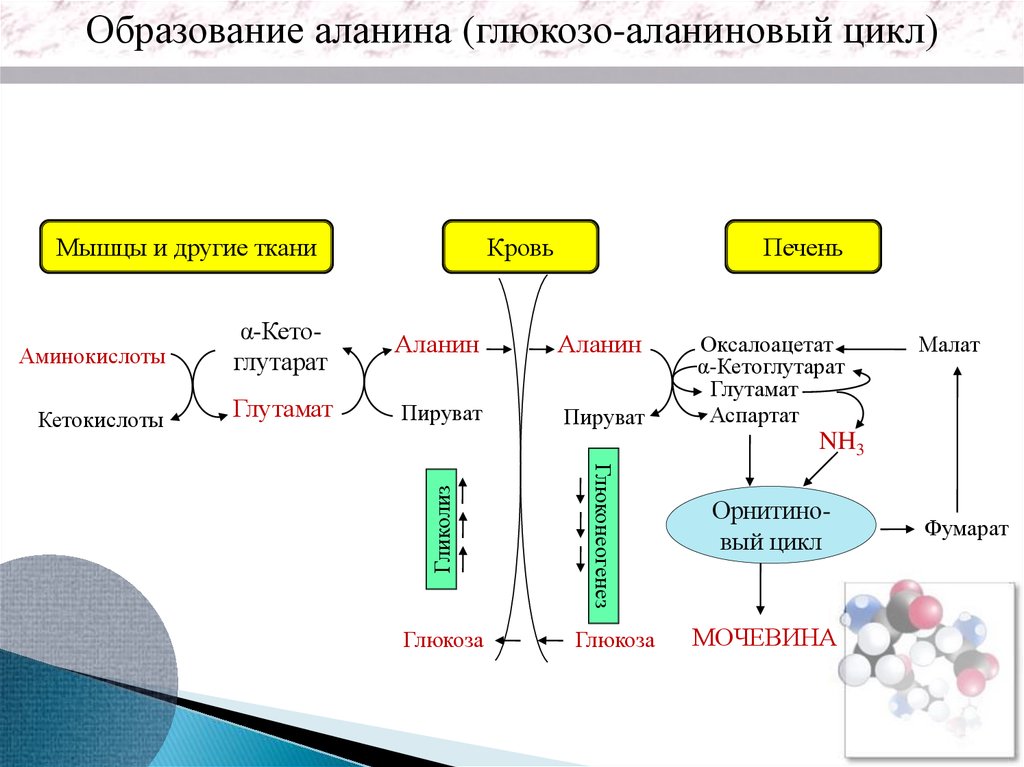
Образование аланина (глюкозо-аланиновый цикл)Мышцы и другие ткани
Кровь
Печень
Аминокислоты
α-Кетоглутарат
Аланин
Аланин
Кетокислоты
Глутамат
Пируват
Пируват
Оксалоацетат
α-Кетоглутарат
Глутамат
Аспартат
Малат
Глюкоза
Глюконеогенез
Гликолиз
NH3
Глюкоза
Орнитиновый цикл
МОЧЕВИНА
Фумарат
29.
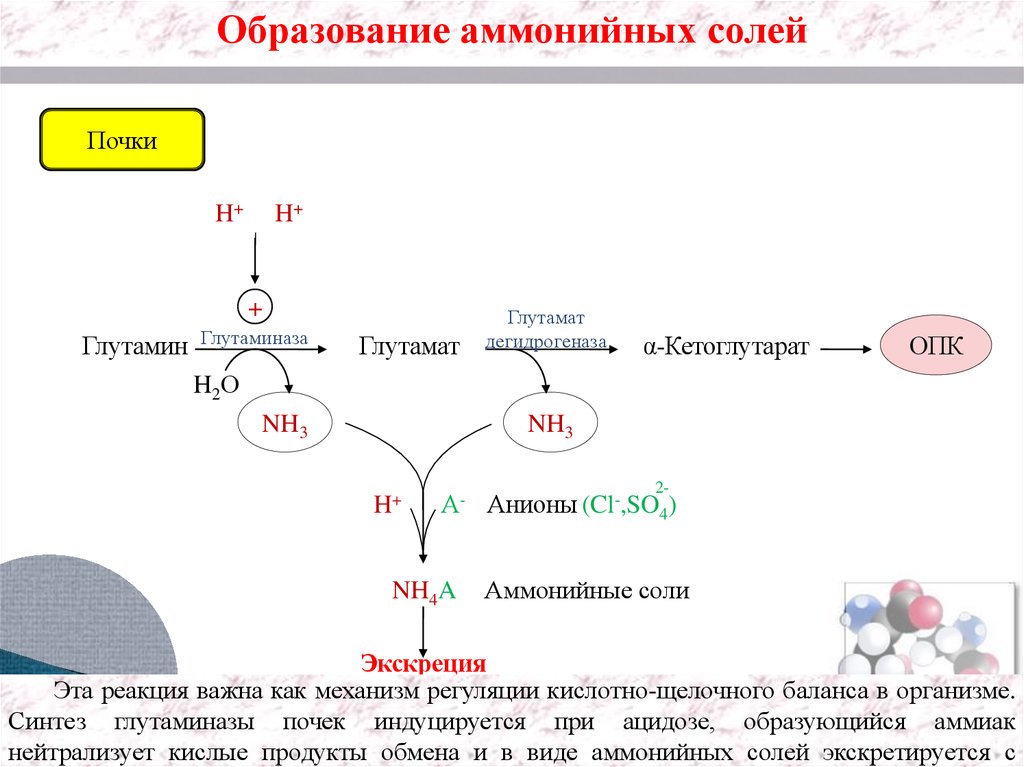
Образование аммонийных солейПочки
H+
H+
+
Глутамин
Глутаминаза
Глутамат
Глутамат
дегидрогеназа
α-Кетоглутарат
ОПК
H2О
NH3
NH3
H+
А-
NH4A
2Анионы (Cl ,SO4)
Аммонийные соли
Экскреция
Эта реакция важна как механизм регуляции кислотно-щелочного баланса в организме.
Синтез глутаминазы почек индуцируется при ацидозе, образующийся аммиак
нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с
30.
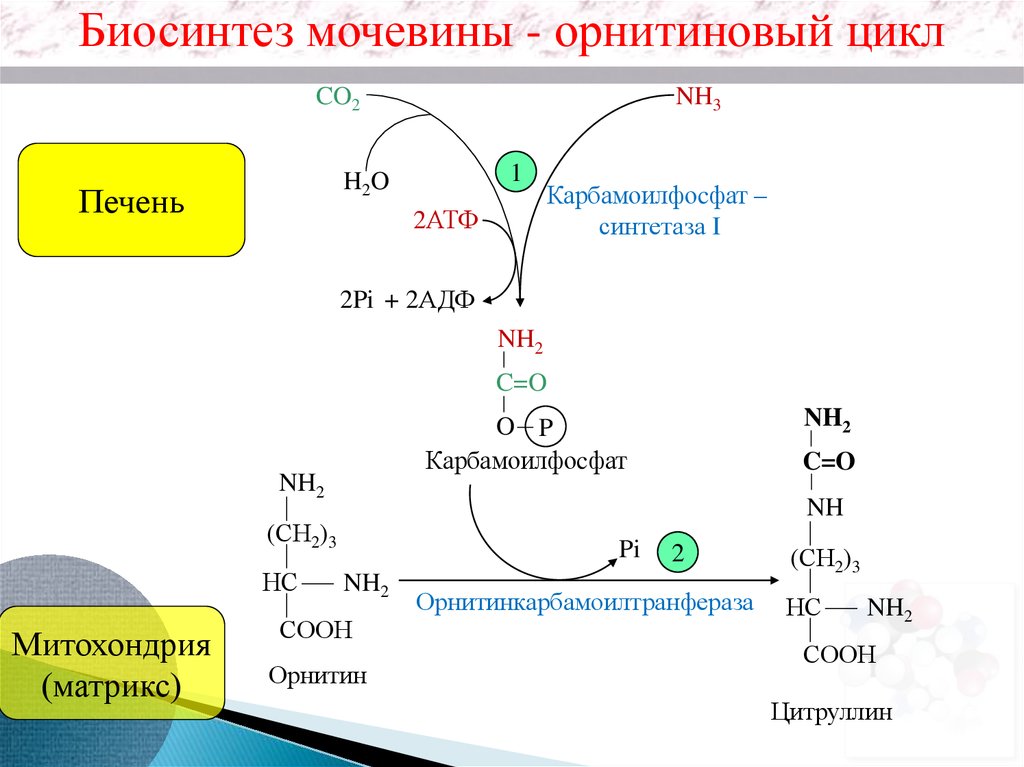
Биосинтез мочевины - орнитиновый циклCO2
NH3
1
H2O
Печень
2АТФ
Карбамоилфоcфат –
синтетаза I
2Pi + 2АДФ
NH2
C=O
NH2
Митохондрия
(матрикс)
C=O
NH
(СН2)3
НС
NH2
O P
Карбамоилфоcфат
Pi
NH2
СООН
Орнитин
2
Орнитинкарбамоилтранфераза
(СН2)3
НС
NH2
СООН
Цитруллин
31.
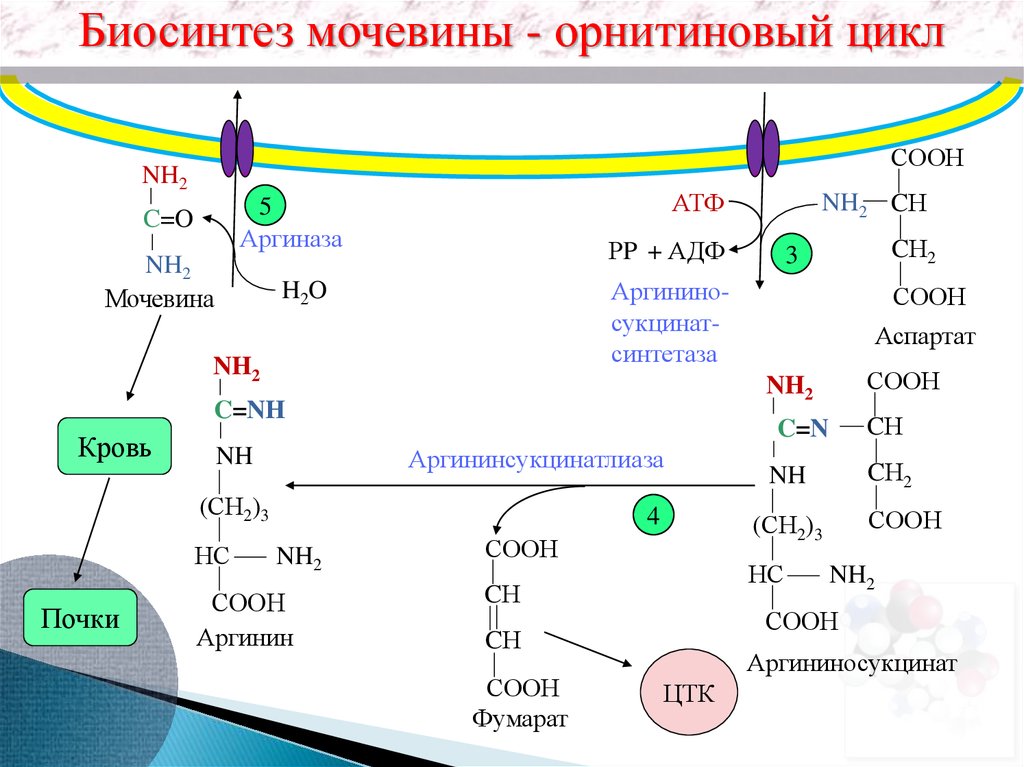
Биосинтез мочевины - орнитиновый циклСООН
NH2
АТФ
5
Аргиназа
C=O
NH2
Мочевина
РP + АДФ
Аргининсукцинатлиаза
Почки
4
NH2
СООН
Аргинин
Аспартат
СООН
CН
C=N
(СН2)3
НС
СООН
NH2
C=NH
NH
CН2
3
Аргининосукцинатсинтетаза
H2O
NH2
Кровь
NH2 CН
СООН
(СН2)3
СООН
НС
CН
NH2
СООН
CН
СООН
Фумарат
CН2
NH
Аргининосукцинат
ЦТК
32.
ГипераммониемияЗаболевания печени (гепатит, цирроз) или
наследственный дефект ферментов обезвреживания
аммиака могут вызвать повышение содержания
аммиака в крови – гипераммониемию
Известно 5 наследственных заболеваний, обусловленных дефектом 5 ферментов орнитинового
цикла:
Гипераммониемия I и II типа
Цитруллинемия
Аргиносукцинатурия
Гипераргининемия
33.
ГипераммониемияПри увеличении концентрации аммиака в 8 – 10 раз
(до 0,6 ммоль/л) проявляется его токсическое действие.
Наблюдаются:
Головокружение;
Тошнота;
Рвота;
Судорожные припадки с потерей сознания.
Наследственные формы гипераммониемии приводят
к отставанию в умственном развитии детей
34.
Токсичность аммиакаОбразование большого количества NH4+ может
привести к сдвигу рН крови в щелочную сторону
(алкалозу). Алкалоз отрицательно сказывается на
транспорте О2 в ткани гемоглобином, в результате чего
возникают гипоксические явления и низкоэнергетическое состояние в клетках, прежде всего головного
мозга.
Высокое
содержание NH3 в тканях снижает
количество α-кетоглутарата, так как он связывает
избыток аммиака и превращается в глутамат. Это
вызывает угнетение обмена аминокислот (трансаминирования) и ЦТК (гипоэнергетическое состояние)
35.
Токсичность аммиакаГипераммониемия усиливает синтез глутамина из
глутамата в нервной ткани. Содержание глутамата
снижается, что приводит к подавлению синтеза
основного тормозного медиатора γ-аминомасляной
кислоты (ГАМК) под действием глутаматдекарбоксилазы:
Глутамат
ГАМК + СО2
В результате происходит повышение нервномышечной возбудимости и возникают судороги.
36.
Токсичность аммиакаСудорожные припадки могут быть также следствием подавления работы Na+, K+-АТФаз, нарушения
трансмембранного переноса ионов Na+ и K+ и проведения нервных импульсов.
Для снижения концентрации NH3 в крови и
облегчения состояния больных рекомендуется малобелковая диета и введение метаболитов орнитинового цикла (аргинин, цитруллин, глутамат).
37.
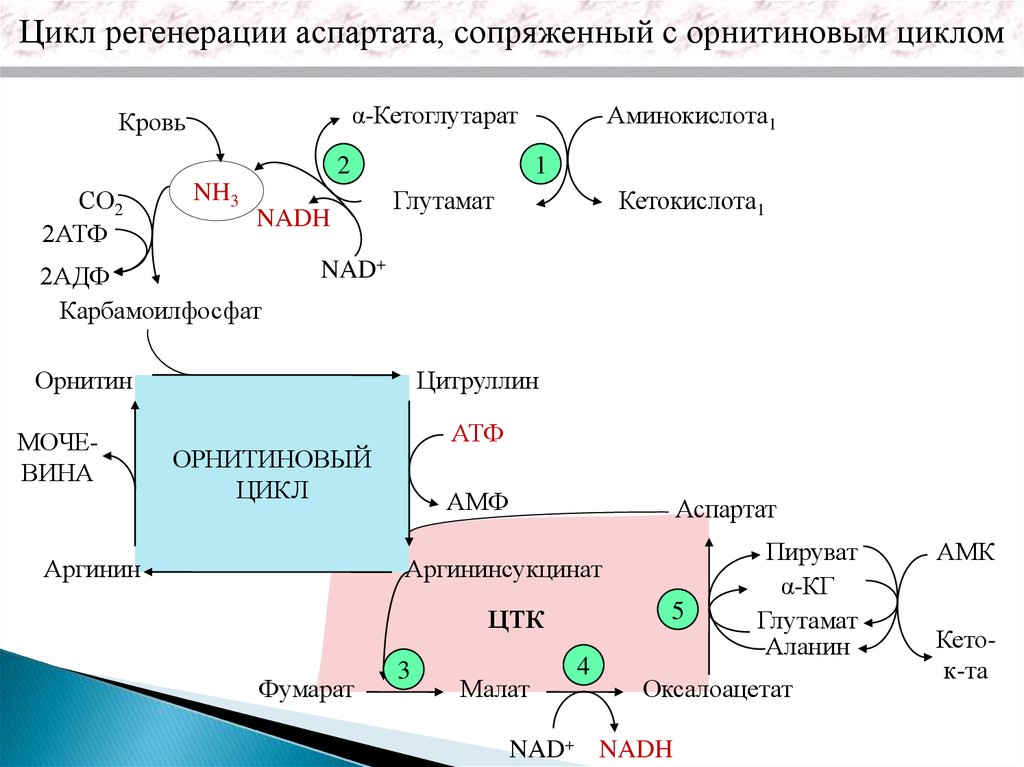
Цикл регенерации аспартата, сопряженный с орнитиновым цикломα-Кетоглутарат
Кровь
2
СО2
2АТФ
NH3
NADH
2АДФ
Карбамоилфосфат
1
Глутамат
Кетокислота1
NAD+
Орнитин
МОЧЕВИНА
Аминокислота1
Цитруллин
АТФ
ОРНИТИНОВЫЙ
ЦИКЛ
Аргинин
АМФ
Аспартат
Аргининсукцинат
5
ЦТК
Фумарат
3
Малат
4
Пируват
α-КГ
Глутамат
Аланин
Оксалоацетат
NAD+ NADH
АМК
Кеток-та
38.
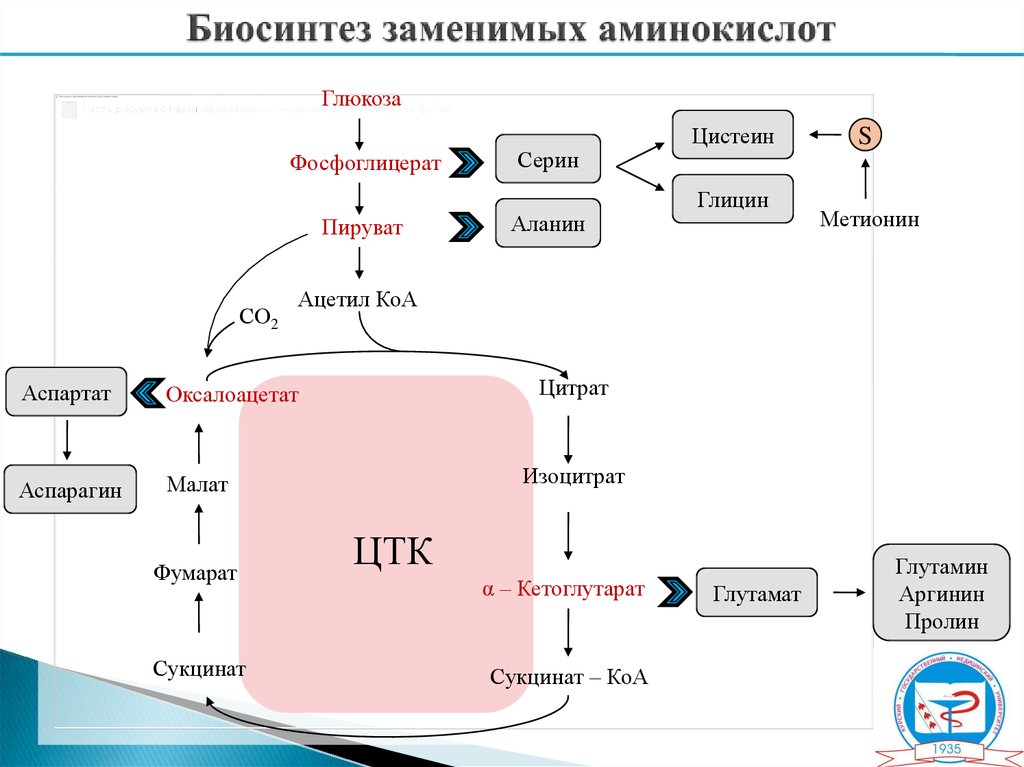
ГлюкозаФосфоглицерат
Пируват
СО2
Оксалоацетат
Аспарагин
Малат
Сукцинат
Аланин
Глицин
S
Метионин
Ацетил КоА
Аспартат
Фумарат
Серин
Цистеин
Цитрат
Изоцитрат
ЦТК
α – Кетоглутарат
Сукцинат – КоА
Глутамат
Глутамин
Аргинин
Пролин




















 Биология
Биология Химия
Химия








