Похожие презентации:
Микробиология. Метод Циля — Нельсена
1. Федеральное государственное бюджетное профессиональное образовательное учреждение «Санкт-Петербургский медико-технический
Федеральное государственное бюджетноепрофессиональное образовательное учреждение
«Санкт-Петербургский
медико-технический колледж
Федерального медико-биологического агентства»
Микробиология
Метод Циля — Нельсена
Ф-124
Чубей Ольга
2016 г
2. Метод Циля — Нельсена
— метод окраски микроорганизмов для выявлениякислотоустойчивых микобактерий
(возбудителей туберкулёза, микобактериозов, лепры), актиномице
тов и других кислотоустойчивых микроорганизмов.
Метод назван именами немецких медиков —
микробиолога Франца Циля и патологоанатома Фридриха
Нельсена, которые разработали его в 1882—1883 гг.
3. Фри́дрих Не́льсен
Фри́дрихКарл
Адо́льф
Не́льсен ( 29 марта 1854, — 11
апреля 1898) — немецкий патолог.
Изучал медицину в Лейпцигском
университете, где спустя 22 года
получил
докторскую
степень.
Позже
Ф.
Нельсен
стал
профессором
института
патологии Ростокского университет
а. В 1883 году совместно
с Францем Цилем разработал метод
окраски
кислотоустойчивых
бактерий, широко применяемый в
диагностике туберкулёза.
Умер от туберкулёза гортани[1].
4. Франц Циль
( 1857 — 1926) — немецкий бактериолог,профессор в Любеке. Продолжая работы Пауля Эрлиха, Франц
Циль создал в 1882 году карболфуксиновый краситель для
окрашивания возбудителя туберкулёза. В 1883 году совместно с
патологом Фридрихом
5. Принцип
Кислотоустойчивость микроорганизмов обусловлена наличием в ихклетках липидов, воска и оксикислот. Такие микроорганизмы плохо
окрашиваются разведёнными растворами красителей. Для
облегчения проникновения красителя в клетки микроорганизмов
нанесённый на препарат карболовый фуксин Циля подогревают над
пламенем
горелки.
Окрашенные
микроорганизмы
не
обесцвечиваются слабыми растворами минеральных кислот и
спирта.
АНАЛИЗИРУЕМЫЕ ОБРАЗЦЫ
Моча, мокрота, спинномозговая жидкость, серозные жидкости
полостей.
6. Приготовление растворов
•Раствор 1. Насыщенный спиртовой раствор фуксина:растереть в ступке 0,3 г основного фуксина с 2 — 3 каплями глицерина,
добавить по каплям 10 мл 96- этилового спирта.
•Раствор 2. Рабочий раствор фенола (5 % водный раствор):
расплавить 5 г кристаллического фенола путём легкого подогревания на
водяной бане. Добавить слегка подогретую дистиллированную воду до
объема 100 мл.
•Раствор 3. Рабочий раствор карболового фуксина:
в 90 мл полученного раствора фенола (2) добавить 10 мл насыщенного
раствора фуксина.
•Раствор 4. Обесцвечивающие растворы:
а) Раствор серной кислоты
К 75 мл дистиллированной воды осторожно долить 25 мл
концентрированной серной кислоты, постепенно наслаивая её по стенкам
сосуда. Смешать. Содержимое нагреется.
б) Раствор солянокислого спирта
Вместо раствора серной кислоты для обесцвечивания можно
использовать 3% солянокислый спирт: Этиловый спирт 96- 97 мл
Концентрированная соляная кислота 3 мл. К 97 мл спирта осторожно
добавляют 3 мл концентрированной соляной кислоты.
•Раствор 5. Рабочий раствор метиленового синего:
растворить 0,3 г хлорида метиленового синего в 100 мл дистиллированной
воды.
7. Методы окраски
1. На фиксированный мазокнакладывают белую фильтровальную
бумагу и наливают карболовый
фуксин Циля. Препарат 2-3 раза
подогревают в в пламени до появления
паров.
Карболовый фуксин-основная краска;
прогревание-протрава.
2. Препарат промывают водой, бумагу
сбрасывают.
3. Препарат обесцвечивают в 5%
растворе серной кислоты.
Серная кислота-обесцвечивающий
фактор.
4. Промывают водой
5. Докрашивают синькой Леффлера 35 минут
Синька Леффлера — дополнительная
краска
6. Промывают водой, высушивают,
смотрят под иммерсией
Кислотоустойчивые бактерии и споры
рубиново- красного цвета, а остальная
микрофлора — синего цвета
8.
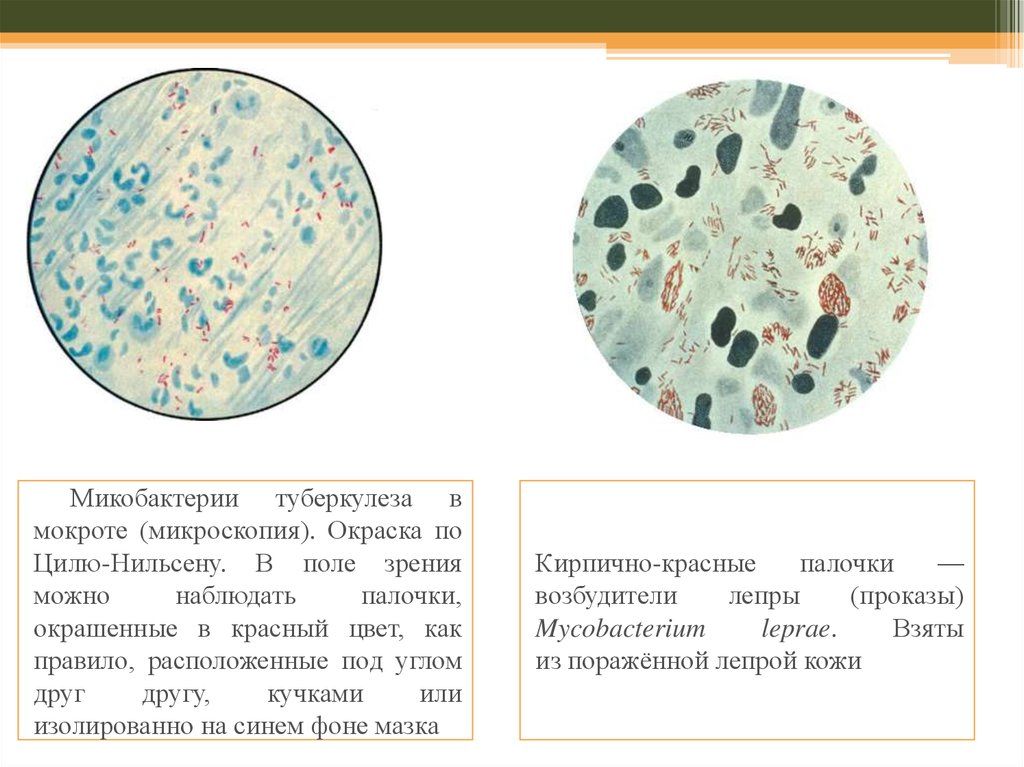
Микобактерии туберкулеза вмокроте (микроскопия). Окраска по
Цилю-Нильсену. В поле зрения
можно
наблюдать
палочки,
окрашенные в красный цвет, как
правило, расположенные под углом
друг
другу,
кучками
или
изолированно на синем фоне мазка
Кирпично-красные
палочки
—
возбудители
лепры
(проказы)
Mycobacterium
leprae.
Взяты
из поражённой лепрой кожи
9. Порядок проведения микроскопического исследования
При микроскопическом исследовании мазка, окрашенного по Циль-Нильсену, следуетпросматривать не менее 100 полей зрения, чтобы дать количественную оценку
препарату и обнаружить единичные микобактерии. В том случае, если результат
такого исследования оказывается отрицательным, для подтверждения просматривают
дополнительно 200 полей зрения. При значительном количестве кислотоустойчивых
микобактерий достаточно исследовать 20 — 50 полей зрения как при окраске по
Циль-Нильсену, так и при люминесцентной микроскопии (см. таблицу). При
микроскопическом исследовании препарата необходимо быть уверенным, что ни одно
поле зрения препарата не просматривается повторно, поэтому рекомендуется
просматривать препарат всегда по одной и той же схеме:
либо 3 параллельных прохода по длине препарата;
либо 9 параллельных проходов по ширине.
Просматривать препарат начинают с левого верхнего выбранного в мазке поля зрения,
постепенно передвигаясь либо вдоль продольной оси препарата до конца мазка, либо
смещаясь вниз и затем вновь поднимаясь вверх и т. д., проходя все поля зрения до
границы мазка. При увеличении микроскопа 1000x, то есть 100x для масляноиммерсионного объектива и 10x для окуляра, при исследовании одной длины мазка (~
20 мм) за один продольный проход просматривается около 100—120 полей зрения
(диаметр поля зрения — 0,16 — 0,2 мм).
10.
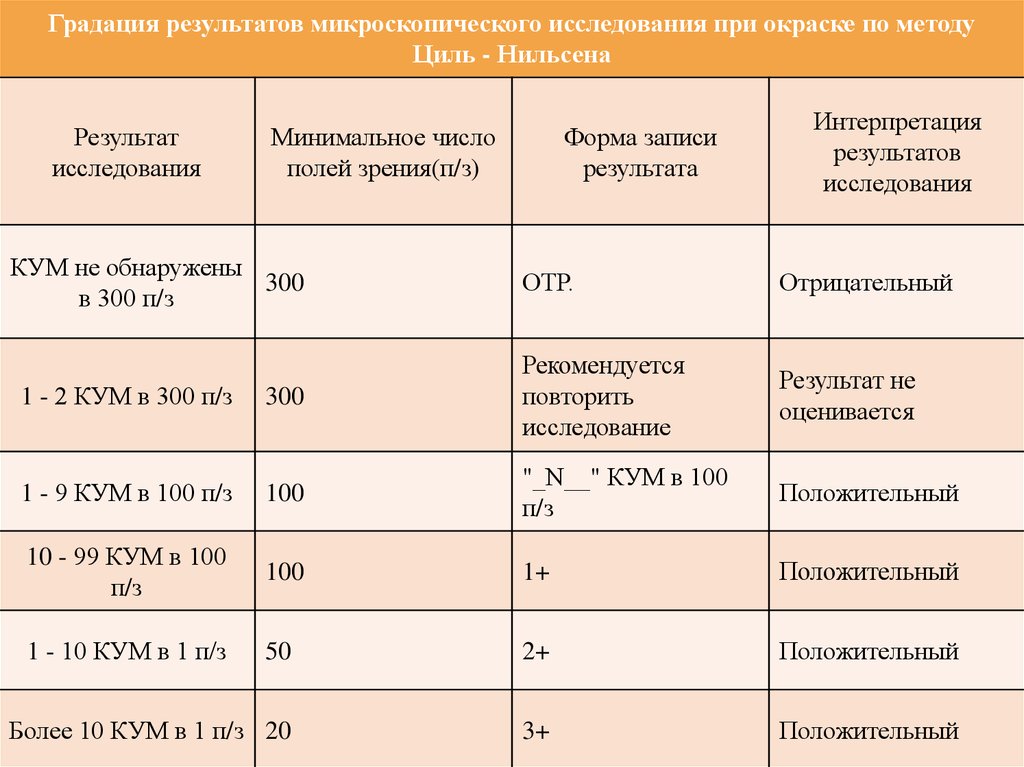
Градация результатов микроскопического исследования при окраске по методуЦиль - Нильсена
Результат
исследования
Минимальное число
полей зрения(п/з)
КУМ не обнаружены
300
в 300 п/з
Форма записи
результата
Интерпретация
результатов
исследования
ОТР.
Отрицательный
Результат не
оценивается
1 - 2 КУМ в 300 п/з
300
Рекомендуется
повторить
исследование
1 - 9 КУМ в 100 п/з
100
"_N__" КУМ в 100
п/з
Положительный
10 - 99 КУМ в 100
п/з
100
1+
Положительный
1 - 10 КУМ в 1 п/з
50
2+
Положительный
Более 10 КУМ в 1 п/з 20
3+
Положительный
11.
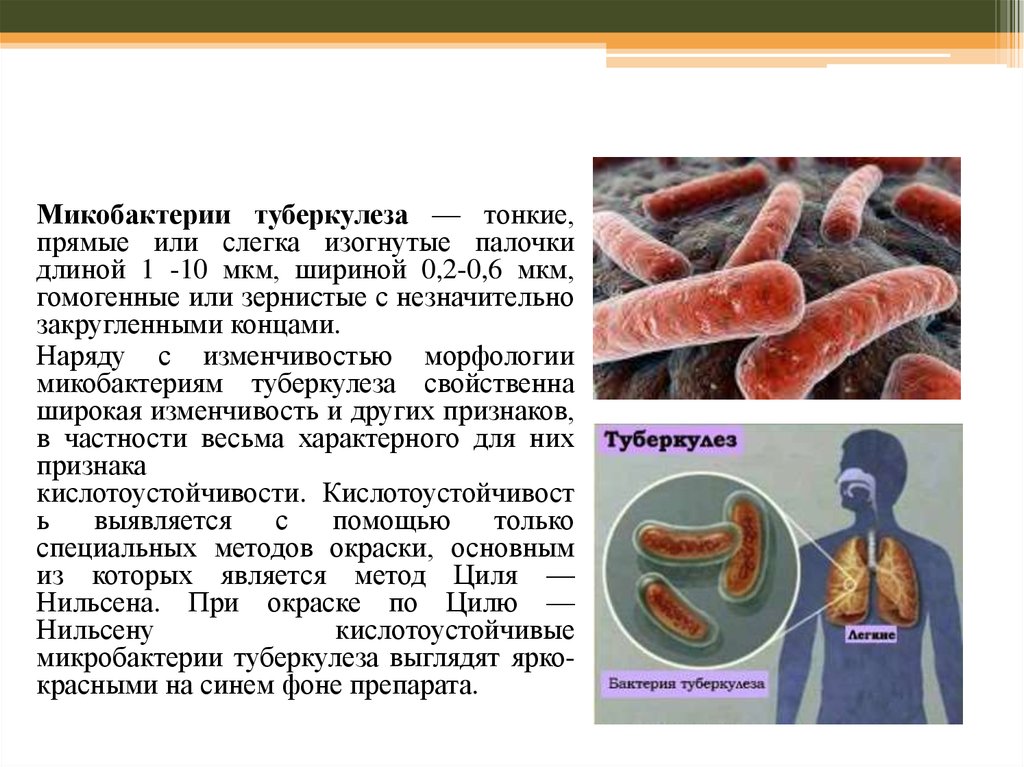
Микобактерии туберкулеза — тонкие,прямые или слегка изогнутые палочки
длиной 1 -10 мкм, шириной 0,2-0,6 мкм,
гомогенные или зернистые с незначительно
закругленными концами.
Наряду с изменчивостью морфологии
микобактериям туберкулеза свойственна
широкая изменчивость и других признаков,
в частности весьма характерного для них
признака
кислотоустойчивости. Кислотоустойчивост
ь
выявляется
с
помощью
только
специальных методов окраски, основным
из которых является метод Циля —
Нильсена. При окраске по Цилю —
Нильсену
кислотоустойчивые
микробактерии туберкулеза выглядят яркокрасными на синем фоне препарата.








 Медицина
Медицина