Похожие презентации:
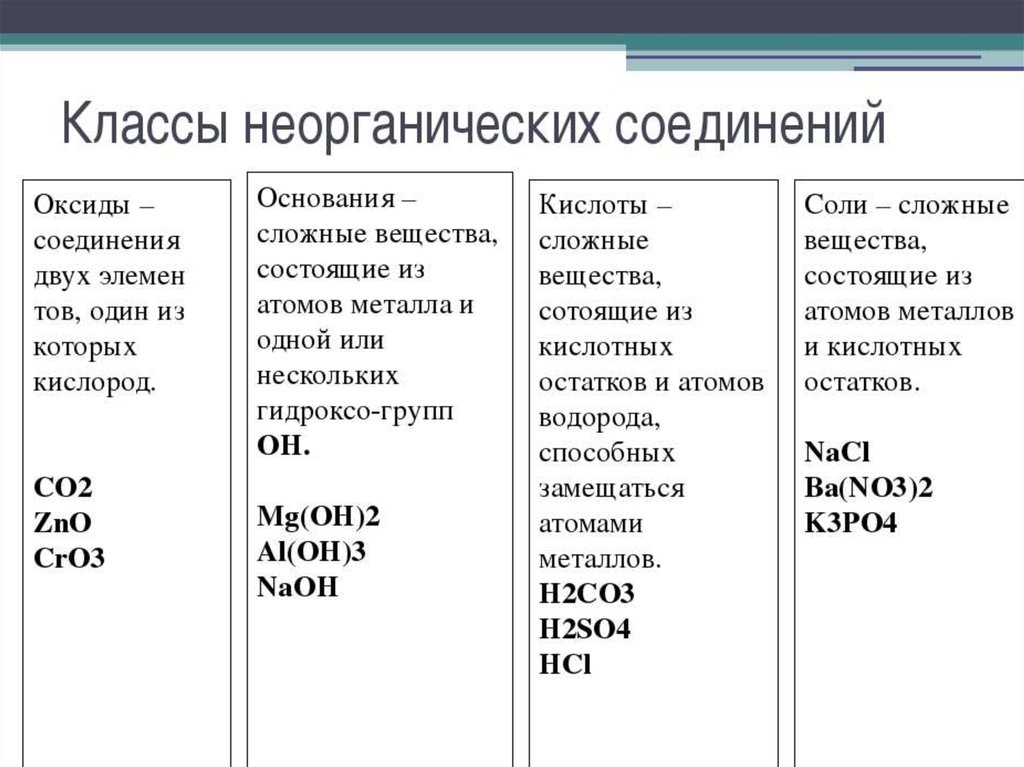
Основные классы неорганических соединений
1.
«ОСНОВНЫЕ КЛАССЫНЕОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ»
2.
ОКСИДЫОСНОВАНИЯ
СОЛИ
КИСЛОТЫ
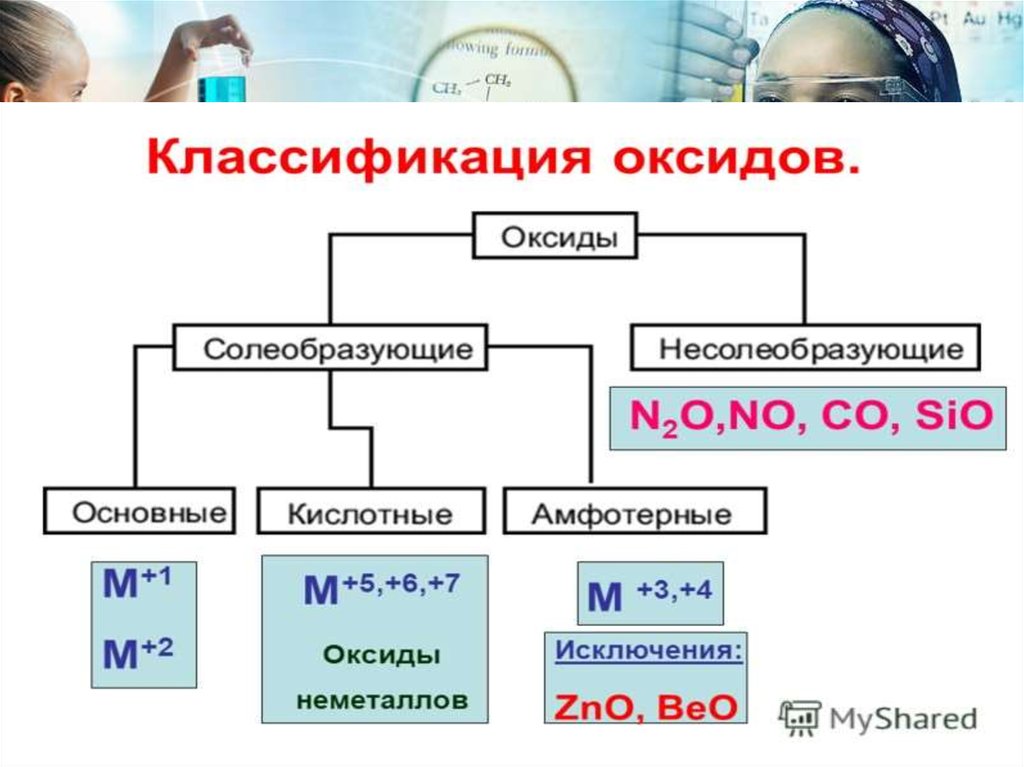
3.
4.
5. Классификация оснований
ОСНОВАНИЯОдноосновные
NaОН, LiОН,
NН4ОН
Двухосновные
Са(ОН)2
Растворимые, или
Амфотерные
Al(OH)3, Fe(OH)3
Трехосновные
Fe(ОН)3
щелочи
LiОН, NаОН, Са(ОН)2
Малорастворимые
Fe(ОН)2, Сu(ОН)2
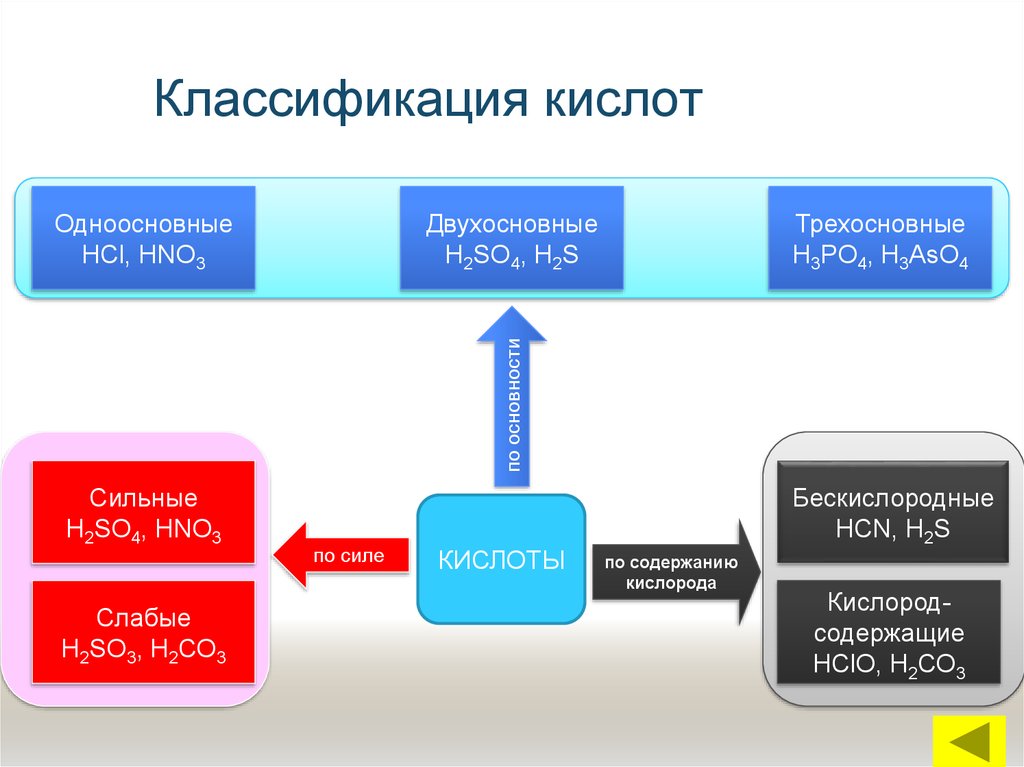
6. Классификация кислот
ДвухосновныеН2SO4, Н2S
Трехосновные
Н3РО4, Н3АsО4
по основности
Одноосновные
НСl, НNО3
Сильные
Н2SO4, НNО3
Слабые
Н2SО3, Н2СО3
по силе
КИСЛОТЫ
Бескислородные
НСN, Н2S
по содержанию
кислорода
Кислородсодержащие
НСlО, Н2СО3
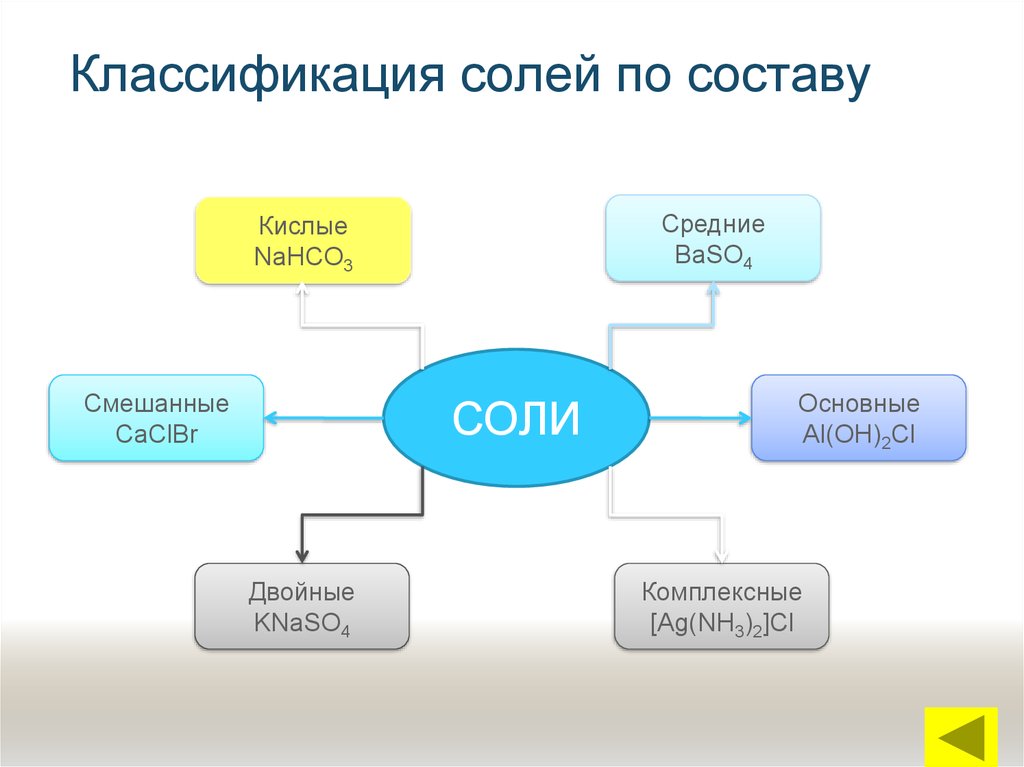
7. Классификация солей по составу
СредниеBaSO4
Кислые
NaHCO3
Смешанные
CaClBr
СОЛИ
Двойные
KNaSO4
Основные
Al(OH)2Cl
Комплексные
[Ag(NH3)2]Cl
8.
9.
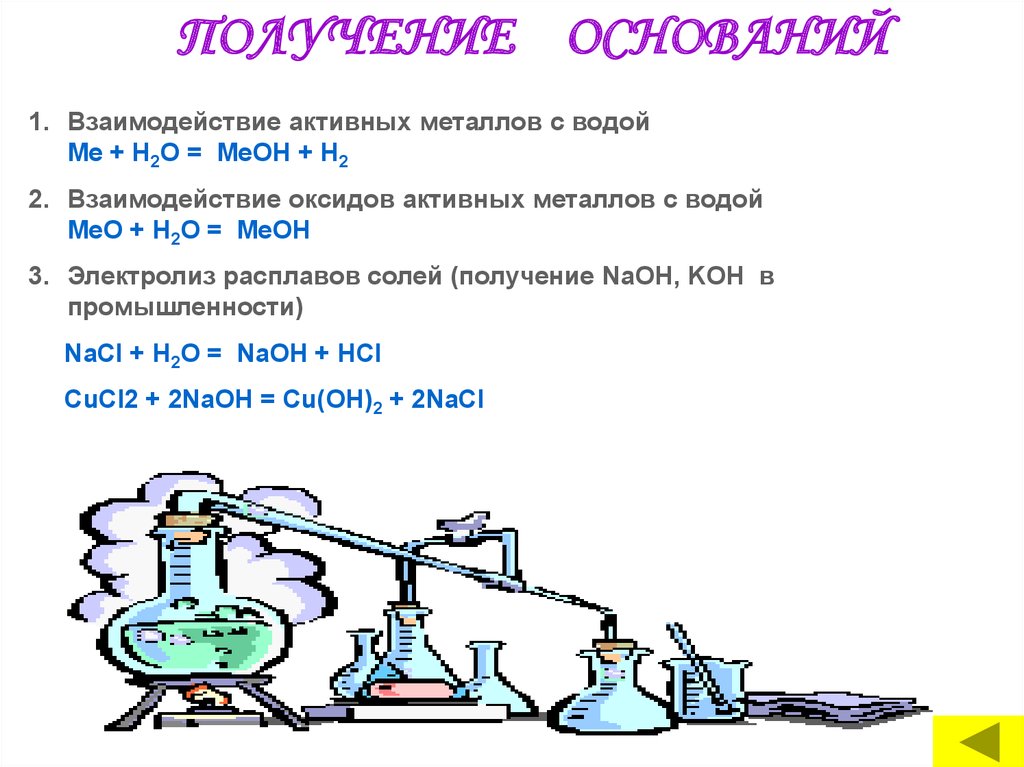
ПОЛУЧЕНИЕ ОСНОВАНИЙ1. Взаимодействие активных металлов с водой
Me + Н2O = МеОН + Н2
2. Взаимодействие оксидов активных металлов с водой
MeО + Н2O = МеОН
3. Электролиз расплавов солей (получение NaOH, KOH в
промышленности)
NaCl + H2O = NaОН + HСl
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
10.
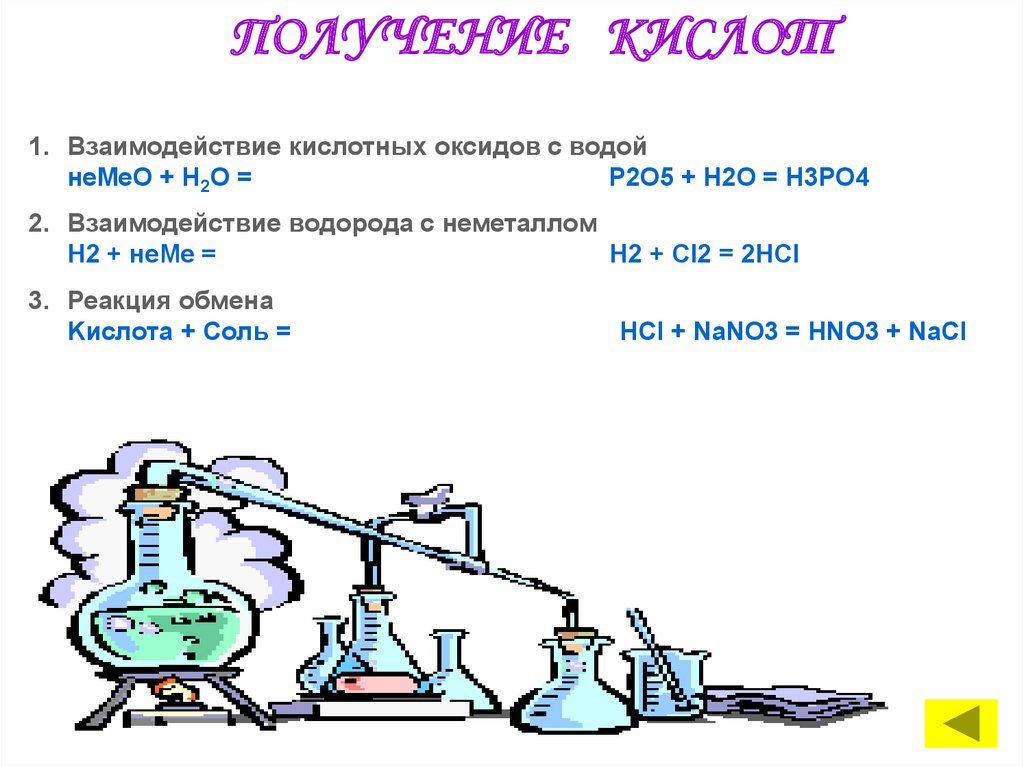
ПОЛУЧЕНИЕ КИСЛОТ1. Взаимодействие кислотных оксидов с водой
неMeО + Н2O =
P2O5 + H2O = H3PO4
2. Взаимодействие водорода с неметаллом
Н2 + неМе =
Н2 + Сl2 = 2HCl
3. Реакция обмена
Kислота + Cоль =
HCl + NaNO3 = HNO3 + NaCl
11.
ПОЛУЧЕНИЕ СОЛЕЙВзаимодействием:
Металла с неметаллом
Са + Сl2 = СаСl
Основного оксида с кислотным оксидом
Основного оксида с кислотой
СаО + 2НСl = CaCl2 + H2О
Кислотного оксида с основанием
CO2 + Ca(OH)2 = CaCO3 + H2O
Кислоты с основанием (р.нейтрализации)
2HCl + Ca(OH)2 = CaCl2 + 2H2O
Соли с кислотой
NaCl + HNO3 = NaNO3 + HCl
Соли с щелочью
NaCl + KOH = NaOH + KCl
Соли с солью
NaCl + AgNO3 = NaNO3 + AgCl
Металла с солью (см. ряд активности металлов)Na + AgNO3 = NaNO3 + Ag
Металла с кислотой (см. ряд активн. металлов)
СаО + СО2 = СаСО3
Са + 2НСl = CaCl2 + H2
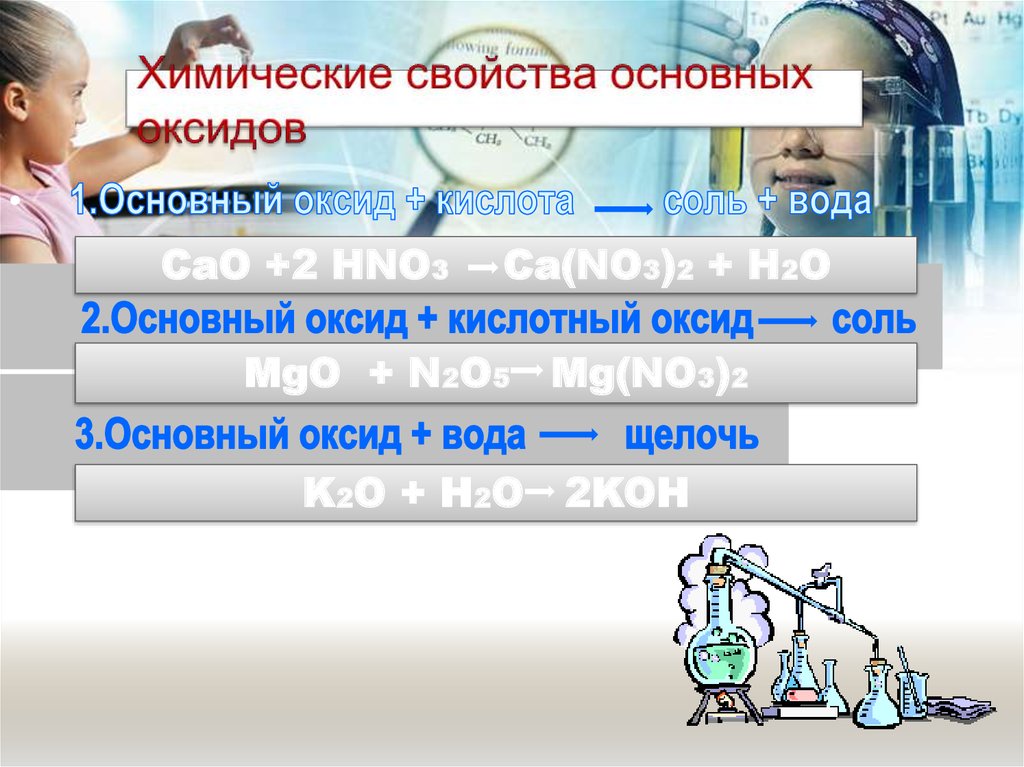
12. Химические свойства основных оксидов
CaO +2 HNO3
Ca(NO3)2 + H2O
MgO + N2O5
K2O + H2O
Mg(NO3)2
2KOH
13. Химические свойства кислотных оксидов
P2O5 + 6LiOH
2 Li3PO4 + 3H2O
SO3 + CaO
CaSO4
SO2 + H2O
H2SO3
14. Химические свойства амфотерных оксидов
• 1.Взаимодействуют с сильными кислотамиZnO + 2HCl
Основный
оксид
Кислот
а
ZnCl2 + H2O
2.Взаимодействуют со щелочами
ZnO +2NaOH
Кислотный
оксид
Na2ZnO2 + H2O
Основание
ZnO + 2NaOH + H2O
Na2 Zn(OH)4
15.
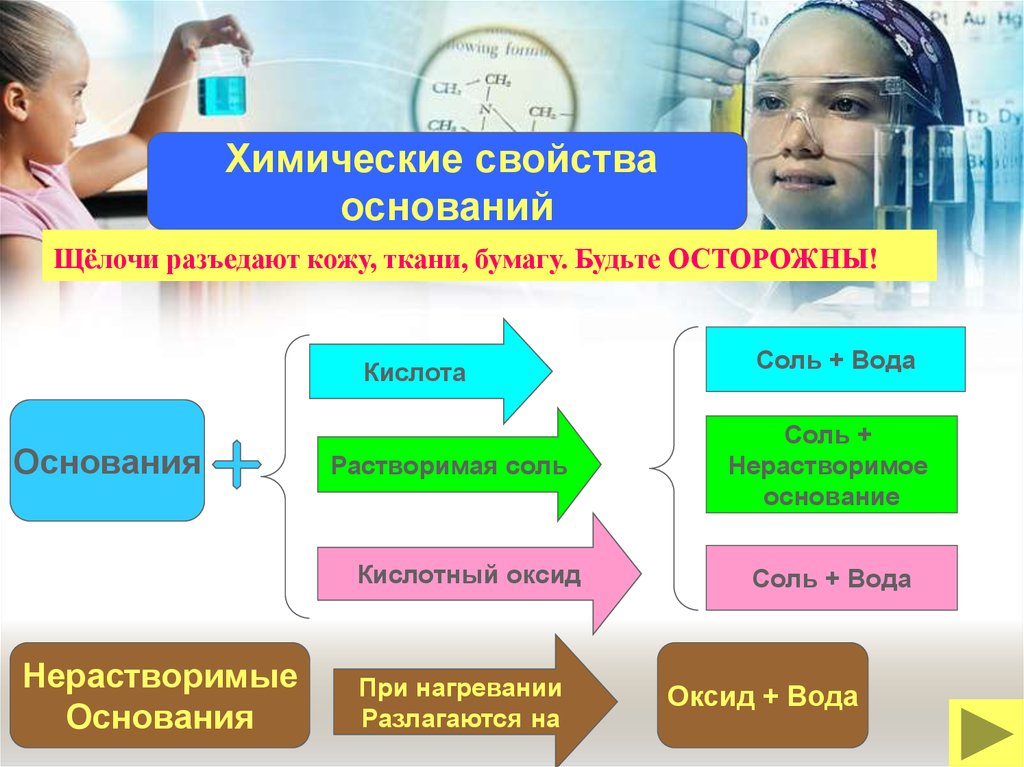
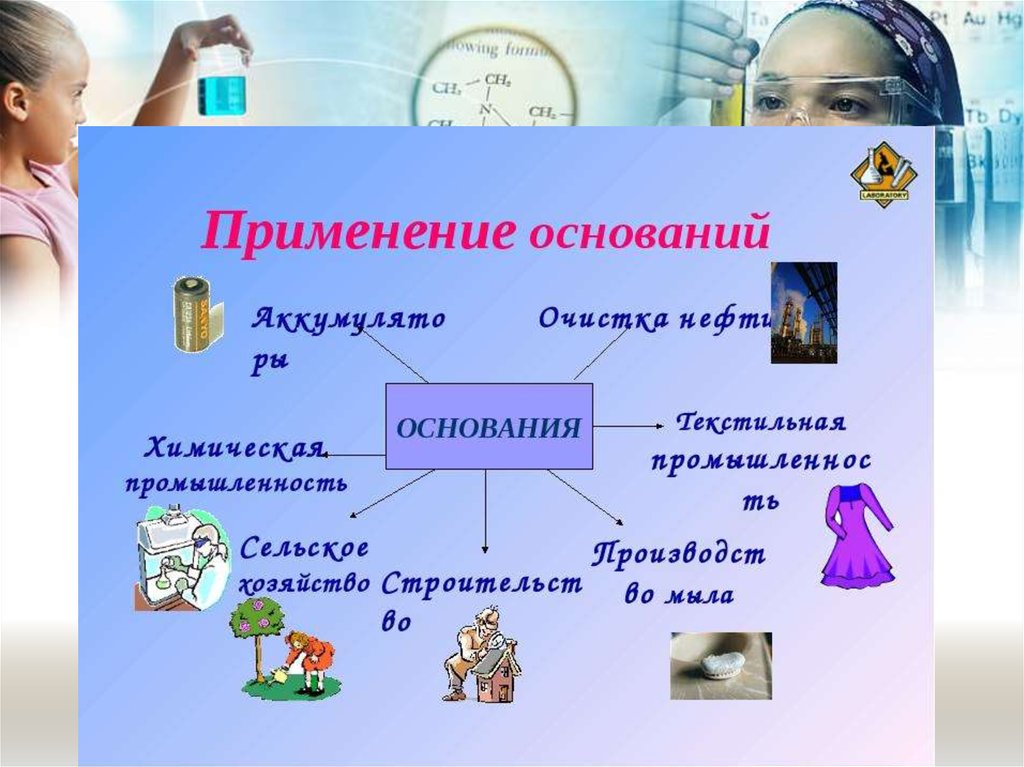
Химические свойстваоснований
Щёлочи разъедают кожу, ткани, бумагу. Будьте ОСТОРОЖНЫ!
Кислота
Основания
Растворимая соль
Кислотный оксид
Нерастворимые
Основания
При нагревании
Разлагаются на
Соль + Вода
Соль +
Нерастворимое
основание
Соль + Вода
Оксид + Вода
16.
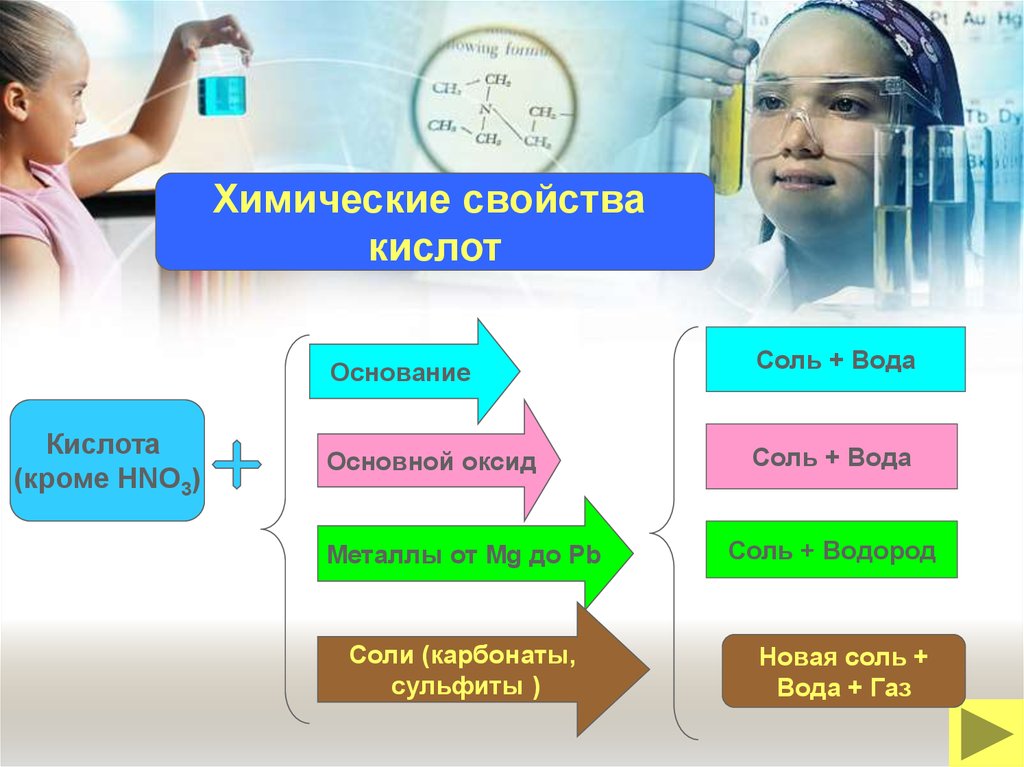
Химические свойствакислот
Кислота
(кроме HNO3)
Основание
Соль + Вода
Основной оксид
Соль + Вода
Металлы от Mg до Pb
Соли (карбонаты,
сульфиты )
Соль + Водород
Новая соль +
Вода + Газ
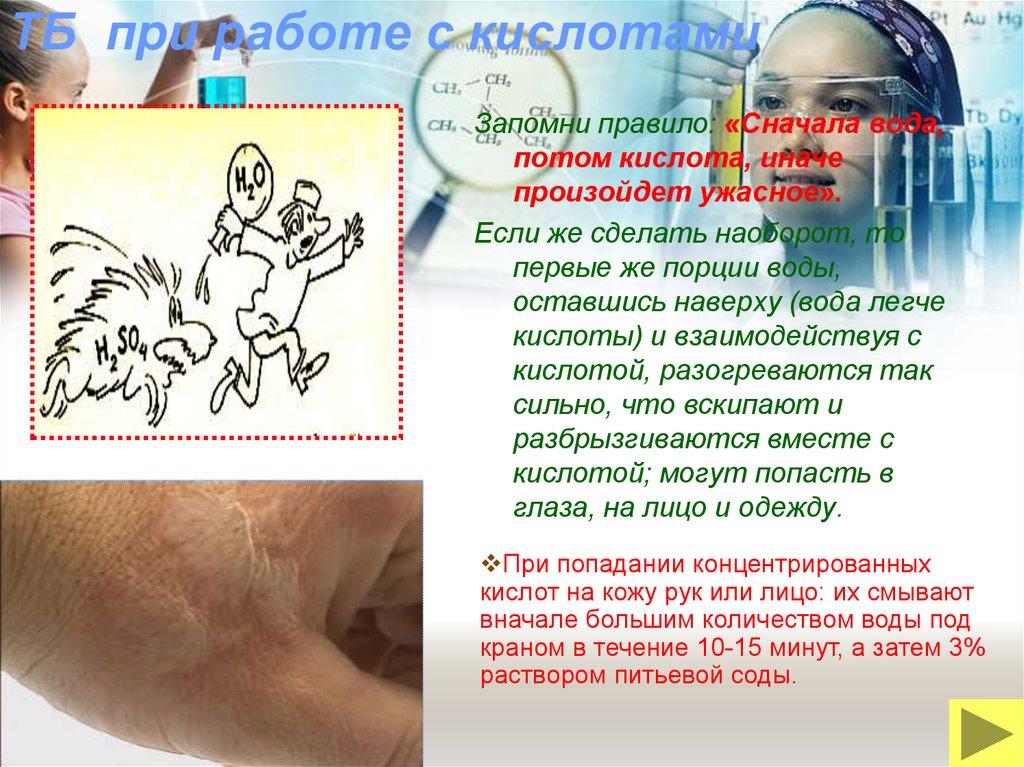
17. ТБ при работе с кислотами
Запомни правило: «Сначала вода,потом кислота, иначе
произойдет ужасное».
Если же сделать наоборот, то
первые же порции воды,
оставшись наверху (вода легче
кислоты) и взаимодействуя с
кислотой, разогреваются так
сильно, что вскипают и
разбрызгиваются вместе с
кислотой; могут попасть в
глаза, на лицо и одежду.
При попадании концентрированных
кислот на кожу рук или лицо: их смывают
вначале большим количеством воды под
краном в течение 10-15 минут, а затем 3%
раствором питьевой соды.
18.
19.
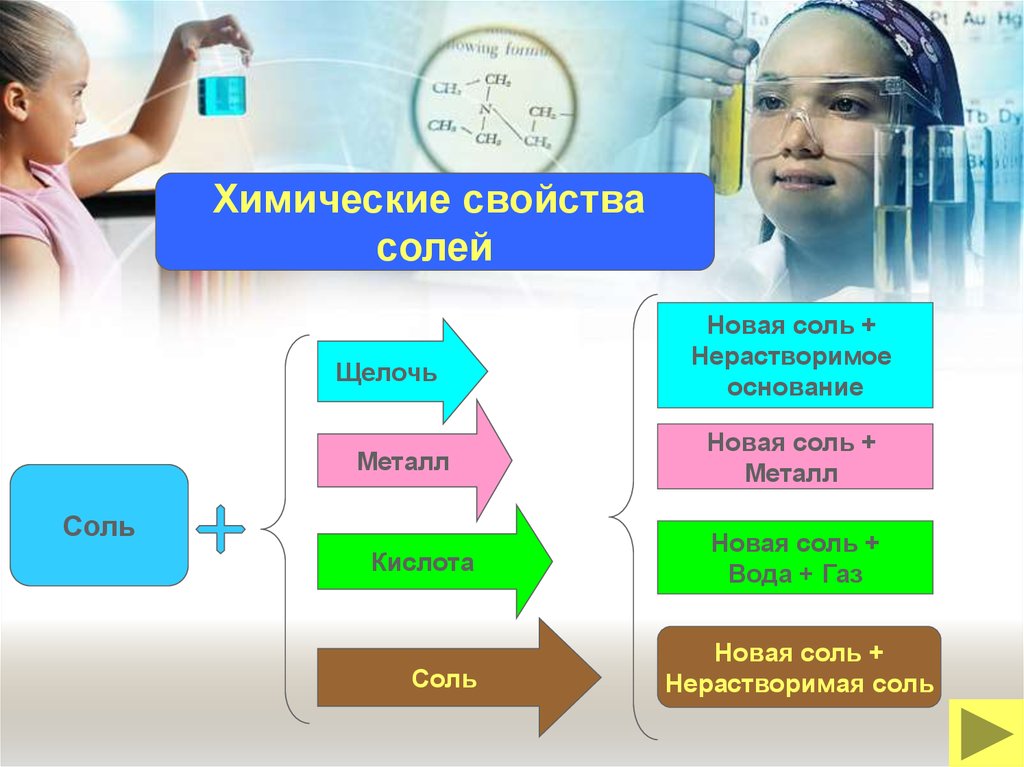
Химические свойствасолей
Щелочь
Металл
Соль
Кислота
Соль
Новая соль +
Нерастворимое
основание
Новая соль +
Металл
Новая соль +
Вода + Газ
Новая соль +
Нерастворимая соль
20. Применение оксидов
• Известно около 300 оксидов. Из железныхруд, содержащих оксиды железа, получают
железо.
Песок, состоящий преимущественно состоит
из SiO2, используют при производстве стекла.
• Некоторые оксиды являются основой для
красок: ZnO – белой, Fe2O3 – коричневой,
Cr2O3 – зелёной. А природные и
искусственные кристаллы оксидов
алюминия, окрашенные примесями,
используют для изготовления ювелирных
украшений.








 Химия
Химия








