Похожие презентации:
Этические вопросы проведения клинических исследований
1. Этические вопросы проведения клинических исследований
Наумова Е.А., д.м.н., профессор кафедры факультетской терапииПредседатель Комитета по Этике
ГБОУ ВПО Саратовский Государственный медицинский
университет им.В.И.Разумовского Минздрава России
2.
Клинические исследованияКлинические испытания
3. Национальный стандарт РФ Надлежащая клиническая практика (ГОСТ Р 52379-2005)
клиническое испытание/исследование (clinical trial/study):Любое исследование, проводимое с участием человека в
качестве субъекта для выявления или подтверждения
клинических и/или фармакологических эффектов
исследуемых продуктов и/или выявления нежелательных
реакций на исследуемые продукты, и/или изучения их
всасывания, распределения, метаболизма и выведения с
целью оценить их безопасность и/или эффективность.
4. Клинические исследования. Надлежащая клиническая практика (ГОСТ Р ИСО 14155-2014)
Клинические исследования. Надлежащаяклиническая практика (ГОСТ Р ИСО 141552014)
Клиническое исcледование (clinical investigatigation):
системное исследование с участием одного или более
человека в качестве субъекта, проводимое для оценки
безопасности и функциональных характеристик
медицинского изделия
Термины клиническое исследование и клиническое
испытание являются синонимами
5. Медицинские изделия
любые инструменты, аппараты, приборы, оборудование, материалы ипрочие изделия, применяемые в медицинских целях отдельно или в
сочетании между собой, а также вместе с другими принадлежностями,
необходимыми для применения указанных изделий по назначению,
включая специальное программное обеспечение, и предназначенные
производителем для профилактики, диагностики, лечения и
медицинской реабилитации заболеваний, мониторинга состояния
организма человека, проведения медицинских исследований,
восстановления, замещения, изменения анатомической структуры или
физиологических функций организма, предотвращения или прерывания
беременности, функциональное назначение которых не реализуется
путем фармакологического, иммунологического, генетического или
метаболического воздействия на организм человека.
http://www.roszdravnadzor.ru/medproducts
6. Этические проблемы КИ:
Права пациентаи его безопасность
Достоверность и
значимость
получаемой
информации
7. Талидомидовая трагедия (1956-1962)
8. История трагедий
1937 год, Эликсирсульфаниламида
Основа – диэтилен-гликоль
(входит в состав атифриза)!
Не был тестирован на
токсичность!
107 человек погибло
9. История трагедий
Медицинские эксперименты нацистовВрачи считали получаемые данные важными для науки
Исследования инфицирования, воздействия ледяной
воды, низкого давления, трансплантации)
23 врача осуждены (7 – казнены)
10. История трагедий
Tuskegee Syphilis Study (US Public HealthService)
Долговременное исследование (1930-1972)
400 черных мужчин
Отсутствие информированного согласия
Недостоверная информация (“особое
бесплатное лечение”)
Отсутствие терапии (несмотря на изобретение
пенициллина в 1940!)
1946 – смертность в 2 раза!
В 1997 государство (в лице президента
Б.Клинтона) принесло свои извенения, а
выжившие (8 человек!) и их родственнико
получили пожизненное бесплатное лечение
11. Местные аллергические реакции на латекс
12. Принятие Нюрнбергского кодекса. 1947
1.
2.
3.
4.
5.
Нюрнбергский Кодекс обозначил обязательные
требования для защиты интересов пациентов –
участников клинических исследований, в том
числе :
Добровольное согласие на участие в
исследовании;
Право участника исследования на получение
полной информации о сути исследования, его
целях и возможных рисках ;
Право участника исследования на прекращение
своего участия (выход из исследования) в любое
время;
Необходимость обоснования проведения
исследования ожидаемой пользой от
внедрения изучаемого метода ;
Необходимость обоснования риска от участия в
исследовании социальной важностью
изучаемой проблемы.
13. Хельсинкская Декларация Всемирной Медицинской Ассоциации, 1964
Последняя редакция 2013 г14. Стандарт Клинических Исследований, 1986
Целью GCP объявляются защитаинтересов пациентов- участников
исследований и получение надёжных и
достоверных данных
15. НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА
НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКАСТАНДАРТ
ПОДГОТОВЛЕН Ассоциацией международных
фармацевтических производителей (AIPM), Международной
конфедерацией обществ потребителей (КонфОП),
Российской Академией медицинских наук (РАМН) по
собственному аутентичному переводу, указанному в пункте 4
ВНЕСЕН Техническим комитетом по стандартизации ТК 450
«Лекарственные средства»
УТВЕРЖДЕН Приказом Федерального агентства по
техническому регулированию и метрологии от 27 сентября
2005 г. № 232-ст
16. НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКА
НАДЛЕЖАЩАЯ КЛИНИЧЕСКАЯ ПРАКТИКАНастоящий стандарт идентичен
Руководству по надлежащей клинической
практике (Consolidated Guideline for Good Clinical
Practice)
Международной конференции по гармонизации
технических требований к регистрации
фармацевтических продуктов, предназначенных
для применения человеком (International
Conference on Harmonization of Technical
Requirements for Registration of Pharmaceuticals
for Human Use; ICH)
17. Надлежащая клиническая практика (Good Clinical Practice; GCP)
представляет собой международныйэтический и научный стандарт
планирования и проведения исследований
с участием человека в качестве субъекта,
а также документального оформления и
представления результатов таких
исследований.
18. Клинические исследования. Надлежащая клиническая практика. ГОСТ Р ИСО 14155-2014
Заменил предыдущийНациональный стандарт РФ. Руководство по проведению
клинических испытаний медицинских изделий.ГОСТ Р
ИСО 14155-1-2008
19. ПРИНЦИПЫ НАДЛЕЖАЩЕЙ КЛИНИЧЕСКОЙ ПРАКТИКИ (GCP)
Клинические исследования должны проводиться в соответствии сэтическими принципами, заложенными Хельсинкской декларацией
ВМА и отраженными в GCP и нормативных требованиях.
До начала исследования должна быть проведена оценка
соотношения прогнозируемого риска и неудобств с ожидаемой пользой
для субъекта исследования и общества. Исследование может быть
начато и продолжено только в том случае, если ожидаемая польза
оправдывает риск.
Права, безопасность и благополучие субъекта исследования
имеют первостепенное значение и должны превалировать над
интересами науки и общества.
Информация (доклиническая и клиническая) об исследуемом
продукте должна быть достаточной для обоснования
предполагаемого клинического исследования.
20. Типы исследований эффективности вмешательств
НЕКОНТРОЛИРУЕМЫЕописание случая, серии случаев
исследования взаимосвязей («поперечные»)
когортные исследования
типа «случай контроль»
неконтролируемые клинические испытания
КОНТРОЛИРУЕМЫЕ
Рандомизированные и нет
С плацебо контролем и без
«Слепые» и «открытые»
Большие (тыс.) и малые (десятки и сотни)
Многоцентровые и нет
21. Научные исследования
Для выдвижения гипотез (ПИЛОТНЫЕ)Для проверки гипотез
(годятся только рандомизированные контролируемые
исследования).
22. Многоцентровые исследования
50 стран23. Информированное согласие
Испытуемый информирован:• о целях исследования
• о методах исследования
• о лекарственных средствах
и режиме лечения
• об имеющемся
альтернативном лечении
• о потенциальной пользе и
риске, а также возможном
дискомфорте
Испытуемый понимает, что:
• согласие дается
добровольно
• согласие не может быть
получено по принуждению
• он может выйти из
исследования в любое
время
• выход из исследования не
повлияет на его
дальнейшее медицинское
обслуживание
24. Протокол (protocol) или план клинического исследования (clinical investigation plan)
Документ, который описывает цели, дизайн, методологию,статистические аспекты и организацию исследования.
Помимо этого протокол обычно содержит полученные
ранее данные и обоснование исследования, однако эта
информация может быть представлена и в других
документах, на которые ссылается протокол
исследования.
25. Выбор больных
Критериивключения
Критерии
исключения
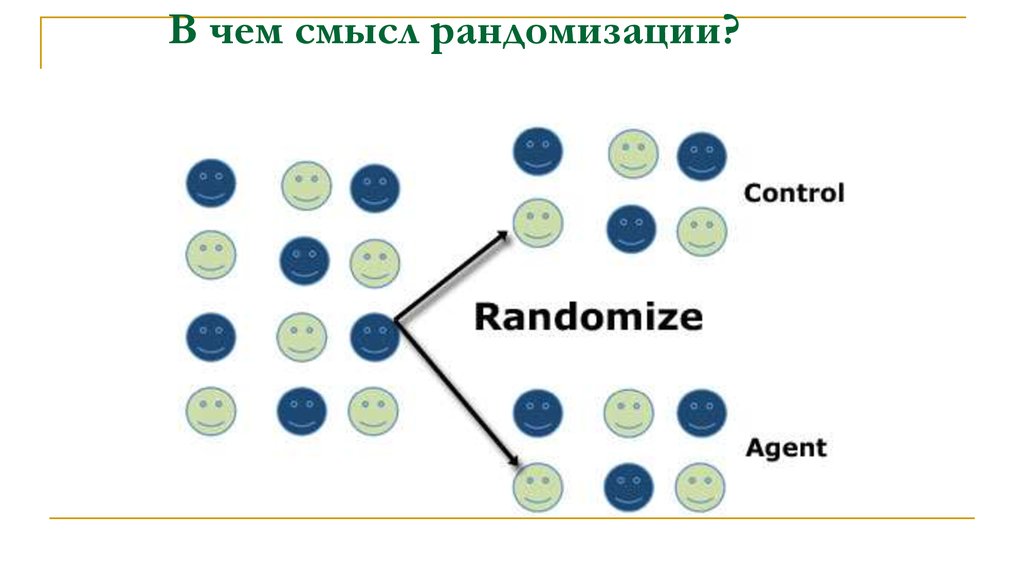
26. В чем смысл рандомизации?
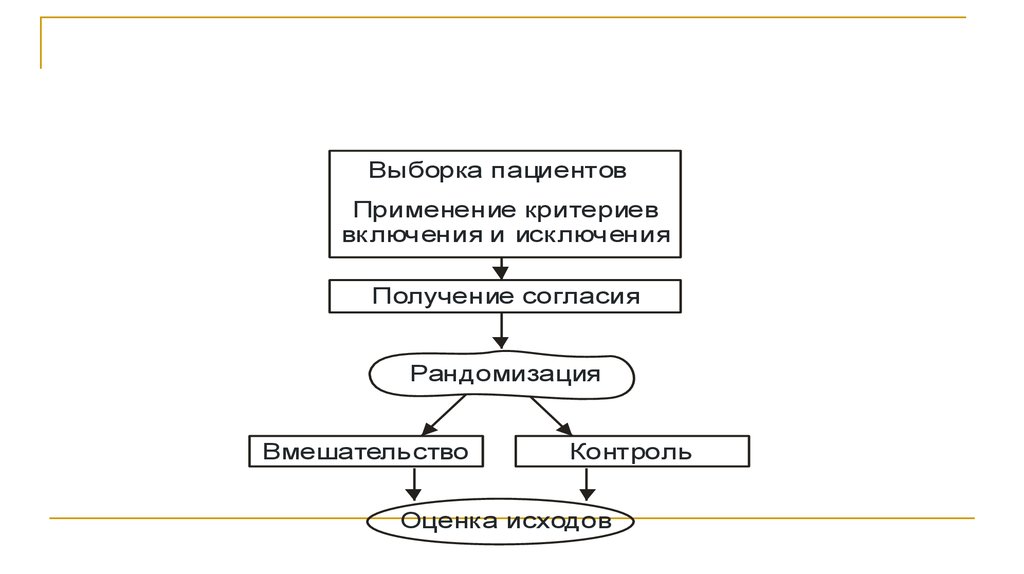
27.
Выборка пациентовПрименение критериев
включения и исключения
Получение согласия
Рандомизация
Вмешательство
Контроль
Оценка исходов
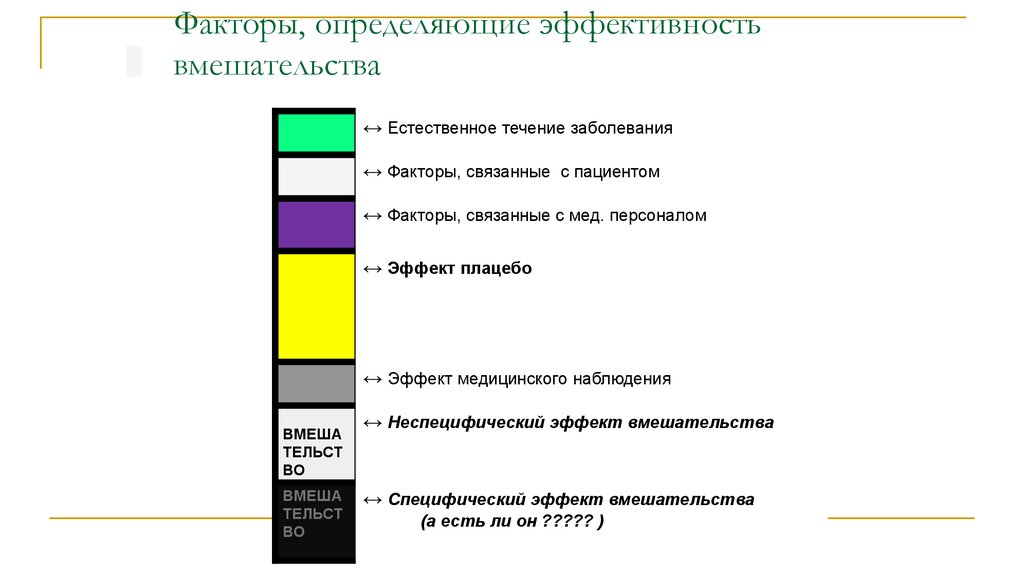
28. Факторы, определяющие эффективность вмешательства
↔ Естественное течение заболевания↔ Факторы, связанные с пациентом
↔ Факторы, связанные с мед. персоналом
↔ Эффект плацебо
↔ Эффект медицинского наблюдения
ВМЕША
ТЕЛЬСТ
ВО
ВМЕША
ТЕЛЬСТ
ВО
↔ Неспецифический эффект вмешательства
↔ Специфический эффект вмешательства
(а есть ли он ????? )
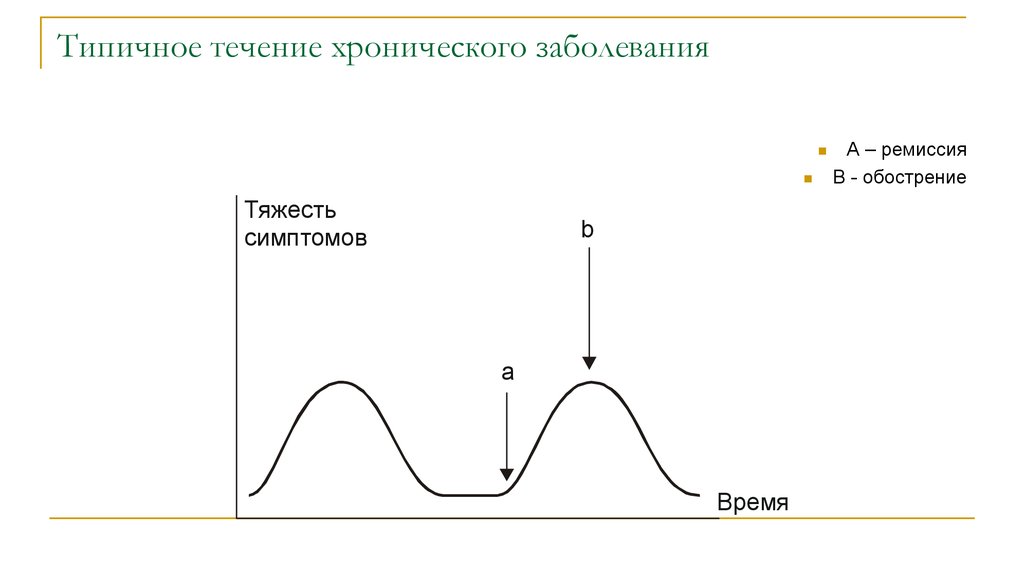
29. Типичное течение хронического заболевания
Тяжестьсимптомов
b
а
Время
А – ремиссия
В - обострение
30. Пациент
Собственное мнениеПредпочтения
Особенности восприятия
31. Клинический опыт и интуиция
- необходимые составляющие врачебного искусства.Ни один клиницист не может иметь достаточного
прямого опыта, чтобы свободно ориентироваться во всем
многообразии клинических ситуаций.
32. Два объективных фактора, ограничивающих ценность врачебного опыта
Определенный врач видит лишь определенный или«отобранный» контингент больных.
Один врач не видит результаты лечения (особенно
отдаленные) всех больных, которых он/она лечит.
33. Факторы, определяющие эффективность вмешательства
↔ Естественное течение заболевания↔ Факторы, связанные с пациентом
↔ Факторы, связанные с мед. персоналом
↔ Эффект плацебо
↔ Эффект медицинского наблюдения
ВМЕША
ТЕЛЬСТ
ВО
ВМЕША
ТЕЛЬСТ
ВО
↔ Неспецифический эффект вмешательства
↔ Специфический эффект вмешательства
(а есть ли он ????? )
34. Рандомизация (randomization)
Процесс распределения субъектов исследования погруппам лечения или контроля случайным образом,
позволяющий свести к минимуму субъективность.
35. Виды ослепления в РКИ
Открытое рандомизированное исследование.Простое слепое рандомизированное
исследование.
Двойное слепое рандомизированное
исследование.
Тройное слепое рандомизированное
исследование.
36. Открытое РКИ
37. Простое слепое РКИ
38. Двойное слепое РКИ
39. Пероральный vs парентеральный препарат?
ПлацебоAктивный
препарат
VS
Плацебо
Активный
препарат
40. А медицинские изделия?
41. Статья 29 Хельсинской Декларации
гласит: "Польза, риски, неудобства и эффективность новогометода должны оцениваться в сравнении с лучшими на текущий
момент профилактическими, диагностическими и
терапевтическими методами. В тех случаях, когда не существует
апробированного профилактического, диагностического или
терапевтического метода, возможно использование в
исследованиях групп сравнения с плацебо либо с отсутствием
лечения".
42. Наблюдение
Нежелательные явления (серьезные и несерьезные)Нежелательное воздействия изделия
Недостатки изделия
Отклонения от протокола
Конечные точки
Отчет о завершении исследования
43. Конечные точки
Конечные точки - это параметры, которые будут оцениваться.Твердые конечные точки — это параметры, связанные
с жизнью больных и развитием угрожающих жизни
осложнений.
Мягкие (суррогатные) конечные точки отражают состояние
одной-двух систем организма, изменения отдельных
параметров.
44. Измерение QT Смерть
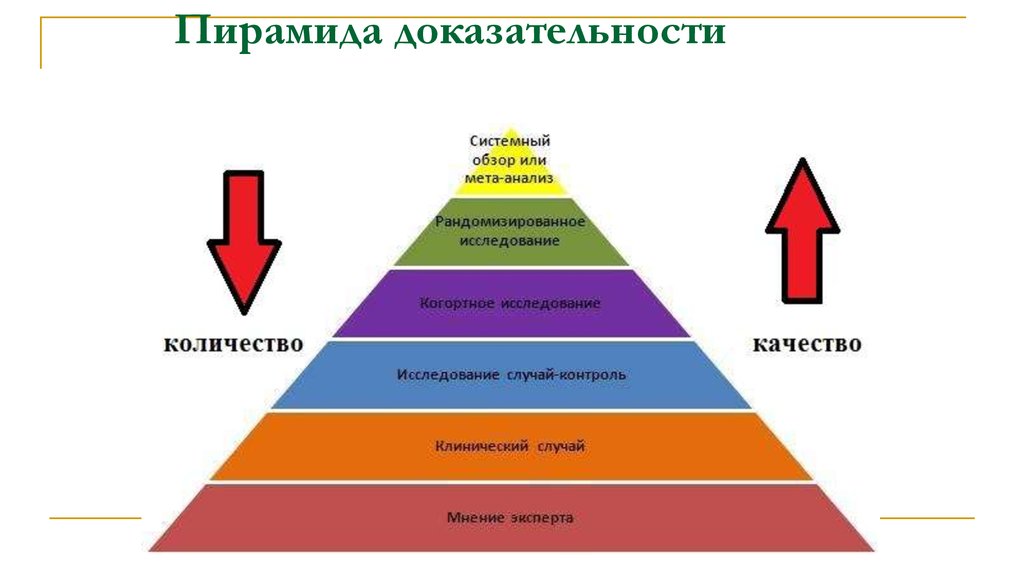
vs45. Пирамида доказательности
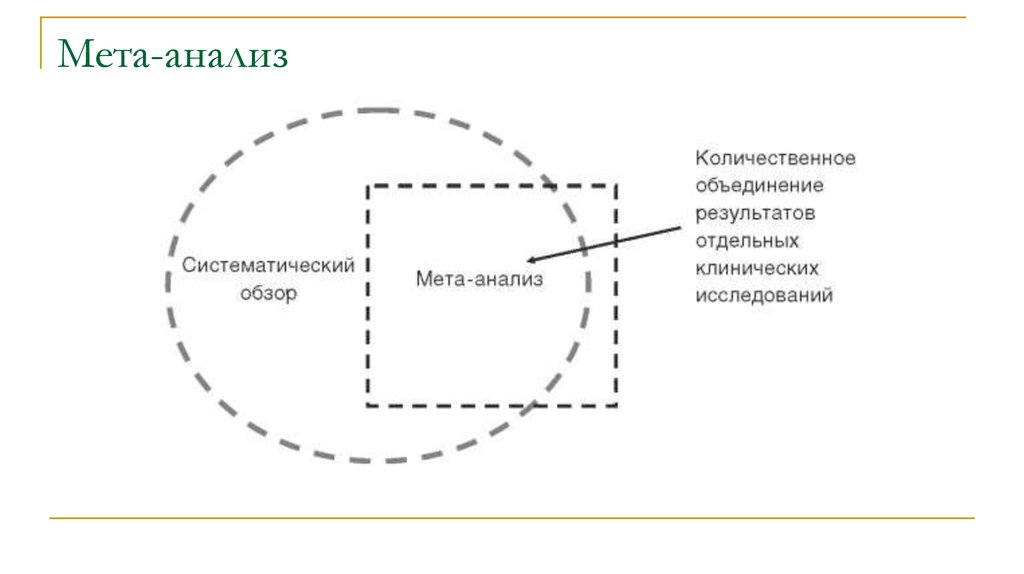
46. Мета-анализ
47. Meta-analysis Antiplatelets : Trials ASA vs. Placebo
Death or MI (%)ASA vs.
Placebo
Theroux
N
ASA
Placebo
479
2.46% 6.35%
Lewis
1266
4.9%
10.1%
Cairns
555
6.1%
12.9%
RISC
728
6.5%
17.1%
Total
3096
5.2%
11.8%
0.41
0
(-)
A
A
A
0.2
0.4
0.6
0.8
ASA betterPl. better
1
1.2
48. Классы рекомендаций
I класс – польза >>> риск, должно быть выполненоIIа класс – польза>>риск, целесообразно выполнить
IIb класс – польза ≥ риск, можно рассмотреть выполнение
III класс - польза ≤ риск, не должно быть выполнено, т.к.
бесполезно или вредно
49. Уровни доказательности
Уровень АДанные получены из
множественных РКИ или
мета-анализа
Уровень В
Данные получены из
единственного РКИ или
крупных неРКИ
Уровень С
Соглашение (консенсус)
или мнение экспертов и /
или маленькие
исследования,
ретроспективные
исследования, регистры
50.
Комитета по этике IRB#: IRB00005197FWA#: FWA00009567 при ГБОУ ВПО
«Саратовский государственный
медицинский университет им. В.И.
Разумовского» Минздрава России
51. Порядок работы этического комитета регламентируется:
Конституцией РФ;Хельсинской декларацией Всемирной Медицинской Ассоциации 1964 г. и ее
последующими редакциями (последняя октябрь 2013 г), документами ООН и
Совета Европы, касающимися прав пациента;
Федеральным законом РФ от 21 ноября 2011 г. «Об основах охраны здоровья
граждан в Российской Федерации»;
Федеральным законом "Об обращении лекарственных средств", от 2010 г. (с
обновлениями 2014 г)
Приказом Минздрава РФ «Об утверждении правил клинической практики в
Российской Федерации» № 266 от 19.06.2003;
Национальным стандартом РФ ГОСТ Р 52379 – 2005 «Надлежащая клиническая
практика»;
52. Порядок работы этического комитета регламентируется (продолжение):
Приказом Минздрава СССР «О мерах по дальнейшему совершенствованиюорганизационных форм работы с использованием экспериментальных
животных» № 755 от 12.08.1977;
Приказом Минздрава РФ «Об утверждении правил лабораторного практикума»
№ 266 от 19.06.2003;
Всеобщей декларацией о биоэтике и правах человека, принятой на 33-й сессии
Генеральной конференции ЮНЕСКО в 2005 году;
Приказом Минздравсоцразвития России №774н от 31 августа 2010г. «О Совете
по этике»
Постановление Правительства РФ о 27 декабря 2013 №1416 “Об утверждении
Правил государственной регистрации медицинских изделий”
Клинические исследования. Надлежащая клиническая практика. ГОСТ Р ИСО
14155-2014
53.
Комитет поЭтике
Минздрава
России
Комитет по
этике
Саратовского
Медицинского
университета
Одобрение проведения КИ
Мониторирование КИ
Диссертационные исследования
НИРС
54.
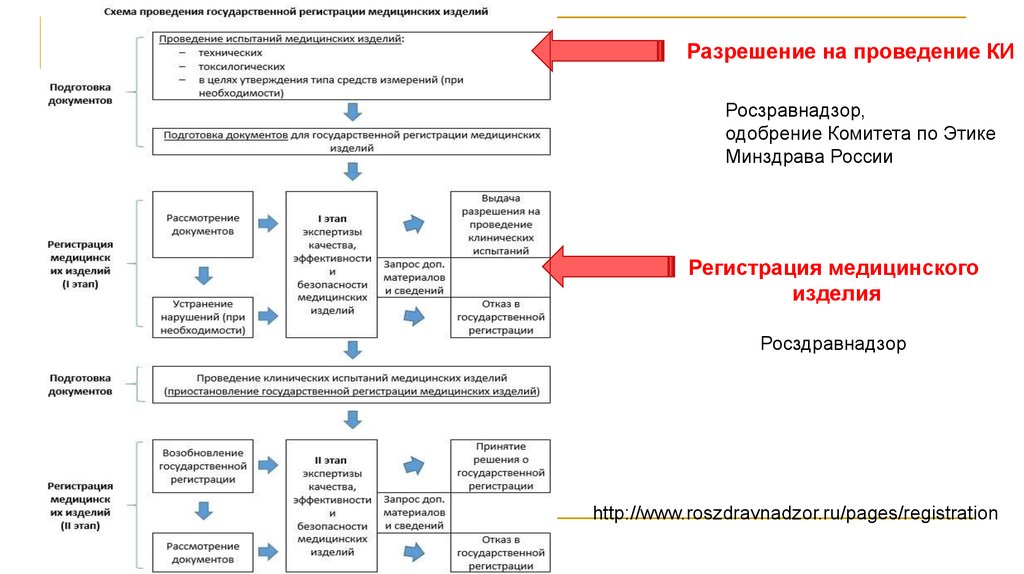
Разрешение на проведение КИРосзравнадзор,
одобрение Комитета по Этике
Минздрава России
Регистрация медицинского
изделия
Росздравнадзор
http://www.roszdravnadzor.ru/pages/registration
55. Основные замечания и причины отказа в одобрении НИР Комитетом по Этике СГМУ:
Использование медицинских изделийне имеющих государственной
регистрации или разрешения на
проведение КИ
Применение методик при патологии, не
являющейся показанием для
применения данных методик
56. Основные замечания и причины отказа в одобрении НИР комитетом по Этике СГМУ:
Отсутствие подробного описанияисследуемых групп с указанием пола,
возраста, критериев включения и
исключения больных и процедур
исследования
Отсутствие в информированном
согласии для пациента подробного
описания риска, показаний и
возможных осложнений при
применении лечебных или
диагностических методик
57. Уинстон Черчиль
Democracy is the worst formof government, except
all the others that have been
tried.
Демократия — наихудшая
форма правления, если
не считать всех остальных.
















































 Медицина
Медицина Право
Право








