Похожие презентации:
Алкены. Состав, строение, свойства и химические превращения
1. Завершите начатые фразы:
Непредельные углеводороды –это углеводороды, ..
которые имеют в углеродной цепи
кратные связи (двойные, тройные).
Алкены – это непредельные
углеводороды …
содержащие в молекуле, помимо одинарных
связей, одну двойную связь между
атомами углерода и отвечают формуле
СnH2n.
2.
Простейший алкен – ...этен (этилен).
Молекулярная формула этилена ...
С2H4
Структурная формула этилена ...
СН2= СН2
Электронное строение молекулы
этилена обусловлено ...
гибридизацией атомов углерода.
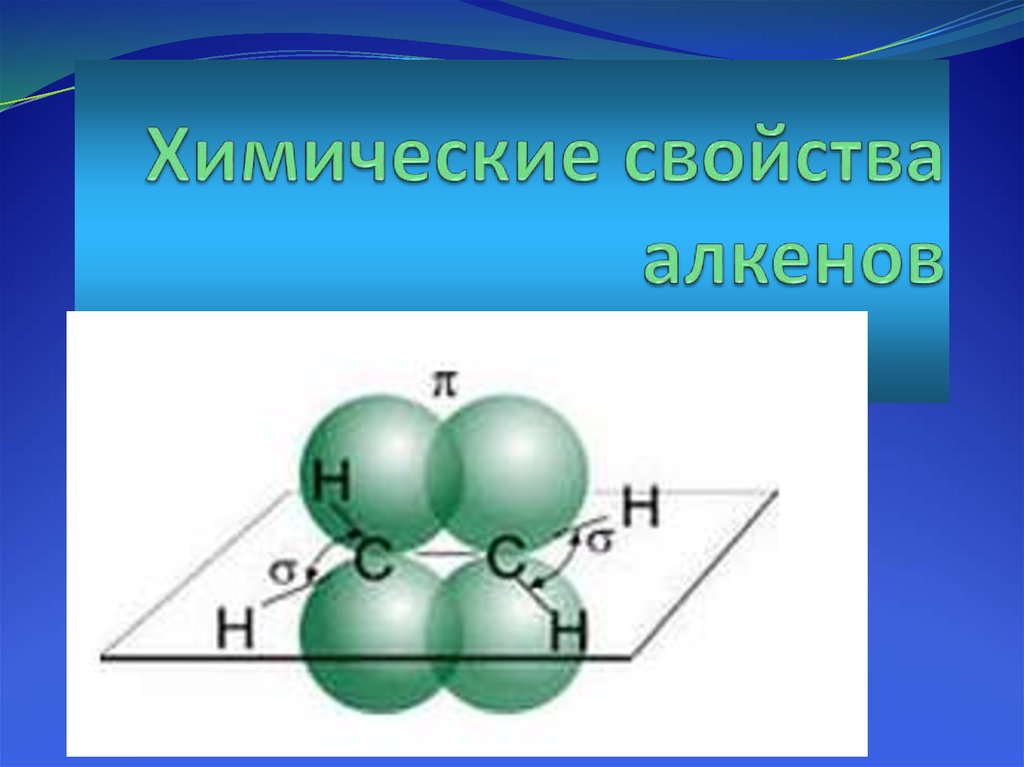
3. Особенности строения алканов
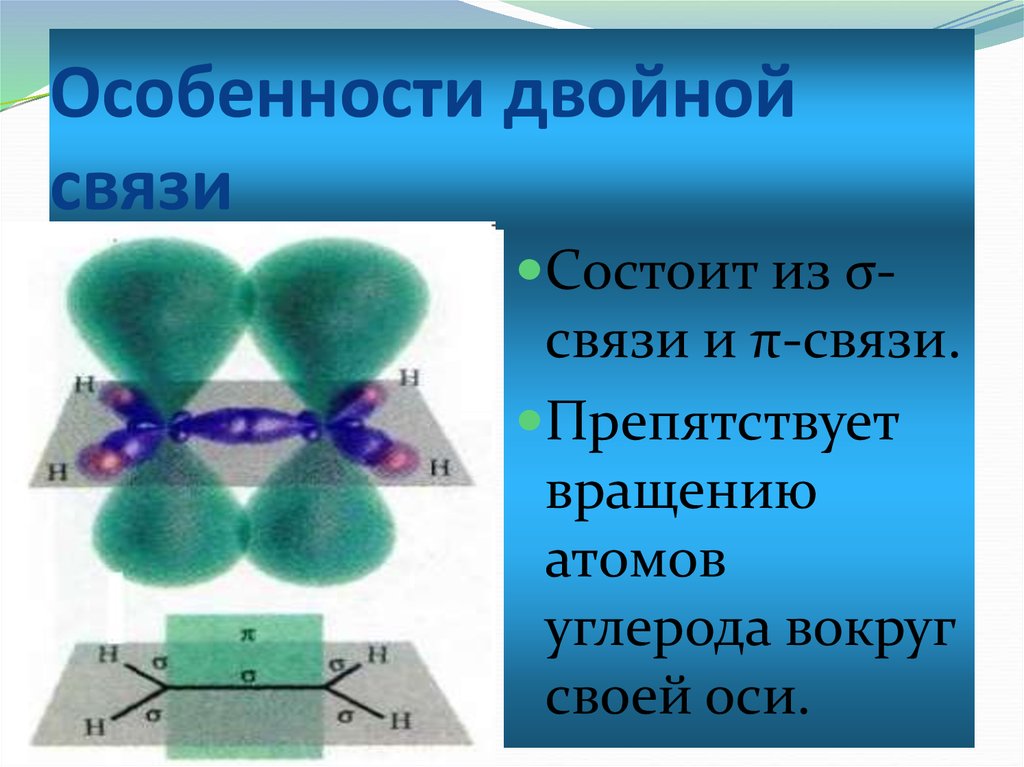
Атомы углерода при двойной связинаходятся в sp2-гибридном
состоянии и между ними образуется
двойная связь, состоящая из πсвязи и σ-связи.
Длина двойной связи – 0,134 нм.
Все валентные углы близки к 120º.
4. Особенности двойной связи
Состоит из σсвязи и π-связи.Препятствует
вращению
атомов
углерода вокруг
своей оси.
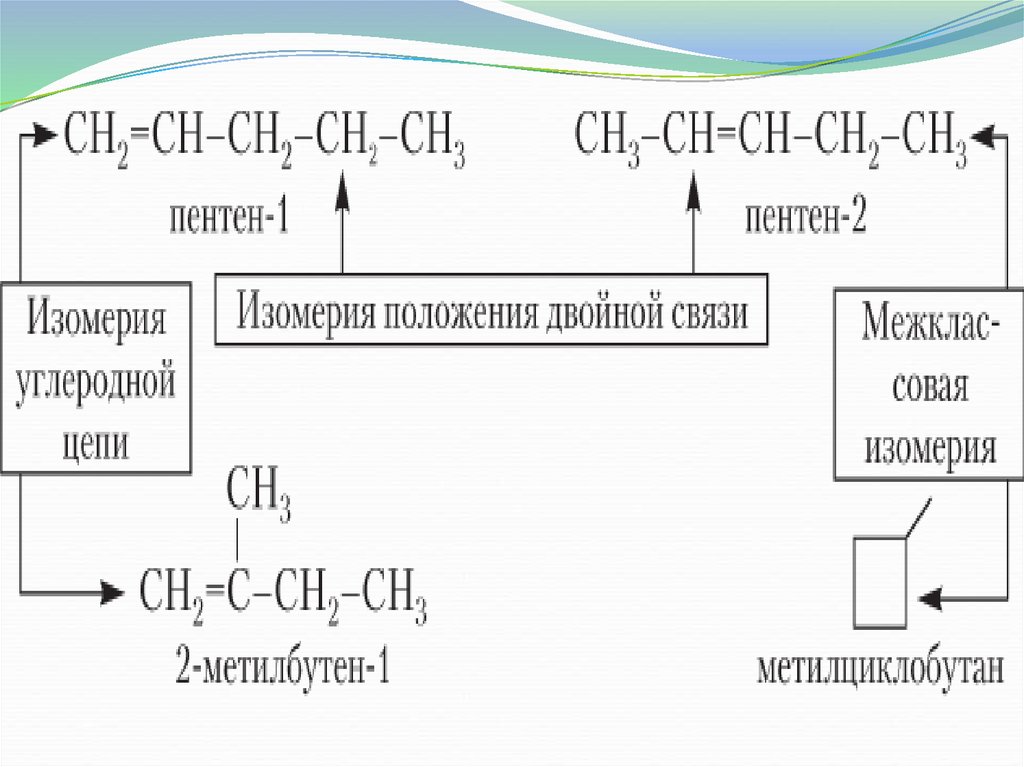
5.
изомерияструктурная
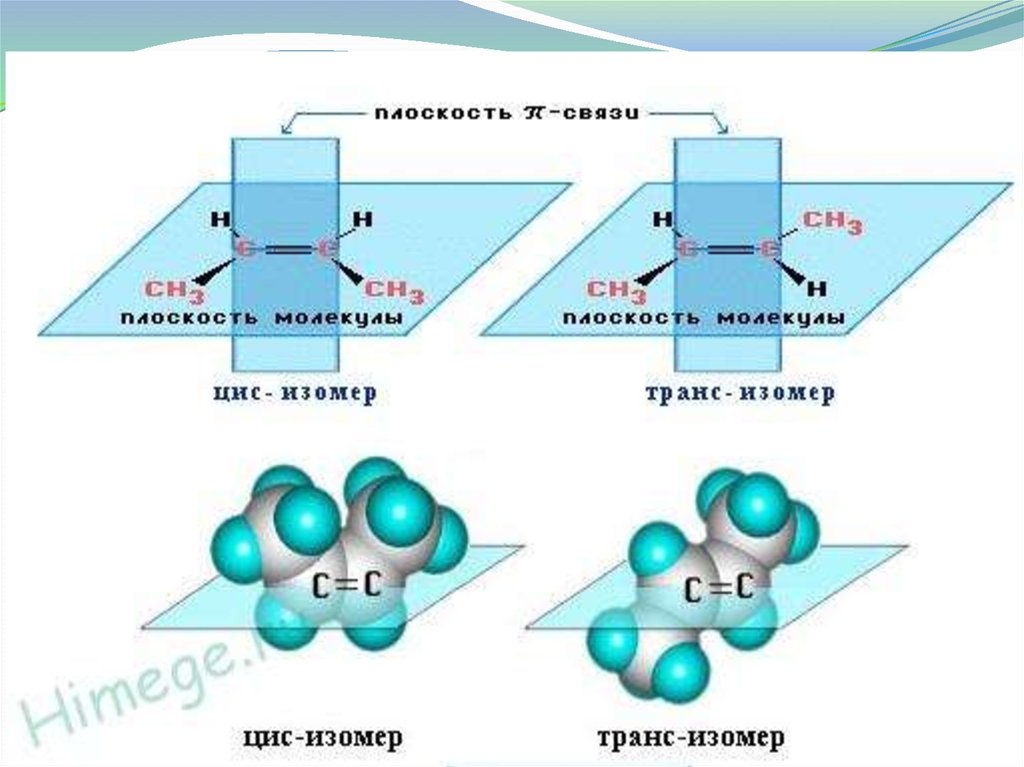
Пространственная
Цис-транс
изомерия
Положения
связи
УВ цепи
Межклассовая с
циклоалка
нами
6.
7.
8.
Ациклические углеводороды, вмолекулах которых содержится одна
двойная связь, называются
А) алканы
Б) алкены
В) алкины
Г) арены.
2. Для алкенов характерна изомерия
А) углеродного
Б) положения
скелета
кратной связи
В) пространственная Г) все ответы
верны.
1.
9.
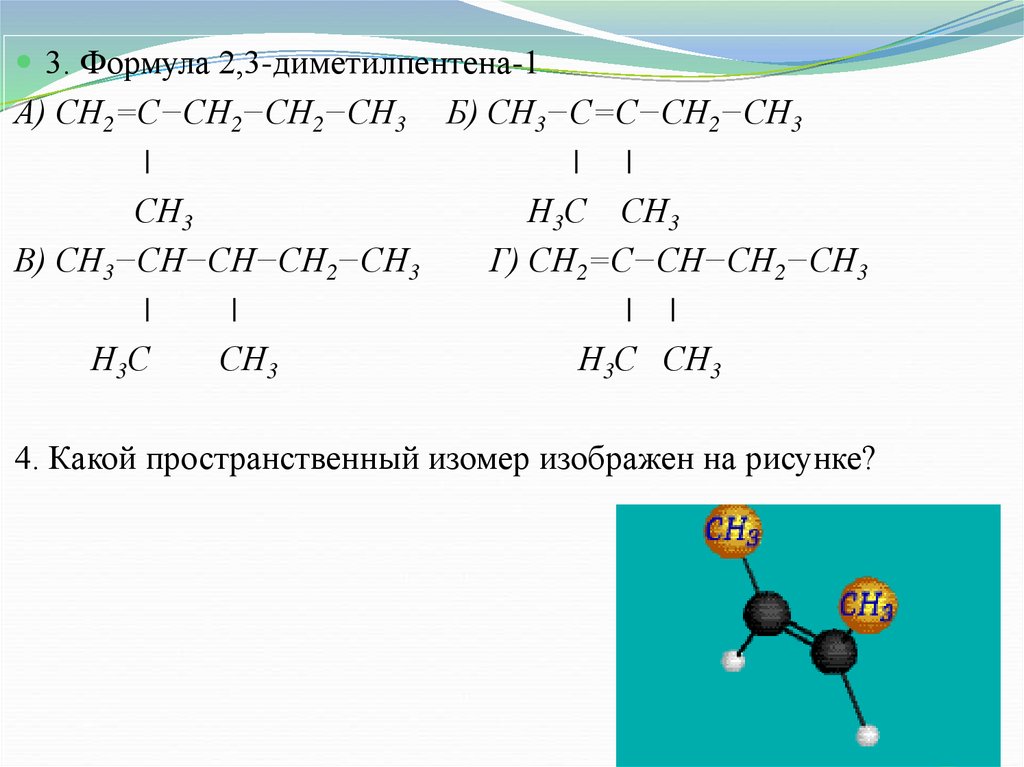
3. Формула 2,3-диметилпентена-1А) СН2=С−СН2−СН2−СН3 Б) СН3−С=С−СН2−СН3
|
| |
СН3
Н3С СН3
В) СН3−СН−СН−СН2−СН3
Г) СН2=С−СН−СН2−СН3
|
|
| |
Н3С
СН3
Н3С СН3
4. Какой пространственный изомер изображен на рисунке?
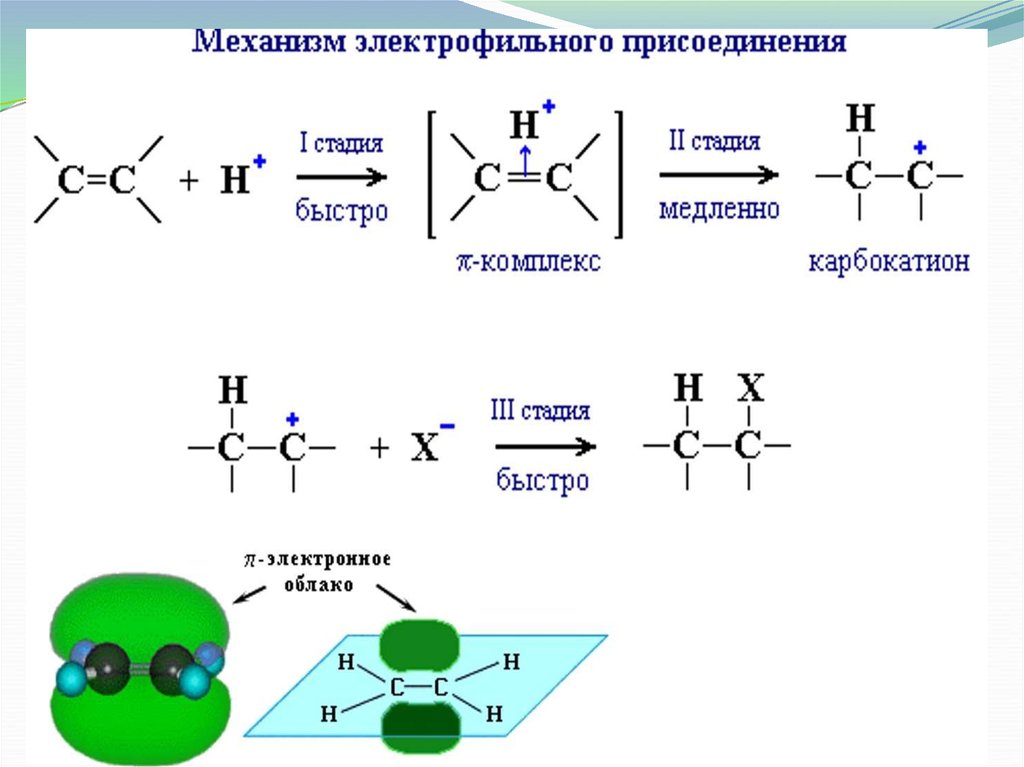
10. Химические свойства алкенов
11. Химические свойства
Алкены вступают в реакцииприсоединения, которые
протекают по месту разрыва
непрочной -связи.
Для алкенов характерны реакции
электрофильного присоединения
(АЕ).
Механизм ионный.
12.
13. Реакции присоединения
Гидрирование (+ Н2)Галогенирование (+ Г2)
Гидрогалогенирование (+НГ)
Гидратация (+ Н2О)
14. Качественная реакция на -связь
Качественная реакция на связьКачественная реакция на -связь это
обесцвечивание бромной
воды.
15.
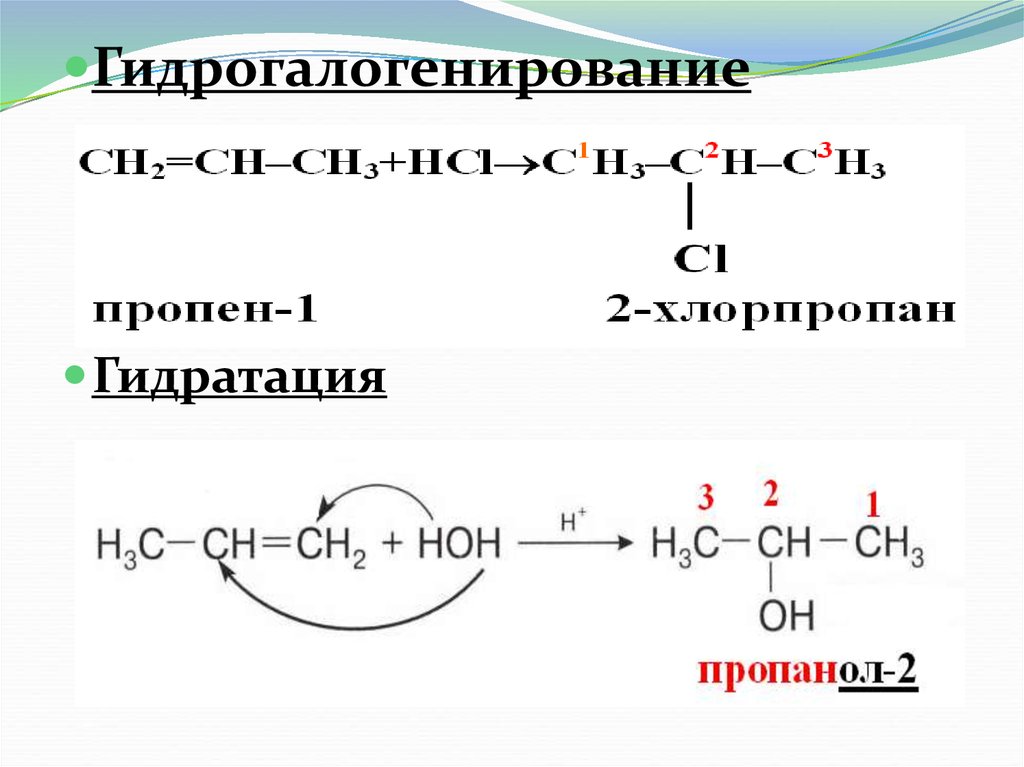
16. Гидрогалогенирование Гидратация
Реакции гидрогалогенирования игидратации несимметричных
гомологов этилена идут легче по
сравнению с этиленом и проходят в
соответствии с правилом
Марковникова.
17. Правило В.В. Марковникова
При присоединении НГ или Н2О к несимметричномуалкену водород присоединяется к более
гидрированному атому углерода, т.е. атому, при
котором находится больше атомов водорода, а галоген
или (ОН ) к менее гидрированному атому углерода.
18.
ГидрогалогенированиеГидратация
19. Реакции окисления
Полное окисление горение.Неполное окисление
взаимодействие с окислителями:
KMnO4 фиолетовый раствор
20. Горение
Этилен горит красноватым светящимсяпламенем, в то время как пламя
предельных углеводородов голубое; это
происходит потому, что массовая доля
углерода в алкенах выше, чем в алканах с
тем же числом атомов углерода.
21.
22. Мягкое окисление
Качественная реакция на -связь обесцвечивание фиолетового
раствора перманганата калия.
этиленгликоль
(этандиол-1, 2)
23.
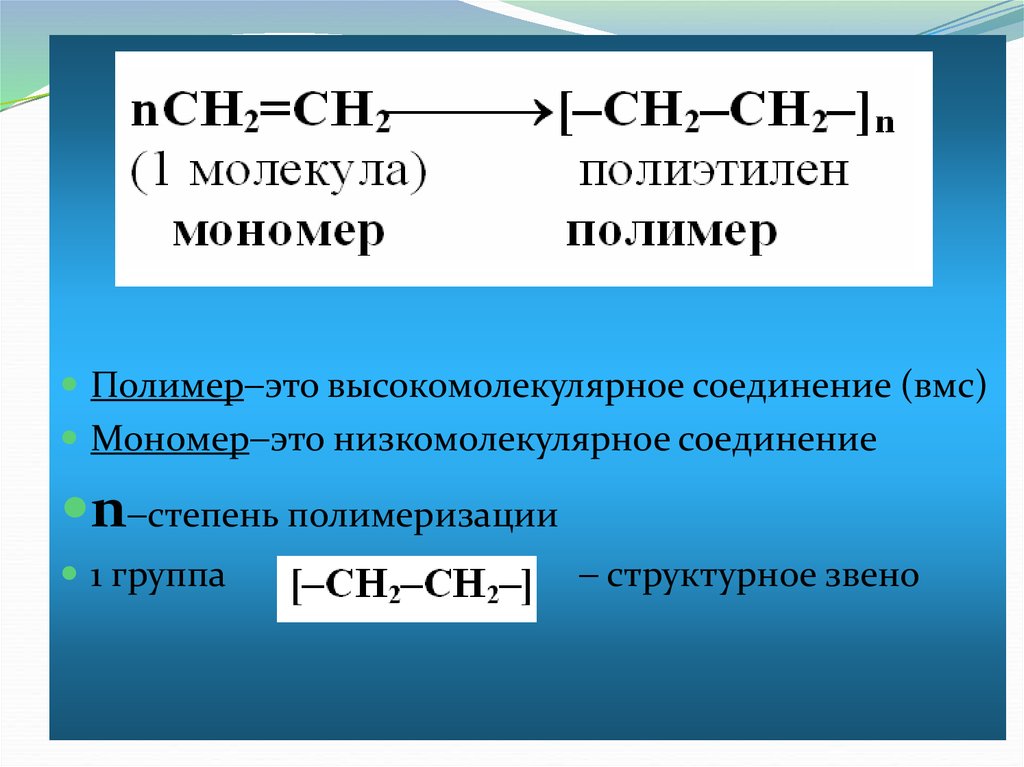
24. Полимеризация
Полимеризация (особый типреакций присоединения, в которых
молекулы алкенов соединяются друг
с другом с образованием больших
длинных молекул, макромолекул.
Реакция полимеризации алкенов и их
производных протекает по свободнорадикальному
механизму.
25.
26.
Полимер это высокомолекулярное соединение (вмс)Мономер это низкомолекулярное соединение
n степень полимеризации
1 группа
структурное звено
27. Сырьеполиэтилен
Сырье полиэтилен28. Изделия из полиэтилена
29. Сырьеполипропилен
Сырье полипропилен30. Изделия из полипропилена
31. Свойства полиэтилена
Полиэтилен полупрозрачный,эластичный, жирный на ощупь
материал.
При нагревании
размягчается, в размягченном
состоянии легко меняет форму, из
расплава можно вытянуть нити.
32.
Горит синеватым пламенем,распространяя запах расплавленного
парафина, продолжает гореть вне
пламени.
Не изменяет окраску желтой бромной
воды и фиолетового раствора
перманганата калия. Данные
растворы веществ не действуют на
полимер, т.к. отсутствует в составе
полимера -связь.
33.
Химические свойства алкеновПрисоединение
Гидрирование
Гидрогалогенирование
Гидратация
Галогенирование
Окисление
Неполное (KMnO4)
Горение
Каталитическое окисление
Полимеризация
34.
1. Реакция присоединения водорода называетсяА) гидрирование
Б) гидрогалогенирование
В) гидратация
В) дегидрирование
2. В реакции бромирования пропена образуется
А) 1,3-дибромпропан Б) 1-бромпропан
В) 2-бромпропан
Г) 1,2-дибромпропан
3. Сумма коэффициентов в уравнении горения пропена
равна:
А) 11
Б) 15
В) 21
Г) 23
4. При гидрогалогенировании алкенов атом водорода
присоединяется к … гидрированному атому углерода,
а атом галогена – к … гидрированному.
А) более
Б) менее
35.
Реакция гидробромирования пропенапротекает:
1) в соответствии с правилом В.В.Марковникова
2) в соответствии с правилом А.М.Зайцева
3) по радикальному механизму
4) по электрофильному механизму
5) с преимущественным образованием 2бромпропана
6) с преимущественным образованием 1бромпропана
Ответы: 1, 4, 5
36.
Предложите способ очисткипропана от примесей этилена.
Напишите уравнения
соответствующих реакций.
Ответ: пропустить смесь газов
через раствор бромной воды или
перманганата калия, этилен
прореагирует с данными
растворами.
37.
Назовите химические реакции,которые являются общими для
алканов и алкенов.
Ответ: реакции горения.
38.
Получение алкенов1. Дегидратация спиртов:
H2SO4
H−CH2−CH2−OH
→
CH2=CH2 + H2O
2. Из галогеналканов:
H−CH2−CH2−Br + KOHсп. р-р → СH2=CH2 + KBr + H2O
3. Крекинг алканов:
t
С8Н18 → С4Н10 + С4Н8
4. Дегидрирование алканов:
t, Cr2O3
H−CH2−CH2−H
→
CH2=CH2 + H2
39.
1. Бутен можно получить крекингом:А) бутана Б) пентана В) гексана Г) октана
2. Какие признаки характеризуют физические
свойства этена: 1) бесцветная жидкость, 2) имеет
резкий запах, 3) бесцветный газ, 4) немного легче
воздуха, 5) почти без запаха, 6) плохо растворим в
воде, 7) не горит, 8) с воздухом образует
взрывоопасные смеси?
А) 3,4,5,6,8
Б) 1,2,6,7
В) 2,3,4,6,8
Г) 3,4,6,8
3. Плотность паров алкена по водороду равна 49.
Массовая доля углерода в нём – 85,71%, массовая
доля водорода – 14,29%. Молекулярная формула
этого углеводорода
А) С5Н10
Б) С6Н12
В) С7Н14
Г) С8Н16
































 Химия
Химия








