Похожие презентации:
Физические и химические свойства алкенов
1.
Тема: Химия 10БВремя: 19 ноя 2020 10:30 AM Москва
Подключиться к конференции Zoom
https://us04web.zoom.us/j/71476600927?pwd=T
lpvQTNSQjFuSE80NjhHSFJiWnY2Zz09
Идентификатор конференции: 714 7660 0927
Код доступа: AFSF0Q
2. Физические и химические свойства алкенов
1. Физические свойства алкенов аналогичнысвойствам алканов.
С2 – С4
газы
С5 – С16
жидкости
С17 . . .
тв. вещества
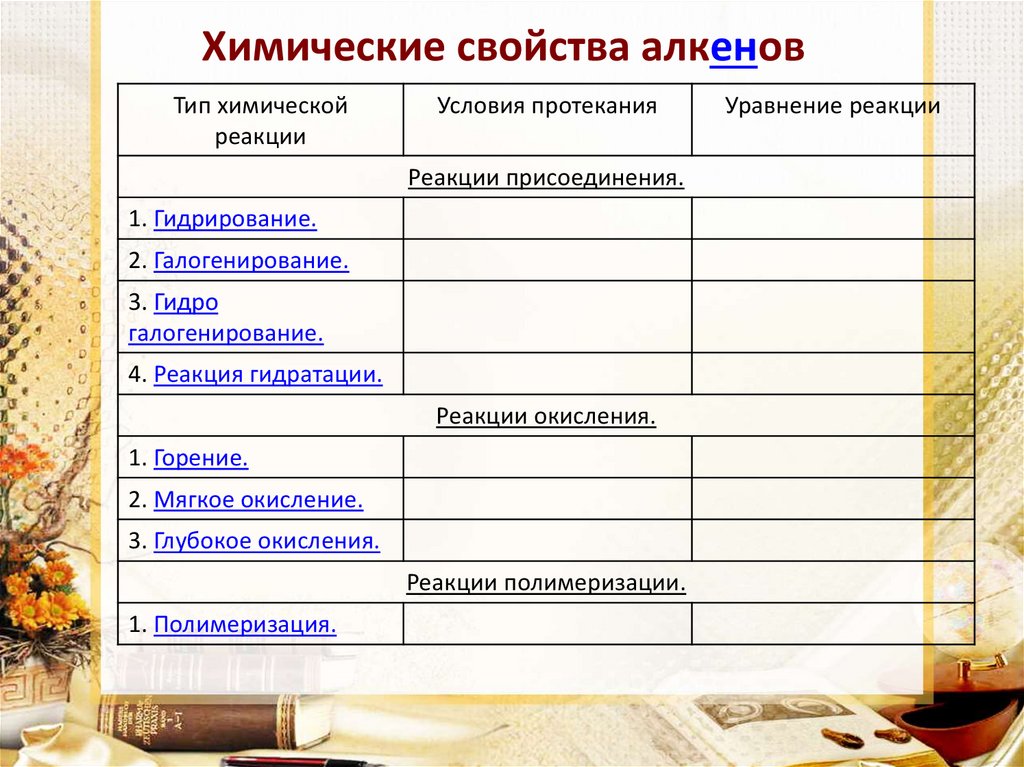
3. Химические свойства алкенов
Тип химическойреакции
Условия протекания
Реакции присоединения.
1. Гидрирование.
2. Галогенирование.
3. Гидро
галогенирование.
4. Реакция гидратации.
Реакции окисления.
1. Горение.
2. Мягкое окисление.
3. Глубокое окисления.
Реакции полимеризации.
1. Полимеризация.
Уравнение реакции
4. Реакция гидрирования.
1. Эту реакцию можно рассматривать какреакцию восстановления.
2. Реакция происходит только в присутствии
катализатора: Pt, Pd, Ni.
CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3
алкен
алкан
5. Реакция галогенирования.
1. Присоединение Br2 к алкенам являетсякачественной реакцией на непредельные УВ.
(Br2 – жёлтого цвета, при пропускании его через
алкен, раствор обесцвечивается).
СH2 = CH – CH3 + Br2 → CH2 – CH – CH3
I
I
Br Br
6. Реакция гидрогалогенирования.
1. Правило Марковникова:- при присоединении к алкенам молекул типа
H-X, водород присоединяется к углероду с
наибольшим количеством атомов водорода
при двойной связи.
СH2 = CH – CH3 + HBr → CH3 – CH – CH3
I
Br
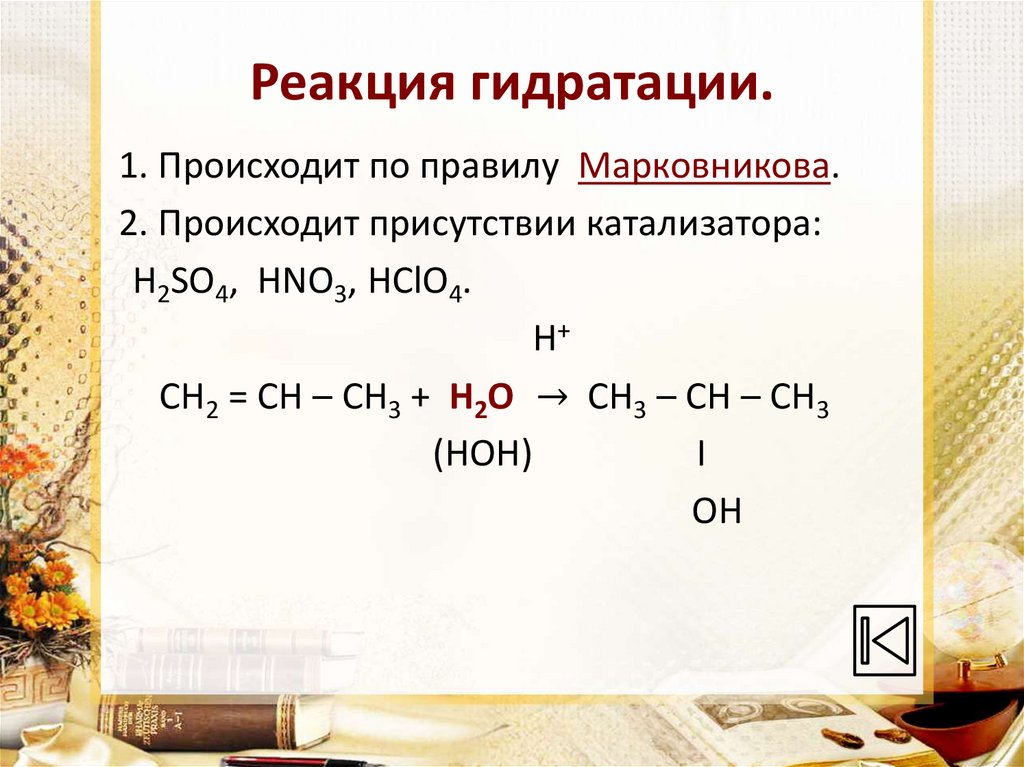
7. Реакция гидратации.
1. Происходит по правилу Марковникова.2. Происходит присутствии катализатора:
H2SO4, HNO3, HClO4.
Н+
СH2 = CH – CH3 + H2O → CH3 – CH – CH3
(HOH)
I
OH
8. Реакция горения.
1. Происходит с полным разрушениемуглеродной цепи.
СH2 = CH2 + 3O2 → 2СO2 + 2H2O
9. Реакция мягкого окисления (реакция Вагнера).
1. В качестве окислителя используется KMnO4(3%). Щелочная среда.
2. Эта реакция является качественной на
двойную связь.
Учебник, стр. 40.
ОНСH2 = CH2 + H2O + KMnO4 → CH2 – CH2
I
I
OH OH
10. Реакция глубокого окисления.
1. В качестве окислителя используется KMnO4,HNO3, K2Cr2O7
O
СH3 - СH = CH – CH3 + KMnO4 → 2CH3 – C
OH
(кислота)
11. Реакция полимеризации.
1. Условие: УФ-излучение, t, давление,катализатор.
nCH2 = CH2 → (… - CH2 – CH2 - … )n
мономер
(этилен)
полимер
(полиэтилен)
n – степень полимеризации.









 Химия
Химия