Похожие презентации:
V група періодичної системи Менделєєва
1.
Тема:V ГРУПА ПЕРІОДИЧНОЇ СИСТЕМИ
Д. МЕНДЕЛЄЄВА (підгрупа Нітрогену)
1. Загальна характеристика елементів
2. Нітроген. Оксиди Нітрогену.
Властивості, одержання, застосування
3. Нітратна кислота. Властивості, застосування.
4. Солі нітратної кислоти.
5. Фосфор, характеристика, властивості, застосування.
6. Сполуки фосфору. Властивості, значення, застосування.
7. Ортофосфатна кислота.
Значення, властивості застосування.
8. Арсен, Стибій, Бісмут. Значення, властивості.
2.
V група періодичної системи МенделєєваПідргупа Нітрогену
3.
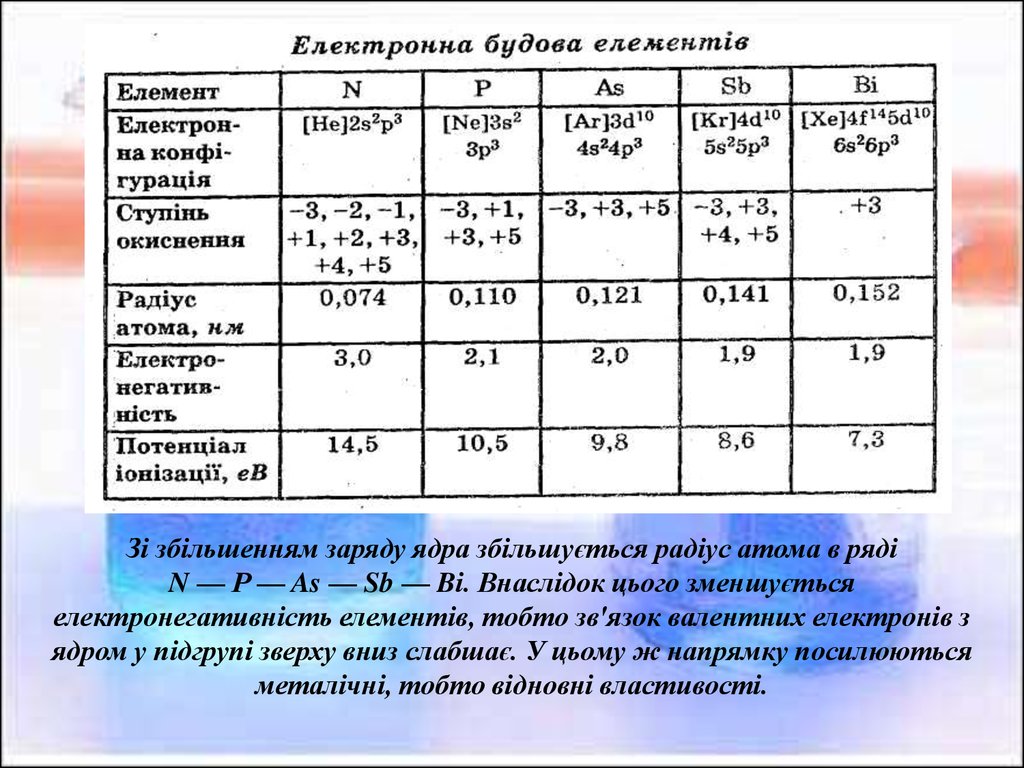
Зі збільшенням заряду ядра збільшується радіус атома в рядіN — Р — As — Sb — Bі. Внаслідок цього зменшується
електронегативність елементів, тобто зв'язок валентних електронів з
ядром у підгрупі зверху вниз слабшає. У цьому ж напрямку посилюються
металічні, тобто відновні властивості.
4.
Хімічні властивостіЕлементи головної підгрупи V групи утворюють сполуки з Гідрогеном
(загальна формула RH3), Оксигеном (загальна формула R2O3 або R2O5) і з металами,
у яких ці елементи проявляють ступінь окиснення -3.
Кислотні властивості оксидів у ряді N — Р — As — Sb — Ві зменшуються
(N2O5 і Р2О5, As2O3 — типові кислотні оксиди, Sb2O3 — амфортерні оксиди,
Ві2О3 — основний оксид).
5.
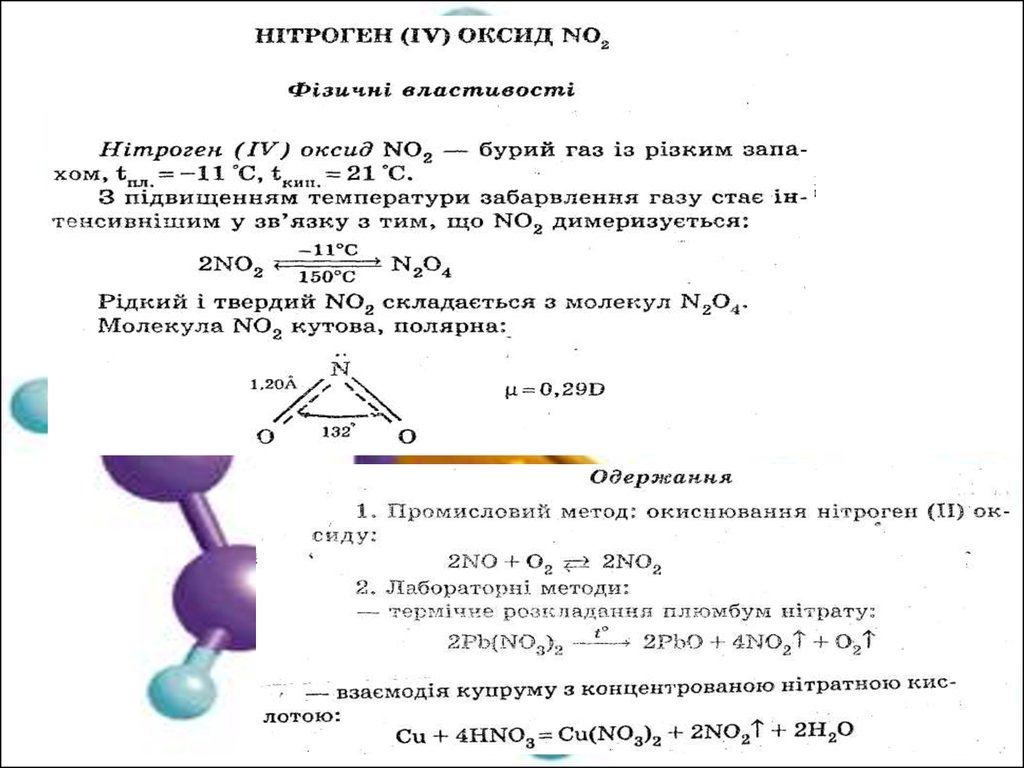
Нітроген. Сполуки нітрогену6.
АМОНІАКФізичні властивості
Амоніак NH3 — безбарвний газ із характерним запахом, tпл. = -78°С, tкип. = -33 °С.
Добре розчинний у воді (розчин відомий як аміачна вода або нашатирний спирт).
Молекула NH3 має форму тригональної піраміди, полярна:
Між молекулами амоніаку існує водневий
зв'язок завдяки неподіленій парі електронів на
Нітрогені й полярності зв'язку N-H.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
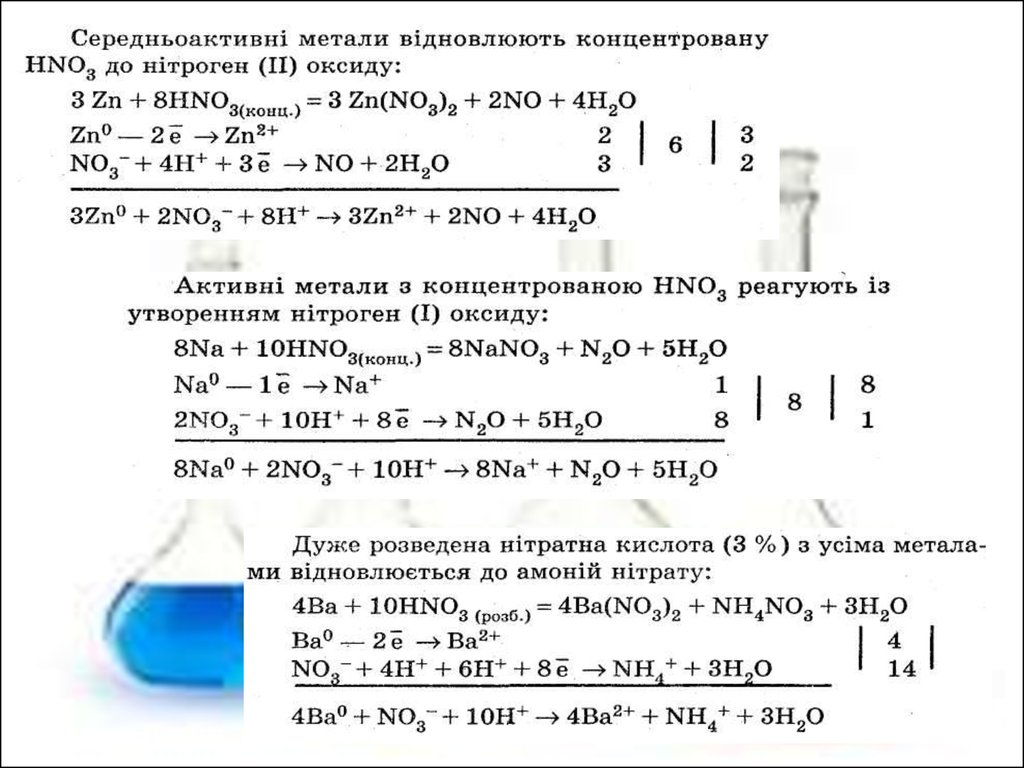
Реакції, у які вступає нітратна кислота (взаємодія з солями) якправило оборотні, оскільки практично всі нітрати розчинні у воді.
До кінця проходять реакції взаємодії нітратної кислоти з солями
карбонатної, силікатної, сірководневої й сірчистої кислот
(продукти виходять зі сфери реакції):
17.
18.
19.
20.
21.
22.
23.
24.
25.
Азот необхідний усім організмам, оскільки входить до складу молекулживих клітин, наприклад білків. Рідкий азот знаходиться при
температурі (-1960С). Його застосовують для заморожування
продуктів, тканин тощо. Наприклад: Пакети з чіпсами заповнюють
газуватим азотом, щоб вони зберігали свіжість. (Якщо в пакеті
залишиться повітря, чіпси псуються). Таз в пакеті також захищає
чіпси від ушкодження при транспортуванні.
Аміак використовують у
виробництві нітратної кислоти,
побутових речовин для чищення,
пластмаси.
NaNO3 використовують у виробництві
вибухових речовин.
NH4NO3 використовують
у виробництві добрив.
Оксид нітрогену (IV)
(N2O) підтримує горіння
деяких активних речовин.
26.
КРУГООБІГ АЗОТУ У ПОВІТРІКругообіг азоту
Циркуляція азоту між
повітрям, тваринами,
рослинами та грунтом.
27.
Забруднення довкілляоксидами нітрогену
Місто влітку
Місто взимку
Утворення
фотохімічного смогу
28.
ФОСФОРФізичні властивості
Фосфор (Р) існує у вигляді трьох алотропних модифікацій, кожна з яких
відрізняється від інших своїми властивостями й будовою.
Білий фосфор —безбарвна м'яка кристалічна речовина. Зв'язки між його
молекулами слабкі, тому білий фосфор плавиться й кипить при досить низьких
температурах (tпл. = 44,1 °С, tкип. = 280 °С). Білий фосфор складається з молекул Р4,
які мають форму правильного тетраедра:
Не розчиняється у воді, але прекрасно розчиняється в ефірах, сірковуглеці, бензолі.
Є сильною отрутою й навіть у малих дозах діє смертельно.
Білий фосфор має високу хімічну активність. Навіть при слабкому нагріванні або
терті він запалюється. На повітрі легко окиснюється з виділенням великої
кількості теплоти, внаслідок чого може самозапалитися. Тому зберігають його під
шаром води, оберігаючи у такий спосіб від окиснення. Свою назву фосфор набув
завдяки здатності білого фосфору світитися в темряві (у перекладі із грецької
«фосфор» означає «світлоносний»).
29.
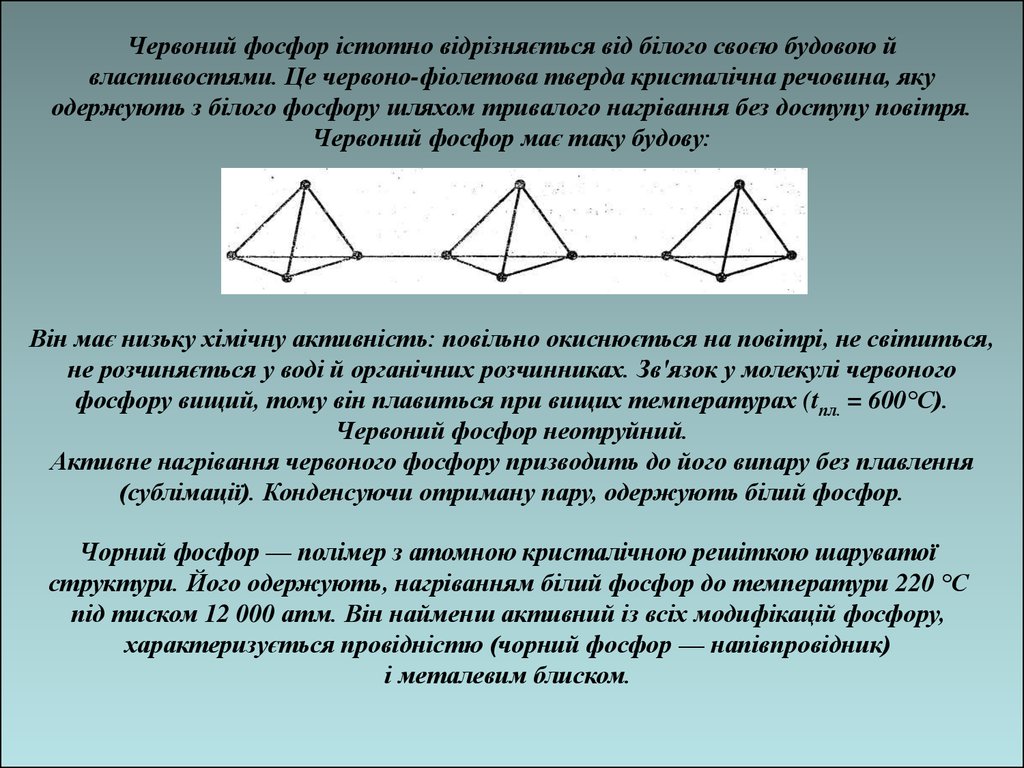
Червоний фосфор істотно відрізняється від білого своєю будовою йвластивостями. Це червоно-фіолетова тверда кристалічна речовина, яку
одержують з білого фосфору шляхом тривалого нагрівання без доступу повітря.
Червоний фосфор має таку будову:
Він має низьку хімічну активність: повільно окиснюється на повітрі, не світиться,
не розчиняється у воді й органічних розчинниках. Зв'язок у молекулі червоного
фосфору вищий, тому він плавиться при вищих температурах (tпл. = 600°С).
Червоний фосфор неотруйний.
Активне нагрівання червоного фосфору призводить до його випару без плавлення
(сублімації). Конденсуючи отриману пару, одержують білий фосфор.
Чорний фосфор — полімер з атомною кристалічною решіткою шаруватої
структури. Його одержують, нагріванням білий фосфор до температури 220 °С
під тиском 12 000 атм. Він найменш активний із всіх модифікацій фосфору,
характеризується провідністю (чорний фосфор — напівпровідник)
і металевим блиском.
30.
Хімічні властивостіФосфор — активний неметал, але його активність багато в чому залежить від
алотропної модифікації. Так, білий фосфор проявляє набагато більшу хімічну
активність, ніж червоний і чорний.
На зовнішньому електронному шарі Фосфору 5 валентних електронів, тому
Фосфор повинен проявляти окисні властивості, прагнучи приєднати три відсутні
електрони. Однак виявляється, що йому енергетично вигідніше віддати 5 своїх
електронів. Це відбувається завдяки тому, що радіус атома Фосфору досить
великий, а потенціал іонізації малий. Тому в сполуках Фосфор частіше проявляє
ступінь окиснення +5, ніж -3.
Відновні властивості фосфору
проявляються в реакціях з неметалами
(галогенами, киснем, сіркою). При цьому
важливо, чи перебуває фосфор у надлишку
або нестачі (вищий ступінь окиснення
фосфор проявляє, якщо знаходиться в
недостатній кількості).
31.
Із сіркою фосфор взаємодіє при нагріванні, при цьому утворюються сульфідифосфору:
Взаємодія фосфору з воднем відбувається в дуже жорстких умовах (високі тиск
і температура), тому сполуку Фосфору й Гідрогену — фосфін РН3 —
одержують реакцією фосфору з гарячим лугом:
Застосування
Фосфор застосовується досить широко. Він використовується для одержання
напівпровідників (СаР, ZnP). Крім того, він входить до складу деяких сплавів,
наприклад, олов'янистих бронз. Горіння білого фосфору супроводжується
виділенням густого білого диму, тому білий фосфор використовується при
виготовленні боєприпасів, які створюють димову завісу.
Величезне значення в народному господарстві мають фосфоровмісні мінеральні
добрива, а також фосфорорганічні препарати, дія яких спрямована на знищення
комах-шкідників.
32.
33.
ЗастосуванняОсновною галуззю застосування фосфор (III) оксиду є одержання фосфористої
кислоти. Фосфор (V) оксид використовують для осушення газів (у лабораторіях),
а також як вихідний реагент при виробництві фосфорних кислот.
34.
35.
Хімічні властивостіН3РО4 — кислота слабкої сили, у водяному розчині східчасто дисоціює:
36.
ЗастосуванняН3РО4 застосовується для виробництва мінеральних добрив — солей
ортофосфорної кислоти.
Фосфорні добрива. Фосфор є незамінним елементом для нормальної
життєдіяльності рослин, однак природним шляхом нестачу фосфору в ґрунті не
поповнює. Мінеральні добрива, що містять зв'язаний фосфор, дозволяють успішно
вирішувати цю проблему.
37.
38.
Горіння червоного фосфору у кисніПісля завершення
реакції на стінці та
дні колби осідають
дрібні кристали
оксиду фосфору (V)
Апатит – мінерал
(зліва) і бірюза
(справа) містить
фосфор
На головці сірника
містяться сполуки
фосфору, які мають
здатність загорятись
Живі організми,
наприклад, рослини
містять сполуки
фосфору, які сприяють
їхньому інтенсивному
росту
39.
АРСЕНФізичні властивості
Арсен As (миш'як) — тверда кристалічна речовина сіро-сталевого кольору.
Алотропні модифікації
Сірий миш'як — крихка кристалічна речовина з металевим блиском. На повітрі
покривається тонкою плівкою оксиду. Найстійкіша форма миш'яку.
Жовтий миш'як — прозора кристалічна речовина, схожа за властивостями на
білий фосфор. Під дією світла або температури переходить у сірий миш'як.
Чорний миш'як — склоподібно-аморфна модифікація миш'яку. Нестійка форма,
що при нагріванні переходить у сірий миш'як.
Бурий миш'як — аморфна речовина буруватого кольору. При температурі > 270 °С
перетворюється на сірий миш'як.
40.
Значення для людиниБере участь в окисно-відновних процесах, вуглеводному обміні, процесах гліколізу й
т. д. Міститься у складі сполук у різних тканинах людського організму. У великих
кількостях отруйний.
Застосування
1. Миш'як додають у свинець при виробництві рушничного дробу.
2. Як замінник сурми використовується в друкарстві.
3. Сполуки миш'яку використовуються в медицині.
СПОЛУКИ АРСЕНА
Органічні сполуки миш'яку (амінарсон, осарсол, новарсенал та ін.) застосовуються
для лікування сифілісу й протозойних інфекцій.
Неорганічні сполуки (натрій арсеніт, калій арсеніт, миш'яковий ангідрид)
застосовують у медицині як загальнозміцнювальні й тонізуючі препарати, а також
для лікування псоріазу. При місцевому застосуванні препарати миш'яку викликають
некротизацію тканин. Ця властивість широко застосовується в стоматології.
41.
СТИБІЙФізичні властивості
Стибій Sb (сурма) — сріблясто-білий метал із синюватим відтінком.
Кристалічна сурма крихка, не піддається куванню. Відомі три аморфні форми
сурми: вибухова, чорна й жовта. Жовта й чорна — нестійкі, при низьких
температурах переходять у звичайну (кристалічну).
Одержання
Пірометалургійна й гідрометалургійна переробка концентратів або руди,
що містить сурму.
42.
Застосування1. У вигляді сплавів з оловом, свинцем — для акумуляторних пластин,
при виготовленні підшипників, кабелів та ін.
2. У типографській справі.
3. При виготовленні напівпровідникових матеріалів.
4. У медицині — для лікування захворювань, що викликаються
найпростішими, амебами й ін.
СПОЛУКИ СТИБІЮ
Солі стибію застосовуються як відновники у різних хімічних процесах.
Всі сполуки сурми отруйні.
43.
БІСМУТФізичні властивості
Вісмут Ві (вісмут) — сріблясто-сірий метал з рожевуватим відтінком.
Крихкий, легко розколюється за площинами спайності.
Одержання
Бісмут є побічним продуктом вогневого рафінування свинцю.
Хімічні властивості
1. У вологому повітрі спостерігається поверхневе окиснення бісмуту.
2. При високій температурі (>1000 0С) горить із утворенням оксиду Ві2О3.
3. Розчиняється в концентрованих нітратній і сульфатній кислотах з виділенням
сірчистого газу.
Значення для людини
Має антисептичні властивості. Солі бісмуту отруйні.
Застосування:
1. У сполуках з телуром використовується для термоелектрогенераторів.
2. При виготовленні скла й кераміки.
3. У фармацевтичній промисловості — як антисептичний, протизапальний засіб.
СПОЛУКИ БІСМУТУ
Оксиди бісмуту застосовуються в хімічній промисловості для одержання солей
бісмуту. Бісмут нітрат входить до складу деяких медичних препаратів
(вікалін, вікаїр, бісмоверол та ін.)
44.
ЛІТЕРАТУРА1.Романова Н.В. Загальна та неорганічна
хімія: підручник для студентів вищ. Навч.
закладів. – Київ; Ірпінь: ВТФ «Перун»,
1998. – 480 с.
2. Карнаухов О.І., Мельничук Д.О. та ін.
Загальна та біонеорганічна хімія:
Підручник для студентів
сільськогосподарських спеціальностей
вищих аграрних навчальних закладів. –
Вінниця: Нова книга, 2003. – 544 с.








































 Химия
Химия








