Похожие презентации:
Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов
1. Ретровирусы и ретровирусные векторы МГУ В.С. Прасолов
Лабораториябиологии клетки
Институт молекулярной биологии им. В.А. Энгельгардта РАН
2. Открытие вирусов
1892 годД.И.Ивановский – инфекционный фильтрующийся агент,
вызывающий табачную мозаику.
1898 год
M.Beijerinck - “contagium vivum fluidum”.
Loeffler & Frosch – foot-and- mouth disease
1908 год
Ellerman & Bang – ALV
1911 год
P.Rous - RSV
3.
Ретровирусы4.
Классификация ретровирусов5.
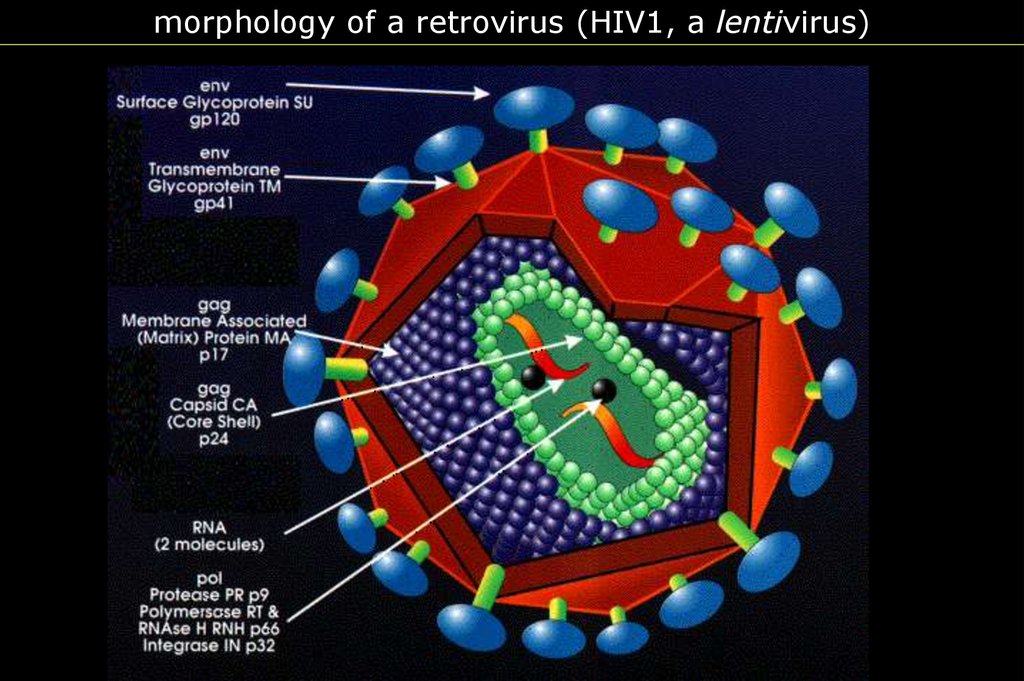
morphology of a retrovirus (HIV1, a lentivirus)6.
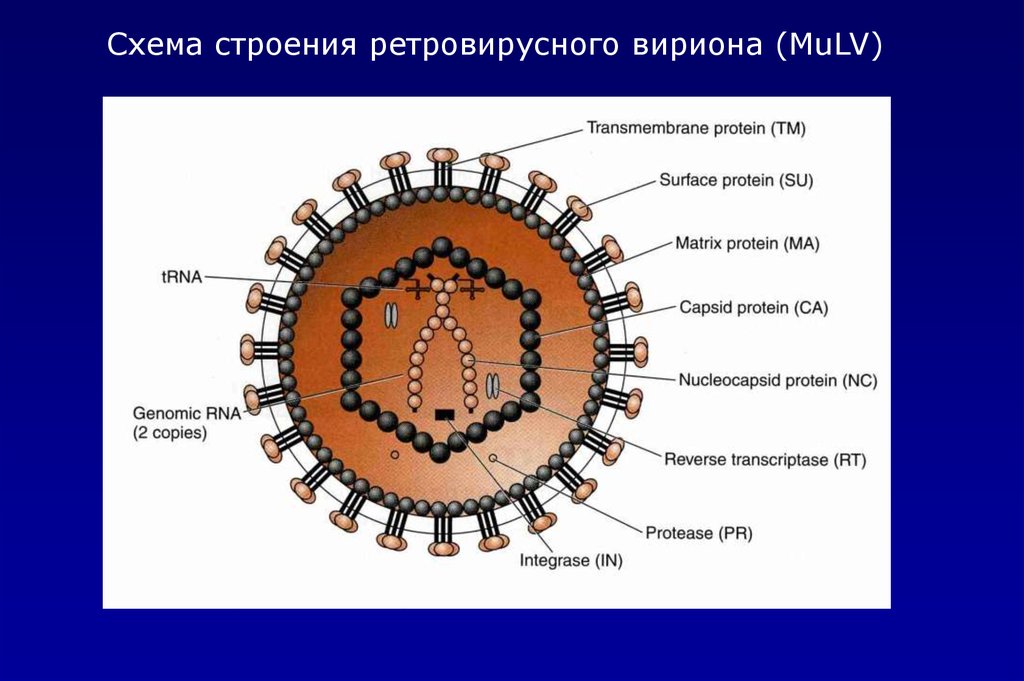
Схема строения ретровирусного вириона (MuLV)7.
Гены простых и сложных ретровирусов8.
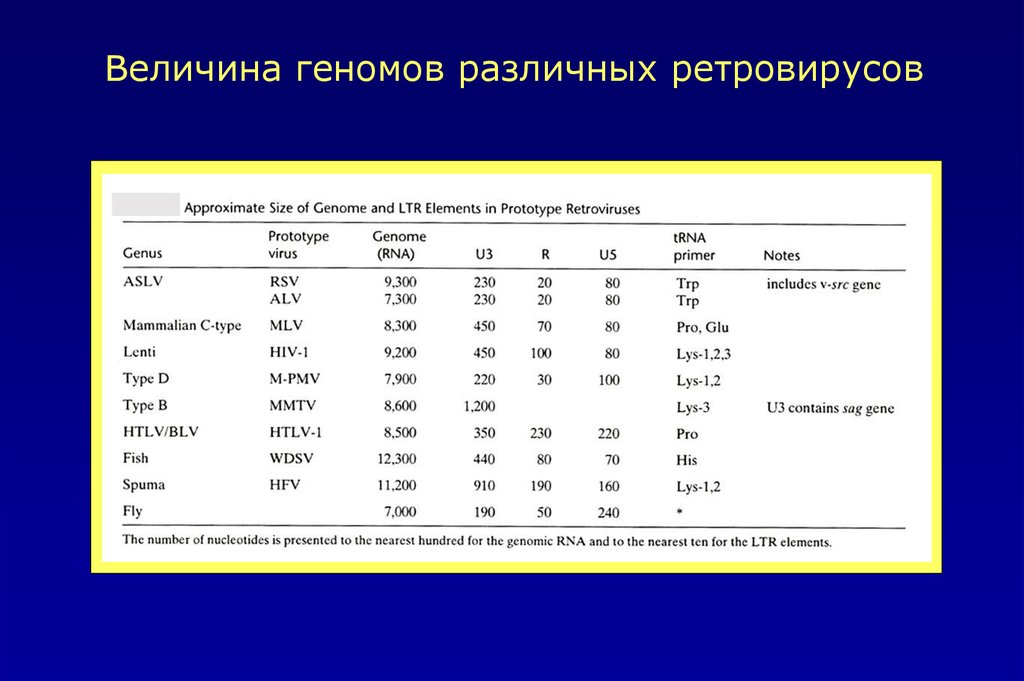
Величина геномов различных ретровирусов9.
Структура геномной РНК простого ретровируса10.
Геномная организация различных ретровирусов11.
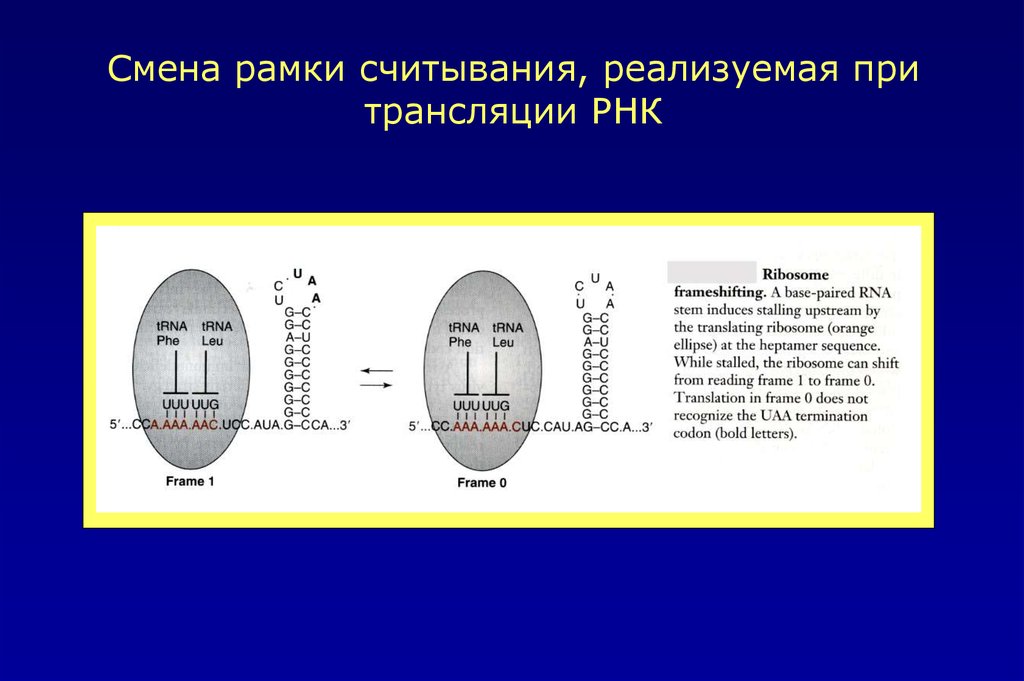
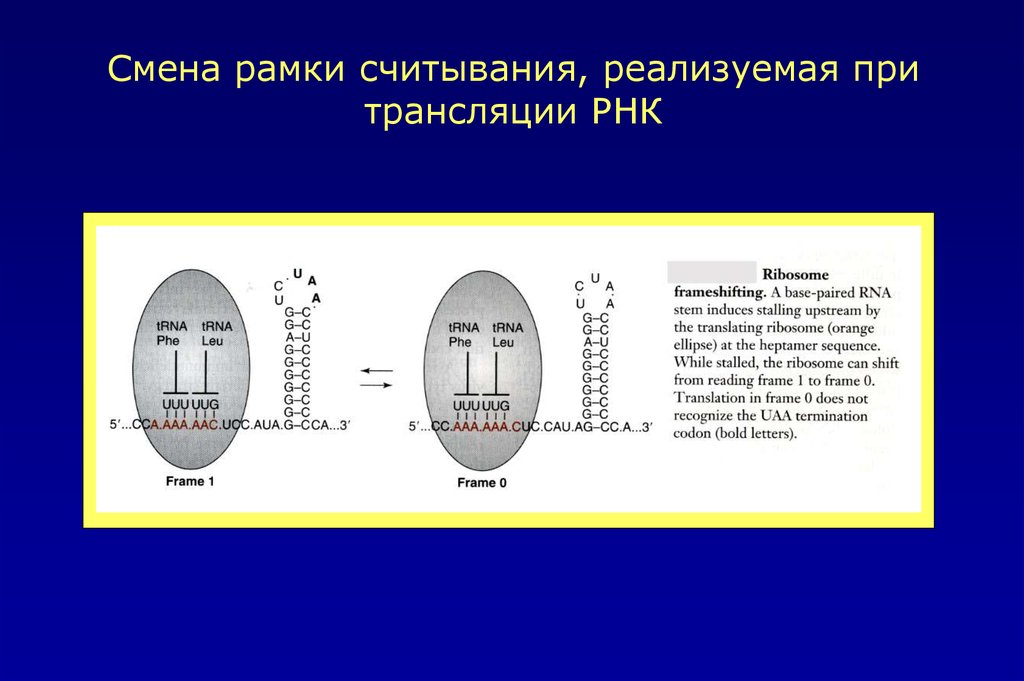
Смена рамки считывания, реализуемая притрансляции РНК
12.
Образование двух форм ретровирусной РНК13.
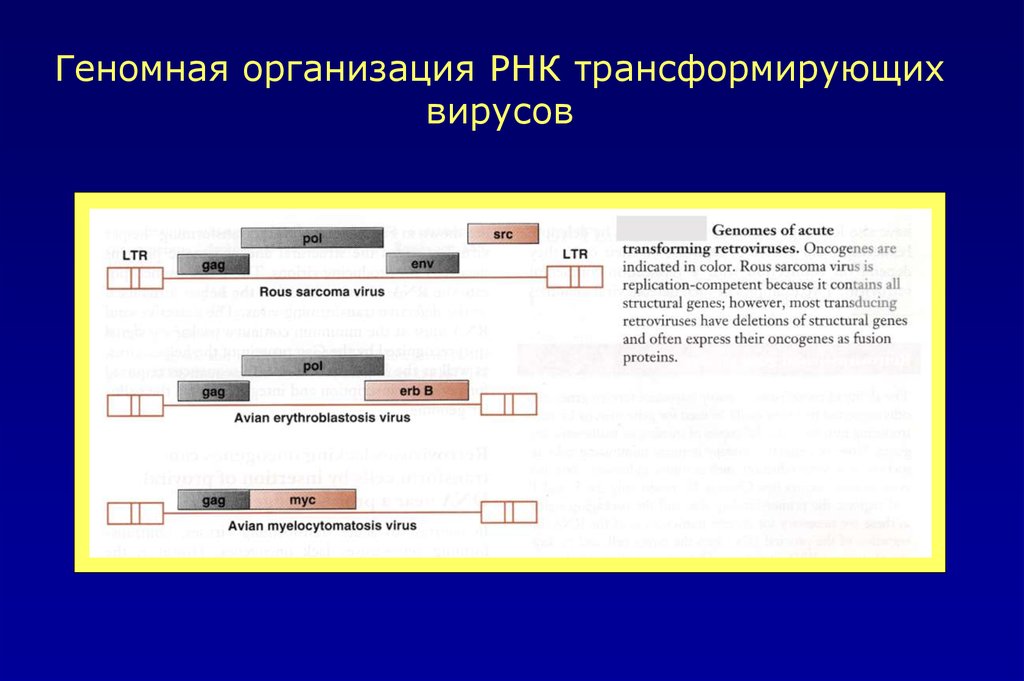
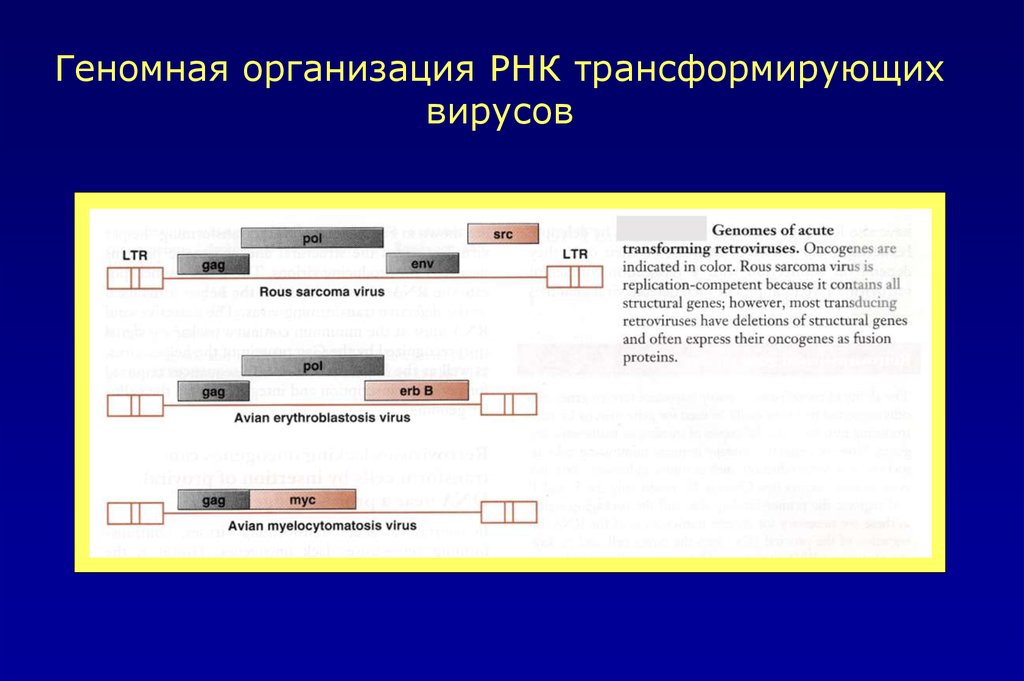
Геномная организация РНК трансформирующихвирусов
14.
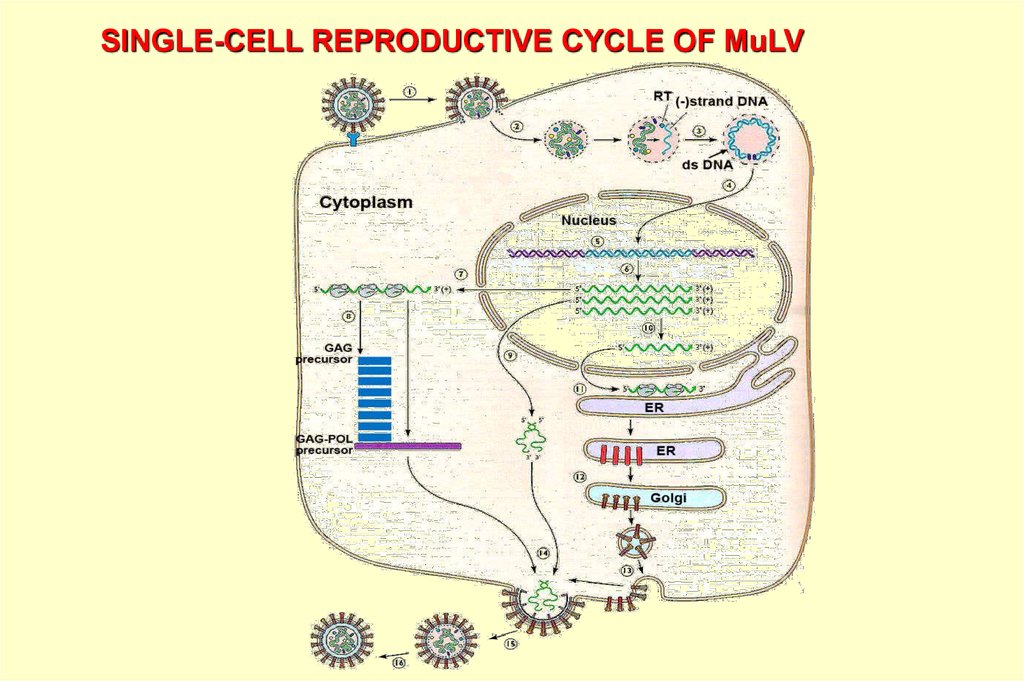
SINGLE-CELL REPRODUCTIVE CYCLE OF MuLV15.
Организация белков оболочки различныхретровирусов
16.
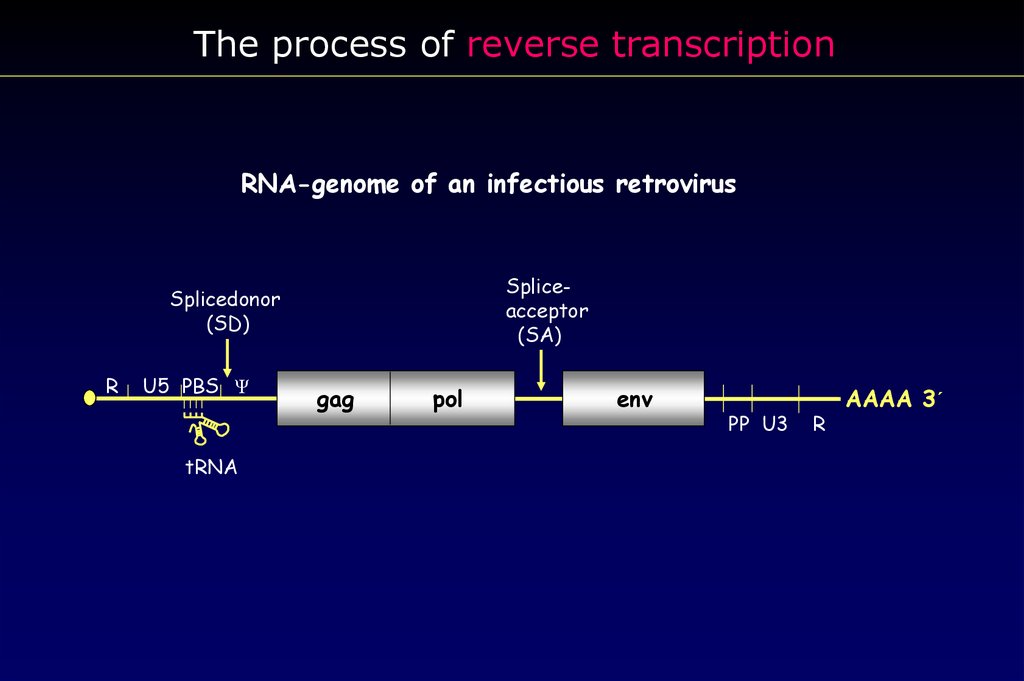
The process of reverse transcriptionRNA-genome of an infectious retrovirus
Spliceacceptor
(SA)
Splicedonor
(SD)
R
U5 PBS Ψ
tRNA
gag
pol
env
PP U3
R
AAAA 3´
17.
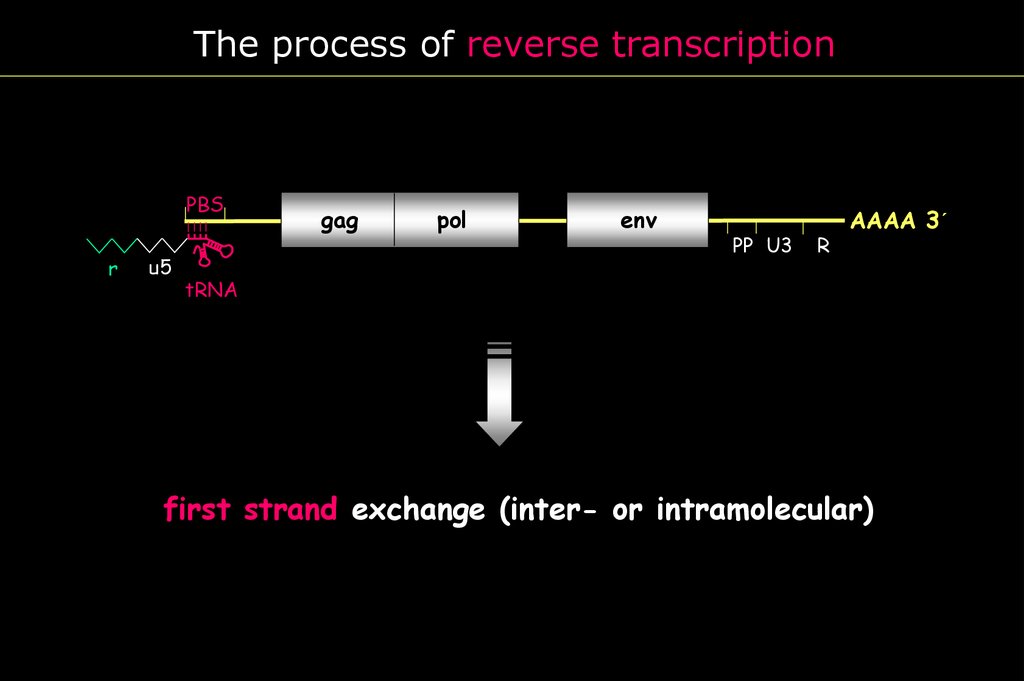
The process of reverse transcriptionR
r
U5 PBS
u5
gag
pol
env
PP U3
R
AAAA 3´
tRNA
first strand exchange (inter- or intramolecular)
18.
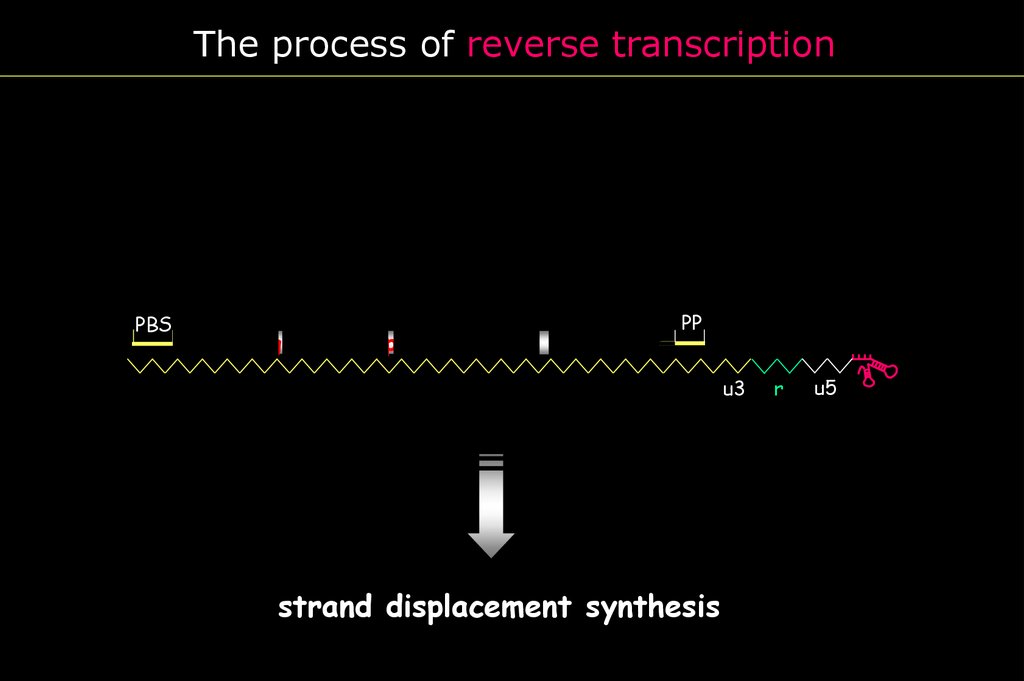
The process of reverse transcriptionPBS
gag
pol
env
PP U3
R
u3
r
strand displacement synthesis
u5
19.
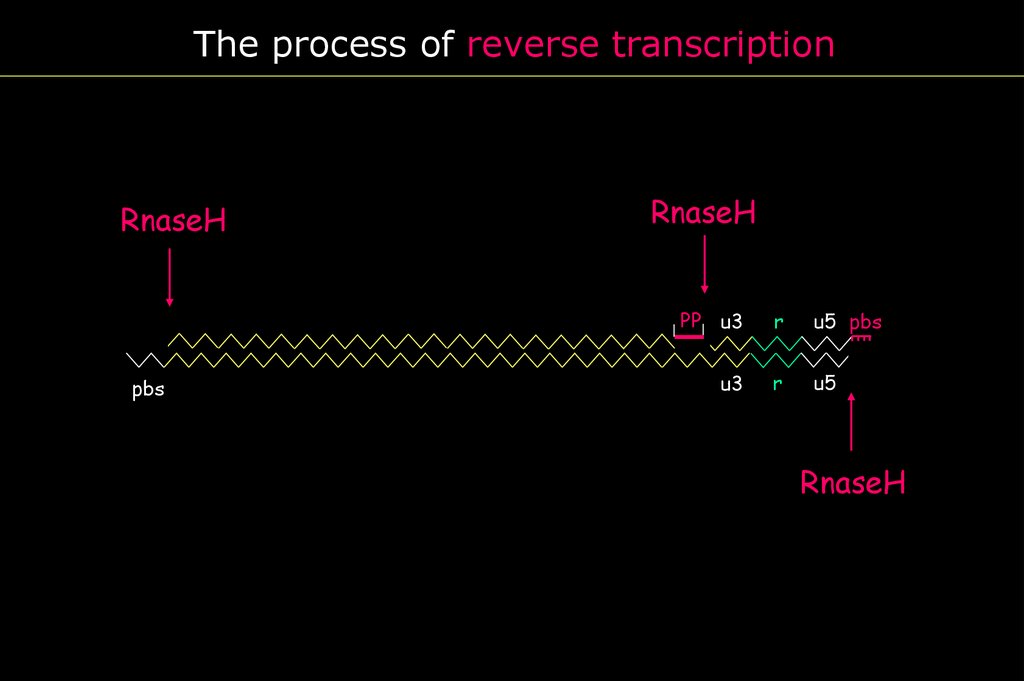
The process of reverse transcriptionRnaseH
RnaseH
PBS
PP u3
r
u5 pbs
pbs
u3
r
u5
RnaseH
20.
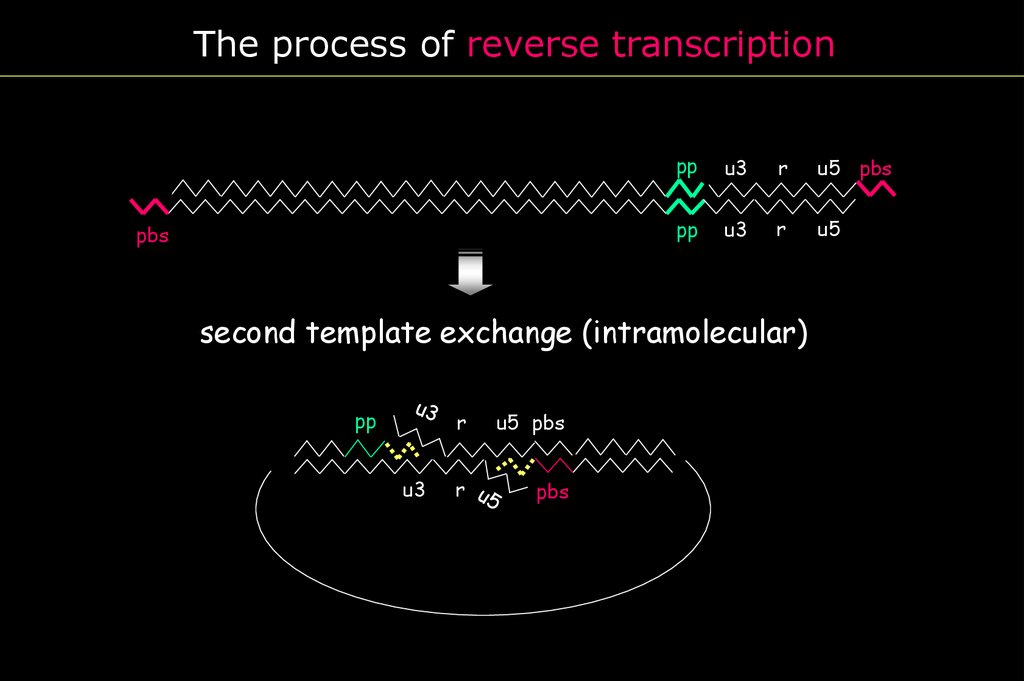
The process of reverse transcriptionPBS
pp
u3
r
u5 pbs
pbs
pp
u3
r
u5
second template exchange (intramolecular)
pp
u3
r
u5 pbs
r
pbs
21.
The process of reverse transcriptionu3
r
u5 pbs
pp
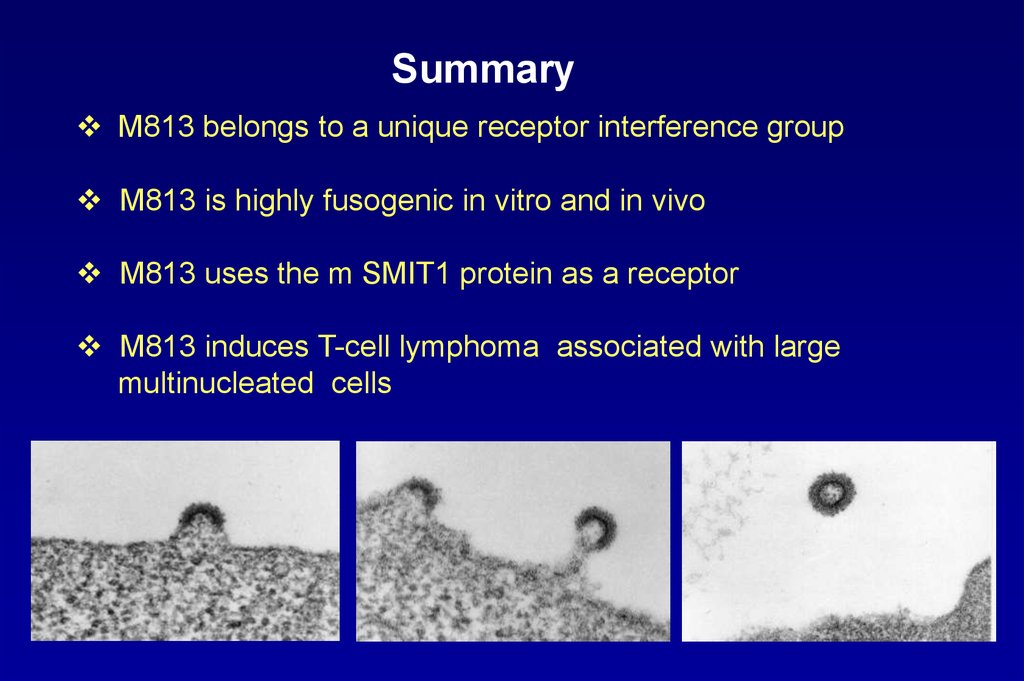
u3
r
u5
u3
r
u5 pbs
pp
u3
r
u5
who was copied to where ?
U3
r
u5 pbs
pp
U3
r
U5
U3
r
U5
pbs
pp
u3
r
u5
22.
Схема обратной транскрипции23.
Genomic organization of murine retroviruses24.
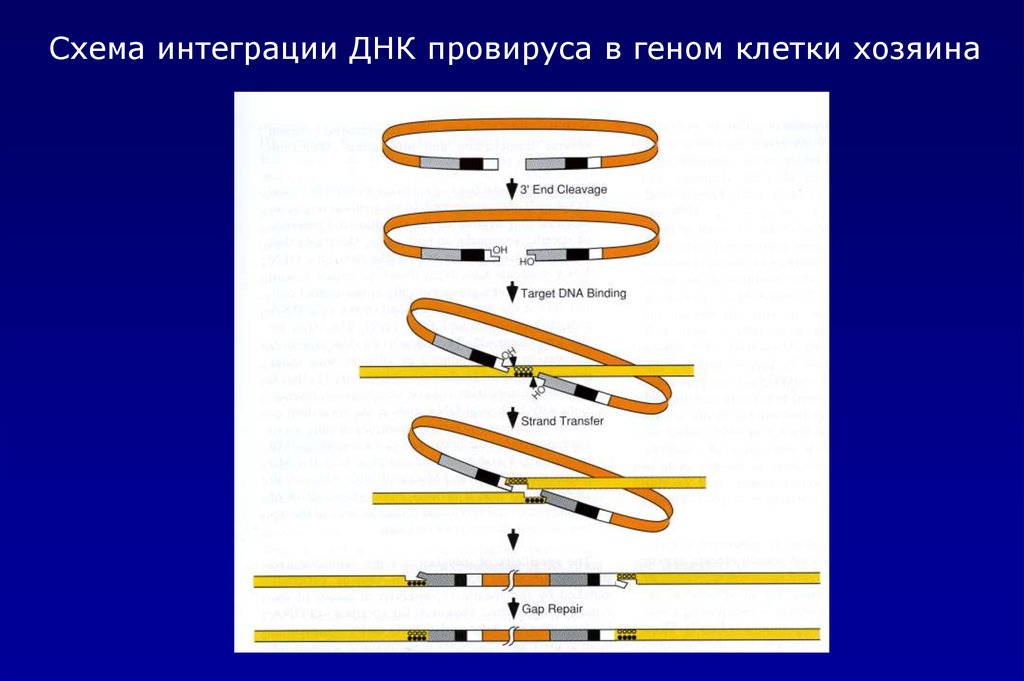
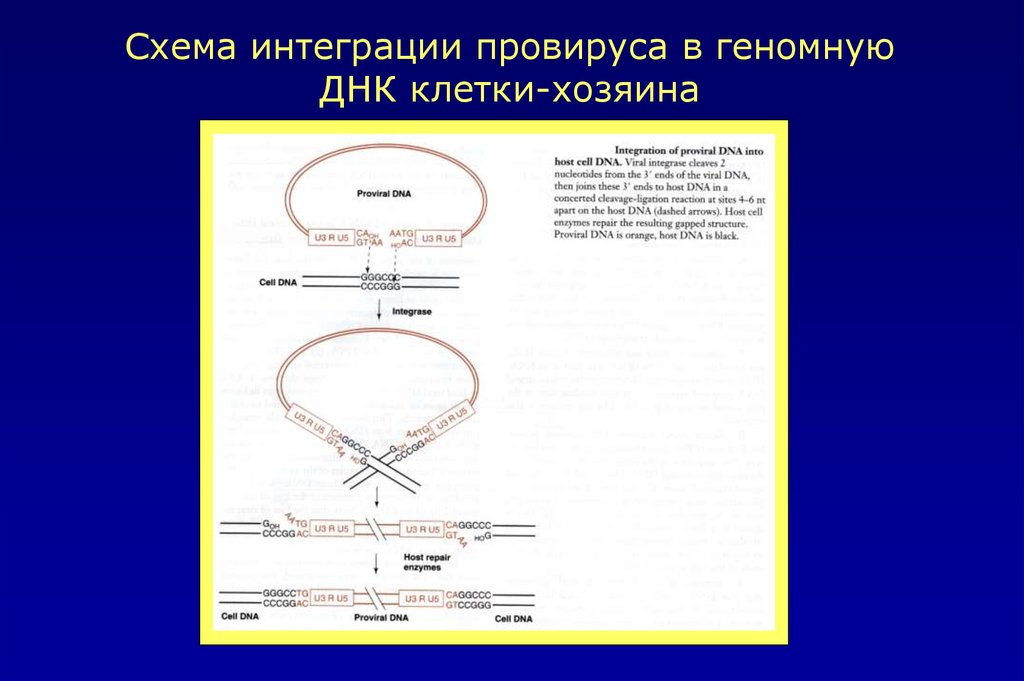
Схема интеграции ДНК провируса в геном клетки хозяина25.
Схема интеграции провируса в геномнуюДНК клетки-хозяина
26.
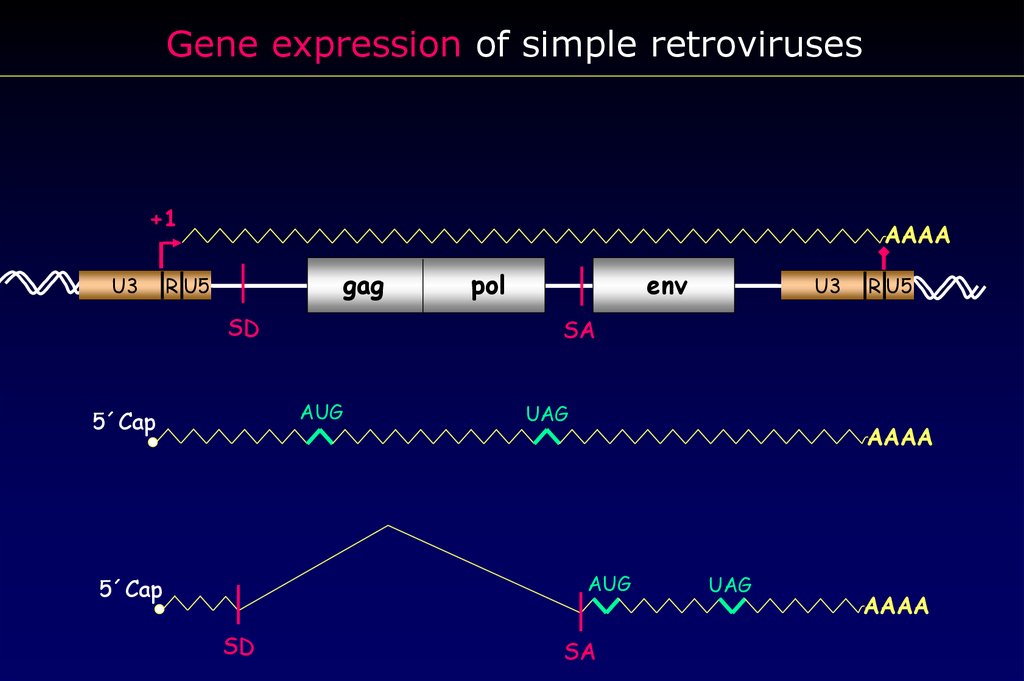
Образование молекул РНК простого ретровируса27.
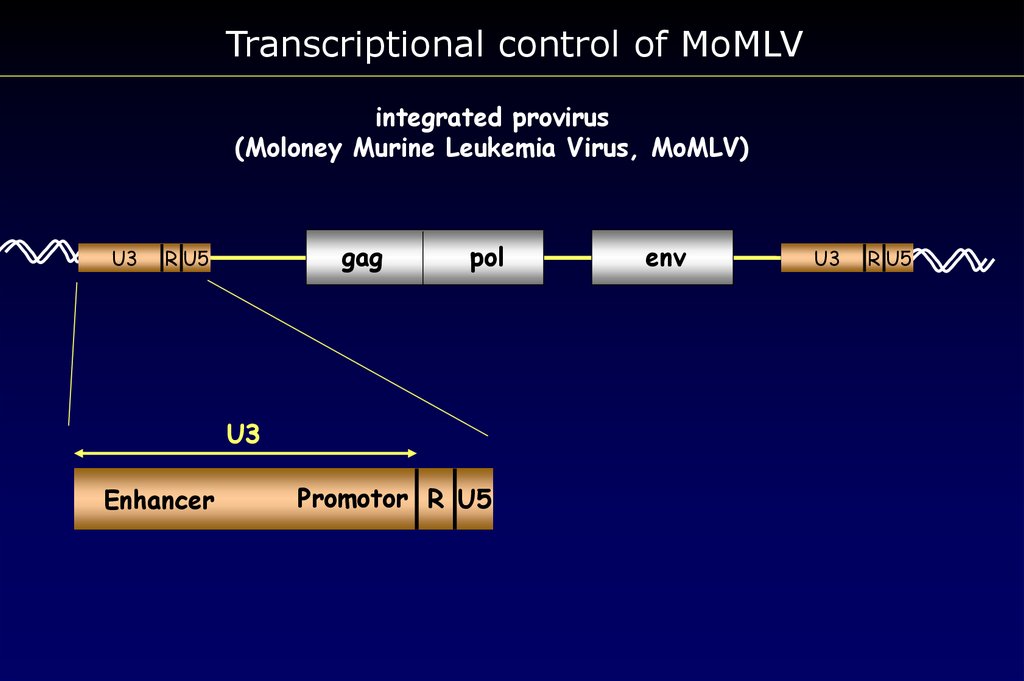
Transcriptional control of MoMLVintegrated provirus
(Moloney Murine Leukemia Virus, MoMLV)
U3
gag
R U5
pol
U3
Enhancer
Promotor R U5
env
U3
R U5
28.
Gene expression of simple retroviruses+1
U3
AAAA
gag
R U5
SD
env
UAG
SD
R U5
AAAA
AUG
5´Cap
U3
SA
AUG
5´Cap
pol
SA
UAG
AAAA
29.
gag-pol region of simple retrovirusesU3
gag
R U5
gag
MA
CA
pol
UAG
NC
PR
env
gag-pol
RT
U3
(5% of gag)
IN
R U5
30.
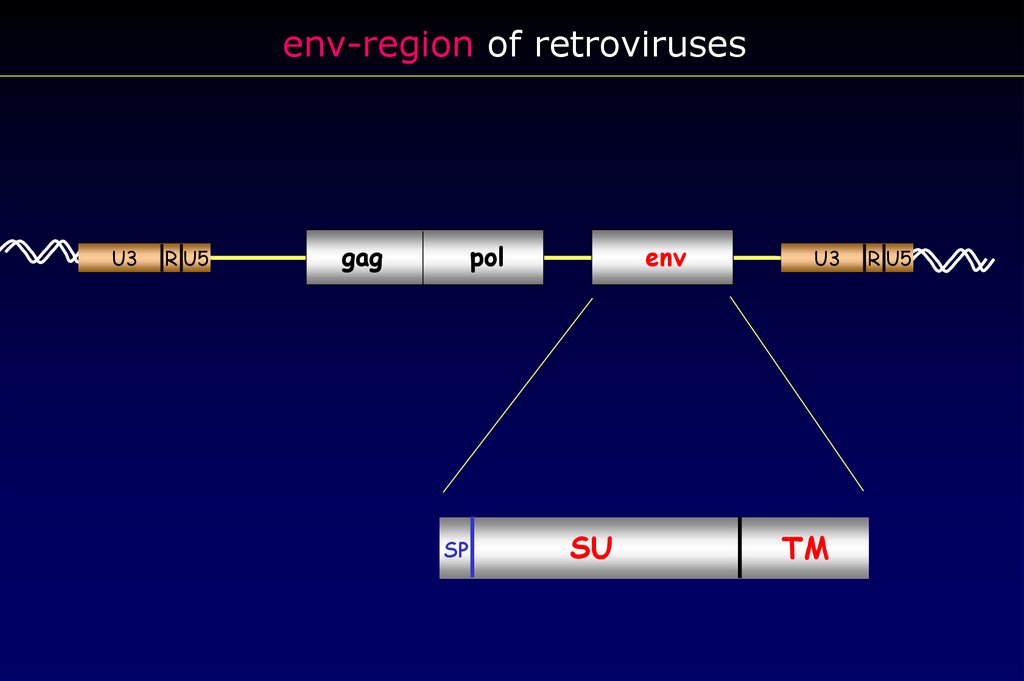
env-region of retrovirusesU3
R U5
gag
pol
SP
env
SU
U3
TM
R U5
31.
Packaging signal of retroviruses+1
U3
AAAA
gag
R U5
Y
5´Cap
Y
pol
env
SD
R U5
SA
AUG
UAG
AAAA
AUG
5´Cap
U3
SA
UAG
AAAA
32.
Смена рамки считывания, реализуемая притрансляции РНК
33.
Геномная организация РНК трансформирующихвирусов
34.
Лентивирусы – возбудители медленныхинфекций
35.
morphology of a retrovirus (HIV1, a lentivirus)36.
Схематическое изображение вируснойчастицы HIV-1
37.
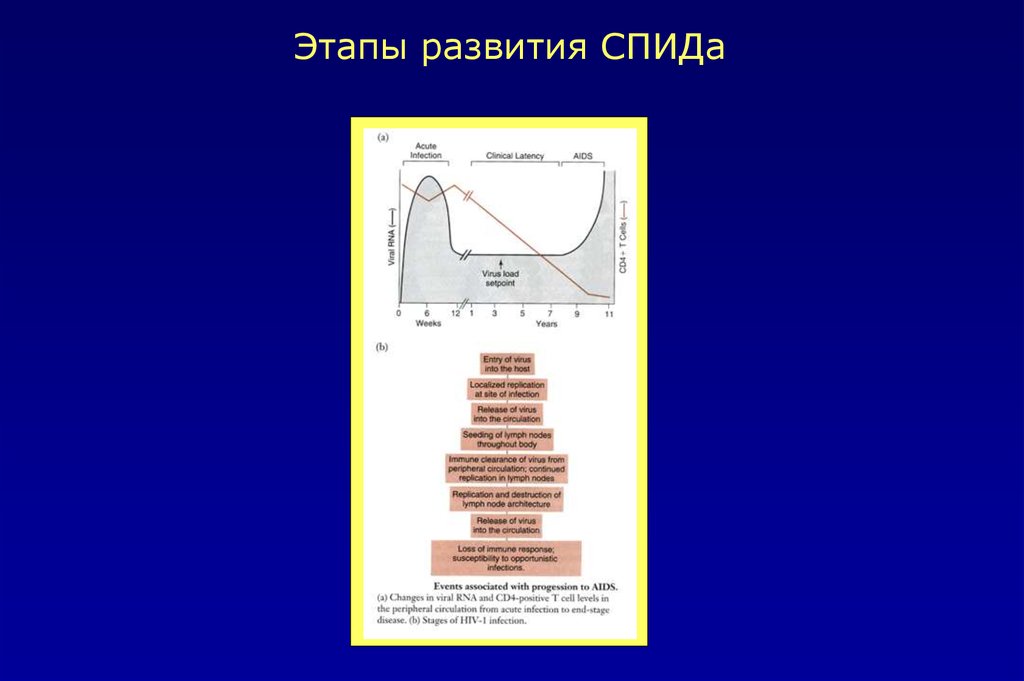
Этапы развития СПИДа38.
Лентивирусы млекопитающих39.
Структура генома и схема сплайсинга РНК HIV-140.
Структурные белки HIV-141.
Неструктурные белки HIV-142.
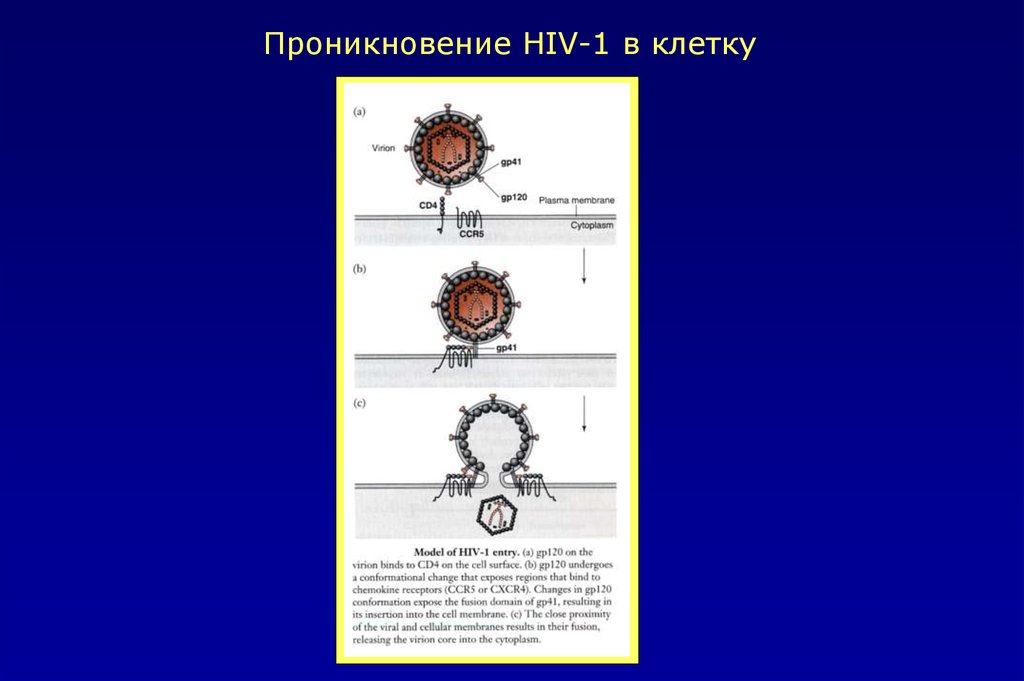
Проникновение HIV-1 в клетку43.
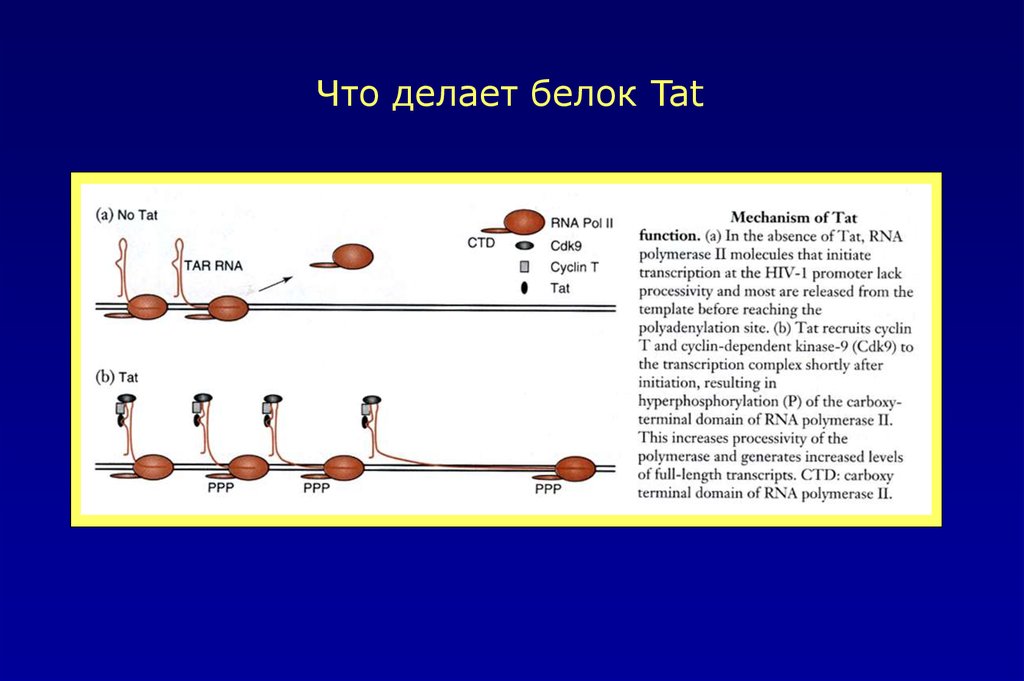
Что делает белок Tat44.
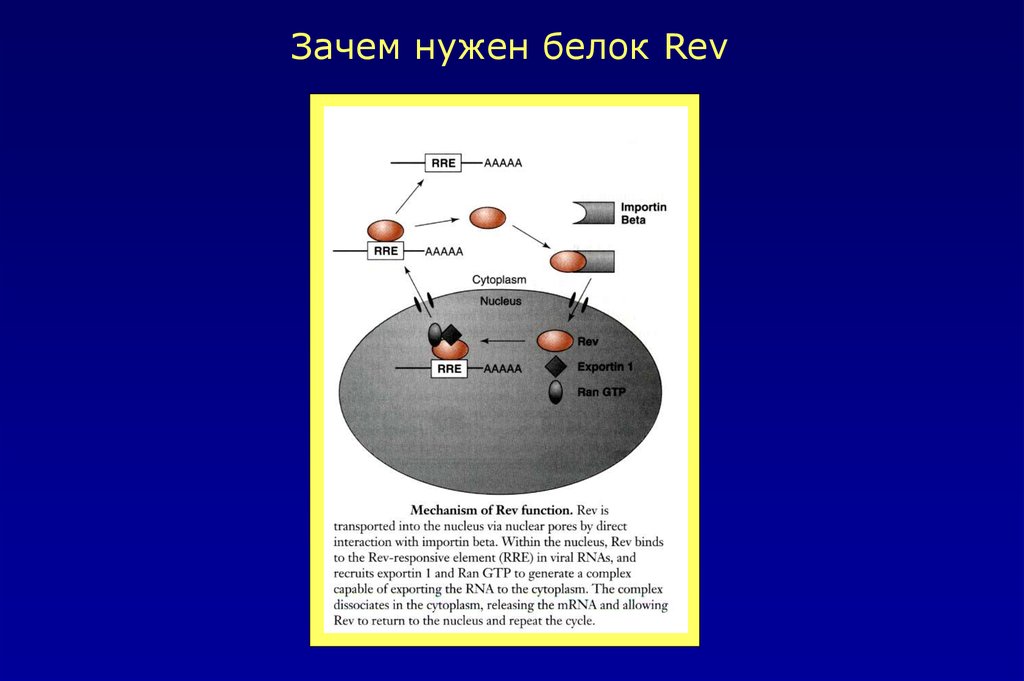
Зачем нужен белок Rev45.
Модуляция экспрессии поверхностногоантигена CD4
46.
Функции вирусных белков1.Белок Tat увеличивает транскрипцию провирусного генома HIV-1,
стимулируя элонгаторную активность РНК-полимеразы II.
2.Белок Rev1 способствует транспорту в цитоплазму вирусных
информационных РНК,
кодирующих структурные белки HIV-1. Tat и Rev белки в значительной степени стимулируют
синтез вирусных белков.
3.Белок Vif увеличивает инфекционность вируса HIV-1, взаимодействуя с клеточной
дезоксицитидин дезаминазой. (Vif, присоединяясь к клеточной дезаминазе CEM15 индуцируя
убиквитинизацию и последующую деградацию этого фермента протеосомами).
4. Белок Vpr важен для переноса преинтеграционного комплекса HIV-1 из цитоплазмы в
ядро.
5. Белок Vpu усиливает выход вирусного потомства из заражённой клетки.
6. Белок Nef – важный медиатор патогенеза (Nef снижает уровень экспрессии белков CD4 и
MHC на поверхности клетки. Влияет на инфекционность вируса и изменяет сигнальные пути:
взаимодействие Nef c src-родственными киназами lyn и hck, приводит к их активации. А
взаимодействие Nef с lyc и fyn приводит к их подавлению. Активация hck приводит к
увеличению экспрессии в T клетках ряда цитокинов и хемокинов, что в свою очередь
увеличивает репликацию HIV-1 и привлекает больше T-клеток к очагу заражения)
47.
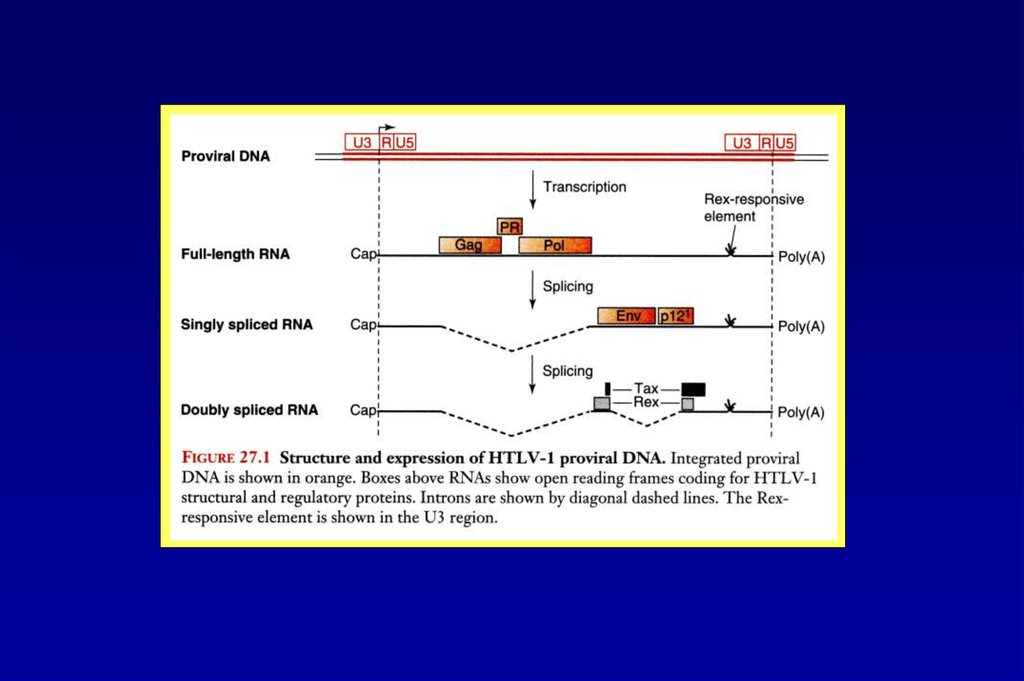
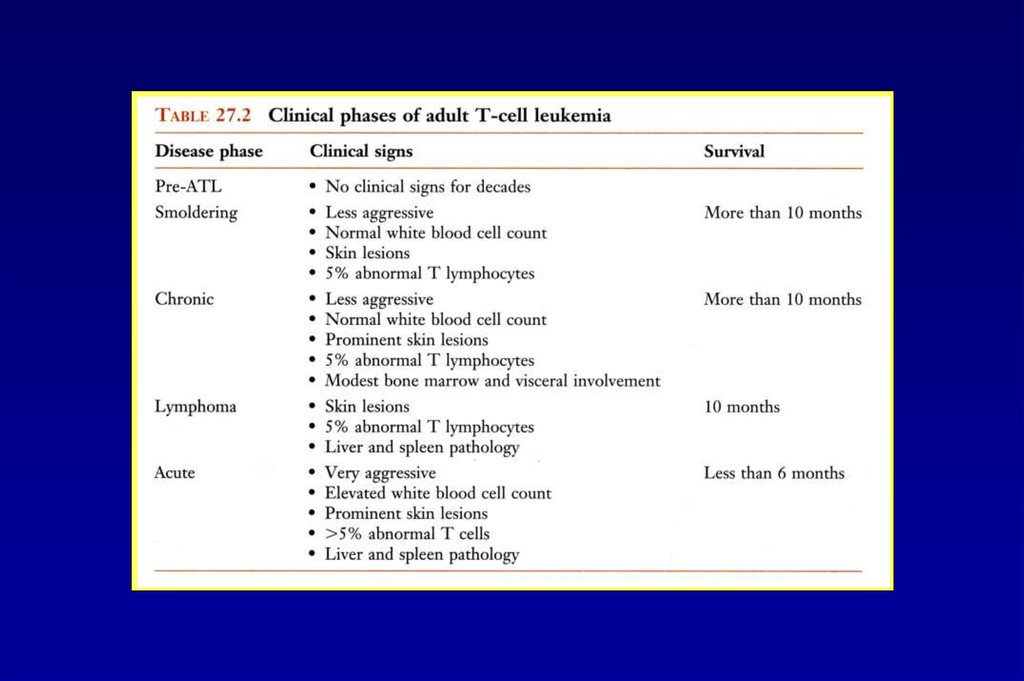
Вирус Т-клеточного лейкоза 1 типа человека48.
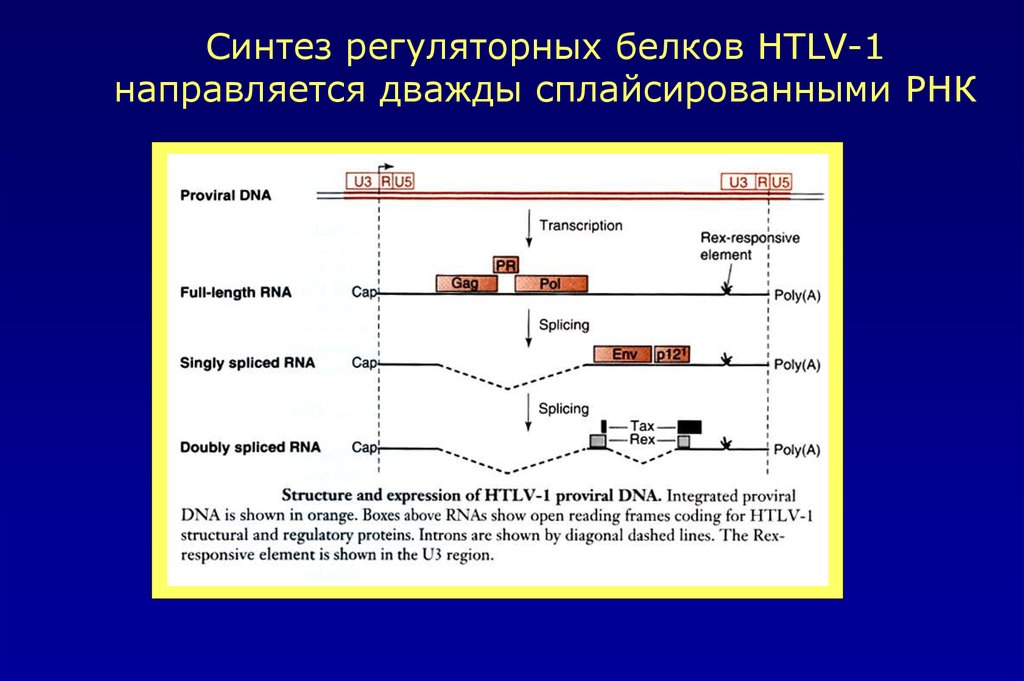
Синтез регуляторных белков HTLV-1направляется дважды сплайсированными РНК
49.
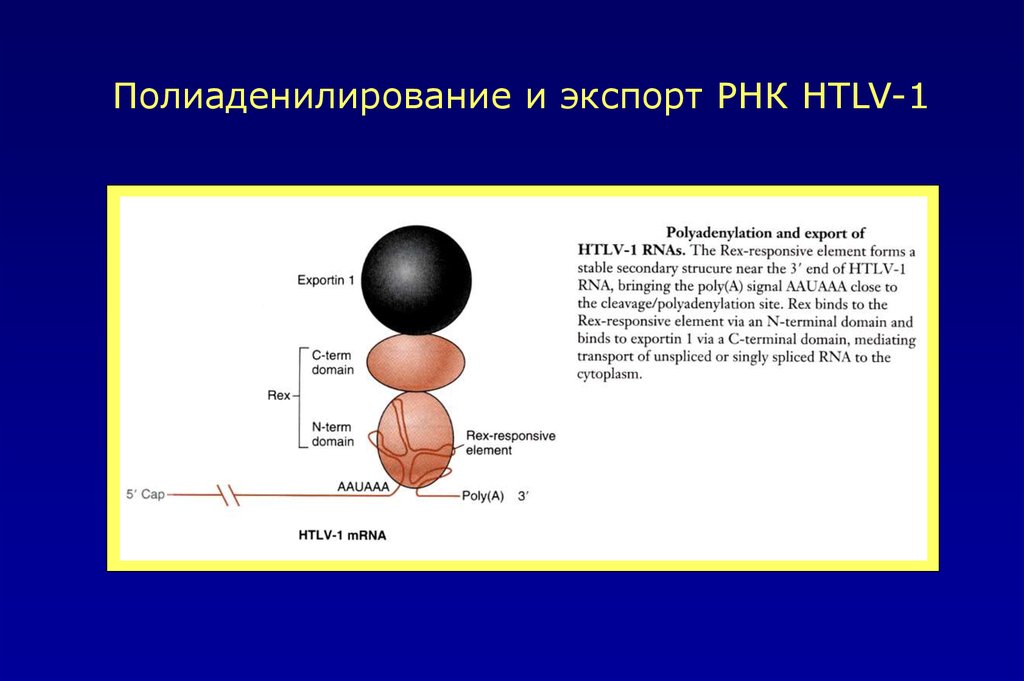
Полиаденилирование и экспорт РНК HTLV-150.
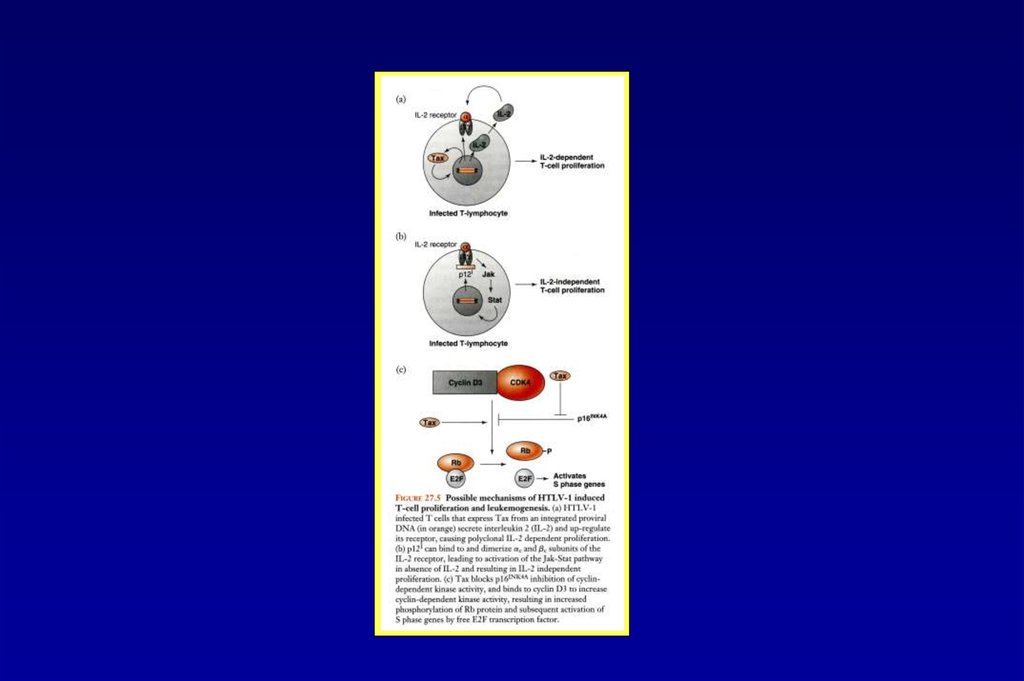
Белок Tax активирует транскрипцию РНК HTLV-151.
Клеточные гены, активируемые вирусным белком Tax52.
53.
54.
55.
56.
57.
58.
59.
60.
The concept of Gene Therapy61.
Необходимые свойства эффективной системыпереноса и экспрессии гена
Высокая эффективность переноса выбранного генетического
материала в клетки-мишени(in vivo и in vitro)
Простота и высокая воспроизводимость метода трансдукции
Стабильная экспрессия внесённого гена
Возможность направленной регуляции экспрессии
Регулируемый тропизм (способность избирательно вносить
экспрессируемые гены в клетки определённых типов)
62.
Выбор метода переноса и экспрессии целевыхгенов
1. Са-фосфатная трансфекция
Простота выполнения, быстрота и низкая стоимость
(не требует специального оборудования)
Применима лишь к ограниченному ряду клеток,
возможность использования только прикреплённых
клеток, низкая эффективность (0,01-2%)
Неконтролируемое число копий внесённого в геном
генетического материала
2. Липосомы (искуственные
мембраны)
Удобный и быстрый и достаточно “мягкий” способ
Высокая стоимость, для многих типов клеток –
низкая эффективность. Неконтролируемое число
копий внесённого в геном генетического материала
3. Электропорация
(электропробой)
Простой и быстрый метод. Возможность
использовать различные типы клеток.
Высокая гибель клеток при электропробое (30-50%)
Требует специального дорогостоящего оборудования.
Не может быть использован в генотерапевтических
целях. Возможны нарушения структуры хромосом.
4. Баллистический метод
(shortgun)
Быстрый метод, требующий опыта и не являющийся
универсальным. Требует специального
оборудования. Низкая воспроизводимость.
Сопровождается разрушением клеточных органелл и
хромосом, что может приводить к злокачественным
перерождениям клеток
63.
Выбор метода переноса и экспрессии целевыхгенов (продолжение)
5. Перенос и экспрессия генов с помощью вирусных векторов
Ретровирусные векторы:
Векторы на основе простых ретровирусов
Векторы на основе лентивирусов
Векторы на основе спумавирусов (пенящих
вирусов)
Высокая эффективность переноса (до 95-100%)
Широкий спектр действия.
Высокая пластичность. Отсутствие
цитотоксичности. Возможность избирательного
переноса и экспрессии в клетках различных
типов и различных организмов. Простота,
высокая воспроизводимость и низкая стоимость.
Отсутствие иммуногенности. Контролируемое
число копий интегрированных в геном клетокмишеней.
Вероятность повреждения клеточных генов в
месте интеграции векторов в геном
Векторы на основе аденовирусов
Высокая эффективность переноса. Низкая
цитотоксичность.Отсутствие интеграции в геном
трансдуцированной клетки. Нежелательная
иммуногенность. Невысокая пластичность.
Векторы на основе аденоассоциированного вируса
Векторы на основе вируса простого
герпеса
Интеграция в определённый участок 19-ой
хромосомы человека. Низкая эффективность.
Способность заражать неделящиеся клетки
(нервные). Невысокая воспроизводимость и
низкая эффективность
64.
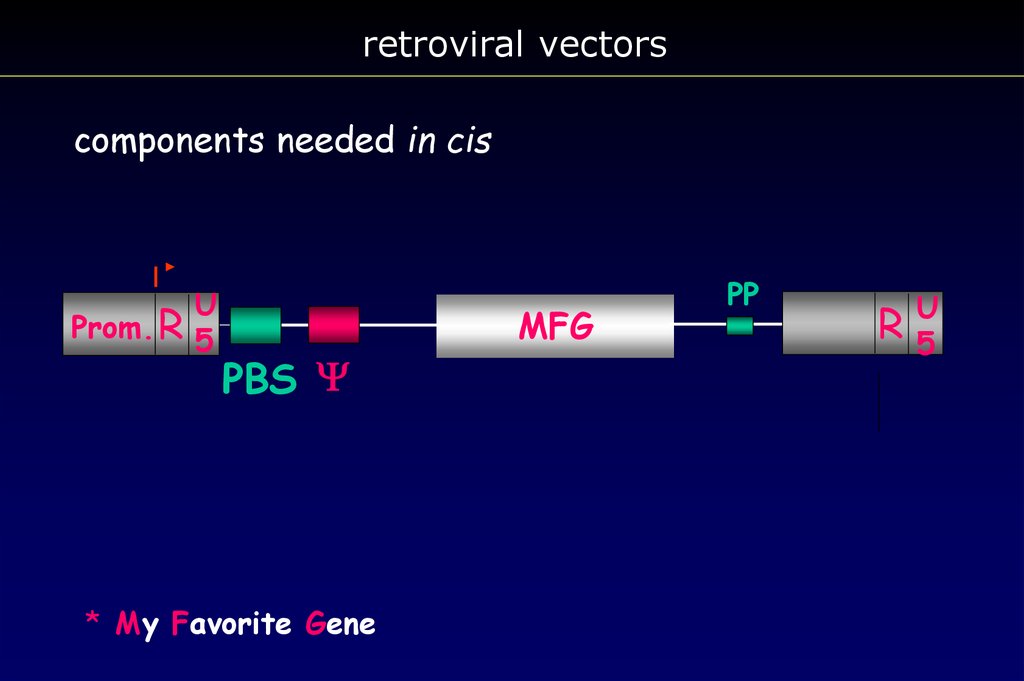
retroviral vectorscomponents needed in cis
Prom. R
U
5
PBS Y
* My Favorite Gene
MFG
PP
R
U
5
65.
retroviral vectorscomponents needed in trans
Pro
env
polyA
Pro
gag / pol
polyA
66.
retroviral replication / packaging of defective particles67.
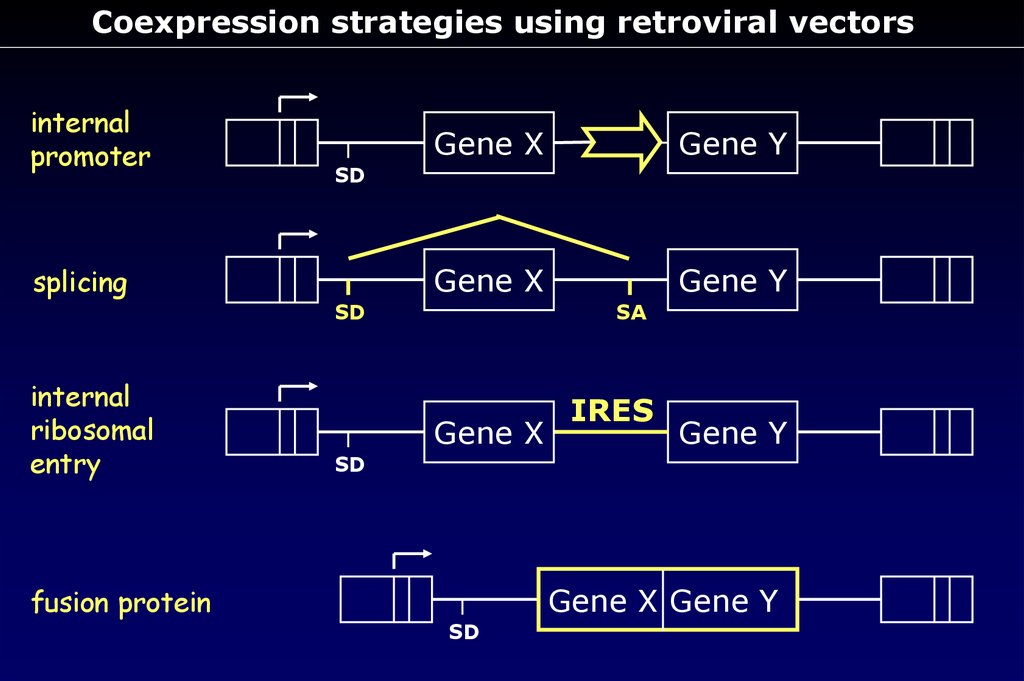
Coexpression strategies using retroviral vectorsinternal
promoter
splicing
internal
ribosomal
entry
fusion protein
Gene X
Gene Y
Gene X
Gene Y
SD
SD
SA
Gene X
IRES
Gene Y
SD
Gene X Gene Y
SD
68.
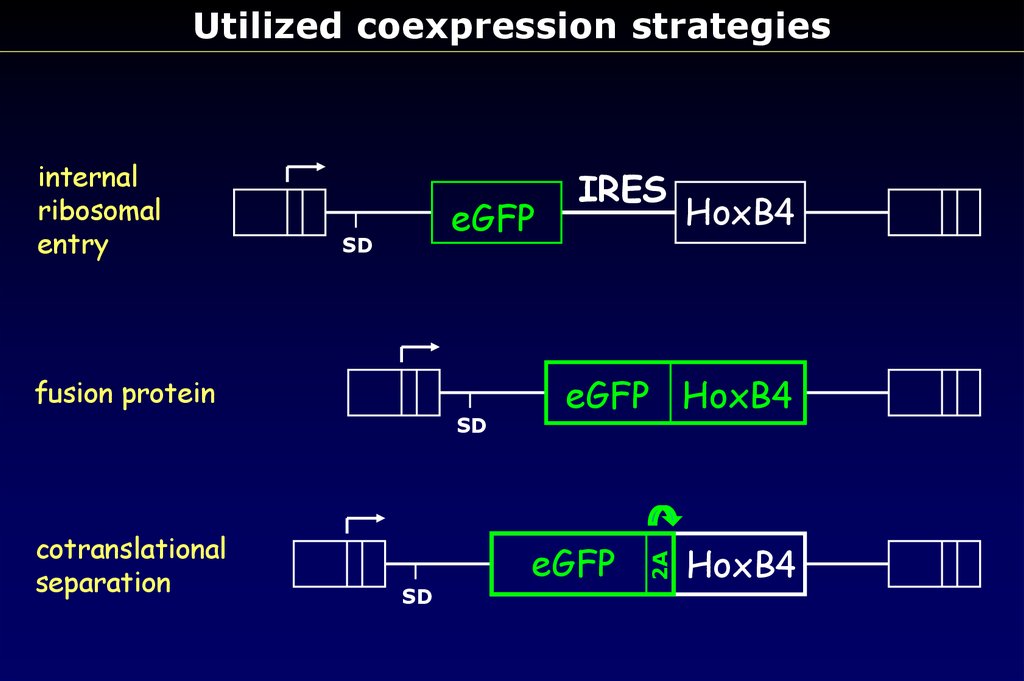
Utilized coexpression strategieseGFP
SD
fusion protein
SD
cotranslational
separation
SD
IRES
HoxB4
eGFP HoxB4
eGFP
2A
internal
ribosomal
entry
HoxB4
69.
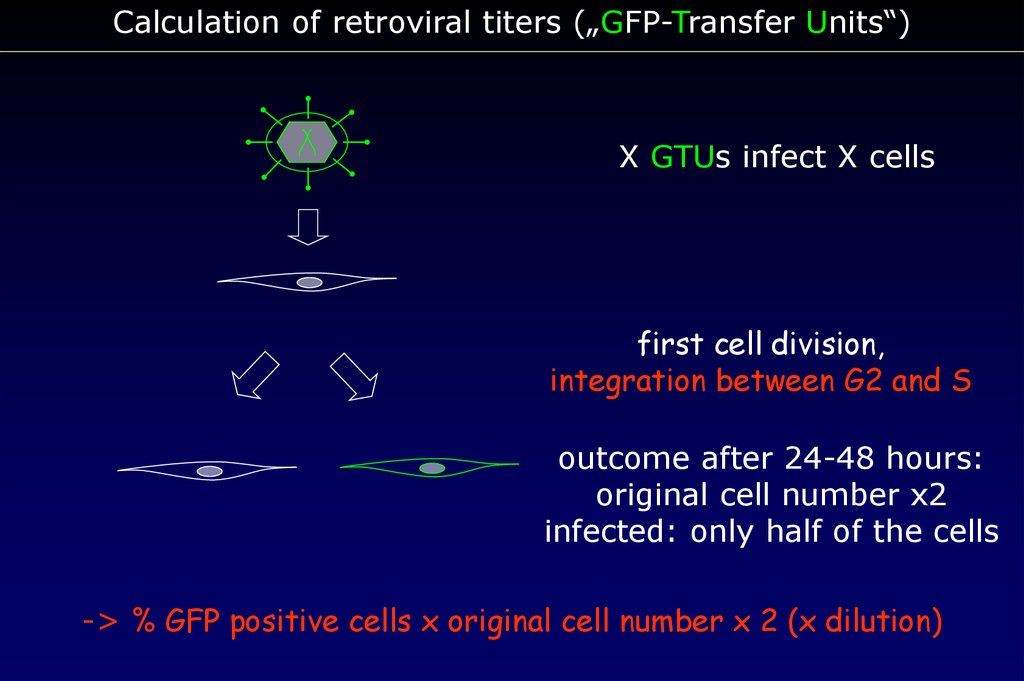
Calculation of retroviral titers („GFP-Transfer Units“)X GTUs infect X cells
first cell division,
integration between G2 and S
outcome after 24-48 hours:
original cell number x2
infected: only half of the cells
-> % GFP positive cells x original cell number x 2 (x dilution)
70.
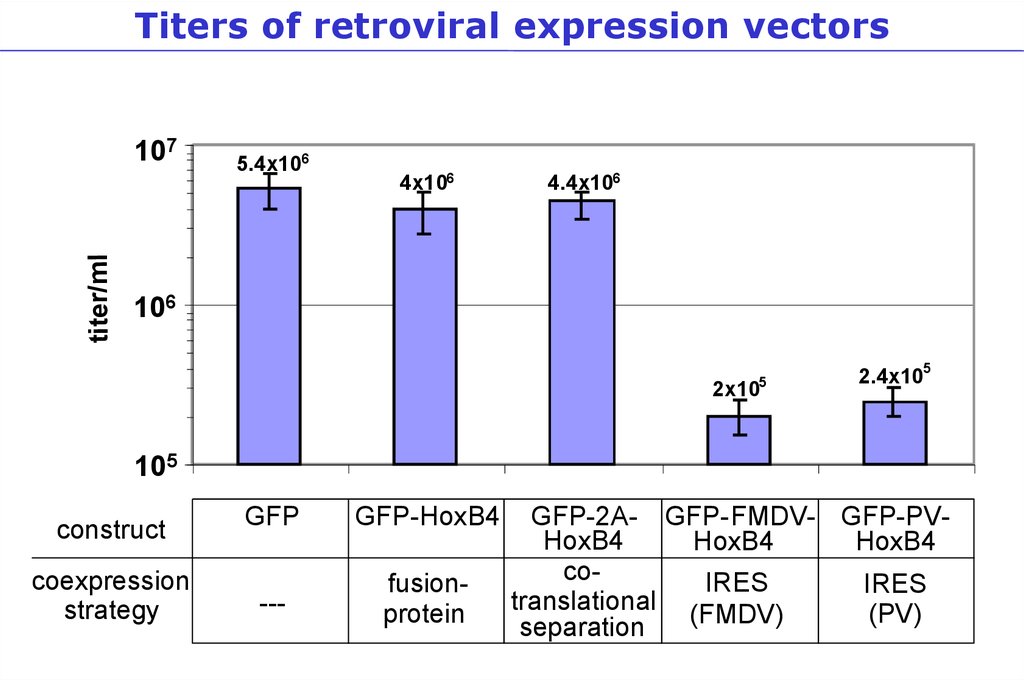
Titers of retroviral expression vectorstiter/ml
107
5.4x106
4x106
4.4x106
106
5
2x10
2.4x105
105
construct
coexpression
strategy
GFP
GFP-HoxB4
---
fusionprotein
GFP-2A- GFP-FMDV- GFP-PVHoxB4
HoxB4
HoxB4
coIRES
IRES
translational
(PV)
(FMDV)
separation
71.
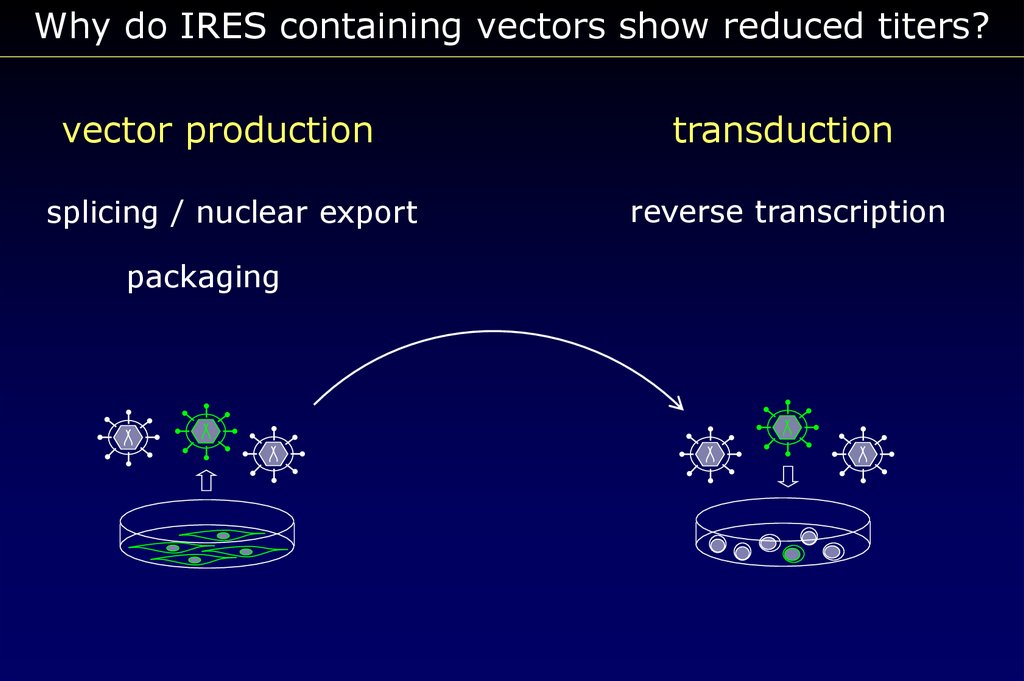
Why do IRES containing vectors show reduced titers?vector production
splicing / nuclear export
packaging
transduction
reverse transcription
72.
73.
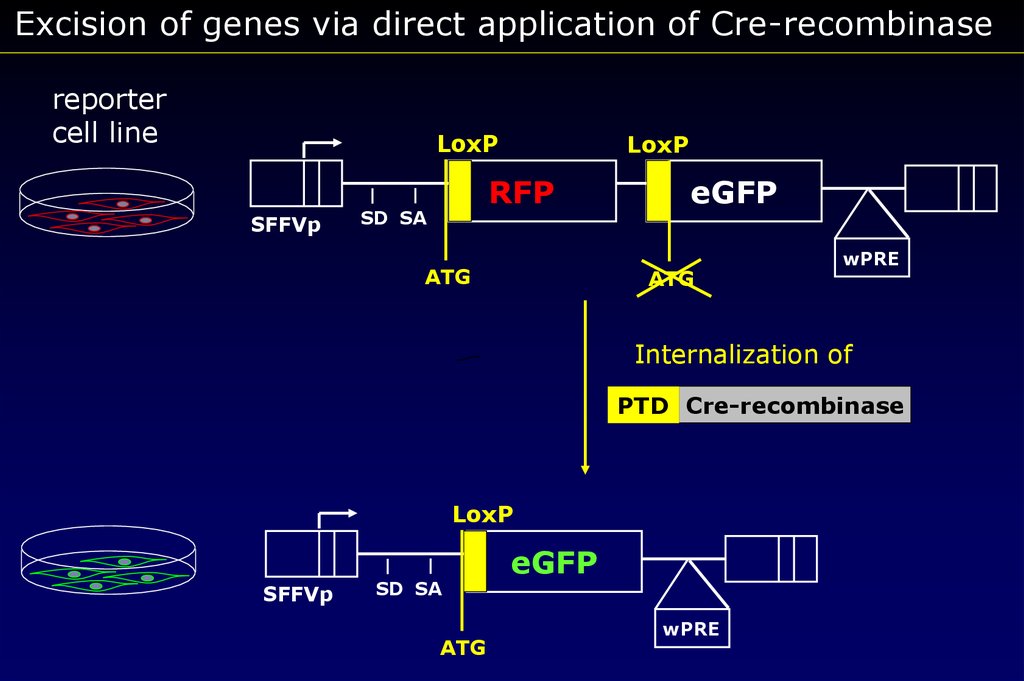
Excision of genes via direct application of Cre-recombinasereporter
cell line
LoxP
SFFVp
LoxP
RFP
SD SA
ATG
eGFP
ATG
wPRE
Internalization of
PTD Cre-recombinase
LoxP
SFFVp
SD SA
ATG
eGFP
wPRE
74.
75.
76.
В процессе работы были получены ретровирусные векторы содержащие в своемсоставе в качестве маркерного гена ген зеленого флуоресцирующего белка или ген
желтого флуоресцирующего белка, RV-eGFP/07-07 и Rv-tYFP/07-07,
соответственно, и лентивирусные векторы, несущие в своем составе маркерный ген
зеленого флуоресцирующего белка, по своим свойствам не уступающие лучшим
зарубежным образцам, а по некоторым параметрам и превосходящие их.
Была разработана методика получения рекомбинантных ретровирусных частиц,
обеспечивающая получение стоковых растворов с высоким титром (до 106
ИВЧ/мл).
LTR
LTR
XbaI (221)
XbaI (221)
BglII (679)
BglII (679)
Pst I (948)
Pst I (948)
Not I (1052)
Not I (1052)
HindIII (1283)
HindIII (1283)
Amp
IRES
Amp
IRES
NcoI (1631)
7053 bp
NcoI (1631)
6977 bp
eYFP
eGFP
Bsr GI (2342)
Bsr GI (2342)
PRE
PRE
NcoI (3044)
NcoI (3044)
BamHI (3072)
LTR
NcoI (3284)
BamHI (3363)
HindIII (3369)
Pst I (3517)
LTR
Pst I (3517)
BamHI (3072)
NcoI (3284)
BamHI (3363)
HindIII (3369)
77.
Экспрессия гена GFP (зелёного флуоресцирующего белка,внесённого в клетки) почки эмбриона человека линии 293,
внесённого в составе ретровирусного вектора RV-GFP/07-07
(А) и трансфицированные (В) клетки 293 при микроскопии в видимом свете. Исходные (Б) и
трансфицированные (Г) клетки 293 при микроскопии в ультрофиолетовом свете ( макс= 488 нм).
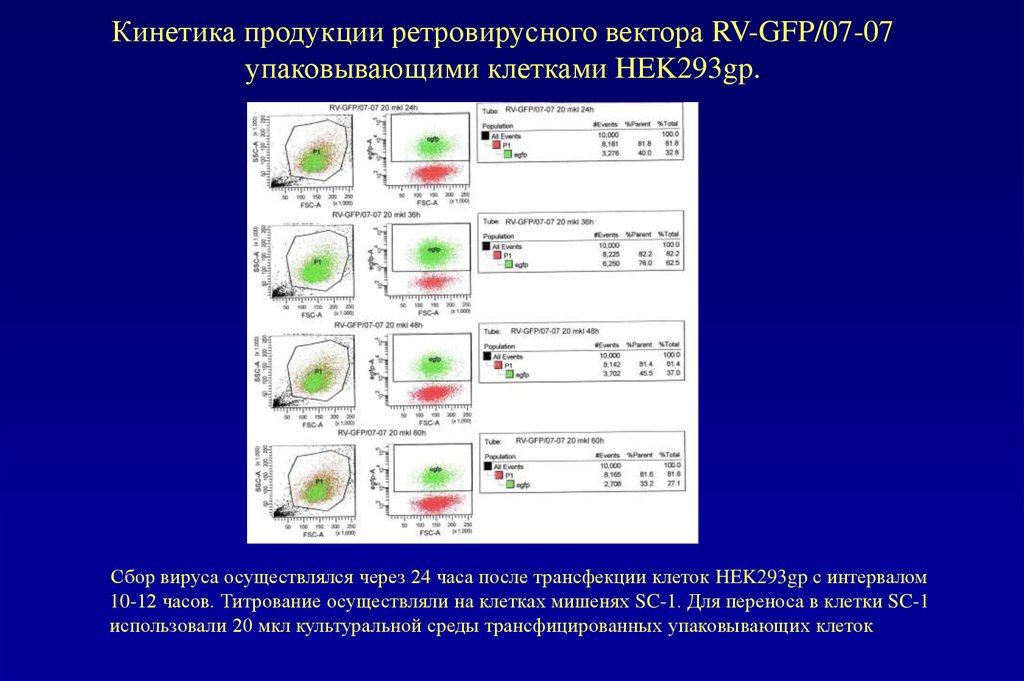
78. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp.
Сбор вируса осуществлялся через 24 часа после трансфекции клеток HEK293gp с интервалом10-12 часов. Титрование осуществляли на клетках мишенях SC-1. Для переноса в клетки SC-1
использовали 20 мкл культуральной среды трансфицированных упаковывающих клеток.
79. Кинетика продукции ретровирусного вектора RV-GFP/07-07 упаковывающими клетками HEK293gp.
Для переноса использовали 100 мкл культуральной среды трансфицированныхупаковывающих клеток.
80. Создание клеток продуцентов (перевиваемых фибробластов мыши) секретируемого гормона роста человека с помощью ретровирусного
вектора RV-GFP/ 07-07.LTR
XbaI (221)
BglII (679)
Pst I (948)
BamHI (1076)
Pst I (1319)
Amp
hGH
BglII (1592)
7765 bp
HindIII (1995)
IRES
NcoI (2343)
eGFP
BsrGI (3054)
LTR
Pst I (4229)
PRE
HindIII (4081)
NcoI (3756)
BamHI (4075)
BamHI (3784)
NcoI (3996)
Карта ретровирусного вектора R-hGH-IRES-eGFP
81. Продукция гормона роста человека перевиваемыми клетками мыши линии SC1, трансдуцированных ретровирусным вектором
R-hGH-IRES-eGFPЭлектрофоретической разделение в полиакриламидном геле в динатурирующих условиях зрелого гормона
роста человека, полученного из культуральной среды трансгенных клеток, геном которых содержит
интегрированный рекомбинантный вектор R-hGH-IRES-eGFP при помощи иммуносорбентной колонки (1)
и зрелого гормона роста человека, полученного из клеток E.coli (3), (2)-маркёрные белки. Концентрация
зрелого гормона роста человека, в кондиционированной среде трансгенных клеток SC1 составляла 5-8
мкг/мл.
82.
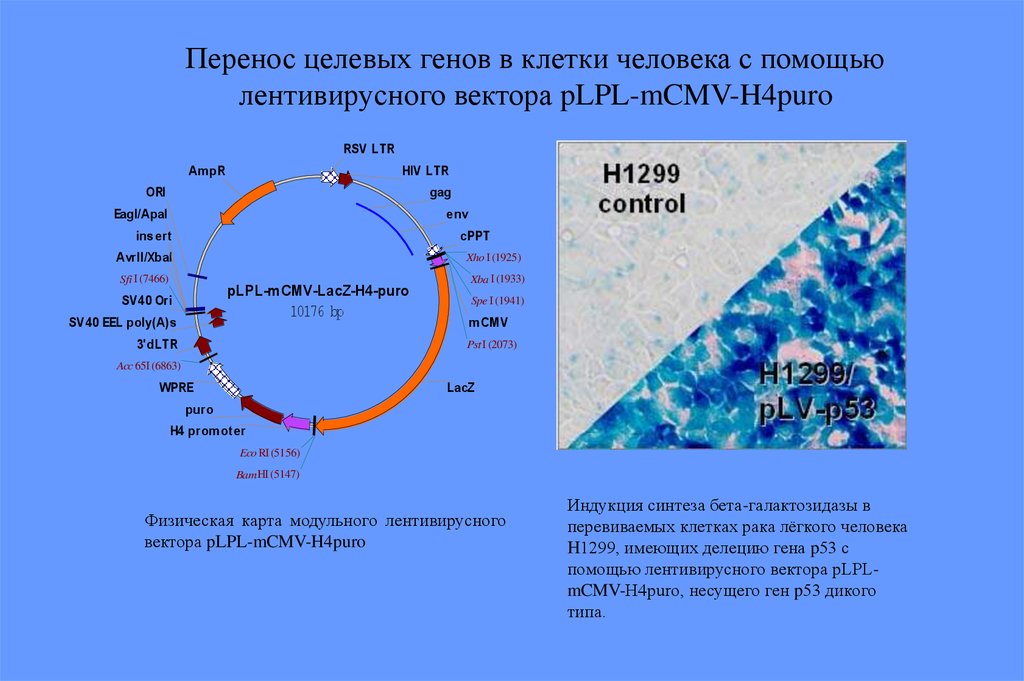
Перенос целевых генов в клетки человека с помощьюлентивирусного вектора pLPL-mCMV-H4puro
RSV LTR
Am pR
HIV LTR
ORI
gag
EagI/ApaI
env
ins ert
cPPT
AvrII/XbaI
Xho I (1925)
Sfi I (7466)
pLPL-mCMV-LacZ-H4-puro
SV40 Ori
10176 bp
SV40 EEL poly(A)s
3'dLTR
Xba I (1933)
Spe I (1941)
m CM V
Pst I (2073)
Acc 65I (6863)
WPRE
LacZ
puro
H4 prom oter
Eco RI (5156)
Bam HI (5147)
Физическая карта модульного лентивирусного
вектора pLPL-mCMV-H4puro
Индукция синтеза бета-галактозидазы в
перевиваемых клетках рака лёгкого человека
H1299, имеющих делецию гена p53 с
помощью лентивирусного вектора pLPLmCMV-H4puro, несущего ген p53 дикого
типа.
83.
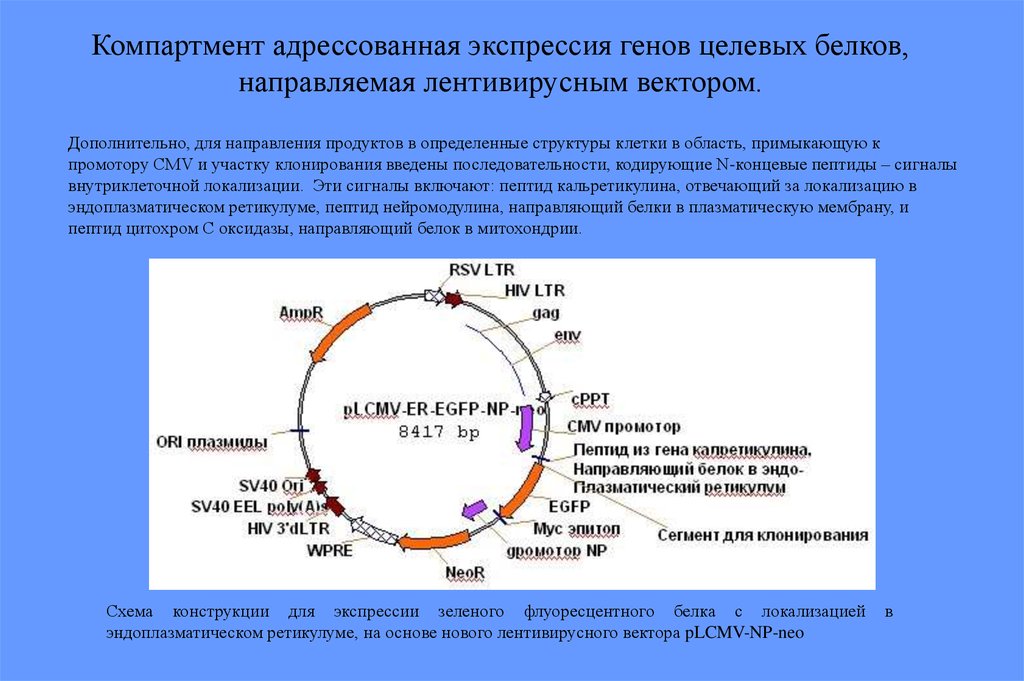
Компартмент адрессованная экспрессия генов целевых белков,направляемая лентивирусным вектором.
Дополнительно, для направления продуктов в определенные структуры клетки в область, примыкающую к
промотору CMV и участку клонирования введены последовательности, кодирующие N-концевые пептиды – сигналы
внутриклеточной локализации. Эти сигналы включают: пептид кальретикулина, отвечающий за локализацию в
эндоплазматическом ретикулуме, пептид нейромодулина, направляющий белки в плазматическую мембрану, и
пептид цитохром С оксидазы, направляющий белок в митохондрии.
Схема конструкции для экспрессии зеленого флуоресцентного белка с локализацией
эндоплазматическом ретикулуме, на основе нового лентивирусного вектора pLCMV-NP-neo
в
84.
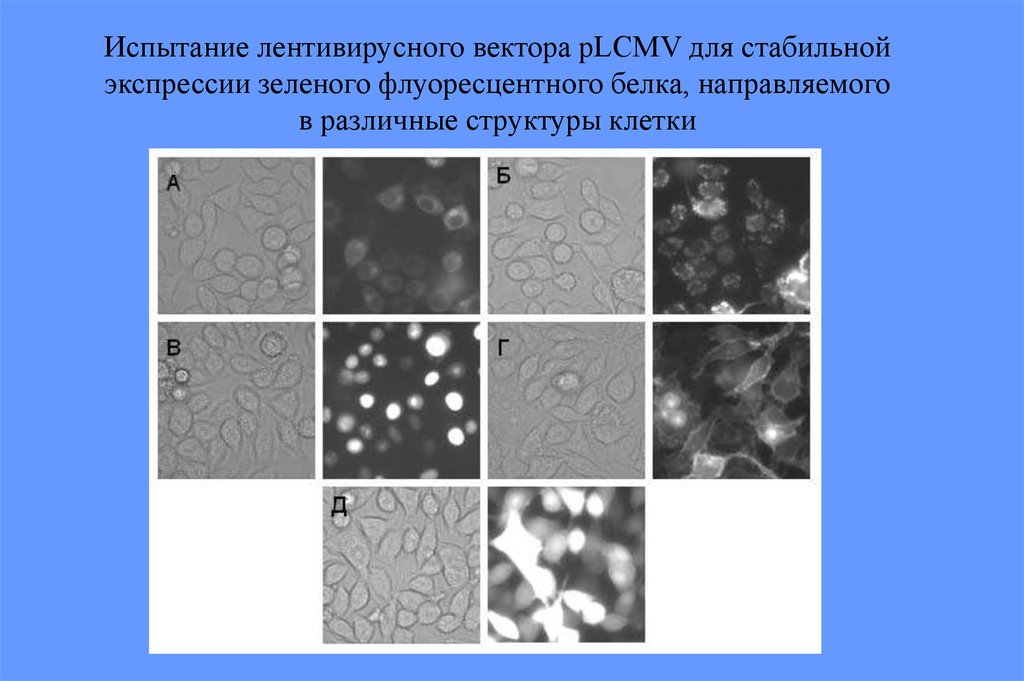
Испытание лентивирусного вектора pLCMV для стабильнойэкспрессии зеленого флуоресцентного белка, направляемого
в различные структуры клетки
85. Retroviral vectors
most commonly used gene transfer system in genetherapy
genome integration ensures stable long-term
expression
BUT
any genome integration may be associated with
insertional mutagenesis
(... which may in the worst case lead to malignant
transformation)
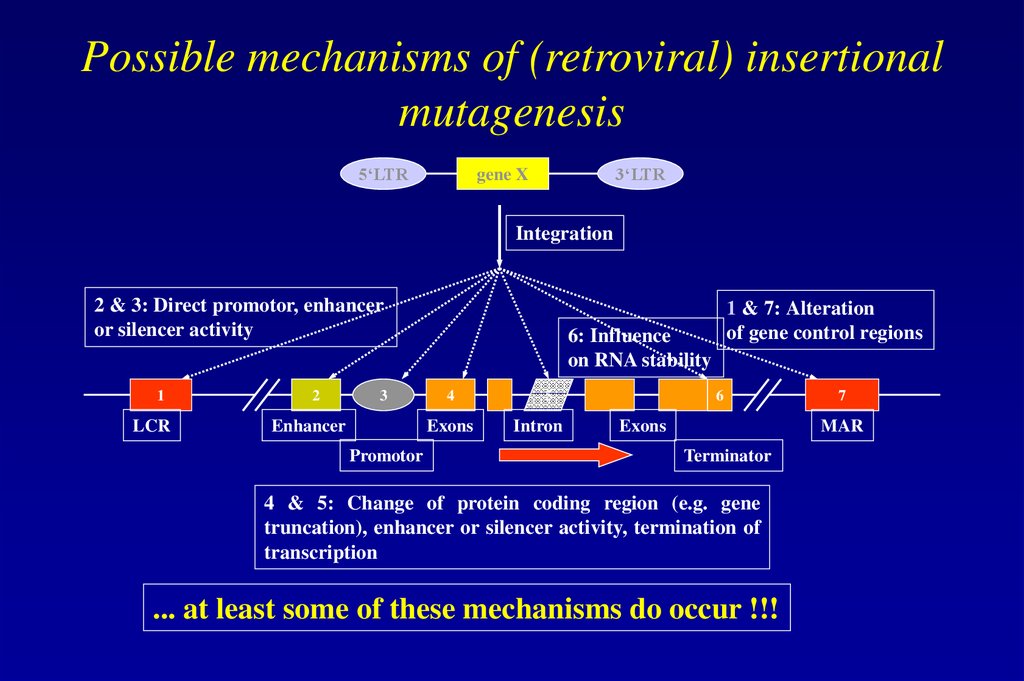
86. Possible mechanisms of (retroviral) insertional mutagenesis
5‘LTR3‘LTR
gene X
Integration
2 & 3: Direct promotor, enhancer
or silencer activity
1
LCR
2
3
Enhancer
6: Influence
on RNA stability
4
Exons
Promotor
1 & 7: Alteration
of gene control regions
5
Intron
6
Exons
7
MAR
Terminator
4 & 5: Change of protein coding region (e.g. gene
truncation), enhancer or silencer activity, termination of
transcription
... at least some of these mechanisms do occur !!!
87. ... theoretical risk assessment
Target cell number: 1x109 (1x107 per kg)Starting cell number: 108
Transduction efficiency: 25-30% 3 x 107 insertions
Genome size: 3 x 109 bp
Random integration would statistically result
in one insertion every 100 bp!!!
88.
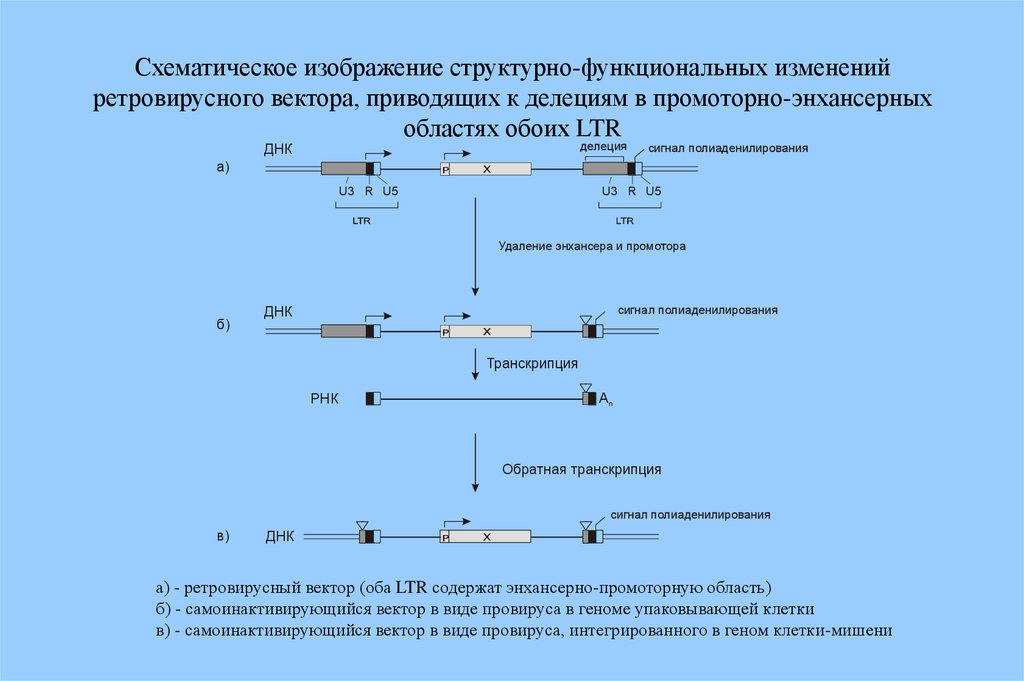
Схематическое изображение структурно-функциональных измененийретровирусного вектора, приводящих к делециям в промоторно-энхансерных
областях обоих LTR
делеция
ДНК
сигнал полиаденилирования
а)
U3 R U5
U3 R U5
Удаление энхансера и промотора
б)
сигнал полиаденилирования
ДНК
Транскрипция
РНК
Аn
Обратная транскрипция
сигнал полиаденилирования
в)
ДНК
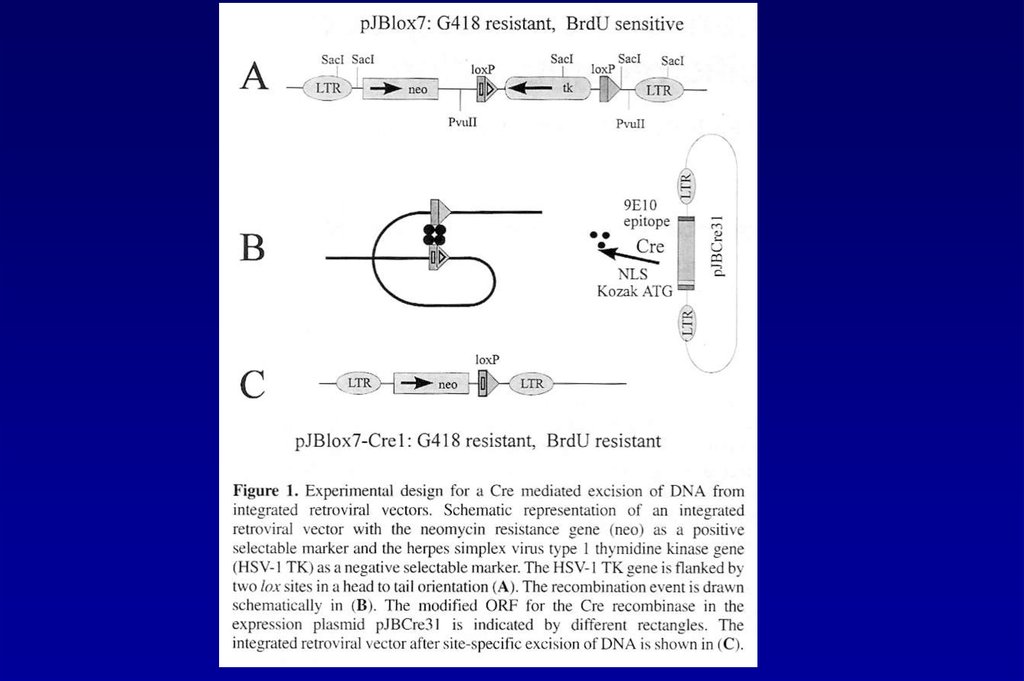
а) - ретровирусный вектор (оба LTR содержат энхансерно-промоторную область)
б) - самоинактивирующийся вектор в виде провируса в геноме упаковывающей клетки
в) - самоинактивирующийся вектор в виде провируса, интегрированного в геном клетки-мишени
89.
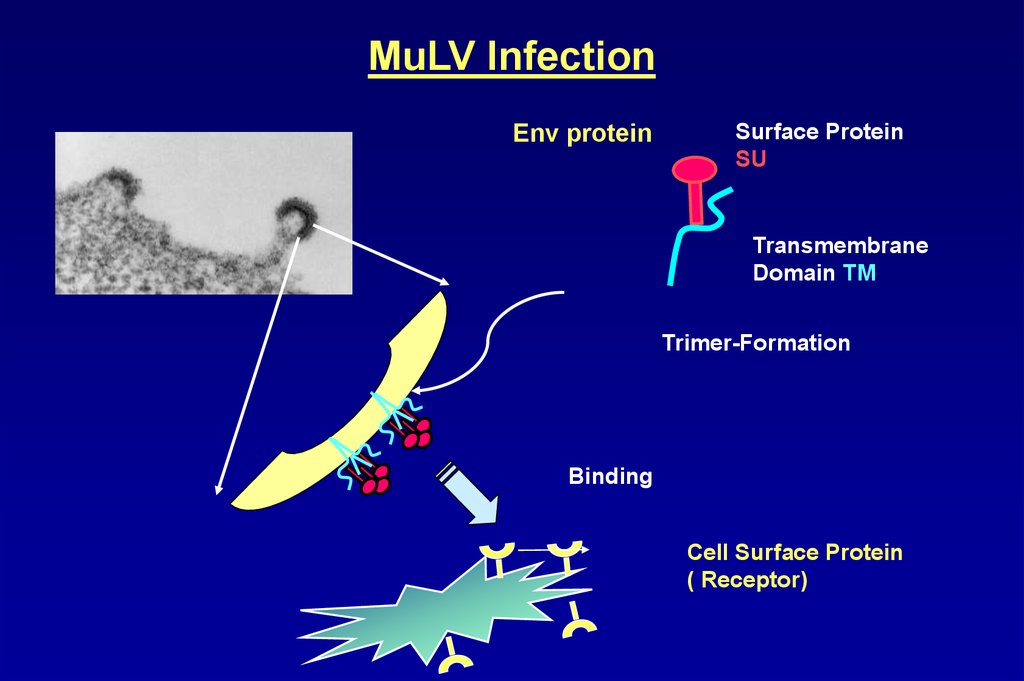
MuLV InfectionEnv protein
Surface Protein
SU
Transmembrane
Domain TM
Trimer-Formation
Binding
Cell Surface Protein
( Receptor)
90.
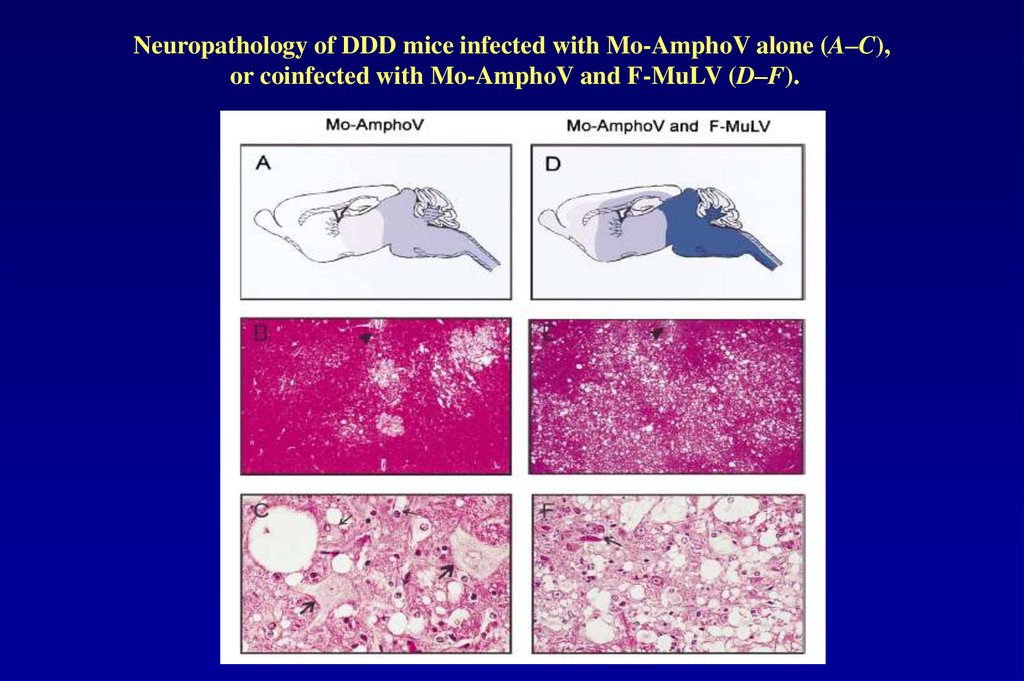
Neuropathology of DDD mice infected with Mo-AmphoV alone (A–C),or coinfected with Mo-AmphoV and F-MuLV (D–F).
91.
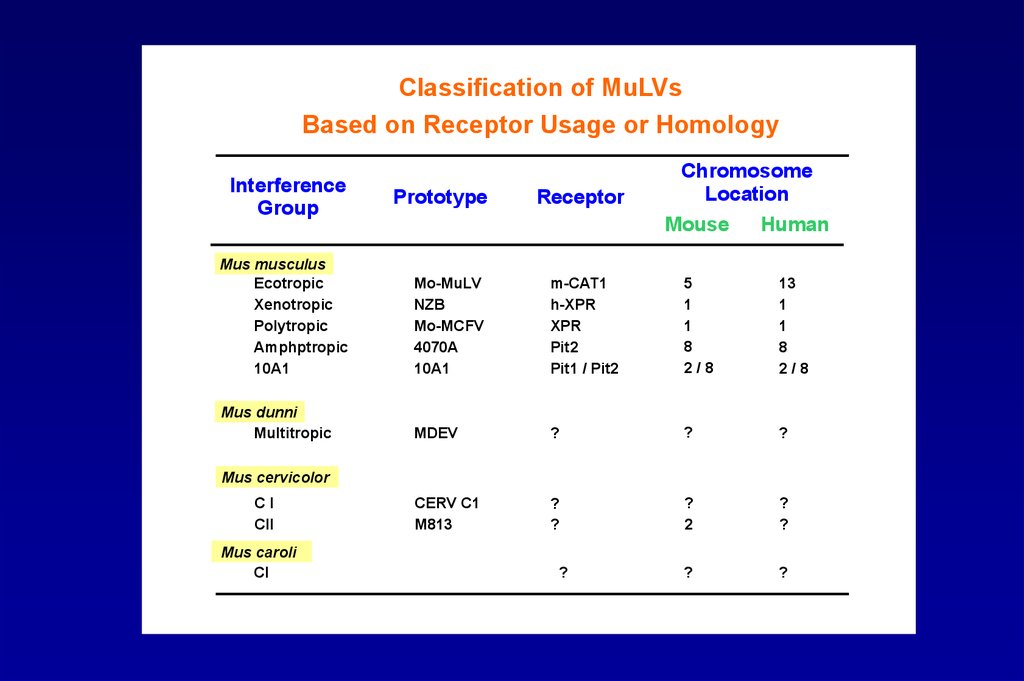
Classification of MuLVsBased on Receptor Usage or Homology
Interference
Group
Prototype
Receptor
Chromosome
Location
Mouse
Human
Mus musculus
Ecotropic
Xenotropic
Polytropic
Amphptropic
10A1
Mo-MuLV
NZB
Mo-MCFV
4070A
10A1
m-CAT1
h-XPR
XPR
Pit2
Pit1 / Pit2
5
1
1
8
2/8
13
1
1
8
2/8
Mus dunni
Multitropic
MDEV
?
?
?
CERV C1
M813
?
?
?
2
?
?
?
?
Mus cervicolor
CI
CII
Mus caroli
CI
?
92.
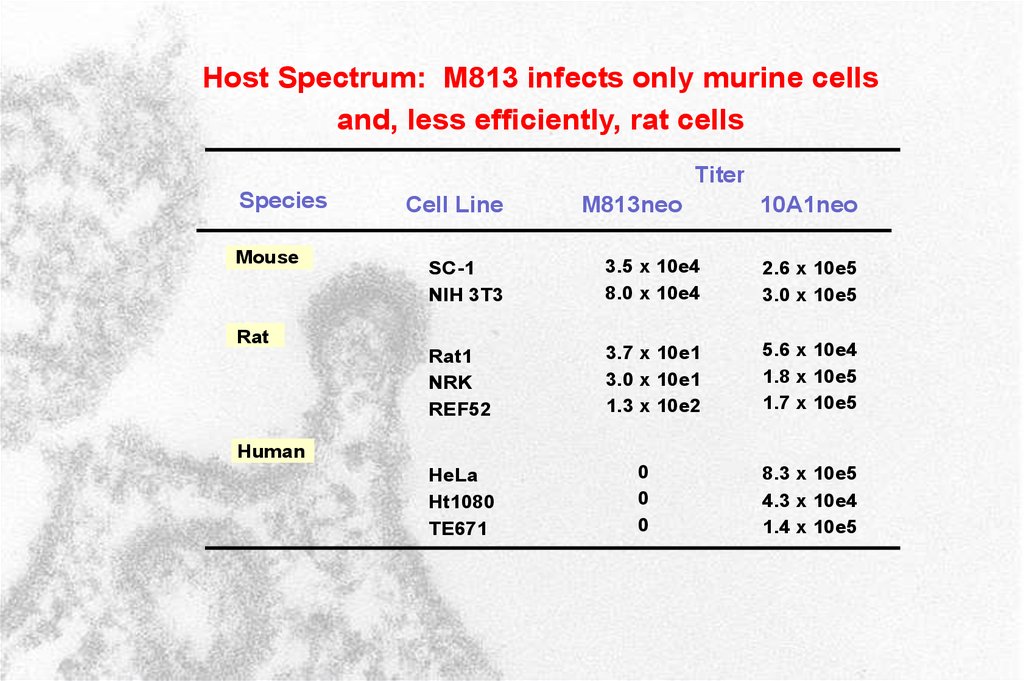
Host Spectrum: M813 infects only murine cellsand, less efficiently, rat cells
Titer
Species
Mouse
Cell Line
M813neo
10A1neo
SC-1
NIH 3T3
3.5 x 10e4
8.0 x 10e4
2.6 x 10e5
3.0 x 10e5
Rat1
NRK
REF52
3.7 x 10e1
3.0 x 10e1
1.3 x 10e2
5.6 x 10e4
1.8 x 10e5
1.7 x 10e5
Rat
Human
HeLa
Ht1080
TE671
0
0
0
8.3 x 10e5
4.3 x 10e4
1.4 x 10e5
93.
M813 Infection Is Not Blockedby Virus of Any of the M. musculus Intereference Groups
Virus
Target Cells
M813-neo
10A1-neo
3.4 x 10e4
7.6 x 10e4
1.5
7.4 x 10e4
SC1 i MoMuLV
3.5 x 10e4
7.6 x 10e4
SC1 i MoAmphoV
5.7 x 10e4
8.8 x 10e4
SC1 i 10A1V
8.8 x 10e3
2.0
SC1 i MoMCFV
4.3 x 10e4
2.0 x 10e5
SC1
SC1 i M813
94.
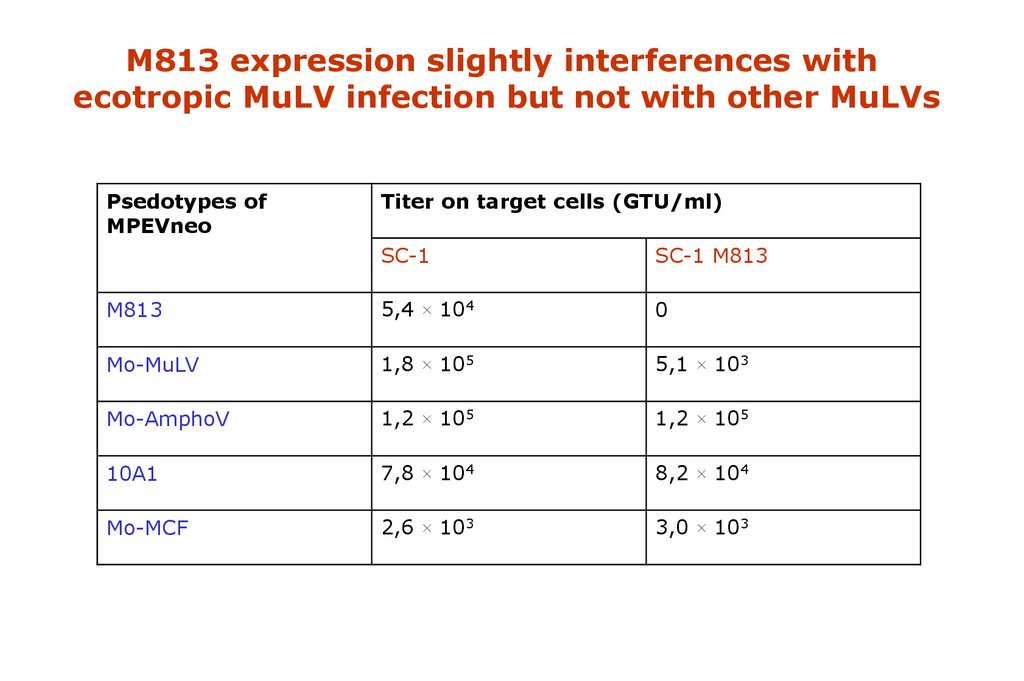
M813 expression slightly interferences withecotropic MuLV infection but not with other MuLVs
Psedotypes of
MPEVneo
Titer on target cells (GTU/ml)
SC-1
SC-1 M813
M813
5,4 × 104
0
Mo-MuLV
1,8 × 105
5,1 × 103
Mo-AmphoV
1,2 × 105
1,2 × 105
10A1
7,8 × 104
8,2 × 104
Mo-MCF
2,6 × 103
3,0 × 103
95.
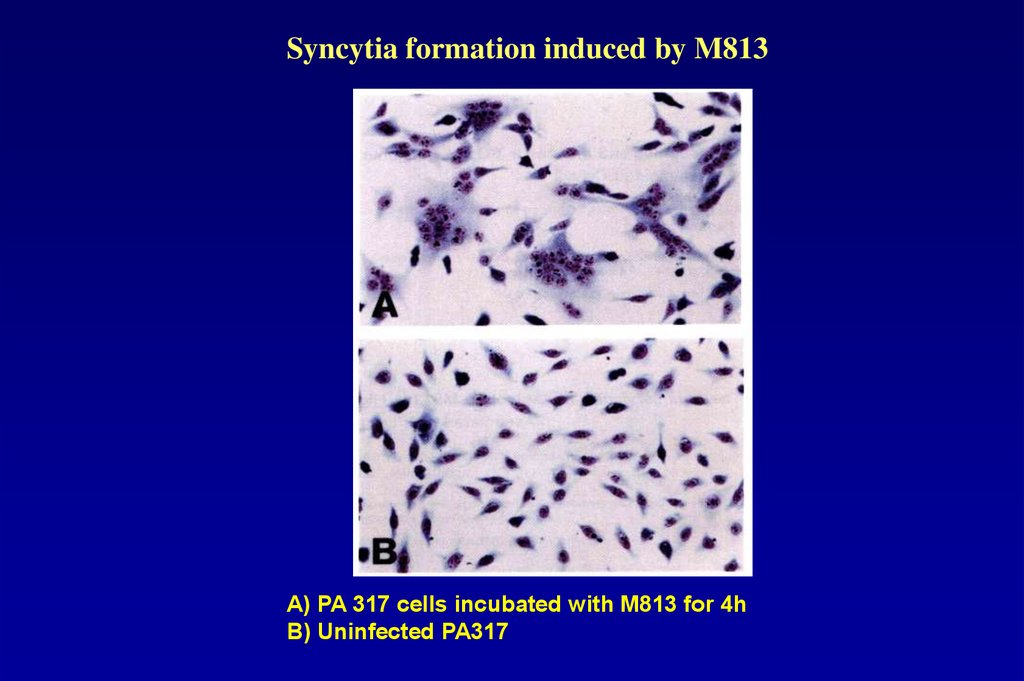
Syncytia formation induced by M813А) PA 317 cells incubated with M813 for 4h
B) Uninfected PA317
96.
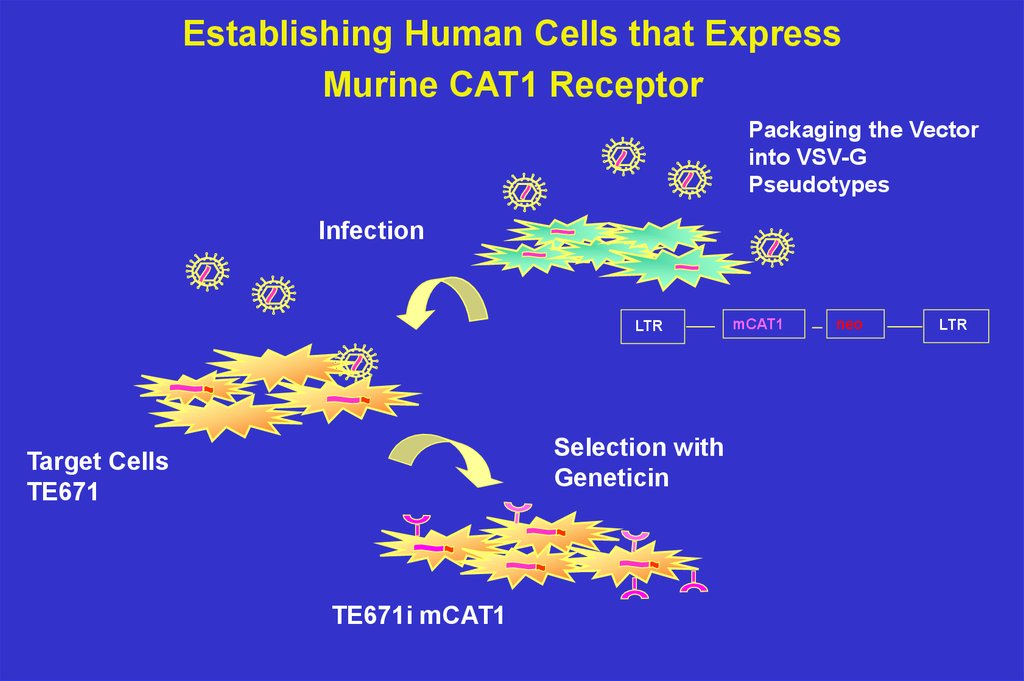
Establishing Human Cells that ExpressMurine CAT1 Receptor
Packaging the Vector
into VSV-G
Pseudotypes
Infection
LTR
Selection with
Geneticin
Target Cells
TE671
TE671i mCAT1
mCAT1
neo
LTR
97.
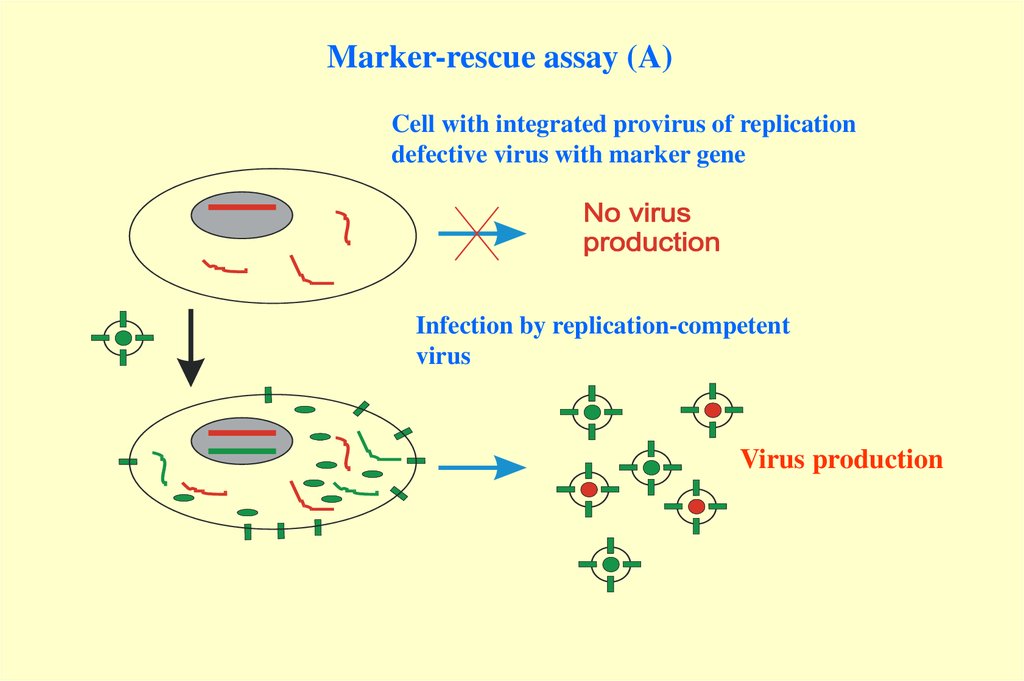
Marker-rescue assay (A)Cell with integrated provirus of replication
defective virus with marker gene
Infection by replication-competent
virus
Virus production
98.
Marker-rescue assay (B)No viral production
Marker gene expression
Viral production
No marker gene expression
99.
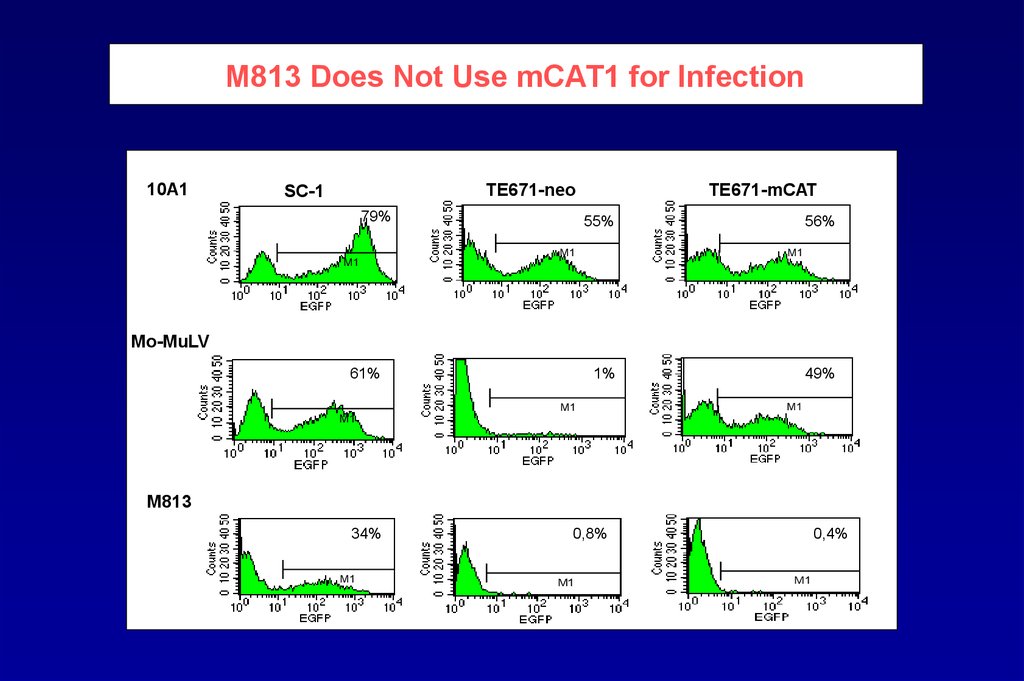
M813 Does Not Use mCAT1 for Infection10A1
TE671-neo
SC-1
79%
M1
TE671-mCAT
55%
M1
56%
M1
Mo-MuLV
61%
1%
M1
49%
M1
M1
M813
34%
M1
0,8%
M1
0,4%
M1
100.
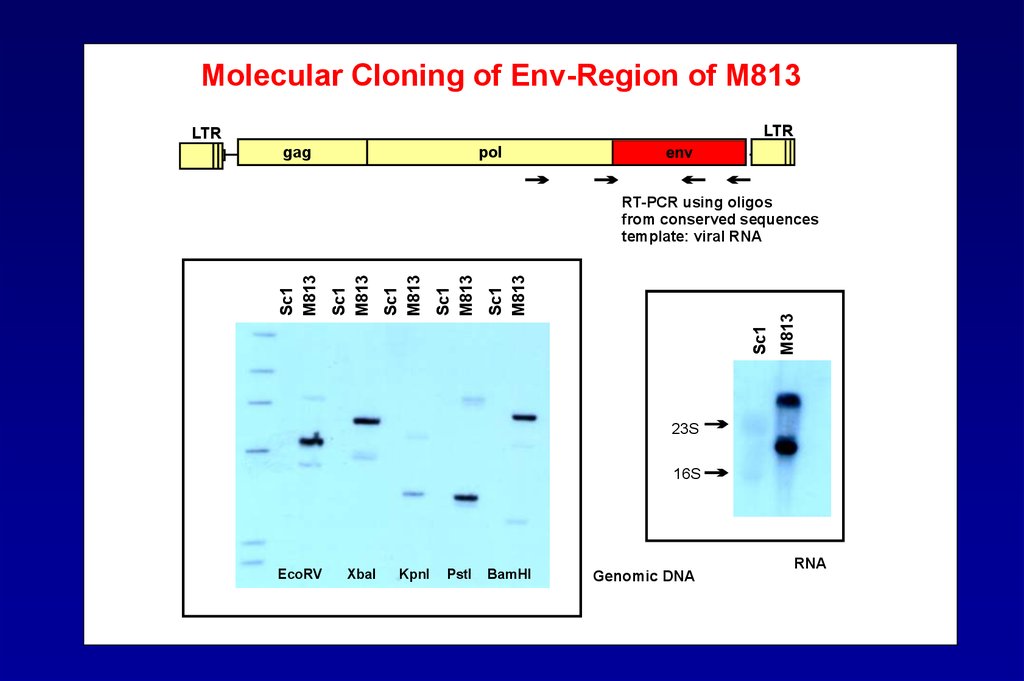
Molecular Cloning of Env-Region of M813LTR
LTR
pol
gag
M813
Sc1
Sc1
M813
Sc1
M813
Sc1
M813
Sc1
M813
Sc1
M813
RT-PCR using oligos
from conserved sequences
template: viral RNA
23S
16S
EcoRV
XbaI
KpnI
PstI
BamHI
Genomic DNA
RNA
101.
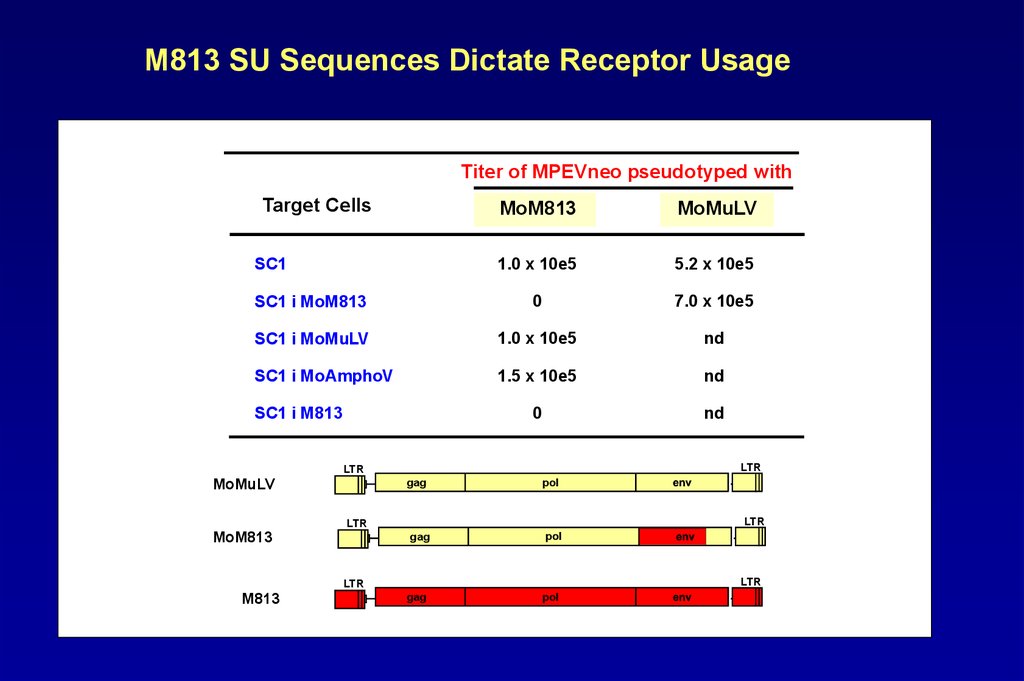
M813 SU Sequences Dictate Receptor UsageTiter of MPEVneo pseudotyped with
Target Cells
MoM813
MoMuLV
1.0 x 10e5
5.2 x 10e5
SC1 i MoM813
0
7.0 x 10e5
SC1 i MoMuLV
1.0 x 10e5
nd
SC1 i MoAmphoV
1.5 x 10e5
nd
0
nd
SC1
SC1 i M813
LTR
LTR
MoMuLV
gag
pol
gag
pol
gag
pol
LTR
LTR
MoM813
LTR
LTR
M813
102.
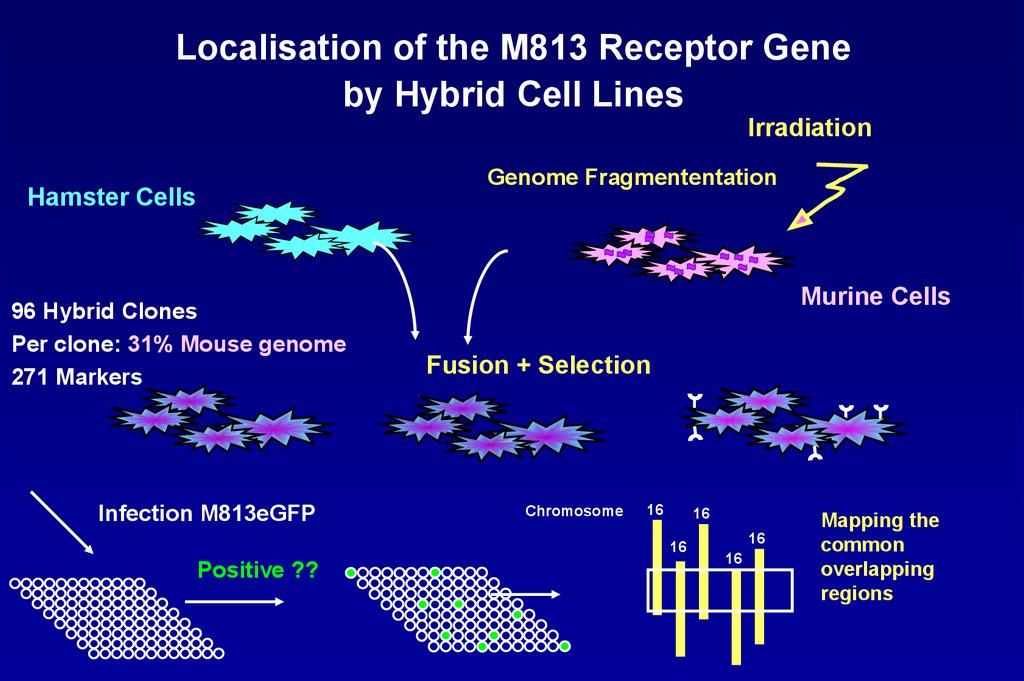
Localisation of the M813 Receptor Geneby Hybrid Cell Lines
Irradiation
Genome Fragmententation
Hamster Cells
96 Hybrid Clones
Per clone: 31% Mouse genome
271 Markers
Infection M813eGFP
Murine Cells
Fusion + Selection
Chromosome
16
16
16
Positive ??
16
16
Mapping the
common
overlapping
regions
103.
promising candidate gene on Chr. 16:► Scl5A3 : multiple membrane spanning surface protein
encoding SMIT1: Sodium myo-Inositol Transporter 1
Na+
myo-Inositol
Symporter
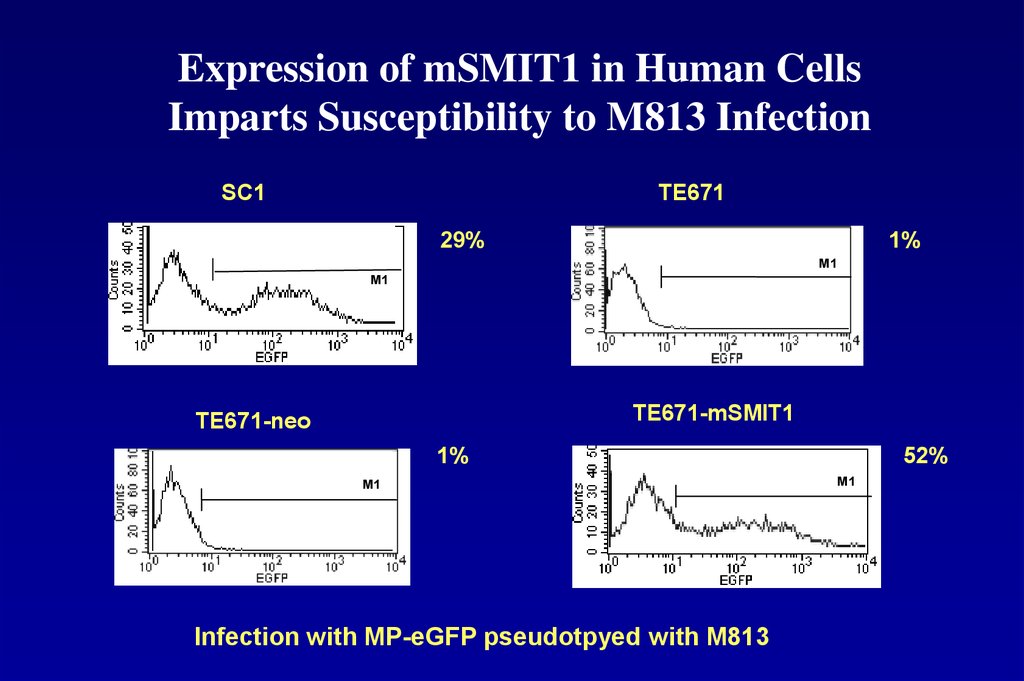
104. Expression of mSMIT1 in Human Cells Imparts Susceptibility to M813 Infection
SC1TE671
29%
1%
M1
M1
TE671-mSMIT1
TE671-neo
1%
M1
52%
M1
M1
Infection with MP-eGFP pseudotpyed with M813
105.
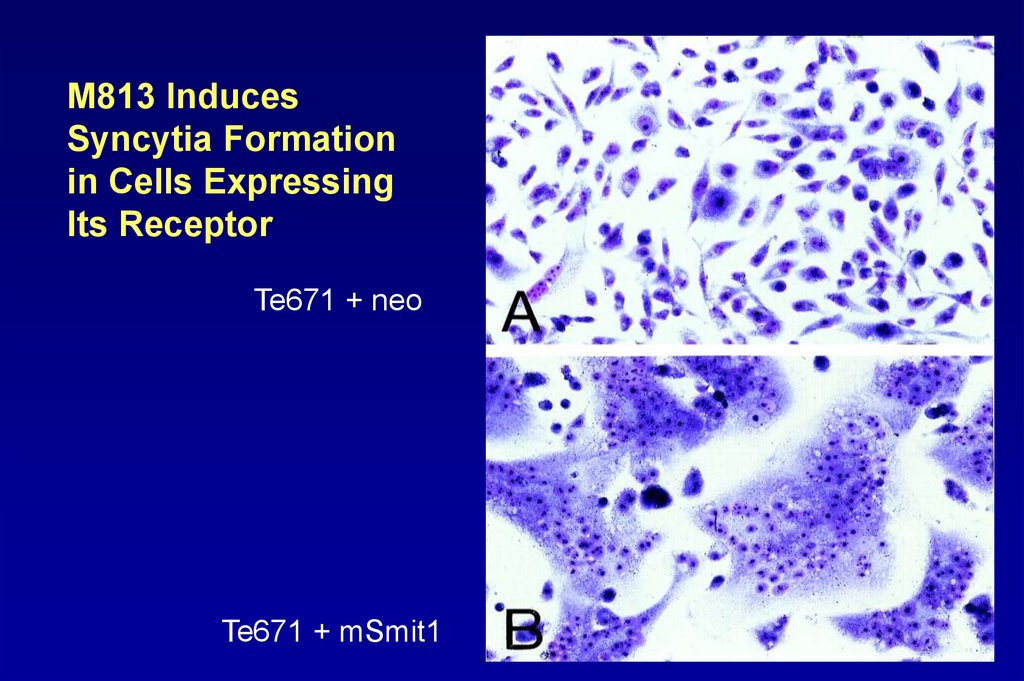
M813 InducesSyncytia Formation
in Cells Expressing
Its Receptor
Te671 + neo
Te671 + mSmit1
106.
SummaryM813 belongs to a unique receptor interference group
M813 is highly fusogenic in vitro and in vivo
M813 uses the m SMIT1 protein as a receptor
M813 induces T-cell lymphoma associated with large
multinucleated cells
107.
AcknowledgmentsDmitry Ivanov,
Pavel Spirin,
Tamara Semenova
Engelhardt Institute of Molecular Biology
Moscow, Russia
Sibyll Hein
Jürgen Löhler
Carol Stocking
Heinrich-Pette-Institute
Hamburg, Germany
This work was supported by grants from the Deustche
Forschungs-gemeinschaft (Sto 224) and Russian Foundation
of Basic Researches (02-04-49103 )
108.
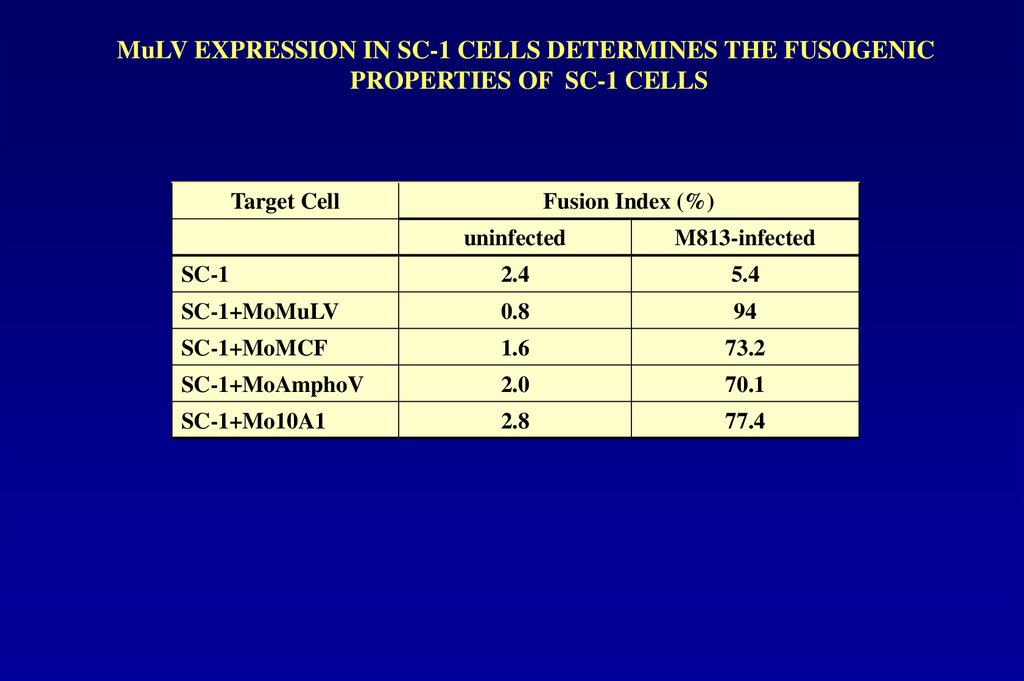
MuLV EXPRESSION IN SC-1 CELLS DETERMINES THE FUSOGENICPROPERTIES OF SC-1 CELLS
Target Cell
Fusion Index (%)
uninfected
M813-infected
SC-1
2.4
5.4
SC-1+MoMuLV
0.8
94
SC-1+MoMCF
1.6
73.2
SC-1+MoAmphoV
2.0
70.1
SC-1+Mo10A1
2.8
77.4
109.
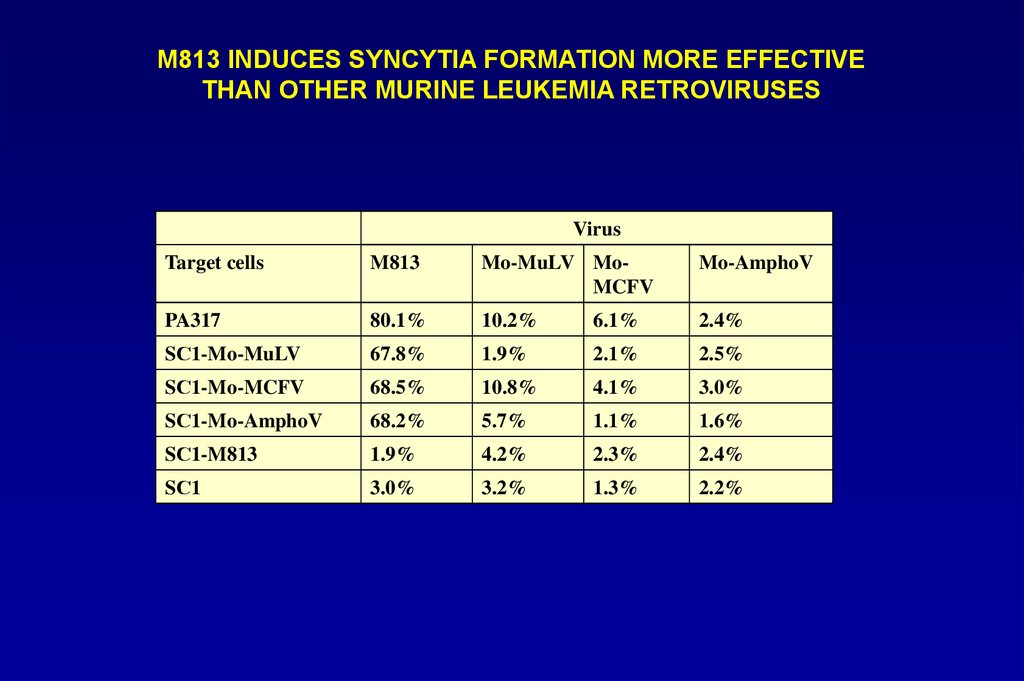
М813 INDUCES SYNCYTIA FORMATION MORE EFFECTIVETHAN OTHER MURINE LEUKEMIA RETROVIRUSES
Virus
Target cells
M813
Mo-MuLV MoMCFV
Mo-AmphoV
PA317
80.1%
10.2%
6.1%
2.4%
SС1-Mo-MuLV
67.8%
1.9%
2.1%
2.5%
SС1-Mo-MCFV
68.5%
10.8%
4.1%
3.0%
SС1-Mo-AmphoV
68.2%
5.7%
1.1%
1.6%
SС1-M813
1.9%
4.2%
2.3%
2.4%
SС1
3.0%
3.2%
1.3%
2.2%
110.
Fusion index (FI) = (N - S)/TN – number of nuclei in syncytium
S – number of syncytium
T – total number of nuclei
Over 500 nuclei were counted in each
experiment to obtain the FI value
111.
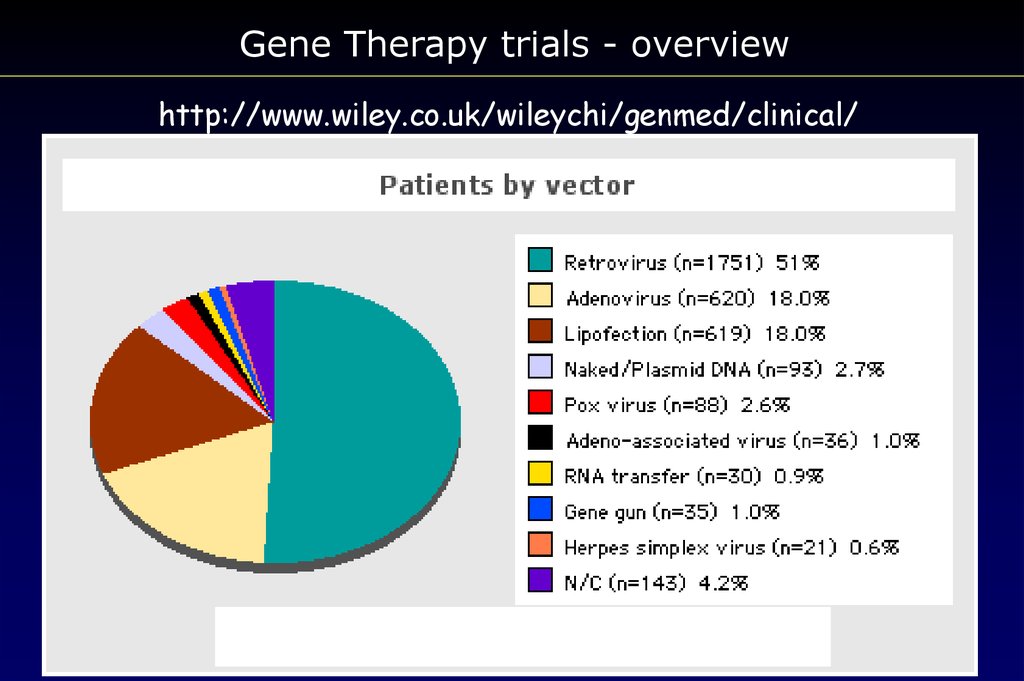
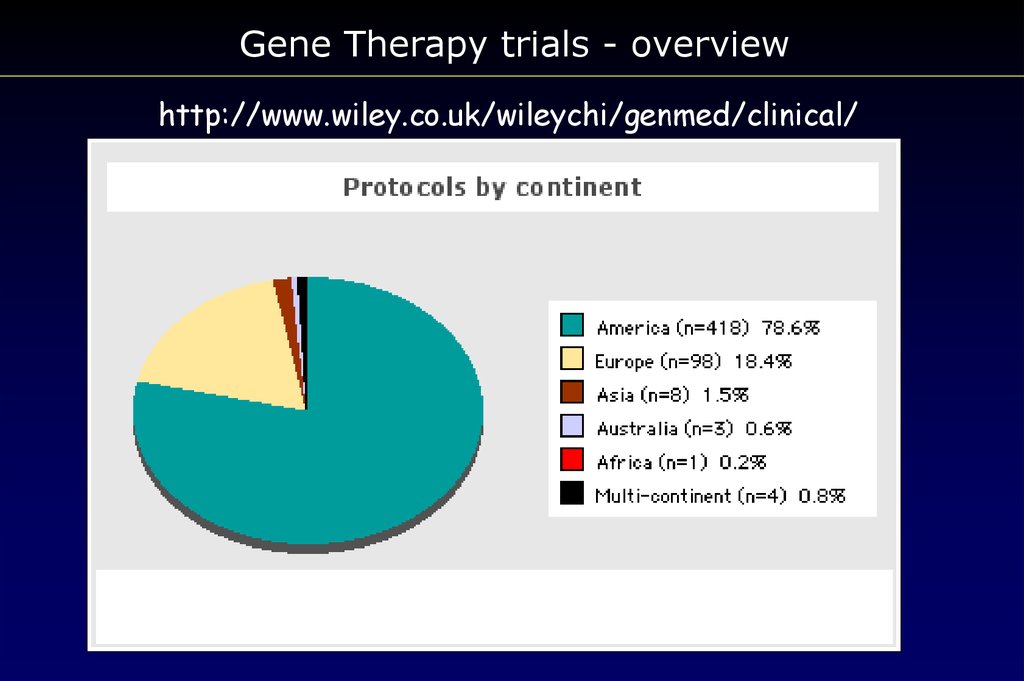
Gene Therapy trials - overviewhttp://www.wiley.co.uk/wileychi/genmed/clinical/
112.
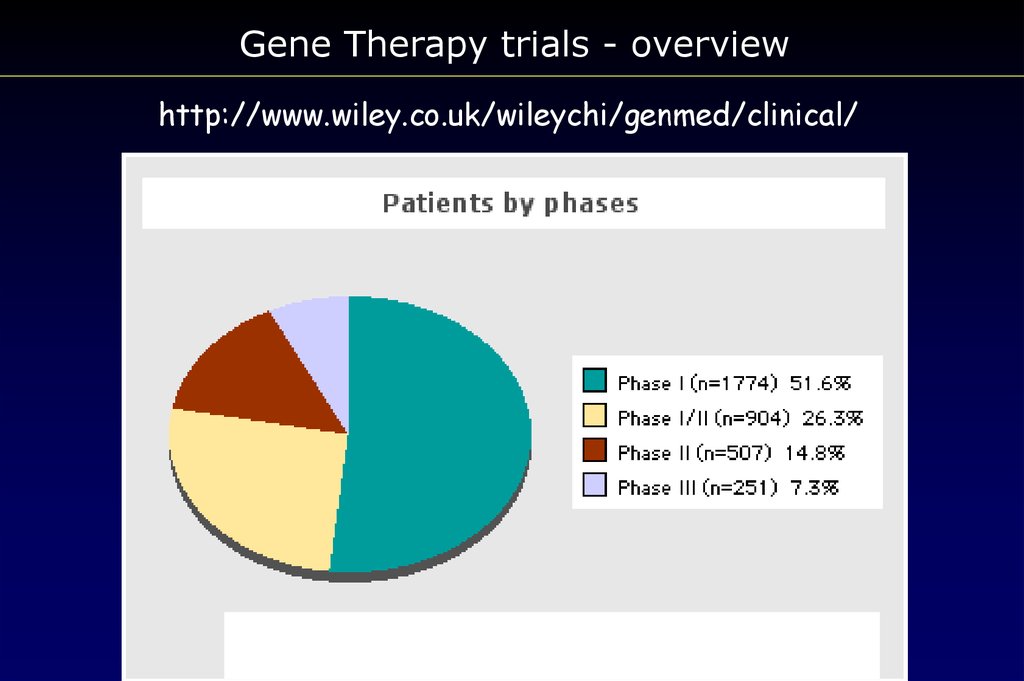
Gene Therapy trials - overviewhttp://www.wiley.co.uk/wileychi/genmed/clinical/
113.
Gene Therapy trials - overviewhttp://www.wiley.co.uk/wileychi/genmed/clinical/
114.
Инсерционный мутагенезВстраивание провируса может приводить к
трансформации клетки
115. Открытие вирусов
1892 годД.И.Ивановский – инфекционный фильтрующийся агент,
вызывающий табачную мозаику.
1898 год
M.Beijerinck - “contagium vivum fluidum”.
Loeffler & Frosch – foot-and- mouth disease
1908 год
Ellerman & Bang – ALV
1911 год
P.Rous - RSV






















































 Биология
Биология








