Похожие презентации:
Химия: основные понятия
1. Химия: основные понятия
Лекция №12. Рекомендуемая литература
1. Химия для профессий и специальностейтехнического и естественно - научного профилей:
учебник. Ерохин Ю.М. М.: Издательский центр
«Академия», 2013.
2. Химия: задачи и упражнения: учеб. пособие. Ерохин
Ю.М.. М.: Издательский центр «Академия», 2014.
3. Сборник тестовых заданий по химии: учеб. пособие..
Ерохин Ю.М. М.: Издательский центр «Академия»,
2012.
3. Дополнительно
1. Химия: Справочник для старшеклассников ипоступающих в ВУЗы. Лидин Р.А. М.: АСТ- Пресс,
2012
2. Химия. Для школьников старших классов и
поступающих в ВУЗы. Лидин Р.А. М.: Дрофа, 2005
3. Химия в школе: научно-методический журнал.
Учрежден Министерством образования и науки РФ.
ООО «Центрхимпресс»
4. Назначение дисциплины
Химия – наука о веществах, их свойствах,превращениях и явлениях, сопровождающих эти
превращения.
Химия изучает химическую форму движения материи
(качественное изменение веществ, превращение
одних веществ в другие).
5. Задачи дисциплины
Задачи химии:1.Научиться различать вещества по их физическим и
химическим свойствам.
2. Научиться получать вещества, не существующие в
природе:
полимеры,
удобрения,
полупроводники,
топливо,
сорбенты
лекарства, витамины и др.
6. Вещество
Все тела, которые нас окружают, отличаются по форме,размерам, цвету и другим признакам (качествам).
Например, пробирка и химический стакан имеют
разную форму, а маленькая и большая колбы —
разные размеры.
Но у всех названных физических тел есть общее
свойство: все они сделаны из одного материала —
стекла.
Материал, из которого состоят физические тела,
называют веществом.
7. Чистые вещества и смеси
Чистыми являются только такие вещества, которыеобладают постоянными свойствами, например
дистиллированная вода.
В природе вещества встречаются в виде смесей.
СМЕСИ
Однородные
Неоднородные
В однородных смесях даже с помощью микроскопа нельзя обнаружить
частицы других веществ.
В неоднородных смесях невооруженным глазом или с помощью
микроскопа можно обнаружить частицы других веществ.
8. Физическое тело
Предмет, который состоит из вещества и имеетопределенный объем, определенную массу и форму,
называют физическим телом.
Тела могут быть одинаковой формы, одинакового
размера, одинакового цвета, но состоять из разных
веществ.
Например, шар из металла и шар из пластмассы.
При этом у металла и пластмассы разная плотность,
разная электрическая проводимость.
9. Свойства веществ
Признаки, по которым вещества отличаются друг отдруга, называют свойствами веществ .
Каждому веществу присущи свои свойства:
• Вода — жидкое вещество, без запаха, цвета и вкуса.
• Сахар — твердое вещество белого цвета, хорошо
растворяется в воде, сладкое на вкус.
• Кислород — газообразное вещество, без цвета,
запаха, плохо растворяется в воде
К свойствам веществ относятся: агрегатное состояние
(твердое, жидкое, газообразное), цвет, блеск, запах,
вкус, растворимость и многие другие.
10. Явления
Все вещества под действием внешних условийизменяются: вода превращается в лед при
охлаждении, медь теряет свой блеск во влажном
воздухе.
Все изменения, которые происходят в окружающем нас
мире, называют явлениями.
Явления, при которых не происходит образования
новых веществ, называют физическими.
Явления, при которых происходит образование новых
веществ, называют химическими явлениями или
химическими реакциями.
11. Атомно-молекулярное учение
Это первое учение о строении вещества. Оноразвивалось на основе большого опытного
материала в течении длительного времени.
Особая роль в развитии атомно-молекулярного учения
принадлежит М.В.Ломоносову.
12. Основные положения атомно-молекулярного учения
1. Все вещества состоят из молекул, атомов или ионов. Молекулаявляется наименьшей частицей, которая сохраняет свойства
данного химического вещества.
2. Молекулы находятся в постоянном движении. С повышением
температуры скорость движения молекул увеличивается.
3. Молекулы различных веществ отличаются друг от друга массой,
размером, составом, строением и химическими свойствами.
4. Молекулы могут состоять из атомов одного химического
элемента (простые вещества) или из атомов разных
химических элементов {сложные вещества). Существенное
значение имеет количество и взаимное расположение атомов в
молекуле.
13. Молекула
Молекула — это наименьшая электронейтральнаячастица вещества, обладающая определенной
массой и всеми химическими свойствами этого
вещества, способная к самостоятельному
существованию.
В химических реакциях молекулы распадаются на
составляющие их атомы, из этих атомов образуются
новые молекулы.
14. Атом
Атом химическим путем не может быть разложен на болеемелкие частицы, поэтому атомы можно рассматривать как
предел химического деления.
Атом — это наименьшая химически неделимая частица
вещества.
Атом — это электронейтральная частица, состоящая из
положительно заряженного ядра и отрицательно
заряженных электронов.
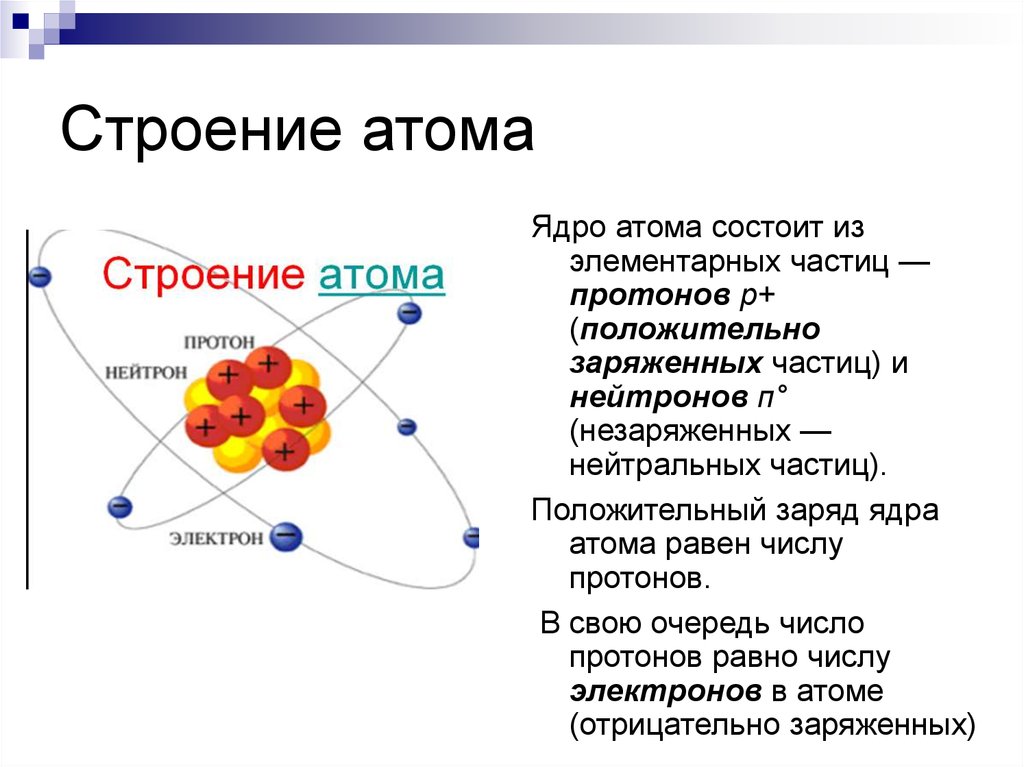
15. Строение атома
Ядро атома состоит изэлементарных частиц —
протонов р+
(положительно
заряженных частиц) и
нейтронов п°
(незаряженных —
нейтральных частиц).
Положительный заряд ядра
атома равен числу
протонов.
В свою очередь число
протонов равно числу
электронов в атоме
(отрицательно заряженных)
16. Химический элемент
Химический элемент — это совокупность атомов содинаковым зарядом ядра.
Обозначение элемента:
Символ элемента
(Hydrogen, лат.)
Н
1 Порядковый номер
1S1 Валентные электроны
Атомная масса 1,0079
17. Формы существования химического элемента
1. Свободные атомы (например, атомарный водородН, атомарный кислород O и др.)
2. Простые вещества (например, водород Н2,
кислород О2, железо F, алюминий Al и др.).
3. В составе сложных веществ (например, углекислый
газ СО2, обычная соль NaCl, серная кислота Н2SO4 и
др.)
18. Аллотропия
Аллотропия – это способность атомов одногохимического элемента образовывать простые
вещества разного состава или разного строения.
Аллотропные модификации (видоизменения) — это
простые вещества, образованные одним и тем же
химическим элементом, но имеющие разный состав
или разное строение, а значит, и разные физические и
химические свойства
19. Примеры аллотропных модификаций
Элемент - кислородКислород О2 и озон О3
Элемент – углерод
Графит, алмаз, карбин С
Фуллерены С60, С70
Графен
Элемент – Олово
Белое олово Sn
Серое олово Sn


















 Химия
Химия








