Похожие презентации:
Клеточная инженерия в современной селекции и семеноводстве растений
1.
4М.П. Мордвинцев
СМсспк
Клеточная
инженерия
в современной
селекции и
семеноводстве
растений
1
2.
4Содержание лекции:
СМсспк
1. Теоретические основы клеточной
инженерии растений
2. Методы микроклонального
размножения
3. Оздоровление посадочного
материала
4. Клеточная селекция
5. Генетическое улучшение растений
(получение гаплоидов,
сомаклональная изменчивость)
М.М.П.
2
3.
4.1СМсспк
1. Теоретические
основы клеточной
инженерии растений
М.М.П.
3
4.
4.1СМсспк
Клеточная инженерия
– система методов, позволяющая конструировать
клетки нового типа на основе их культивирования,
гибридизации и реконструкции.
Она базируется на выращивании отдельных клеток или
тканей на искусственных питательных средах и на
присущем соматическим растительным клеткам свойстве
тотипотенции, т.е. полного потенциала развития будущего
организма, каким обладает оплодотворённая яйцеклетка.
Из таких изолированных от материнского организма
клеток могут сформироваться целые организмы
растений, являющиеся по сути клонами, то есть
потомками от митотических делений одной клетки.
Выращивание изолированных растительных клеток и
растительных тканей стало возможным после того,
как были разработаны соответствующие среды и
режимы культивирования.
М.М.П.
4
5.
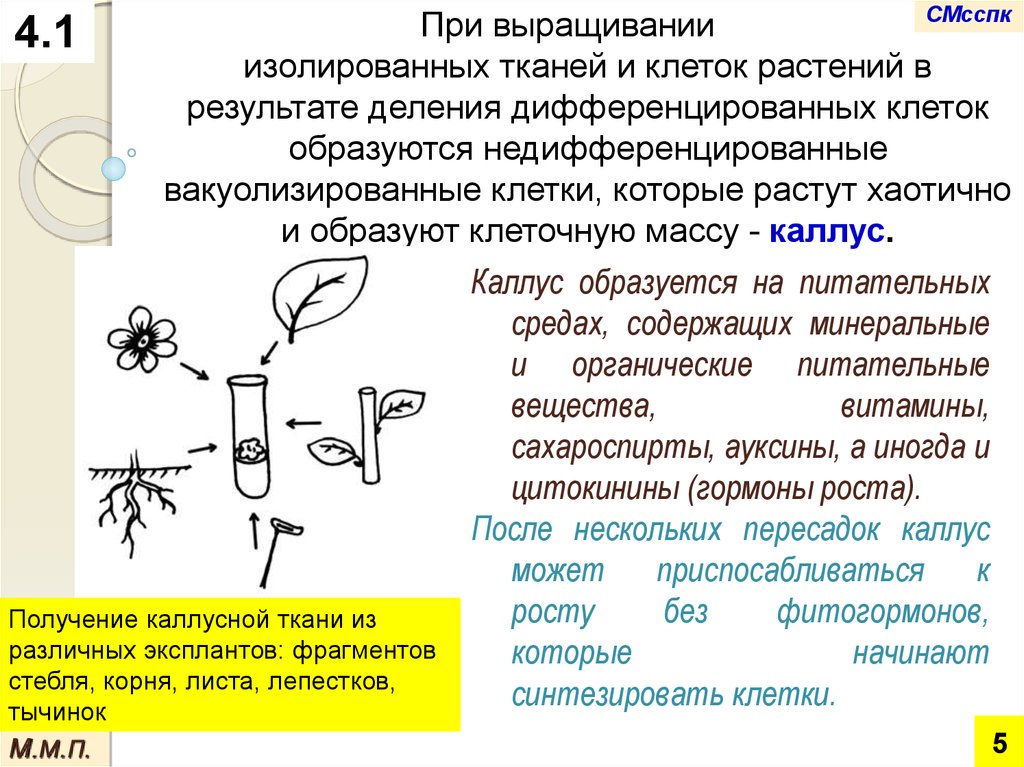
СМсспкПри
выращивании
4.1
изолированных тканей и клеток растений в
результате деления дифференцированных клеток
образуются недифференцированные
вакуолизированные клетки, которые растут хаотично
и образуют клеточную массу - каллус.
Каллус образуется на питательных
средах, содержащих минеральные
и органические питательные
вещества,
витамины,
сахароспирты, ауксины, а иногда и
цитокинины (гормоны роста).
После нескольких пересадок каллус
может
приспосабливаться
к
росту
без
фитогормонов,
Получение каллусной ткани из
различных эксплантов: фрагментов
которые
начинают
стебля, корня, листа, лепестков,
синтезировать клетки.
тычинок
М.М.П.
5
6.
4.1СМсспк
Каллус на
травмированной
виноградной
лозе
М.М.П.
6
7.
4.1М.М.П.
СМсспк
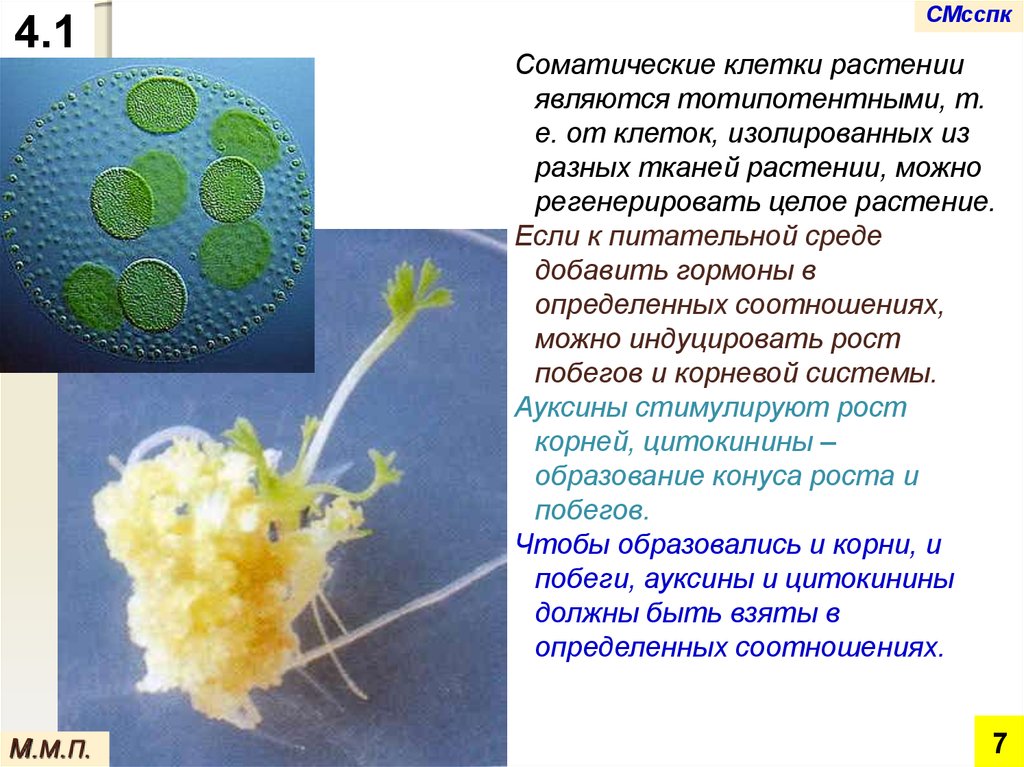
Соматические клетки растении
являются тотипотентными, т.
е. от клеток, изолированных из
разных тканей растении, можно
регенерировать целое растение.
Если к питательной среде
добавить гормоны в
определенных соотношениях,
можно индуцировать рост
побегов и корневой системы.
Ауксины стимулируют рост
корней, цитокинины –
образование конуса роста и
побегов.
Чтобы образовались и корни, и
побеги, ауксины и цитокинины
должны быть взяты в
определенных соотношениях.
7
8.
4.1СМсспк
Выращивание
изолированных тканей и клеток на
искусственных питательных средах в
стерильных условиях (in vitro)
получило название метода
культуры изолированных тканей и
метода культуры изолированных
клеток.
Получаемое потомство
называют клоном (от греческого
- ветвь).
Все потомства, как однояйцовые
близнецы, имеют одинаковый
наследственный материал, т.к. при
клонировании генетическая
информация передается от одного
«материнского» организма всем
потомкам.
М.М.П.
8
9.
4.1СМсспк
В зависимости от способов, условий и
происхождения можно выделить несколько
типов культур клеток и тканей.
Клетки растений можно культивировать не только на
поверхности питательных сред, но и в жидких
питательных средах. Такие культуры называют
суспензионными.
Культуры
Каллусная
(поверхностное
культивирование)
Пло тные тка ни с
зонами
редуцированного
камбия и сосудов
М.М.П.
Суспензионная
(глубинное
культивирование)
Ткани средней
плотнос ти с
хорошо
выраженными
меристематическими очагами
(органогенез)
Ры хлые ткани ,
сильно
обводненные,
легко
распадаются
на отдельные
кле тки
9
10.
4.1Основные направления использования
культуры клеток и тканей растений:
СМсспк
1) размножение или поддержание жизни у неизмененных по
сравнению с донорами клеток, тканей, растений;
2) целенаправленное воздействие на изменение генетического
статуса клеток и отбор в селективных условиях нужных
вариантов.
Возможности культуры изолированных клеток и тканей растений:
1) получение вторичных метаболитов, продуцируемых отдельными
клетками и тканями некоторых полезных растений (алкалоидов,
глюкозидов, стероидов и т.д.), используемых для производства
лекарств;
2) ускоренное (микроразмножение) ценных и уникальных генотипов и
поддержание жизнеспособности ослабленных клеток и тканей;
3) освобождение (оздоровление) посадочного материала от вирусной
инфекции;
4) клеточная и тканевая селекция форм с полезными
хозяйственными свойствами;
5) генетическое улучшение сельскохозяйственных растений;
6) сохранение генофонда в условиях криоконсервации.
М.М.П.
10
11.
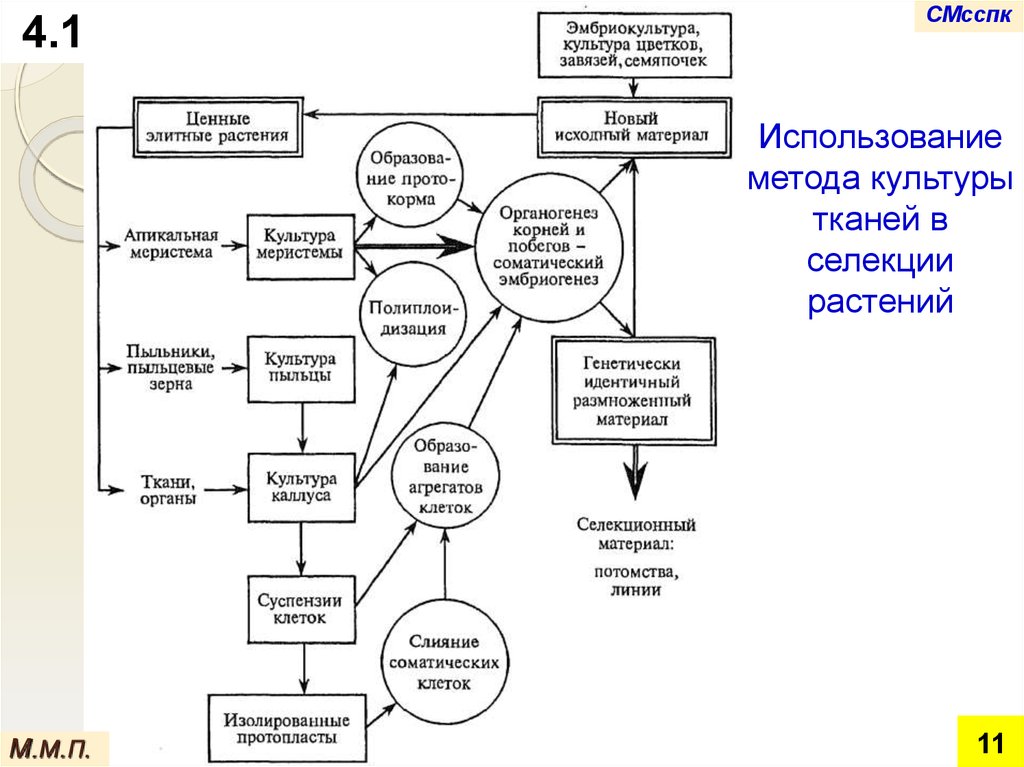
4.1СМсспк
Использование
метода культуры
тканей в
селекции
растений
М.М.П.
11
12.
4.1СМсспк
Методы культуры изолированных тканей
и изолированных клеток играют большую роль в
расширении генетического базиса для селекции
растений.
∞ Одни из этих методов обеспечивают нетрадиционные
пути получения новых растительных форм и сортов.
∞ Другие же не подменяют традиционную селекцию, а
служат ей в качестве вспомогательных методов.
Методами первой группы являются:
методы клеточной селекции с использованием
каллусной ткани,
сомаклональная изменчивость и соматическая
гибридизация,
методы, используемые в генетической инженерии.
М.М.П.
12
13.
4.1СМсспк
Методы второй группы используются при:
преодолении прогамной несовместимости
(оплодотворение in vitro),
преодолении постгамной несовместимости
(эмбриокультура),
выращивании гаплоидов (культура пыльников и
пыльцы),
сохранении и размножении in vitro ценных элитных
растений, линий, отдалённых гибридов и редких,
исчезающих образцов растительных коллекций,
получении и сохранении безвирусного исходного
материала
и в иных случаях.
М.М.П.
13
14.
СМсспк4.2
2. Методы
микроклонального
размножения
М.М.П.
14
15.
4.2СМсспк
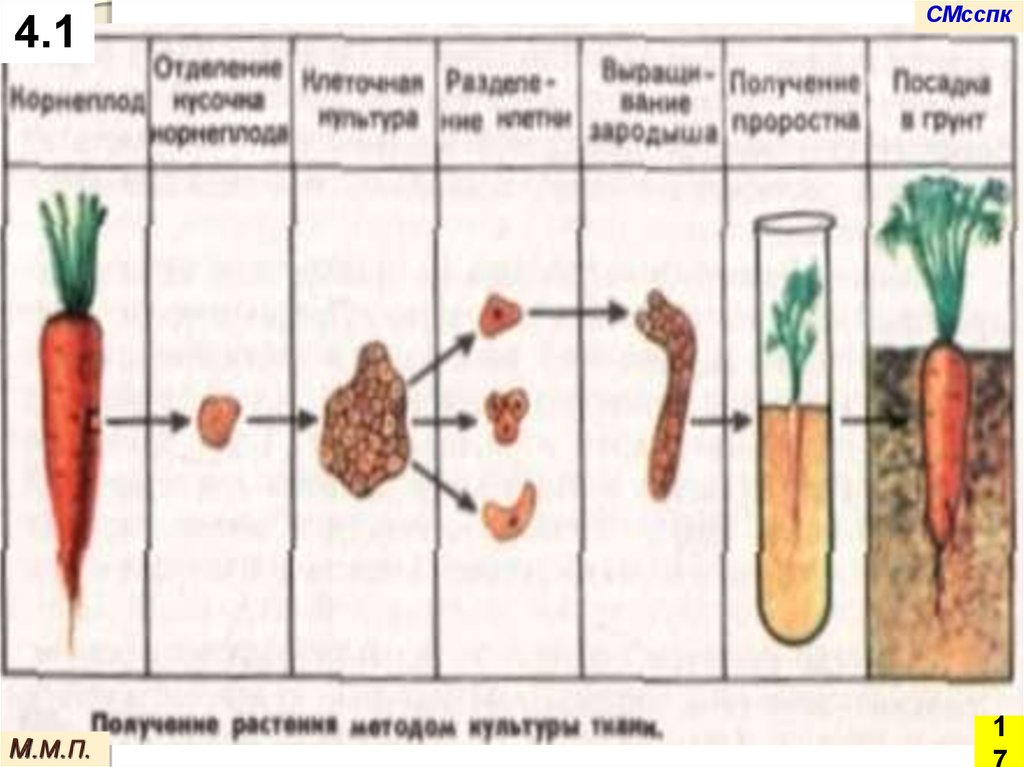
Методы культуры изолированных тканей и клеток in
vitro (микроклонального размножения) – наиболее
эффективные методы для получения вегетативного
потомства растений, обладающего всеми признаками
исходной формы, а также для оздоровления
посадочного материала.
Микроклональным размножением называют неполовое
размножение растений с помощью метода культуры клеток и
тканей, позволяющее получать растения, идентичные исходному.
Микроклональное размножение – это размножение растений in
vitro, «в пробирке».
Этот метод даёт возможность
усовершенствовать и резко
ускорить селекционный процесс.
С помощью метода микроклонального размножения можно
расширить возможности селекционной работы: получать клоны
клеток, а затем и растения с запрограммированными свойствами.
М.М.П.
15
16.
4.2СМсспк
Метод микроклонального размножения
применяют тогда, когда имеются трудности в половом
размножении сорта или когда получен удачный гибрид, но его
свойства нельзя сохранить, размножая половым путем.
Суть метода состоит в
том, что от маточного
растения отщипывается
образец ткани, который
помещается на
питательную среду в
стерильные условия, а
затем из него получают
микро-растение.
Позже это растение
превращается в
нормальный отросток, и
его можно вернуть в
естественные условия.
М.М.П.
16
17.
4.1М.М.П.
СМсспк
1
18.
4.2СМсспк
Преимущества микроклонального
размножения перед традиционными
способами размножения растений (семенным
и вегетативным):
получение генетически однородного посадочного
материала;
освобождение растений от вирусов; высокий коэффициент
размножения (от тысяч до миллионов);
сокращение продолжительности селекционного процесса;
ускорение перехода растений от ювенильной к
репродуктивной фазе развития;
размножение растений, трудно размножаемых
традиционными способами;
возможность проведения работ в течение всего года;
возможность автоматизации процесса выращивания.
М.М.П.
18
19.
4.2СМсспк
Примером использования микроклонального размножения
может служить массовое клонарное микроразмножение
плодовых, овощных и декоративных растений, а также их
оздоровление от вирусных и других инфекций.
Этот метод позволяет не только быстро
размножать новые перспективные сорта
растений, но и получить незараженный вирусами
посадочный материал.
М.М.П.
19
20.
СМсспк4.2
Экспланты
М.М.П.
На эффективность микроклонального
размножения влияет чрезвычайно
много факторов.
Одним из главных факторов является
выбор материнского растения и
экспланта (группы клеток,
отделенных от материнского
организма).
Прежде всего, исходные растения не
должны быть поражены грибными,
бактериальными и вирусными
заболеваниями и должны
находиться в фазе интенсивного
роста.
В качестве эксплантов лучше всего
использовать пазушные почки,
зародыши, молодые листья,
соцветия, черенки.
20
21.
4.2Процесс клонального микроразмножения
можно разделить на 4 этапа:
СМсспк
выбор растения донора, отбор эксплантов и получение
хорошо растущей культуры;
собственно размножение, когда достигается получение
максимального количества клонов;
укоренение побегов и адаптация к почвенным условиям;
пикировка в кассеты, доращивание в условиях теплицы.
1
2
3
4
М.М.П.
После 4-го этапа возможна
реализация либо посадка размноженных растений в поле.
21
22.
СМсспк4.2
Морфогенез каллусной ткани Получение мериклонов
Пробирочные культуры на этапе
укоренения
М.М.П.
Культивирование в теплице
22
23.
4.2СМсспк
Выбор растения-донора, изолирование
эксплантов и получение хорошо
растущей стерильной культуры.
Собственно микроразмножение, когда
достигается получение максимального
количества меристематических клонов.
3.Укоренение размноженных побегов с
последующей адаптацией их к
М.М.П.
почвенным условиям.
Выращивание растений в условиях
теплицы и подготовка их к
реализации или посадке в поле.
23
24.
4.2Выделяют несколько методов
микроклонального размножения:
СМсспк
Активация
уже существующих в растении
меристем (апекс стебля, пазушные и спящие
почки стебля).
Индукция возникновения почек или
эмбриоидов de novo:
♦индукция возникновения адвентивных
побегов непосредственно тканями
экспланта;
♦индукция соматического эмбриогенеза;
♦дифференциация адвентивных почек в
первичной и пересадочной каллусной
ткани.
М.М.П.
24
25.
4.2СМсспк
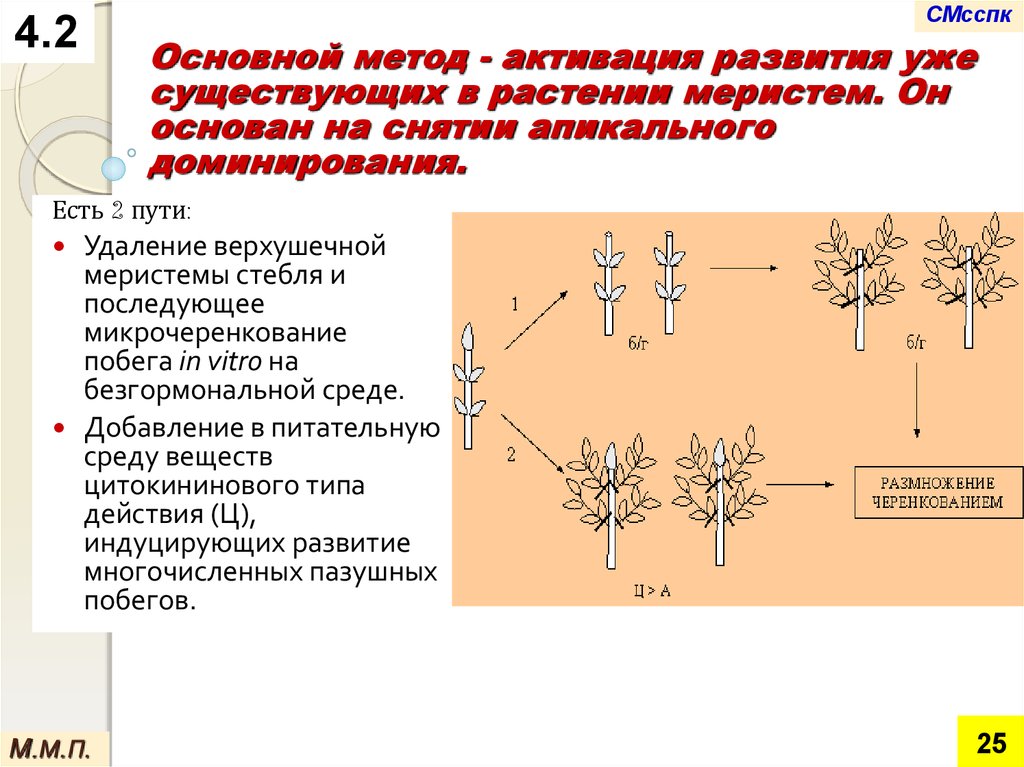
Основной метод - активация развития уже
существующих в растении меристем. Он
основан на снятии апикального
доминирования.
Есть 2 пути:
Удаление верхушечной
меристемы стебля и
последующее
микрочеренкование
побега in vitro на
безгормональной среде.
Добавление в питательную
среду веществ
цитокининового типа
действия (Ц),
индуцирующих развитие
многочисленных пазушных
побегов.
М.М.П.
25
26.
СМсспк4.2
Первый метод - активация развития меристемы
(черенкование розы)
М.М.П.
26
27.
4.2СМсспк
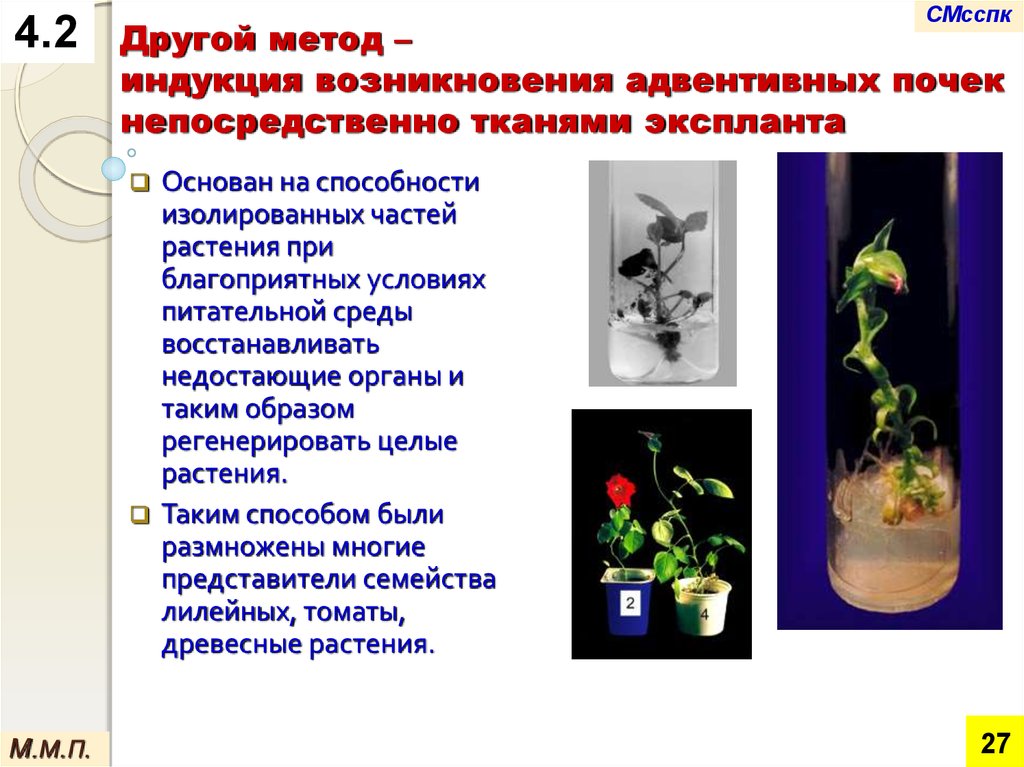
Другой метод –
индукция возникновения адвентивных почек
непосредственно тканями экспланта
Основан на способности
изолированных частей
растения при
благоприятных условиях
питательной среды
восстанавливать
недостающие органы и
таким образом
регенерировать целые
растения.
Таким способом были
размножены многие
представители семейства
лилейных, томаты,
древесные растения.
М.М.П.
27
28.
СМсспк4.2
М.М.П.
Другой метод – формирование адвентивных почек
в тканях экспланта
28
29.
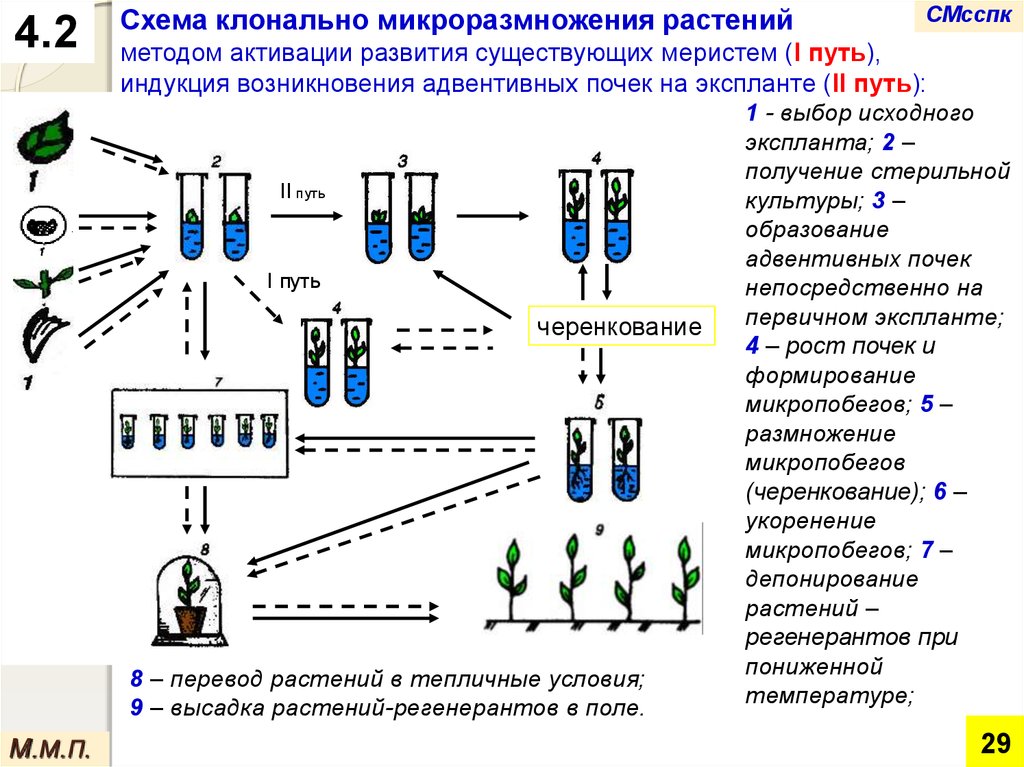
4.2Схема клонально микроразмножения растений
методом активации развития существующих меристем (I путь),
индукция возникновения адвентивных почек на экспланте (II путь):
II путь
I путь
черенкование
8 – перевод растений в тепличные условия;
9 – высадка растений-регенерантов в поле.
М.М.П.
СМсспк
1 - выбор исходного
экспланта; 2 –
получение стерильной
культуры; 3 –
образование
адвентивных почек
непосредственно на
первичном экспланте;
4 – рост почек и
формирование
микропобегов; 5 –
размножение
микропобегов
(черенкование); 6 –
укоренение
микропобегов; 7 –
депонирование
растений –
регенерантов при
пониженной
температуре;
29
30.
4.2Ещё один метод –
соматический эмбриогенез
СМсспк
Основывается на дифференциации из соматических
клеток зародышеподобных структур, которые
по своему виду напоминают зиготические зародыши.
Соматические зародыши
проходят 3 стадии
развития: глобулярную,
сердцевидную,
торпедовидную и в
конечном итоге
развиваются в
проросток.
М.М.П.
30
31.
4.2Ещё один метод - соматический эмбриогенез
СМсспк
Проростки пшеницы из соматического эмбриоида
М.М.П.
31
32.
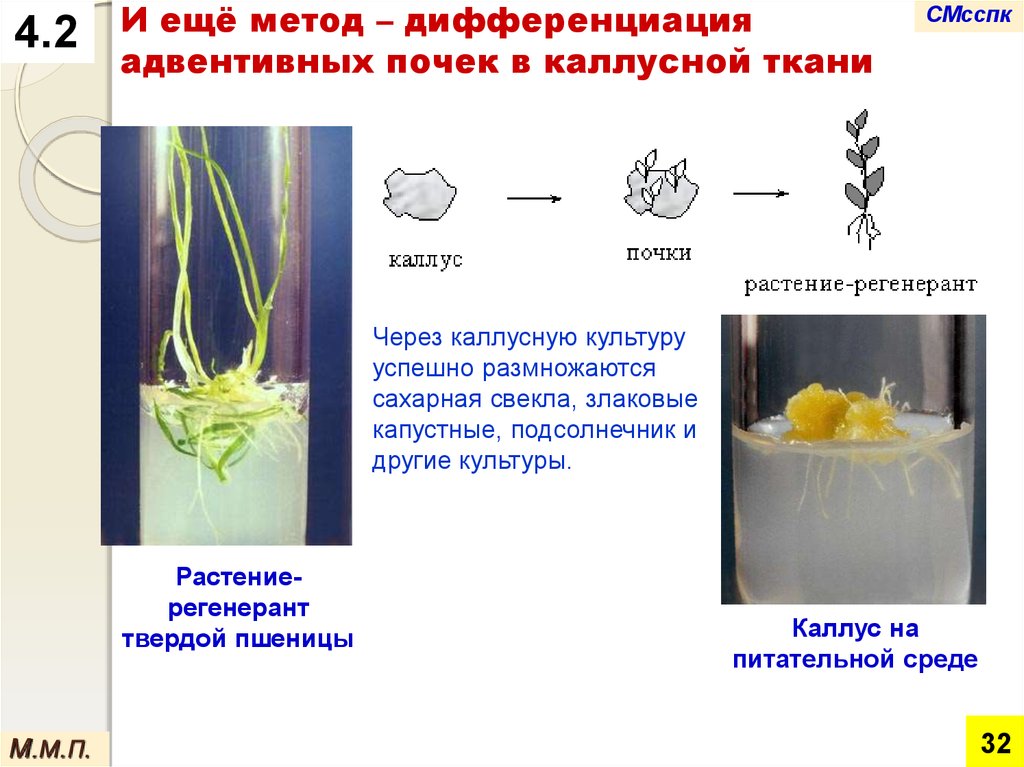
4.2И ещё метод – дифференциация
адвентивных почек в каллусной ткани
СМсспк
Через каллусную культуру
успешно размножаются
сахарная свекла, злаковые
капустные, подсолнечник и
другие культуры.
Растениерегенерант
твердой пшеницы
М.М.П.
Каллус на
питательной среде
32
33.
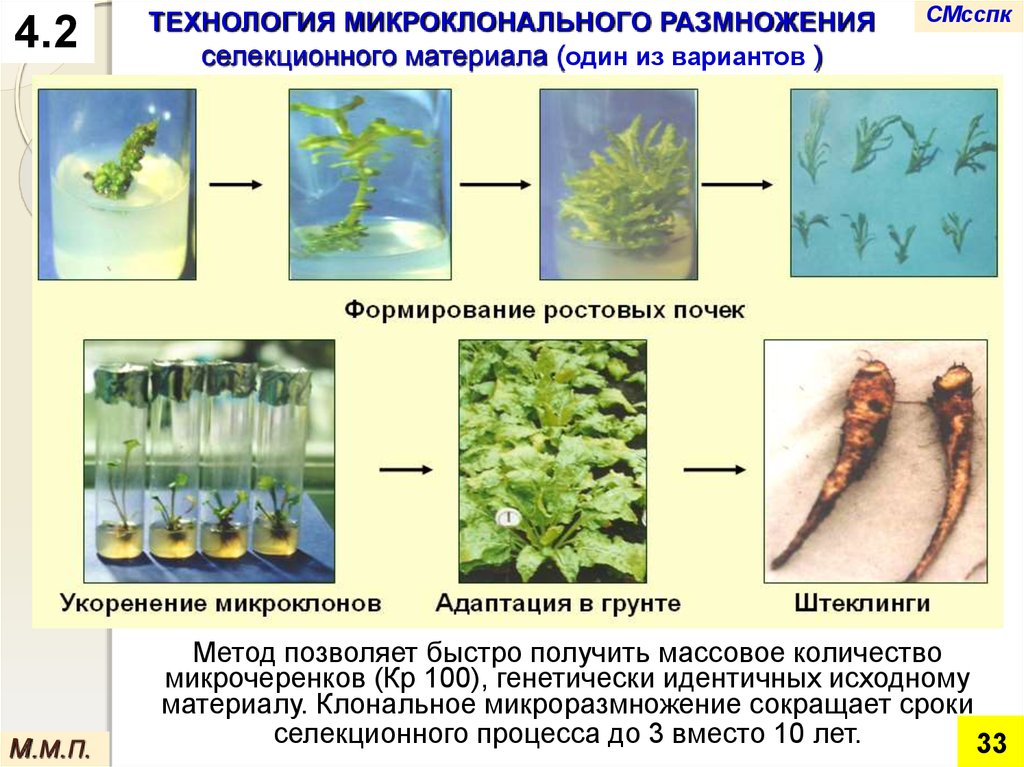
4.2М.М.П.
ТЕХНОЛОГИЯ МИКРОКЛОНАЛЬНОГО РАЗМНОЖЕНИЯ
селекционного материала (один из вариантов )
СМсспк
Метод позволяет быстро получить массовое количество
микрочеренков (Кр 100), генетически идентичных исходному
материалу. Клональное микроразмножение сокращает сроки
селекционного процесса до 3 вместо 10 лет.
33
34.
4.2МИКРОКЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ РОЗ
растения розы
черенкование
М.М.П.
СМсспк
черенкование
стерилизация эксплантов
34
35.
4.2МИКРОКЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ РОЗ
СМсспк
ризогенез
микрорастений
образование
побегов
высадка
микрорастений
в горшочки
поддержание высокой влажности
для укоренения и выживания
микрорастений в теплице
М.М.П.
35
36.
СМсспк4.3
3. Оздоровление
посадочного
материала
М.М.П.
36
37.
4.3СМсспк
В настоящее время метод активации развития
существующих в растении меристем широко
используется в производстве безвирусного посадочного
материала технических (сахарная свекла, хмель, табак,
топинамбур, стахис) и овощных культур (томаты,
картофель, огурец, перец, тыква, спаржа и др.),
а также для размножения культур промышленного
цветоводства (гвоздика, хризантема, роза, гербера),
тропических и субтропических растений (рододендрон,
азалия, камелия, чай и др.), плодовых и ягодных культур
(яблоня, слива, вишня, груша, виноград, малина,
смородина, крыжовник и др.) и древесных растений
(тополь, ива, ольха, береза, рябина, секвойя, туя,
можжевельник и др.).
М.М.П.
37
38.
4.3СМсспк
Вызывающие болезни растений вирусы, вироиды и микоплазмы
передаются из поколения в поколение, причём не только при
вегетативном размножении (картофель), но и при семенном
(соя).
Наиболее эффективный для оздоровления от этой инфекции
способ – культивирование растительных меристем стебля или
органов стеблевого происхождения. В трудных случаях метод
культуры меристем дополняют термо- и хемотерапией.
Схема мест формирования растительных
меристем на побеге: 1 – верхушечные, 2 –
боковые, 3 – промежуточные
М.М.П.
38
39.
4.3СМсспк
Одно из преимуществ клонального
микроразмножения – получение генетически однородного,
безвирусного посадочного материала растений.
Это можно достичь, используя меристемные ткани апексов
и пазушных почек органов стеблевого происхождения.
Как правило, меристема состоит из конуса нарастания, а
также одного или двух листовых зачатков (примордий) и
является свободной от инфекции.
Оздоровлённые применением меристемной культуры растения
размножают далее, чаще всего, обычным методом клонального
размножения.
М.М.П.
39
40.
4.3М.М.П.
СМсспк
Для некоторых сельскохозяйственных культур,
таких как картофель, технология получения
безвирусного посадочного материала с
использованием клонального
микроразмножения поставлена на
промышленную основу.
Применение метода активации развития
существующих в растении меристем позволяет
получать из одной меристемы картофеля
более 1млн. растений в год, причем
технология предусматривает получение в
пробирках микроклубней – ценного
безвирусного семенного материала.
40
41.
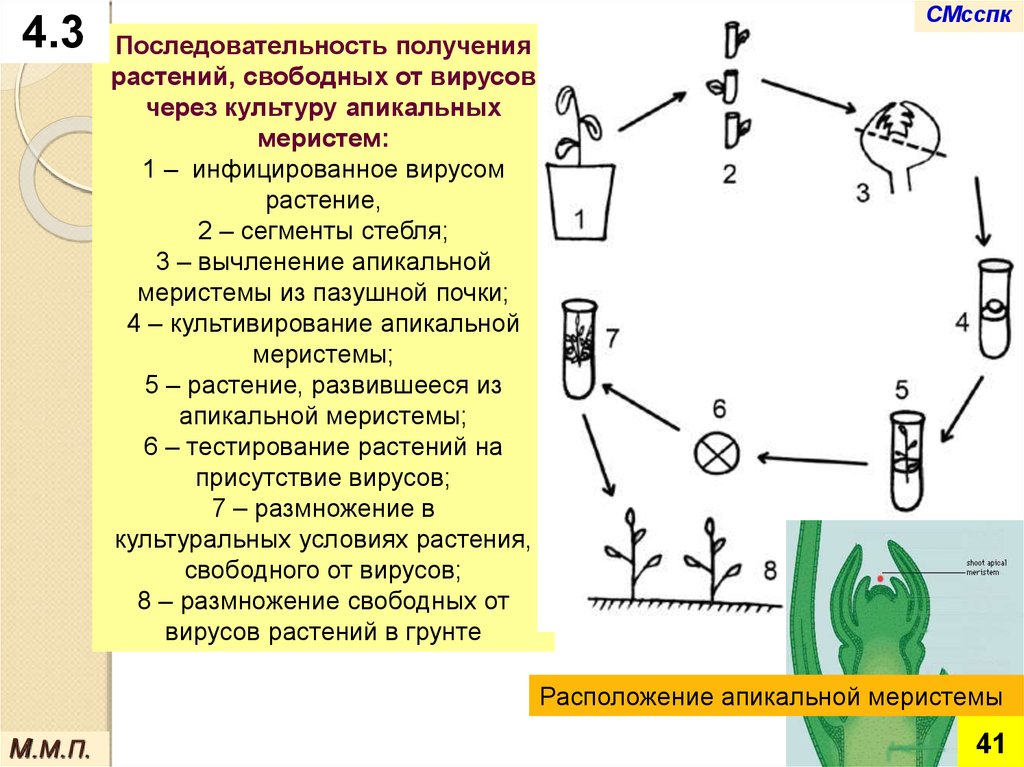
4.3СМсспк
Последовательность получения
растений, свободных от вирусов
через культуру апикальных
меристем:
1 – инфицированное вирусом
растение,
2 – сегменты стебля;
3 – вычленение апикальной
меристемы из пазушной почки;
4 – культивирование апикальной
меристемы;
5 – растение, развившееся из
апикальной меристемы;
6 – тестирование растений на
присутствие вирусов;
7 – размножение в
культуральных условиях растения,
свободного от вирусов;
8 – размножение свободных от
вирусов растений в грунте
Расположение апикальной меристемы
М.М.П.
41
42.
4.3СМсспк
Этапы размножения пробирочных растений картофеля
черенкованием:
а – микропобег = объект черенкования (линиями отмечены места
разрезов при черенковании), б – микрочеренок на питательной
среде, в – развитие растения картофеля из черенка.
М.М.П.
42
43.
4.3СМсспк
2
1
3
1 – микрорастение
картофеля; 2 –
размножение картофеля
in vitro; 3 – микроклубни
безвирусного картофеля
М.М.П.
43
44.
4.3Этапы получения пробирочных растений
картофеля
Питательная
среда
М.М.П.
Посадка
апикальной
меристемы
Проросто
к из
меристемы
Пробирочное
растение из
меристемы
СМсспк
Пробирочное растение из
меристемы
после
черенкования
44
45.
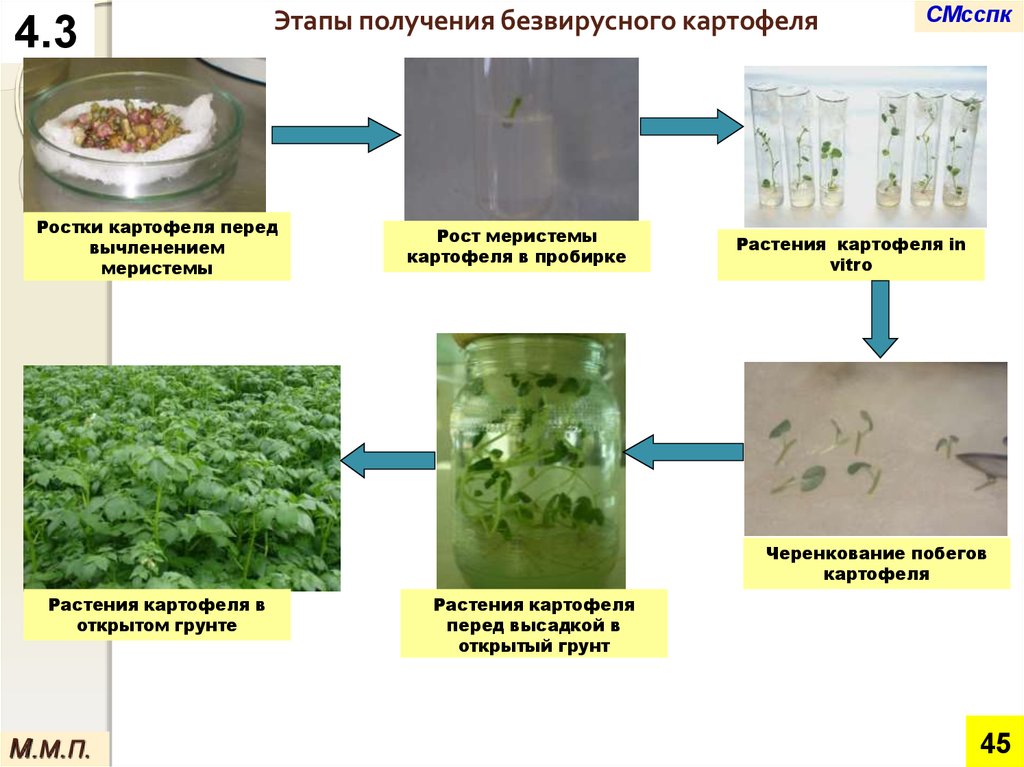
4.3Этапы получения безвирусного картофеля
Ростки картофеля перед
вычленением
меристемы
Рост меристемы
картофеля в пробирке
СМсспк
Растения картофеля in
vitro
Черенкование побегов
картофеля
Растения картофеля в
открытом грунте
М.М.П.
Растения картофеля
перед высадкой в
открытый грунт
45
46.
СМсспк4.4
4. Клеточная
селекция
М.М.П.
46
47.
4.4СМсспк
Если при культивировании изолированных клеток их
обработать мутагеном и поместить в какие-то
неблагоприятные условия, выживут только
мутанты, устойчивые к этим условиям.
Такими неблагоприятными условиями могут быть
токсичные вещества (пестициды, гербициды),
возбудители болезней или факторы роста, которых
не хватает в почве, засоление почвы, её
повышенная кислотность, и т. п.
Подобные манипуляции в культуре изолированных
клеток принято относить к методу клеточной
селекции.
М.М.П.
47
48.
4.4СМсспк
Клеточная селекция –
селекция, которая проводится на клеточном уровне.
Это направление клеточной инженерии, позволяющее
ускорить получение высокоценных сортов, уникальных
генотипов.
Клеточная селекция является как бы развитием
мутационной селекции, но реализуется на уровне
единичных клеток с использованием техники in vitro.
М.М.П.
48
49.
СМсспк4.4
М.М.П.
Использование мутагенов позволяет существенно расширить
спектр сомаклональной изменчивости и благодаря этому
повысить эффективность клеточной селекции.
В качестве исходного материала для экспериментального
мутагенеза используют:
каллюсные и суспензионные культуры и культуры протопластов
(обработка мутагенами и отбор на селективных средах)
Также нашли применение обработки мутагенами:
Семян с последующим получением из зародышей или проростков
культуры клеток in vitro
пробирочных растений или эксплантатов, которые дают
морфогенный каллюс, или культуры, способные к эмбриогенезу.
49
50.
4.4М.М.П.
СМсспк
Наиболее распространенный метод отбора мутантных
клеточных вариантов - прямая (позитивная)
селекция. Её используют для выделения мутантов,
устойчивых к различным антиметаболитам:
гербицидам, антибиотикам, токсинам. Применяют две
основные стратегии прямой селекции: одношаговую и
многошаговую, или ступенчатую.
Для отбора условно летальных мутантов (ауксотрофных,
чувствительных к стрессовым воздействиям) применяют
непрямую (негативную) селекцию. Этот метод селекции
основан на избирательной гибели под действием
селективного фактора делящихся клеток дикого типа и
выживании метаболически неактивных мутантных клеток.
В некоторых случаях отбор клеточных вариантов
можно проводить визуально по внешним признакам.
Еще один метод – тотальная селекция, которая
основана на индивидуальном тестировании
отдельных клеточных клонов.
50
51.
4.4СМсспк
Использование техники in vitro придаёт клеточной селекции
более широкие возможности в сравнении с традиционными
методами селекции, но и создает значительные трудности в
работе из-за необходимости регенерации из отдельных
клеток полноценных организмов.
Преимущество клеточной селекции
перед традиционными методами
состоит в отсутствии сезонности в
работе, возможности использования
миллионов клеток при отборе,
направленности селекции путем
применения селективных сред и
выполнении работ в лабораторных
условиях.
М.М.П.
В результате клеточной селекции
получены растения, устойчивые к
возбудителям картофельной
гнили, фитофторы, к гербицидам,
и т. д.
51
52.
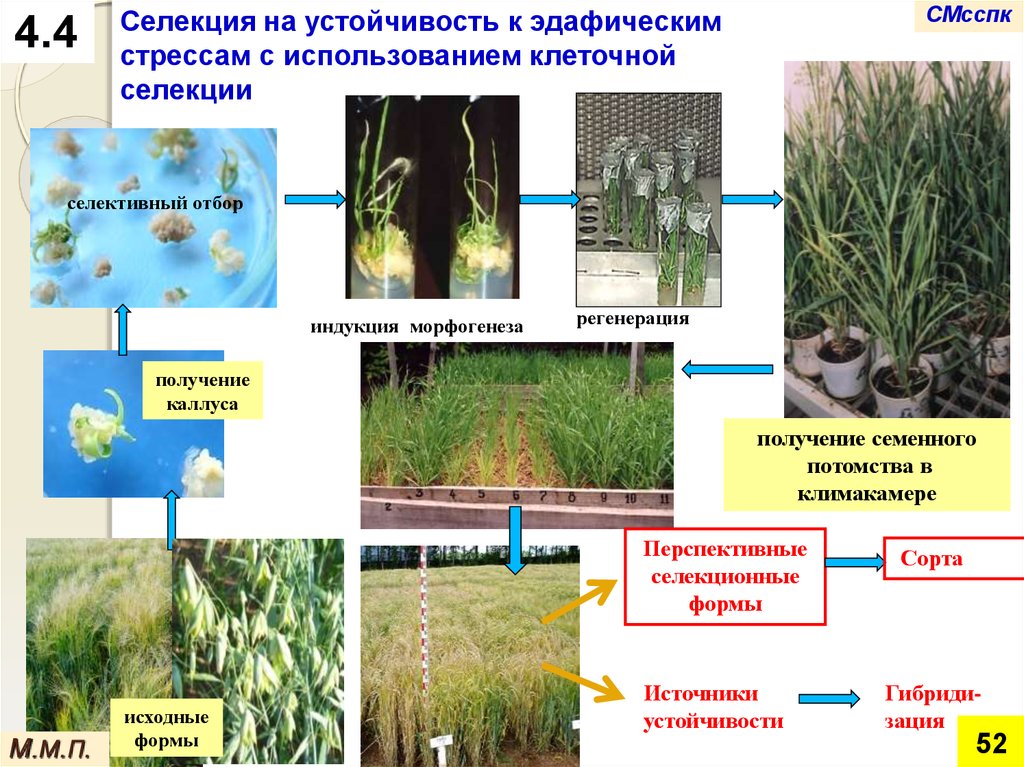
4.4СМсспк
Селекция на устойчивость к эдафическим
стрессам с использованием клеточной
селекции
селективный отбор
индукция морфогенеза
регенерация
получение
каллуса
получение семенного
потомства в
климакамере
Перспективные
селекционные
формы
М.М.П.
исходные
формы
Источники
устойчивости
Сорта
Гибридизация
52
53.
4.5СМсспк
5. Генетическое
улучшение растений
(получение гаплоидов,
сомаклональная
изменчивость, соматическая
гибридизация)
М.М.П.
53
54.
4.5М.М.П.
СМсспк
С развитием культуры in vitro появилась
реальная возможность широкого использования
гаплоидии в селекции сельскохозяйственных культур.
54
55.
4.5СМсспк
Применение метода культуры клеток позволило
осуществить регенерацию растений из генеративных
клеток, содержащих гаплоидный набор хромосом.
Стало возможным массовое получение гаплоидов.
Практическое значение в селекции в настоящее
время получили культура пыльников (андрогенез),
завязей и семяпочек (гиногенез) и метод
гаплопродюсера, который является разновидностью
гиногенеза.
Метод культуры клеток позволяет получать
гомозиготный материал из обогащенных в
генетическом отношении гибридов без
многократного самоопыления за 2 - 3 года вместо
8 - 10 лет при традиционной селекции
М.М.П.
55
56.
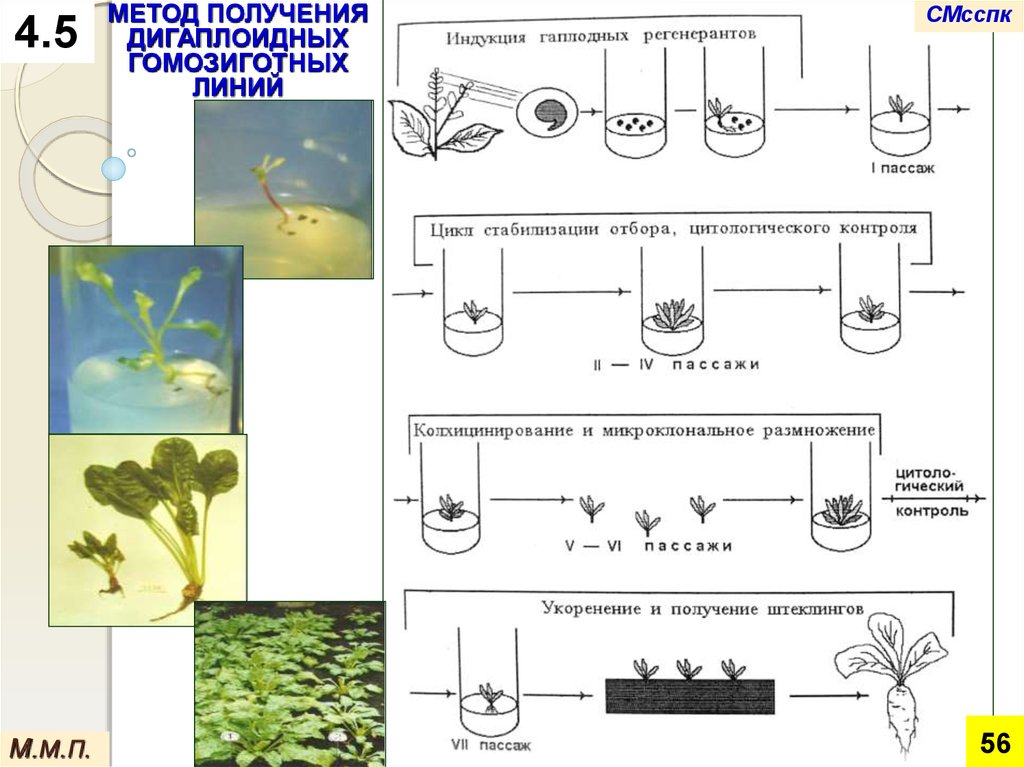
4.5М.М.П.
МЕТОД ПОЛУЧЕНИЯ
ДИГАПЛОИДНЫХ
ГОМОЗИГОТНЫХ
ЛИНИЙ
СМсспк
56
57.
СМсспкТехнология получения
гомозиготных линий злаков
4.5
1. Отбор донорных
растений и
культивирование
пыльников на среде
с 2,4 - Д
5. Размножение семян для
последующего селекционного
изучения
М.М.П.
2. Получение гаплоидных
новообразований
(эмбриоидов и каллусов)
4. Удвоение
числа хромосом
колхицином у
регенерантов
3. Регенерация
гаплоидных
растений
57
58.
4.5М.М.П.
СМсспк
При изучении растений, регенерированных
из соматических клеток в культуре in vitro,
было установлено, что они генетически не
всегда однородны.
Эту, так называемую сомаклональную
изменчивость, стали использовать в
селекции растений как источник полезных
мутаций.
58
59.
4.5СМсспк
У регенерантов, в отличие от
индуцированных мутантов, редко
наблюдается мозаичность, что
является результатом их
происхождения из единичной
клетки, и поэтому сомаклоны
могут быть стабилизированы в
течение одного поколения.
Растения сомаклональных вариантов
могут отличаться от прототипа не только
моногенными качественными признаками,
но и (что более важно практически)
количественными полигенными
признаками (продуктивность,
толерантность, и др.), и могут сочетать
признаки, которые невозможно или трудно
соединить в одном генотипе
традиционным селекционным путём.
М.М.П.
59
60.
4.5СМсспк
Клеточные культуры используют и для гибридизации
клеток. Это принципиально новый способ создания
гибридов на основе соединения в единую систему
будущего организма не половых, а соматических
клеток.
Соматическая гибридизация – это слияние лишённых
оболочки соматических клеток (т.н. протопластов).
Таким способом можно преодолеть физиологическую
несовместимость и скрещивать неродственные виды,
получать ассиметричные гибриды.
Сущность соматической гибридизации состоит в том, что
в качестве гибридизуемых клеток используют не гаметы
(репродукционные клетки), а клетки тела растений
(соматические), из которых получаются протопласты.
М.М.П.
60
61.
4.5СМсспк
Протопласты – это содержимое растительной
клетки растений после разрушения клеточной
стенки специальными ферментными
препаратами (целлюлазой, гемицеллюлазой и
пектиназой).
Чтобы выделить жизнеспособные протопласты,
необходим осмотический стабилизатор
(растворы сахаров, солей) и другие
соответствующие факторы: рН,
освещенность, температура.
После прекращения действия ферментов у протопластов
начинает образовываться клеточная стенка.
Целое растение можно получить от протопластов
далеко не всех растений.
М.М.П.
61
62.
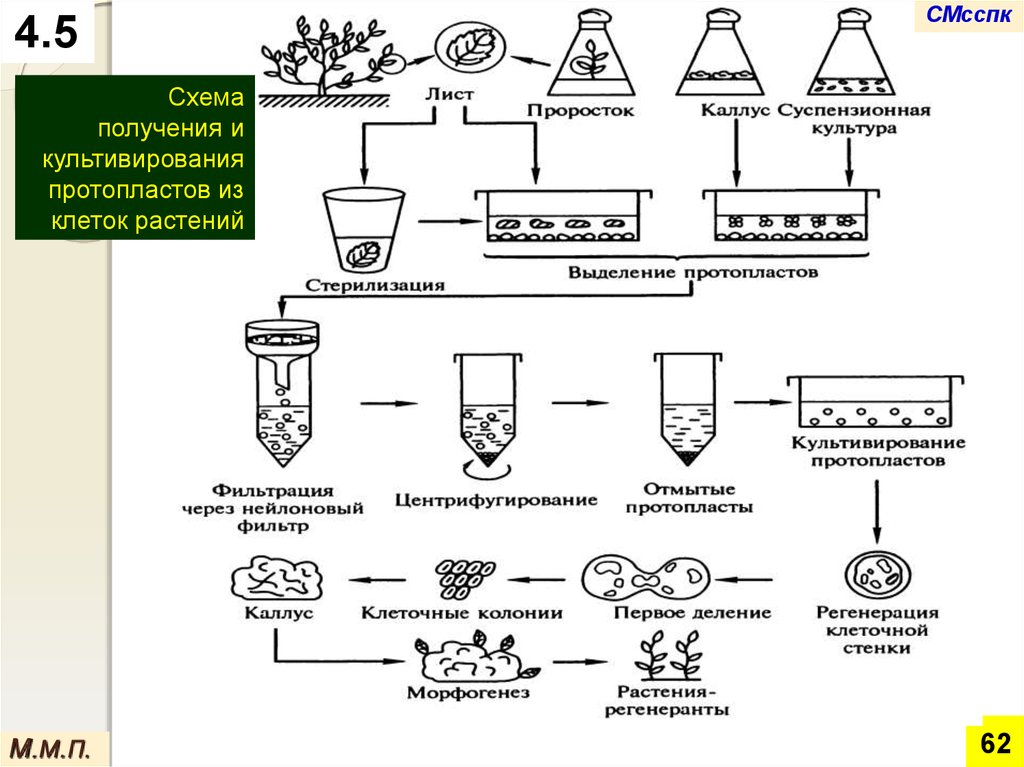
4.5СМсспк
Схема
получения и
культивирования
протопластов из
клеток растений
М.М.П.
62
63.
4.5СМсспк
Развитие техники культивирования
растительных клеток in vitro, обеспечивающей
возможность получения изолированных
протопластов, разработка методов
индуцированного слияния протопластов, а затем
их выращивания с образованием каллуса и в
последующем целого растения, и привели к
формирование нового перспективного метода
гибридизации растений, который получил
название соматической гибридизации.
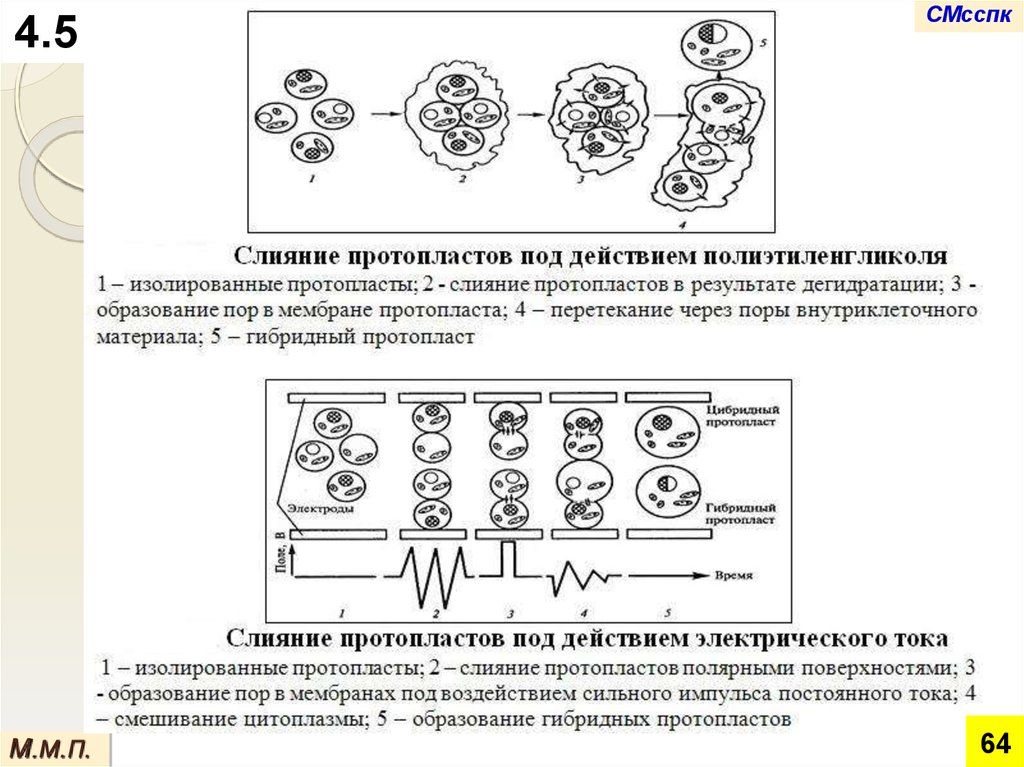
Слияние протопластов обеспечивает объединение не только
клеточных геномов, но и двух различных цитоплазм.
Слияние протопластов может происходить
спонтанно, но более успешно оно
осуществляется при использовании
индуцирующих факторов (этиленгликоль,
переменное электрическое поле, и др.).
М.М.П.
63
64.
4.5М.М.П.
СМсспк
64
65.
4.5В большинстве известных случаев слияние
протопластов высших растений приводит к
образованию либо гибрида, либо цибрида.
СМсспк
Цибридное растение содержит ядро одного партнёра, а
цитоплазму – обоих партнеров и потому является
гетерозиготным по внеядерным (цитоплазматическим)
генам, определяющим, например, устойчивость к
гербицидам или признак цитоплазматической мужской
стерильности.
Этапы соматической гибридизации:
получение протопластов из тканей выбранных
родителей,
обеспечение слияния ядер,
отбор слившихся гетерокарионтов,
обеспечение начала деления клеток,
регенерация гибридных растений.
М.М.П.
65
66.
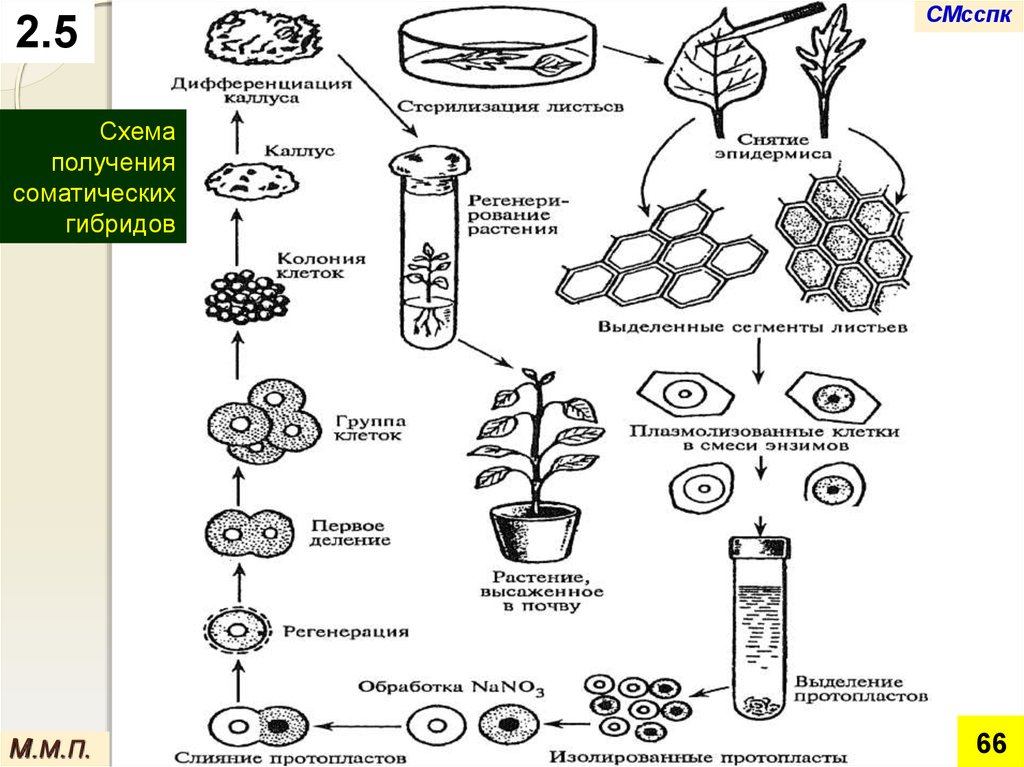
2.5СМсспк
Схема
получения
соматических
гибридов
М.М.П.
66
67.
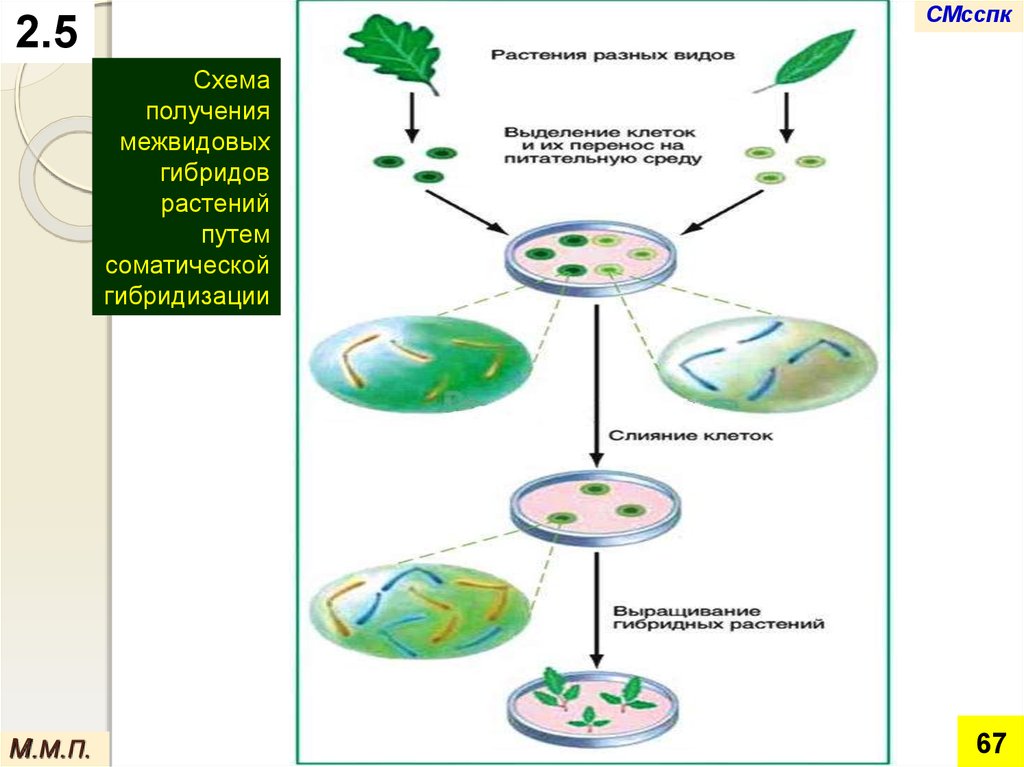
СМсспк2.5
Схема
получения
межвидовых
гибридов
растений
путем
соматической
гибридизации
М.М.П.
67


















































 Биология
Биология








