Похожие презентации:
Термохимия. Типы энтальпии
1. Термохимия
Типы энтальпииТеплоемкость
Закон Кирхгофа
Закон Гесса
Нураденова Айнагуль
АТ-17-2.1
1
2. Термохимия
Термохимия - это разделтермодинамики.
Термохимия изучает
тепловые эффекты
химических реакций.
Реакционный сосуд и его
содержание образуют
термодинамическую систему.
Химическая реакция, которая
протекает в системе, приводит
к обмену энергией между
системой и окружающей
средой.
Внешняя среда
вещество
система
энергия
вещество
энергия
2
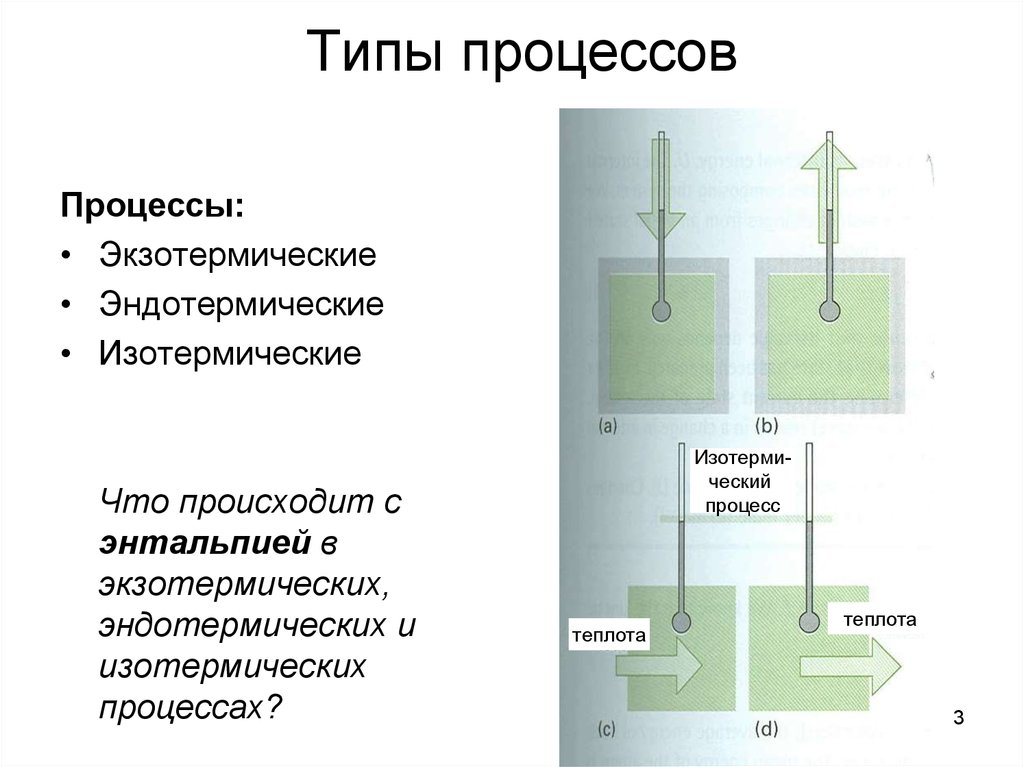
3. Типы процессов
Процессы:• Экзотермические
• Эндотермические
• Изотермические
Что происходит с
энтальпией в
экзотермических,
эндотермических и
изотермических
процессах?
Изотермический
процесс
теплота
теплота
3
4. Изменение энтальпии в экзотермических и эндотермических процессах
Выделение теплоты приводит к уменьшениюэнтальпии системы (при Р = const). Поэтому
для экзотермического процесса:
ΔH < 0.
Поглощение теплоты приводит к увеличению
энтальпии системы (при Р = const). Поэтому
для эндотермического процесса:
ΔH > 0.
4
5. Измерение теплоты химической реакции
H = U + PVЕсли для реакции известно
ΔU или ΔH то можно
предсказать сколько теплоты
выделяется или
поглощается в реакции.
Калориметрия - это метод,
который используется для
измерения теплоты, которая
поглощается или
выделяется в ходе
химической реакции.
При постоянном объеме
количество теплоты будет
равно изменению
внутренней энергии.
U = Qv (V=const)
При постоянном давлении
количество теплоты будет
равно изменению энтальпии
H = QP (P=const)
5
6. Стандартная энтальпия и стандартное состояние
Стандартное изменениеэнтальпии, ΔH°, - это
изменение энтальпии для
процесса, в котором
исходные вещества и
продукты находятся в
стандартном состоянии.
Стандартное состояние
вещества при определенной
температуре - это его
состояние при стандартном
давлении.
(1 aтм, или1.01325 . 105 Пa).
Примеры:
стандартное состояние
жидкого этанола - это
жидкий этанол при 298
K и 1 aтм;
стандартное состояние
твердого железа – это
железо при 500 K и 1
aтм.
6
7. Энтальпия физических превращений
Стандартная энтальпия образованиявещества ΔfH° - это стандартная энтальпия
химической реакции образования вещества
из элементов.
Стандартная энтальпия сгорания
вещества ΔcH° - это стандартная энтальпия
полного окисления органического вещества
до CO2 и H2O.
7
8. Энтальпия физических превращений
Стандартная энтальпия фазового перехода ΔtrsH° – этоизменение стандартной энтальпии при изменении физического
состояния вещества.
Примеры изменения
физического состояния
вещества:
испарение
конденсация
плавление
кристаллизация
возгонка
сублимация
Что происходит
с веществом
в этих процессах?
8
9. Энтальпия физических превращений
Стандартная энтальпия испарения, ΔvapH°, этоизменение энтальпии при испарении 1 моль чистой
жидкости при 1 атм
Пример :
H2O(ж) → H2O(г) + ΔvapH°
ΔvapH°(373 K) = +40.66 kДж/моль
Стандартная энтальпия плавления ΔfusH°, это
изменение энтальпии при переходе 1 моль твердого
вещества в жидкость.
Пример:
H2O(тв) → H2O(ж) + ΔfusH°
ΔfusH°(273 K) = +6.01 kДж/моль
9
10. Стандартная энтальпия возгонки
Два этапа:H2O(тв) → H2O(ж) + ΔfusH°
H2O(ж) → H2O(г) + ΔvapH°
Энтальпия, Н
H2O(тв) → H2O(г) + ΔsubH°
ΔsubH° = ΔfusH° + ΔvapH°
10
11. Энтальпия прямого и обратного процесса
ΔH° (A B) = -ΔH° (B A)Энтальпия, Н
Энтальпия – это
функция состояния
Пример:
Энтальпия испарения воды
равна +44kДж/моль.
Чему равна энтальпия
конденсации воды?
11
12. Типы энтальпии
Фазовый переходФазовый переход
процесс
фаза
обозначение
фаза
плавление
твердое
испарение
жидкое
газ
твердое
газ
возгонка
смешение
вещества
растворение
вещество
гидратация
смесь
раствор
(ж)
(г)
атомизация
вещества
ионизация
(г)
Присоединение е
(г)
реакция
реагенты
сгорание
жидкое
вещества
атомы
(г)
(г)
(г)
(г)
продукты
оксиды
12
образование
элементы
соединение
13. Энтальпия химической реакции (Тепловой эффект )
элементыЭнтальпия, Н
Стандартная энтальпия
химической реакции, ΔrH° это изменение энтальпии
когда продукты реакции в
стандартном состоянии
переходят в реагенты в
стандартном состоянии.
реагенты
продукты
13
14. Энтальпия химической реакции
Расчет энтальпии химическойреакции с использованием
стандартных энтальпий
образования веществ:
Пример :
CH4(г) + 2O2(г) → CO2(г) +
2H2O(ж) + ΔrH°
продукты
реагенты
ΔrH = – 890 kДж/моль
14
15. Энтальпия химической реакции
Расчет энтальпии химическойреакции с использованием
стандартных энтальпий
сгорания веществ:
Пример :
C6H12O6(тв) + 6O2(г) = 6CO2(г)+ 6H2O(ж)
реагенты
продукты
ΔrH = -2808 kДж/моль
15
16. Закон Гесса
Теловой эффект химической реакции можноопределить если известны энтальпии других реакций,
из которых можно получить суммарную реакцию.
Закон Гесса:
Стандартная энтальпия реакции может быть
определена как сумма стандартных энтальпий реакций,
из которых можно получить данную реакцию.
Термодинамическая основа закона Гесса – это
независимость пути получения энтальпии реакции.
16
17. Применение закона Гесса
МетодПример
Метод
термохимических
схем
Метод
термохимических
уравнений
17
18. Метод термохимических схем
+О2Метод
термохимических
уравнений
Н1
Н2
(1)
(2)
(3)
Н3
+1/2 О2
+1/2 О2
Н2 = -110,53 кДж/моль
Н3 = -282,98 кДж/моль
Сложение уравнений (2) и (3)
дает уравнение (1).
Н2 + Н3 = -393,51 кДж/моль
Н1 = -393,51 кДж/моль
Поэтому:
Н1= Н2 + Н3
18
19. Применение закона Гесса
МетодПример
Метод
термохимических схем
Метод
термохимических
уравнений
Использование стандартных
энтальпий образования
продукты
реагенты
Использование стандартных
энтальпий сгорания
реагенты
продукты
Приближенные методы
Расчет по энергиям связи
Использование тепловых поправок
Сравнительный расчет
19
20. Теплоемкость
• Внутренняя энергиявещества возрастает если
температура повышается.
(Кривая на графике
характеризует
теплоемкость).
• Производная поглощенной
теплоты , отнесенная к
температуре называется
теплоемкостью.
Q
C
dT
Внутренняя энергия
Теплоемкость
Температура
20
21. Молярная и удельная теплоемкость
Удельная теплоемкость вещества – этотеплоемкость, отнесенная к массе вещества
Молярная теплоемкость при постоянном
объеме, CV,m, - теплоемкость одного моля
вещества.
Теплоемкость является экстенсивным
термодинамическим параметром.
Но: молярная теплоемкость при постоянном
объеме является интенсивным параметром.
(все молярные величины являются
интенсивными).
21
22. Резюме
ТеплоемкостьТеплоемкость
уд
м
Удельная = Дж/К г
Молярная = Дж/К моль
Средняя теплоемкость
м
уд
22
23. Зависимость теплоемкости от температуры
В общем случае эмпирическая зависимостьтеплоемкости от температуры выражается
полиномом:
23
24. Определение dU и dH
Теплоемкость при постоянном объемеиспользуется для расчета изменения
внутренней энергии при изменении
температуры при постоянном объеме:
dU = CV dT
Теплоемкость при постоянном давлении
используется для расчета изменения
энтальпии при изменении температуры
при постоянном давлении:
dH = Cp dT
24
25. Зависимость энтальпии от температуры
dH CP dTH T2
H T1
H T2
T2
dH CP dT
T1
T2
c
dH a bT 2 dT
T
H T1
T1
dx x
1 2
xdx 2 x
dx
1
x2 x
1 1
1
2
2
H T2 H T1 a T2 T1 b T2 T1 c
2
T2 T1
25
26. Зависимость энтальпии от температуры
2627. Закон Кирхгофа для химической реакции
H T1dH CP dT
продукты
Энтальпия, Н
• Зависимость энтальпии
химической реакции от
температуры выражается
законом Кирхгофа.
• Для химической реакции:
H T2
T2
H T2
H T1
T2
dH CP dT
T1
T1
Это выражение
применяется для
каждого вещества в
реакции:
C p vC p ( f ) vC p (i )
реагенты
Температура
27
28. Закон Кирхгофа для химической реакции
• Уравнение Кирхгофаможно записать для
зависимости внутренней
энергии химической
реакции от температуры
• Для химической реакции:
U T2
U T1
T2
dU CV dT
T1
Внутренняя энергия, U
Закон Кирхгофа для химической реакции
продукты
H T2
H T1
T2
U
dH CP dT
T1
U
реагенты
C p vC p ( f ) vC p (i )
Температура
28
29. Закон Кирхгофа для химической реакции
C p vC p ( f ) vC p (i )H T2
c
C p a bT 2
T
H T1
T2
dH CP dT
T1
T2
HT2 HT1 CP dT
T1
H T2
c
dH a bT 2 dT
T
H T1
T1
T2
29
30. Энтальпия фазового перехода
CpКипение
Плавление
Энтальпия фазового перехода
Н
Н(кип)
твердое
жидкое
Н(плавл)
газ
Н(0)
Т(плавл) Т(кип)
Н (T ) НТ1
Tплавл
T1
C p ( тв ) dT плавл H
Т(плавл)
Tкип
Tплавл
Т(кип)
C p ( жид ) dT испар H
T2
C
Tкип
p ( газ )
dT
30
31. Важные соотношения в термохимии
Применение первого законатермодинамики для химических процессов
продуктов и реагентов
одинакова
продукты
реагенты
реагенты
продукты
Расчет энтальпии
химической реакции
при любой температуре
продукты
реагенты
31
32. Энтальпия образования ионов в растворе
Тепловой эффект образованияхимического соединения в растворе,
диссоциирующего на ионы,
определяется по энтальпиям
образования ионов в растворе.
Пример:
Теплота образования иона SO42равна энтальпии реакции:
S(тв) + 2O2(г) + H2O(ж) + 2e = SO42(aq)
Теплота образования вещества в
растворе равна сумме теплоты
образования и теплоты растворения.
32
33. Теплота растворения
• Теплота растворения зависит отконцентрации химического
соединения в растворе.
• Теплота, которая поглощается
или выделяется при образовании
раствора определенной
концентрации (моляльности) –
интегральная теплота
растворения.
• Теплота растворения зависит от:
– Теплоты разрушения
кристаллической решетки
– Теплоты сольватации
33
34. Моляльность
• Моляльность – способвыражения
концентрации раствора.
• Моляльность
показывает количество
молей растворенного
вещества в 1000 г
растворителя.
34
35. Зависимость интегральной теплоты растворения от моляльности раствора
НmН0m1
Н0
Нm1m2
Нm1
Н0m2
m1
m2
Н0s
m
35
36. Интегральная теплота растворения
• ∆Н0 – первая интегральнаятеплота растворения. Это
тепловой эффект при
растворении 1 моль вещества в
бесконечно большом объеме
растворителя.
• ∆Нs – полная интегральная
теплота растворения. Это
теплота растворения 1 моль
вещества в таком объеме
растворителя, чтобы
образовался насыщенный
раствор.
36
37. Тепловой эффект при разведении раствора
Прибавление воды краствору
сопровождается
теплотой разведения.
Интегральная теплота
разведения – это
тепловой эффект при
разбавлении раствора,
который содержит 1
моль вещества, до
бесконечного
разведения.
H
o
m1
H o H m1
37
38. Промежуточная теплота разведения
Промежуточнаятеплота
разведения – это
тепловой эффект
разбавления
раствора,
содержащего 1 моль
вещества от
концентрации m2 до
меньшей
концентрации m1.
H
m1
m2
H m1 H m 2
38
39. Промежуточная теплота раcтворения
Hm2
m1
H m 2 H m1
Промежуточная
теплота раcтворения
– это тепловой
эффект, который
получается при
концентрировании
раствора от
концентрации m1 до
большей
концентрации m2.
39





































 Химия
Химия








