Похожие презентации:
Термохимия. Расчет тепловых эффектов химических реакций
1. Термохимия.
Расчет тепловыхэффектов химических
реакций.
2. Закон Гесса.
• Термодинамическая основа закона Гесса –независимость теплового эффекта химической реакции
от способа её проведения.
QP H
QV U
• Закон Гесса – следствие I начала термодинамики.
При постоянном давлении или объеме тепловой
эффект химической реакции зависит только от вида и
состояния исходных веществ и продуктов реакции,
но не зависит от пути протекания процесса.
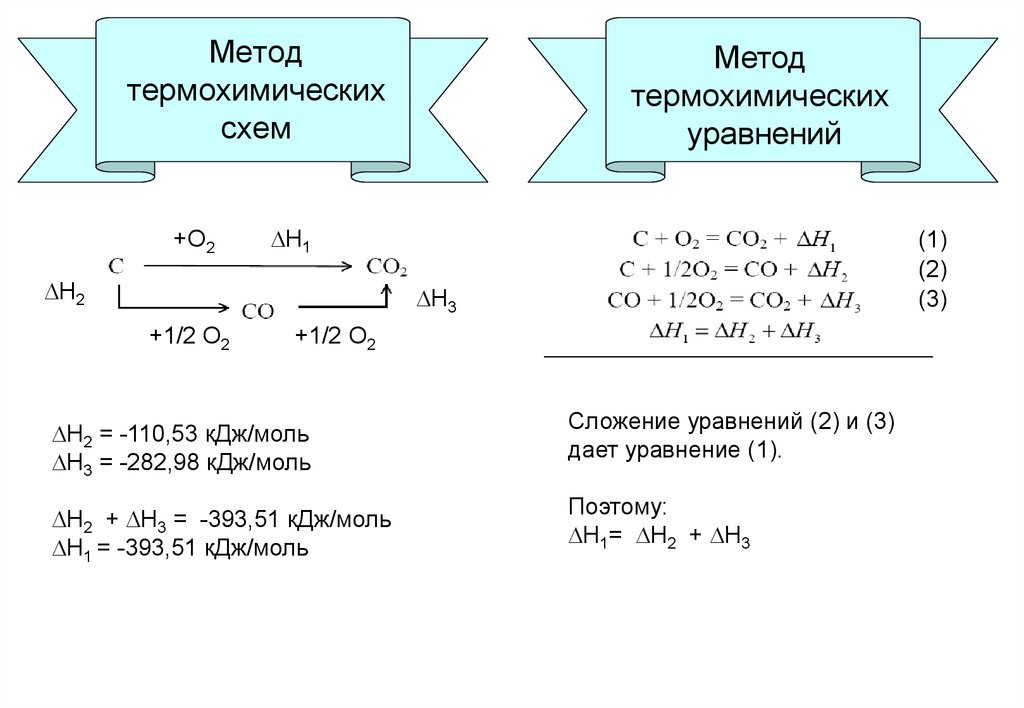
3. Применение закона Гесса
ММетод термохимических
схем
Метод термохимических
Метод
термохимических
уравнений
Если из одних и тех же
реагентов
можно
получить одни и те же
продукты
различными
способами, то при любом
способе
проведения
химической реакции её
тепловой эффект будет
одинаковым.
Тепловой эффект реакции
можно определить через
известные
тепловые
эффекты других реакций,
если из них возможно
получить искомую.
уравнений
4. Метод термохимических схем
+О2Метод
термохимических
уравнений
Н1
Н2
(1)
(2)
(3)
Н3
+1/2 О2
+1/2 О2
Н2 = -110,53 кДж/моль
Н3 = -282,98 кДж/моль
Сложение уравнений (2) и (3)
дает уравнение (1).
Н2 + Н3 = -393,51 кДж/моль
Н1 = -393,51 кДж/моль
Поэтому:
Н1= Н2 + Н3
5. Следствия из закона Гесса.
Следствие 1. Тепловой эффект химической реакции равенразности энтальпий образования продуктов реакции и
исходных веществ с учетом их стехиометрических
коэффициентов:
r H T0 j f H 0j продуктов i f H i0исх. веществ
j
i
fH
0
i Т - стандартная энтальпия образования i-того вещества при
температуре Т и давлении 1 атм.
• Стандартной
энтальпией образования вещества называют тепловой
эффект реакции образования 1 моля этого вещества из простых
веществ, находящихся в термодинамически устойчивом состоянии.
0
f H 298
Na SiO :
2
3
2 Na кр Si кр 1,5O г Na SiO
2
2
3
6.
Следствие 2. Тепловой эффект химической реакции равенразности энтальпий сгорания исходных веществ и
продуктов реакции с учетом их стехиометрических
коэффициентов:
0
0
0
r H T i C H i исх.веществ j C H j продуктов
i
0
C H i
Т
j
- стандартная энтальпия сгорания i-того вещества
при температуре Т и давлении 1 атм.
• Стандартной энтальпией сгорания вещества называют
тепловой эффект реакции полного окисления 1 моля этого
вещества.
0
C H 298 C H OH :
2
5
C2H5OH + 3O2 = 2CO2 + 3H2O
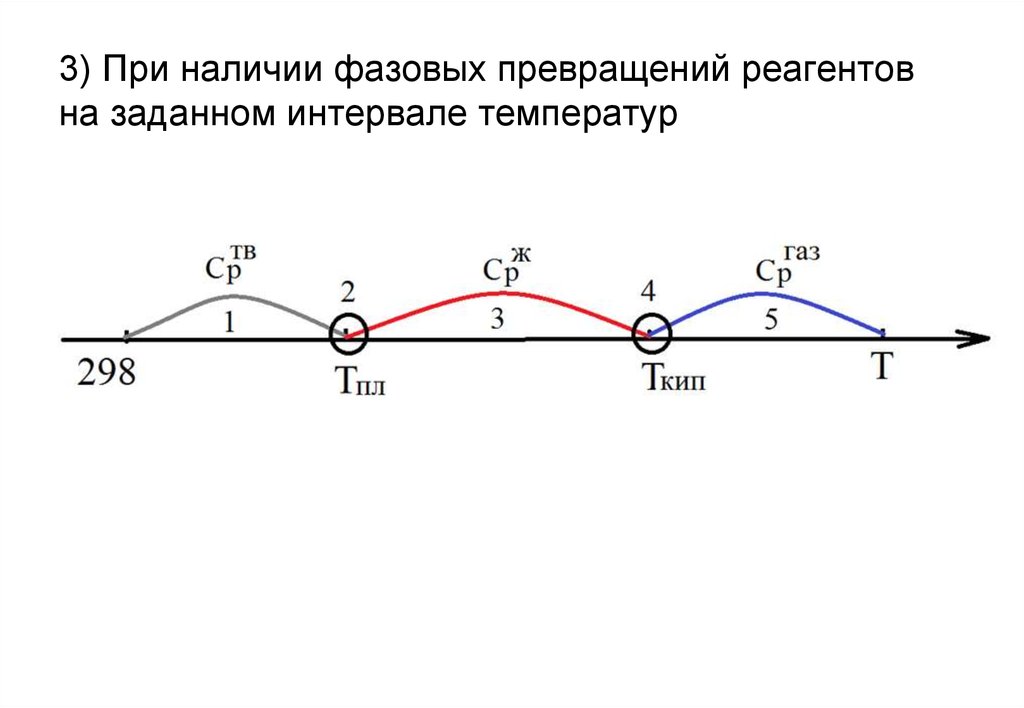
7. Зависимость тепловых эффектов химических реакций от температуры.
Теплоемкость.Уравнение Кирхгофа.
8.
• Расчеты тепловых эффектов реакций на основеследствий из закона Гесса с использованием справочных
термодинамических данных ограничены стандартными
условиями (Р = 1 атм; Т=298 К).
• Тепловые эффекты химических реакций зависят от
температуры,
т.к.
при
изменении
температуры
изменяются теплоемкости веществ – участников реакции.
• Теплоемкость – количество теплоты, необходимое для
нагревания 1 моля или 1 грамма (1 кг) вещества на один
градус.
С – молярная теплоемкость, Дж/(моль•К)
СУД – удельная теплоемкость, Дж/(г•К) или Дж/(кг•К)
По условиям измерения:
СP – изобарная теплоемкость,
СV – изохорная теплоемкость,
9.
• Средние теплоемкостиизмеряются на определенном
интервале температур
• Истинные теплоемкости
соответствуют бесконечно
малому изменению температуры
• Изобарная теплоемкость
• Изохорная теплоемкость
Q
Q
С
T2 T1 T
C lim C
T 0
Q
dT
Q
dH
CP
dT
dT
P
Q
dU
СV
dT
dT
V
dH dU d U PV dU d PV d RT
dT
C P CV
R
R
dT dT
dT
dT
dT
dT
PV RT n 1 моль
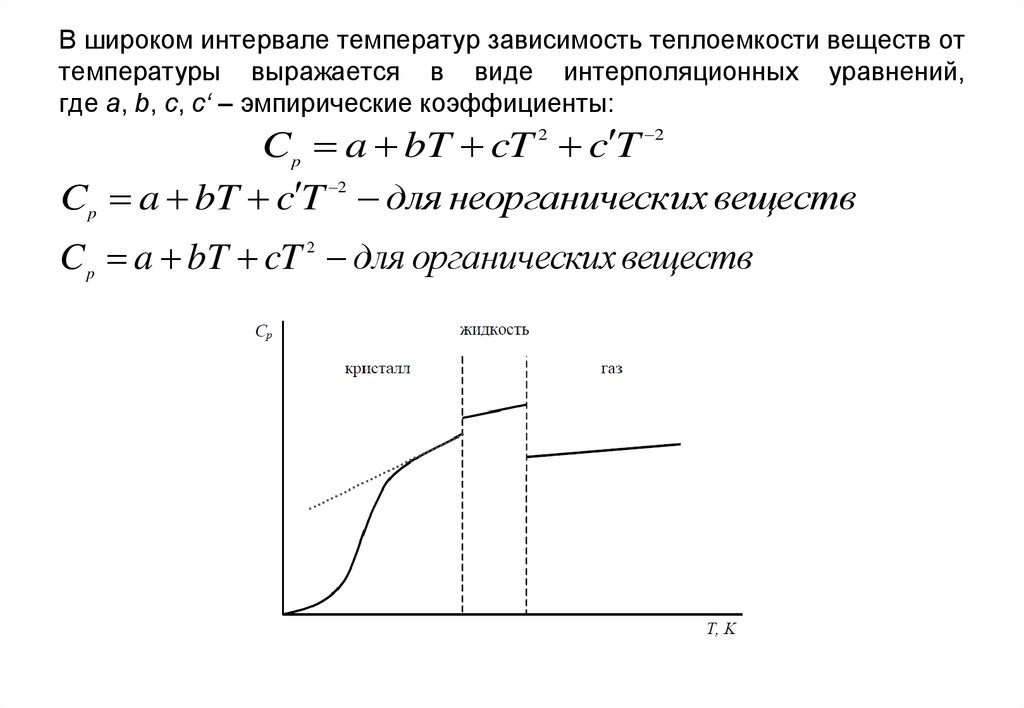
10. В широком интервале температур зависимость теплоемкости веществ от температуры выражается в виде интерполяционных уравнений, где a, b, c, c‘
– эмпирические коэффициенты:2
Cp a bT cT c T
2
Cp a bT c T для неорганических веществ
2
C p a bT cT 2 для органических веществ
11. Уравнение Кирхгофа и его интегрирование
d UC
V
dT
d H
C P
dT
T
2
T
2
d H C dT
T
1
P
T
(1)
(2)
1
T2
H T H T C P dT
2
1
(3)
T1
1) ∆СР = const
H T H T C T T
2
1
P 2
1
(4)
CP jCP0 j
(5)
j
продуктов i iCP0 i исх.веществ
12. На практике интегрирование обычно проводят от стандартной температуры 298 К до заданной Т, при которой протекает реакция:
THT H
o
298
C dT
p
298
0
H T0 H 298
C P T 298
(6)
Величина изменения теплоемкости в ходе реакции ∆СР
рассчитывается по уравнению (5) при Т=298 К и Р=1атм.
на основании справочных данных.
Стандартный тепловой эффект реакции
рассчитывается по следствиям из закона Гесса.
13.
2) ∆CP = f(T),C p a bT cT 2 c T 2
(7)
T2
H T H T a bT cT 2 c T 2 dT
2
1 T
1
H
T
2
T
1
T
2
T
2
2
T
2
adT bTdT cT dT
T
1
T
1
T
1
T
1
c dT
T2
b 2
c 3
2
3
H T H T a T T
T T
T T
2
1
2
1
1
1
2 2
3 2
(8)
1
1
c
T
T
2
1
14.
Т1 298 К ; Т 2 Т0
HT0 H 298
a T 298
1
1
c
T 298
b 2
c 3
T 298 2
T 2983
2
3
(9)
15.
Т1 298 К ; Т 2 ТHT0
0
H 298
b 2
c 3
2
a T 298
T 298
T 2983
2
3
1
1
c
T 298
(9)
Т1 0 К ; Т 2 Т
HT0
H 00
b 2 c 3 c
aT
T
T
2
3
T
(10)
Т1 0 К ; Т 2 298 К
H 2980 H 00
b
c
3 с
298 a 298
298
2
3 298
2
(11)
16.
Td H
0
298
d H
0
10 9 11
T
d H
298
b
298 a 298
2
c
3 с
298
3
298
H 00
0
∆










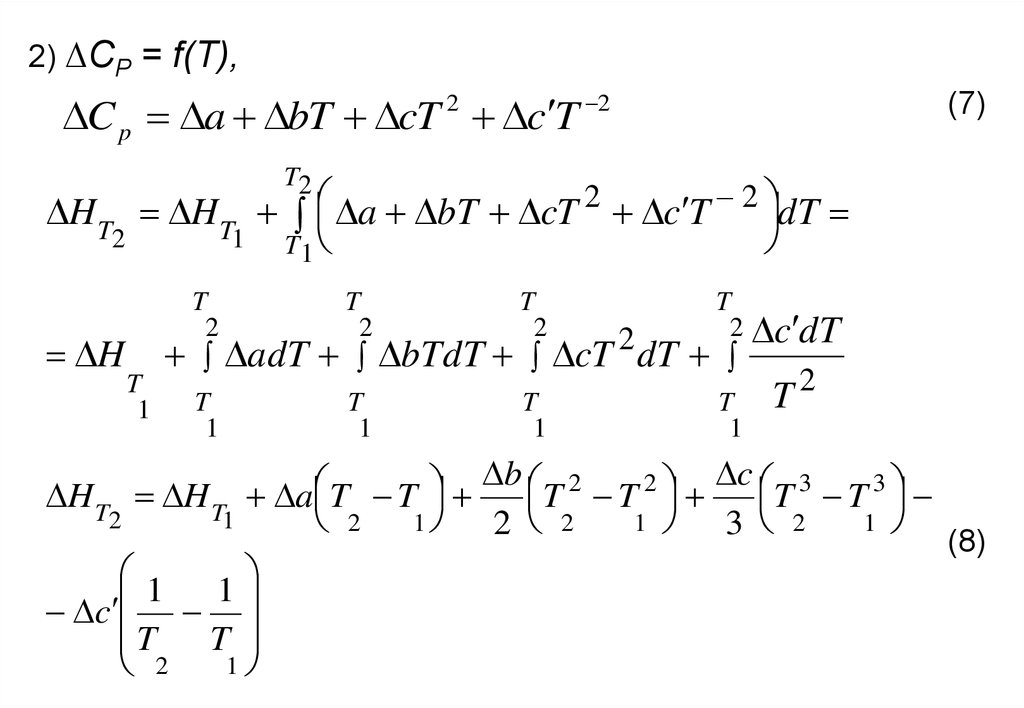
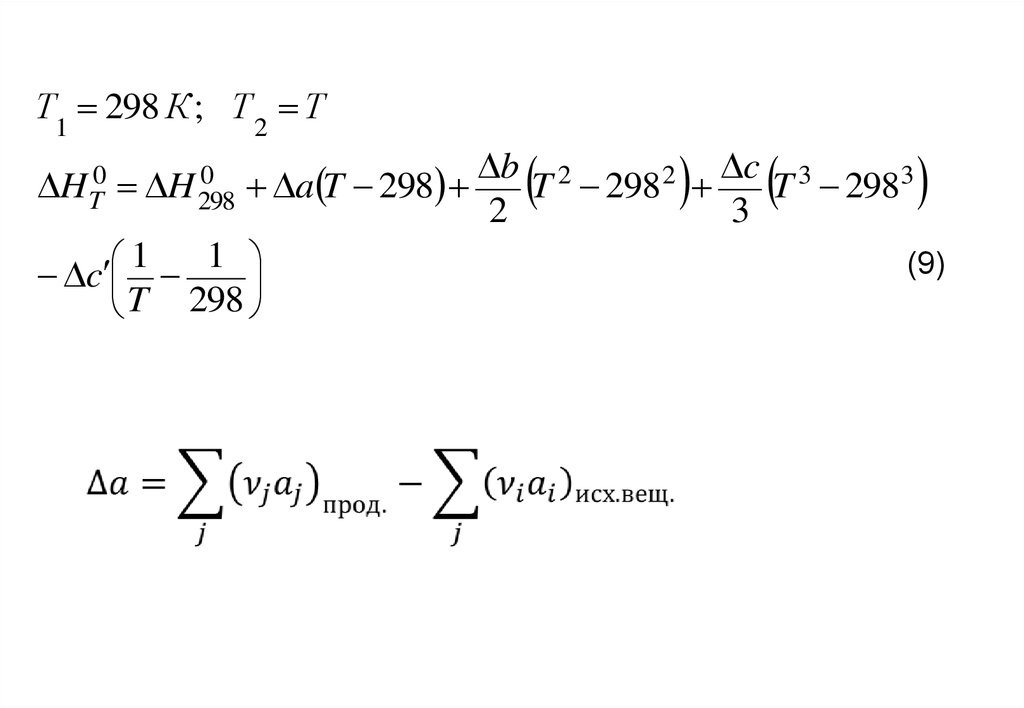











 Химия
Химия








