Похожие презентации:
Электрохимические методы
1. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ
Лекция 92. ЛИТЕРАТУРА
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
2
3. Теоретические основы электрохимических методов
Электрохимические методы основаны наизучении и использовании процессов,
протекающих на поверхности электрода или в
приэлектродном пространстве.
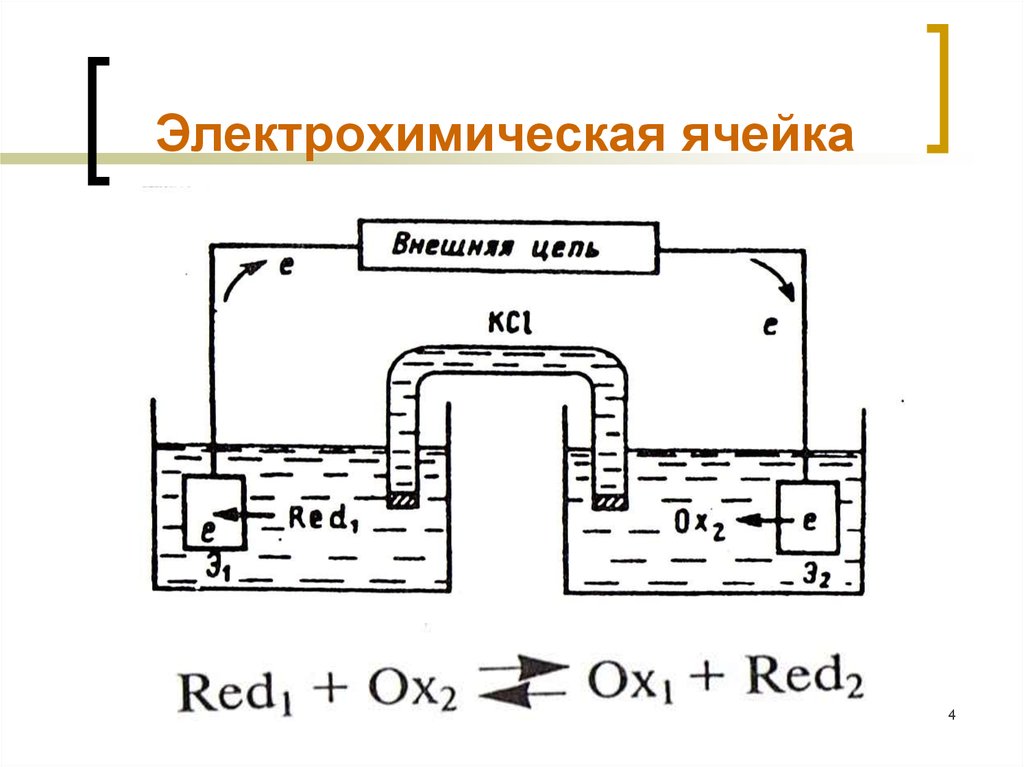
Основной узел любого электрохимического
прибора – электрохимическая ячейка.
Виды электрохимических ячеек:
Гальванический элемент;
Электролитическая ячейка.
Каждая ячейка содержит два электрода:
электрод сравнения и индикаторный электрод.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
3
4. Электрохимическая ячейка
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
4
5. Электроды, используемые в электрохимии
Электроды первого рода (обратимые относительнокатиона, общего с материалом электрода):
Металлические электроды;
Амальгамные электроды;
Газовые электроды (водородный).
Электроды второго рода (обратимые относительно
аниона, общего с материалом электрода):
Электроды сравнения (хлоридсеребряный,
каломельный);
Газовые электроды (хлорный).
Электроды третьего рода (редокс-электроды):
Металлические электроды, погруженные в редокссистему;
Хингидронный электрод.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
5
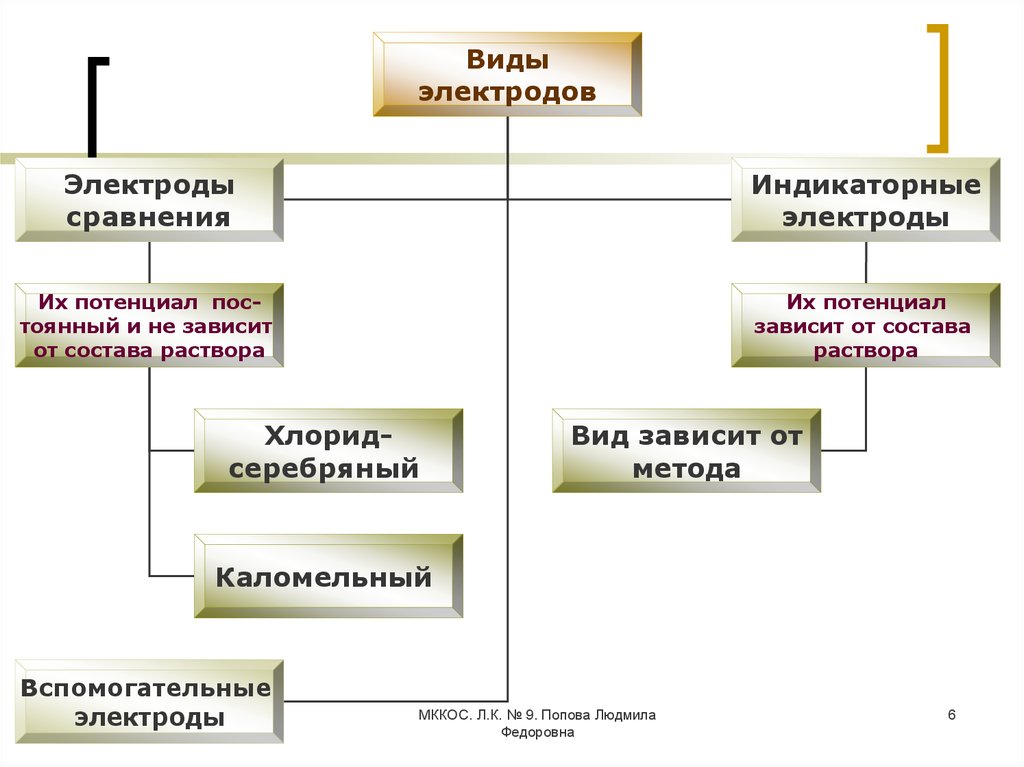
6.
Видыэлектродов
Электроды
сравнения
Индикаторные
электроды
Их потенциал постоянный и не зависит
от состава раствора
Их потенциал
зависит от состава
раствора
Хлоридсеребряный
Вид зависит от
метода
Каломельный
Вспомогательные
электроды
МККОС. Л.К. № 9. Попова Людмила
Федоровна
6
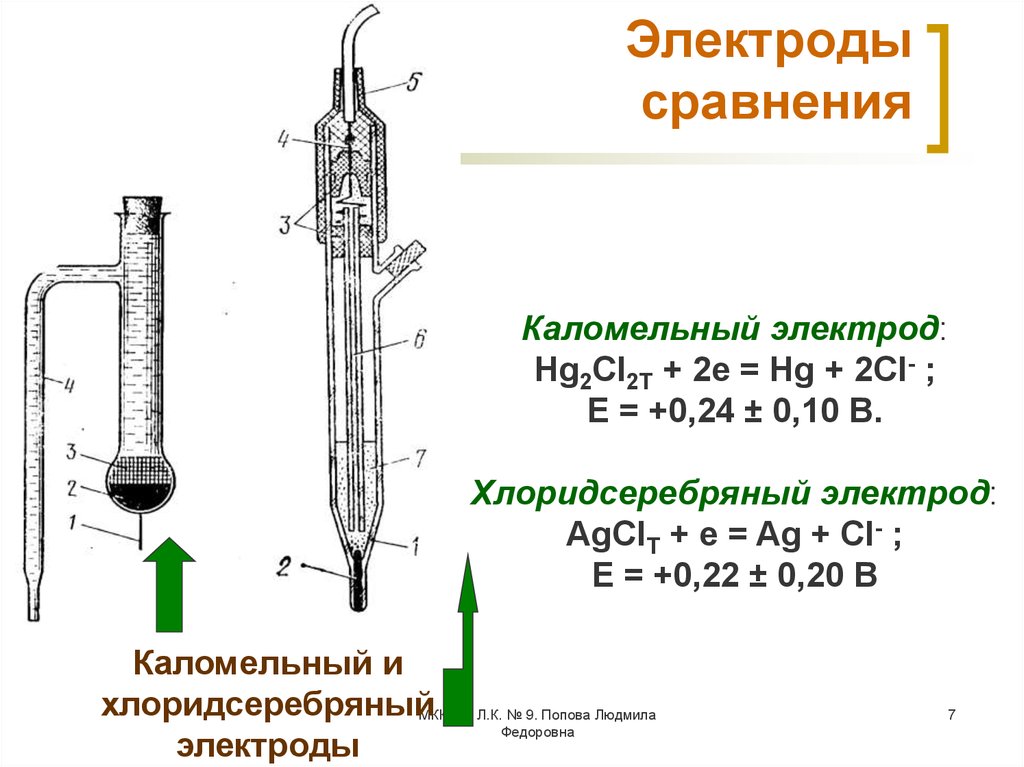
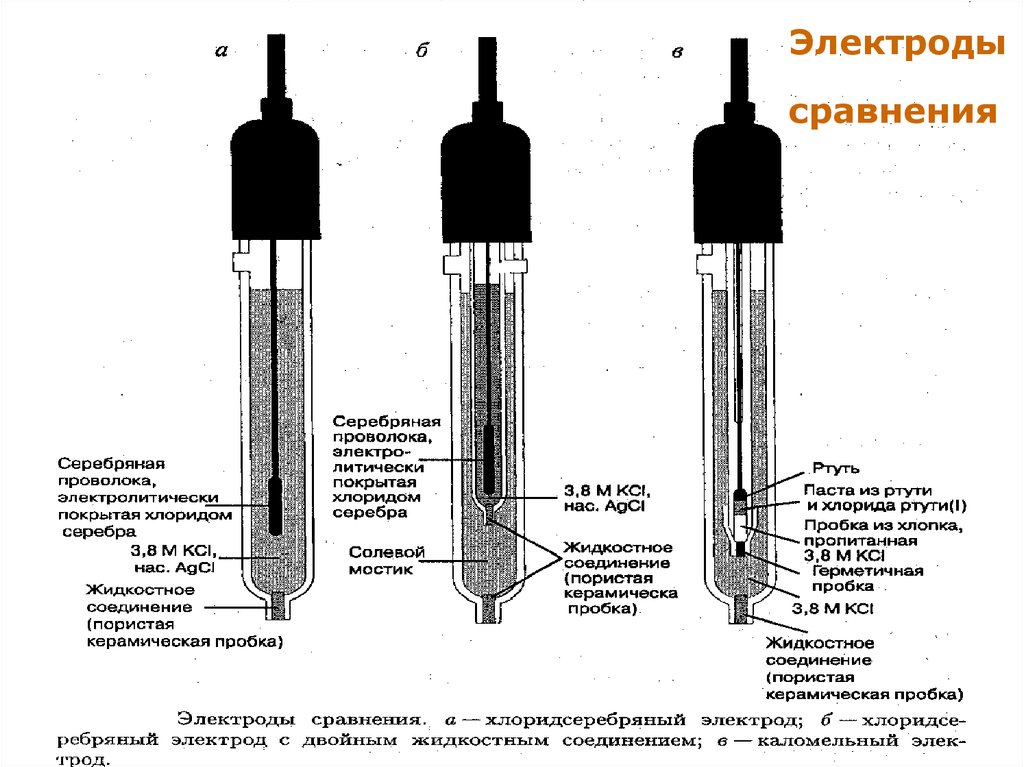
7. Электроды сравнения
Каломельный электрод:Hg2Cl2Т + 2e = Hg + 2Cl- ;
Е = +0,24 ± 0,10 В.
Хлоридсеребряный электрод:
AgClТ + e = Ag + Cl- ;
Е = +0,22 ± 0,20 В
Каломельный и
хлоридсеребряныйМККОС. Л.К. № 9. Попова Людмила
Федоровна
электроды
7
8.
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
8
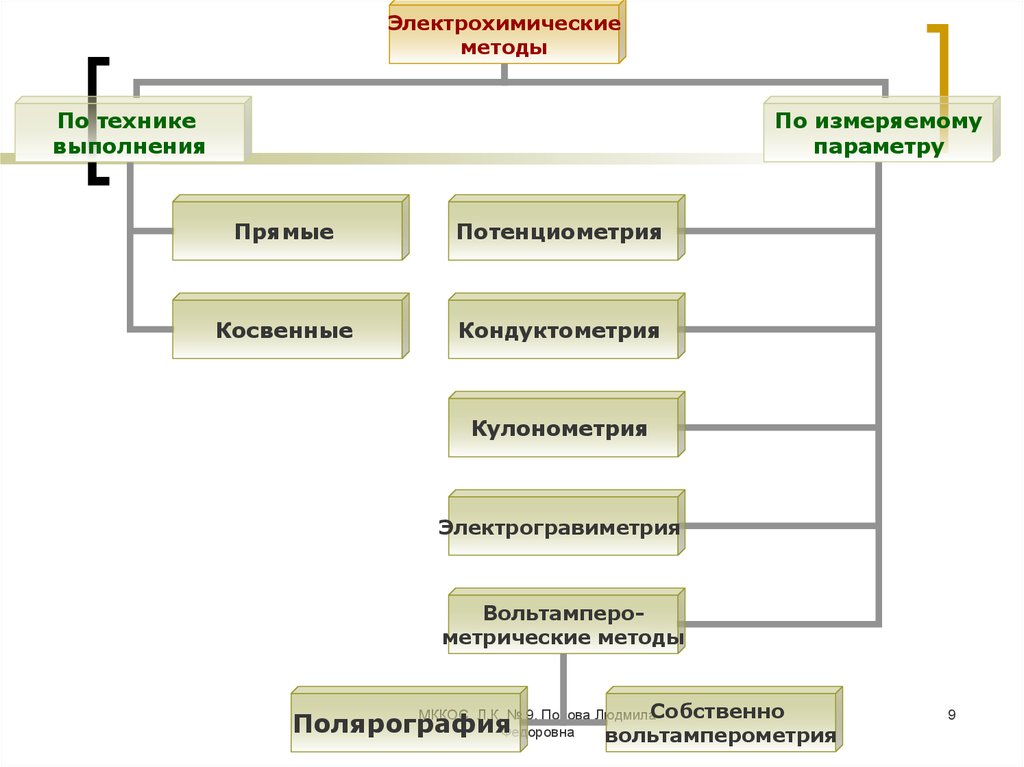
9.
Электрохимическиеметоды
По технике
выполнения
По измеряемому
параметру
Прямые
Потенциометрия
Косвенные
Кондуктометрия
Кулонометрия
Электрогравиметрия
Вольтамперометрические методы
Собственно
МККОС. Л.К. № 9. Попова Людмила
Полярография
Федоровна
вольтамперометрия
9
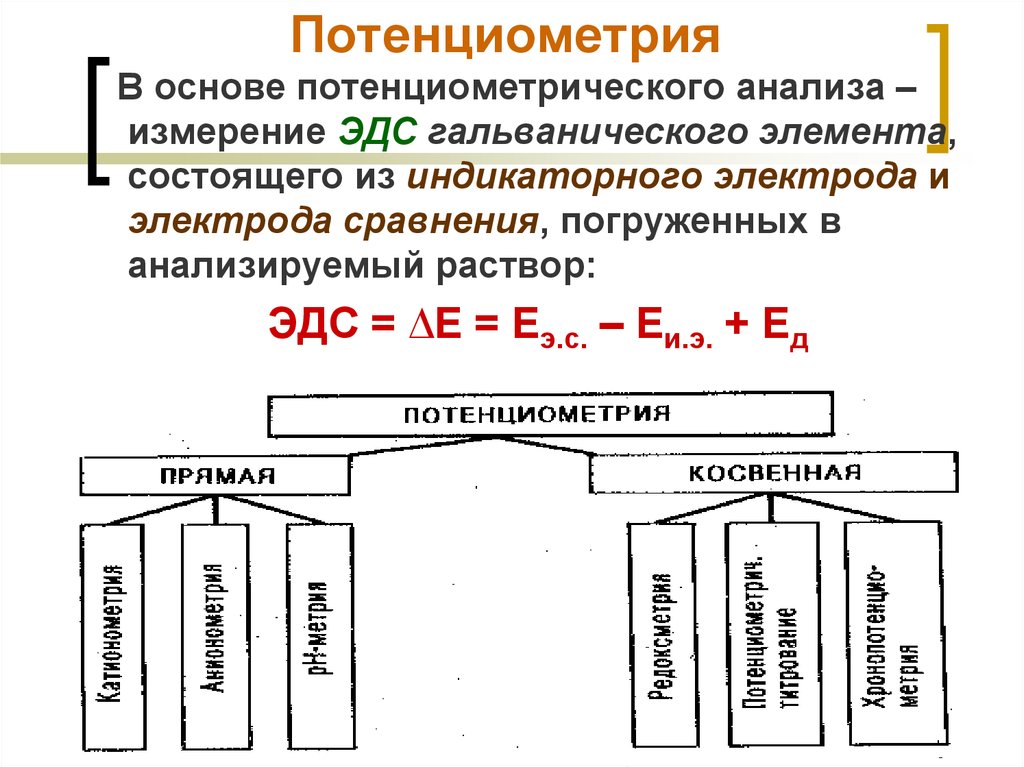
10. Потенциометрия
В основе потенциометрического анализа –измерение ЭДС гальванического элемента,
состоящего из индикаторного электрода и
электрода сравнения, погруженных в
анализируемый раствор:
ЭДС = ∆Е = Еэ.с. – Еи.э. + Ед
МККОС. Л.К. № 9. Попова Людмила
Федоровна
10
11.
В основе потенциометрических измеренийлежит зависимость равновесного
потенциала индикаторного электрода от
состава и концентрации анализируемого
раствора, описываемая уравнением
Нернста (250С):
Е = Е0Ox/Red + (RT/nF) • ln(aOx / aRed) =
= Е0Ox/Red + (0,059/n) • lg(aOx / aRed),
где Е – равновесный электродный потенциал;
n – число электронов, участвующих в
полуреакции; Е0 – стандартный электродный
потенциал; Т – абсолютная температура;
F – постоянная Фарадея; R – универсальная
газовая постоянная.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
11
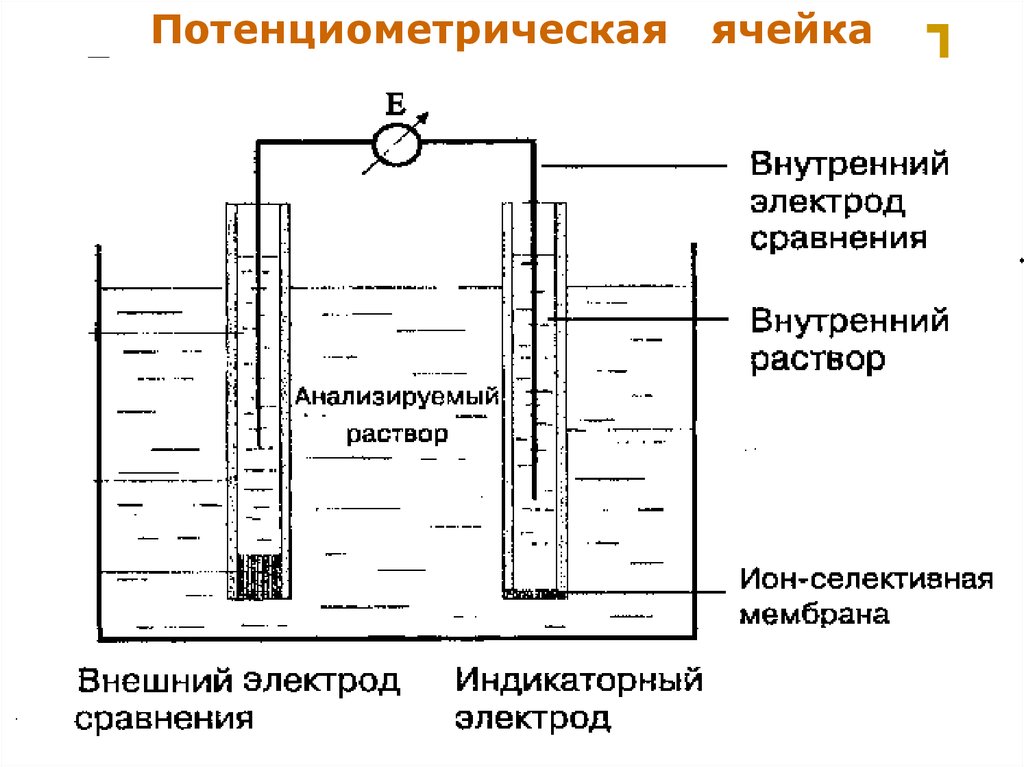
12.
ПотенциометрическаяМККОС. Л.К. № 9. Попова Людмила
Федоровна
ячейка
12
13.
Электродысравнения
МККОС. Л.К. № 9. Попова Людмила
Федоровна
13
14. Индикаторные электроды
Металлические:
Активные (первого рода);
Инертные (третьего рода).
Ионоселективные (мембранные):
Простые:
С твердой мембраной:
с жесткой матрицей (стеклянные);
с кристаллическими мембранами (монокристалл,
таблетка).
С жидкой мембраной (подвижным носителем):
жидкие ионообменные («+» и «–» заряженные;
с нейтральными носителями (незаряженные).
Сложные (многомембранные):
Сенсибилизированные (активированные
электроды):
газочувствительные;
ферментные.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
14
15. Металлические электроды
Активные МЭ изготавливают из металлов (Ag, Pb,Cu, Cd). Любой такой электрод в растворе,
содержащем собственные ионы, приобретает Е,
обратимо изменяющийся при изменении
активности этих ионов:
Ag+ + e = Ag0;
E = E0 + 0,059•lg(a Ag+).
Инертные МЭ изготавливают из благородных
металлов (Pt, Au). Они служат переносчиками е
от Red-формы к Ох-форме. Е таких электродов
зависят от соотношения Ох и Red форм
полуреакции:
Е = Е0 (Fe3+/Fe2+) + 0,059•lg(a Fe3+/a Fe2+).
Измеряя потенциал такого электрода можно
проследить за изменением соотношения:
МККОС. Л.К. № 9. Попова Людмила
15
(a Fe3+/a Fe2+).
Федоровна
16. Мембранные электроды
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
16
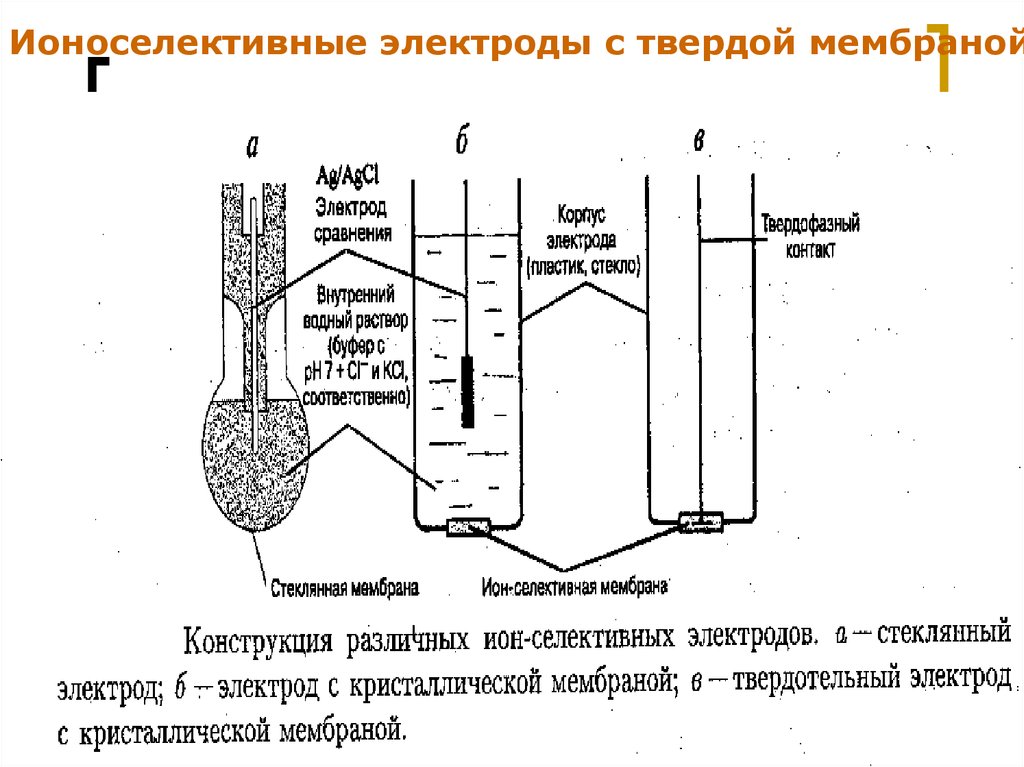
17.
Ионоселективные электроды с твердой мембранойМККОС. Л.К. № 9. Попова Людмила
Федоровна
17
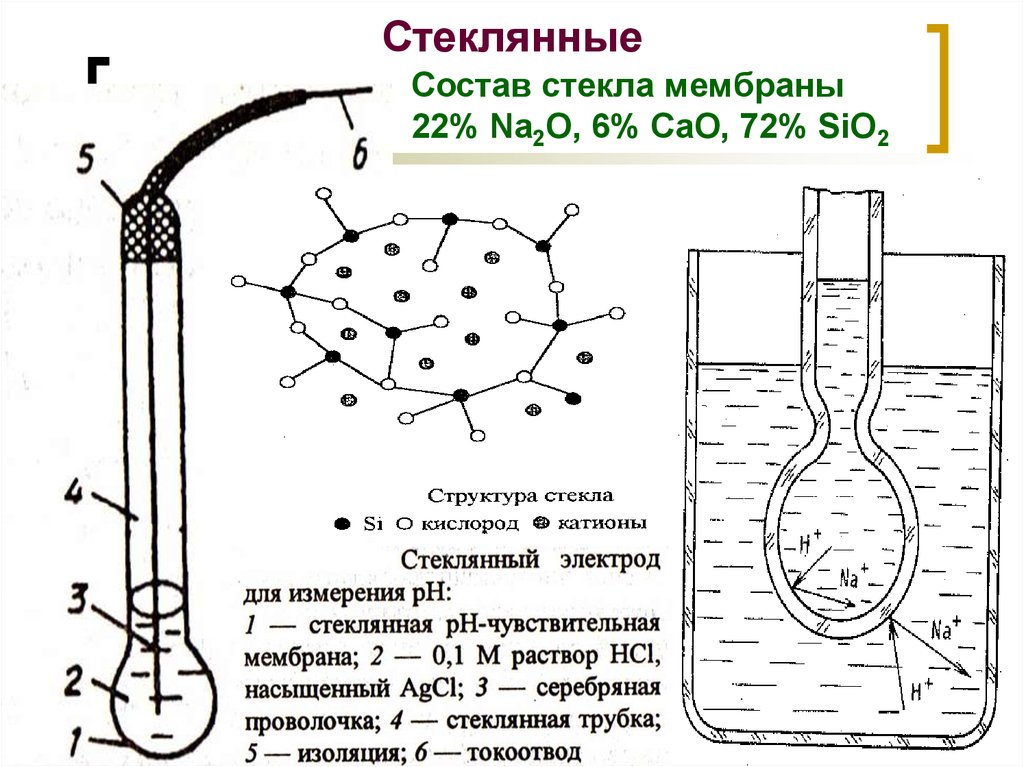
18. Стеклянные
Состав стекла мембраны22% Na2O, 6% CaO, 72% SiO2
МККОС. Л.К. № 9. Попова Людмила
Федоровна
18
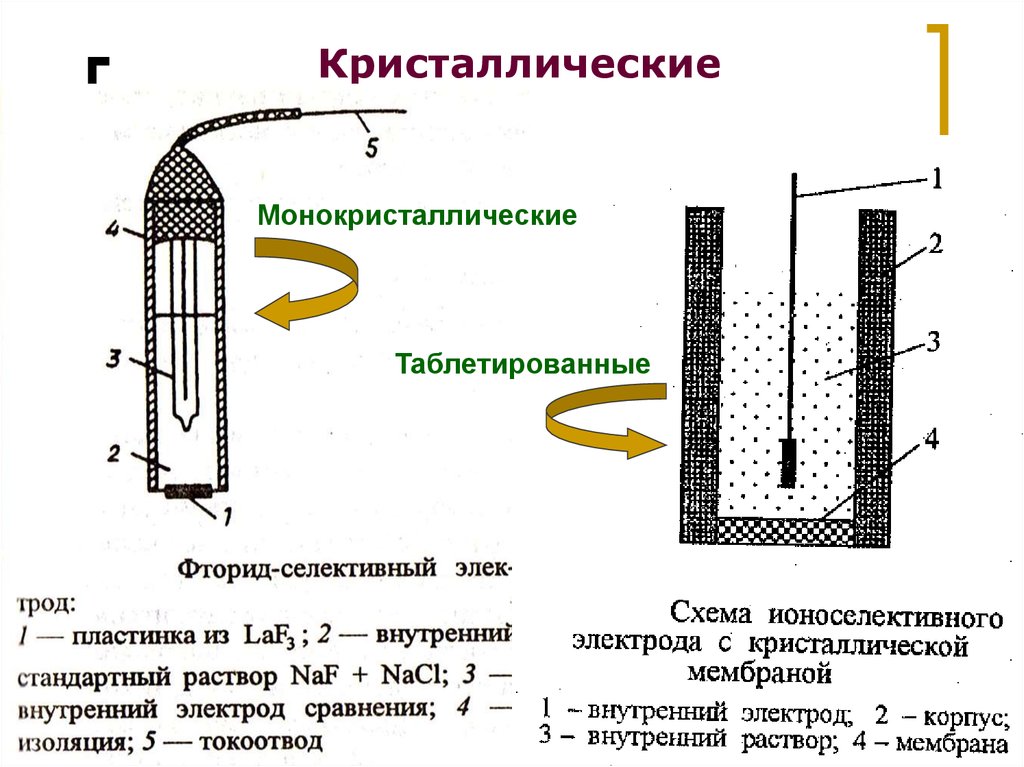
19.
КристаллическиеМонокристаллические
Таблетированные
МККОС. Л.К. № 9. Попова Людмила
Федоровна
19
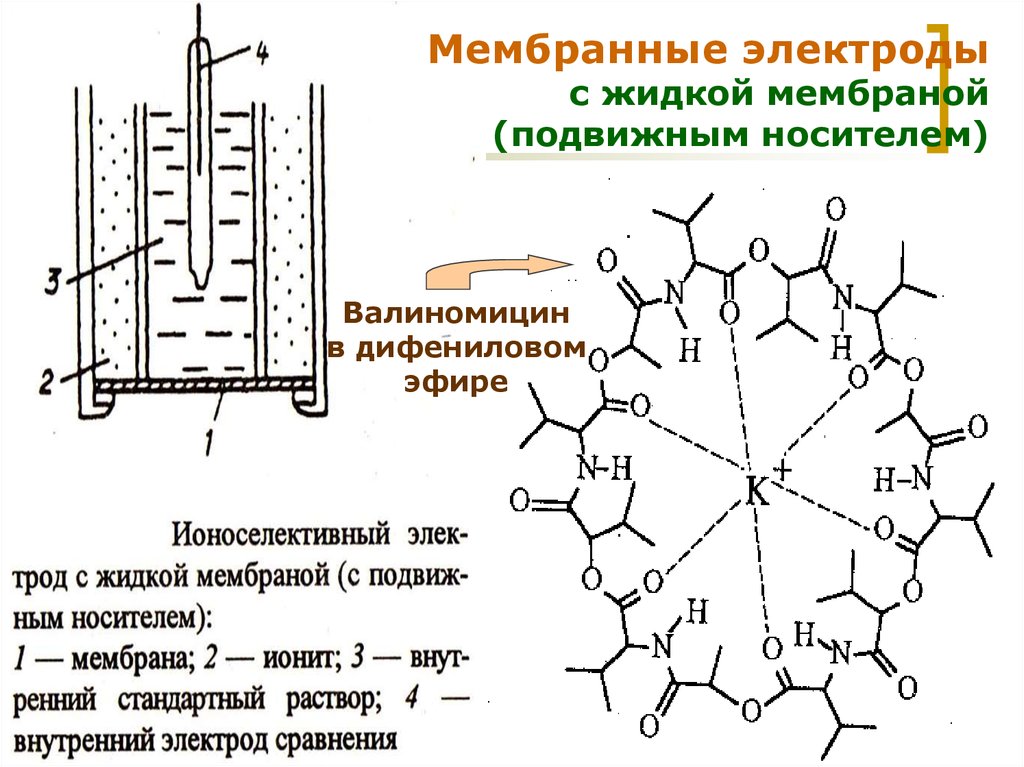
20.
Мембранные электродыс жидкой мембраной
(подвижным носителем)
Валиномицин
в дифениловом
эфире
МККОС. Л.К. № 9. Попова Людмила
Федоровна
20
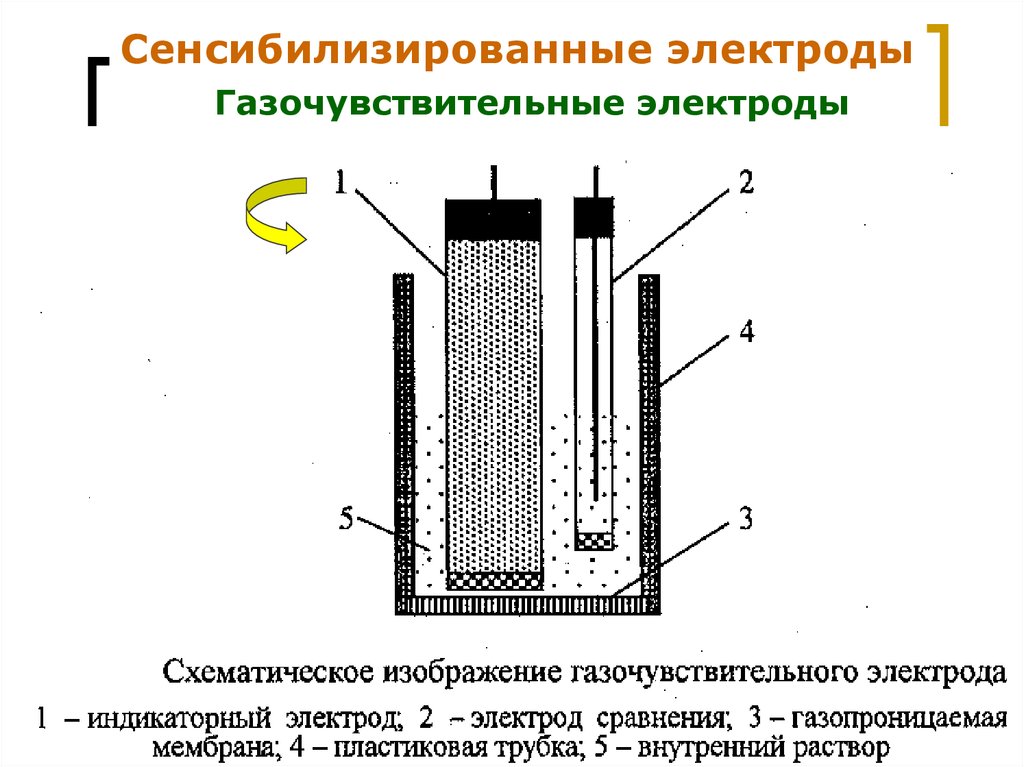
21.
Сенсибилизированные электродыГазочувствительные электроды
МККОС. Л.К. № 9. Попова Людмила
Федоровна
21
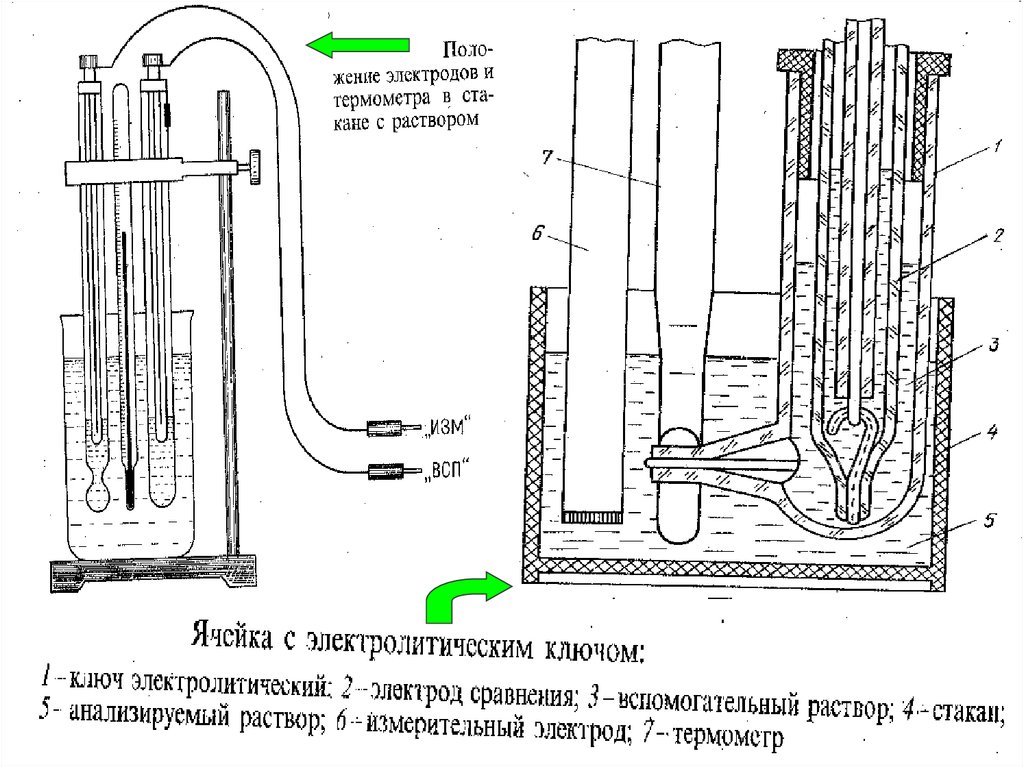
22. Оборудование для потенциометрии
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
22
23.
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
23
24. Прямая потенциометрия
В основе метода – зависимостьравновесного потенциала индикаторного
электрода от концентрации иона в
анализируемом растворе, выражаемое
уравнением Нернста:
2,3 RT
Е Е
lg C
nF
0
МККОС. Л.К. № 9. Попова Людмила
Федоровна
24
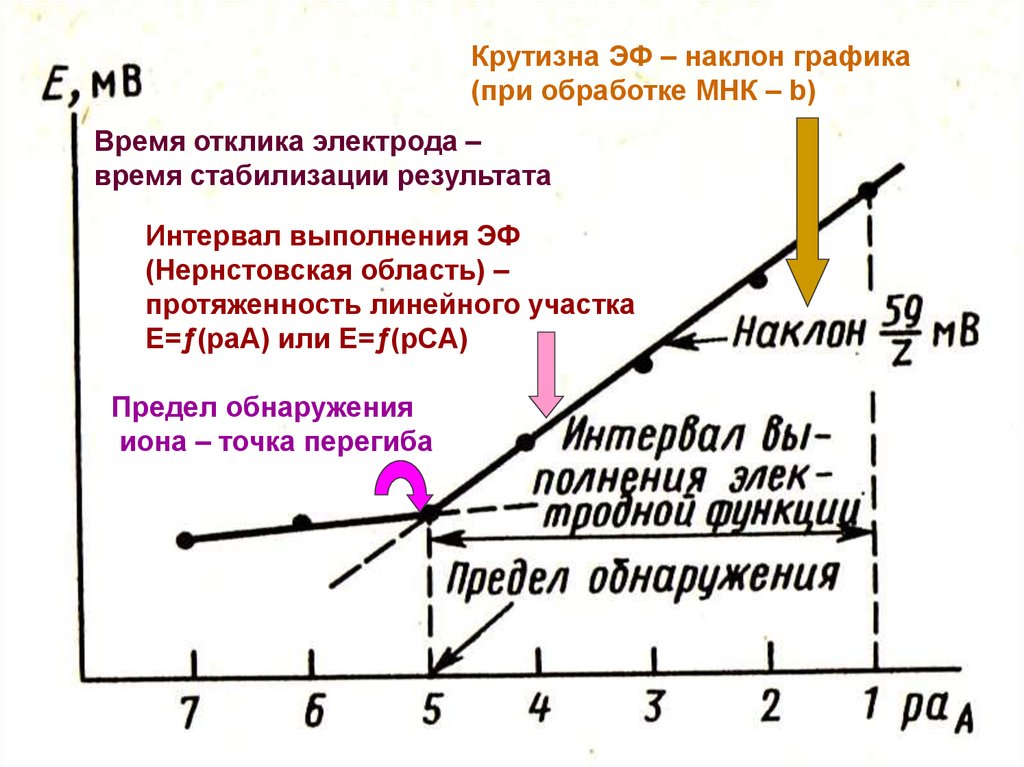
25. Ионометрия
Построить калибровочный график и по немуопределить основные характеристики
ионоселективного электрода (см. далее рис.):
Крутизна электродной функции (наклон графика –
b);
Время отклика электрода;
Нернстовская область (интервал выполнения
электродной функции);
Предел обнаружения определяемого иона.
Провести анализ природного объекта.
Расчетно или графически определить
концентрацию иона в ООС.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
25
26.
Крутизна ЭФ – наклон графика(при обработке МНК – b)
Время отклика электрода –
время стабилизации результата
Интервал выполнения ЭФ
(Нернстовская область) –
протяженность линейного участка
Е=ƒ(раА) или Е=ƒ(рСА)
Предел обнаружения
иона – точка перегиба
МККОС. Л.К. № 9. Попова Людмила
Федоровна
26
27. Способы определения концентрации
Способ калибровочного графикаЕ а
рХ
b
рХ lg C х
МККОС. Л.К. № 9. Попова Людмила
Федоровна
27
28.
Способ добавокс учетом разбавления
E / S
Vст .
Vx
C x C ст .
10
Vст . Vx
Vx Vст .
1
;
без учета разбавления
1
Vст .
E / S
C x Cст .
10
1
Vx
МККОС. Л.К. № 9. Попова Людмила
Федоровна
28
29. Потенциометрическое титрование
Сущность метода – измерение потенциалаиндикаторного электрода (ЭДС) в ходе
титрования для последующего определения
конечной точки титрования (КТТ).
Для этого необходимо:
Построить кривую титрования.
Определить на кривой скачок потенциала.
По скачку определить объем титранта в точке
эквивалентности.
Рассчитать концентрацию определяемого иона
по закону эквивалентов.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
29
30.
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
30
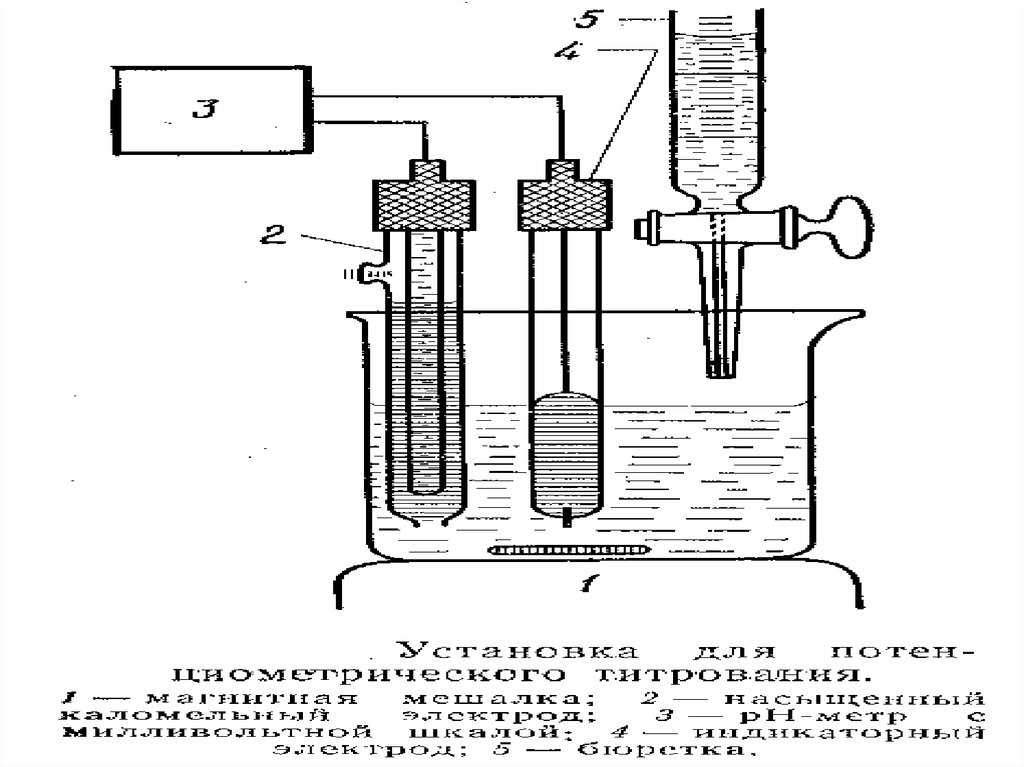
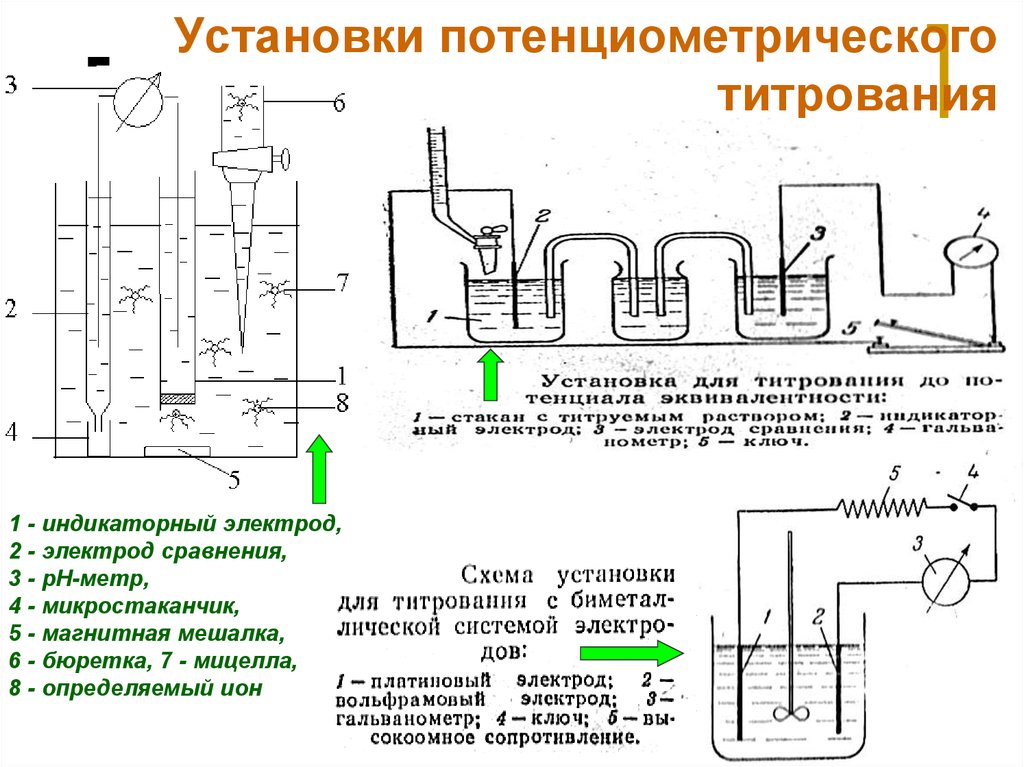
31. Установки потенциометрического титрования
1 - индикаторный электрод,2 - электрод сравнения,
3 - pH-метр,
4 - микростаканчик,
5 - магнитная мешалка,
6 - бюретка, 7 - мицелла,
8 - определяемый ион
МККОС. Л.К. № 9. Попова Людмила
Федоровна
31
32.
Автотитраторы(современные
установки)
МККОС. Л.К. № 9. Попова Людмила
Федоровна
32
33.
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
33
34. Способы определения КТТ
Расчетный способVКТТ
n
V1 m Vк
2
V2 V1
Vк
N
N – число капель; Vк – объем капли; m – число капель,
прибавленных до скачка потенциала; n – число капель,
составляющее порцию раствора титранта, вызвавшую скачок ∆Е;
Л.К. № 9. Попова Людмила
34
V1 = VКТТ - 1; V2 – общий объемМККОС.
затраченного
титранта
Федоровна
35.
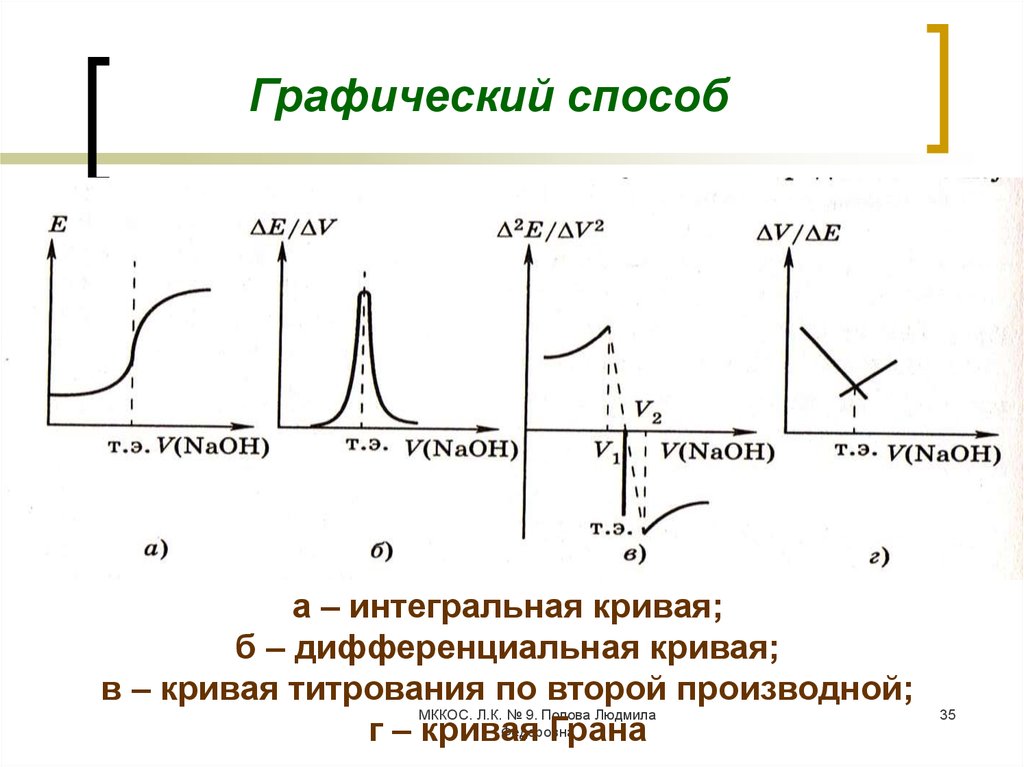
Графический способа – интегральная кривая;
б – дифференциальная кривая;
в – кривая титрования по второй производной;
МККОС. Л.К. № 9. Попова Людмила
Федоровна
г – кривая
Грана
35
36.
Расчетно-графический способVКТТ
A1
V1 V2 V1
A1 A2
E
A1
;
V1
МККОС. Л.К. № 9. Попова Людмила
Федоровна
E
A2
V2
36
37. Виды потенциометрического титрования
Кислотно-основное(рН-селективный электрод).
Комплексонометрическое
(Ме-селективные электроды ).
Окислительно-восстановительное
(Pt-электрод).
Осадительное (Ag-электрод; другие
ионоселективные электроды).
МККОС. Л.К. № 9. Попова Людмила
Федоровна
37
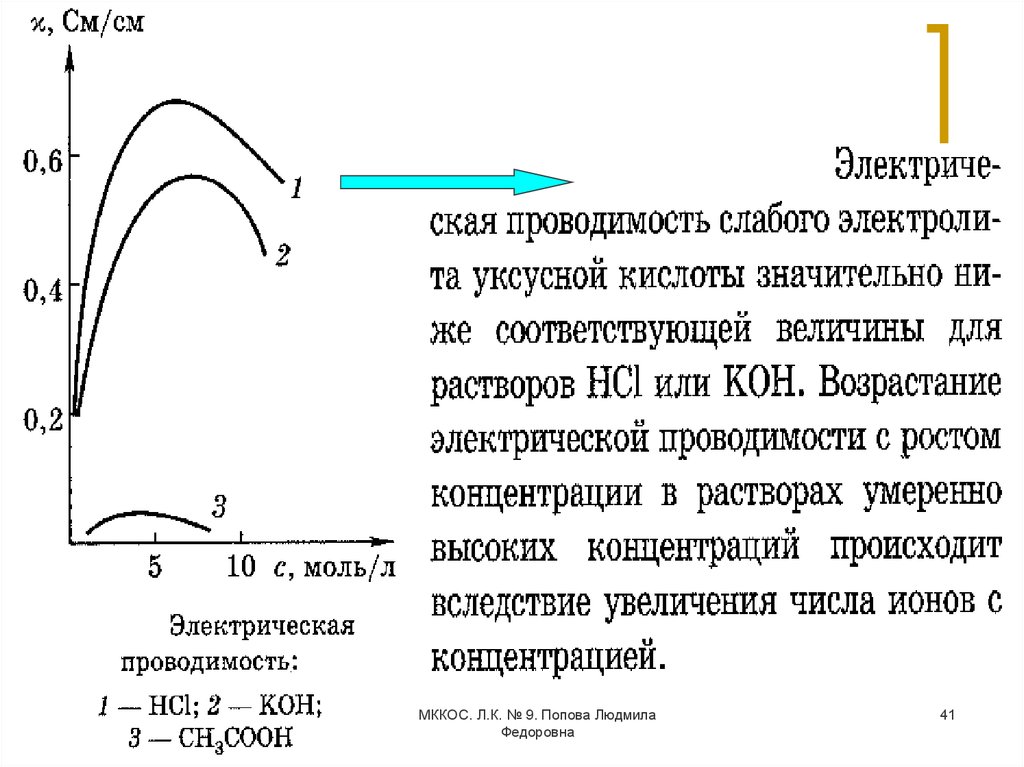
38. Кондуктометрия
Основана на измерении удельнойэлектропроводности анализируемого раствора.
Электрическая проводимость – способность
веществ пропускать электрический ток под
действием внешнего электрического поля.
Единица измерения – сименс (См).
Вещества, пропускающие электрический ток
(проводники) по механизму переноса
электричества делятся на 3 класса:
проводники первого рода (электронные): Ме,
полупроводники, сплавы, С, некоторые твердые
соли и оксиды;
проводники второго рода (ионные): растворы и
расплавы электролитов;
проводники третьего рода (смешанные):
растворы щелочных и щелочноземельных Ме в
жидком аммиаке, некоторые жидкие сплавы и
МККОС. Л.К. № 9. Попова Людмила
38
соли.
Федоровна
39. Теоретические основы метода
Электрическая проводимость – W –величина обратная электрическому
сопротивлению – R (W = 1/R).
МККОС. Л.К. № 9. Попова Людмила
Федоровна
39
40.
Удельная электропроводность æ (См/см илиОм-1•см-1) равна электрической
проводимости 1 мл раствора, находящегося
между параллельными электродами
площадью 1см2 при расстоянии между ними 1
см, другими словами, - это электрическая
проводимость столба раствора длиной 1 см
и площадью поперечного сечения 1 см2. Ее
можно измерить, или рассчитать по
формуле: æ = 1 / ρ = l / (R • S)
Для измерения удельной электропроводности
анализируемого раствора используется
электролитическая ячейка с переменным
током.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
40
41.
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
41
42.
Эквивалентная ионнаяэлектропроводность
(подвижность) λ
(См•см2/моль-экв) – это
проводимость раствора,
содержащего 1 моль
эквивалента вещества и
находящегося между
двумя параллельными
электродами, расстояние
между которыми равно 1
см. Ее можно рассчитать
по формуле:
λ = (1000 • æ) / СN.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
42
43.
Закон аддитивности электрическойпроводимости
В соответствии с законом независимого
движения ионов Кольрауша эквивалентная
электропроводность раствора электролита при
бесконечном разбавлении называется предельной
эквивалентной электропроводностью (λ или λ0) и
может быть представлена суммой предельных
электрических проводимостей, или предельных
подвижностей ионов: λ = λ0(-) + λ0(+). Подвижности
ионов в растворах с конечной концентрацией не
являются постоянными и зависят от концентрации
раствора: с ростом концентрации раствора
подвижность ионов уменьшается: λ = λ0 – а • √СN,
где а – константа.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
43
44.
Молярнаяэлектропроводность
(См•см2/моль) – это
проводимость
раствора,
содержащего 1 моль
вещества и
находящегося между
двумя
параллельными
электродами,
расстояние между
которыми составляет
1 см. Ее можно
рассчитать по
формуле:
МККОС. Л.К. № 9. Попова
Людмила
μ=
(1000 • æ) / СM.44
Федоровна
45.
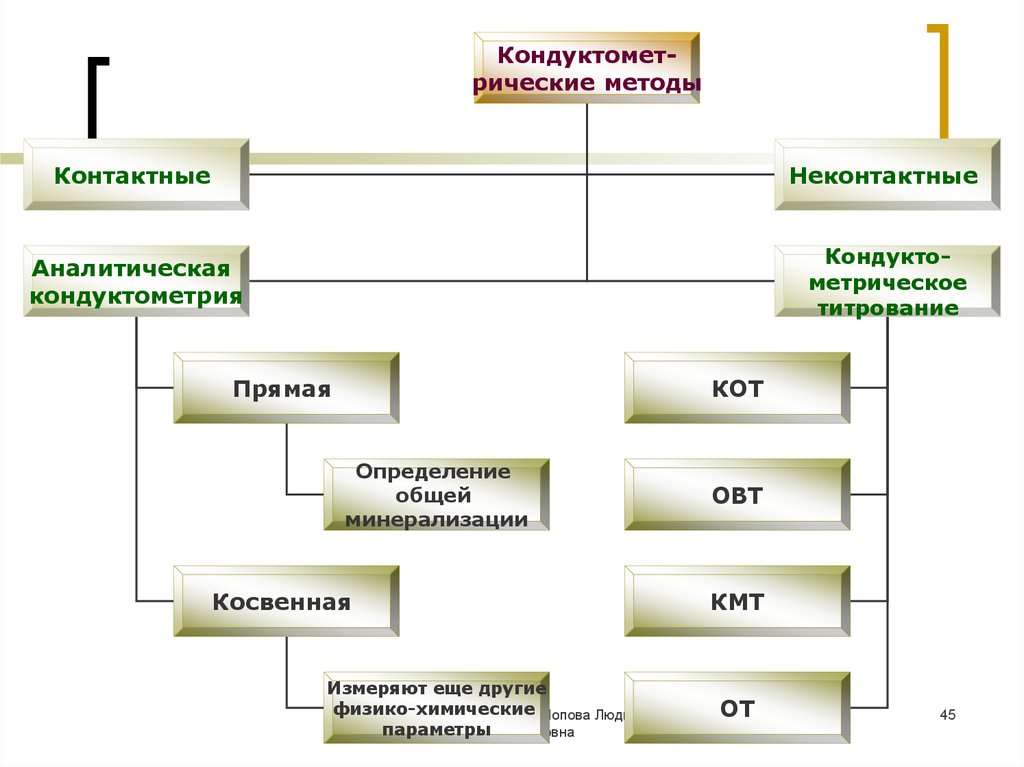
Кондуктометрические методыКонтактные
Неконтактные
Аналитическая
кондуктометрия
Кондуктометрическое
титрование
Прямая
КОТ
Определение
общей
минерализации
Косвенная
Измеряют еще другие
физико-химические
МККОС. Л.К. № 9. Попова Людмила
параметры Федоровна
ОВТ
КМТ
ОТ
45
46. Измерение удельной электропроводности
используетсяэлектролитическая
ячейка с переменным
током частотой 1000 Гц.
МККОС. Л.К. № 9. Попова Людмила
Федоровна
46
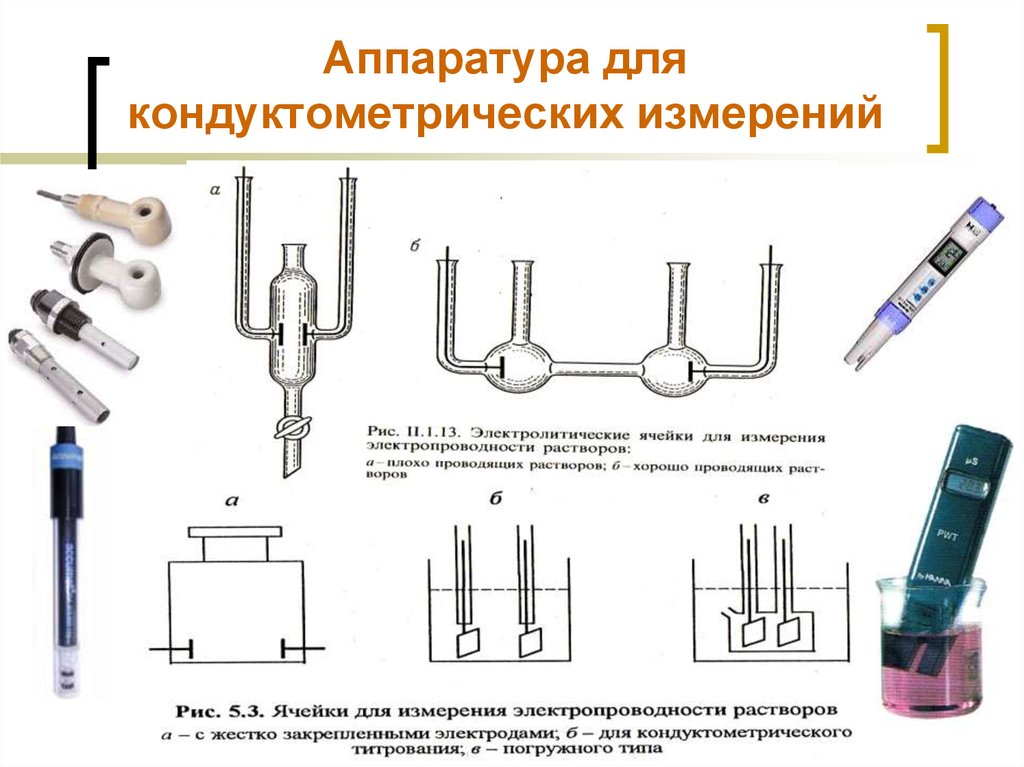
47. Аппаратура для кондуктометрических измерений
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
47
48. Аналитическая кондуктометрия
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
48
49.
Кондуктометрически можноопределять:
физико-химические свойства и
характеристики веществ, например:
степень диссоциации,
константу диссоциации,
растворимость малорастворимых
соединений и др.
Для их расчета можно использовать
формулы:
степень диссоциации: α = λ / λ ;
константа диссоциации:
Кд = {λ2 / [λ • (λ - λ)]} • CN;
растворимость малорастворимого
соединения: S = (1000 • æнас) / λ .
МККОС. Л.К. № 9. Попова Людмила
Федоровна
49
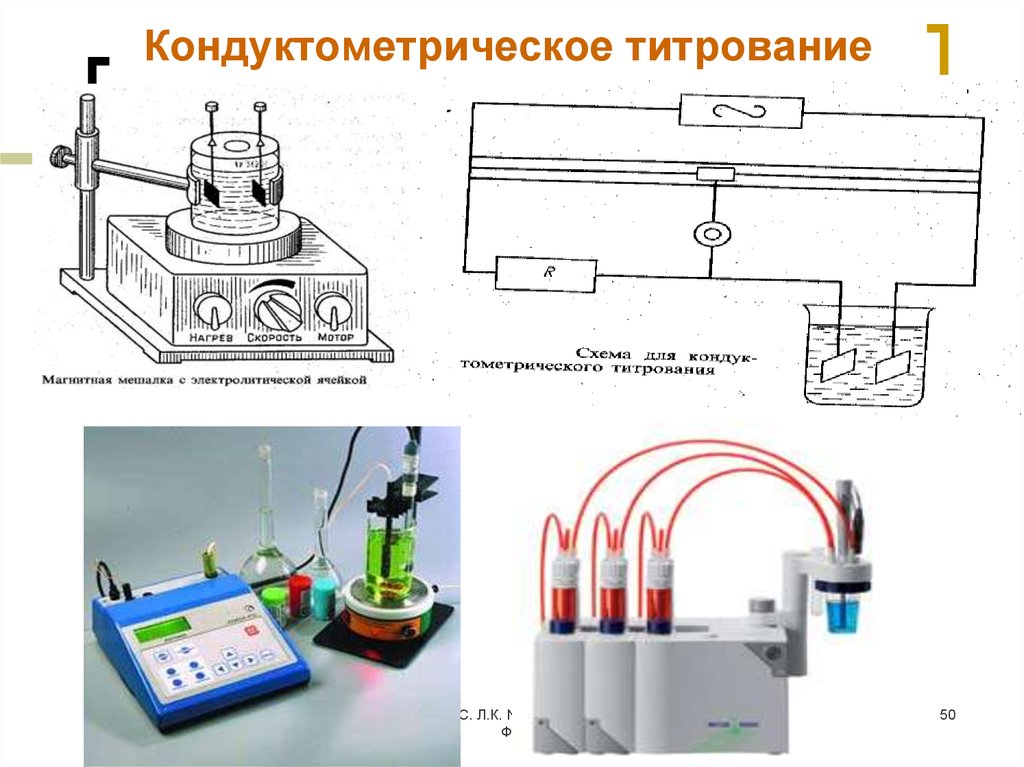
50. Кондуктометрическое титрование
МККОС. Л.К. № 9. Попова ЛюдмилаФедоровна
50
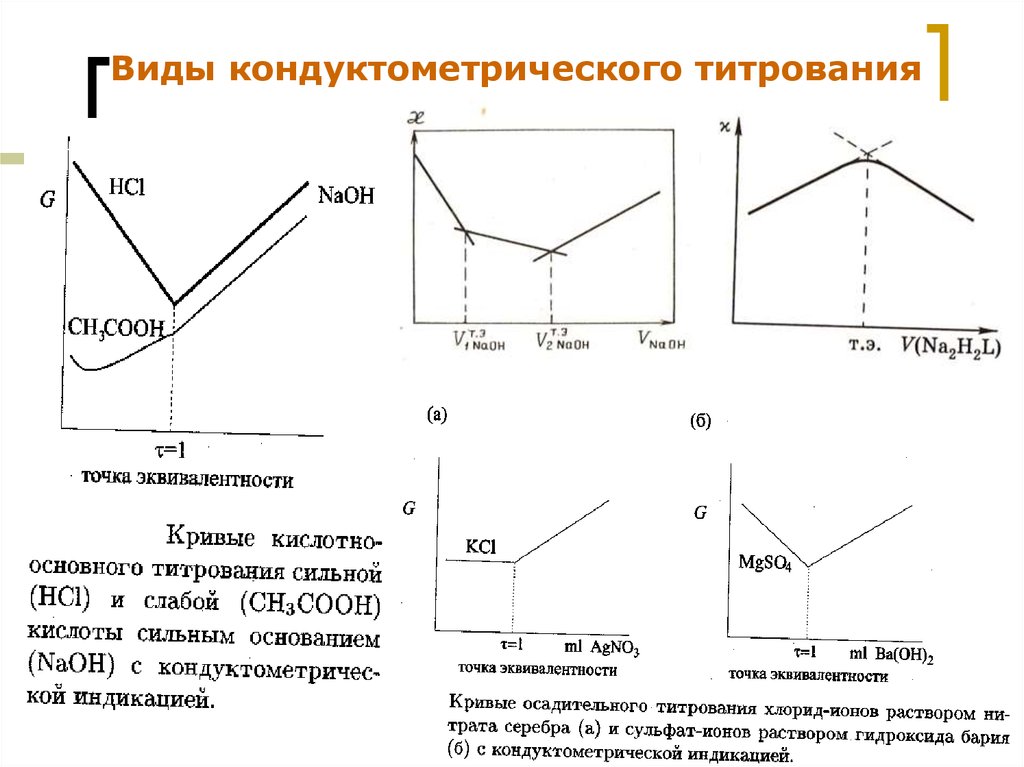
51.
Виды кондуктометрического титрованияМККОС. Л.К. № 9. Попова Людмила
Федоровна
51





























 Химия
Химия