Похожие презентации:
Электрохимические методы анализа
1. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Общие вопросыВольтамперометрия
Потенциометрия
Другие э/х методы
2. ЭХМА
Особенность ЭХМА: используютсяпроцессы, связанные с переносом
электрических зарядов.
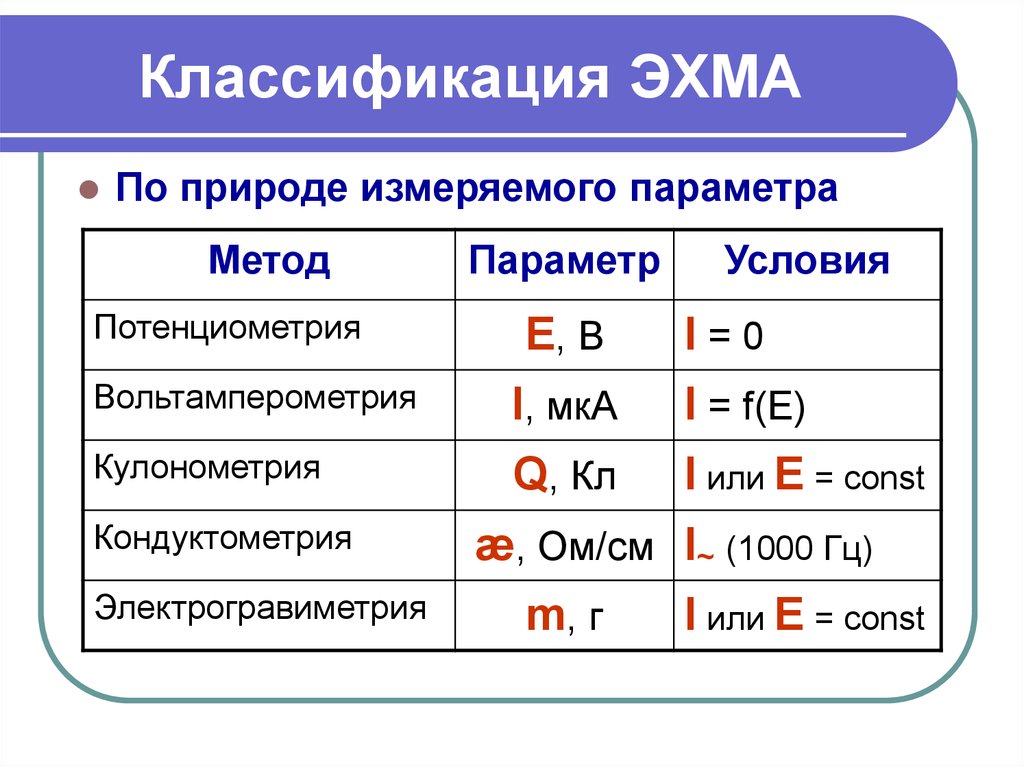
3. Классификация ЭХМА
По природе измеряемого параметраМетод
Потенциометрия
Параметр
Условия
Е, В
I=0
Вольтамперометрия
I, мкА
I = f(E)
Кулонометрия
Q, Кл
I или E = const
Кондуктометрия
Электрогравиметрия
æ, Ом/см I~ (1000 Гц)
m, г
I или E = const
4. Электрохимическая ячейка
Ячейка = электроды + электролитЭлектрод – ГРФ, на которой
направленное движение носителей
заряда одного типа меняется на
направленное движение носителей
заряда другого типа
направленное
движение
электронов
электрод
направленное
движение
ионов
ГРФ
электролит
5. Электрохимическая ячейка
Электролит – раствор, обеспечивающийнаправленное движение ионов.
2х-электродная ячейка: ЭС и ИЭ
3х-электродная ячейка: ЭС, ИЭ и ВЭ
ИЭ – датчик, чувствительный к процессам,
протекающим с участием электронов или
ионов, т.е. к составу электролита.
ЭС – неполяризуемый электрод, имеет
постоянный потенциал, который не зависит от
состава электролита.
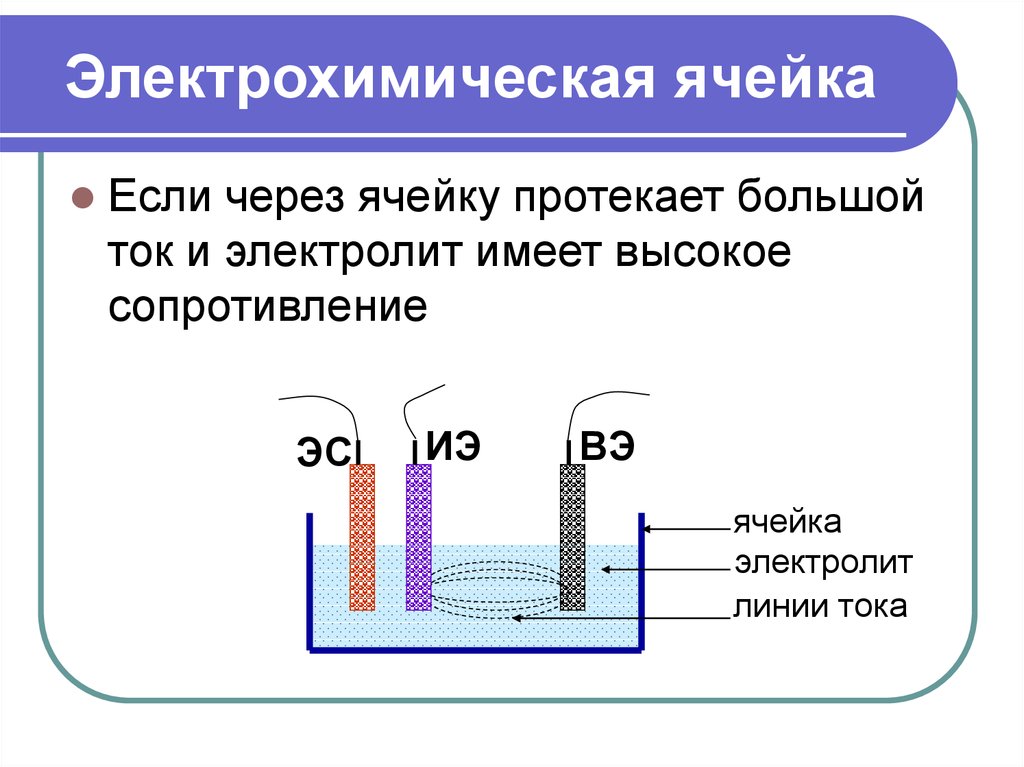
6. Электрохимическая ячейка
Если через ячейку протекает большойток и электролит имеет высокое
сопротивление
ЭС
ИЭ
ВЭ
ячейка
электролит
линии тока
7. Электрохимическая ячейка
Инертный электрод –материал электрода не принимает
участия в химических и
электрохимических реакциях,
протекающих на его поверхности.
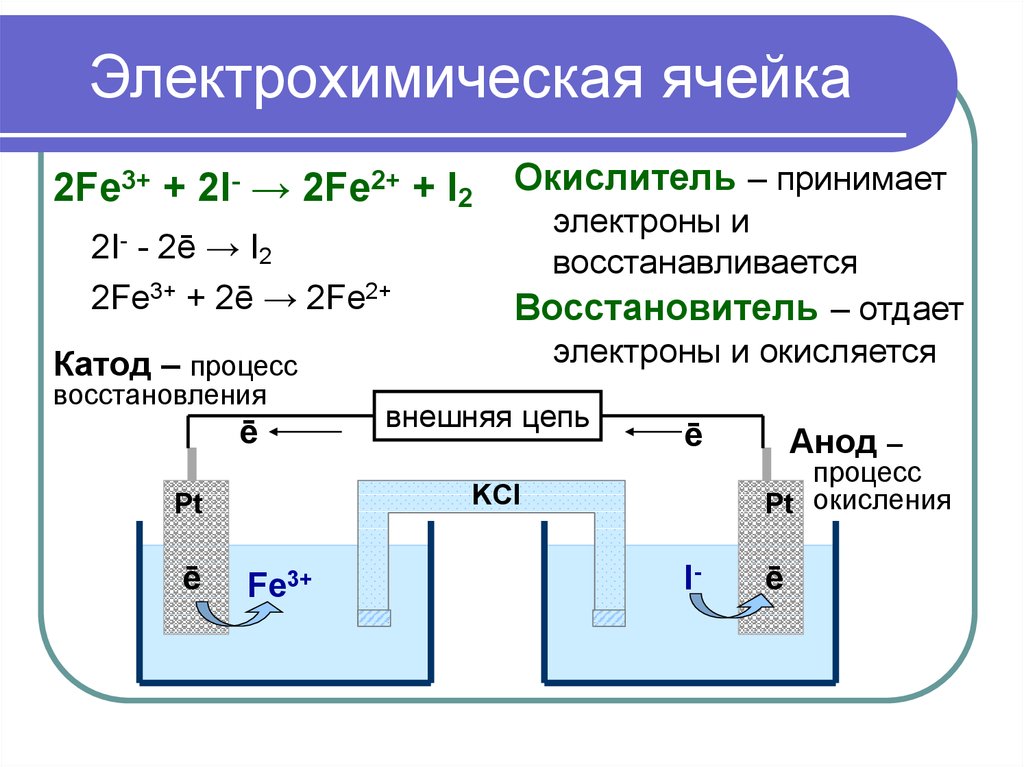
8. Электрохимическая ячейка
2Fe3+ + 2I- → 2Fe2+ + I2- 2ē → I2
2Fe3+ + 2ē → 2Fe2+
2I-
Катод – процесс
восстановления
ē
электроны и
восстанавливается
Восстановитель – отдает
электроны и окисляется
внешняя цепь
ē
Fe3+
Анод –
процесс
Pt окисления
KCl
Pt
ē
Окислитель – принимает
I-
ē
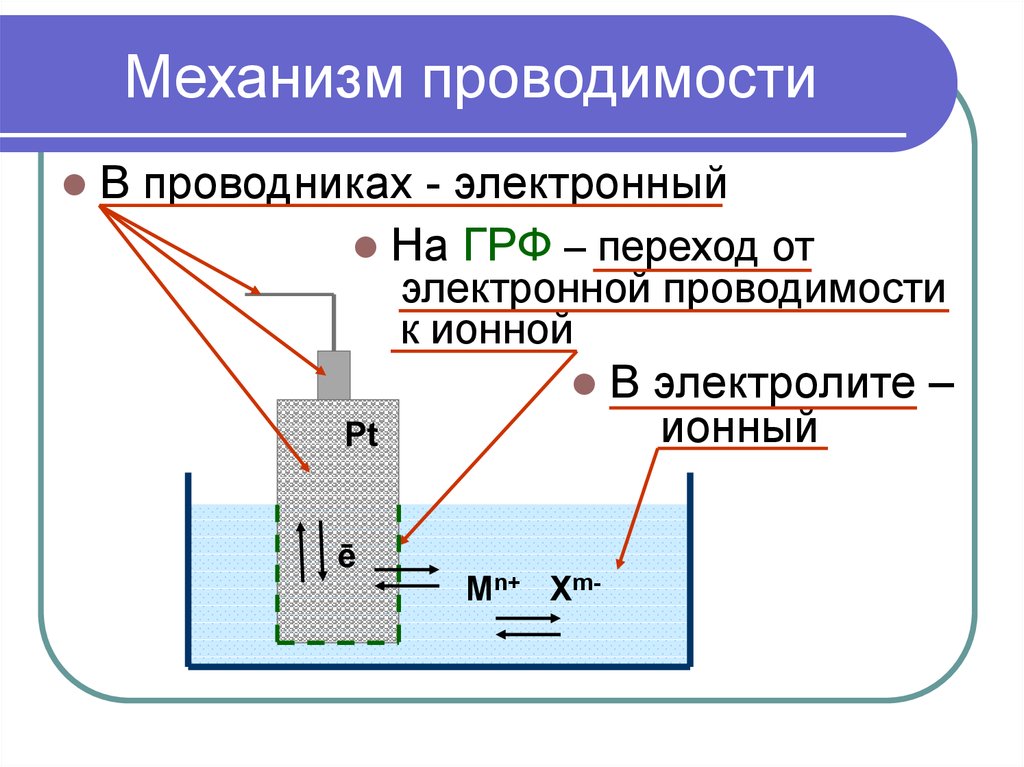
9. Механизм проводимости
В проводниках - электронныйНа ГРФ – переход от
электронной проводимости
к ионной
Pt
ē
Mn+ Xm-
В электролите –
ионный
10.
На катоде – катодный ток (токвосстановления)
На аноде – анодный ток (ток
окисления)
Токи, обусловленные
электрохимическими реакциями, фарадеевские.
Red1 + Ox2 → Ox1 + Red2
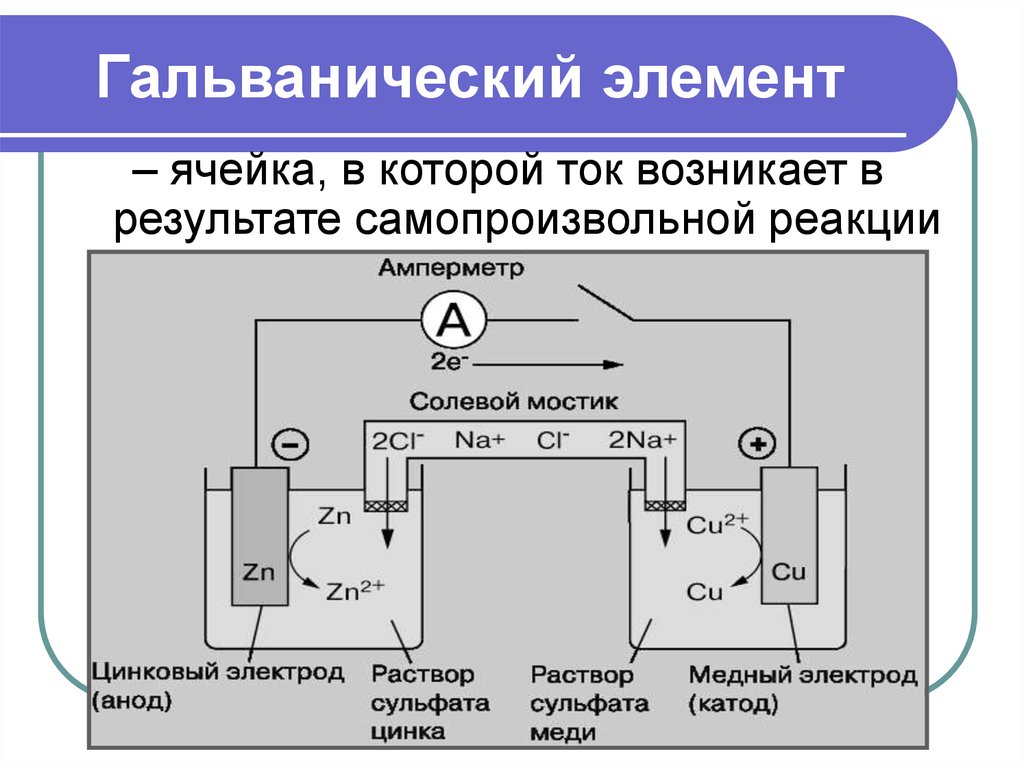
11. Гальванический элемент
– ячейка, в которой ток возникает врезультате самопроизвольной реакции
12. Потенциал
Количественное описание окислительновосстановительной реакции – потенциал системы:G0
RT [Ox1][Red2]
E = - —— + ——ln——————
nF
nF [Red1][Ox2]
R – молярная газовая константа (8.314 Дж/моль·К)
n – число электронов
F – константа Фарадея (96 500 Кл)
E – ЭДС гальванического элемента
G – энергия Гиббса, - G = А (работа по
электрохимическому превращению 1 моль вещества)
13. СЭП
Если концентрации всех компонентов равны 1стандартный
электродный
потенциал
G0
E = - ——
nF
Для измерения СЭП – эталон.
Требования к эталону:
обратимая реакция
простая конструкция электрода
постоянный и воспроизводимый
потенциал электрода
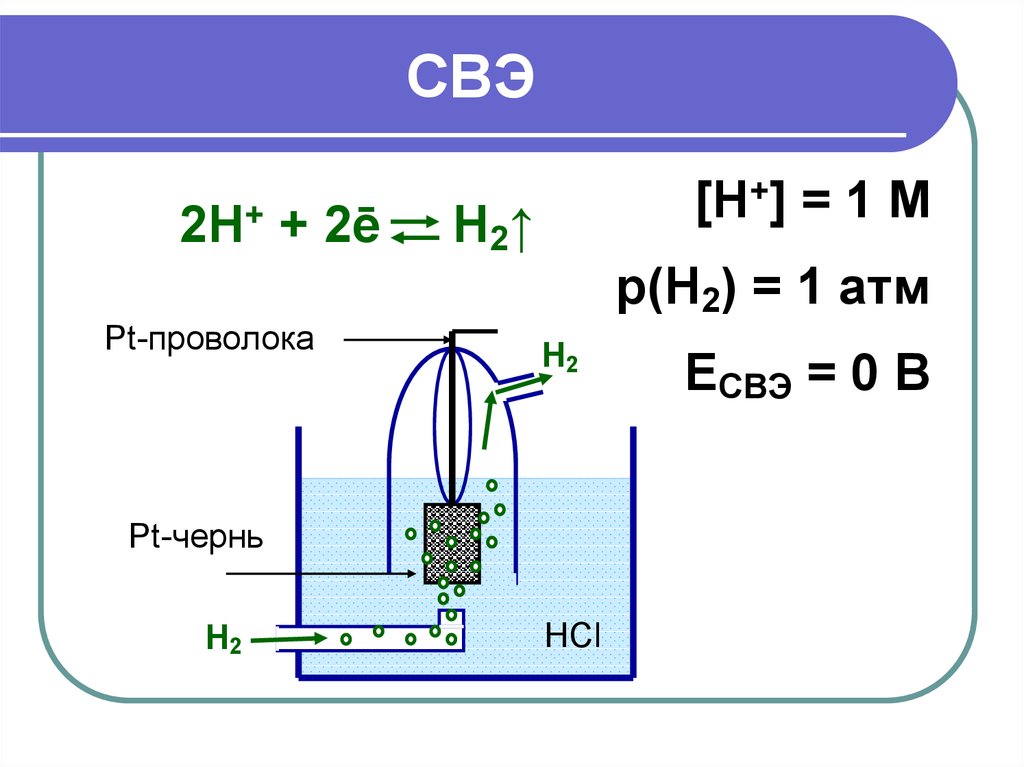
14. СВЭ
2Н+ + 2ēРt-проволока
[H+] = 1 M
Н2↑
p(H2) = 1 атм
Н2
Pt-чернь
Н2
HCl
EСВЭ = 0 В
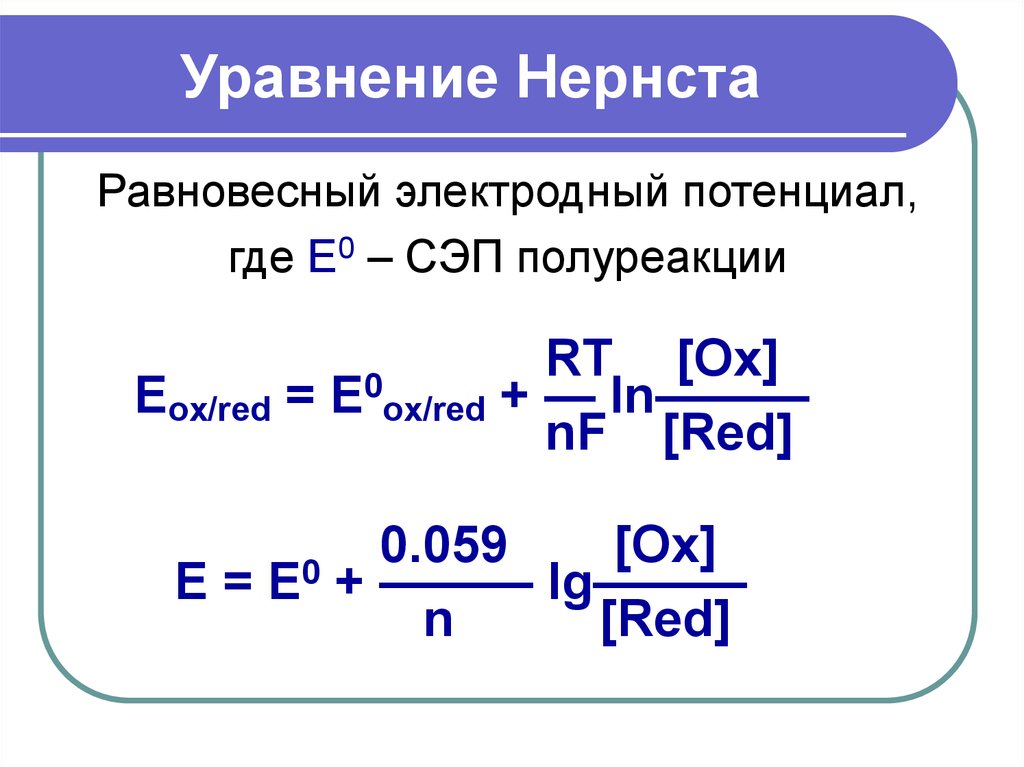
15. Уравнение Нернста
Равновесный электродный потенциал,где Е0 – СЭП полуреакции
Eox/red =
E0ox/red
RT [Ox]
+ — ln———
nF [Red]
0.059
[Ox]
E = E0 + ——— lg———
n
[Red]
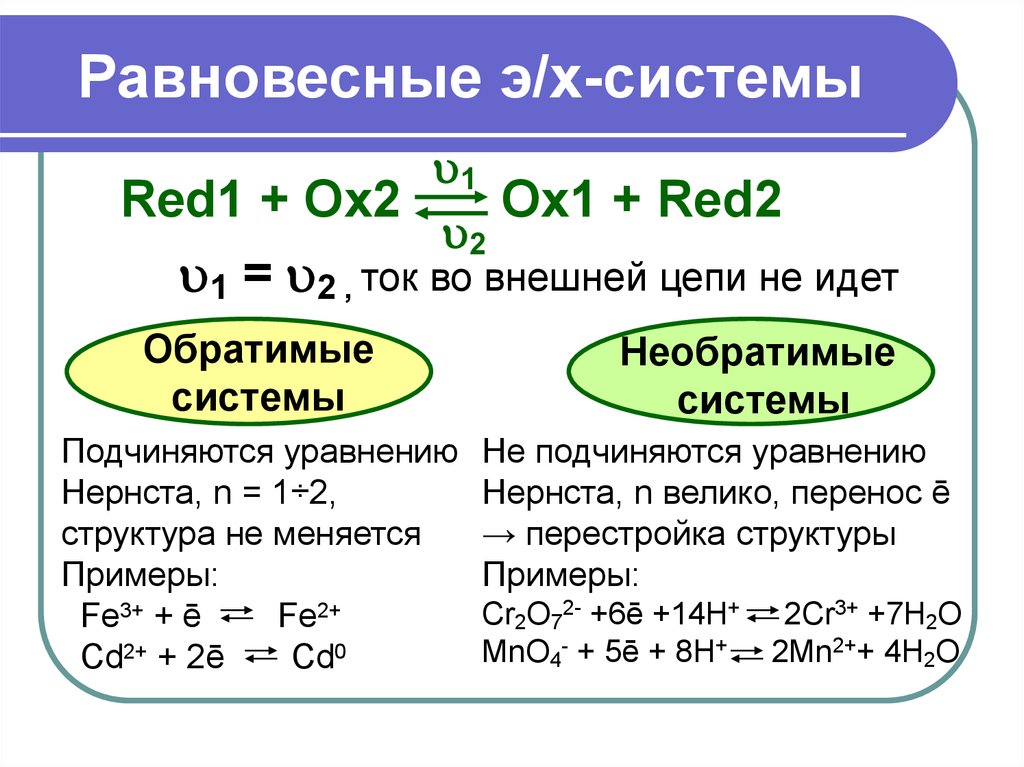
16. Равновесные э/х-системы
1Red1 + Ox2
Ox1 + Red2
2
1 = 2 , ток во внешней цепи не идет
Обратимые
системы
Подчиняются уравнению
Нернста, n = 1÷2,
структура не меняется
Примеры:
Fe3+ + ē
Fe2+
Cd2+ + 2ē
Cd0
Необратимые
системы
Не подчиняются уравнению
Нернста, n велико, перенос ē
→ перестройка структуры
Примеры:
Cr2O72- +6ē +14H+ 2Cr3+ +7H2O
MnO4- + 5ē + 8H+ 2Mn2++ 4H2O
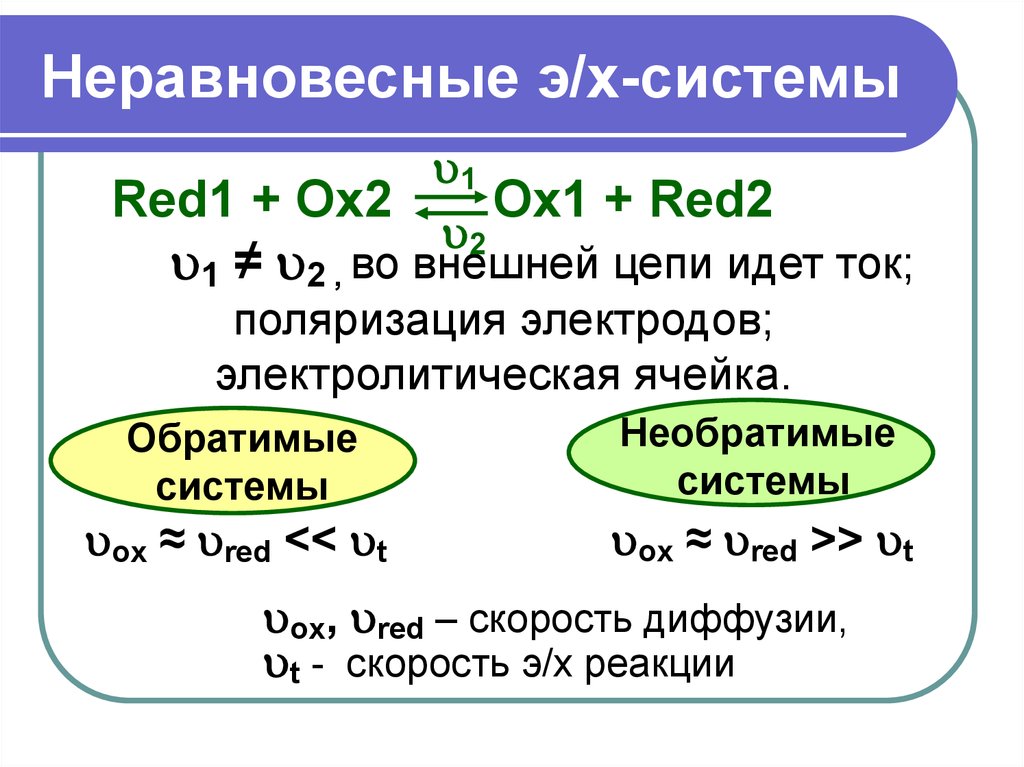
17. Неравновесные э/х-системы
1Red1 + Ox2
Ox1 + Red2
2
1 ≠ 2 , во внешней цепи идет ток;
поляризация электродов;
электролитическая ячейка.
Обратимые
системы
Необратимые
системы
ox ≈ red << t
ox ≈ red >> t
ox, red – скорость диффузии,
t - скорость э/х реакции
18. ПОТЕНЦИОМЕТРИЯ
Потенциометрический анализ –метод определения концентрации
ионов, основанный на измерении
равновесного э/х потенциала ИЭ,
погруженного в анализируемый
раствор.
Используется уравнение Нернста,
связывающее равновесный потенциал
и концентрацию ионов Е = f(C)
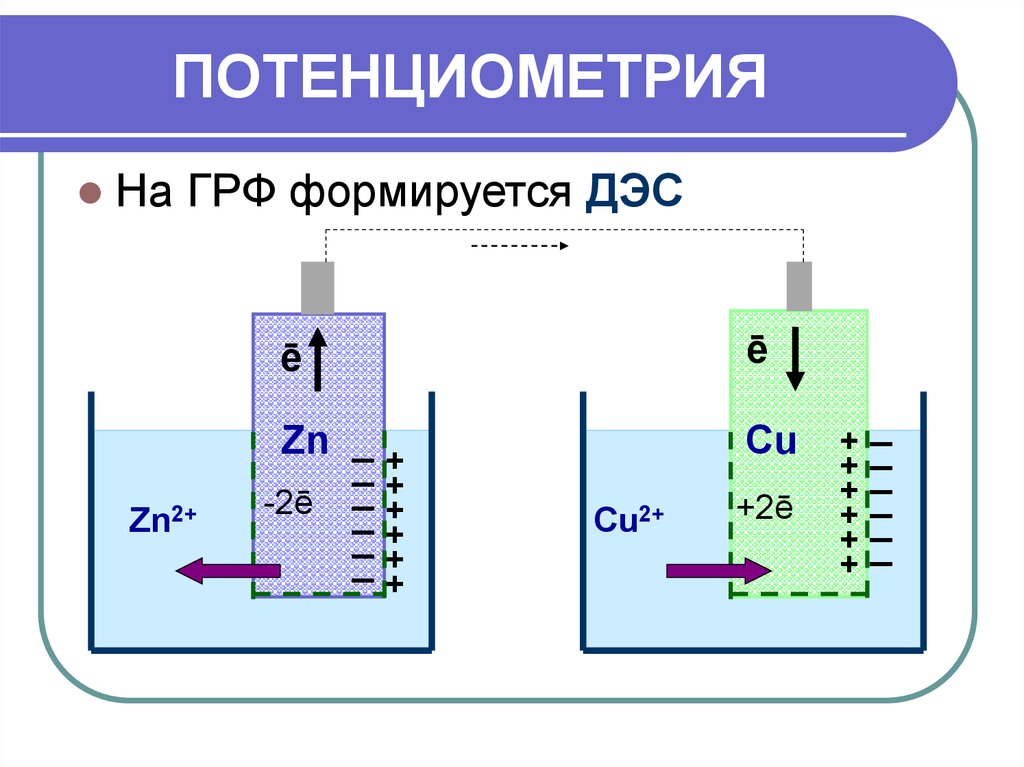
19. ПОТЕНЦИОМЕТРИЯ
На ГРФ формируется ДЭСē
ē
Zn2+
Zn _ +
_+
-2ē _
_+
_+
_+
+
Cu
Cu2+
+2ē
+
+
+
+
+
+
_
_
_
_
_
_
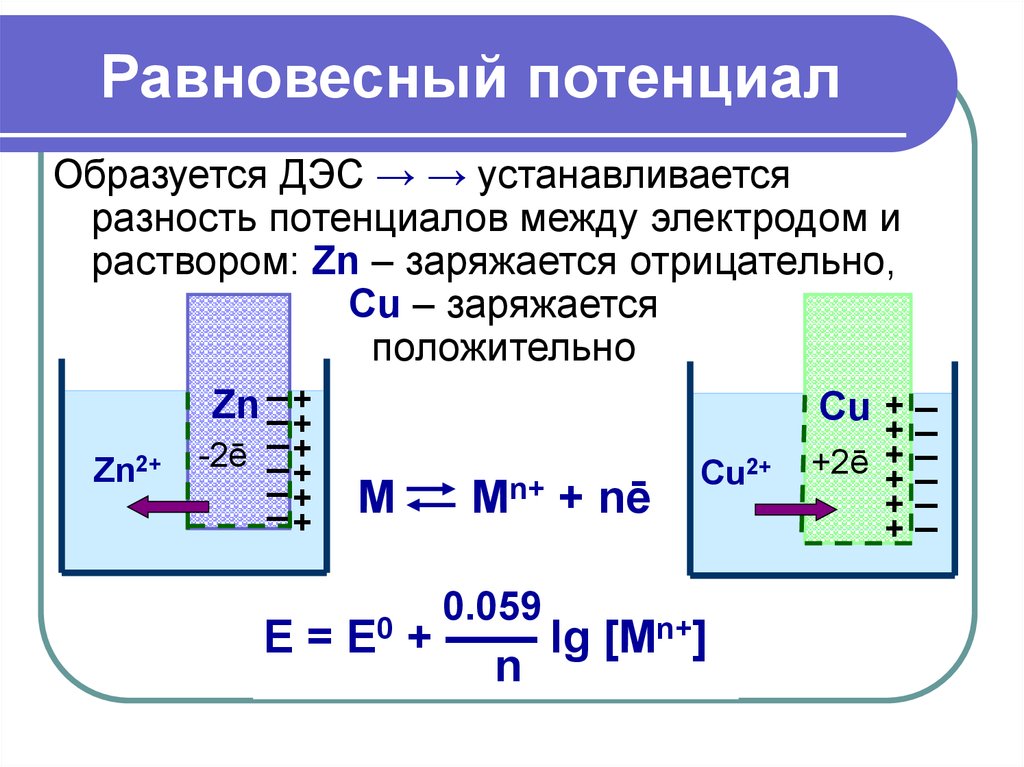
20. Равновесный потенциал
Образуется ДЭС → → устанавливаетсяразность потенциалов между электродом и
раствором: Zn – заряжается отрицательно,
Cu – заряжается
положительно
_+
Zn _ +
Cu + _
_+
+_
_
_
+
-2ē
2+
+2ē _
2+
Zn
Cu
_+
+_
n+
+
М
M + nē
_
+_
+
+
0.059
E = E0 + —— lg [Mn+]
n
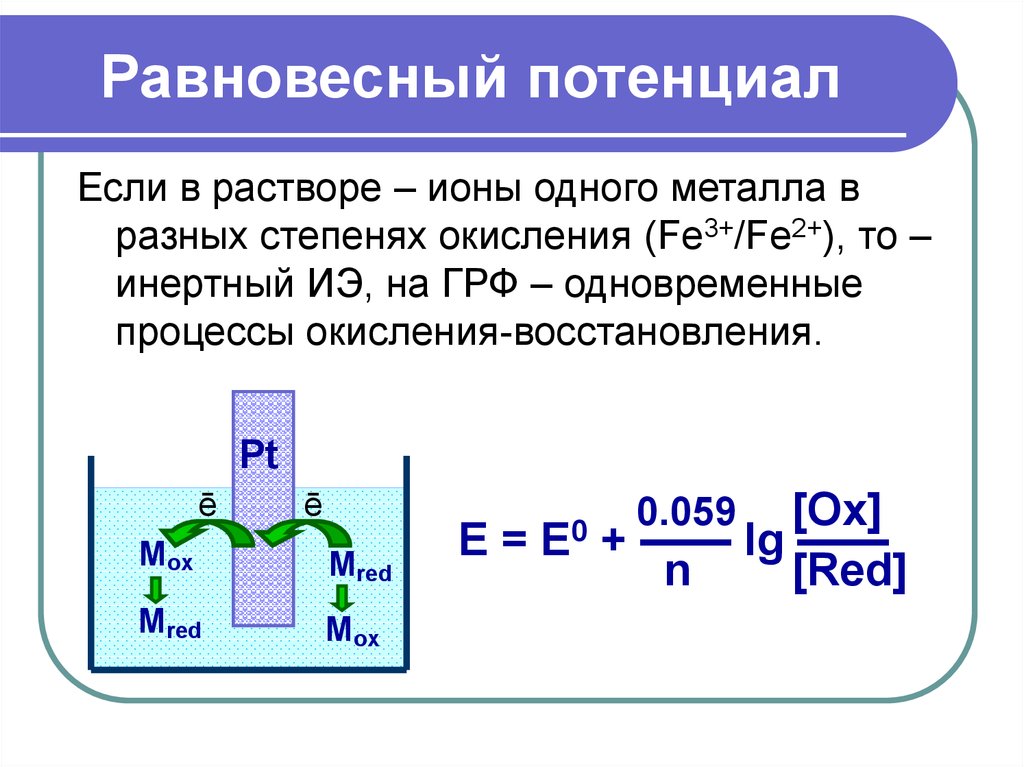
21. Равновесный потенциал
Если в растворе – ионы одного металла вразных степенях окисления (Fe3+/Fe2+), то –
инертный ИЭ, на ГРФ – одновременные
процессы окисления-восстановления.
Pt
ē
ē
Mox
Mred
Mred
Mox
E=
E0
[Ox]
+ —— lg ——
n
[Red]
0.059
22. Потенциометрия
Прямаяпотенциометрия
Ионометрия:
анионометрия
катионометрия,
в т.ч. рН-метрия
Ферментные датчики
Потенциометрическое
титрование
Достоинства:
Простота
Дешевизна
Экспрессность
Возможность
анализа «на
месте»
23. Потенциометрическое титрование
Зависимость равновесного потенциалаэлектрода от состава раствора
(концентрации ионов)
Достоинства по сравнению с обычным
титрованием:
- исключены субъективные ошибки при определении
конечной точки титрования (ктт)
- бóльшая чувствительность
- можно титровать мутные и окрашенные растворы
- можно титровать смеси веществ
- можно автоматизировать процесс
- высокая точность нахождения ктт
24.
Потенциометрическое титрованиеТребование к индикаторному электроду:
равновесный потенциал должен
устанавливаться быстро.
Вид
титрования:
кислотно-основное
редокс-титрование
осадительное
комплексиметрическое
–
-
Индикаторные
электроды:
рН-электроды
Pt-электрод
I или II рода
III рода
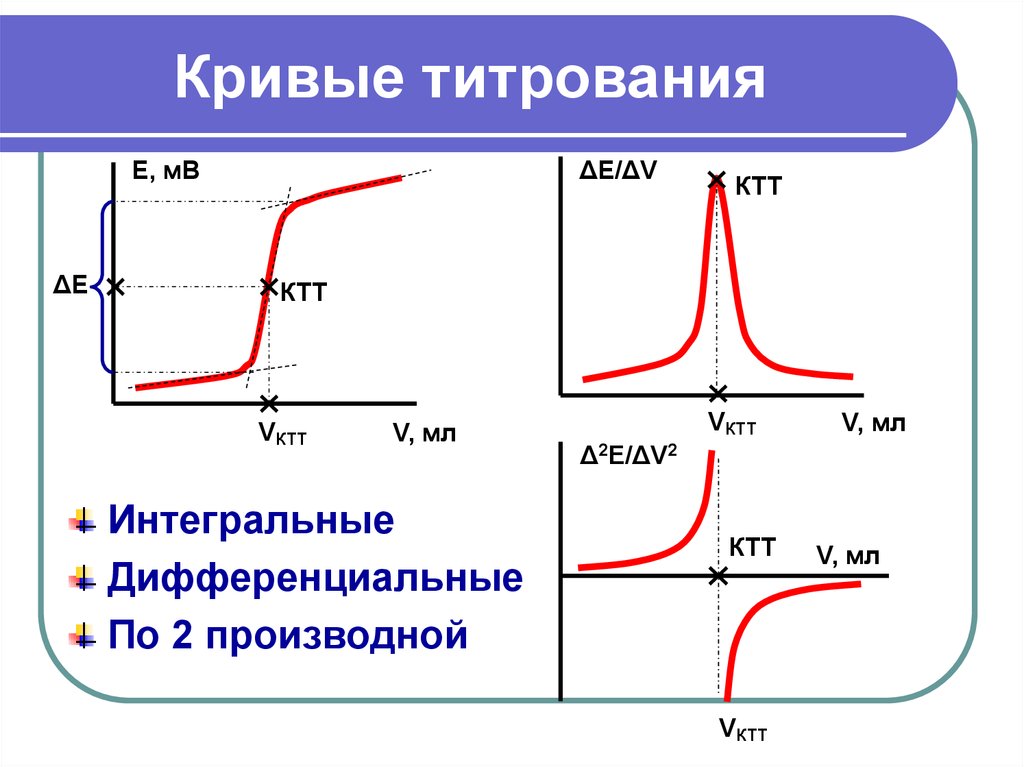
25. Кривые титрования
Е, мВΔЕ
ΔЕ/ΔV
КТТ
КТТ
VКТТ
V, мл
Интегральные
Дифференциальные
По 2 производной
VКТТ
V, мл
Δ2Е/ΔV2
КТТ
VКТТ
V, мл
26. Электроды сравнения
Обладают постоянным потенциалом,не зависящим от состава раствора
Требования:
- низкое электрическое сопротивление
- отсутствие влияния на состав
раствора
- простота конструкции
- быстрое установление потенциала
- обратимый, воспроизводимый,
стабильный
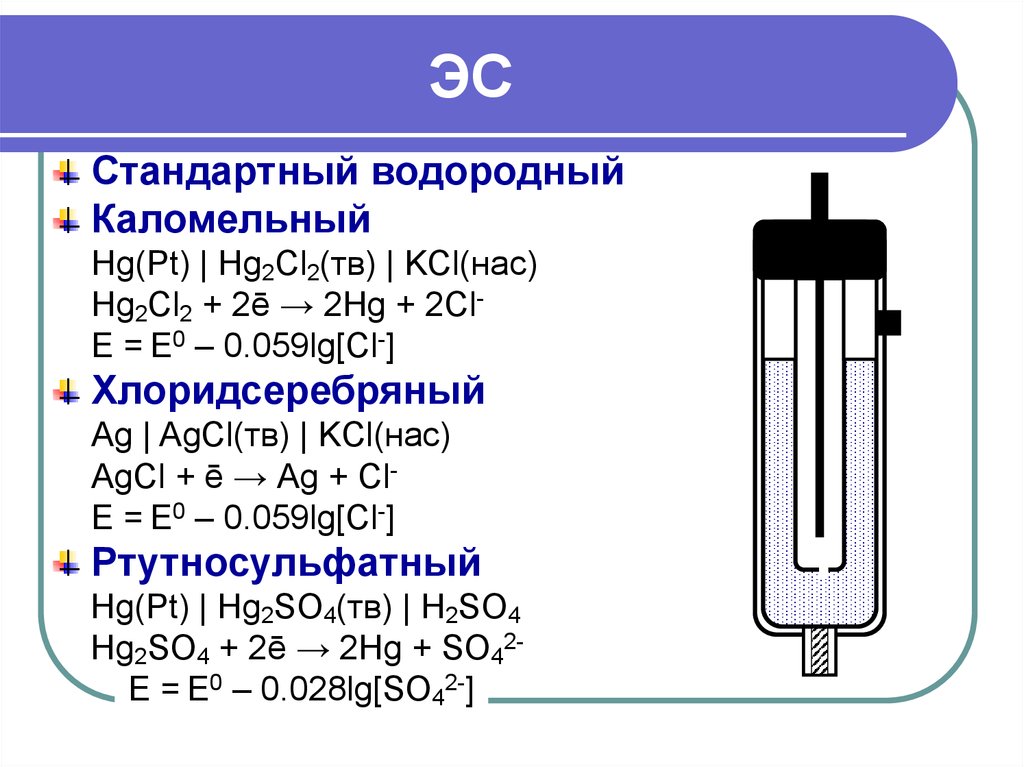
27. ЭС
Стандартный водородныйКаломельный
Hg(Pt) | Hg2Cl2(тв) | KCl(нас)
Hg2Cl2 + 2ē → 2Hg + 2ClE = E0 – 0.059lg[Cl-]
Хлоридсеребряный
Ag | AgCl(тв) | KCl(нас)
АgCl + ē → Аg + ClE = E0 – 0.059lg[Cl-]
Ртутносульфатный
Hg(Pt) | Hg2SO4(тв) | H2SO4
Hg2SO4 + 2ē → 2Hg + SO42E = E0 – 0.028lg[SO42-]
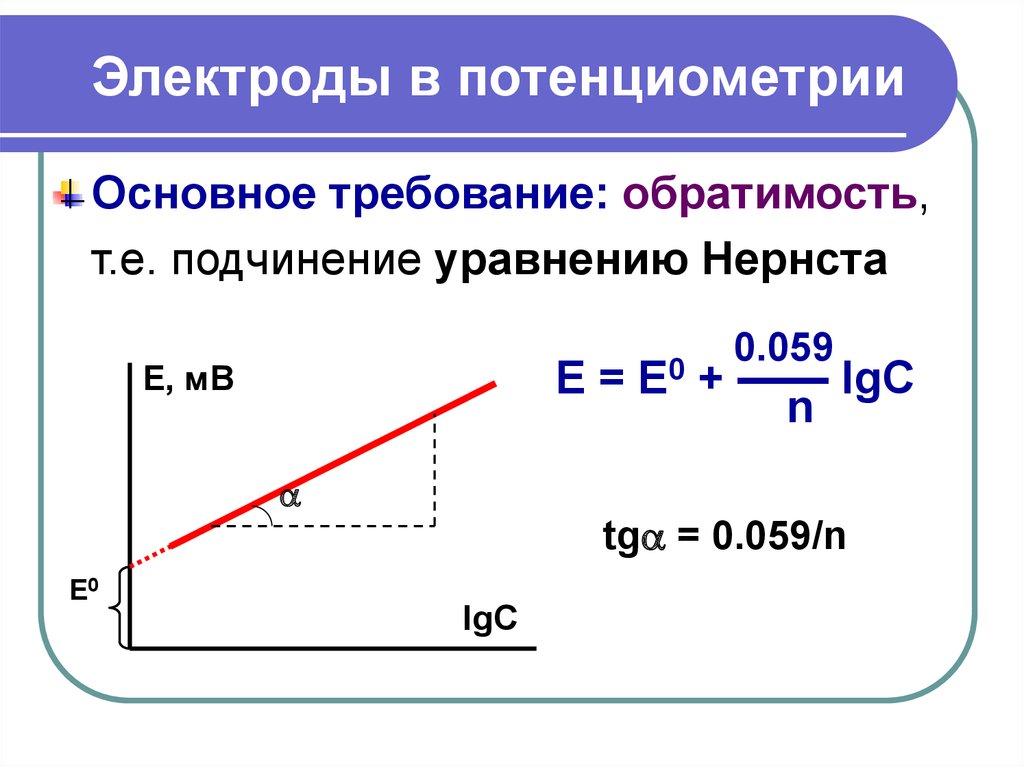
28. Электроды в потенциометрии
Основное требование: обратимость,т.е. подчинение уравнению Нернста
Е, мВ
E=
E0
0.059
+ —— lgC
n
tg = 0.059/n
Е0
lgC
29. Электроды I рода
Катионные:- металлические
Mn+ + nē → M0
E=
- амальгамные
Mn+ +
nē + Hg →
- водородный
E0
0.059
+ —— lg[Mn+]
n
n+]
0.059
[M
M(Hg)
E = E0 + —— lg ———
n
[M(Hg)]
E = E0 + 0.059 lg[H+], E0 = 0,
E = -0.059pH
2H+ + 2ē → H2
Анионные
An- - nē → A0
E=
E0
0.059
- —— lg[An-]
n
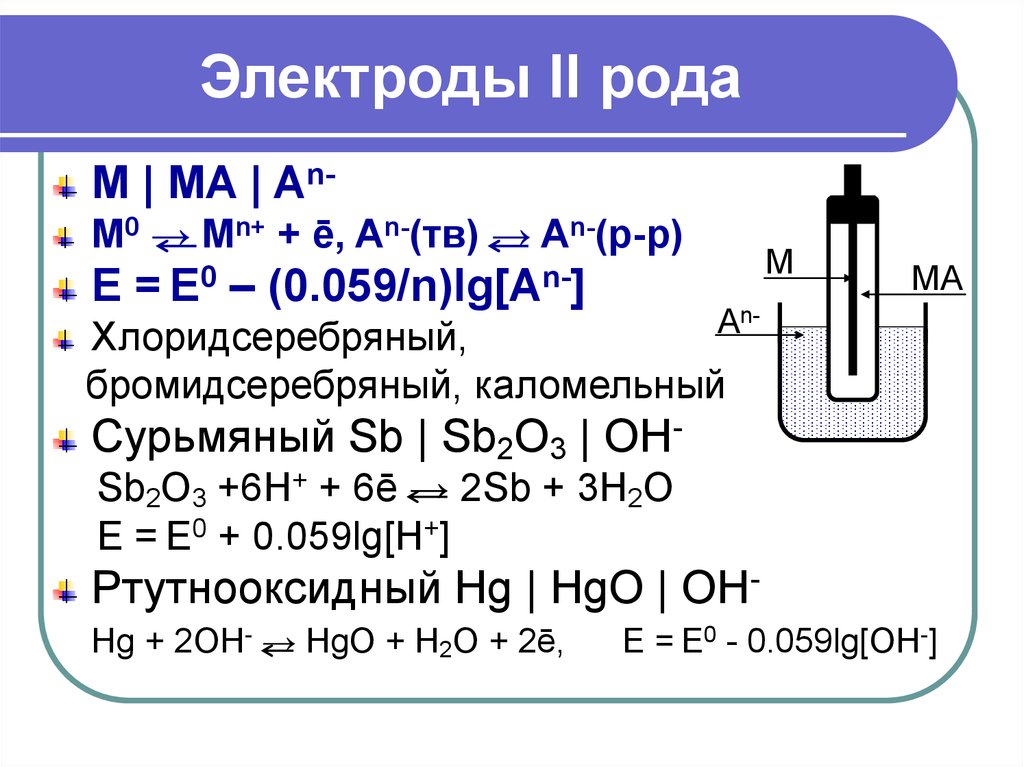
30. Электроды II рода
M | MA | AnM0 → Mn+ + ē, An-(тв) → An-(р-р)E
= E0
–
(0.059/n)lg[An-]
M
MA
An-
Хлоридсеребряный,
бромидсеребряный, каломельный
Сурьмяный Sb | Sb2O3 | OHSb2O3 +6H+ + 6ē → 2Sb + 3H2O
E = E0 + 0.059lg[H+]
Ртутнооксидный Hg | HgO | OHHg + 2OH- → HgO + H2O + 2ē,
E = E0 - 0.059lg[ОH-]
31. Электроды III рода
M | MA(нас) | M`A(нас) | M`+(р-р)E = E0 + (0.059/n)lg[M`n+ ]
Ртутный
Hg | Hg2C2O4 | Ca2C2O4 | Ca2+
Hg2C2O4 + Ca2+ + 2ē → Hg + Ca2C2O4
E = E0 + 0.029lg[Ca2+ ]
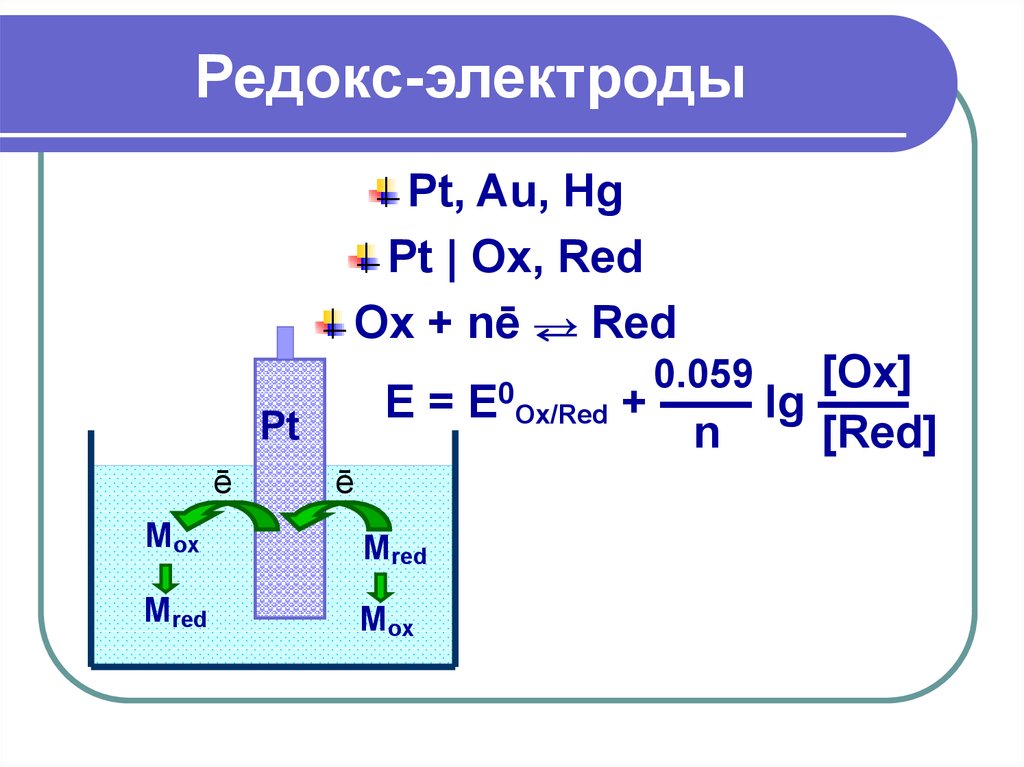
32. Редокс-электроды
Pt, Au, HgPt | Ox, Red
Ox + nē → Red
E=
Pt
ē
ē
Mox
Mred
Mred
Mox
[Ox]
Ox/Red + —— lg ——
n
[Red]
E0
0.059
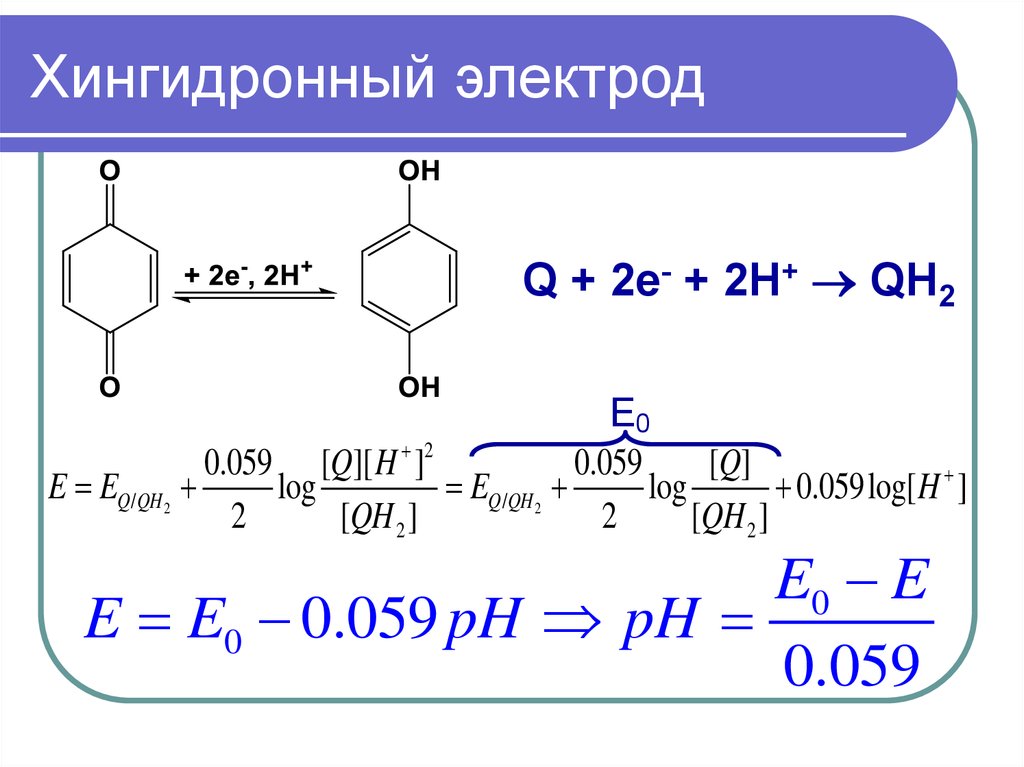
33. Хингидронный электрод
Q + 2e- + 2H+ QH2E0
0.059 [Q][ H ]2
0.059
[Q]
E EQ /QH2
log
EQ /QH2
log
0.059log[ H ]
2
[QH 2 ]
2
[QH 2 ]
E0 E
E E0 0.059 pH pH
0.059















 Химия
Химия








