Похожие презентации:
Химия плутония, америция и трансамерициевых актиноидов
1.
ХИМИЯ плутония,америция и
трансамерициевых
актиноидов
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
1
2. ПЛУТОНИЙ
Впервые получен и идентифицирован в 1940 Г. Сиборгом, Э. Макмилланом,Дж. Кеннеди и А. Валеном при бомбардировке урана дейтонами:
Вслед за ураном и нептунием назван в честь далекой планеты солнечной
системы Плутона.
В шифровках Манхэттенского проекта именовался медью. А когда возникла
необходимость в самой меди то в шифровках наряду с «медью»
появилась «подлинная медь».
Стабильных изотопов не имеет. Известны 15 изотопов с массовыми числами
232-246. Наиболее долгоживущие изотопы - 244Pu (T1/2 = 8,26·107 лет),
242Pu (T = 3,76 · 105 лет, 239 Pu (T
4
238Pu (T
1/2
1/2 = 2,41 ·10 лет), и
1/2 =87,74 г)
α-излучатели. В природе встречается в ничтожных количествах в
урановых рудах (239 Pu); он образуется из U под действием нейтронов,
источниками которых являются: реакции (α,n), протекающие при
взаимодействии α-частиц с легкими элементами (входящими в состав
руд), спонтанное деление ядер U и космическое излучение.
Плутоний высокотоксичен
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
2
3. ОБЩАЯ характеристика химических свойств плутония
Конфигурация внешних электронных оболочек атома5s2 5p65d105f66s26p67s2; степень окисления от + 3 до
+ 7, наиб. устойчива + 4; атомный радиус 0,160 нм,
ионные радиусы Pu3+, Pu4+, Pu5+ и Pu6+
соответственно 0,0974, 0,0896, 0,087 и 0,081 нм.)
Химические свойства Pu во многом сходны со
свойствами его предшественников в периодической
системе - ураном и нептунием. Pu образует
соединения со степенями окисления от +2 до +7.
Известны окислы PuO, Pu2O3, PuO2. В соединениях с
галогенами обычно проявляет степень окисления +3,
но известны также галогениды PuF4 и PuCl4.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
3
4. СВОЙСТВА металлического плутония
Плутоний - блестящий белый металл, при температурах откомнатной до 640оС (tпл) существует в шести аллотропных
модификациях. Две из них отличаются замечательным свойством
– отрицательным коэффициентом температурного
расширения: с ростом температуры металл не расширяется, а
сжимается. При изготовлении отливок из плутония его легируют добавляют незначительные количества нужных элементов. Вес
плутониевого заряда ядерных бомб 5...6 кг. Он без труда
поместился бы в кубике с размером ребра 10 см.
Компактный плутоний медленно окисляется на воздухе, порошок и
стружка пирофорны; медленно взаимодействует с водой,
растворяется в соляной кислоте, HClO4, HBr и H3PO4,
пассивируется концентрированными HNO3, CH3COOH и H2SO4; в
растворах щелочей заметно не растворяется.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
4
5. ПЛУТОНИЙ в растворе (1)
В растворах плутоний существует в формах Pu3+, Pu4+, PuO2+ (плутоноил - ион), PuO22+(плутонил - ион) и PuO53-, отвечающих степеням окисления от +3 до +7.
Формальные окислительно-восстановительные потенциалы плутония в 1 M растворе HClO4:
Близость значений ox-red потенциалов для различных с.о. приводит к легкости переходов из
одного окисленного состояния в другое и к сосуществованию окислительных состояний. Все
ионы (кроме PuO53-) могут находиться в растворе одновременно в равновесии, что делает
химию плутония исключительно сложной и интересной
Pu в степени окисления + 7 впервые получили в 1967 H. H. Крот и А. Д. Гельман окислением
озоном в щелочной среде. В кислых водных растворах плутоний существует в виде ионов
Pu3+ (цвет в растворе сине-фиолетовый), Pu4+ (желто-коричневый), PuO2+ (светло-розовый),
PuO22+ (розово-оранжевый). Ионы Pu4+ и PuO2+ в водных растворах диспропорционируют:
Склонность к комплексообразованию уменьшается в ряду Pu4+>Pu3+> PuO22+ > PuO2+ .
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
5
6. ПЛУТОНИЙ в растворе Рu(III), Рu(IV)
Рu(III): лишь медленно окисляется кислородом. В 0,5 М HCl идет значительноеокисление до Рu(IV) под действием собственного излучения.
Склонность к гидролизу выражена сильнее, чем у U(III) и Np(III). Под действием
щелочей выпадает основная гидроокись
Pu(OH)3 ·xH2O. Малорастворимы иодаты, оксалаты, ферроцианиды. Умеренно
растворим сульфат. Менее растворимы двойные сульфаты. Малорастворимы
двойные фториды, например, NaPuF4.
Рu(IV): самая устойчивая с.о. В слабокислых растворах в отсутствии
комплексообразующих веществ плутоний (IV) диспропорционирует по схеме
1 ступень: 2Pu4+ + 2H2O PuO2+ + Pu3+ + 4H+
2 ступень: Pu4+ + PuO2+2 Pu3+ + PuO22+
суммарно:
3Pu4+ + 2H2O 2Pu3+ + PuO22+ + 4H+
Благодаря высокому заряду и сравнительно небольшому радиусу Рu(IV)
гидратирован и сильно гидролизуется. Склонность к гидролизу уменьшается в
ряду Рu(IV)>Np(IV)>U(IV)>Th(IV), она меньше, чем у Zr(IV) и Hf(IV), близка к
Ce(IV). Гидролиз Рu(IV) приводит к образованию крупных коллоидных частиц, и
в конечном счете – к образованию труднорастворимого осадка Рu(ОН)4 (уже при
рН=2). Коллоидные частицы сильно сорбируются на стекле, двуокиси кремния и
бумаге.
Малорастворимые соединения: иодаты Pu(IO3)4, оксалаты Pu(C2O4) 2·6H2O,
фториды PuF4·nH2O, фосфаты Pu(HPO4)2 ·nH2O. В кислой среде перекись
водорода осаждает пероксид Pu (O2)2 ·nH2O.
Хорошорастворимые соединения – сульфаты, нитраты
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
6
7. СРАВНИТЕЛЬНАЯ характеристика степени окисления +4 U, Np, Pu, Am (1)
Уран и нептуний в степени окисления +4 устойчивы в водных растворах, но медленноокисляются кислородом воздуха с образованием UO2 2+и NpO2+ соответственно. Рu
(IV) устойчив в сильнокислых растворах. Америций, кюрий и калифорний в этой
степени окисления получены в виде оксидов и фторидов и в водных растворах в
виде фторидных, фосфатных и фосфоровольфраматных (Р : W = 1 : 11 и 2 : 17)
комплексов.
Реакции диспропорционирования для актиноидов в степени окисления +4 известны
для плутония и америция. В слабокислых растворах в отсутствии
комплексообразующих веществ плутоний диспропорционирует по схеме:
I. 2Pu4+ + 2H2O PuO2+ + Pu3+ + 4H+
II.
2. Pu4+ + PuO2+ Pu3+ + PuO22+
суммарно:
3Pu4+ + 2H2O 2Pu3+ + PuO22+ + 4H+.
Америций в степени окисления +4 очень неустойчив и быстро диспропорционирует по
схеме
2Am4+ + 2H2O Am3+ + AmO2+ + 4H+
причем в присутствии SO42- -ионов, играющих роль катализаторов, имеет место
реакция
Am4+ + AmO2+ Am3+ + AmO22+.
В присутствии комплексообразующих веществ устойчивость Pu(IV) и Am (IV) к
диспропорционированию увеличивается.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
7
8. СРАВНИТЕЛЬНАЯ характеристика степени окисления +4 U, Np, Pu, Am (2)
Актиноиды в степени окисления +4 являются химическимианалогами тория и церия (IV) в большей степени, чем
гафния и циркония. Труднорастворимыми соединениями в
степени окисления +4 являются гидроксиды, фториды,
иодаты, пероксиды, фосфаты, а также карбонаты и оксалаты
(последние растворяются в присутствии избытка карбонатов
и оксалатов щелочных металлов и аммония). В качестве
носителей для выделения элементов в этой степени
окисления могут быть использованы труднорастворимые
соединения тория, церия (IV) и циркония. В степени
окисления +4 эти элементы являются сильными
комплексообразователями, причем устойчивость
комплексных соединений растет с увеличением атомного
номера элемента. Наиболее характерными
координационными числами актиноидов в степени
окисления +4 являются 8 или 10.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
8
9. ПЛУТОНИЙ в растворе - Рu(V)
Рu(V) находится в растворе в виде плутоноил-ионаPuO2+, который медленно диспропорционирует в
слабокислых растворах:
2PuO2+ + 4H+ Pu4+ + PuO22+ + 2H2O
В 1 М растворе хлорной кислоты содержание Рu(V)
составляет 5%, а в 0,01М – 60%.
Нерастворимые соли – калийплутоноил карбонат
К3 PuО2(СО3)2
При рН=3,6 в осадок выпадает амфотерная
гидроокись PuO2ОН, которой соответствуют соли
плутоноила и плутониты состава МеIPu2О6
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
9
10. ПЛУТОНИЙ в растворе Рu(VI)
Рu(VI) находится в растворе в виде плутонил-иона PuO22+, которыйполучают окислением низших степеней жестким окислением горячими
растворами азотной кислоты, бихромата калия, перманганата калия и
т.п.
PuO22+ устойчив, самовосстанавливается под действием собственного
излучения. При рН = 5 начинается гидролиз, а при рН=6-9 образуется
амфотерная гидроокись PuO2(ОН)2. Вследствие амфотерности
существуют соли плутонила (благодаря основным свойствам
гидроокиси плутонила) и плутонаты и полиплутонаты - как результат
кислотной функции гидроокиси плутонила.
РАСТВОРИМЫЕ СОЕДИНЕНИЯ - все галогениды, нитраты, перхлораты,
сульфаты
К ТРУДНО РАСТВОРИМЫМ относятся соединения с гидроксид-ионом, а
также иодаты, фосфаты, оксалаты, и двойные ацетаты состава
Na[РuO2(CH3COO)3] (еще хуже растворимы тройные ацетаты,
например, NaZn[MeO2(CH3COO)3]3
Перекись водорода восстанавливает PuO22+ до Pu4+ с последующим
образованием осадка пероксида Pu4+
В щелочной среде возможно диспропорционирование Рu(VI) на Рu(VII)
и Рu(IV)
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
10
11. ПЛУТОНИЙ в растворе Рu(VII)
Степень окисления +7. Эта степень окисления характерна для нептуния, плутония иамериция. Наиболее устойчивой она является для нептуния. Основным методом
получения всех трех элементов в степени окисления +7 является окисление в
щелочной среде их шестивалентных форм сильными окислителями, например
озоном, а также радикалами ОН и ионом О-, образующимися при радиолизе водных
растворов, насыщенных N2O.
Соединения нептуния и плутония в степени окисления +7 могут быть получены и при
действии более мягких окислителей, например гипобромита, персульфата и др., а
также электрохимическим окислением. Методами получения соединений нептуния и
америция в этой степени окисления могут служить реакции диспропорционирования
Me(VI). Устойчивость степени окисления +7 рассматриваемых элементов
существенно возрастает с увеличением концентрации щелочи. В кислых растворах
семивалентное состояние известно только для нептуния
В химическом поведении нептуния, плутония и америция в степени окисления +7
наблюдается двойственный характер — кроме общности их свойств, как 5fэлементов, они проявляют аналогию с d-элементами (рением и технецием). При этом
в степени окисления +7 наблюдается расхождение в поведении нептуния, плутония
и америция и d-элементов.
Наиболее вероятными и установлеными экспериментально формами семивалентных
нептуния и плутония в щелочных растворах являются гидратированные формы
аниона МеО53- с координационными числами от 6 до 10 и с числом
координированных молекул воды от 0 до 5.
Из щелочных растворов Np(VII) и Pu(VII) могут быть выделены в виде трудно
растворимых солей тяжелых щелочных и щелочно-зeмельных металлов, а также с
некоторыми сложными катионами, например [(C2H5)4N]+, [Co(NH3)6]3- и др.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
11
12. ПОЛУЧЕНИЕ плутония
Наиболее важный в практическом отношении изотоп 239Pu получают вядерных реакторах при длит. облучении нейтронами природного или
обогащенного U:
Долгоживущие изотопы Pu и 244Pu получают при длит. облучении
нейтронами 239Pu.
Весовые кол-ва изотопно чистого 238Pu образуются при облучении
нейтронами 237Np. Легкие изотопы плутония с массовыми числами 232237 обычно получают на циклотроне при облучении изотопов U αчастицами. Выделение и очистку изотопов плутония осуществляют
преимущественно экстракционными и сорбционными методами. Для
промышленного производства 239Pu используют PUREX-процесс,
основанный на экстракции трибутилфосфатом в разбавителе. В первом
цикле осуществляют совместную очистку Pu и U от продуктов деления, а
затем их разделение. Во втором и третьем циклах плутоний подвергают
дальнейшей очистке и концентрированию.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
12
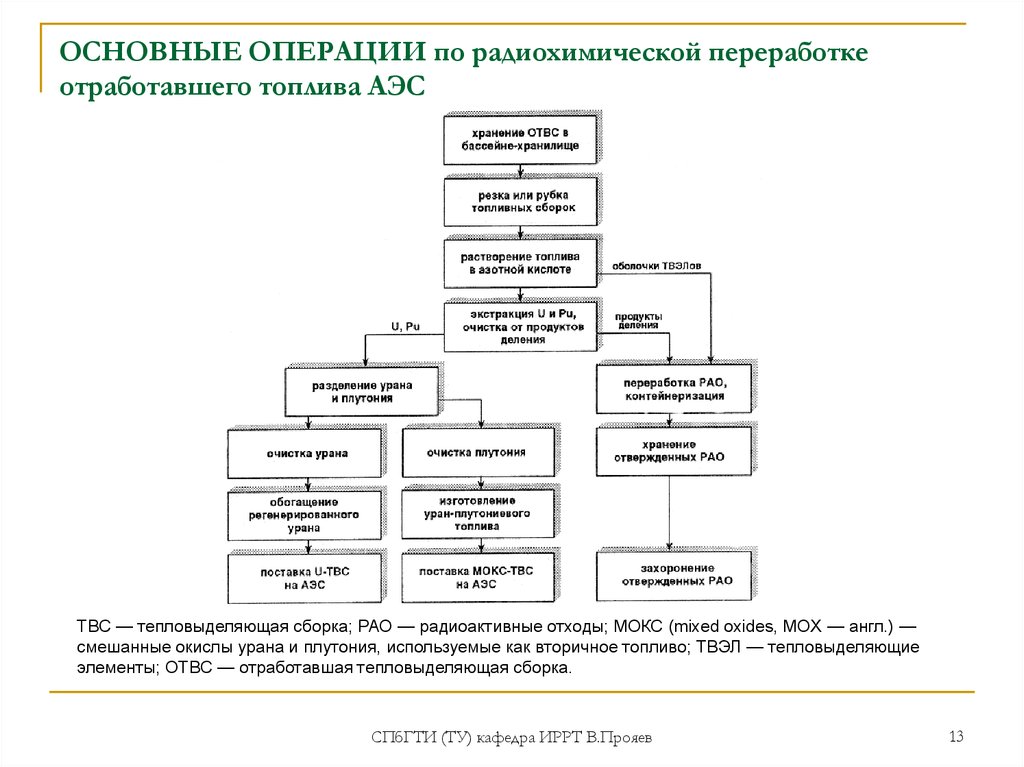
13. ОСНОВНЫЕ ОПЕРАЦИИ по радиохимической переработке отработавшего топлива АЭС
ТВС — тепловыделяющая сборка; РАО — радиоактивные отходы; МОКС (mixed oxides, MOX — англ.) —смешанные окислы урана и плутония, используемые как вторичное топливо; ТВЭЛ — тепловыделяющие
элементы; ОТВС — отработавшая тепловыделяющая сборка.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
13
14. ПРИМЕНЕНИЕ плутония
239Pu(наряду с U) используют в качестве ядерного
топлива энергетических реакторов, работающих
на тепловых и особенно на быстрых нейтронах, а
также при изготовлении ядерного оружия.
Критическая масса для 239Pu в виде металла
составляет 5,6 кг.
239Pu является также исходным веществом для
получения в ядерных реакторах
трансплутониевых элементов.
238Pu применяют в малогабаритных ядерных
источниках электрического тока, используемых в
космических исследованиях, а также в
стимуляторах сердечной деятельности человека.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
14
15. ПЛУТОНИЙ энергетический и оружейный
В атомных реакторах за счёт комплекса параллельныхи последовательных ядерных реакций образуется набор
изотопов плутония от 236-го до 244-го. Изотопы 239Pu и 241Pu
хорошо делятся тепловыми нейтронами, поэтому „нечётный“
плутоний и образуется, и одновременно „выгорает“ в реакторах
АЭС типа ВВЭР, PWR, CANDU, РБМК; чётные изотопы при этом
накапливаются. Согласно сделанным оценкам, около 50%
энергии, производимой АЭС, образуется за счёт деления
плутония.
Изотопный состав плутония в отработавшем топливе разных
реакторов различен. Плутоний из энергетических реакторов
обычно называют „гражданским“ или „энергетическим“;
а наработанный в специальных (промышленных) реакторах, „оружейным“:
238Pu
239Pu
240Pu
241Pu
242Pu
Изотопный состав, %
ВВЭР-1000
1,6
44,1
30,4
16,4
7,3
БН–600
0,1
85,0
13,5
1,0
0,1
Оружейный Pu
0,05
93,6
6,0
0,4
0,05
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
15
16. АМЕРИЦИЙ
Стабильных изотопов не имеет. Синтезирован в конце 1944 начале 1945 американскими учёными Г. Сиборгом, Р.Джеймсом, Л. Морганом и А. Гиорсо в результате
облучения плутония 239Pu нейтронами. Название дано от
слова "Америка" по аналогии с гомологом Аm в ряду
лантаноидов – европием. Известны изотопы Аm с
массовыми числами 237-246 и ядерные изомеры 242mAm,
244mAm Наиболее долгоживущий изотоп 243Am α-активен
(T1/2 = 7950 лет). Конфигурация внешних электронных
оболочек 5f76s26p67s2; степень окисления от +2 до +7
(наиболее характерна +3). Aтомный радиус 0,174нм;
ионные радиусы Am3+, Am4+, Am5+ и Am6+ соотв. 0,0962,
0,0888, 0,0860 и 0,0800 нм.
Америций используют при синтезе более тяжелых
элементов. В смеси с бериллием 241Am применяют в
качестве источников нейтронов.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
16
17. АМЕРИЦИЙ в растворе
Аm - первый актиноид, для которого в растворах наиболееустойчива валентность 3. Растворы Am3+ окрашены в яркорозовый цвет.
Am(IV) устойчив в концентрированных растворах фторидов
щелочных металлов, а также в присутствии Н3РО4, Na4P2O7 или
ненасыщенных гетерополианионов Неустойчивость Am(IV)
обусловлена его диспропорционированием,
самовосстановлением вследствие радиолиза растворов, а также
восстановлением водой до Am(III).
Am(V) в кислой среде существует в виде иона AmO2+; Am(V)
диспропорционирует в концентрированных растворах
минеральных кислот с образованием Am(III) и Am(VI), медленно
восстанавливается Н2О2, I- и др. до Am(III). Под действием
излучения 241Аm происходит самовосстановление Am(V) до
Am(III). В кислых р-рах Am(VI) присутствует в виде иона
америцила AmО22+ . Ионы AmО22+ - сильные окислители. Под
действием излучения 241Аm происходит самовосстановление
Am(VI) до Am(V).
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
17
18. СРАВНИТЕЛЬНАЯ характеристика степени окисления +3 U, Np, Pu, Am
Устойчивость степени окисления +З возрастает в ряду уран —америций. Если уран и нептуний в этой степени окисления очень
неустойчивы (U (III) разлагается водой. Np (III) быстро окисляется
кислородом воздуха), то Рu (III) на воздухе заметно окисляется
только в щелочных растворах. Для америция эта степень
окисления является наиболее характерной.
Актиноиды в степени окисления +3 являются химическими аналогами
лантаноидов, но обладают более сильно выраженной
способностью к комплексообразованию. К труднорастворимым
соединениям этих элементов следует отнести гидроксиды,
фториды, иодаты, двойные сульфаты, оксалаты, фосфаты. В
качестве носителей для соосаждения микроколичеств элементов в
этой степени окисления могут быть использованы LaF3, KLa(SO4)2,
BiPO4 и др.
Склонность к комплексообразованию актиноидов в степени
окисления +3 изменяется в ряду: U < Np < Pu < Am.
Координационные числа актиноидов в этой степени окисления, как
и у лантаноидов, обычно равны 6 или 8.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
18
19. ТРАНСАМЕРИЦИЕВЫЕ актиноиды (ТАЭ)
Особенностью изучения химии ТАЭ является необходимостьиспользования методов радиохимии. Это обусловлено невозможностью
получения большинства указанных элементов в весомых количествах, а
также их чрезвычайно высокой массовой активностью.
Все элементы от кюрия до фермия получены в виде металлов. Основным
методом получения является восстановление их трифторидов щелочными
или щелочно-земельными металлами (или оксидов металлическим
лантаном) при высоких температурах. Данные по химическому поведению
этих элементов в металлическом состоянии относятся в основном к кюрию.
Он легко растворяется в разбавленных кислотах, взаимодействует с
водородом с образованием гидрида.
Оксиды состава МеО2 и Ме2О3 получены для кюрия, берклия и калифорния.
Оксиды являются исходными соединениями для синтеза галогенидов состава
МеГ3 и МеГ4 и оксигалогенидов общей формулы МеОxГу где 2х + у = 3 или
4. Оксиды и галогениды актиноидов тяжелее калифорния до настоящего
времени не получены.
Как и более легкие актиноиды, кюрий, берклий и калифорний способны
образовывать металлорганические соединения изоструктурные
соответствующим соединениям празеодима.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
19
20. СОСТОЯНИЕ и комплексообразование ТАЭ в водных растворах
В водных растворах для всех рассматриваемыхэлементов, за исключением No основной степенью
окисления является +3. (для No самой устойчивой
является с.о. +2). В c.о. +3 ТАЭ аналогично
лантаноидам, находятся (в отсутствие процессов
гидролиза и комплексообразования) в форме ионов
[Me(H2O)x]3+. Для лантаноидов число молекул
координационной воды колеблется в пределах 6—9.
В ряду Cm(III) — Es(III) степень гидратации
возрастает. Склонность к комплексообразованию у
рассматриваемых актиноидов в степени окисления
+3 больше, чем у соответствующих лантаноидов.
Устойчивость образующихся комплексов
возрастает с ростом порядкового номера
элемента.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
20
21. СТЕПЕНЬ окисления +4 ТАЭ
Кроме степени окисления +3, характерной для всех рассматриваемыхэлементов, кюрий, берклий и калифорний проявляют степень
окисления +4. По химическим свойствам все рассматриваемые
элементы в степени окисления +4, так же как и более легкие
актиноиды, аналогичны Th(IV) и Ce(IV). Устойчивость степени
окисления +4 для рассматриваемых элементов (за исключением
берклия) уменьшается с ростом порядкового номера элемента.
Аномальное поведение берклия обусловлено устойчивостью
наполовину заполненного электронного 5f'-подуровня в ионе Bk4+.
Кюрий и калифорний в этой степени окисления, аналогично америцию,
крайне неустойчивы. Для них известны оксиды МеО2 и фториды MeF4.
В водных растворах эти элементы в степени окисления +4 могут быть
получены действием очень сильных окислителей в виде фторидных,
фосфатных и фосфоро-вольфрамовых комплексов. Более легко
происходит окисление Bk(III) до Bk(IV), которое может быть
осуществлено в растворах минеральных кислот с помощью озона или
электрохимически. Все эти элементы в степени окисления +4 в водных
растворах восстанавливаются до степени окисления +3 под действием
продуктов радиолиза воды. Особенно быстро этот процесс протекает в
случае Cm(IV) и Cf(IV) (восстановление которых происходит также и в
результате взаимодействия с водой).
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
21
22. СТЕПЕНЬ окисления +2 ТАЭ
Существование степени окисления +2 в водных растворахдостоверно установлено для всех элементов от калифорния
до No. В ряду калифорний — No устойчивость степени
окисления +2 растет. Калифорний, эйнштейний и фермий в
степени окисления +2 были получены восстановлением Me(III)
металлическим магнием в спиртовых солянокислых растворах
и выделены изоморфным соосаждением с SmCl2. Менделевий
в степени окисления +2 может быть получен восстановлением
Me(III) более мягкими восстановителями, такими, как Eu(II),
Cr(II), V(II).
Актиноиды в степени окисления +2 являются химическими
аналогами лантаноидов в той же степени окисления, а также
щелочноземельных элементов: они изоморфно соосаждаются
с BaSO4, SmCl2 и др., легко образуют амальгамы. No с
радиусом иона, по своей величине расположенным между
радиусами ионов кальция и стронция, ведет себя при
экстракции, ионном обмене и процессах
комплексообразования подобно щелочно-земельным
элементам.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
22
23. СТЕПЕНЬ окисления +1 ТАЭ
Степень окисления +1 установлена только дляменделевия (первый элемент 2-ой сотни имеет
с.о. +1!). Md(I) может быть получен
восстановлением Md(III) в водно-спиртовых
растворах металлическим магнием. В этой
степени окисления менделевий изоморфно
соосаждается с соединениями тяжелых
щелочных металлов, например с CsCI, RbCl,
Rb2[PtCl6] и др. Однако, принимая во внимание
рассчитанное значение радиуса иона Md(I),
можно ожидать увеличения ковалентности
химической связи в его соединениях по
сравнению с соединениями щелочных металлов.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
23
24. МЕТОДЫ выделения ТАЭ (1)
Способы получения рассматриваемых элементоввынуждают выделять их из облученных мишеней
сложного элементного и изотопного состава
(элемент мишени, соседние актиноиды, продукты
реакций деления и реакций глубокого
отщепления).
При синтезе элементов бомбардировкой тяжелыми
ионами эта задача решается легче и быстрее,
чем при других способах синтеза. Применяя
достаточно тонкую мишень (толщиной не более
длины пробега), можно обеспечить почти полное
выбивание из нее ядер отдачи – метод атомов
отдачи. Атомы отдачи собираются на
движущейся металлической ленте или диске, а
также увлекаться к сборнику газовой струёй.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
24
25. МЕТОДЫ выделения ТАЭ (2)
Наиболее сложной задачей является отделение тяжелых актиноидов другот друга и от лантаноидов, используемых в качестве специфических
носителей. Трудность заключается в том, что (в отличие от легких
актиноидов) для рассматриваемых элементов характерна одна
степень окисления + 3, с чем связана большая близость в их
поведении при различных процессах, а отсюда следует необходимость
использования многостадийных циклов очистки. Особо трудными для
разделения являются пары америций — кюрий и калифорний —
эйнштейний.
Для отделения актиноидов друг от друга и от лантаноидов используются
процессы экстракции и ионного обмена. В качестве экстрагентов
используются фосфорорганические производные, амины,
хелатообразующие реагенты или их смеси.
Кроме экстракции для целей выделения и разделения ТАЭ используют
почти все известные варианты хроматографических методов: ионный
обмен, распределительная хроматография и разделение с
использованием неорганических сорбентов. Метод ионного обмена
сыграл важную роль при идентификации вновь открываемых тяжелых
актиноидов по заранее предсказанному положению пика на кривой
вымывания. Наиболее эффективно сочетание методов экстракции и
ионного обмена
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
25
26. ВЫМЫВАНИЕ трехвалентных ионов с катионита раствором α-оксиизобутирата аммония: а - лантаноидов, в - соответствующих им
ВЫМЫВАНИЕ трехвалентных ионов с катионита раствором αоксиизобутирата аммония: а - лантаноидов, в - соответствующих имгомологов в группе актиноидов.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
26
27. МЕТОДЫ определения ТАЭ
Наиболее чувствительным и надежным методомопределения трансамерициевых актиноидов
является радиометрический метод. Большинство
изотопов этих элементов: 242, 244Сm, 249, 250,251Cf,
253Es, 252, 254, 255Fm, 256Md, 255, 256 No и 256Lr могут
быть определены по их α-излучению.
Определение 244Cm, 252, 254Cf, 254, 256Fm
производится по нейтронам, испускаемым при
спонтанном делении, или по осколкам деления.
249Bk определяется по β-излучению после
тщательной очистки анализируемых препаратов.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
27
28. ПРИМЕНЕНИЕ ТАЭ
Практическое применение тяжелых актиноидов, так жекак и легких, обусловлено их ядерно-физическими
свойствами.
Изотопы 242, 244Cm используются для приготовления
изотопных источников тока.
252, 254Cf являются удобным материалом для
изготовления источников нейтронов с большой
интенсивностью потока (5мкг 252Cf эквивалентны 1 г
радия).
Изотопы 242Cm и 254Es находят применение для
изготовления α-источников. Изотопы 245Сm, 249, 251Cf,
так же как 242Аm, могут найти применение в качестве
ядерного топлива для малогабаритных реакторов.
СПбГТИ (ТУ) кафедра ИРРТ В.Прояев
28



























 Химия
Химия








