Похожие презентации:
Биологически активные высокомолекулярные вещества
1.
Кафедра биологической химии с курсами медицинской,фармакологической и токсикологической химии
Тема: Биологически активные
высокомолекулярные
вещества
Лекция №10 (обзорная) для студентов 1 курса, обучающихся по
специальности 310502 - Педиатрия
Автор: Оловянникова Раиса Яковлевна
(доцент кафедры биохимии с курсами
медицинской, фармацевтической и
токсикологической химии)
2017
2.
Цель лекции• Получить
представление
о
строении и самых важных
свойствах
полимеров
организма,
участвующих
в
процессах жизнедеятельности,
а
также
их
структурных
компонентов
2
3.
План лекции• Пептиды и белки, их
структурные компоненты
• Углеводы. Полисахариды и их
структурные компоненты
• Нуклеиновые кислоты и их
структурные компоненты
3
4.
Актуальность• Среди бесчисленного разнообразия
химических веществ, из которых
построены живые организмы, особое
положение занимают два типа
биологических полимеров – белки и
нуклеиновые кислоты (ДНК и РНК).
• ДНК является материальным
носителем информации, ответственным
за то, каким образом будут собираться
аминокислоты при биосинтезе белка.
4
5.
Актуальность(продолжение)
• РНК будет помогать ДНК
реализовывать информацию,
перемещая её в нужное место (из ядра
в цитозоль) и подвозя к этому месту
нужные аминокислоты в нужной
последовательности.
• Изучение нуклеиновых кислот и белков
продолжает оставаться одной из самых
горячих точек на переднем крае
современной науки.
5
6.
Актуальность• Энергетической сырьевой базой для
жизнедеятельности организма
являются углеводы и жиры.
• Но углеводы, входя в состав смешанных
биополимеров (гликопротеинов,
гликолипидов), обеспечивают также
процессы узнавания на разных уровнях:
молекула – молекула, молекула – клетка,
клетка – клетка.
6
7.
Актуальность(продолжение)
• В рамках процессов узнавания
работают свертывающая система
крови, система роста и
дифференцировки тканей, иммунная,
эндокринная и др. системы.
• Без углеводов (гетерополисахаридов)
не могла бы функционировать и
соединительная ткань
7
8.
Пептиды, белки• Это полимеры, мономером которых
являются аминокислоты, соединенные
пептидной связью
• Белковые аминокислоты – это α-АК, Lстереохимического ряда и на них есть код.
• Существует 20 белковых аминокислот.
H2N - CH - COOH
R
9.
Классификация АКПо R-группам
(классификация Ленинджера, рН ~7)
І. АК с неполярными гидрофобными Rгруппами
ІІ. АК с полярными гидрофильными Rгруппами
а) R-группы незаряжены
б) R-группы (-) заряжены
в) R-группы (+) заряжены
9
10.
І. АК с неполярными R-группами(R-гр. не содержат никаких ФГ) n=8
+
−
+
NH
–
СН
–
COO
3
NH3 – СН – COO −
СН
СН3
СН3
Н3С
Аланин (ала)
+
NH3 – СН – COO −
СН2
СН
Н3С СН3
Лейцин (лей)
Валин (вал)
+
NH3 – СН – COO −
СН СН3
СН2
Н3С Изолейцин (иле)
10
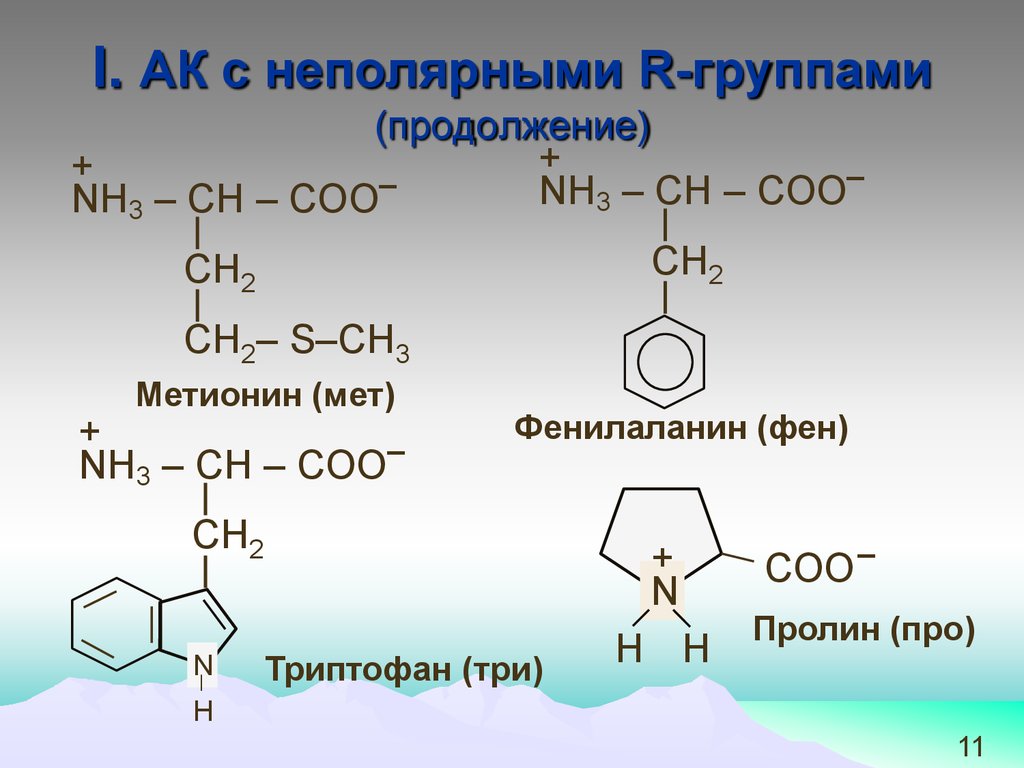
11.
І. АК с неполярными R-группами(продолжение)
+
+
−
−
NH
–
СН
–
COO
3
NH3 – СН – COO
СН2
СН2
СН2– S–CH3
Метионин (мет)
+
NH3 – СН – COO−
Фенилаланин (фен)
СН2
N
+
N
Триптофан (три)
H H
COO−
Пролин (про)
H
11
12.
І. АК с неполярными R-группами(продолжение)
+
+
−
−
NH
–
СН
–
COO
3
NH3 – СН – COO
СН2
СН2
СН2– S–CH3
Метионин (мет)
+
NH3 – СН – COO−
Фенилаланин (фен)
СН2
N
+
N
Триптофан (три)
H H
COO−
Пролин (про)
H
12
13.
ІІ. АК с полярными R-группами(R-гр. содержат определенные ФГ)
а) R-гр. незаряжены (есть –ОН, -SH, -СОNH2
обладающие слабыми кислотно-основными свойствами )
n=7
# сюда отнесен и глицин, у которого R-группа представлена
просто СН-кислотным центром.
+
NH3–СН–COO −
+
NH3–СН–COO −
Н
Глицин (гли)
СН2-ОН
Серин (сер)
+
NH3–СН–COO −
СН-ОН
СН3
Треонин (тре)
13
14.
+NH3–СН–COO −
+
NH3–СН–COO −
СН2
СН2-SН
Цистеин (цис)
О
+
NH3–СН–COO −
СН2
СН2
О
С
NH2
Аспарагин (асн)
+
NH3 – СН – COO−
СН2
С
NH2
Тирозин (тир)
Глутамин (глн)
ОН
14
15.
б) R-гр.(-) заряжены
(есть COOH, обладающая относительно большей
кислотностью) n=2
+
NH3–СН–COO −
NH3–СН–COO −
СН2
СН2
С −
О
О
СН2
Аспартат (асп)
+
С −
О
О
Глутамат (глу)
15
16.
в) R-гр. (+) заряжены(есть атом N со свободной электронной парой,
обусловливающей повышенную основность) n=3
+
+
NH3–СН–COO −
СН2
СН2
СН2
СН2
+ NH3
Лизин (лиз)
NH3–СН–COO −
СН2
СН2
+
NH3 – СН – COO−
СН2
СН2
NH
+
С NH2
NH2
H
N
N H
+
Гистидин (гис)
Аргинин (арг)
16
17.
Примечание• # В конце прошлого века была
обнаружена ещё одна белковая
кислота (21-я) – селеноцистеин (Seцис, Sec), отличающая от классического
цистеина наличием селена вместо серы.
Селенсодержащие белки:
Глутатионредуктаза,
тиоредоксинредуктаза
17
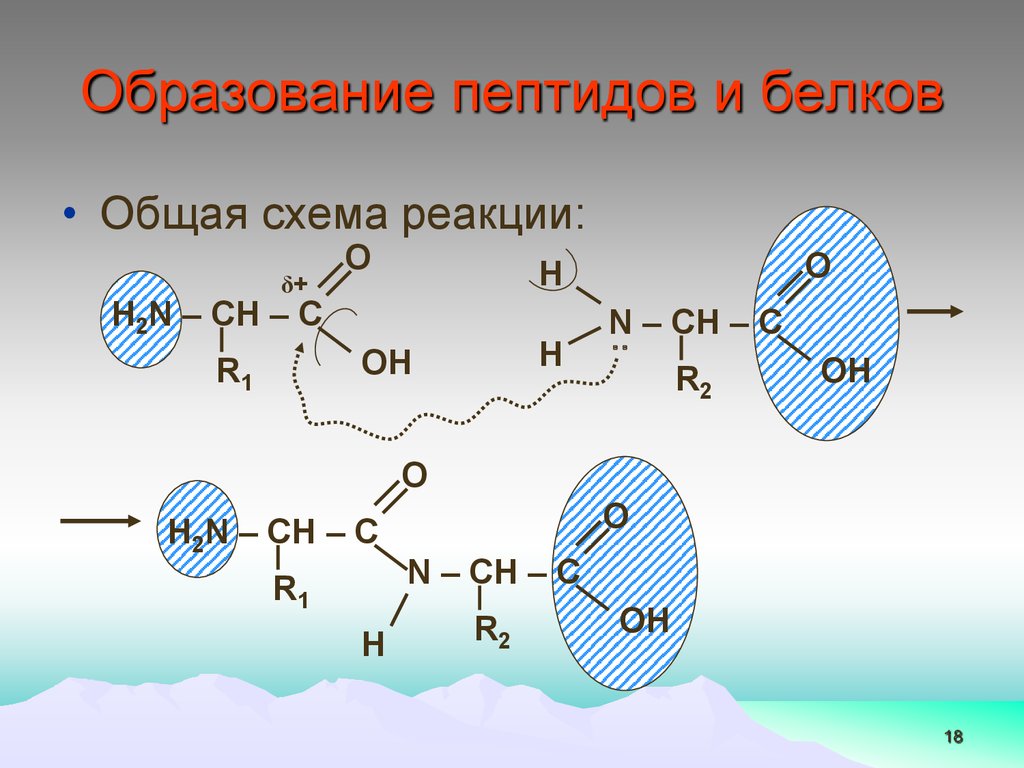
18.
Образование пептидов и белков• Общая схема реакции:
δ+
O
H2N – CH – C
H
OH
R1
O
H
N
‥ – CH – C
R2
OH
O
H2N – CH – C
R1
H
O
N – CH – C
R2
OH
18
19.
Строение пептидной группы• Мезомерное строение
С
О
С
..
N
О
+
N
H
H
Кето-форма
δ-
С
О
δ+
N
Внутримолекулярное
Кислотно - основное
взаимодействие
С
ОН
N
Енольная форма
(неустойчива в
кислой и
нейтральной
среде)
H
Т.о пептидная связь носит частично двойной
характер, а атомы кислорода и водорода находятся в
транс-конфигурации относительно плоскости π-связи
19
20.
Структура медного комплекса..
N
2..
N
C
O
C
N
..
O
O C
Cu
O
C
От синего
N
..
• Енольная форма
пептидной группы
устойчива в щелочной
среде и может давать
комплексы , например,
с катионами тяжелых
металлов.
• Енольную форму
пептидной группы
обнаруживает
биуретовая реакция,
которая проводится с
CuSO4 + NaOH
20
21.
До фиолетового21
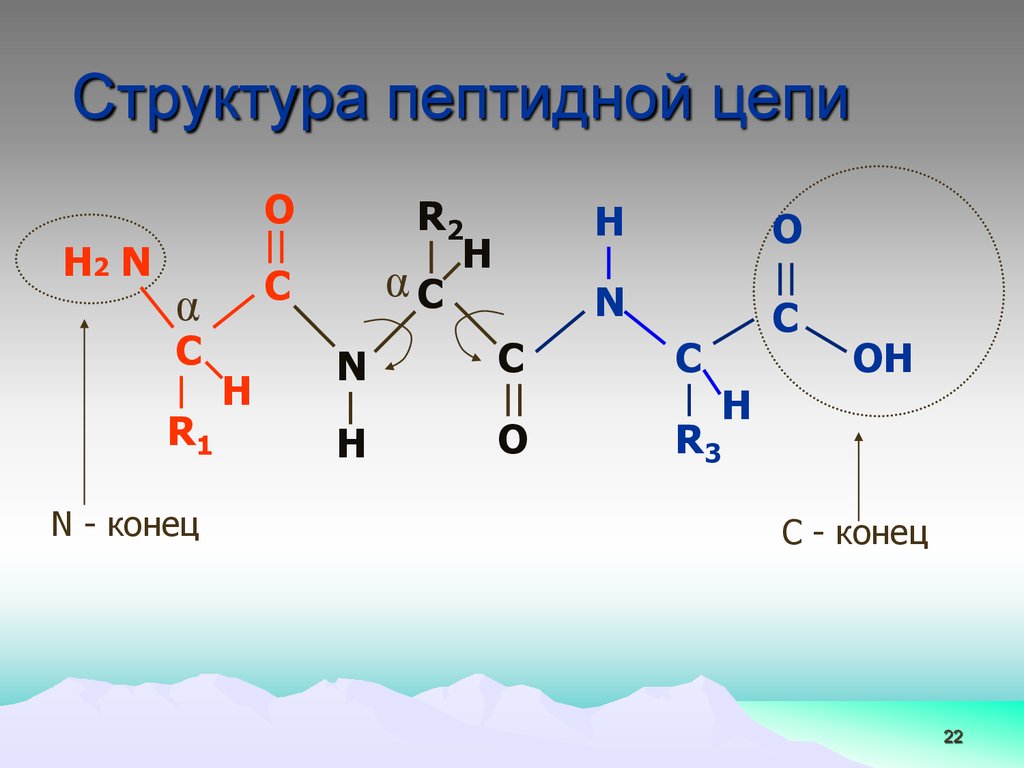
22.
Структура пептидной цепиO
H2 N
C
α
C
R1
N - конец
R2
H
αC
H
H
O
N
C
N
C
C
H
O
R3
H
OH
C - конец
22
23.
Классификация пептидовПептиды
Белки
Олигопептиды
2 – 10 АК
АДГ
- окситоцин
- либерины, статины
- нейропептиды
- кинины крови
- глутатион
- Гликопролины и
т.д.
> 50 АК.
М.м. > 5000
Полипептиды
10 – 50 АК
М.м. до 5000
-
-
Простые
АКТГ
- инсулин
гастрин
- СТГ
секретин
- АХЭ
глюкагон
и т. д.
факторы
роста и т. д.
-
Сложные
Гликопротеины
Нуклеопротеины
Липопротеины
Фосфопротеины
Гемпротеины
Металлопротеины
24.
Роль пептидов в организме• Межклеточные регуляторы (см.
классификацию)
• Участвуют в окислительновосстановительных) реакциях
(глутатион)
• Осуществляют транспорт аминокислот
+
через
стенку
кишечника
(γ-глутамильный
+
цикл с участием глутатиона)
24
25.
Роль пептидов в организме• Поддержание рН мышечных клеток
(ансерин и карнозин)
• Антибиотики с различным
механизмом действия
- каналообразователи (грамицидин А для
переноса Na+ и K+ через мембраны)
- ионофоры (валиномицин для переноса К+)
- связываются с ДНК → изменение генома
→ нарушение синтеза белка
25
26.
Роль пептидов в организме(продолжение)
• Пептиды – яды, токсины змей, рыб,
скорпионов, пчел, грибов
• Пептиды обладают вкусовыми
качествами (горькие, сладкие, есть
слаще сахара в несколько раз)
• Особая регуляторная активность
обнаружена в семействе
глипролинов (состоящие из гли и про)
26
27.
Роль глипролинов• Оказывают антитромбическое
действие и препятствуют
светыванию крови
• Защищают слизистую желудка от
разнообразных ульцерогенных
воздействий, включающих
практически все модели
язвообразования
27
28.
Роль глипролинов(продолжение)
• Воздействуют на ЦНС (циклический
про-гли обладает значительным
стимулирующим действием на
консолидацию памяти)
• Стабилизируют различные пептиды,
принадлежащие к другим семействам
(например, АКТГ, гонадолиберин,
энтеростатин и др.)
28
29.
Роль глипролинов(продолжение)
Стабилизирующее действие
глипролинов важно при создании
лечебных пептидов:
- препарат семакс – это гибрид АКТГ и
про-гли-про, позволяющий реализовать
ноотропные (стимулирующие
мыслительную деятельнсть) и
нейропротекторные (защищающие
нейроны) свойства кортикотропина.
29
30.
• Семакс обладает такжепротивовоспалительным действием,
влияя на активность нейтрофилов.
• Препарат селанг получен путем
«пришивания» про-гли-про к Сконцу тафцина (стимулятору
фагоцитоза и умеренному анксиолитику)
и является перспективным
анксиолитиком (снимающим
тревожное состояние).
30
31.
Структурная организациябелковой молекулы
• Первичная структура
• Вторичная структура
• Третичная структура
• Четвертичная структура
31
32.
Первичная структура• Это последовательность
(порядок чередования)
аминокислот в полипептидной
цепи
• Связи, стабилизирующие эту
структуру – пептидные
• Форма – зигзагообразная цепь
32
33.
Вторичная структура• Это регулярное (закономерное)
расположение полипептидной
цепи в пространстве
• Связи, стабилизирующие эту
структуру – водородные между
пептидными группами
• Форма: α-спираль или β-складчатый
лист или спираль коллагена
33
34.
Третичная структура• Это дальнейший специфический
способ укладки полипептидной цепи в
пространстве
• Связи, стабилизирующие эту структуру
– водородные между боковыми R-группами
аминокислот (это отличает третичную структуру от
вторичной)
– Ионные
– Гидрофобные взаимодействия
– Дисульфидные (наиболее прочные)
• Форма – клубок (глобула) или нить
(фибрилла).
34
35.
Еще одно понятие• Супервторичная структура
– определенный регулярно
повторяющийся структурный
мотив (структурный модуль)
ПП-цепи.
35
36.
Конформация• Конформация – это форма
молекулы, определяемая
ее вторичной и третичной
структурой.
•Не является жесткой и
зависит от наличия
кофакторов в окруж. среде.
36
37.
ДоменВ третичной структуре больших
белков (>200 АК) выделяют такие
компактные упаковки как домены (или
белковые модули).
Домен – фрагмент ПП-цепи, сходный
по своим свойствам с самостоятельным
глобулярным белком.
Домен автономен, но вместе с другими
доменами в данном белке нацелен на
37
38.
выполнение одной задачи.• Так, благодаря доменной структуре
фермент синтаза жирных кислот у
млекопитающих катализирует 7
последовательных реакций. Тогда как
у бактерий для этого нужно 7
отдельных ферментов.
• В молекулах дегидрогеназ есть два
домена один из которых связывает
38
39.
• НАД+ и сходен по строению у всехферментов этого семейства, тогда как
другой связывает окисляемые субстраты
АН2 и отличается по структуре у разных
дегидрогеназ. Вместе они катализируют
одну реакцию:
АН2 + НАД+ → А + НАДН + Н+
• Доменная структура белкам присуща и
антителам
39
40.
Строение различных белкова)
б)
в)
г)
а) миоглобин (в центре
расположен гем)
б) стафилококковая
нуклеаза
в)
триозофосфатизомераза
(под ней показано
расположение в цепи α
спиралей и β-складчатых
листов)
г)
пируваткиназа
Элементы вторичной
структуры: β-складчатые
слои показаны в виде стрелок;
α-спирали – в виде цилиндров
или скрученных лент;
соединительные петли – в
виде простых линий
40
41.
Супервторичная структуратипа β-бочонка
а) триозофосфат
изомераза;
б) домен
пируваткиназы
а
б
41
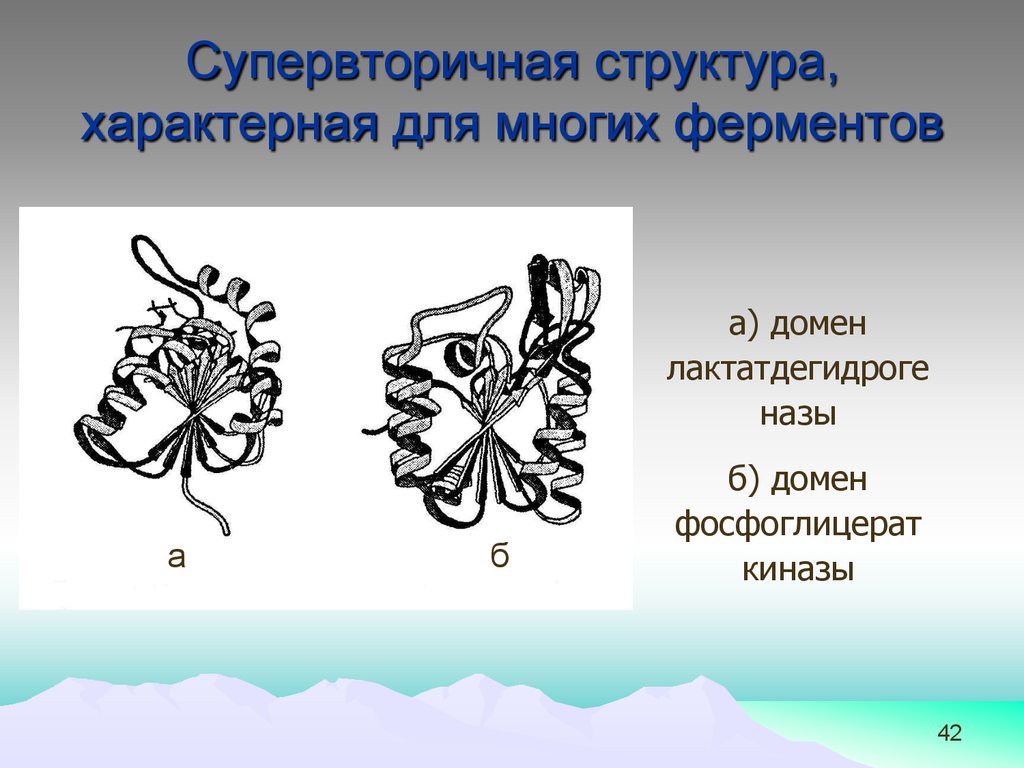
42.
Супервторичная структура,характерная для многих ферментов
а) домен
лактатдегидроге
назы
а
б
б) домен
фосфоглицерат
киназы
42
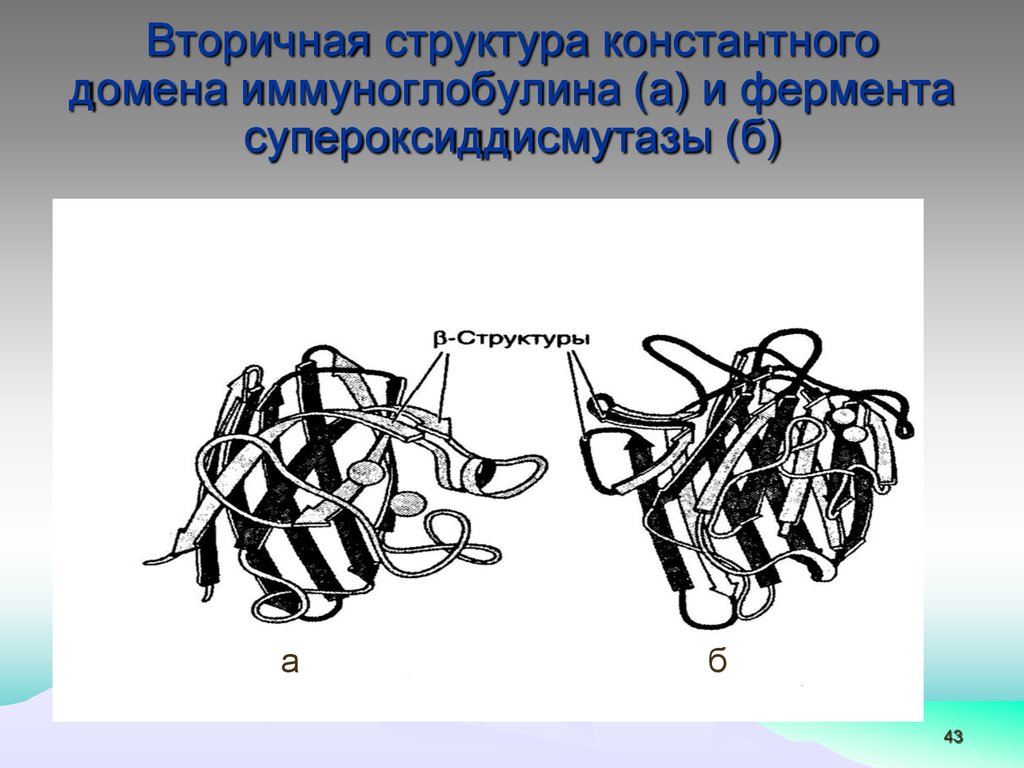
43.
Вторичная структура константногодомена иммуноглобулина (а) и фермента
супероксиддисмутазы (б)
а
б
43
44.
• Супервторичнаяструктура ДНКсвязывающих белков
«α-спираль –
поворот – αспираль»
в большой
бороздке ДНК
44
45.
Связывание димера ДНКсвязывающего белка с молекулойДНК в 2 смежных областях
45
46.
Структура участкаДНК-связывающих
белков в форме
«цинкового пальца»
Лейциновая
«застежка-молния»
(между α-спиральными участками
двух белков)
46
47.
Четвертичная структура• Некоторые белки собираются в
олигомерный комплекс из нескольких
субъединиц (протомеров) с помощью
нековалентных связей.
• Пространственное расположение
субъединиц в олигомерном белке – это
и есть 4-ая структура.
47
48.
Четвертичная структура• Субъединичная (или
четвертичная) структура очень
важна для аллостерической
регуляции ферментов, а также
регуляции экспрессии генов.
48
49.
Физико-химические свойствабелков
• Набухаемость (ограниченная и
неограниченная)
• Растворимость в воде (касается только тех
белков, у которых на поверхность
выступают гидрофильные группы)
• Осаждаемость (или коагуляция)
• Электрофоретическая подвижность
• Буферное действие
• Лиофилизация
• Изоэлектрическая точка
49
50.
Осаждение белков–
• Высаливание – • Денатурация
разрушение всех
осаждение без
структур белка, кроме
нарушения структуры
первичной.
белка: путём отнятия • Денатурирующие
гидратной оболочки и факторы:
нейтрализации заряда - высокие температуры
на поверхности с
- УФ и ионизирующее
излучение
помощью солей
- встряска
щелочных и
щелочно-земельных - кислоты и щелочи
- соли тяжелых металлов
металлов, а также
- спирт, ацетон при
сернокислого
длительном воздействии
аммония
50
51.
Изоэлектрическая точка• Значение рН среды, при котором
суммарный заряд на поверхности белка
равен нулю, называется
изоэлектрической точкой - pI
• При рН < pI , молекула белка будет
заряжена положительно
• При рН > pI, заряд молекулы белка
будет отрицателен
51
52.
Химические свойства белков• Белки также, как и аминокислоты можно
♦ фосфорилировать,
♦ ацетилировать
♦ ацилировать
♦ гликозилировать
♦ комплексировать с катионами металлов и
т.д.
• Реакции гидролиза
• Цветные реакции (биуретовыя,
нингидриновая, ксантопротеиновая,
нитропруссидная и др.)
52
53.
Роль белков в организме• Ферментативная
• Рецепторная (рецепторы для
гормонов и факторов роста)
• Регуляторная
• Структурно-образовательная
(построении мембран клеток и
межклеточного матрикса)
53
54.
Роль белков в организме• Опорная (коллаген и
неколлагеновые фосфопротеины
служат матрицами для
минерализации кости)
• Защитная (участие в иммунных
реакциях, в свертывании крови)
• Энергетическая
54
55.
Углеводы• Это полигидроксикарбонильные
соединения и их производные
(аминосахара, дезоксисахара,
сахарные кислоты, а также
продукты их конденсации –
олиго- и полисахариды)
55
56.
Классификация углеводовУглеводы
Моносахариды
Олигосахариды
По оксо-группе
Альдозы
Простые
Кетозы
Сложные
Полисахариды
Гомополисахариды
По числу атомов углерода в цепи
Триозы
Пентозы Гексозы
Тетрозы
Гетерополисахариды
56
57.
Кольчато-цепная таутомериямоносахаридов (КЦТ)
Кольчатые формы преобладают
6
Н
δ-
1
δ+С
Н
НО
Н
Н
Н
О
2
ОН
3
Н
4
ОН
‥
5
О-Нδ+
6СН ОН
2
4
5
О ОН
ОН Н 1 *
3
2
Н
НО
Н ОН
6 СН ОН
2
Н
О Н
5
D-Глюкоза
НО
* Аномерный центр
СН2ОН
4 ОН Н 1
3
2
Н
*
β-глюкоза
α -глюкоза
ОН
ОН
57
58.
Правило перехода от проекций отпроекций Фишера к проекциям Хеуорса
58
59.
Олигосахариды (ОС)• По числу МС звеньев ОС делятся:
- дисахариды
- трисахариды
- тетрасахариды
- пентасахариды
Олигосахариды
женского молока
• По составу и функциям ОС бывают:
- простые (состоят только из МС)
- сложные, или смешанные (кроме МС могут
содержать пептиды, белки, липиды)
59
60.
Дисахариды• Редуцирующие (восстанавливающие)
– содержат свободный гликозидный
(полуацетальный) гидроксил.
Раскрывают один цикл и окисляются.
• Нередуцирующие
(невосстанавливающие) – нет
свободного гликозидного
гидроксила.
Не раскрывают своих циклов и не
окисляются
60
61.
Редуцирующие дисахариды• Мальтоза (солодовый сахар) – состоит
из двух глюкоз, соединенных α-1,4
гликозидными связями.
СН2ОН
СН2ОН
О
О
ОН
НО
1
О
ОН
α-1,4
4ОН
ОН
Свободный
гликозидный
гидроксил
ОН
α -глюкозидоглюкоза
61
62.
Редуцирующие дисахариды• Целлобиоза (структурный фрагмент
целлюлозы) - состоит из двух глюкоз,
соединенных β-1,4 гликозидными связями.
СН2ОН
β-1,4
СН2ОН
О
О
ОН
НО
4
1
О
ОН
ОН
ОН
Свободный
гликозидный
гидроксил
ОН
β-глюкозидоглюкоза
62
63.
Редуцирующие дисахариды• Лактоза – молочный сахар – состоит из
галактозы и глюкозы, соединенных
β-1,4- гликозидными связями.
СН2ОН
β-1,4
СН2ОН
О ОН
О
НО
ОН
4
1
О
ОН
ОН
Свободный
гликозидный
гидроксил
ОН
β-галактозидоглюкоза
63
64.
Нередуцирующие дисахариды(сахароза)
• Сахароза –
пищевой, или
тростниковый, или
свекловичный сахар.
Состоит из глюкозы и
фруктозы,
соединенных
α-1,β-2гликозидными
связями.
# Нет свободного
гликозидного
гидроксила
СН2ОН
О
ОН
НО
НО–Н2С
НО
1
О
α-1, β-2
О
НО
2
СН2ОН
ОН
α-глюкозидо-β-фруктозид
64
65.
Другой подход к классификацииолигосахаридов (2-20 МС)
Олигосахариды
Простые
Состоят только
из У-компонентов
- дисахариды
- трисахариды
и т.д.
Энергетическая
По составу и
функциям
состав
Сложные
Смешаны с другими
компонентами: Б, Л, т.е.
входят в состав
гликопротеинов и
гликолипидов
функция
Информативная
65
66.
Гликопротеины и гликолипиды широкораспространены в организме
1) Они находятся на внешней поверхности
всех клеток (в том числе эритроцитов, лейкоцитов
и тромбоцитов) и выстилают внутреннюю
поверхность трубочек, каналов, цистерн
(цитоскелет).
– Это рецепторы мембран, ферменты,
структурные и транспортные белки,
групповые вещества крови,
обусловливающие иммунные свойства
(антигенную специфичность)
66
67.
Гликопротеины и гликолипиды широкораспространены в организме
2) Они растворены в плазме крови.
– Это компоненты свертывающей
системы крови, все транспортные
белки (кроме альбуминов), некоторые
гормоны, ферменты,
иммуноглобулины (антитела),
интерферон (противовирусный и
противоопухолевый белок).
3) Они растворены в других
биологических жидкостях: в слезах
(лизоцим), в слюне (амилаза и другие
ферменты, муцины)
67
68.
Гликопротеины и н гликолипидышироко распространены в организме
4) Они находятся в слизистых
секретах ЖКТ, бронхов,
мочеполовой системы.
– Это муцины, внутренний фактор Касла
и др.
5) Они находятся в матриксе
соединительной ткани (коллаген и
неколлагеновые белки костей и зубов,
служащие матрицами для минерализации
твердых тканей)
6) Это РНК вирусы.
68
69.
Структура ОС- цепей гликопротеинови гликолипидов
• У-цепи ГП и ГЛ содержат до 20-25 МСзвеньев
– Разветвленные (на концах или в начале)
– Нерегулярно построены (нет закономерности в
построении)
– На концах обычно сиаловые кислоты или Lфукоза (6-дезокси-L-галактоза)
– Внутри цепи – гексозамины, Nацетилгексозамины, манноза, галактоза
• Связи с белком или керамидом – О- или Nгликозидные.
69
70.
Функции ОС-цепейРазнообразие МС-звеньев и способ
связывания между ними создают
предпосылки для выполнения
информативной функции – участие
в процессах узнавания
– ОС обеспечивают:
Адгезию (слипание) клеток и контактное
торможение (расхождение) клеток в
процессе роста и дифференцировки
тканей во время морфо- и гистогенеза.
70
71.
Участие ОС-цепей в процессахузнавания
Агрегацию и дезагрегацию
тромбоцитов во время свертывания
крови
Приживление или отторжение
трансплантата после пересадки
органов и тканей.
Направленный транспорт различных
молекул, клеток в органы или
внутриклеточные органеллы.
71
72.
Участие ОС-цепей в процессахузнавания
Заключительный этап
посттрансляционного синтеза ГП и
ГЛ на мембранах ЭПС и их
дальнейщую сортировку в
клеточные органеллы или на
«экспорт» (в кровь).
Взаимодействие антитело-антиген
Взаимодействие фермент–субстрат,
рецептор–гормон
72
73.
Структурно-образовательнаяфункция ОС-цепей
• Формирование цитоскелета,
поддержание формы клеток и контроля
за ней (после деления или экзоцитоза)
• Поддержание ассиметрии клеточных
мембран
– Благодаря ОС-цепям мембранные белки
на внешней поверности не могут
вращаться и перемещаться на внутреннюю
поверхность
73
74.
Структурно-образовательнаяфункция ОС-цепей
• Поддержание вторичной и
третичной структуры белковой
молекулы.
– Например, муцины, благодаря
сиаловым кислотам ОС-цепей
находятся в расправленном
состоянии, обеспечивают вязкость (и
тем самым, защиту от чужеродных
веществ, микробов или смазку
трущихся поверхностей).
74
75.
Защитная функция ОС-цепейСоздание гидрофильной
поверхности клеток, что защищает
клетки от фагоцитоза специфическими
нейтрофилами
Создание смазки на трущихся
поверхностях ЖКТ, бронхов,
мочеполовых путей.
Развитие иммунных реакций против
чужеродного (антитела, антигены тканевой
специфичности, интерферон).
75
76.
Защищают белки от термического ихимического повреждения, в том числе,
ферментативного
– Защищают внутренний белковый фактор Касла
в желудке от разрушения пепсином
– Защищают различные протеазы (трипсин,
химотрипсин, карбоксипептидаза) друг от
друга и позволяют им работать в кишечнике
содружественно.
Связывают (комплексируют) ионы Ca2+ и
др., дающие труднорастворимые соли с
фосфатами, оксалатами и, тем самым,
препятствуют выпадению осадков в
биологических жидкостях.
76
77.
Гомополисахариды• Крахмал – синтезируется в
растениях
• Целлюлоза (клетчатка) – тоже
• Гликоген – синтезируется в печени
и мышцах, а также в других тканях
• Декстраны – бактериального
происхождения или синтетические
77
78.
Гомополисахариды• Фруктаны, маннаны – тоже
• Пектиновые вещества – пищевые
волокна фруктов, овощей
• Хитин – роговые оболочки
насекомых, ракообразных, в
некоторых грибах
78
79.
Крахмал• Две фракции:
– Растворимая амилоза (20 %)
– Нерастворимый амилопектин (80 %)
• Амилоза – линейный гомополисахарид,
построенный из D-глюкозы, соединенной
α-1,4 гликозидными связями (как в
мальтозе).
Вторичная структура – спираль.
• Амилопектин – разветвленный гомогликан,
состоит из D-глюкозы, соединенной α-1,4 и
α-1,6 гликозидными связями
79
80.
Амилопектин (фрагмент)СН2ОН
СН2ОН
О
О
ОН
О
4
1
О
ОН
ОН
α-1,4
О
ОН
СН2ОН
СН2О
О
О
О
1
α-1,6
ОН
СН2ОН
ОН
Точка ветвления
(через 20 -25 МС-звеньев)
ОН
О
α-1,4
4
1
О
ОН
ОН
ОН
α-1,4
80
81.
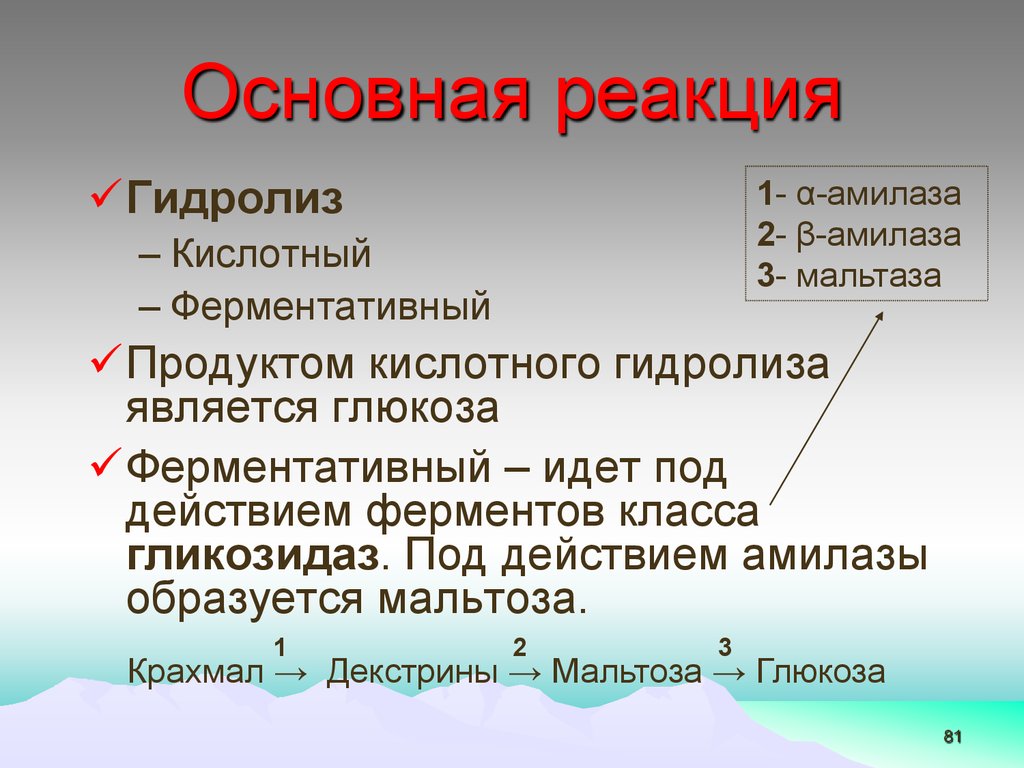
Основная реакцияГидролиз
1- α-амилаза
2- β-амилаза
3- мальтаза
– Кислотный
– Ферментативный
Продуктом кислотного гидролиза
является глюкоза
Ферментативный – идет под
действием ферментов класса
гликозидаз. Под действием амилазы
образуется мальтоза.
1
2
3
Крахмал → Декстрины → Мальтоза → Глюкоза
81
82.
Гликоген• По строению похож на амилопектин.
Однако, α-1,6-гликозидные связи
встречаются чаще (через 3–5 МСзвеньев) и поэтому молекула имеет еще
большую молекулярную массу.
• В организме гликоген выполняет роль
резервного источника энергии.
Основной процесс расщепления –
фосфоролиз под действием
фосфорилаз
82
83.
Декстраны• Полимеры из глюкозы с основным
типом связи α-1,6-гликозидной, но
есть и α-1,2; α-1,3 и др. связи в очень
незначительном количестве.
• Декстран – это α-1,6-гликозид с
небольшим числом разветвлений,
присоединенных к основной цепи α1,2-, α-1,3- и α-1,4-гликозидными
связями
83
84.
Декстраны• Это компоненты зубного налета,
создающие кариесогенную ситуацию
(благодаря метаболизму до глюкозы, а
затем и орг. кислот: лактата, пирувата).
• Молекулярная масса нативных декстранов
разнообразна (105 – 108)
• «Клинический» декстран получают
частичным кислотным гидролизом с
последующим фракционированием
высокомолекулярного нативного
декстрана.
84
85.
Декстраны• Под названием «полиглюкин» с
М=60±10 тыс. и «реополиглюкин» с
М=35±5 тыс. клинический декстран
широко используют в качестве
противошокового
кровезаменителя при агрегации
форменных элементов крови и
нарушении микроциркуляции.
85
86.
Декстраны• Содержание α-1,6-связей в
отечественном декстране не меньше
93 % (остальное приходится на долю
α-1,4 и α-1,2-связей, а α-1,3 связи
отсутствуют).
• Повышение степени разветвленности
вызывает рост иммуногенности.
• Высокомолекулярный декстран
(М>200 тыс.) токсичен.
86
87.
Целлюлоза• Линейный гомополисахарид,
построен из глюкозы,
соединенной β-1,4
гликозидными связями
• Конформация углеводной цепи
обусловливает параллельную укладку
нескольких молекул и скручивание в
прочные жгуты, обладающие
механической и химической
устойчивостью
87
88.
Целлюлоза• С большим трудом подвергается
гидролизу
• Назначение – опорно-механический
материал у растений.
• Не расщепляется обычными
ферментами ЖКТ (амилазой,
мальтазой, которые могут
гидролизовать только α-1,4-связи)
88
89.
• Однако, для жвачных животных, укоторых в желудке есть специальные
ферменты (целлюлаза и
целлобиаза), гидролизующие
целлюлозу до глюкозы, этот
полисахарид имеет энергетическое
значение.
• У человека целлюлоза не
переваривается (из-за отсутствия этих
ферментов) и долгое время считалась
бесполезной.
89
90.
Значение целлюлозы• К настоящему времени известно, что
целлюлоза и другие пищевые
волокна овощей, фруктов
выполняют важные функции в
организме:
– Усиливают перистальтику кишечника
– Снижают уровень холестерина в
организме (путем адсорбции его в
кишечнике)
– Повышают аппетит.
90
91.
Пектиновые вещества. Хитин• Это полигалактуроновые кислоты с α-1,4
гликозидными связями и с теми же
функциями, что и у целлюлозы
• Широкое применение в медицине находит
сейчас хитин (N-ацетил-D-глюкозамин с β1,4-связями). У животных и грибов он
выполняет опорно-механические
функции.
• Деацетилированные производные хитина
– хитозаны – используются в медицине.
91
92.
Гетерополисахариды(гликозаминогликаны, мукополисахариды)
• Гиалуроновая кислота – вырабатывается
фибробластами соединительной ткани и
является основным органическим
компонентом межклеточного матрикса.
• Хондроитинсульфаты (ХИСы) –
вырабатываются там же, но их больше в
твердой ткани (хрящах, костях, зубах).
• Гепарин – вырабатывается тучными
клетками печени, легких, сосудов.
92
93.
Общее в структуре и функциях• Гиалуроновая кислота и
хондроитинсульфаты
состоят из многократно
повторяющихся дисахаридных
звеньев: глюкуроновой
кислоты и аминосахара,
ацетилированного по атому
азота.
93
94.
Общее в структуре и функциях• Полимерная цепь неразветвленная
• Регулярность структуры делает их
непригодными для выполнения
информативной функции.
Действительно, ГК и ХИСы
структурируют соединительную
ткань и выполняют опорномеханические функции (подобно
целлюлозе, но только у животных и грибов).
94
95.
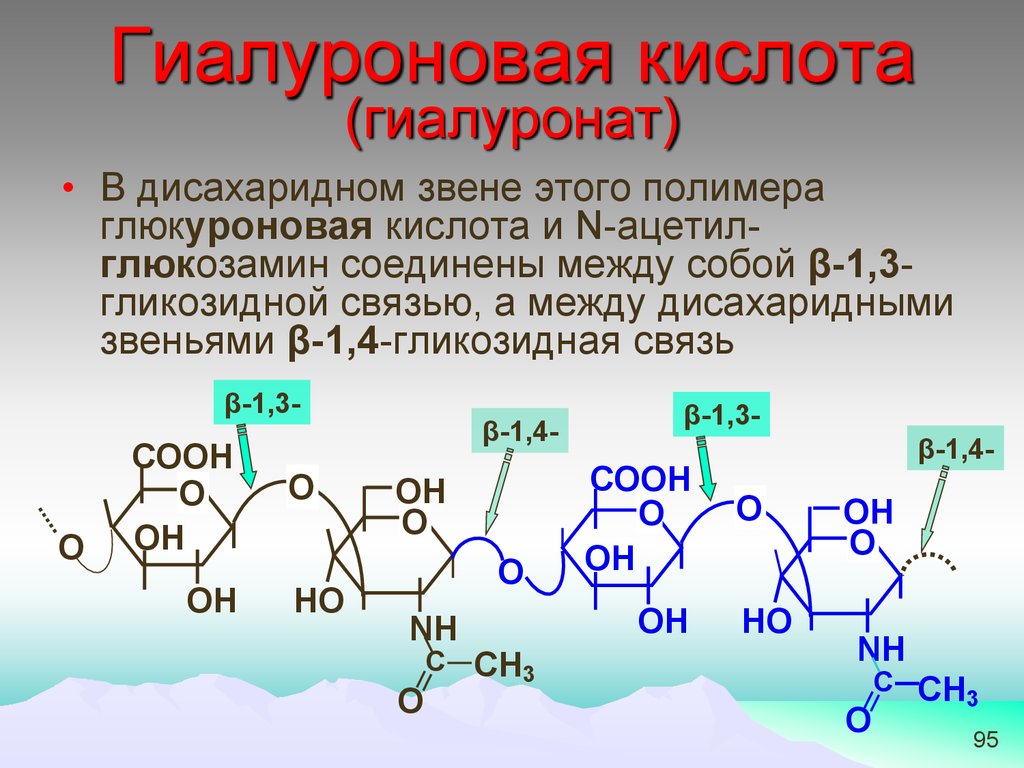
Гиалуроновая кислота(гиалуронат)
• В дисахаридном звене этого полимера
глюкуроновая кислота и N-ацетилглюкозамин соединены между собой β-1,3гликозидной связью, а между дисахаридными
звеньями β-1,4-гликозидная связь
β-1,3-
О
СООН
О
ОН
ОН
О
НО
β-1,4-
ОН
О
О
NH
О
C CH3
β-1,3-
СООН
О
ОН
ОН
β-1,4-
О
НО
ОН
О
NH
О
C CH
3
95
96.
ХондроитинсульфатыДисахаридное звено этого полимера
отличается аминосахаром: ХИСы содержат Nацетил-галактозамин, сульфатированный по
гидроксилу у С6 или у С4. Набор связей тот же.
О
СООН
О
ОН 1
ОН
Здесь SO3Н
О
НО
6
ОН
О
3
1
О
NH
C CH3
О
4
Здесь SO3Н
СООН
О
ОН 1
ОН
О
НО
6
ОН
О
3
NH
C CH3
О
96
97.
Свойства и рольгиалуроновой кислоты
Гиалуроновая кислота обладает
самой высокой молекулярной
массой и как самый большой
гидрофильный полимер, хорошо
связывает воду, образуя вязкие
растворы и упругие гели. Поэтому
гиалуронат является:
– Биологическим депо воды
– Биологическим фильтром
– Биологическим клеем, цементом,
– Биологической смазкой
97
98.
Не случайно гиалуроновая кислотаприсутствует на всех трущихся
поверхностях и в синовиальной
жидкости, стекловидном теле глаза,
оболочки яйцеклетки.
Вместе с ХИСами гиалуроновая
кислота также находится в коже,
сухожилиях, связках, клапанах
сердца, аорте, трахее,
межпозвоночных дисках, хрящах и
др.тканях.
98
99.
Свойства и роль ГК и ХИСовБлаголаря множеству карбоксильных групп
гиалуронат и ХИСы являются полианионами
Как полианионы, они выполняют роль
биологических рессор и биологических опор.
Так, в хрящах гиалуроновая кислота
электростатически комплексируется с
белками, к которым ковалентно (О- и Nгликозидными связями) «пришиты» ХИСы, и
образуются протеогликановые агрегаты
(структура «ерша»)
99
100.
Протеогликановые агрегаты- Гиалуроновая
кислота
- Белковый кор
- ХИСы
ЭС
ЭС
ЭС
ЭС
ЭС
ЭС
ЭС – электростатическая связь
100
101.
Роль биологических рессорПод действием удара
протеогликановый агрегат
сначала сжимается, но (-)
заряженные цепи ХИСов,
отталкиваясь друг от друга,
расправляют его снова.
101
102.
Роль биологических опорЭта роль заключается в том, что как
полианион гиалуроновая кислота
связывает не только белковые коры в
хрящах, но и коллаген соединительной
ткани, поддерживая его в
расправленном состоянии,
необходимом для минерализации
твердых тканей.
102
103.
Роль ХИСовПомимо амортизационной функции
ХИСы, будучи более сильными
полианионами по сравнению с
гиалуроновой кислотой, хорошо
связывают катионы металлов Ca2+, Na+
и являются депо этих катионов в хрящах,
костях и зубах. Из этих депо Cа2+ идет на
минерализацию твердых тканей.
Минерализуясь, ткани приобретают
гидрофобный характер и теряют воду.
103
104.
Есть данные, что ХИСы участвуют вфильтрации (+) заряженных частиц
(+NH4) через мембраны почечных
клубочков из крови в первичную
мочу.
Имеются также данные, что
гиалуроновая кислота в значительной
степени деполимеризована в
синовиальной жидкости суставов при
ревматизме или артрите. Не это ли
вызывает боль суставов?
104
105.
ГепаринИмеет менее регулярную структуру У-цепей,
чем гиалуроновая кислота и ХИСы.
Молекула состоит из многократно
чередующихся звеньев, в состав которых
входят:
D-глюкуроновая кислота
L-идуроновая кислота, сульфатированная по 2-ОН
Глюкозамин, сульфатированный по 6-ОН и по N-,
если стоит после идуроновой кислоты
Если аминосахар стоит после глюкуроновой
кислоты, то он ацетилирован.
105
106.
Функции гепаринаОсновной тип связи: α-1,4 и β-1,4-гликозидная
Таким образом, в структуре гепарина больше
разнообразия, чем в структуре других
гликозаминогликанов. Поэтому и функции
гепарина более специфические.
Ему не принадлежит опорно-механическая
роль
Его деятельность связана с процессами
узнавания.
106
107.
Функции гепаринаГепарин вырабатывается тучными
клетками печени, легких, сосудистой
стенки, матки, в органах ЖКТ, молочной
железе, миндалинах.
Он обнаруживается на поверхности
многих клеток, в крови, в лимфе, а
также внутри тучных клеток, где
связывает гистамин.
107
108.
Гепарин специфически инеспецифически сорбируется на
поверхности клеток эндотелия,
лимфоцитов (Т и В), тучных
клеток
Придавая (-) заряд, он защищает
эти клетки от фагоцитоза,
препятствует их агрегации,
снижает вязкость крови.
108
109.
Нет агрегации тромбоцитов – нетсвертывания крови (антикоагулирующее
действие)
Нет агрегации Т и В-лимфоцитов – не
освобождаются в кровь иммуноглобулины
(антитела) – не развиваются иммунные
реакции в ответ на аллерген
(противоаллергическое действие)
Нет агрегации тучных клеток – не
освобождается из них гистамин, вызывающий
аллергию (опять противоаллергическое
действие)
109
110.
# Более того, гепарин связываетмногие биогенные амины в тучных
клетках (гистамин, серотонин,
катехоламины, участвующие в
сокращении сосудов и оттягчающие
атеросклероз), компоненты
комплемента, участвующие в
аллергических реакциях
(противоаллергическое действие)
110
111.
Нет агрегации эндотелиальных клеток –не освобождается фактор,
стимулирующий деление
гладкомышечных клеток – нет
атеросклероза
противоатеросклеротическое действие)
Связываясь со своими гепаритиновыми
рецепторами на поверхности
эндотелия, гепарин освобождает из
них липопротеидлипазу,
разрушающую жиры во фракции
хиломикронов и ЛОНП
111
112.
и тем самым способствует переходукомпонентов жира в ткани (усвоению
жира организмом)
Благодаря такому антилипемическому
действию, гепарин разгружает кровь от
липидов и обладает
противоатеросклеротическим действием
Кроме того, гепарин снижает вязкость
крови – и это тоже
антиатеросклеротический параметр
112
113.
• В присутствии гепарина гиалуроноваякислота не разрушается, что необходимо
для целостности структуры
соединительной ткани.
• Таким образом, с медицинской точки
зрения важно, что гепарин обладает:
–
–
–
–
–
Антикоагулирующим
Антилиполитичесим
Противоаллергическим
Противоатеросклеротическим действием
И поддерживает целостность
соединительной ткани
113
114.
Нуклеиновые кислоты• Это полимеры, мономером
которых являются
мононуклеотиды (точнее
нуклеозидмонофосфаты),
соединенные
3ꞌ,5ꞌ- фосфорно-эфирными
связями.
114
115.
Нуклеозиды• Это β-N-гликозиды, у которых в
качестве сахарной части выступает
пентоза (обычно рибоза илѝ 2′-дезокси
рибоза), а в качестве несахарной
части (т.е. агликона) – азотистое
основание гетероциклического ряда
(чаще пуриновое или пиримидиновое).
Сахар
Азотистое основание
β-N-гликозидная связь
115
116.
Нуклеозиды (НЗ)• В зависимости от вида сахара
нуклеозиды делятся:
- рибонуклеозиды
- дезоксирибонуклеозиды.
• В зависимости от вида азотистого
основания нуклеозиды бывают
пуриновые и пиримидиновые.
116
117.
Рибонуклеозиды117
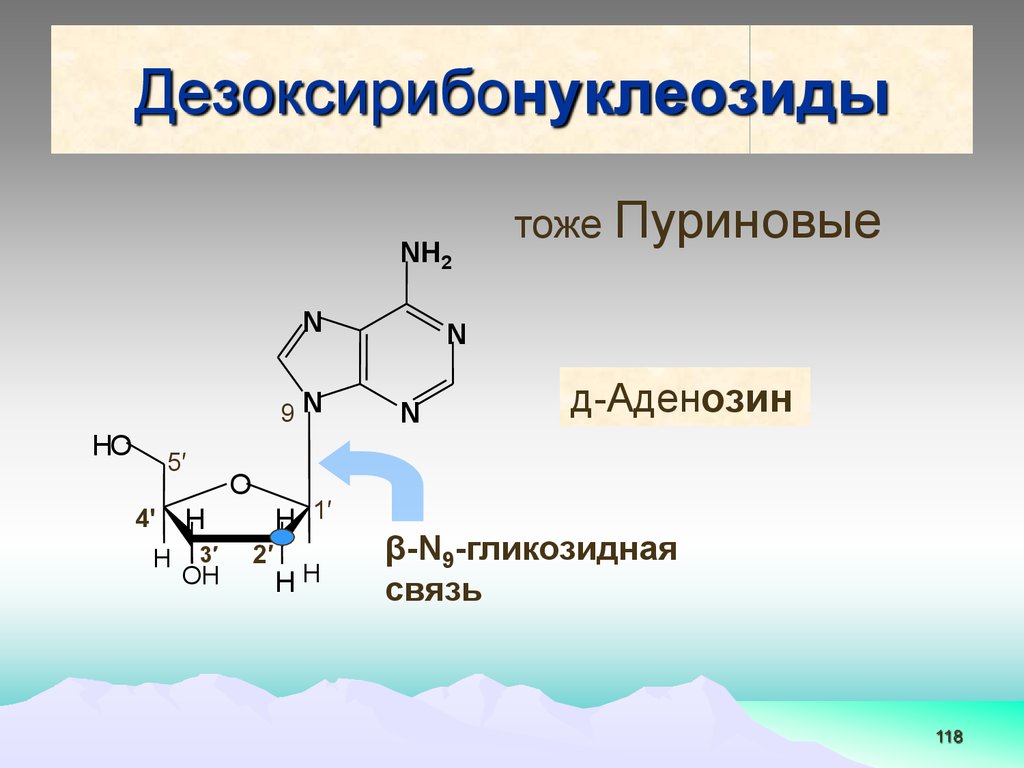
118.
ДезоксирибонуклеозидыNН2
N
9N
HO
5′
4ꞌ
H
тоже Пуриновые
N
N
д-Аденозин
O
H 1′
H
3′
OН
2′
HH
β-N9-гликозидная
связь
118
119.
Роль нуклеозидов (НЗ)• Нуклеозиды являются составными
частями нуклеотидов
• Однако для некоторых НЗ доказана
самостоятельная роль, например, для
пуриновых НЗ существуют рецепторы
на внешней поверхности клеточной
мембраны. Следовательно, эти НЗ будут
передавать определенную информацию в
клетку.
119
120.
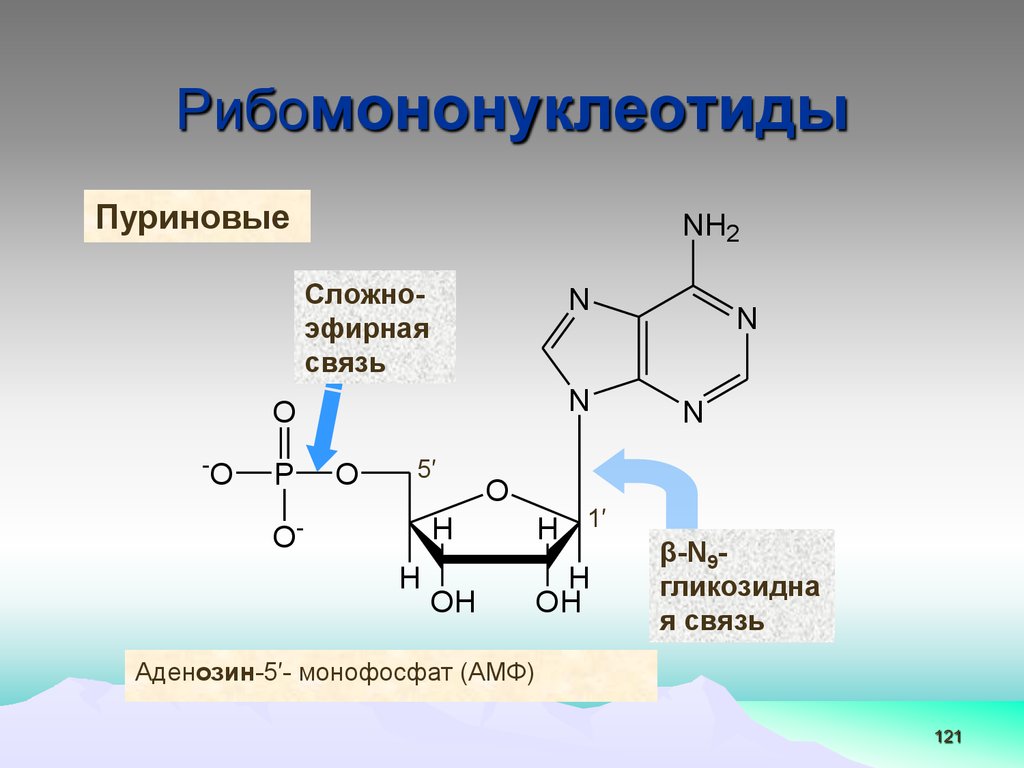
Нуклеотиды (НТ)• Это фосфорные эфиры нуклеозидов
# Фосфат обычно находится в
положении 5′- рибозы или
дезоксирибозы
Фосфат
5′
Сахар
Азотистое основание
Сложноэфирн
ая связь
120
121.
РибомононуклеотидыПуриновые
NH2
Сложноэфирная
связь
N
N
O
-
O
P
O
O
5′
-
H
N
N
O
H
H 1′
OH
H
OH
β-N9гликозидна
я связь
Аденозин-5′- монофосфат (АМФ)
121
122.
РибомононуклеотидыNH2
Пиримидиновые
N
Сложноэфирная
связь
N
O
-
O
P
O
5′
O
O-
Цитидин-5′ -монофосфат
(ЦМФ)
O
H
H
OH
H
OH
H
122
123.
Уридин-5ꞌ-монофосфатСложноэфирная
связь
5ꞌ
4ꞌ
1ꞌ
3ꞌ
2ꞌ
123
124.
ДезоксирибомононуклеотидыNH 2
Пиримидиновые
Сложноэфирная
связь
N
N
O
-O
P
O
O
5′
O
H
O-
2′
H
H
1′
H
OH
H
д-Цитидин-5′ -монофосфат (д-ЦМФ)
124
125.
ДезоксирибомононуклеотидыПуриновые
O
N
Сложноэфирная
связь
N
O
-O
P
O
NH
N
NH 2
5′
O
H
O-
H
H
H
OH
H
д-Гуанозин-5′ -монофосфат (д-ГМФ)
125
126.
КлассификацияНуклеотиды
Мононуклеотиды
Динуклеотиды Полинуклеотиды
Нуклеозидмонофосфаты
НАД
Нуклеозиддифосфаты
НАДФ
Нуклеозидтрифосфаты
ФАД
ДНК
РНК
Циклонуклеотиды
Флавинмононуклеотиды
126
127.
НуклеозидтрифосфатыNH2
Аденозинтрифосфат (АТФ)
γ
N
β
α
N
O
O
N
N
5′
P
O
O
O-
H
H
OH
H
OH
H
127
128.
Роль мононуклеотидов• Все мононуклеотиды, кроме ФМН, могут
выполнять регуляторную роль
• Кроме того, нуклеозидтрифосфаты являются
макроэргами и субстратами для биосинтеза
нуклеиновых кислот
• Макроэргами являются и
нуклеозиддифосфаты
• Циклонуклеотиды являются
внутриклеточными усилителями и
посредниками (мессенджерами) действия
многих гормонов.
128
129.
Динуклеотиды• НАД -НикотинамидАденинДинуклеотид
Фосфат
5′
Рибоза
Никотинамид
Фосфат
5′
Рибоза
Аденин
НМН
АМФ
129
130.
Строение НАДО
NH2
C
N
N
N
N
O
о
CH2 O
P
O–
OH OH
NH2
O
O P-OH2C
о
N+
O–
OH OH
НАДФ+ отличается от НАД+ наличием дополнительного
фосфата в положении 2' АМФ
130
131.
Механизм переноса гидридиона с участием пиридиновыхкоферментов
Н–
O
δ+
С
Н
Н
С
NН2
N
R
R
Окисленная форма
кофермента НАД+,
НАДФ+
NН2
..
N
+
O
Восстановленная
форма кофермента
НАДН, НАДФН
131
132.
Строение ФАД5′
• ФАД – ФлавинАденинДинуклеотид
Фосфат
5′
Рибитол
Флавин
Фосфат
5′
Рибоза
Аденин
ФМН
АМФ
132
133.
Формула ФАД6
Н 3С
O
5
4
N
N3
7
2
Н 3С
8
9
10
N
N
O
1
СН2
О
НО
Р
Н
Н
Н
О
NH2
ОН
ОН
ОН
6
1
2
СН2
3
Н2С
Р
НО
О
О
9N
8
O
4'
Н
7
N
4
N
5'
О
5
N
Н
3'
ОН
Н
2'
1'
ОН
133
134.
Фрагмент РНКO
N
НO
N
5ꞌ
О-Н2С
НО
N
NH2
О
P
O
NН
О
3ꞌ
О
ОН
NН
O
5ꞌ
N
P– О–Н2С
OН
О
О
3ꞌ
О
ОН
134
135.
Функции НК• Хранение наследственной информации
• Передача наследственной информации
• Реализация наследственной
информации
• Наследственная информация записана
в виде трехбуквенного кода – три
нуклеотида, соответствуют одной
определенной аминокислоте.
135
136.
Структура НК• Первичная – последовательность
нуклеотидов в полинуклеотидной цепи,
организованная с помощью 3ꞌ,5ꞌ-ФЭС
• Вторичная – у ДНК – двойная спираль,
(закрученная вокруг общей оси) с
антипараллельными, но не идентичными
полинуклеотидными цепями.
Стабилизируется водородными связями
между комплементарными азотистыми
основаниями, а также стэкинг взаимод-ми
между плоскими циклами азот.оснований.
136
137.
Структура НК• Вторичная структура РНК менее
регулярна, чем у ДНК и представлена
одной цепью, где местами встречаются
спиральные участки.
• Третичная структура имеет место только
у ДНК – это сверхскрученная упаковка
двойной спирали вокруг белков гистонов.
• Комплексируясь со щелочными белками
гистонами, ДНК формирует метафазную
хромосому.
137
138.
Структура НК• Гистоны препятствуют считыванию
информации с молекулы ДНК (т.е.
транскрипции, или синтезу м-РНК)
• Кроме того, в регуляторных зонах с ДНК
могут связываться другие белки как
активаторы, так и ингибиторы
транскрипции (причем, это могут быть
гормонрецепторные комплексы)
• м-РНК имеет тенденцию сворачиваться в
хаотические клубки, но во время
трансляции она раскручивается
138
139.
Структура НК• Фрагмены одной нити р-РНК образуют
«шпильки», позволяющие эффективно
комплексироваться со щелочными
белками в рибосому.
• т-РНК самая маленькая (50-90 НТ)
имеет форму «кленового листа». К 3ꞌконцу прикрепляется определенная АК
в соответствии с антикодоном (триплет
нуклеотидов в центральной петле).
139
140.
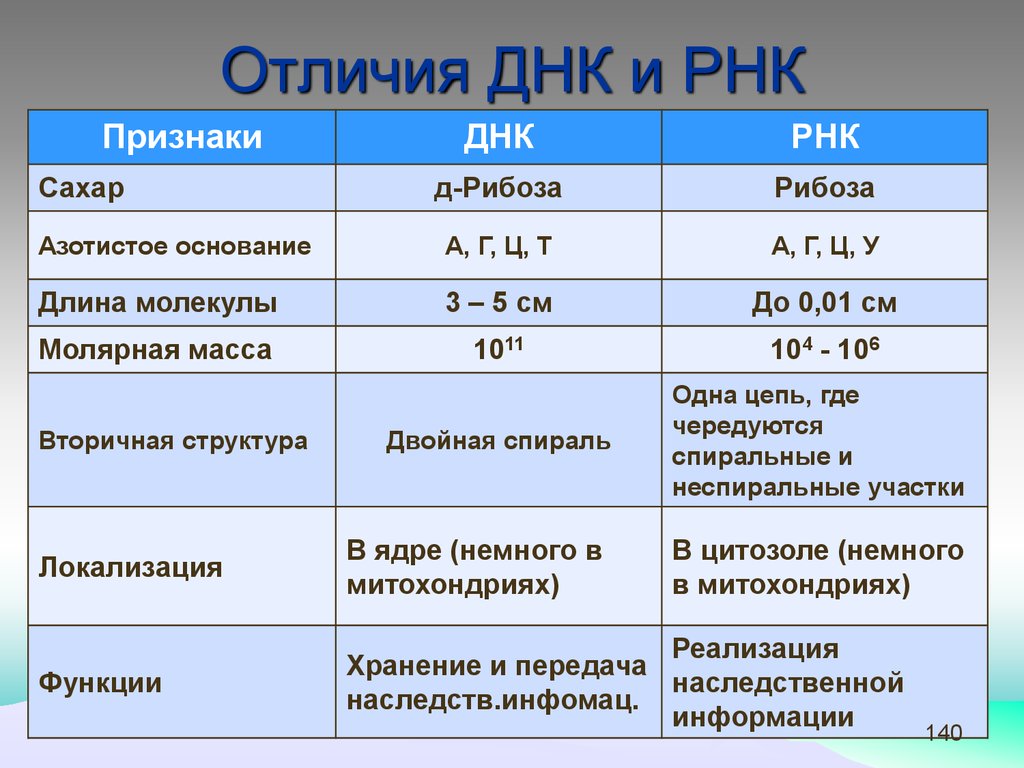
Отличия ДНК и РНКПризнаки
ДНК
РНК
д-Рибоза
Рибоза
Азотистое основание
А, Г, Ц, Т
А, Г, Ц, У
Длина молекулы
3 – 5 см
До 0,01 см
Молярная масса
1011
104 - 106
Двойная спираль
Одна цепь, где
чередуются
спиральные и
неспиральные участки
Сахар
Вторичная структура
Локализация
В ядре (немного в
митохондриях)
В цитозоле (немного
в митохондриях)
Функции
Реализация
Хранение и передача
наследственной
наследств.инфомац.
информации
140
141.
• В клетках прокариот (где нет ядра, этомикроорганизмы, простейшие, грибы)
вся ДНК находится в цитоплазме и
привязана ковалентно к
цитоплазматической мембране.
• Поэтому она более доступна для
фармакологически активных веществ и
других неблагоприятных факторов
внешней среды.
141
142.
• ФАВ могут алкилировать, ацилировать,интеркалировать (проникать внутрь
двойной спирали и укладываться между
стопками азотистых оснований) ДНК и
менять её физико-химические свойства.
• Эти свойства ФАВ и ДНК используются
при лечении опухолей, вирусных
инфекций, заболеваний, вызванных
патогенными микроорганизмами и
простейшими. Среди таких препаратов
многие антибиотики
142
143.
Физико-химические свойства НК• НК поглощают свет в УФ-области
• Как полимеры они подвергаются
денатурации в щелочной, кислой среде
и при повышении температуры
• Уже слабое нагревание приводит к
разрушению водородных связей и
гидрофобных взаимодействий. При
95°С две цепи ДНК расходятся, что
говорит о процессе плавления
143
144.
Физико-химические свойства НК• Денатурация приводит к повышению
вязкости растворов
• Денатурированная ДНК легко
подвергается гидролизу (кислотному,
щелочному, ферментативному)
• ДНК легче гидролизуется, чем РНК
• НК легко связываются с катионами
металлов, образуя хелаты.
144
145.
Физико-химические свойства НК• НК не содержат склонных к окислению
группировок и в мягких условиях не
окисляются
• Однако в жестких условиях в присутствии
азотистой кислоты HNO2 аминогруппа
азотистых оснований заменяется на
гидрокси-группу: Ц→У, А→гипоксантин,
Г→ксантин
• Поэтому HNO2 является сильным
мутагеном
145
146.
Физико-химические свойства НК• Окислительной модификации
подвергаются НК и в присутствии
свободных радикалов (ȮН, ȮR, ȮОН,
О2), а также пероксинитрита ONO2 и
хлорноватистой кислоты
• Свободнорадикальному окислению ДНК
отводится ведущая роль в процессах
старения, канцерогенеза, ауто- и
иммуногенеза (ревматоидный артрит,
146
147.
• системная красная волчанка), а также ввозникновении инсулинустойчивого
(инсулинонезависимого) сахарного
диабета.
• Кроме окислительной модификации
оснований существуют и другие типы
повреждений ДНК (разрывы нитей,
межнитевые сшивки ДНК-ДНК, сшивки
ДНК-белок, образование участков,
лишенных оснований).
147
148.
Физико-химические свойства НК• Летальное и мутагенное действие на
организм оказывает УФ-излучение,
т.к.
– Запускает процесс свободно-радикального
окисления
– Может приводить к образованию
циклобутановых структур между двумя
пиримидиновыми азотистыми основаниями
(Т, Ц). Циклобутановые структуры
блокируют процесс репликации ДНК.
148
149.
Основные выводы• На основе строения
продемонстрированы самые
важные свойства
высокомолекулярных
соединений, таких как белки,
углеводы, нуклеиновые кислоты
во взаимосвязи с их функциями.
149
150.
Литератураосновная:
• Слесарев В.И. – Химия: Основы химии
живого: Учебник для вузов. – 3-е изд.,
испр. – СПб: Химиздат. – 2007. – 784с.
• Тюкавкина Н. А., Бауков Ю.И. –
Биоорганическая химия : Учебник. – М.:
ДРОФА. – 2006. – С. 278 - 312
150
151.
Литературадополнительная:
• Грандберг И.И. – Органическая
химия: Учеб. Для студ. вузов,
обучающихся по агроном. спец. – 5-е
изд. – М.: Дрофа, 2002. – 672 с.
• Пузаков С.А. – Химия: Учебник, 2-е
изд. испр. и доп. М.: ГЭОТАР-Медиа
Медицина, - 2006. – 630 с.
151
152.
Литератураэлектронные ресурсы:
• Электронная библиотека Т.12.
Органическая химия. /гл. ред.М.А.
Пальцев.-М.: Русский врач, 2005
• Электронная библиотека Colibris
• Ресурсы Интернет
152
153.
Конец лекции(продолжение следует)
Благодарю за внимание















































































































































 Биология
Биология Химия
Химия








