Похожие презентации:
Углеводы-2
1. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Тема:УГЛЕВОДЫ-2
Краснодар
2016
2. Пентозофосфатный путь окисления глюкозы
С6С1
СО2
С5
пентоза
3. Стадии пентозофосфатного пути окисления глюкозы
1. окислительная стадия2. неокислительная стадия
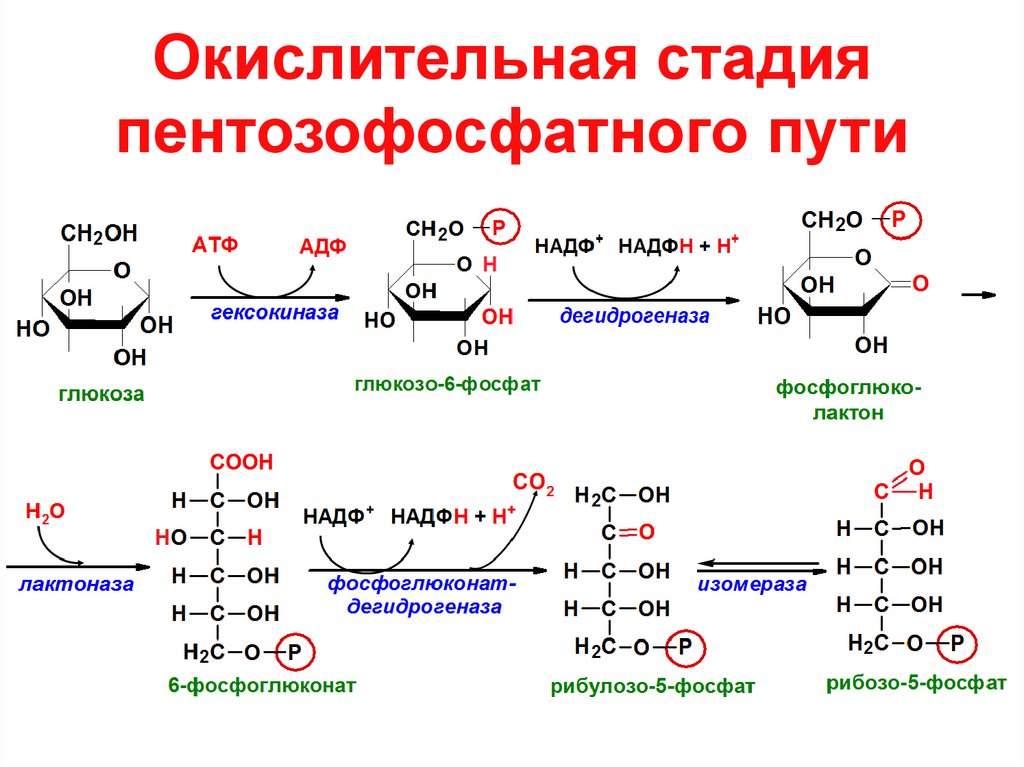
4. Окислительная стадия пентозофосфатного пути
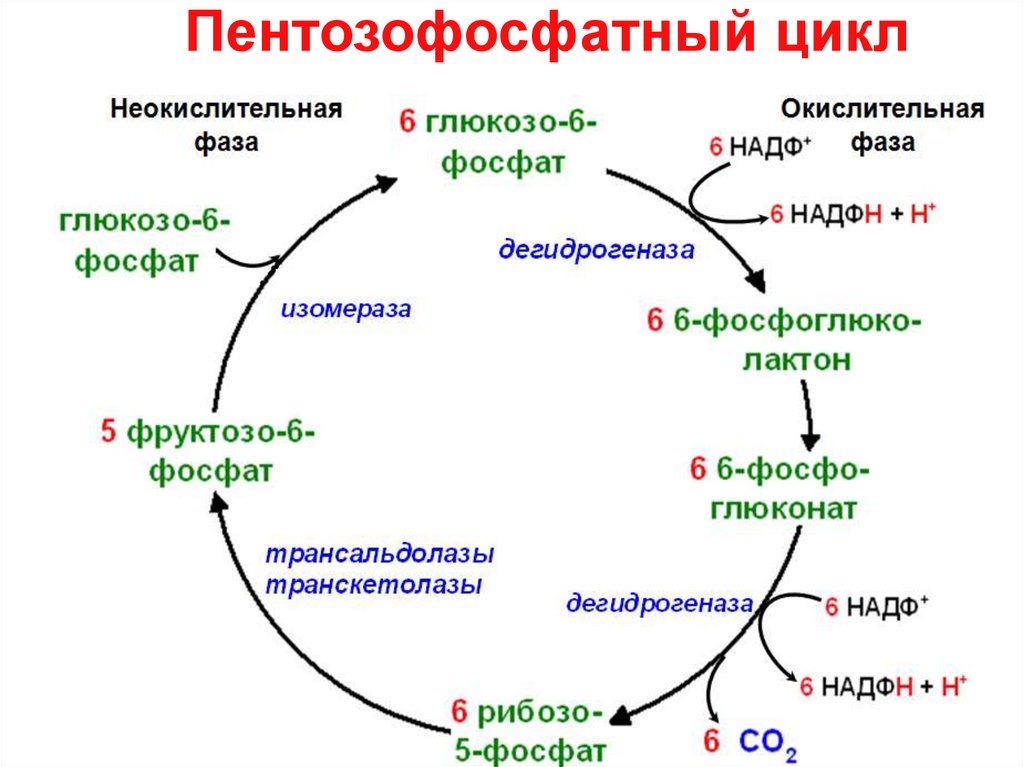
5. Пентозофосфатный цикл
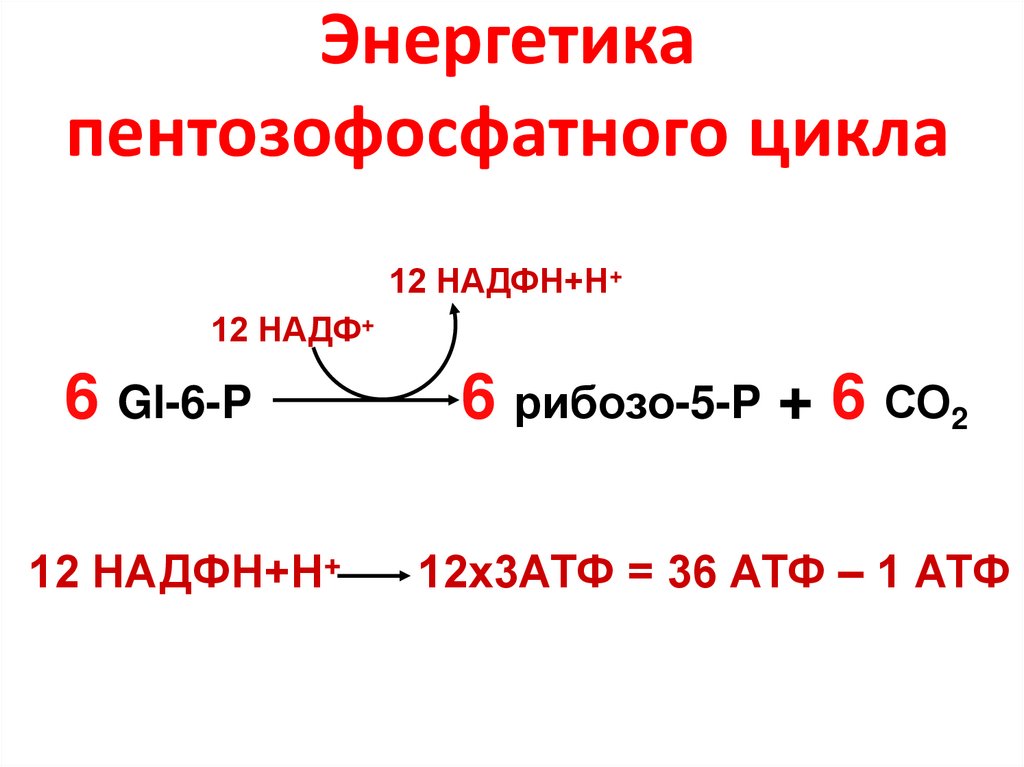
6. Энергетика пентозофосфатного цикла
12 НАДФН+Н+12 НАДФ+
6 Gl-6-P
12 НАДФН+Н+
6 рибозо-5-P + 6 СО2
12х3АТФ = 36 АТФ – 1 АТФ
7. Регуляция пентозофосфатного пути
• Состояние депо энергииАДФ + НР активатор
АТФ ингибитор
• Состояние коферментов
НАДФ+ активатор
НАДФН+Н+ ингибитор
• Гормональная регуляция:
инсулин – активатор
8. Биологическая роль пентозофосфатного пути
• Единственный способ получения пентоз (для синтезануклеотидов);
• Путь получения восстановленного НАДФН+Н+ для:
синтеза липидов (жирных кислот, холестерина и т.д.
– восстановительных синтезов),
обезвреживания токсических веществ;
• Короткий, выгодный путь получения энергии;
• Осуществление взаимосвязи между энергетическим и
пластическим обменами, между обменом углеводов и
обменом других веществ.
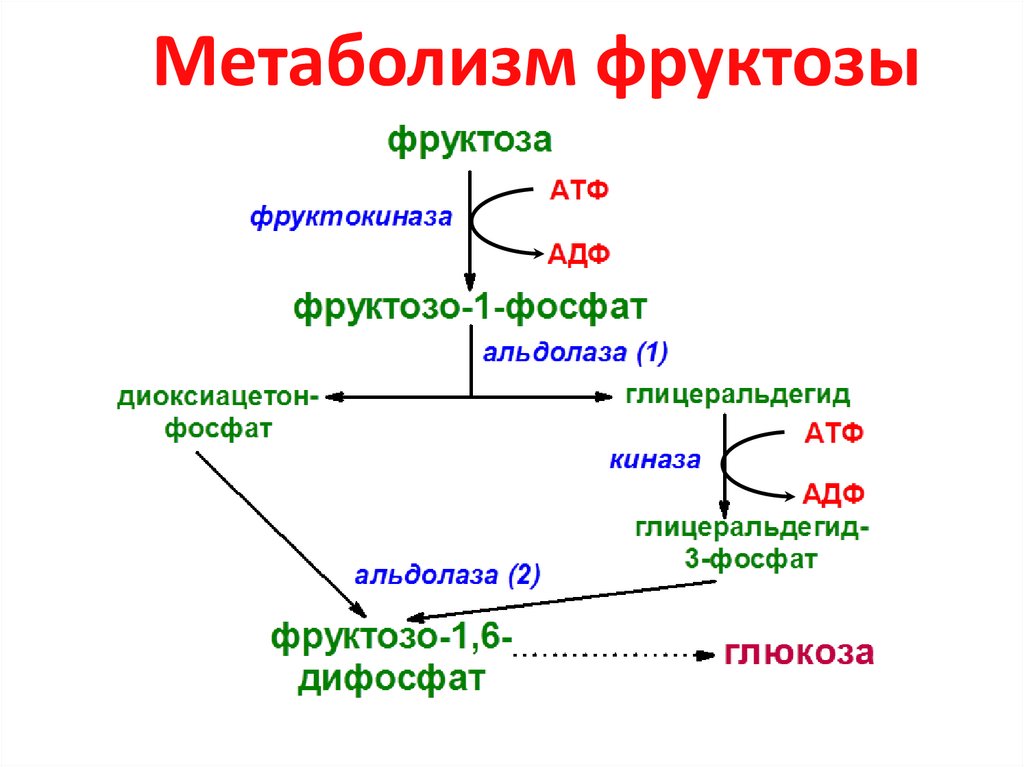
9. Метаболизм фруктозы
10. Нарушение обмена фруктозы
1. эссенциальная фруктозурия –недостаточность фруктокиназы
2. наследственная непереносимость
фруктозы – недостаточность
фруктозо-1-фосфатальдолазы
(альдолазы 1)
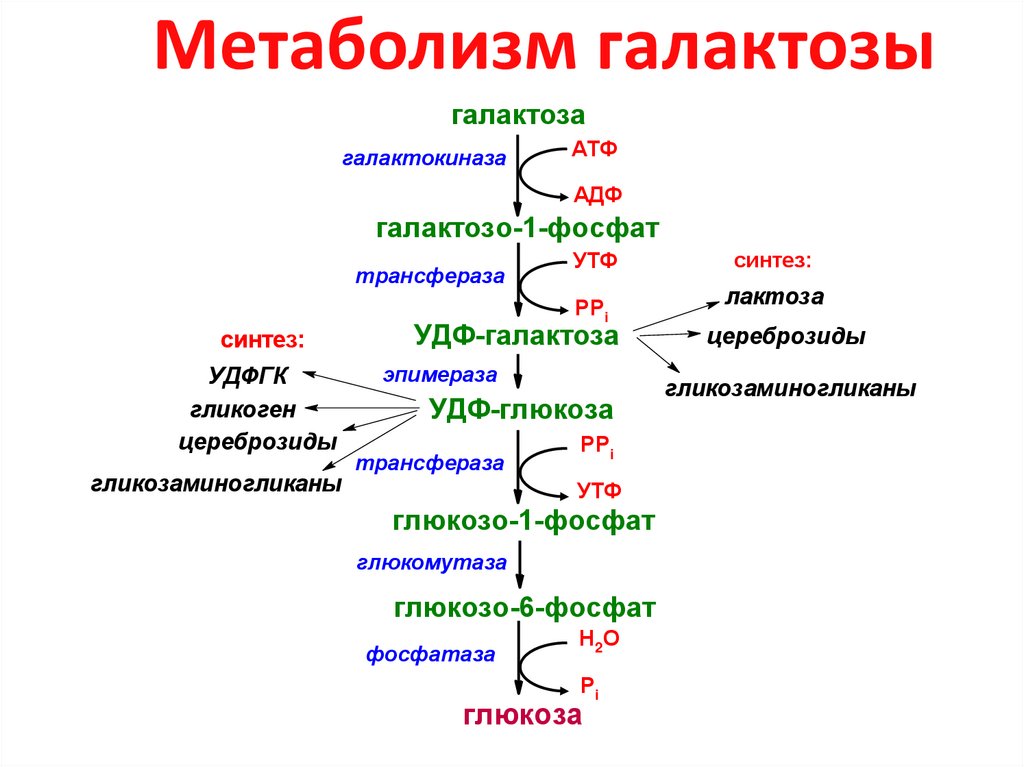
11. Метаболизм галактозы
галактозагалактокиназа
АТФ
АДФ
галактозо-1-фосфат
трансфераза
УТФ
РРi
синтез:
УДФГК
гликоген
цереброзиды
гликозаминогликаны
УДФ-галактоза
эпимераза
УДФ-глюкоза
трансфераза
РРi
УТФ
глюкозо-1-фосфат
глюкомутаза
глюкозо-6-фосфат
фосфатаза
Н2О
Рi
глюкоза
синтез:
лактоза
цереброзиды
гликозаминогликаны
12. Нарушение обмена галактозы
• галактоземия – недостаточностьферментов метаболизма
галактозы:
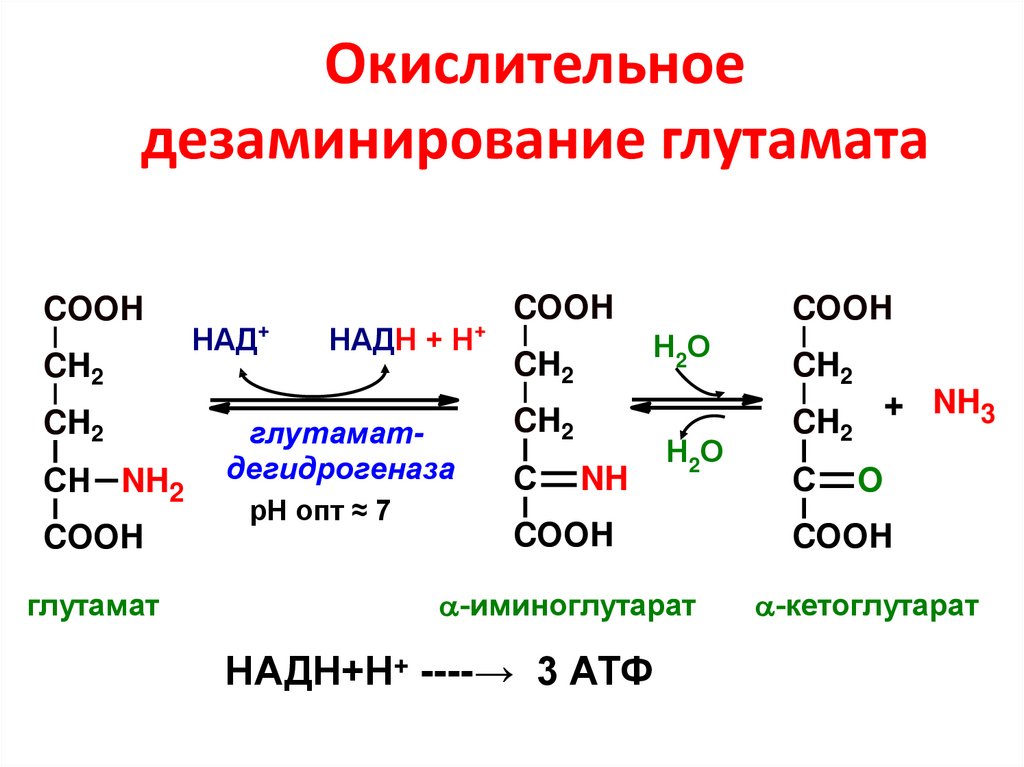
• галактокиназа
• галактозо-1-фосфатуридилтрансфераза
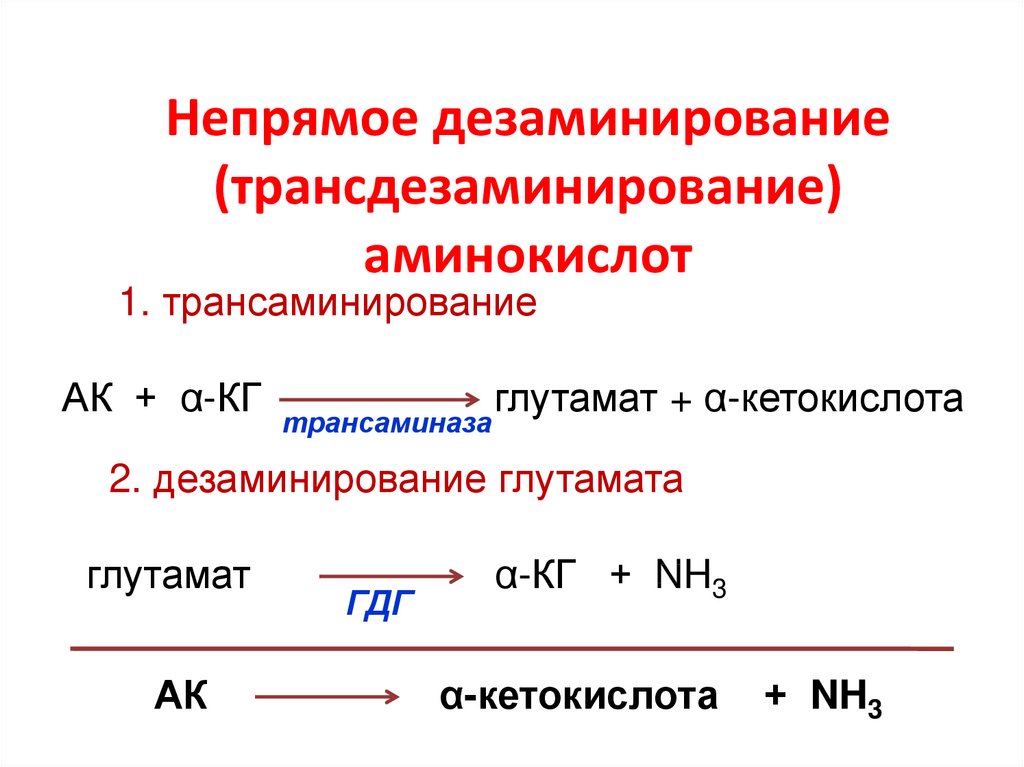
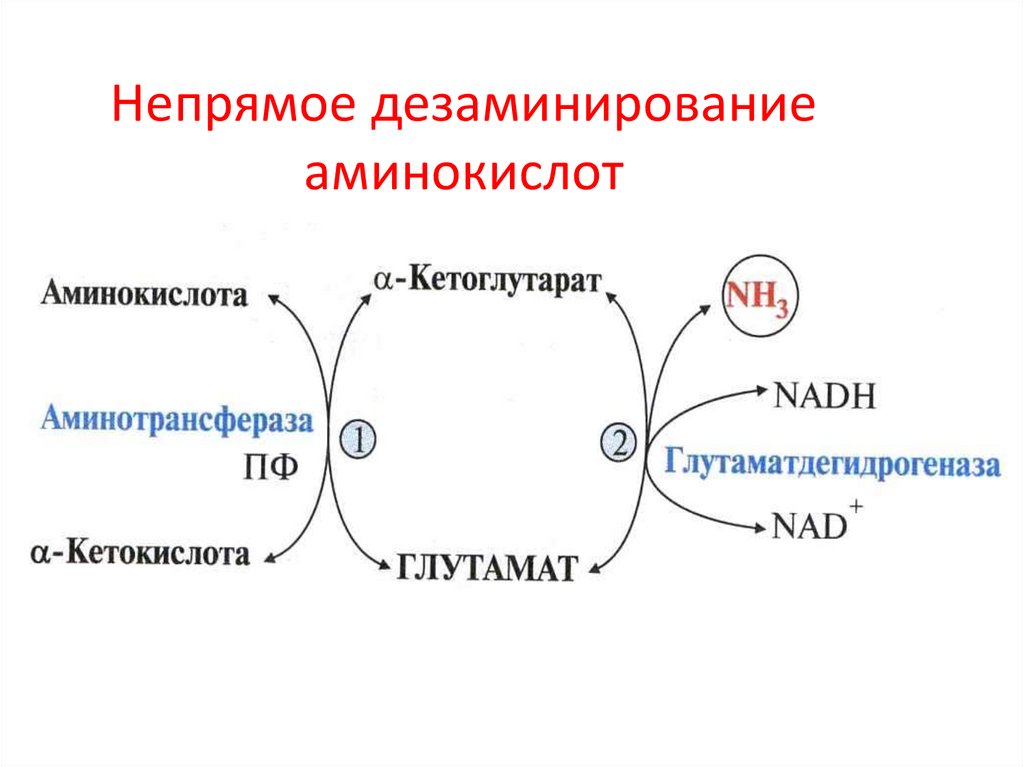
• уридилфосфат-4-эпимераза
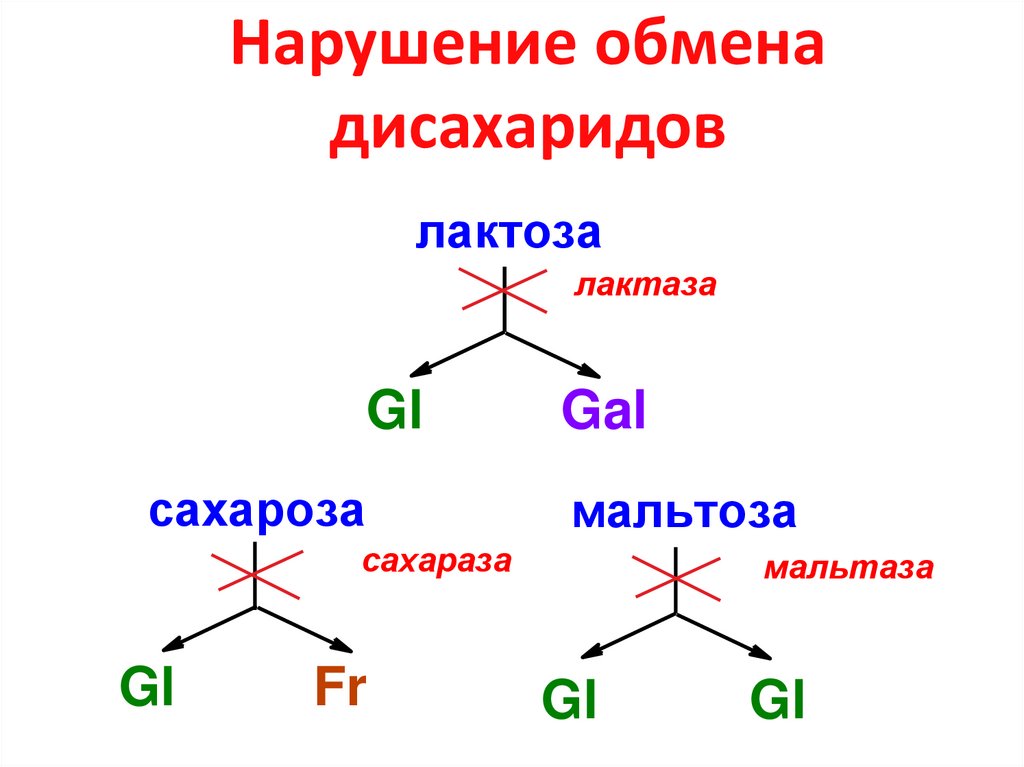
13. Нарушение обмена дисахаридов
лактозалактаза
Gl
сахароза
Gal
мальтоза
сахараза
Gl
Fr
мальтаза
Gl
Gl
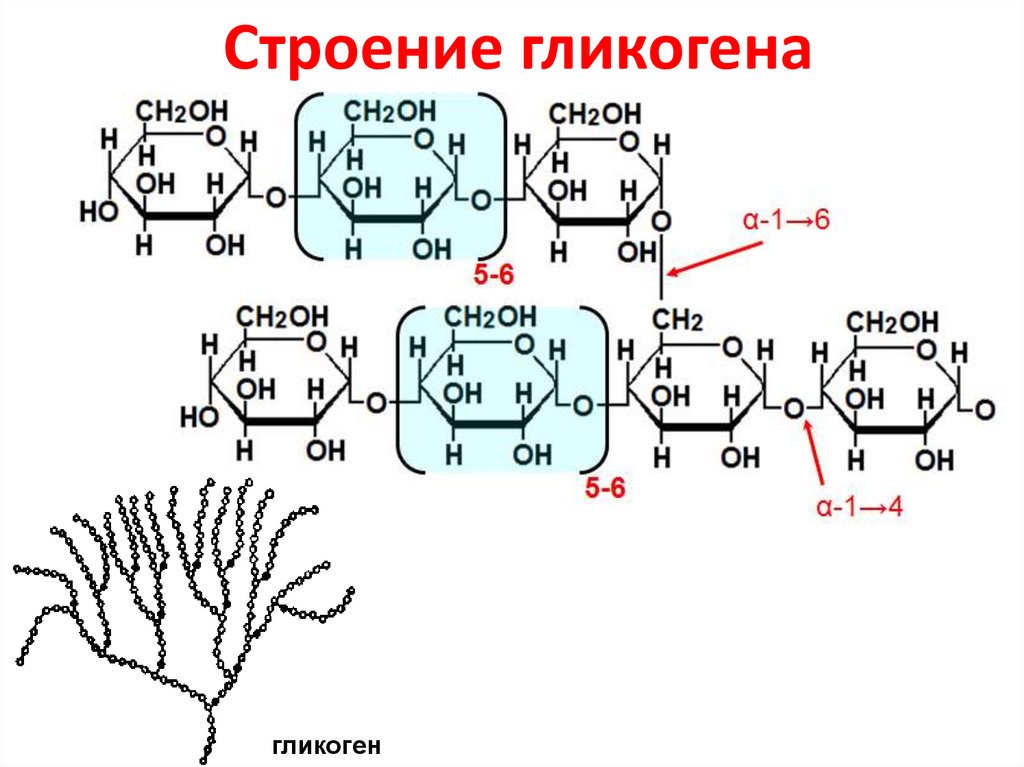
14. Строение гликогена
гликоген15. Биологическая роль гликогена
Гликоген – резервный гомополисахарид,состоящий из остатков α-D-глюкозы
– гликоген мышц – резерв энергии для
мышечной ткани,
– гликоген печени – резерв глюкозы крови
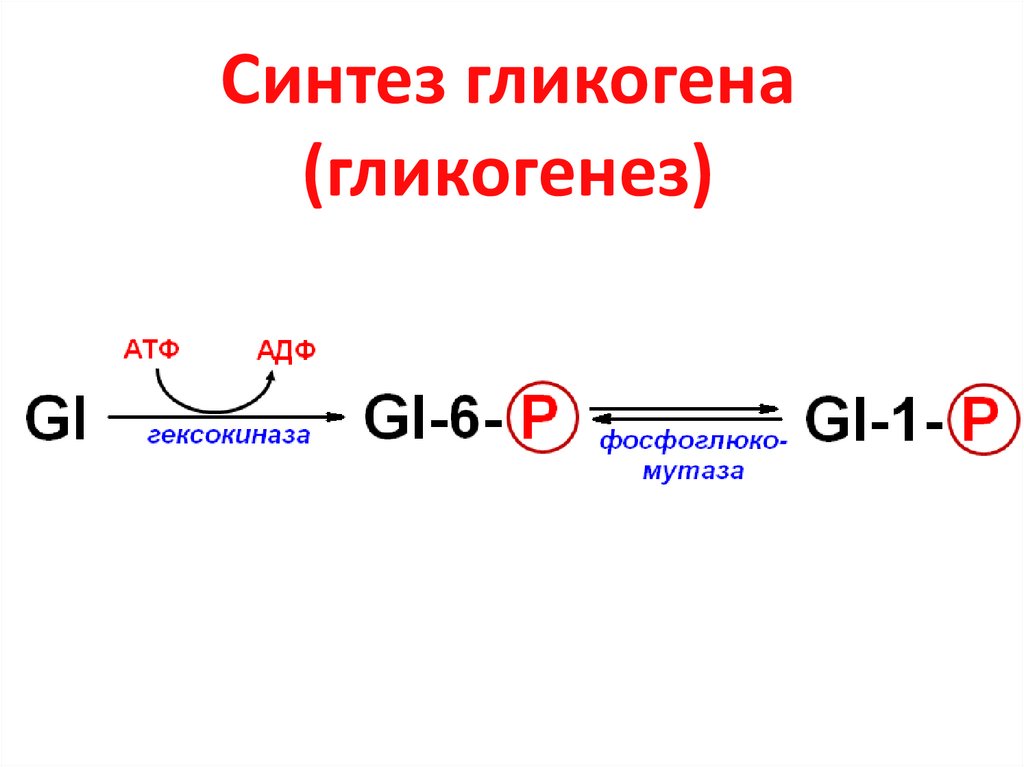
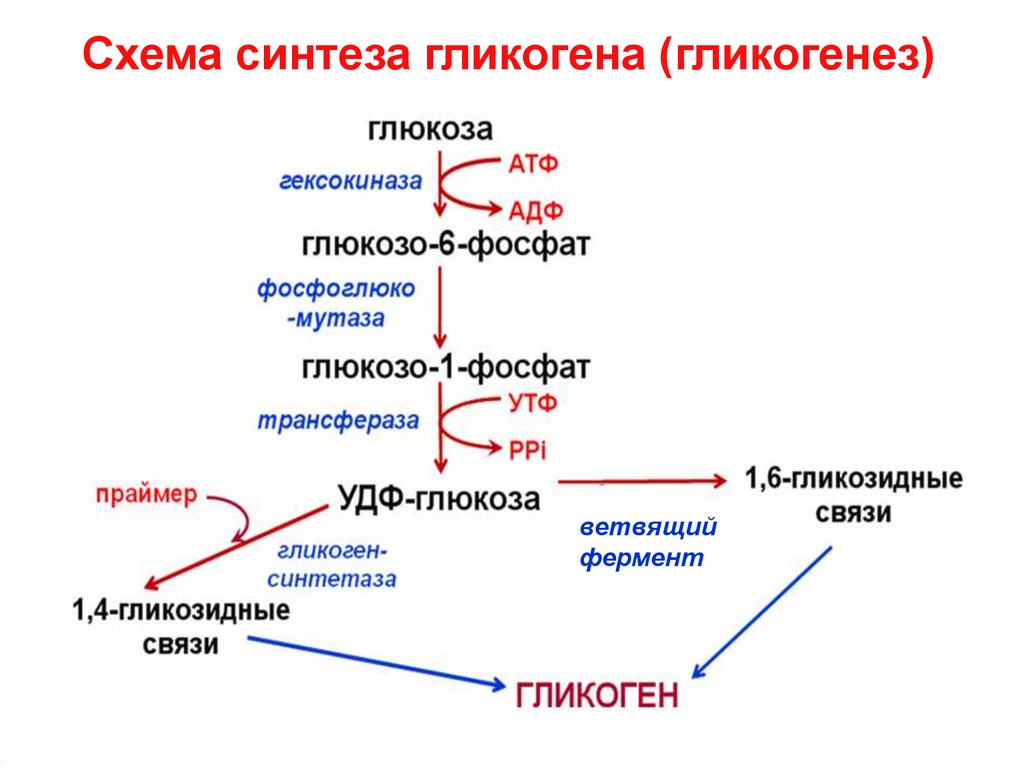
16. Синтез гликогена (гликогенез)
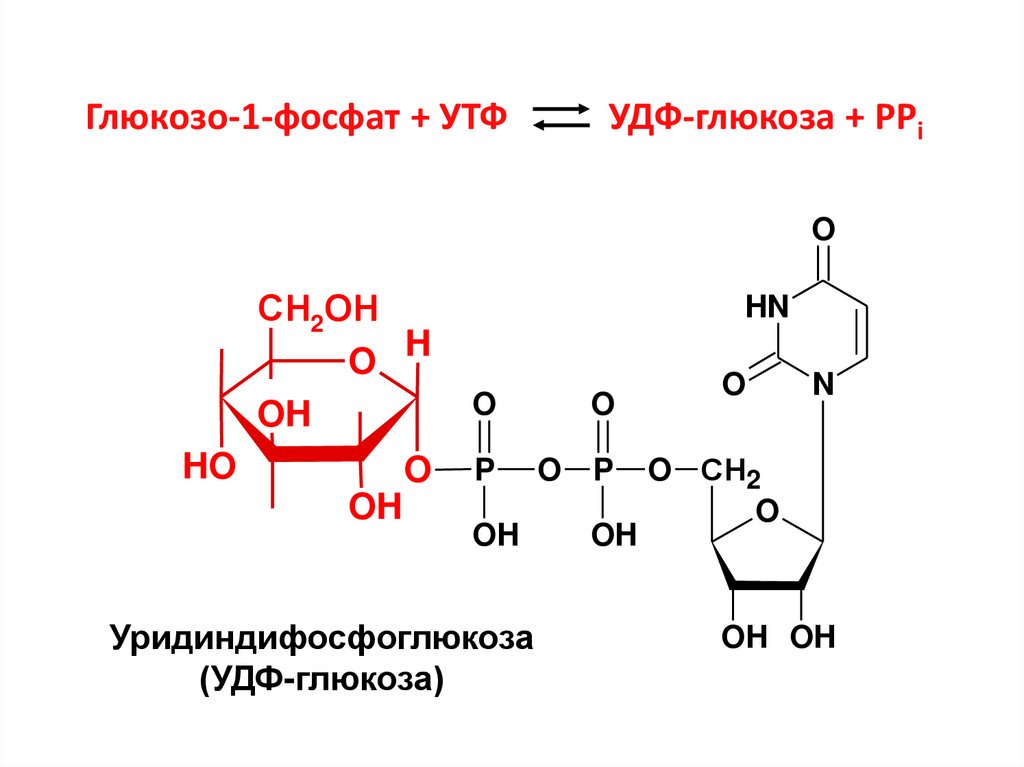
17. Глюкозо-1-фосфат + УТФ УДФ-глюкоза + РРi
OСН2ОН
O H
OH
O
O
O
P
O P
HO
OH
HN
OH
Уридиндифосфоглюкоза
(УДФ-глюкоза)
OH
O
N
O СН2
O
OH OH
18.
СН 2О HO
O УДФ
O
O
+
OH
HO
СН 2ОН
СН 2ОН
OH
OH
O
OH
O
HO
OH
HO
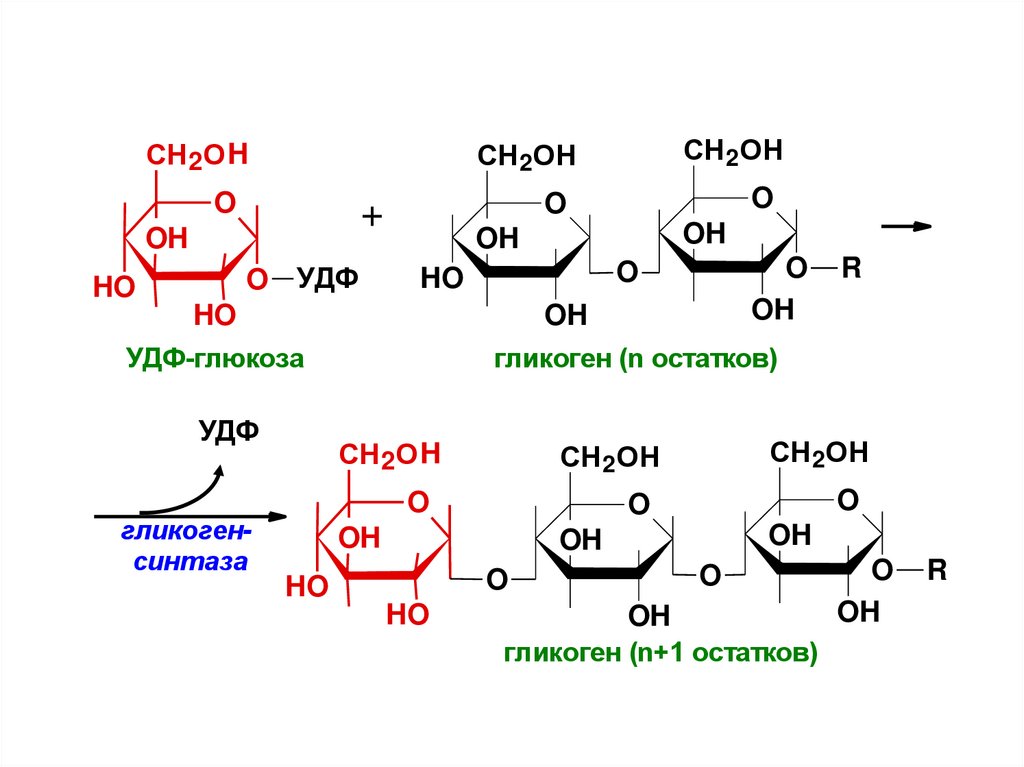
УДФ-глюкоза
УДФ
гликоген (n остатков)
СН 2О H
СН 2ОН
СН 2ОН
O
гликогенсинтаза
R
O
O
OH
OH
OH
O
O
HO
HO
OH
гликоген (n+1 остатков)
O
OH
R
19.
Схема синтеза гликогена (гликогенез)ветвящий
фермент
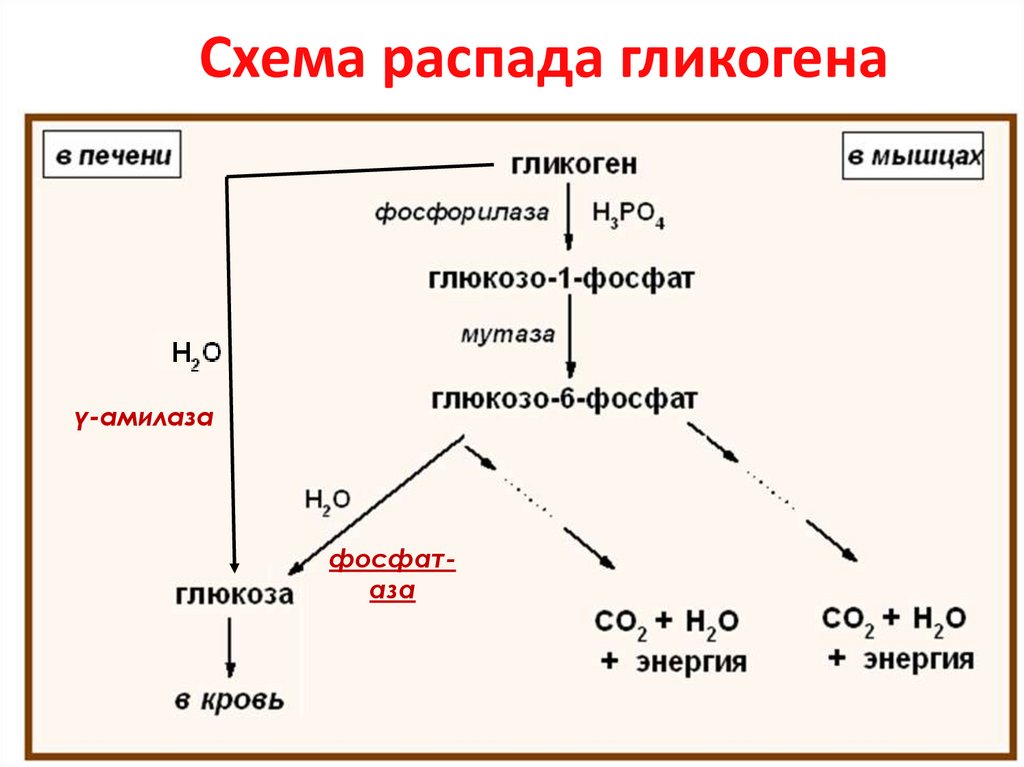
20. Схема распада гликогена
γ-амилазафосфатаза
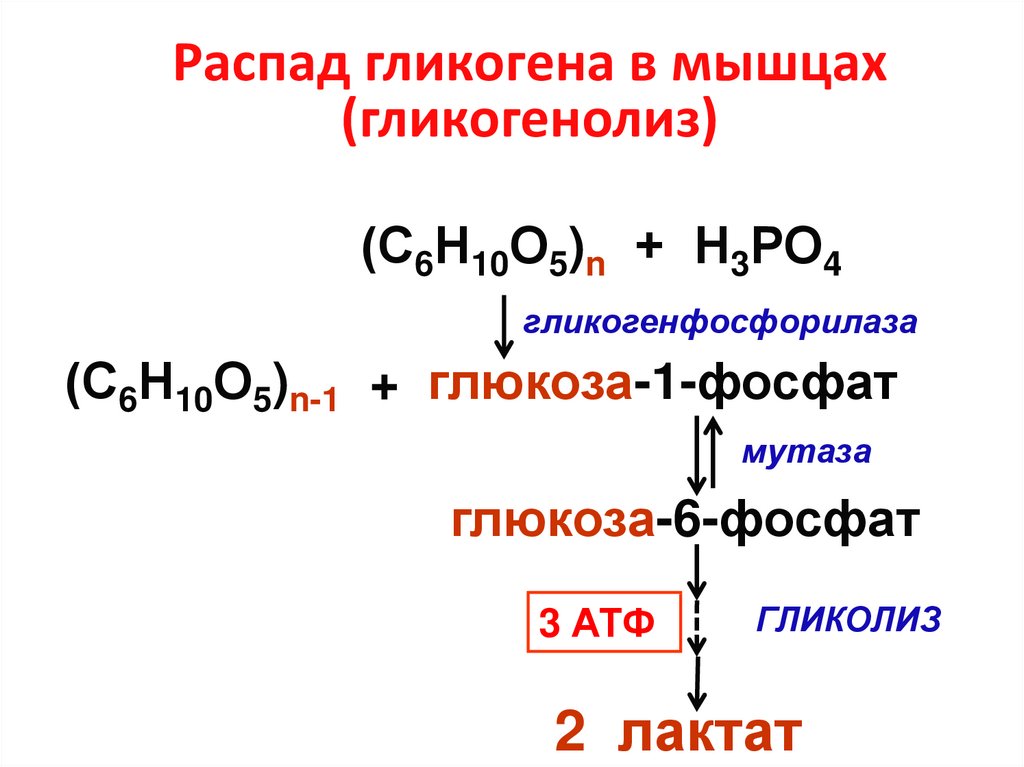
21. Распад гликогена в мышцах (гликогенолиз)
(С6Н10О5)n + Н3РО4гликогенфосфорилаза
(С6Н10О5)n-1 + глюкоза-1-фосфат
мутаза
глюкоза-6-фосфат
3 АТФ
ГЛИКОЛИЗ
2 лактат
22. Регуляция метаболизма гликогена
• Глюкагон и адреналин стимулируют распадгликогена
– активируют фосфорилазу
– ингибируют синтетазу
• Инсулин стимулирует синтез гликогена
(гликогенез)
– активирует синтетазу
– ингибирует фосфорилазу
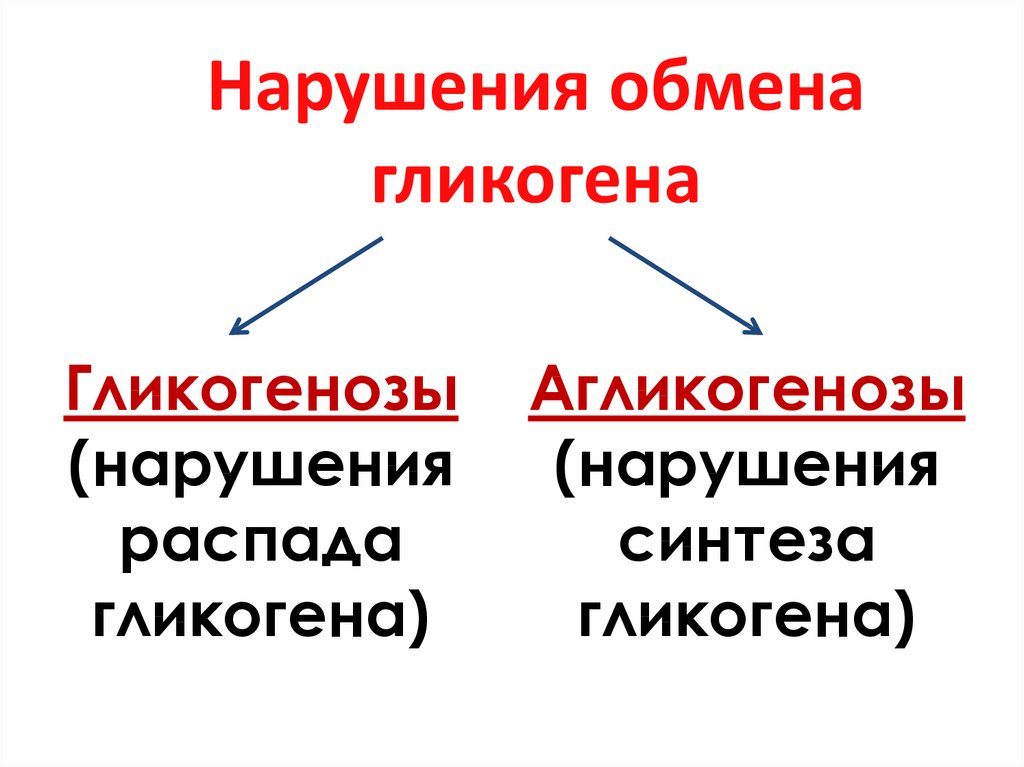
23. Нарушения обмена гликогена
Гликогенозы(нарушения
распада
гликогена)
Агликогенозы
(нарушения
синтеза
гликогена)
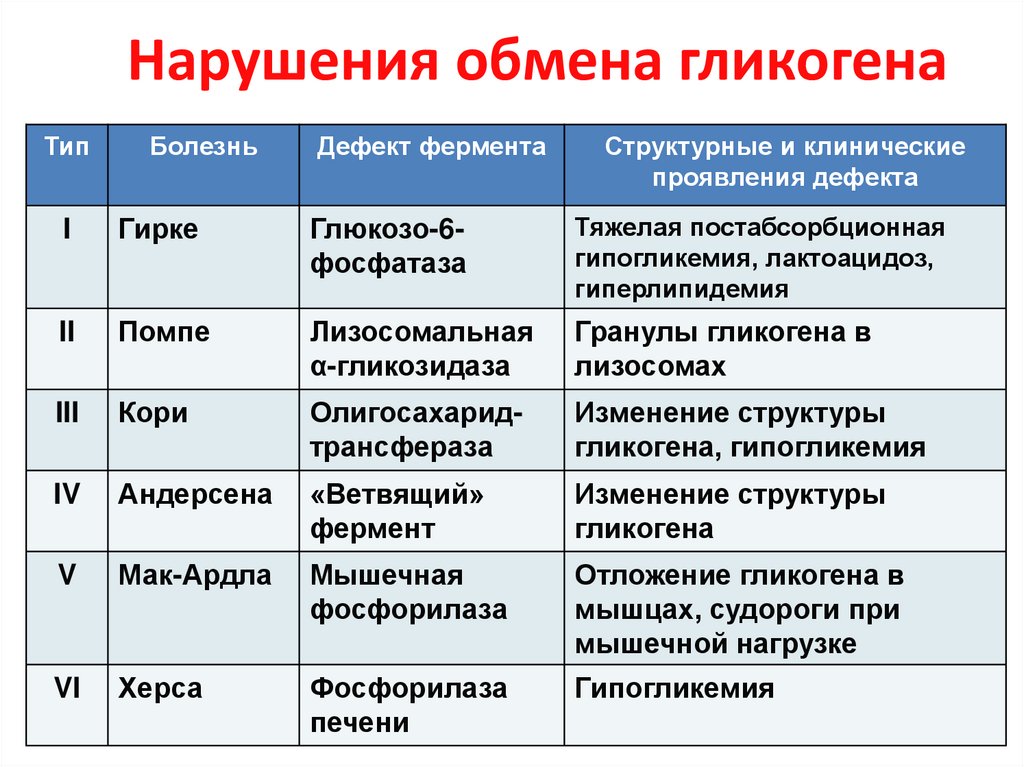
24. Нарушения обмена гликогена
ТипБолезнь
Дефект фермента
Структурные и клинические
проявления дефекта
I
Гирке
Глюкозо-6фосфатаза
Тяжелая постабсорбционная
гипогликемия, лактоацидоз,
гиперлипидемия
II
Помпе
Лизосомальная
α-гликозидаза
Гранулы гликогена в
лизосомах
III
Кори
Олигосахаридтрансфераза
Изменение структуры
гликогена, гипогликемия
IV
Андерсена
«Ветвящий»
фермент
Изменение структуры
гликогена
V
Мак-Ардла
Мышечная
фосфорилаза
Отложение гликогена в
мышцах, судороги при
мышечной нагрузке
VI
Херса
Фосфорилаза
печени
Гипогликемия
25. Регуляция углеводного обмена
• Инсулин снижает уровень глюкозы в крови:– увеличивает проницаемость мембран клеток для
глюкозы,
– активирует синтез гликогена,
– активирует синтез жиров из глюкозы,
– активирует окисление глюкозы
• Глюкагон и адреналин повышают уровень
глюкозы в крови:
– активируют распад гликогена
• Кортизол повышает уровень глюкозы в крови:
– активируют гликонеогенез
26. Белково-углеводные соединения
ГликопротеиныПротеогликаны
• Белок 85-95%
• Углеводы 5-15%
• Белок 3-10%
• Углеводы 90-97%
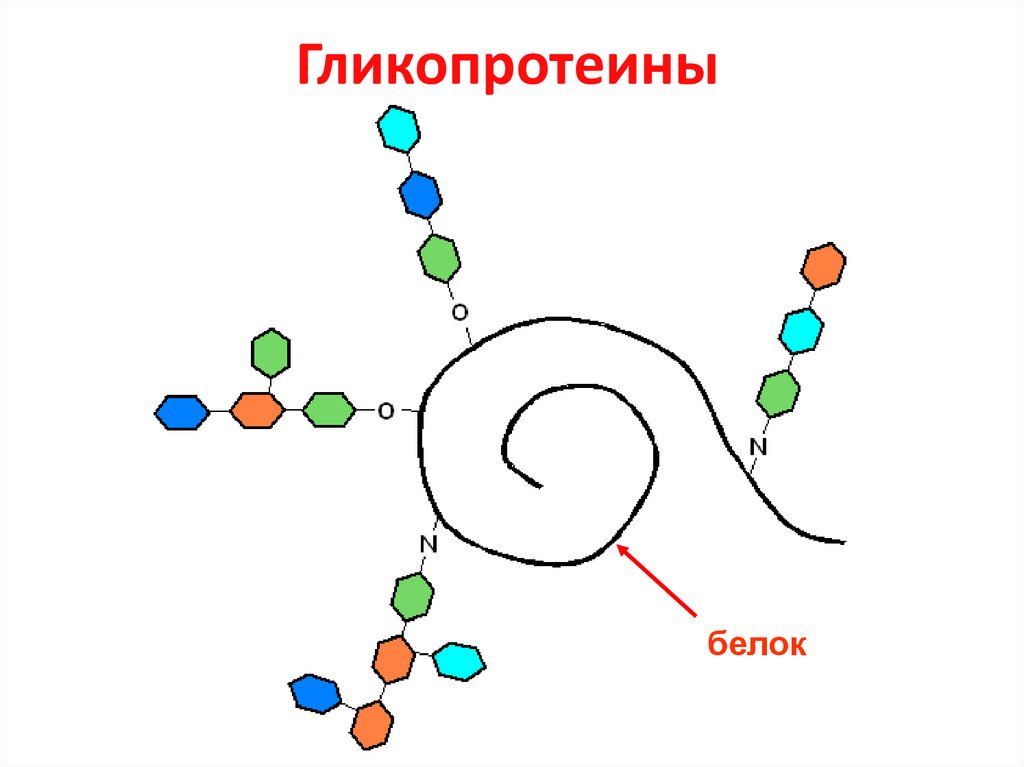
27. Гликопротеины
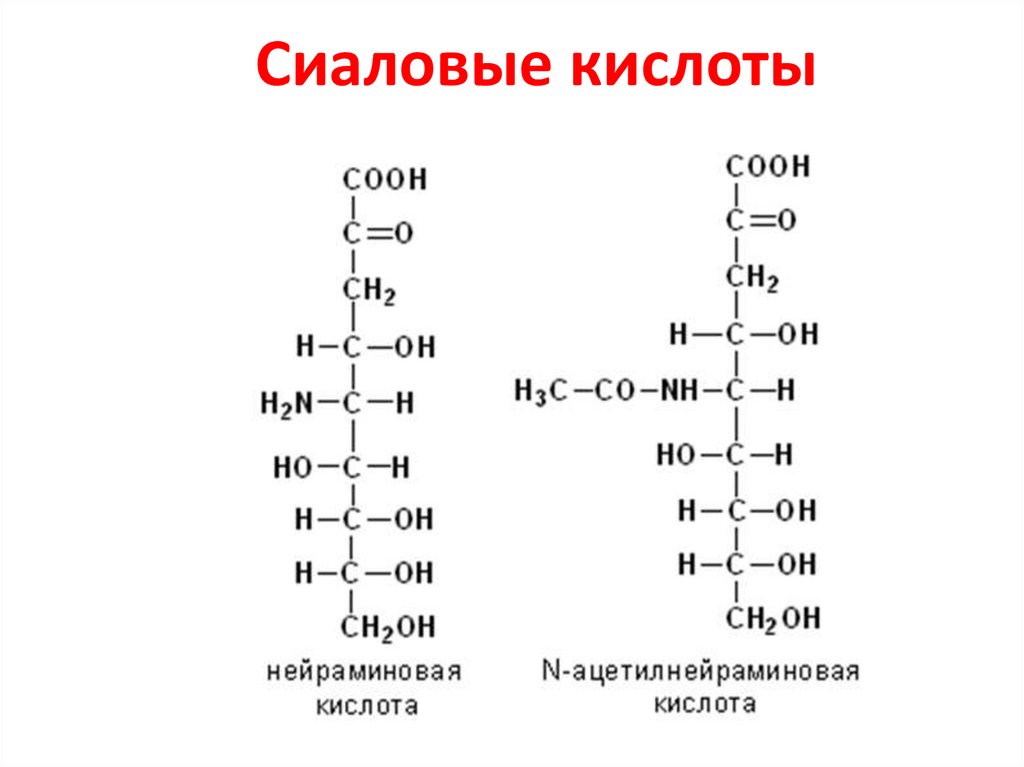
белок28. Сиаловые кислоты
29. Биологические функции гликопротеинов
• Структурная (коллаген, мембранные белки)• Защитная (иммуноглобулины, факторы
свёртывания крови, муцин)
• Регуляторная (тиреотропин, гонадотропины)
• Транспортная (церуллоплазмин, трансферрин)
• Рецепторная
• Каталитическая (плазмин, тромбин)
• Определяют групповую принадлежность
крови
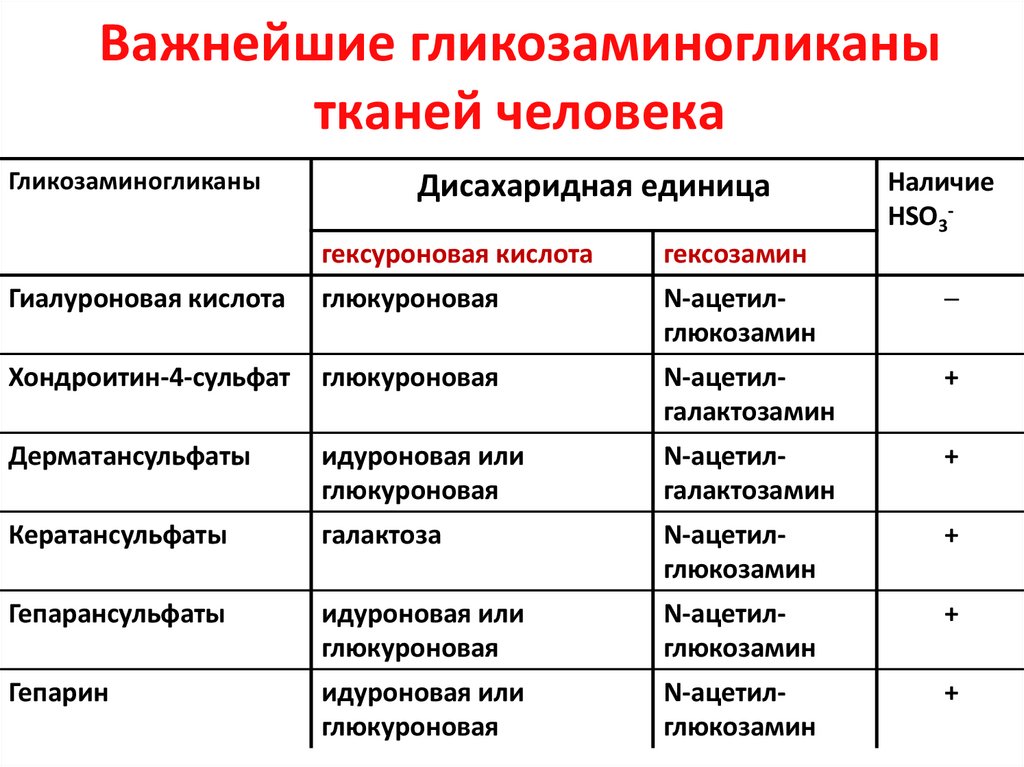
30. Важнейшие гликозаминогликаны тканей человека
ГликозаминогликаныДисахаридная единица
Наличие
НSO3-
гексуроновая кислота
гексозамин
Гиалуроновая кислота
глюкуроновая
N-ацетилглюкозамин
─
Хондроитин-4-сульфат
глюкуроновая
N-ацетилгалактозамин
+
Дерматансульфаты
идуроновая или
глюкуроновая
N-ацетилгалактозамин
+
Кератансульфаты
галактоза
N-ацетилглюкозамин
+
Гепарансульфаты
идуроновая или
глюкуроновая
N-ацетилглюкозамин
+
Гепарин
идуроновая или
глюкуроновая
N-ацетилглюкозамин
+
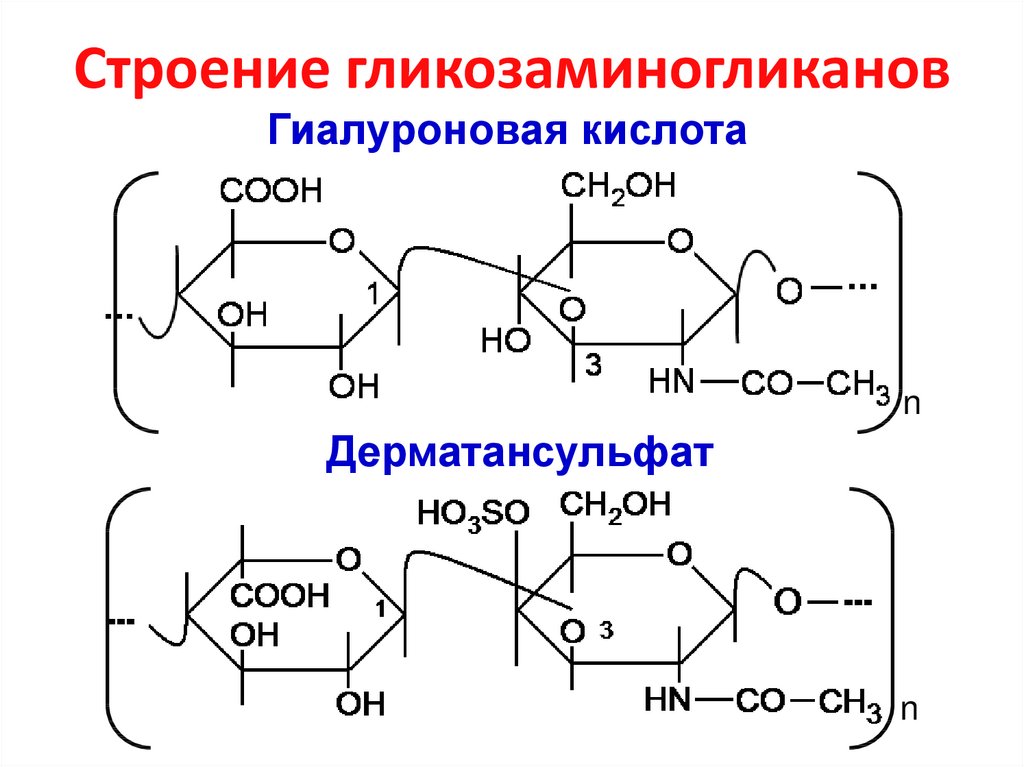
31. Строение гликозаминогликанов
Гиалуроновая кислотаn
Дерматансульфат
n
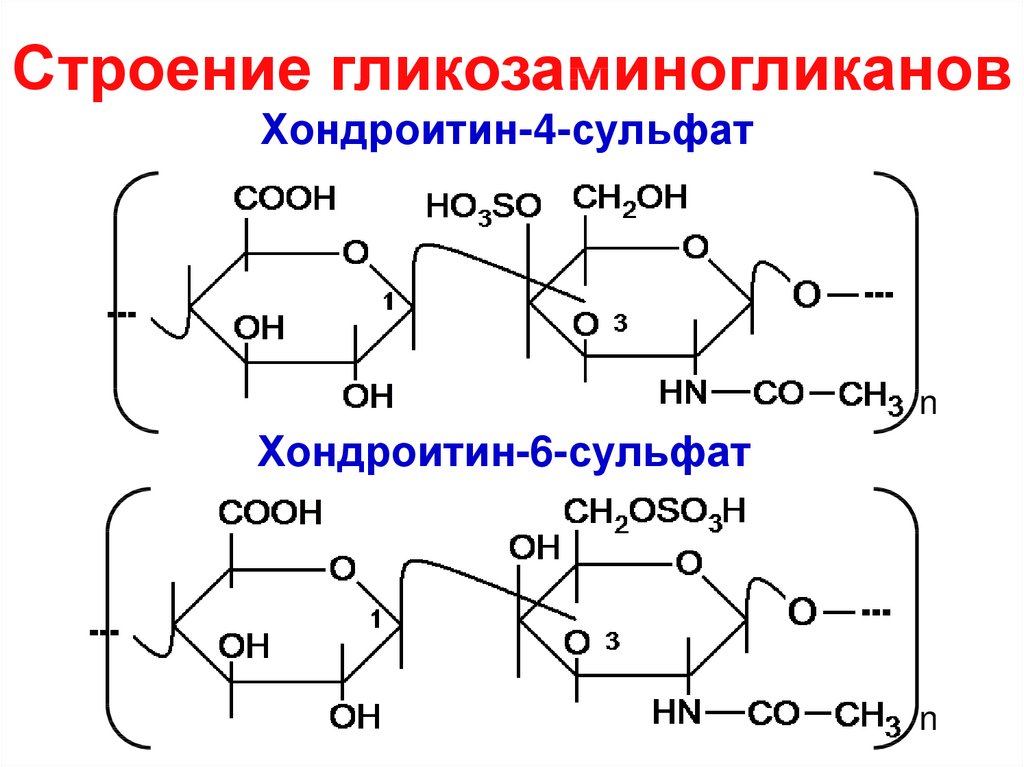
32. Строение гликозаминогликанов
Хондроитин-4-сульфатn
Хондроитин-6-сульфат
n
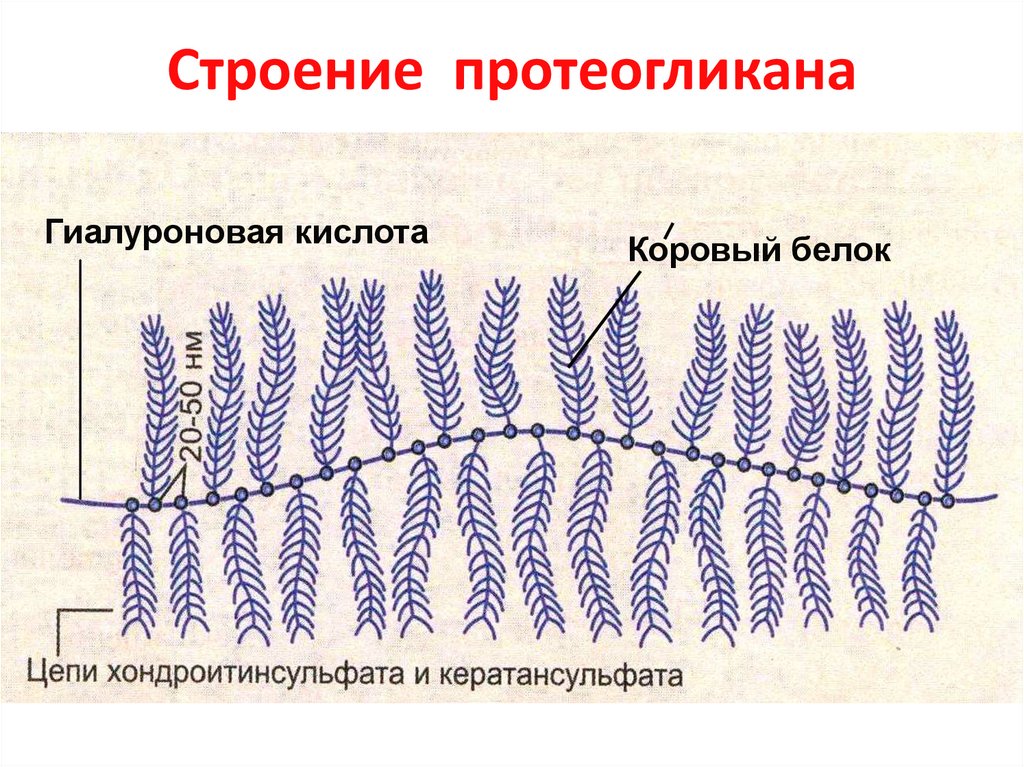
33. Строение протеогликана
Гиалуроновая кислотаКоровый белок
34. Биологические функции гликозаминогликанов и протеогликанов
• являются структурными компонентами межклеточногоматрикса;
• связывают воду, большие количества катионов (Na+, K+, Са2+) и
формируют тургор тканей;
• играют роль молекулярного сита в межклеточном матриксе,
препятствуют распространению патогенных микроорганизмов;
• выполняют рессорную функцию в суставных хрящах;
• обеспечивают прозрачность роговицы;
• гепарин – антикоагулянт;
• гепарансульфаты – компоненты плазматических мембран
клеток, участвуют в клеточной адгезии и межклеточных
взаимодействиях.
35. КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по теме:Обмен белков – 1
Краснодар
2016
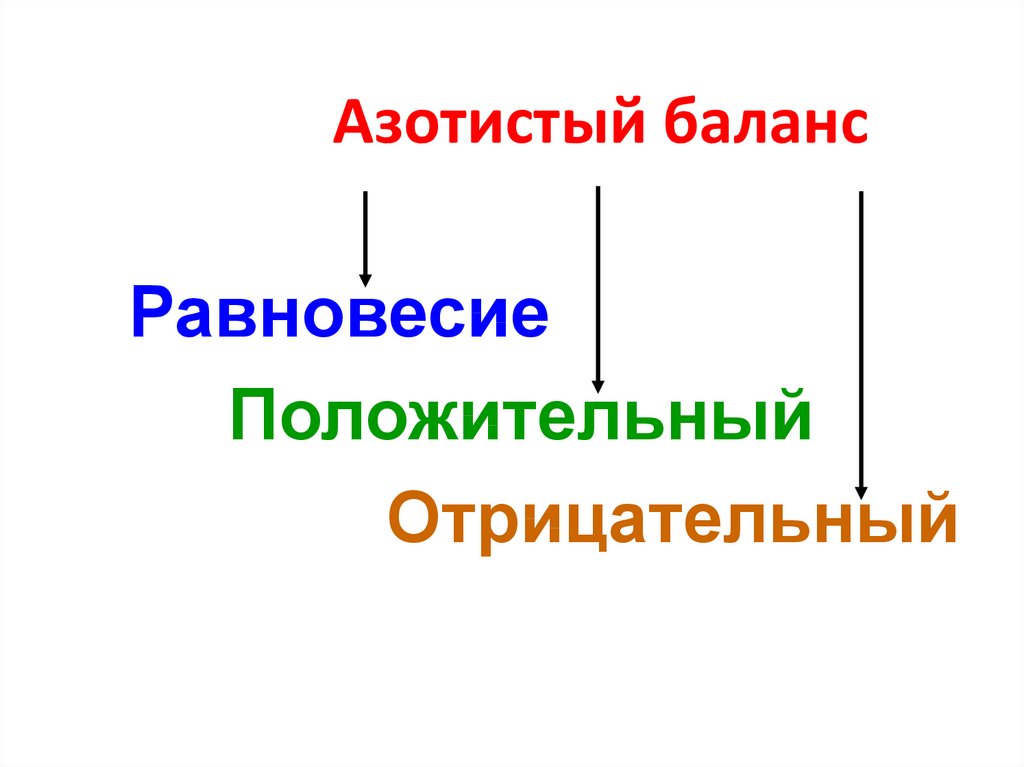
36. Азотистый баланс
РавновесиеПоложительный
Отрицательный
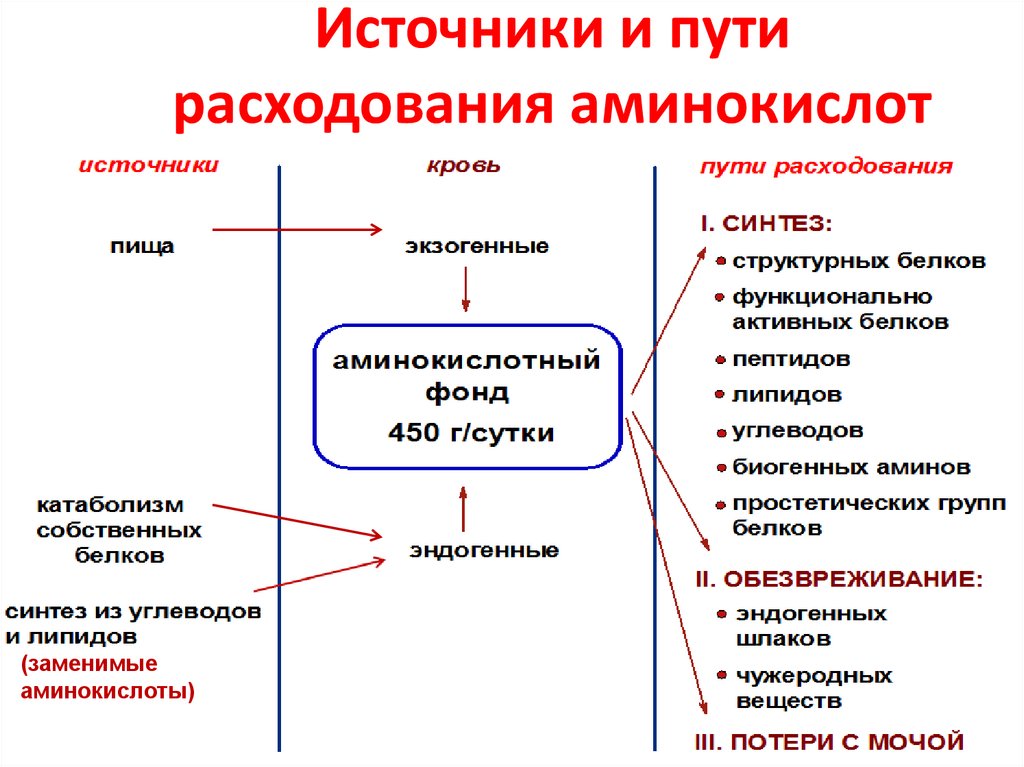
37. Источники и пути расходования аминокислот
(заменимыеаминокислоты)
38. Катепсины –
лизосомальные протеолитическиеферменты (протеиназы),
обеспечивающие распад тканевых
(собственных) белков, рН
оптимум их лежит в кислой среде
39. Потребность в пищевых белках
• 23,2 г/сут – коэффициент Рубнера –«коэффициент изнашивания» (азотистый
баланс отрицательный).
• 30-45 г/сут – «физиологический минимум
белка». Это минимальное количество белка,
позволяющее поддерживать азотистое
равновесие.
• Физиологическая норма – 1-1,2 г белка на кг
массы тела
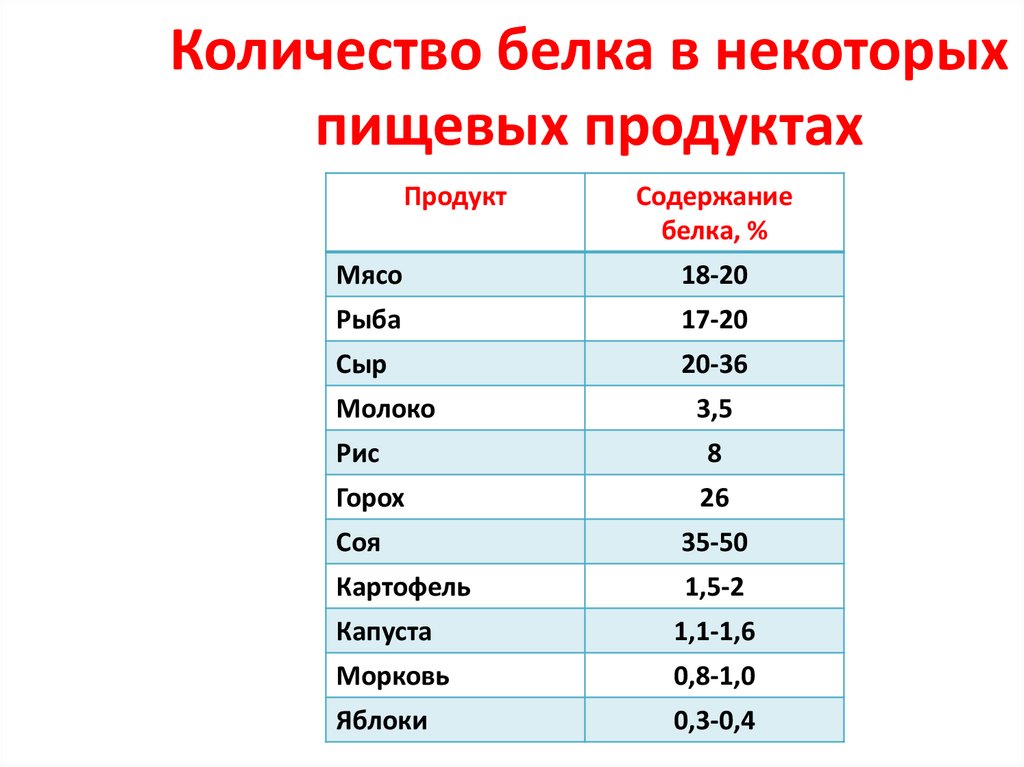
40. Количество белка в некоторых пищевых продуктах
ПродуктСодержание
белка, %
Мясо
18-20
Рыба
17-20
Сыр
20-36
Молоко
3,5
Рис
8
Горох
26
Соя
35-50
Картофель
1,5-2
Капуста
1,1-1,6
Морковь
0,8-1,0
Яблоки
0,3-0,4
41. Заменимые и незаменимые аминокислоты
заменимыеАланин
Аспарагиновая
кислота
Аспарагин
Глицин
Глутаминовая
кислота
незаменимые
заменимые
незаменимые
Аргинин*
Валин
Глутамин
Пролин
Лизин
Метионин
Гистидин*
Изолейцин
Лейцин
Серин
Тирозин
Цистеин
Треонин
Триптофан
Фенилаланин
* - частично заменимые аминокислоты
42. Критерии полноценности пищевого белка
• Белок должен содержать все заменимыеаминокислоты в соотношениях, близких к их
соотношениям в человеческом организме
• Белок должен перевариваться протеиназами
ЖКТ
• Белок не должен содержать веществ,
мешающих перевариванию и усваиванию
43.
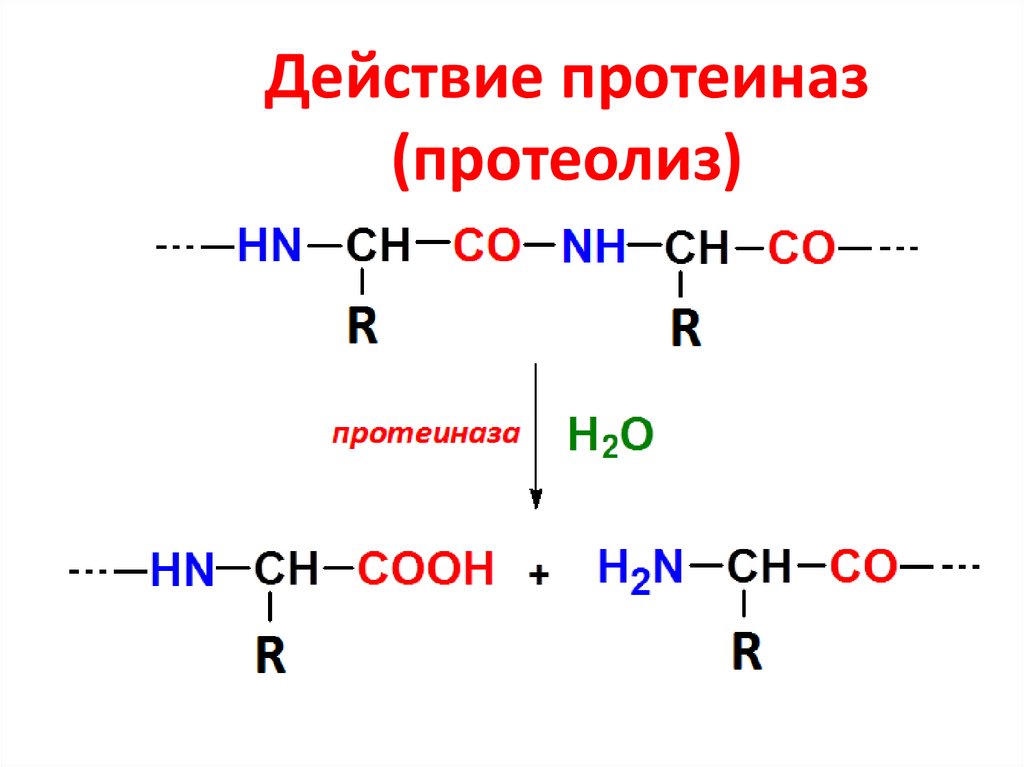
Ферменты,переваривающие белки
(гидролизующие пептидные
связи), называются
протеиназы (пептидазы,
протеазы, протеолитические
ферменты)
44. Действие протеиназ (протеолиз)
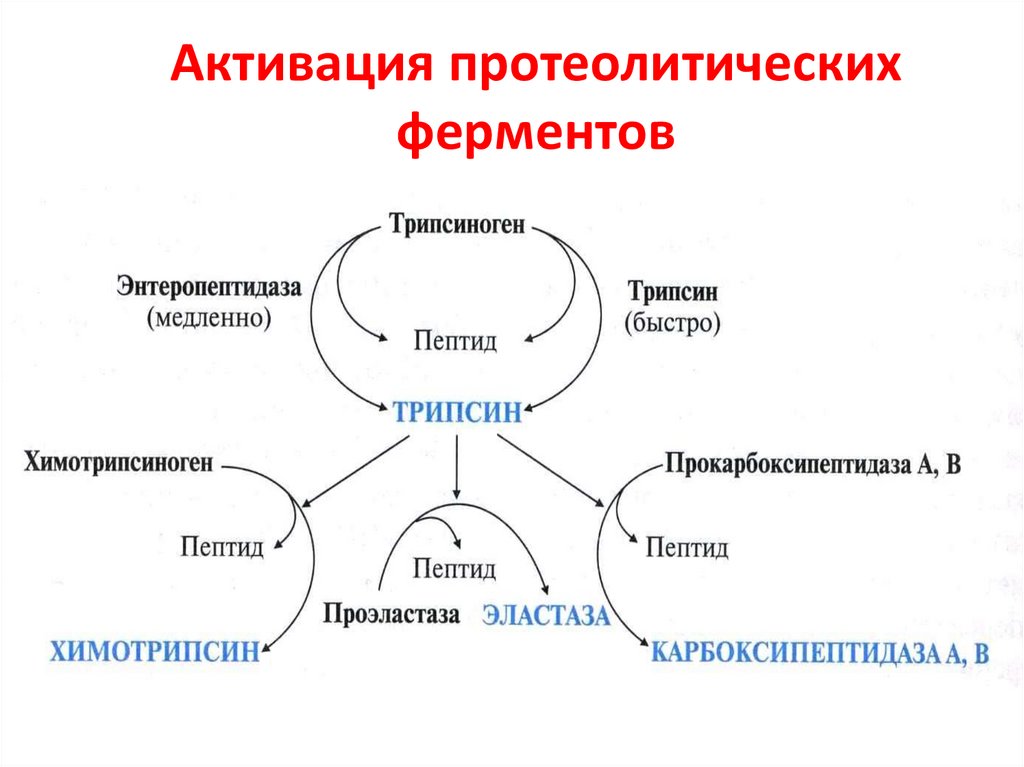
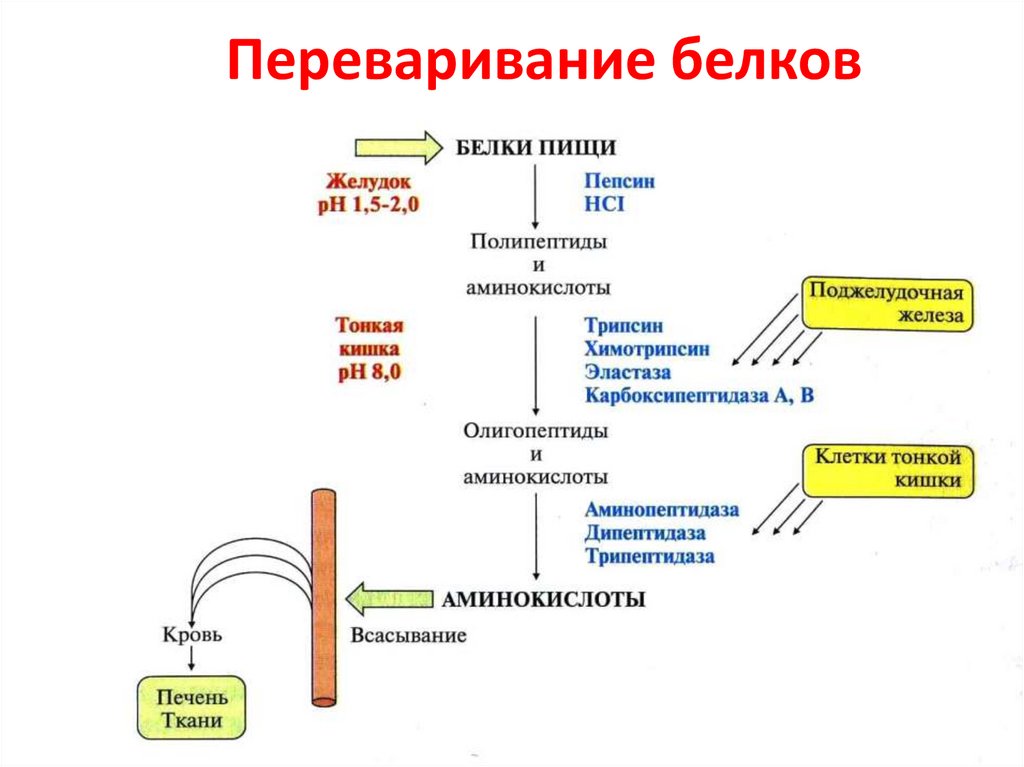
45. Протеиназы ЖКТ
Эндопептидазы ЭкзопептидазыПепсин;
Реннин;
Гастриксин;
Трипсин;
Химотрипсин;
Эластаза.
• Карбоксипептидазы
А и В;
• Аминопептидазы;
• Дипептидазы;
• Трипептидазы.
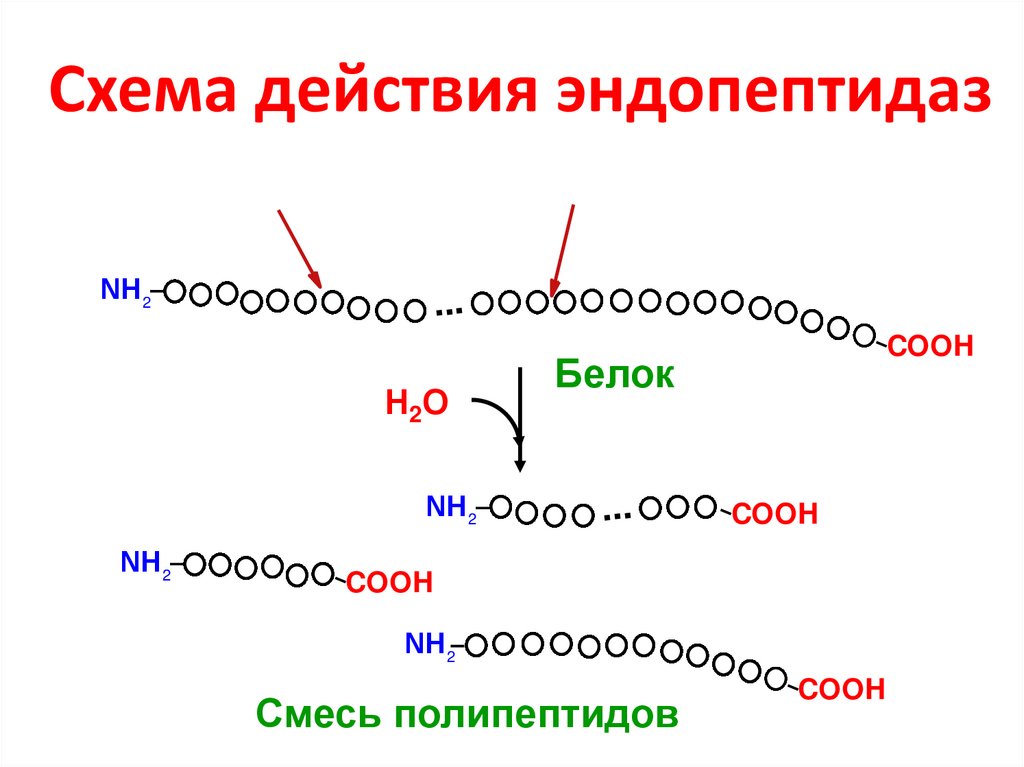
46. Схема действия эндопептидаз
NН 2...
Н2О
NН 2
NН 2
COOH
Белок
...
COOH
COOH
NН 2
Смесь полипептидов
COOH
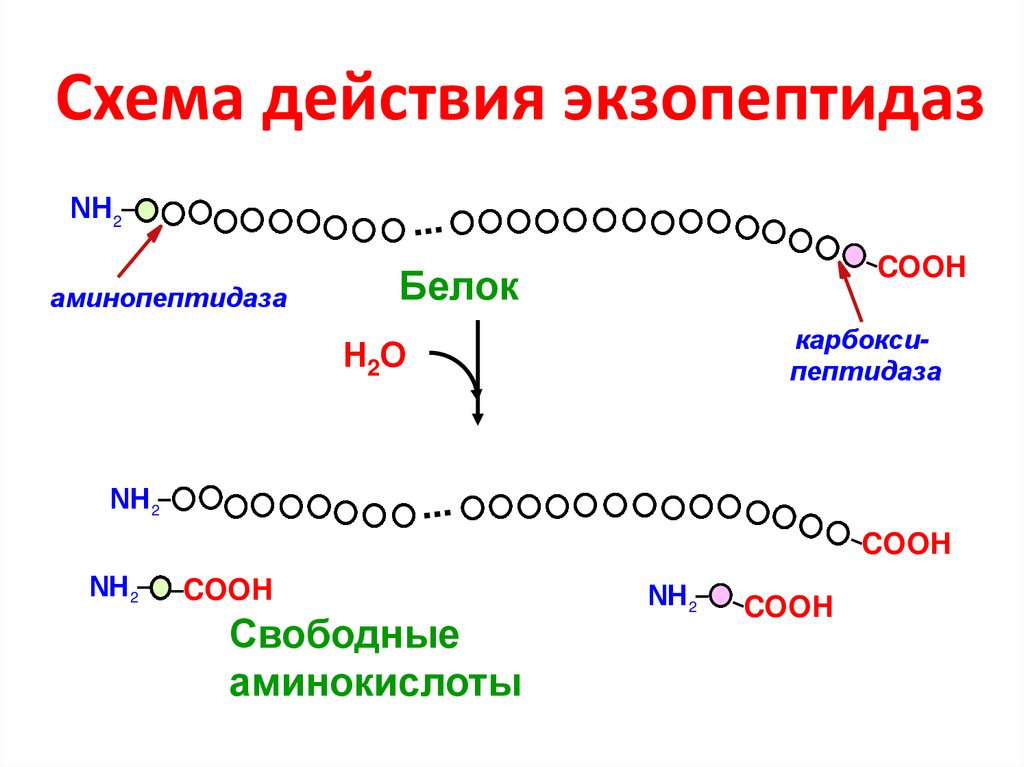
47. Схема действия экзопептидаз
NН 2...
аминопептидаза
COOH
Белок
карбоксипептидаза
Н2О
NН 2
...
COOH
NН 2
COOH
Свободные
аминокислоты
NН 2
COOH
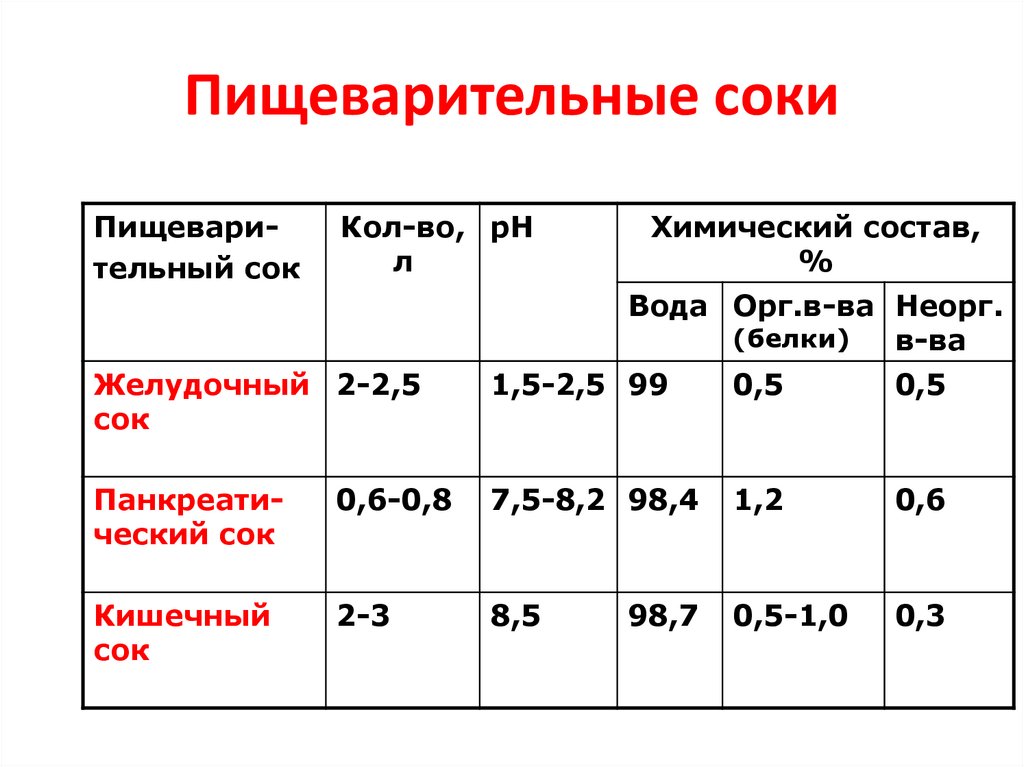
48. Пищеварительные соки
Пищеварительный сокКол-во, рН
л
Химический состав,
%
Вода Орг.в-ва Неорг.
(белки)
в-ва
Желудочный 2-2,5
сок
1,5-2,5 99
0,5
0,5
Панкреатический сок
0,6-0,8
7,5-8,2 98,4
1,2
0,6
Кишечный
сок
2-3
8,5
0,5-1,0
0,3
98,7
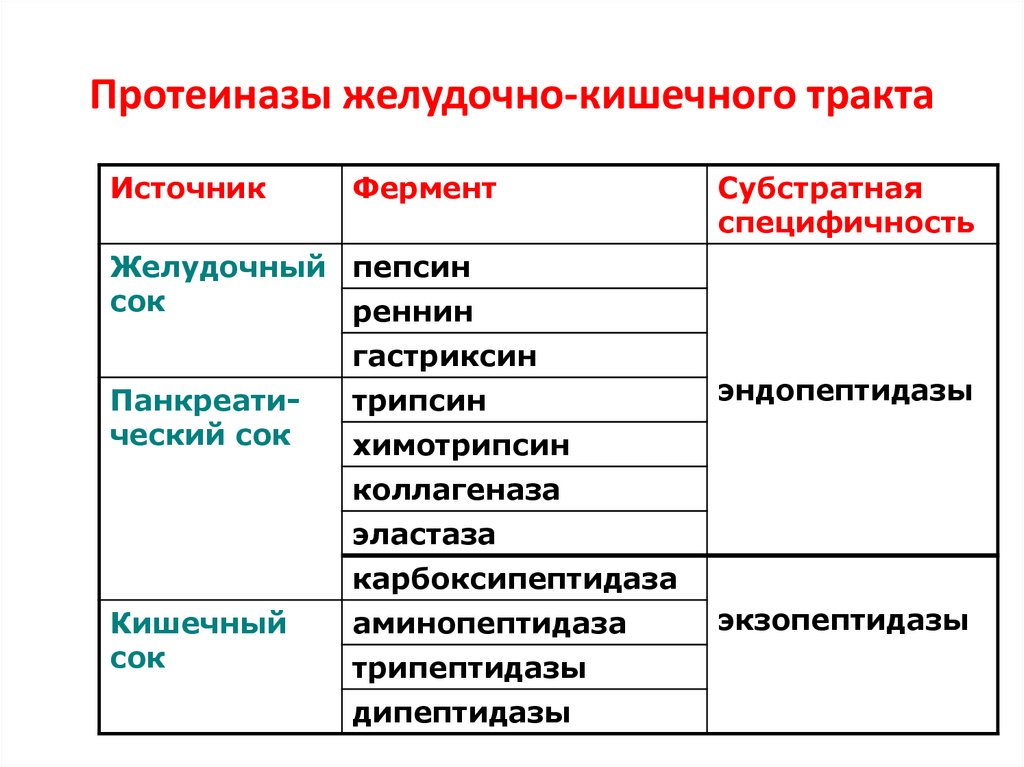
49. Протеиназы желудочно-кишечного тракта
ИсточникФермент
Субстратная
специфичность
Желудочный пепсин
сок
реннин
гастриксин
Панкреатический сок
трипсин
эндопептидазы
химотрипсин
коллагеназа
эластаза
карбоксипептидаза
Кишечный
сок
аминопептидаза
трипептидазы
дипептидазы
экзопептидазы
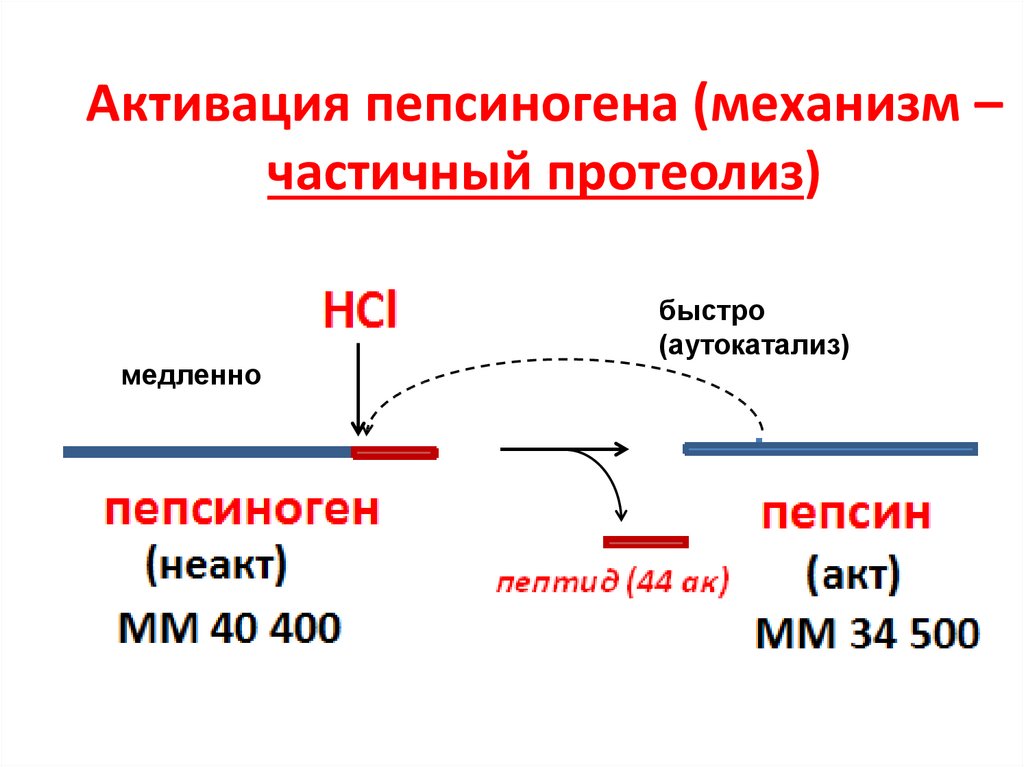
50. Активация пепсиногена (механизм – частичный протеолиз)
медленнобыстро
(аутокатализ)
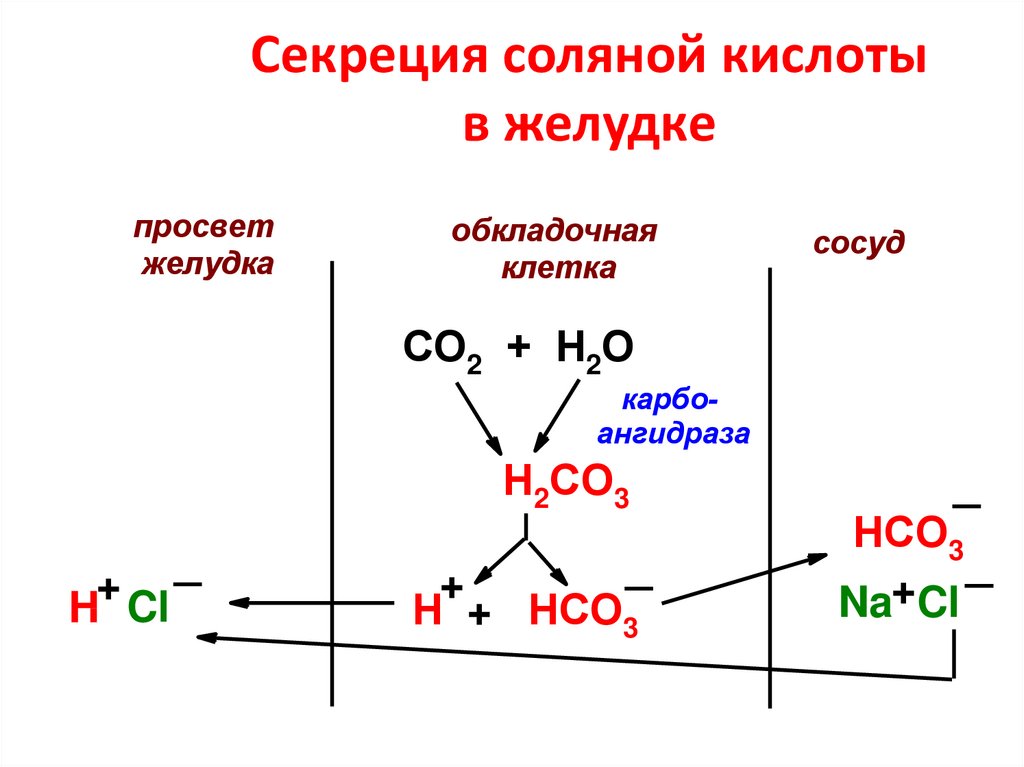
51. Секреция соляной кислоты в желудке
просветжелудка
обкладочная
клетка
сосуд
СО2 + Н2О
карбоангидраза
Н2СО3
+
H Cl
+
Н + НСО3
НСО3
Na+Cl
52. Функции соляной кислоты
1.2.
3.
4.
5.
активация пепсиногена
создание рН-оптимума для пепсина (1,5-2,5)
бактерицидное действие
денатурирует белки
регулирует работу привратника и стимулирует
выработку секретина в кишечнике
6. активирует всасывание железа
7. обеспечивает всасывание витамина В12 (участвует
с синтезе белкового фактора Кастла –
антианемического)
53. Виды кислотности желудочного сока
• Общая кислотность (НСl + прочиекислые вещества – кислые соли,
органические кислоты) 40-60 ммоль/л
• Соляная кислота:
– Свободная 20-40 ммоль/л
– Связанная (с ионогенными группами белков) –
СООН + -NH3Сl 10-12 ммоль/л
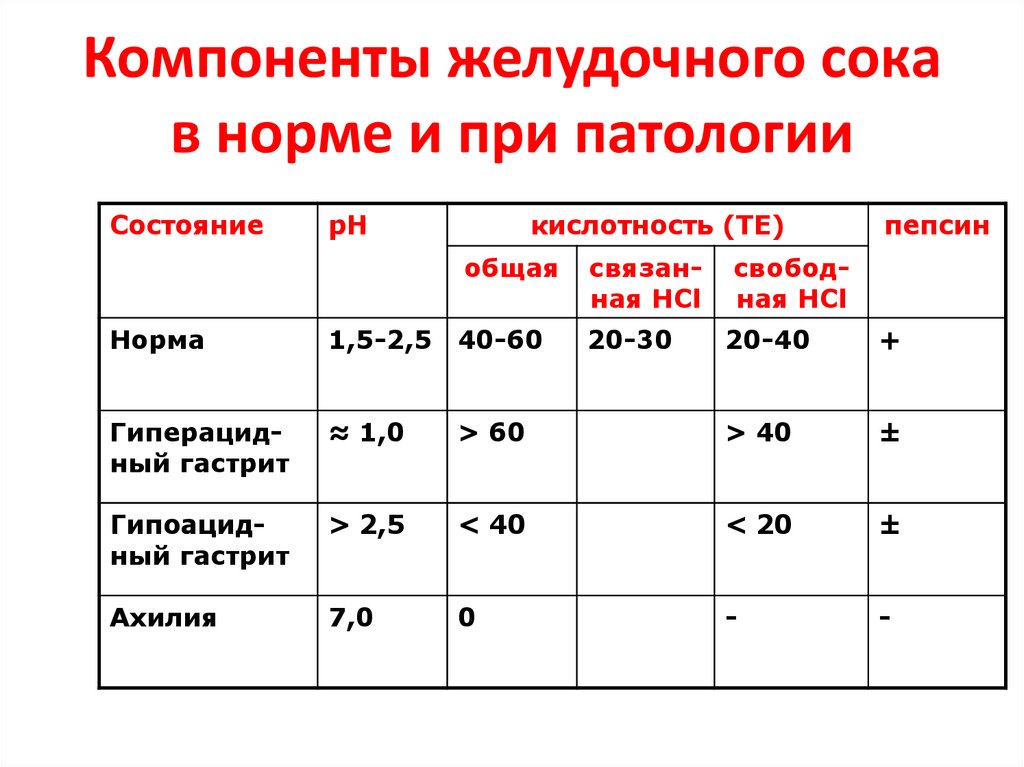
54. Компоненты желудочного сока в норме и при патологии
СостояниерН
кислотность (ТЕ)
общая
Норма
1,5-2,5 40-60
Гиперацидный гастрит
≈ 1,0
Гипоацидный гастрит
Ахилия
связанная НСl
20-30
пепсин
свободная HCl
20-40
+
> 60
> 40
±
> 2,5
< 40
< 20
±
7,0
0
-
-
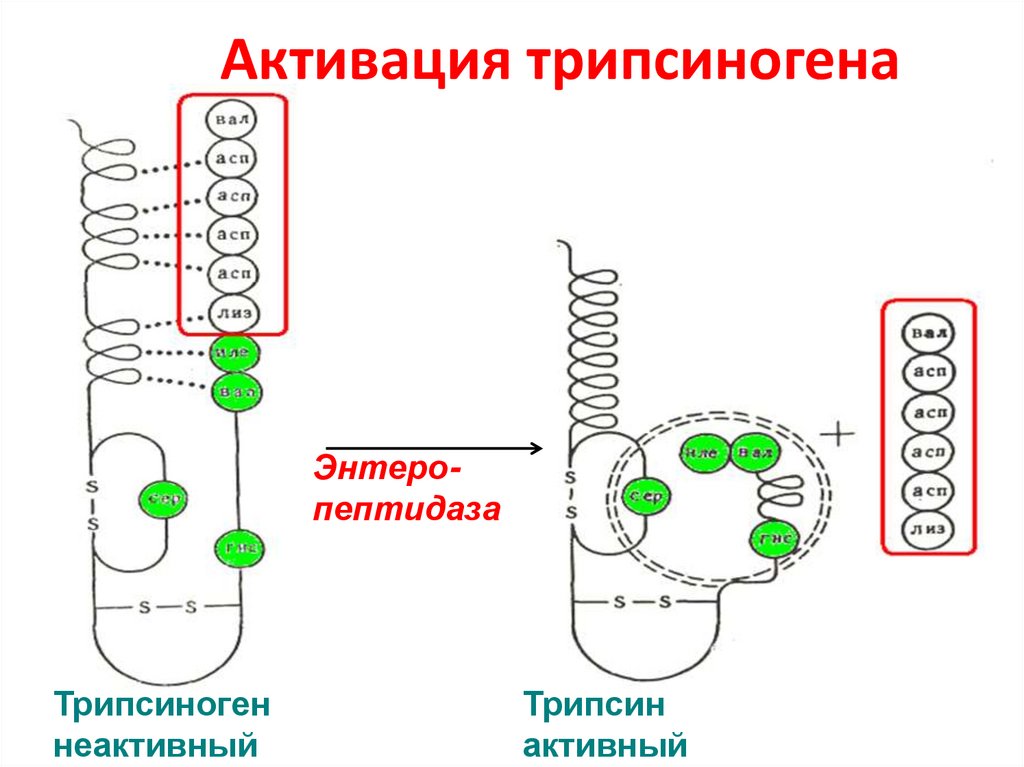
55. Активация трипсиногена
ЭнтеропептидазаТрипсиноген
неактивный
Трипсин
активный
56. Активация протеолитических ферментов
57. Биологический смысл синтеза проферментов –
защита тканейпищеварительных желёз от
самопереваривания
(аутолиза)
58. Переваривание белков
59.
РЕГУЛЯЦИЯ ПРОЦЕССОВПЕРЕВАРИВАНИЯ БЕЛКОВ
ГОРМОН
ГАСТРИН
ЭНТЕРОГАСТРОН
СЕКРЕТИН
МЕСТО
ВЫРАБОТКИ
ПИЛОРИЧЕСКАЯ
ЧАСТЬ ЖЕЛУДКА
12-ПЕРСТНАЯ
КИШКА
12-ПЕРСТНАЯ
КИШКА, ТОЩАЯ
ХОЛЕЦИСТОКИНИН
ТОНКИЙ
КИШЕЧНИК
ВАЗОАКТИВНЫЙ
ИНТЕСТЕНАЛЬНЫЙ ПЕПТИД
(ВИП)
ПАНКРЕОТИЧЕС КИЙ ПОЛИПЕПТИД
(ПП)
ТОНКИЙ
КИШЕЧНИК
ТОНКИЙ
КИШЕЧНИК
БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
УСИЛИВАЕТ СИНТЕЗ СОЛЯНОЙ
КИСЛОТЫ
ТОРМОЗИТ ВЫРАБОТКУ НСI И
ПЕПСИНА
УСИЛИВАЕТ СИНТЕЗ
БИКАРБОНАТОВ И ЖИДКОЙ
ЧАСТИ ПАНКРЕАТИЧЕСКОГО
СОКА
УСИЛИВАЕТ СИНТЕЗ
ПАНКРЕОТИЧЕСКИХ
ФЕРМЕНТОВ
СТИМУЛИРУЕТ СИНТЕЗ
БИКАРБОНАТОВ ВЫРАБОТКУ
ЖЕЛЧИ, ТОРМОЗИТ ДЕЯТЕЛЬНОСТЬ ЖЕЛУДОЧНЫХ ЖЕЛЕЗ
ТОРМОЗИТ ВЫРАБОТКУ ПАНКРЕАТИЧЕСКИХ
ФЕРМЕНТОВ
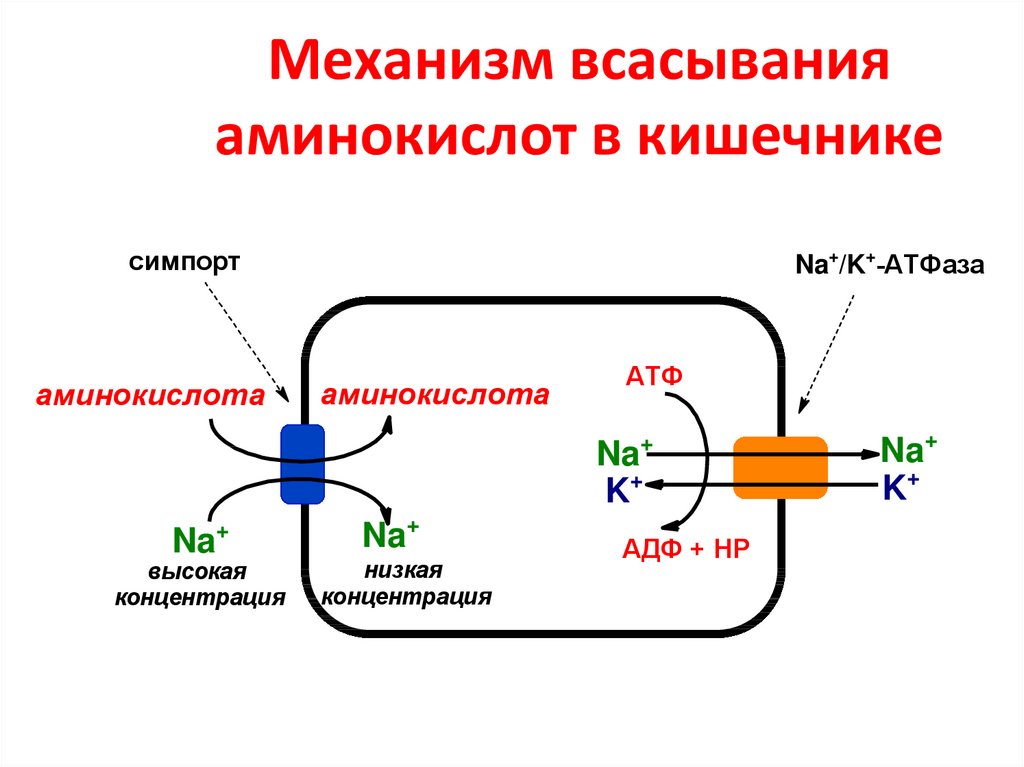
60. Механизм всасывания аминокислот в кишечнике
симпортаминокислота
Na+/K+-АТФаза
аминокислота
АТФ
Na+
K+
Na
+
высокая
концентрация
Na+
низкая
концентрация
АДФ + НР
Na+
K+
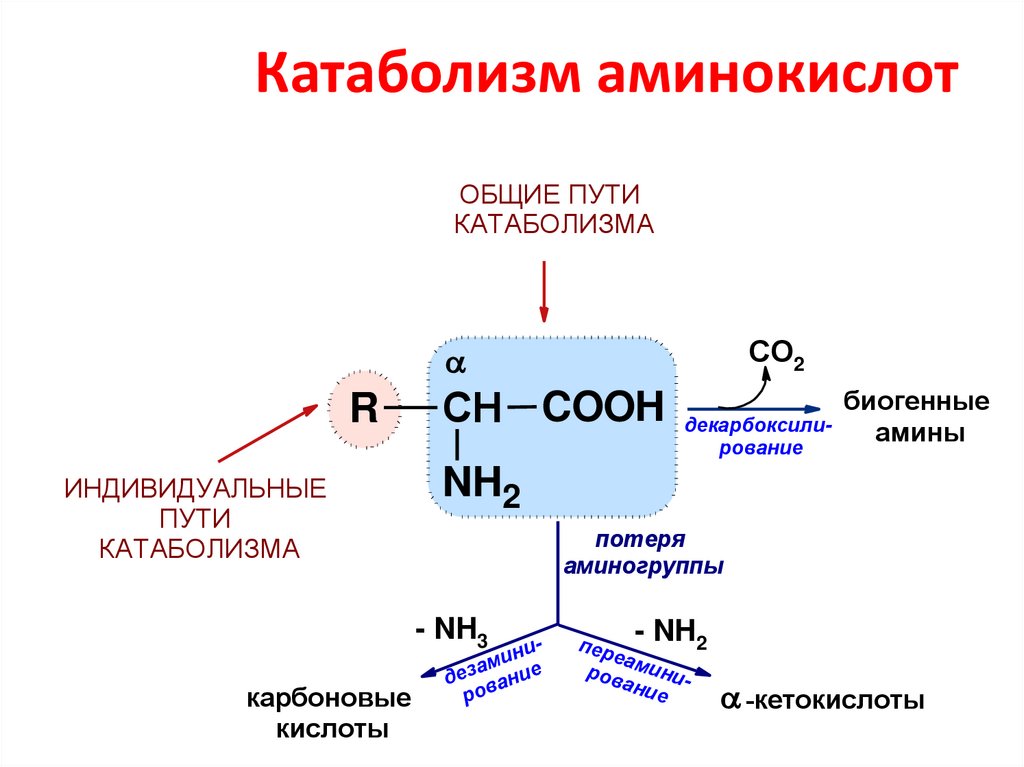
61. Катаболизм аминокислот
ОБЩИЕ ПУТИКАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
ПУТИ
КАТАБОЛИЗМА
СН COOH
биогенные
амины
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
декарбоксилирование
нии
м
а
дез вание
ро
- NH2
п ер
еа
ров миниани
е
-кетокислоты
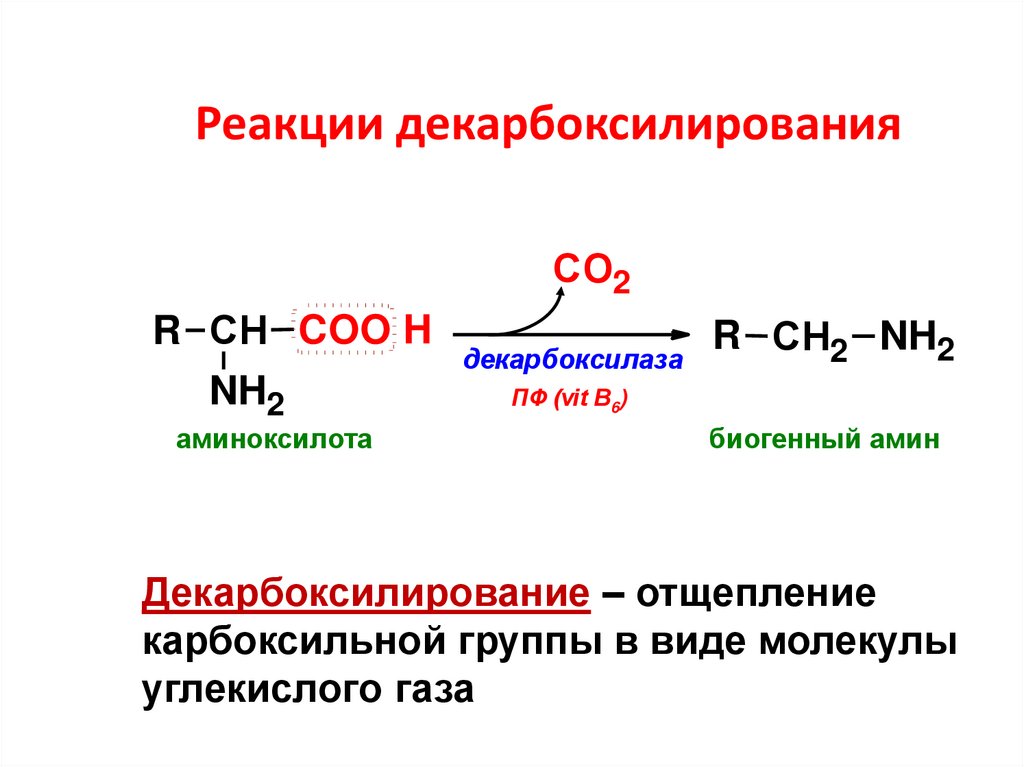
62. Реакции декарбоксилирования
СО2R СН COO H
NH2
аминоксилота
декарбоксилаза
R СН2 NH2
ПФ (vit B6)
биогенный амин
Декарбоксилирование – отщепление
карбоксильной группы в виде молекулы
углекислого газа
63. Биологическая роль реакций декарбоксилирования –
образование биогенных аминов,которые могут быть:
1. Гормонами
2. Нейромедиаторами
3. Входить в состав более сложных
структур
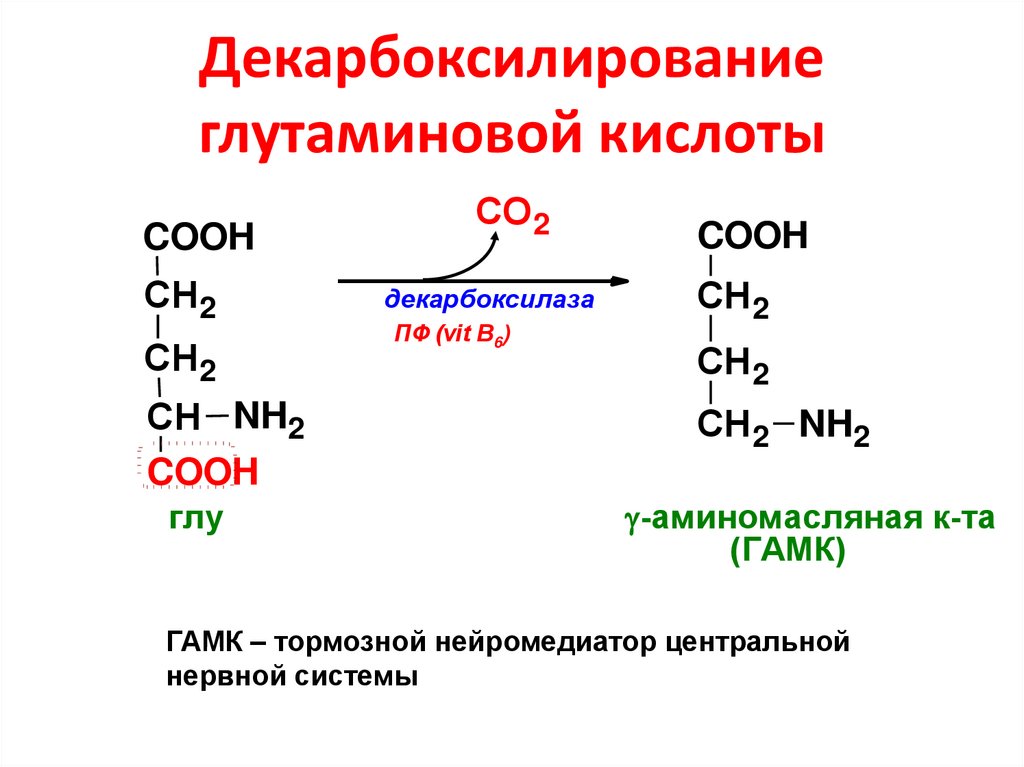
64. Декарбоксилирование глутаминовой кислоты
COOHСН2
СН2
СН NH2
COOH
глу
СО 2
декарбоксилаза
ПФ (vit B6)
COOH
СН2
СН2
СН2 NH2
-аминомасляная к-та
(ГАМК)
ГАМК – тормозной нейромедиатор центральной
нервной системы
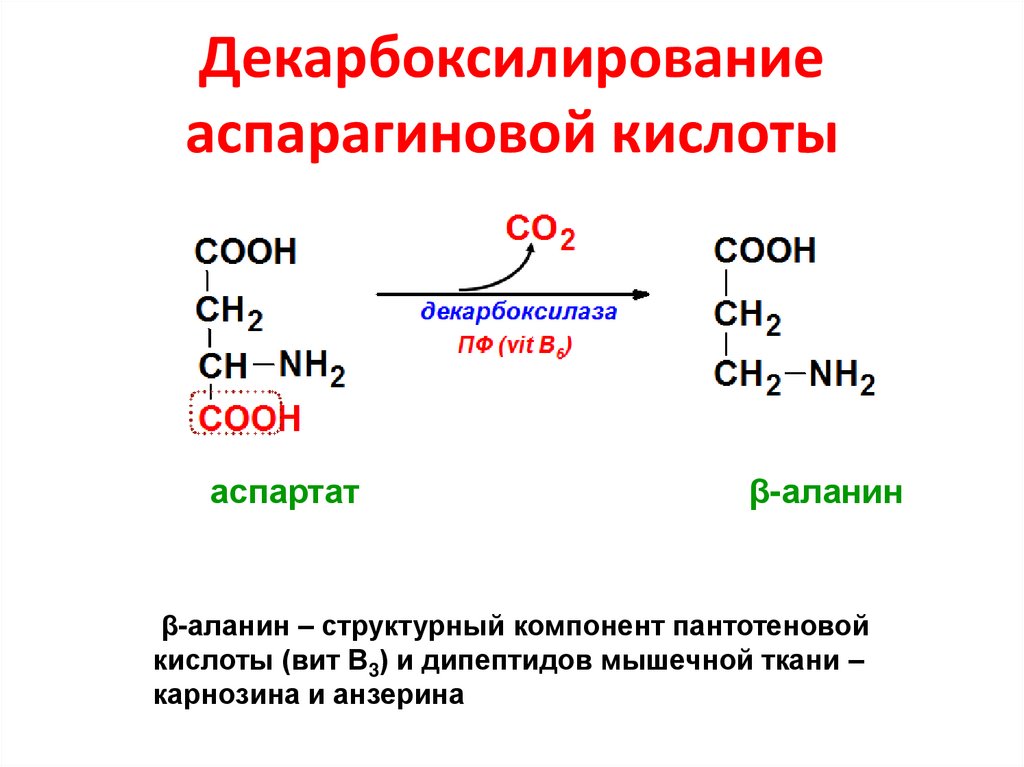
65. Декарбоксилирование аспарагиновой кислоты
аспартатβ-аланин
β-аланин – структурный компонент пантотеновой
кислоты (вит В3) и дипептидов мышечной ткани –
карнозина и анзерина
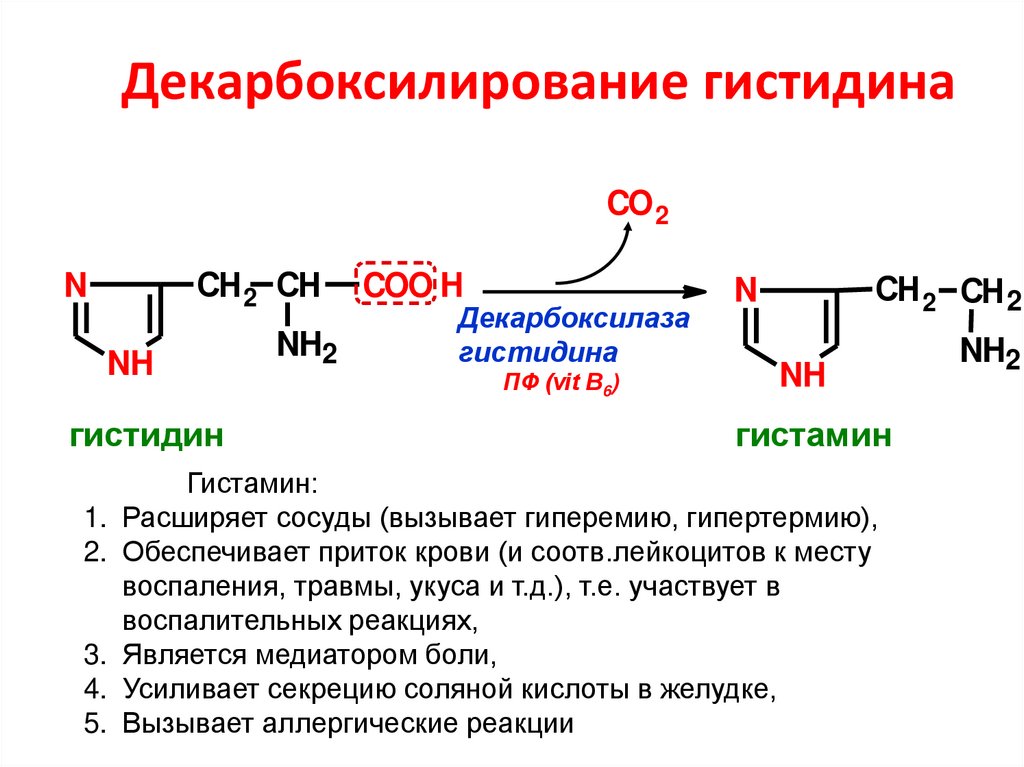
66. Декарбоксилирование гистидина
CO 2СН 2 СН
N
NH
гистидин
1.
2.
3.
4.
5.
NH2
COO H
Декарбоксилаза
гистидина
ПФ (vit B6)
СН 2 СН 2
N
NH
гистамин
Гистамин:
Расширяет сосуды (вызывает гиперемию, гипертермию),
Обеспечивает приток крови (и соотв.лейкоцитов к месту
воспаления, травмы, укуса и т.д.), т.е. участвует в
воспалительных реакциях,
Является медиатором боли,
Усиливает секрецию соляной кислоты в желудке,
Вызывает аллергические реакции
NH2
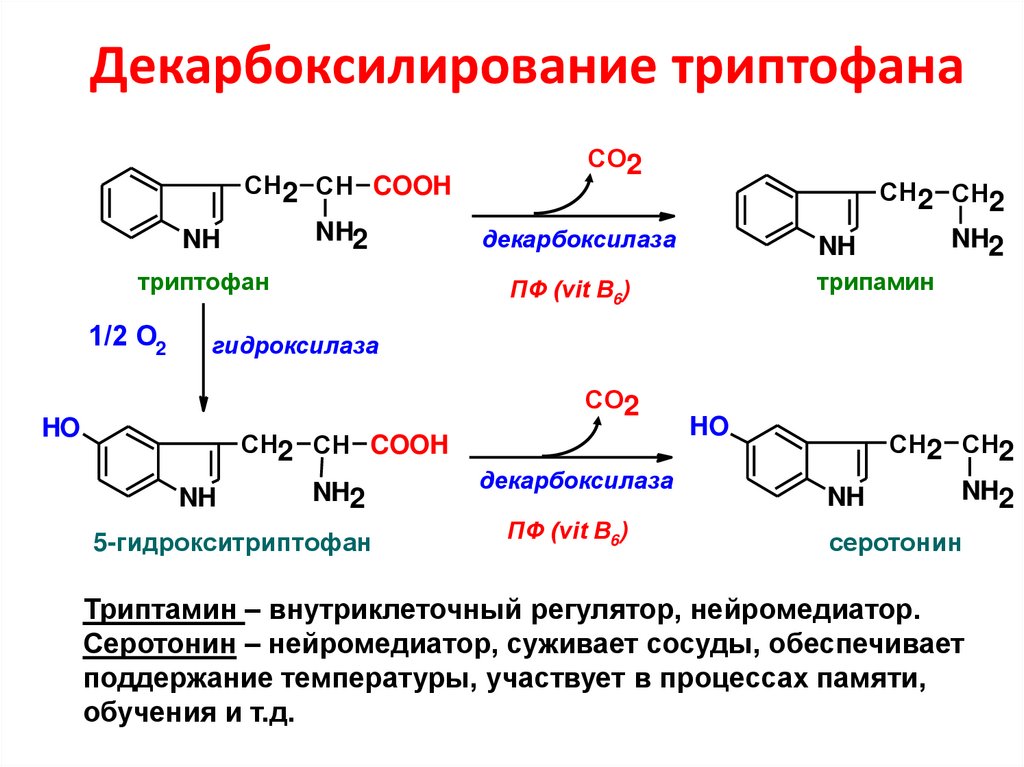
67. Декарбоксилирование триптофана
СН2 СН COOHNH2
NH
триптофан
1/2 О2
СО2
СН2 СН2
декарбоксилаза
NH2
NH
трипамин
ПФ (vit B6)
гидроксилаза
СО2
HO
СН2 СН COOH
NH
NH2
5-гидрокситриптофан
декарбоксилаза
ПФ (vit B6)
HO
СН2 СН2
NH
NH2
серотонин
Триптамин – внутриклеточный регулятор, нейромедиатор.
Серотонин – нейромедиатор, суживает сосуды, обеспечивает
поддержание температуры, участвует в процессах памяти,
обучения и т.д.
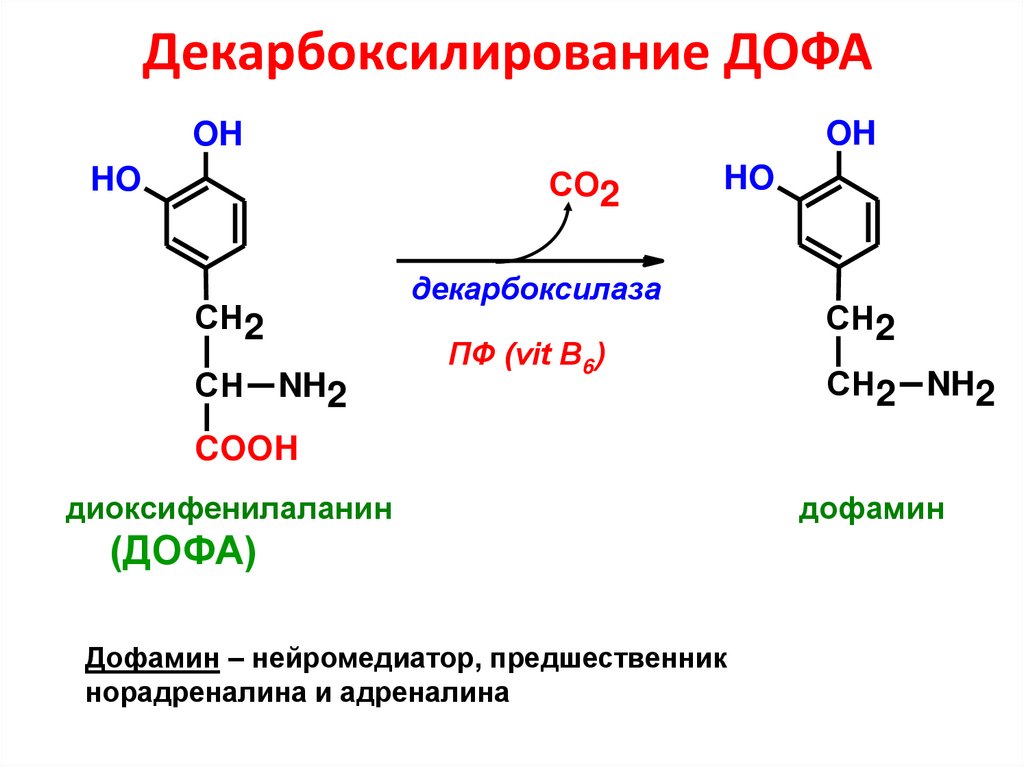
68. Декарбоксилирование ДОФА
OHOH
СО2
HO
декарбоксилаза
СН2
СН
HO
NH2
ПФ (vit B6)
СН2
СН2 NH2
COOH
диоксифенилаланин
(ДОФА)
Дофамин – нейромедиатор, предшественник
норадреналина и адреналина
дофамин
69.
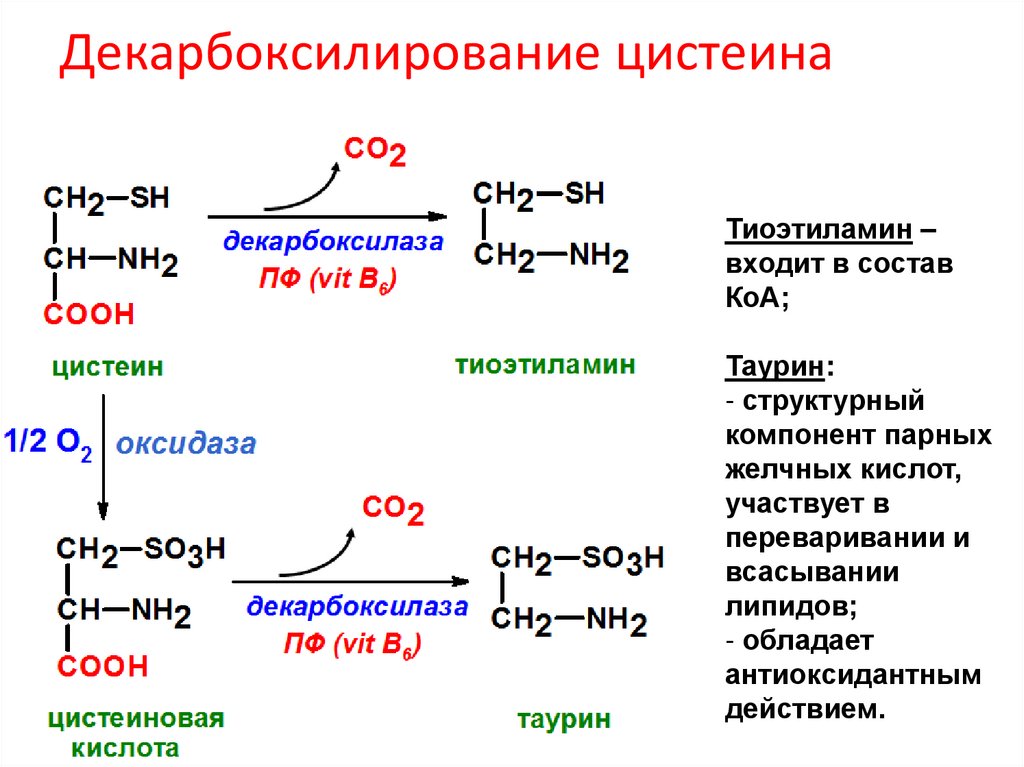
Декарбоксилирование цистеинаТиоэтиламин –
входит в состав
КоА;
Таурин:
- структурный
компонент парных
желчных кислот,
участвует в
переваривании и
всасывании
липидов;
- обладает
антиоксидантным
действием.
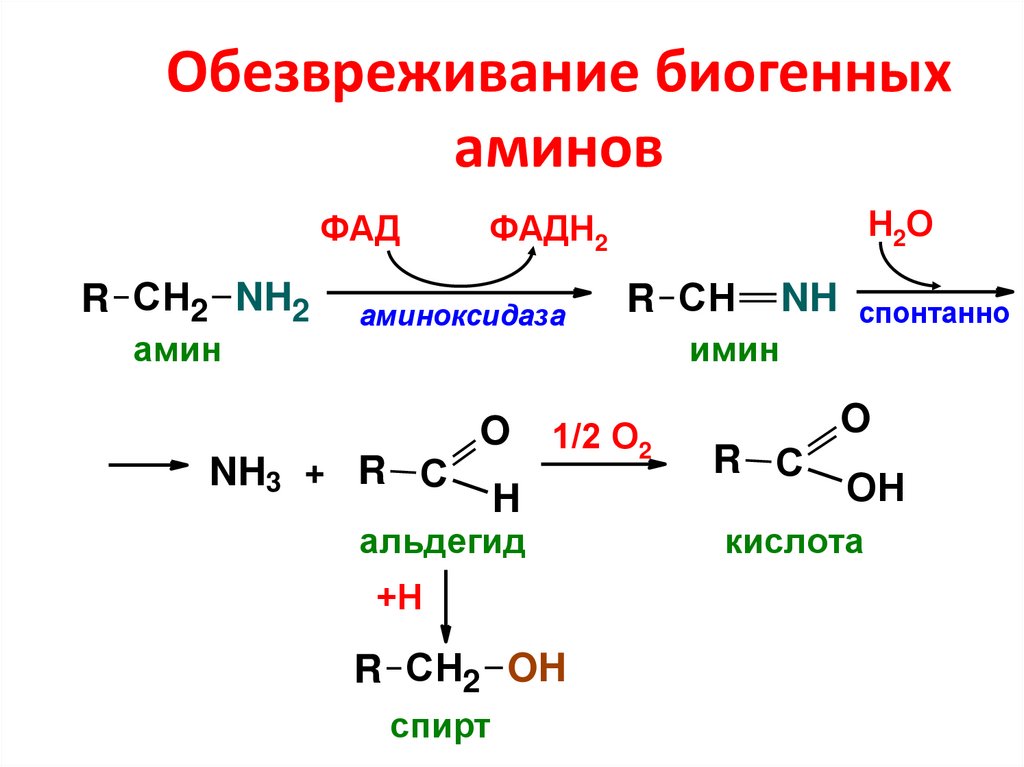
70. Обезвреживание биогенных аминов
ФАДR СН2 NH2
амин
аминоксидаза
NH3 + R С
Н2О
ФАДН2
O
1/2 О2
H
альдегид
+Н
R СН2 OH
спирт
R СН
NH
имин
спонтанно
O
R С
ОН
кислота
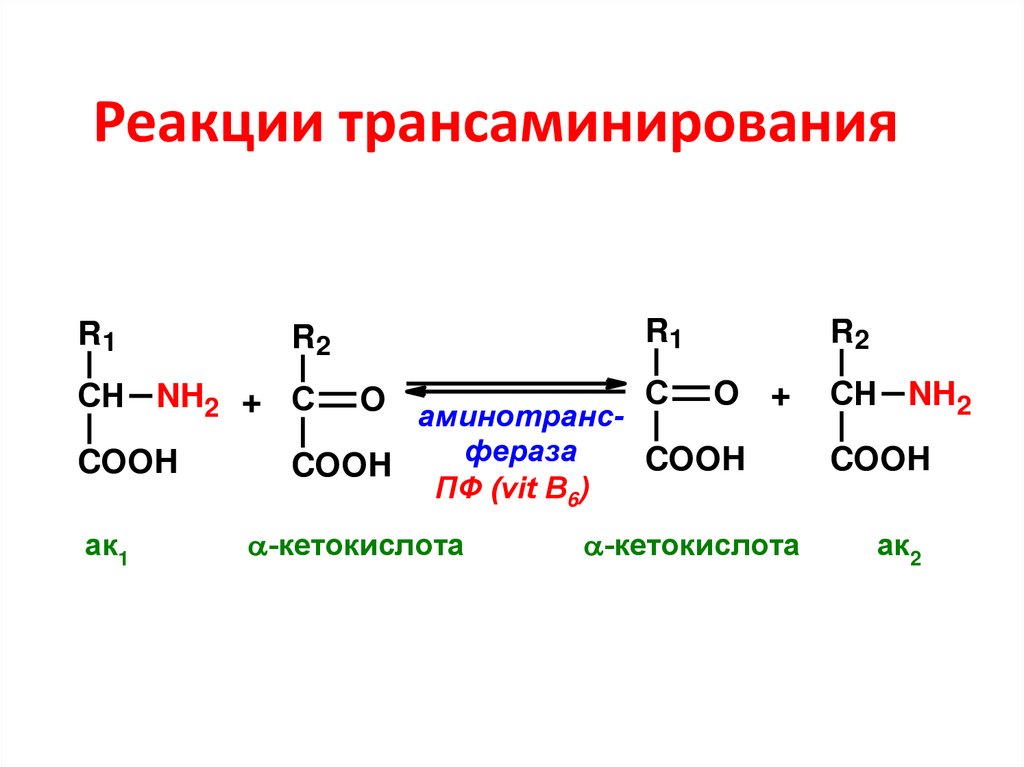
71. Реакции трансаминирования
R1R1
R2
O аминотранс- С O +
фераза
COOH
COOH
R2
СН NH2 + С
СН NH2
COOH
COOH
ак1
ПФ (vit B6)
-кетокислота
-кетокислота
ак2
72. Вещества, участвующие в трансаминировании:
• Аминокислоты – практически все, крометреонина, лизина и пролина, но особенно
активны глу, асп, ала;
• Кетокислоты – только три – ПВК, ЩУК и α-КГ
• ПФ – активная форма витамина В6
Ферменты – трансаминазы, или
аминотрансферазы, специфичны к
донорно-акцепторной паре
73. Роль пиридоксальфосфата в трансаминировании – является промежуточным переносчиком аминогруппы (первичным акцептором)
74. Биологическая роль трансаминирования
• Путь синтеза заменимых аминокислот• Путь перераспределения азота без
образования токсичного аммиака
• Путь пополнения энергетического
материала (образование субстратов
окислительного декарбоксилирования
ПВК и ЦТК)
75. Реакции трансаминирования
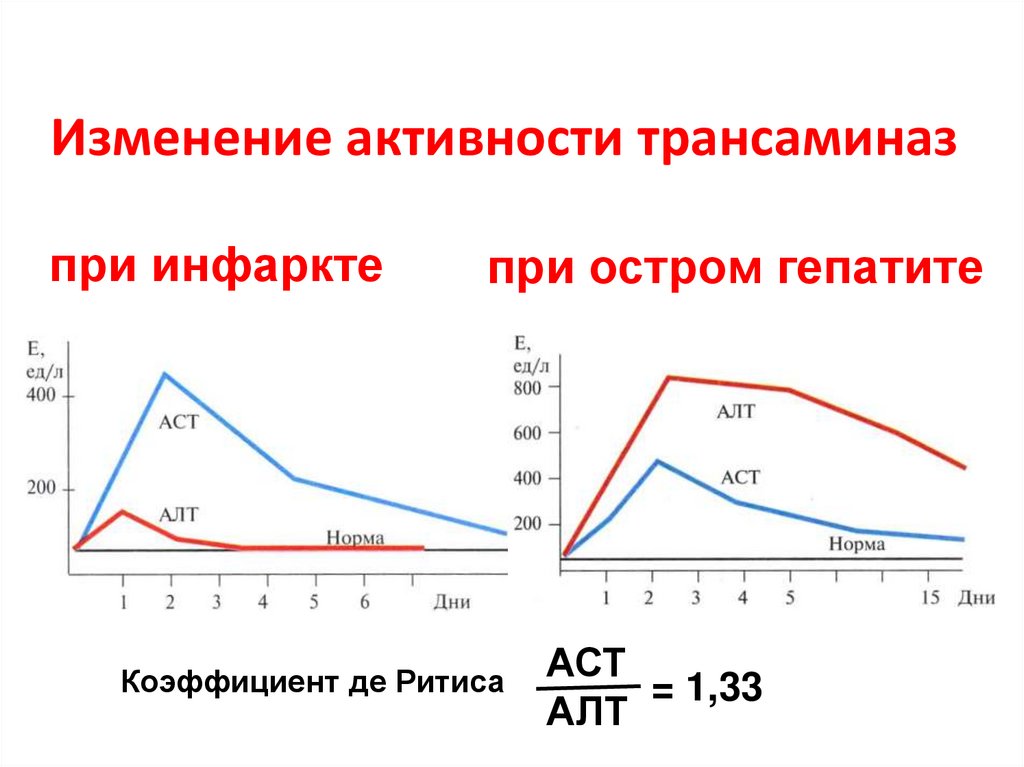
76. Изменение активности трансаминаз
при инфарктепри остром гепатите
Коэффициент де Ритиса
АСТ
= 1,33
АЛТ
77. Типы реакций дезаминирования
Дезаминирование – отщеплениеаминогруппы в виде молекулы аммиака
Восстановительное
Гидролитическое
Внутримолекулярное
Окислительное
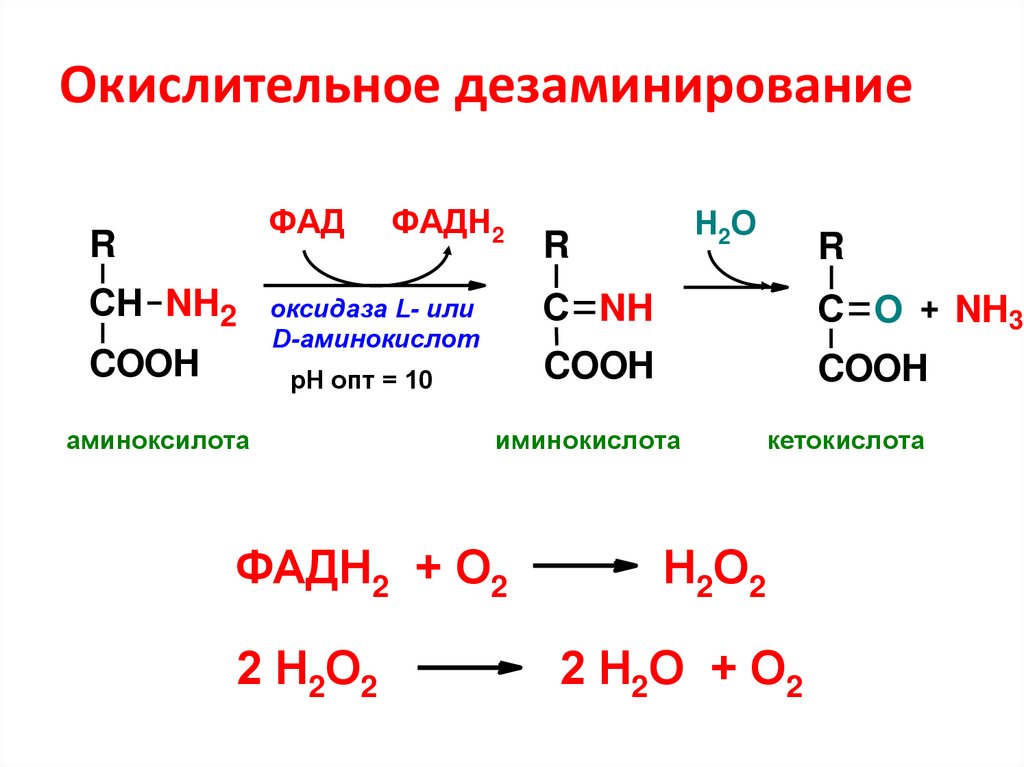
78. Окислительное дезаминирование
ФАДR
СН NH2
COOH
ФАДН2
оксидаза L- или
D-аминокислот
рН опт = 10
аминоксилота
R
R
С NH
С O + NH3
COOH
COOH
иминокислота
ФАДН2 + О2
2 Н2О2
Н2О
кетокислота
Н2О2
2 Н2О + О2
79. Окислительное дезаминирование глутамата
COOHCH2
CH2
СН NH2
COOH
глутамат
+
НАД
НАДН + Н
глутаматдегидрогеназа
рН опт ≈ 7
+
COOH
COOH
Н2О
CH2
CH2
С
NH
Н2О
COOH
-иминоглутарат
НАДН+Н+ ----→ 3 АТФ
CH2
+ NH3
CH2
С
O
COOH
-кетоглутарат
80. Отличия и роль процесса дезаминирования глутамата
• Глутаматдегидрогеназа активна прифизиологических значениях рН;
• Глутаматдегидрогеназа обладает обратимостью
действия (обратный процесс –
восстановительное аминирование – путь
обезвреживания аммиака);
• Глутаматдегидрогеназа в качестве кофермента
имеет НАД (а не ФАД)
• Восстановленный НАД – источник 3 молекул
АТФ в дыхательной цепи.
81. Непрямое дезаминирование (трансдезаминирование) аминокислот
1. трансаминированиеАК + α-КГ
трансаминаза
глутамат + α-кетокислота
2. дезаминирование глутамата
глутамат
АК
ГДГ
α-КГ + NH3
α-кетокислота
+ NH3































 Биология
Биология








