Похожие презентации:
Введение в протеомику
1. ВВЕДЕНИЕ В ПРОТЕОМИКУ
Лекция 1Янцевич Алексей Викторович
Протеомика , БГУ 2015
2. План курса
Структурно-функциональные основы протеомикиМетоды разделения белков:
хроматография
электрофорез
Методы идентификации белков
Масс-спектрометрия
Методы установления пространственной структуры
белков
Базы данных в протеомике
Интерактомика и протеомика
Клиническая протеомика
3. Литература к курсу
№№п/п
Список литературы
Год издания
Основная (ЛО)
1.
2.
3.
Нолтинг Б. Новейшие методы исследования биосистем.
Филиппович, Ю.Б. Основы биохимии
Финкельштейн, А.В., Птицын, О.Б. Физика белка: Курс лекций с цветными
и стереоскопическими иллюстрациями и задачами.
2005
1999
2005
4.
Twyman, R.M. (2004). Principles Of Proteomics (Advanced Text Series).
2004
5.
Naven T, Westermeier R. (2002). Proteomics in Practice: A Laboratory Manual of
Proteome Analysis.
2002
6.
Wilkins, M.R., Williams, K.L., Appel R.D., Hochstrasser D.F. (1997). Proteome
Research: New Frontiers in Functional Genomics (Principles and Practice).
1997
7.
Palzkill, T. Proteomics
2002
1.
Дополнительная (ЛД)
Vikas Dhingraa, Mukta Gupta, Tracy Andacht and Zhen F. Fu (2005). "New
frontiers in proteomics research: A perspective". International Journal of
Pharmaceutics
1983
4. План лекции
1. Многообразие белков2. Строение и функционирование белков в
клетке
3. Предпосылки возникновения протеомики
4. Протеомика как постгеномная дисциплина
5. Инструментарий протеомики
6. Приложения протеомики
5.
1. Многообразие белковых соединенийБелки различаются по:
СТРУКТУРЕ,
СВОЙСТВАМ
ФУНКЦИЯМ
6.
Структура белковАминокислотная
последовательность
Вторичная структура
Третичная структура
Четвертичная структура
7.
Свойства белковБелки различаются:
По размеру
По заряду (изоэлектрической точке)
По растворимости в воде
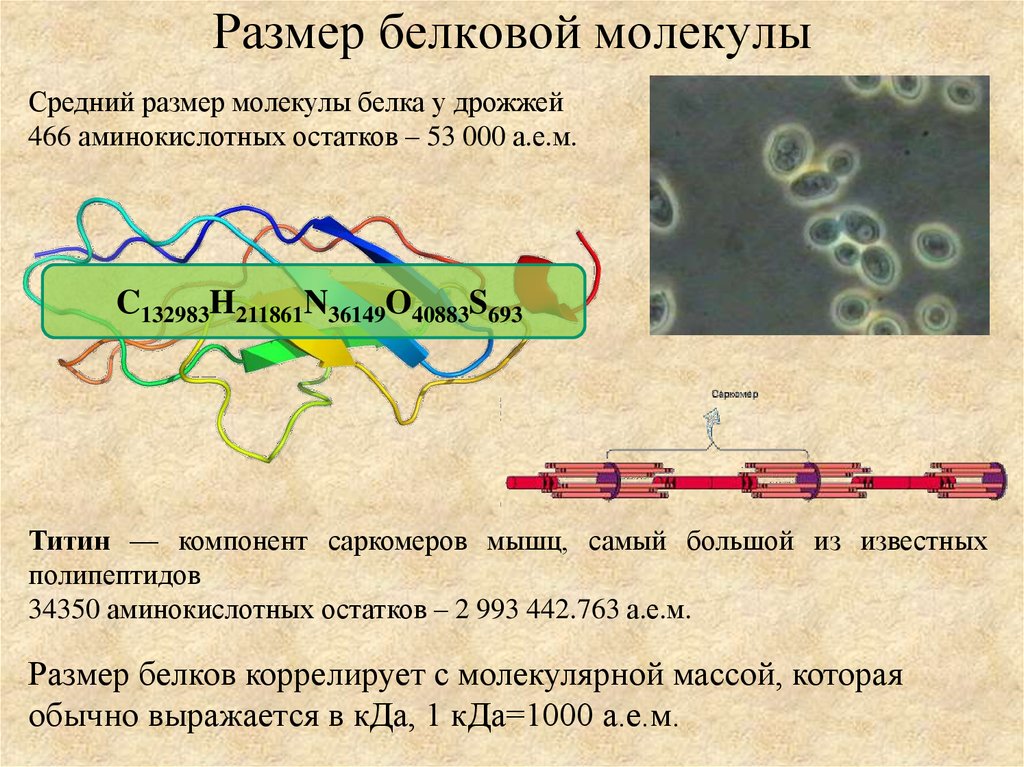
8. Размер белковой молекулы
Средний размер молекулы белка у дрожжей466 аминокислотных остатков – 53 000 а.е.м.
C132983H211861N36149O40883S693
Титин — компонент саркомеров мышц, самый большой из известных
полипептидов
34350 аминокислотных остатков – 2 993 442.763 а.е.м.
Размер белков коррелирует с молекулярной массой, которая
обычно выражается в кДа, 1 кДа=1000 а.е.м.
9. Заряд белковой молекулы
Белки - амфотерные полиэлектролитыЗаряд определяется двумя параметрами:
рН среды и изоэлектрическая точка
Изоэлектрическая точка
в основном - 5,5 до 7,0,
значения лежат в экстремальных областях для специализированных
белков:
пепсин - pI ~ 1, желудочный сок
сальмин - pI ~ 12, протамин молок лосося (высокое содержание аргинина)
Белки, связывающиеся с нуклеиновыми кислотами за счёт
электростатического взаимодействия с фосфатными остатками
нуклеиновых кислот, часто являются основными белками.
Примером таких белков служат гистоны и протамины.
10. Растворимость в воде
Большинство белков – растворимы в воде.• Нерастворимые белки: кератин и фиброин.
гидрофильные и гидрофобные.
• Гидрофильные – большинство белков цитоплазмы, ядра и межклеточного
вещества, в т.ч. нерастворимые кератин и фиброин.
• Гидрофобные - большинство белков, входящих в состав биологических
мембран интегральных мембранных белков, которые взаимодействуют с
гидрофобными липидами мембраны (есть и небольшие гидрофильные
участки).
• Для извлечения гидрофобных белков из мембраны используют метод
солюбилизации детергентами.
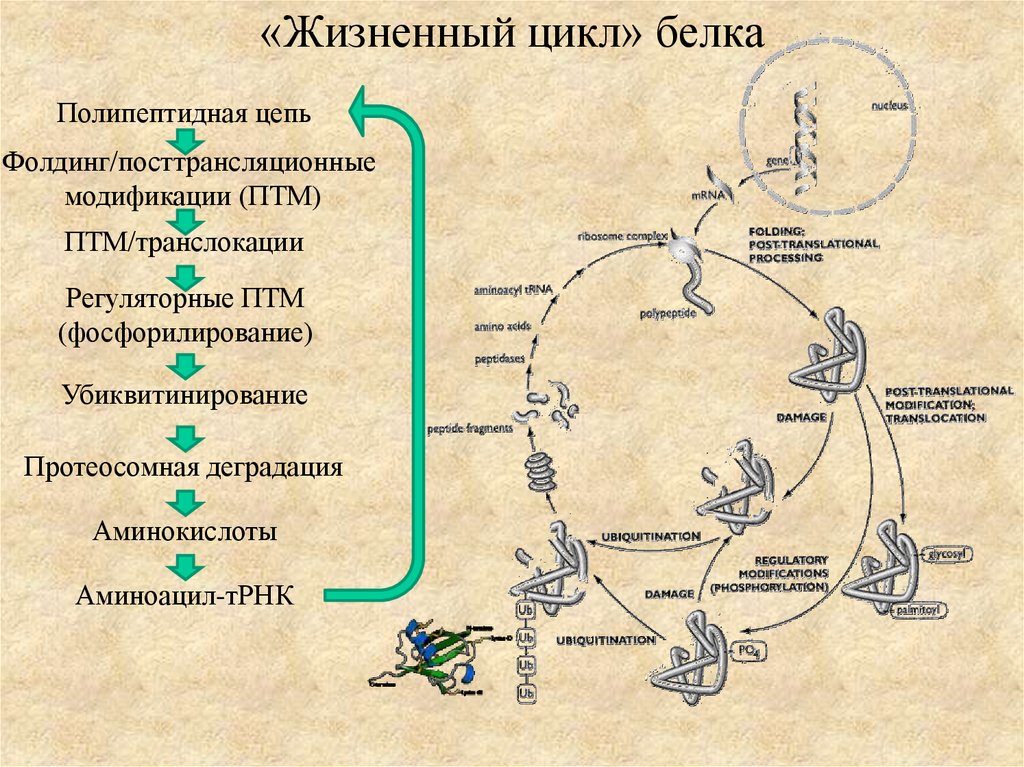
11. «Жизненный цикл» белка
Полипептидная цепьФолдинг/посттрансляционные
модификации (ПТМ)
ПТМ/транслокации
Регуляторные ПТМ
(фосфорилирование)
Убиквитинирование
Протеосомная деградация
Аминокислоты
Аминоацил-тРНК
12. Функциональные семейства белков
Venter et al. (2001) Science291:1304–1351
13. Функционально белки связаны между собой в рамках отдельных метаболических путей
• Метаболические белки – катализаторы химическихреакций
• Сигнальные белки – участвуют в передаче сигнала.
• Регуляторные – специфически контролируют
скорость химических реакций или поступления
веществ в клетку
• Структурные
• Транспортные
• Двигательные
• ДНК и РНК связывающие
• Защитные
14.
• Основной метаболизм – 15%• Структурные белки и синтез белка – 15-20%
цитоскелет, рибосомальные белки, шапероны, белки протеосомы
• Сигнальные и ДНК-связывающие белки – 20-25%
• Функция неизвестна – 40%
Функциональная геномика – поиск функций неизвестных генов
Гены и геномы
Гомологичные
последовательности
называют ортологичными, если к их
разделению привел акт видообразования:
если ген существует у некоего вида,
который дивергирует с образованием двух
видов, то копии этого гена у дочерних
видов
называются
ортологами.
Гомологичные
последовательности
называют паралогичными, если к их
разделению привело удвоение гена: если в
пределах одного организма в результате
хромосомной
мутации
произошло
удвоение гена, то его копии называют
паралогами.
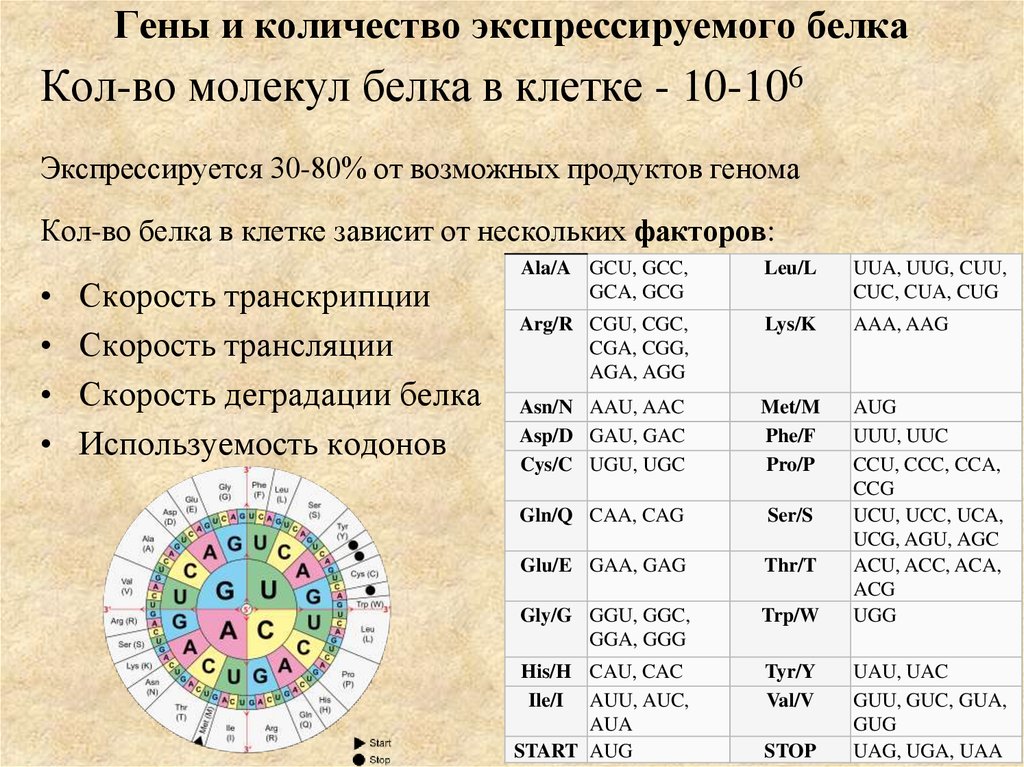
15. Гены и количество экспрессируемого белка
Кол-во молекул белка в клетке - 10-106Экспрессируется 30-80% от возможных продуктов генома
Кол-во белка в клетке зависит от нескольких факторов:
Скорость транскрипции
Скорость трансляции
Скорость деградации белка
Используемость кодонов
Ala/A GCU, GCC,
GCA, GCG
Leu/L
UUA, UUG, CUU,
CUC, CUA, CUG
Arg/R CGU, CGC,
CGA, CGG,
AGA, AGG
Lys/K
AAA, AAG
Asn/N AAU, AAC
Asp/D GAU, GAC
Cys/C UGU, UGC
Met/M
Phe/F
Pro/P
Gln/Q CAA, CAG
Ser/S
Glu/E GAA, GAG
Thr/T
Gly/G GGU, GGC,
GGA, GGG
Trp/W
AUG
UUU, UUC
CCU, CCC, CCA,
CCG
UCU, UCC, UCA,
UCG, AGU, AGC
ACU, ACC, ACA,
ACG
UGG
His/H CAU, CAC
Ile/I AUU, AUC,
AUA
START AUG
Tyr/Y
Val/V
STOP
UAU, UAC
GUU, GUC, GUA,
GUG
UAG, UGA, UAA
16.
Посттрансляционнаямодификация
—
это
химическая модификация белка после его трансляции.
Это одна из последних стадий процесса биосинтеза
белка для многих белков.
ацетилирование
фосфорилирование
гликозилирование
изменение природы аминокислоты
метилирование
протеолиз
17. Белки – «модульные» соединения
Домен – часть белковой молекулы, имеющая собственную3D структуру.
Независимая структурная единица.
Может эволюционировать независимо от остального белка
На основании доменной структуры белки подразделяются на
семейства
Примеры доменов: Zn-пальцы, домены иммуноглобулинов
18. Масштабные направления
геномика - геномтранскриптомика - транскриптом
метаболомика - метаболом
цитомика - цитом
пептидомика - пептидом
19. Зачем нужна протеомика?
Геном-
Транскриптом
-
Протеом
из: Graves and Haystead, 2002
• Несколько уровней регуляции ген-функция
• Белки – молекулы, реализующие физиологический эффект
Одни и те же гены, но...
20.
21.
Протеомика , БГУ 201122.
Протеомика , БГУ 201123. 2.Что такое протеом?
"PROTEins" и "genOMe"Протеом — множество всех белков биообъекта в данный
момент времени.
Клеточный протеом – все белки определенной клетки на конкретной
стадии дифференцировки, развивающейся в определенных условиях.
Гепатоцит (клетка печени) содержит 10000-20000 различных белков, каждый
из которых может находиться в количестве 20 тыс. – 100 млн. копий на одну
клетку.
Протеом гепатоцита имеет массу 0,5 нг, что составляет 18-20 % от общей
массы клетки.
Общий протеом организма - весь набор белков конкретного организма в
данный момент времени, и в том числе объединяет различные клеточные
протеомы.
Один и тот же организм может иметь различный протеом в зависимости от
стадии жизненного цикла, окружающих условий среды и т.д.
Протеом человека включает в среднем 2 миллиона различных белков, каждый
из которых имеет свою структуру и обладает различными функциями.
24. Задачи протеомики
Протеомика: цель и задачиЦель протеомики - идентификация, характеристика и
количественный учет ВСЕХ белков метаболического пути,
органеллы, клетки, ткани, органа и всего организма.
Объект исследования - протеомы
Задачи протеомики
1) идентификация белков
2) количественное определение белков
3) дифференциальный анализ
4) анализ белок-белковые взаимодействий (с интерактомикой)
5) установление характера посттрансляционных модификаций
6) структурный анализ белков протеома
7) экспериментальная биоинформатика в области протеомики (создание и
усовершенствование существующих экспериментальных и биоинформационных
методов и выявление новой информации и создание новых баз данных о белках)
7) поиск биомаркеров патологических процессов
8) установление механизмов возникновения заболеваний на молекулярном уровне
25.
Протеомика конкретных биообъектовпротеомика плазмы крови,
протеомика микроорганизмов
протеомика новообразования
Протеомика
Протеомика как методология
26. Протеомика и геномика
ДНКСтатична
Может быть
амплифицирована
Простота строения (1компонент)
Хорошая растворимость
Белки
Очень динамичны
Не может быть
амплифицирована
Высокая сложность
строения (модификации)
Растворимость
различная
Полностью изучен ряд геномов, но до сих пор полностью
не охарактеризован ни один эукариотический протеом
27.
Протеомика и химия белкаБелковая химия
Протеомика
Индивидуальные белки
Сложные смеси белков
Полный анализ
последовательности
Частичный анализ
последовательности
Акцент на структуре и функции
Акцент на идентификации по
базам данных
Структурная биология
Системная биология
28. Кто занимается протеомикой
2001 Международная организация по изучению протеомачеловека (Human Proteome Organization / HUPO).
Chromosome
Group Leader
National Affiliations
1
Fuchu He
China
2
Lydie Lane
Switzerland
3
Toshihide Nishimura
Japan
4
Yu Ju Chen
Taiwan
5
Rainer Bischoff
Netherlands
6
Paul Keown
Canada
7
Mark Baker
Australia, New Zealand
8
Pengyuan Yang
China
9
Je-Yoel Cho
Seoul, Korea
10
Joshua Labaer
USA
11
Jong Shin Yoo
Korea
12
Visith Thongboonkerd
India, Singapore, Taiwan,
Thailand
13
Young Ki Paik
Korea
14
Jérôme Garin
France
15
Gilberto B Domont
Brazil
16
Juan Pablo Albar
Spain
17
Bill Hancock
USA
18
Alex Archakov
Russia
19
Gyorgy Marko Varga
Sweden
20
Siqiu Liu
China
21
Daniel Figeys
Canada
22
Charles Lee
USA
X
Tadashi Yamamoto
Japan
Y
Hosseini Salekdeh
Iran
MT
Andrea Urbani
Italy
Деятельность: реализация проекта
«Протеом человека» (HPP)
«Хромосомный» подход к протеомике
Интеграция и обработка данных в
швейцарском институте
биоинформатики (SIB), Женева
Journal of Proteome Research
(January 4, 2013, Volume 12, Issue 1)
29. Инструментарий протеомики
30. Методы протеомики
Методы разделения белковМетоды идентификации белков
Методы количественного анализа белков
Методы
накопления,
хранения
и
обработки полученной информации
31. Методы разделения
SDS-электрофорез в полиакриламидном гелеИзоэлектрическое фокусирование
Двумерный электрофорез
Хроматография
32. Методы идентификации белков
7501000
1250
1500
1750
1612.7
2000
2250
2869.3
2290.0
2735.1
2097.0
2147.8
2201.1
2005.7
1794.7
1273.7
1096.6
0.5
1198.7
976.4
1929.9
687.4
1849.7
1490.7
1546.8
1125.7
902.5
878.5
Intens. [a.u.]
Методы идентификации белков
• Масс-спектрометрия
• Иммуноблоттинг
x10 4
1.5
1.0
0.0
2500
2750
3000
m /z
33. Обработка информации - биоинформатика
Биоинформатика - использование математических средств для извлеченияполезной информации из «шумных» или слишком объёмных данных о
структуре ДНК и белков, полученных экспериментально.
Биоинформа́тика
1. математические методы компьютерного анализа в сравнительной
геномике (геномная биоинформатика).
2. разработка алгоритмов и программ для предсказания пространственной
структуры белков (структурная биоинформатика).
3. исследований стратегий, соответствующих вычислительных методологий,
а также общее управление информационной сложности биологических
систем.
Биоинформатика помогает связать
геномные и протеомные проекты, к
примеру, помогая в использовании
последовательности
ДНК
для
идентификации белков.
34. Дифференциальная экспрессия генов
• 2D-гель электрофорез и масс-спектрометрия способны дать качественную иколичественную информацию о поведении отдельных белков
• наиболее часто используемый подход в протеомном анализе
from: Pandey and Mann, 2000
35.
Клиническое и биомедицинское применениепротеомики
• Клинические применения 2-D PAGE & MS
– Идентификация происхождения образцов жидкостей организма и
образцов тканей, полученных биопсией.
– Анализ белковых фенотипов и посттрансляционных
модификаций в жидкостях, клетках или тканях.
– Изучение клональности иммуноглобулинов и определение
клонов, которые не могут быть определены обычными методами.
– Наблюдение за процессом течения болезни и экспрессией белков.
– Определение новых биомаркеров болезней и/или шаблонов в
клетках и тканях.
36.
Клиническое применение2-D электрофореза
• Физиологические жидкости
–
–
–
–
–
–
–
–
–
Клетки крови
Плазма и сыворотка
Моча
Цереброспинальная
жидкость
Амниотическая
жидкость
Синовиальная
жидкость
Слюна
Пот
Слезная жидкость
• Твердые ткани
–
–
–
–
Сердце
Мозг
Щитовидная железа
Мышца
• Злокачественые опухоли
• Культура тканей
• Малигнизированные
клетки
• Бактериальные белки
Young & Tracy Journal of Chromatography A, 698 (1995) 163-179
37. Прикладная протеомика
Поиск и обнаружение биомаркеровУстановление молекулярных механизмов
возникновения заболеваний
Ранняя диагностика заболеваний
Аннотация геномов
Эволюционный анализ
Идентификация видовой принадлежности
38. Биомаркеры
NIH, 2001Биомаркер — это характеристика, которую можно объективно
измерить, и которая может служить в качестве индикатора
физиологических и патологических биологических процессов или
фармакологических ответов на терапевтическое вмешательство.
Биомаркер (биологический маркер) – это исследуемый параметр, измерение
которого отличается высокой точностью, надежностью и воспроизводимостью,
что позволяет отражать напряженность физиологических процессов, состояние
здоровья, степень риска или факт развития заболевания, его стадию и прогноз.
Биомаркер – это характеристика (биологический признак), которая
используется в качестве индикатора биологического состояния всего
организма.
39. Использование биомаркеров
Прогнозирование индивидуального риска заболеванийу здоровых лиц.
Оценка нормальных физиологических процессов в
организме (рост, вес, спортивная форма, протекание
беременности, старение).
Выявление заболеваний, подбор лечения, оценка его
эффективности.
Прогнозирование течения и исхода заболевания.
Определения негативных эффектов внешней среды, в
том числе химических отравлений, радиационного
облучения и др.
Разработка новых лекарственных средств.
40. Виды биомаркеров
• ПредупредительныеИспользуются для выявления лиц с повышенным риском возникновения заболевания по уровню
содержания в организме тех или иных веществ.
Высокий уровень ЛПНП может указывать на высокий риск развития атеросклероза.
• Верификационные
Подтверждающие заболевания на субклинической стадии.
Микроальбуминурия появляется у лиц с сахарным диабетом ещё до того, как появятся первые
клинические проявления.
• Диагностические биомаркеры
Используются для идентификации определенного заболевания.
Повышение концентрации тропонина в крови указывает на инфаркт миокарда, а
гликолизированного гемоглобина — на сахарный диабет.
• Биомаркеры состояния
Используются для определения тяжести заболевания.
Мозговой натрийуретический пептид — для определения функционального класса застойной
сердечной недостаточности.
• Прогностические.
Используются для оценки прогноза развития заболевания, его возможного исхода и оценки
эффективности лечения. Например, биомаркеры рака при опухолях или гликозилированный
гемоглобин при диабете.
• Фармакодинамические биомаркеры.
Используются при разработке лекарств и выявляют определенный фармакологический ответ, что
необходимо при исследованиях по оптимизации дозировок лекарств.
41.
Протеомика и разработкалекарств будущего
Пауль Эрлих (начало 20 в.):
Концепция мишени
42. Заключение
• Протеом — совокупность белков биообъекта.• Протеомика — изучает белки и их взаимодействия в живых организмах.
• Цель протеомики - интегральное изучение поведения и функций клеточных
белков в живой клетке
• Задачи протеомики:
– каталогизация всех белков, синтезируемых различными типами клеток;
– выяснение характера влияния возраста, условий окружающей среды и заболеваний на
синтезируемые клеткой протеины;
– выяснение функций идентифицированных белков;
– составление схем связей между повышением или понижением уровня синтеза белков и
происходящими в организме процессами, например, при развитии заболевания, инфицировании
организма или биохимическими реакциями сельскохозяйственного растения, происходящими в
ответ на нападение насекомых;
– изучение взаимодействий различных белков с другими белками, содержащимися внутри клетки
и во внеклеточном пространстве.
• Основная методология
– двумерный электрофорез
– хроматография
– масс –спектрометрия
- биоинформатика





































 Биология
Биология








