Похожие презентации:
Культуры эукариотических клеток
1.
Культурыэукариотических
клеток
Дитченко Татьяна Ивановна
Кафедра клеточной
биологии и биоинженерии
растений
2.
Лекции – 8 часовПрактические занятия – 4 часа
Зачет
3.
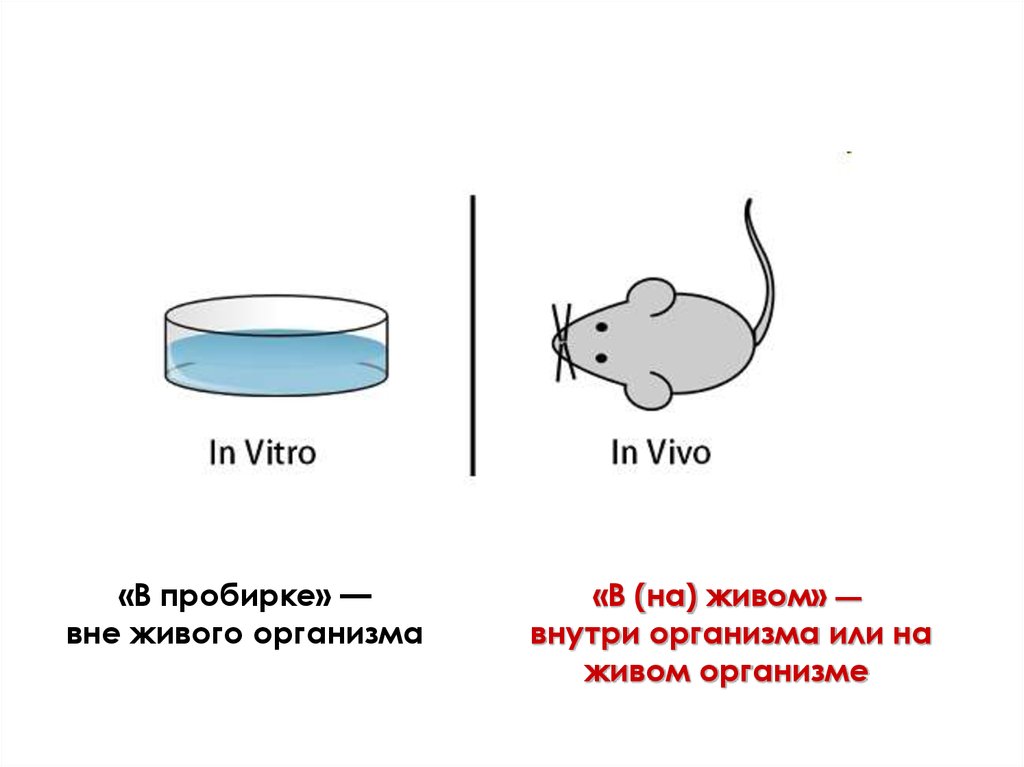
Культуры клеток – это клетки, растущиеили сохраняющие жизнеспособность
вне организма (в условиях in vitro)
In vitro – культивирование
объектов «в стекле»
(пробирке, колбе, биореакторе)
на искусственных питательных
средах в стерильных условиях
4.
«В пробирке» —вне живого организма
«В (на) живом» —
внутри организма или на
живом организме
5.
Цель курса «Культурыэукариотических клеток» –
знакомство с методами получения
культур клеток, их ведения, а также
практическим использованием этих
объектов
Клеточные технологии включают:
• культивирование растительных клеток;
• культивирование животных клеток
6.
Главное требование –соблюдение строгой асептики
Все работы по получению культур растительных и
животных клеток, их пересадкам производятся в
ламинар-боксах
7.
Ламинар-боксыБоксы
биологической
безопасности
класс III
(защита продукта,
оператора,
окружающей
среды)
Ламинарные боксы
с вертикальным
нисходящим
потоком воздуха
(защита продукта)
Боксы
биологической
безопасности
класс I
(защита оператора
и окружающей
среды)
Боксы биологической
безопасности класс II
(тип А2)
(защита продукта,
оператора,
окружающей среды)
8.
Второе условие –использование специальных
питательных сред
Культуральная среда должна
обеспечивать все внешние условия,
которые клетки имели
in vivo
9.
Способы культивированиярастительных клеток
Поверхностное
культивирование на
плотной (агаризованной)
питательной среде
Каллусные
культуры
Глубинное
культивирование в
жидкой питательной
среде
Суспензионные
культуры
10.
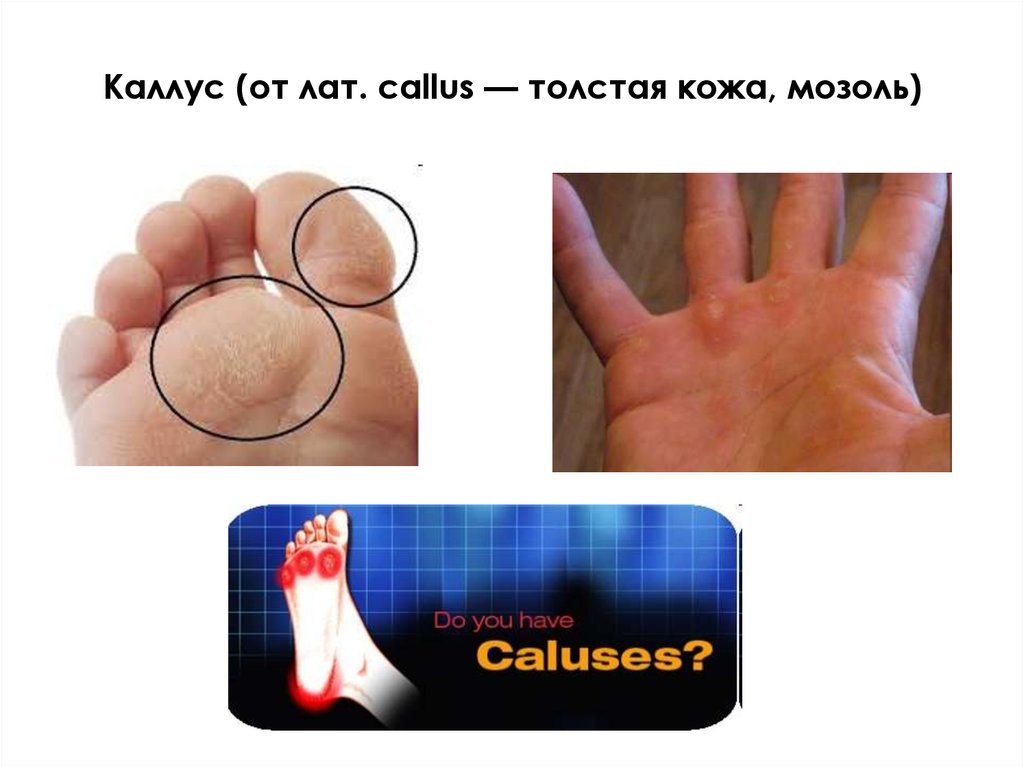
Каллус (от лат. callus — толстая кожа, мозоль)11.
Каллус - недифференцированные растительныеклетки, выращиваемые поверхностным
способом на полутвердой питательной среде
12.
Каллус может образоваться не только в искусственныхусловиях, но и в природе, например, на раневой поверхности.
Каллусная ткань способствует зарастанию ран, срастанию
прививок и служит для восстановления (регенерации)
утраченных органов
13.
Этапы получения каллусной культуры1. Выбор экспланта
Эксплант - фрагмент ткани или органа, используемый
для получения первичного каллуса
14.
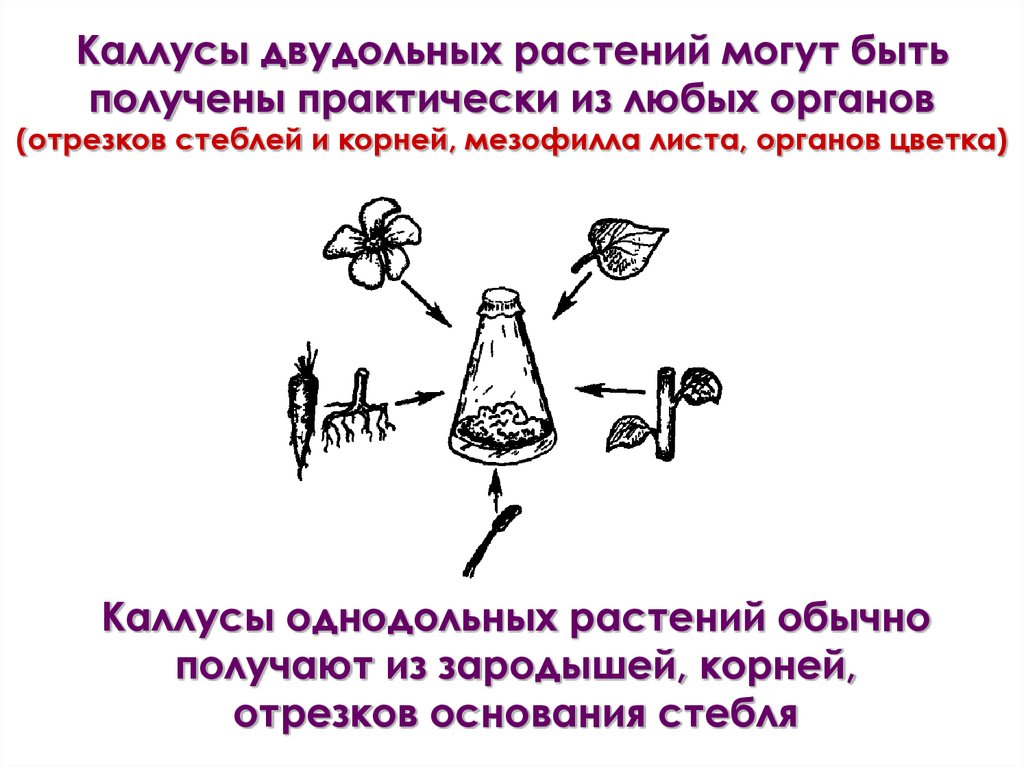
Каллусы двудольных растений могут бытьполучены практически из любых органов
(отрезков стеблей и корней, мезофилла листа, органов цветка)
Каллусы однодольных растений обычно
получают из зародышей, корней,
отрезков основания стебля
15.
Лучшими эксплантами для получениякаллуса являются:
молодая ткань;
ткань ответственная за пролиферацию
(меристема)
Нежелательно использовать:
одревесневшие ткани;
старые ткани с низким уровнем
метаболизма;
плохо пролиферирующие ткани (напр.,
мякоть плодов);
ткани, покрытые восками, суберином и т.п.
16.
Проращивание простерилизованныхсемян в асептических условиях дает
наиболее пригодный материал для
получения каллусов
17.
Этапы получения каллусной культуры2. Стерилизация растительного
материала
На поверхности органов растений всегда находится
эпифитная микрофлора. Эксплант должен быть
освобожден от всех видов микроорганизмов
(бактерий, грибов, микоплазм и т.д.).
Поверхностная стерилизация освобождает эксплант
от наружной инфекции.
18.
АНТИСЕПТИКИ, ИСПОЛЬЗУЕМЫЕ ДЛЯСТЕРИЛИЗАЦИИ РАСТИТЕЛЬНЫХ ТКАНЕЙ:
соединения, содержащие активный хлор, – 0,5-1%
(гипохлорит кальция, гипохлорит натрия, хлорная известь,
хлорамин);
двухлористая ртуть (сулема), 0,1-1 %-ный раствор;
формалин, 5%-ный раствор;
перекись водорода, 10-20%-ный раствор;
этиловый спирт, 70%-ный раствор;
фенол, 5%-ный раствор;
антибиотики (в случае внутренней инфекции)
19.
ТЕХНИКА ПРОВЕДЕНИЯ СТЕРИЛИЗАЦИИРАСТИТЕЛЬНОГО МАТЕРИАЛА:
1) Предварительная стерилизация
(проводят очистку поверхности путем ее промывания
проточной водой; обработки этанолом (70%-ный раствор
в течение 1 мин), растворами CuSO4 либо KMnO4)
2) Стерилизация
(в условиях ламинар-бокса предварительно
простерилизованные ткани помещают в стерилизующий
раствор)
3) Постстерилизация
(растительный материал отмывают от стерилизующего
агента 3-4 порциями стерильной дистиллированной воды)
20.
Этапы получения каллусной культуры3. Перенос стерильных эксплантов
на питательную среду
21.
Этапы получения каллусной культуры4. Получение первичного каллуса
Образование каллуса, в первую очередь,
отмечается на раневой поверхности экспланта
22.
При оптимально подобранной среде первичныекаллусы в количестве достаточном для пересадки
образуются в течение 3-8 недель в зависимости от
вида растения
23.
Этапы получения каллусной культуры5. Субкультивирование
(пассирование)
Первичный каллус разделяют на части, которые в
дальнейшем культивируются отдельно.
Следует обратить внимание на размеры
трансплантов, переносимых на свежую питательную
среду: если они слишком малы, то дальнейший рост
каллуса может быть угнетен.
24.
Типы каллусных культур:Каллусные культуры различаются по:
интенсивности роста;
окраске;
консистенции и др.
25.
Типы каллусных культур:рыхлые
(легко распадаются на отдельные клетки);
среднеплотные
(клетки могут быть отделены друг от друга
сильным встряхиванием);
плотные
(клетки очень мелкие, не отделяются
взбалтыванием)
26.
Направления использованиякаллусных культур:
изучение процессов цитодифференцировки и
морфогенеза;
биохимические и молекулярно-биологические
исследования;
изучение механизмов опухолеобразования;
получение суспензионных культур;
регенерация растений, получение новых форм
растений;
сохранение в растущем состоянии коллекций
разных видов растений
27.
Суспензионная культура – отдельные клетки иликлеточные агрегаты, выращиваемые в жидкой
питательной среде во взвешенном состоянии
28.
Необходимое условие для поддержаниясуспензионных культур –
постоянное перемешивание питательной
среды
29.
ОСНОВНЫЕ ПРЕИМУЩЕСТВАСУСПЕНЗИОННЫХ КУЛЬТУР:
удобная модель для молекулярно-биологических и
биохимических исследований;
(клетки в одинаковой степени доступны для
внешнего воздействия, более «открыты»);
возможность быстрого набора биомассы для
получения БАВ;
простота процессов субкультивирования
(легко заменить или отобрать питательную среду)
30.
ЭТАПЫ ПОЛУЧЕНИЯ:1. Отбор хорошо растущей
рыхлого типа
каллусной культуры
2. Инициализация первичной суспензии
2-3 г свежей массы каллусной ткани на 60-100 мл
жидкой питательной среды.
3. Культивирование
Колбы помещают на качалку, скорость вращения
которой составляет 100-120 об/мин.
Процесс получения первичной суспензии
занимает 2-3 недели.
31.
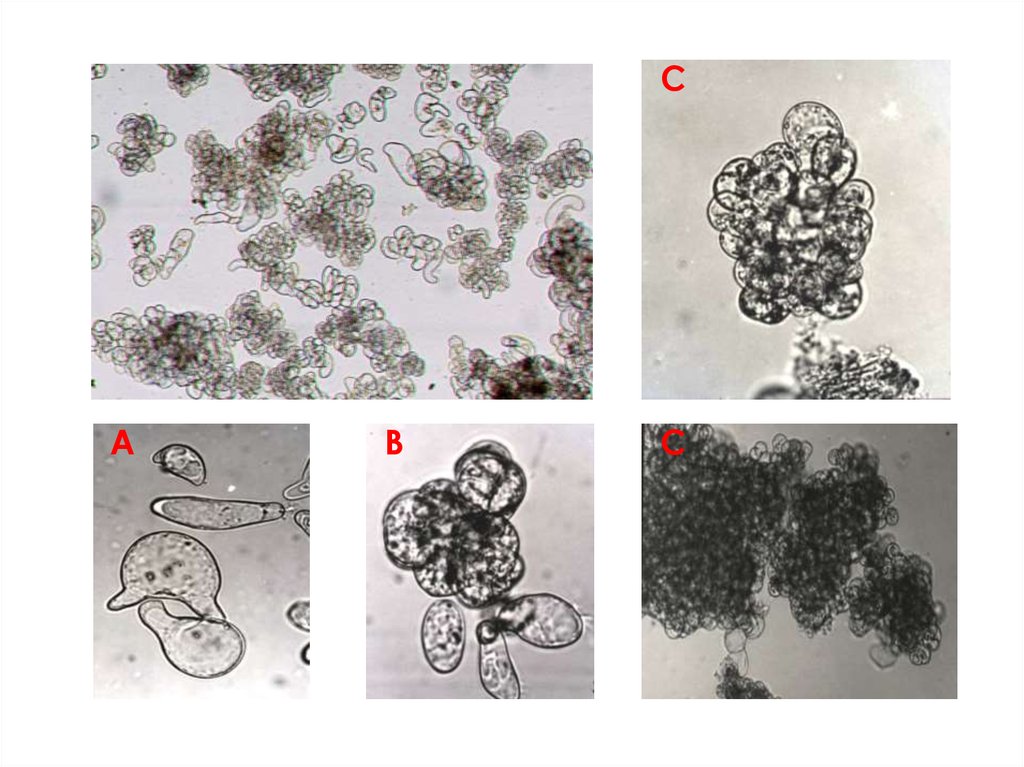
Суспензионные культуры состоят из:отдельных клеток;
клеточных групп (2-10 клеток);
многоклеточных агрегатов (сотни и тысячи
клеток).
32.
СА
В
С
33.
ТИПЫ СУСПЕНЗИОННЫХ КУЛЬТУР:(в зависимости от степени агрегированности)
слабоагрегированные;
(состоят из одиночных клеток (40%) и мелких агрегатов (60%),
агрегаты не должны содержать более 10-12 клеток)
среднеагрегированные;
(состоят из одиночных клеток (40%), мелких агрегатов (40%) и
крупных агрегатов (20%))
высокоагрегированные;
(состоят из мелких (40%) и крупных агрегатов (60%)
34.
КУЛЬТУРЫПРОТОПЛАСТОВ
35.
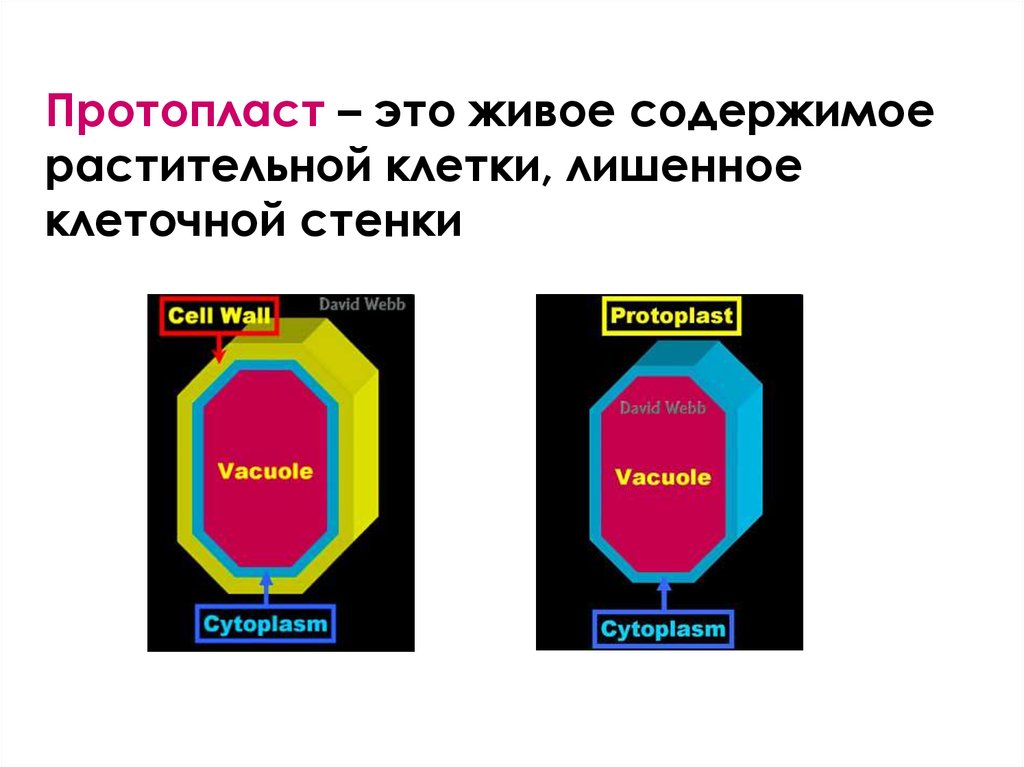
Протопласт – это живое содержимоерастительной клетки, лишенное
клеточной стенки
36.
ИСТОЧНИКИ ПОЛУЧЕНИЯПРОТОПЛАСТОВ:
изолированные органы растений и их части
(листья, корни, лепестки);
суспензионная культура;
каллусная ткань.
37.
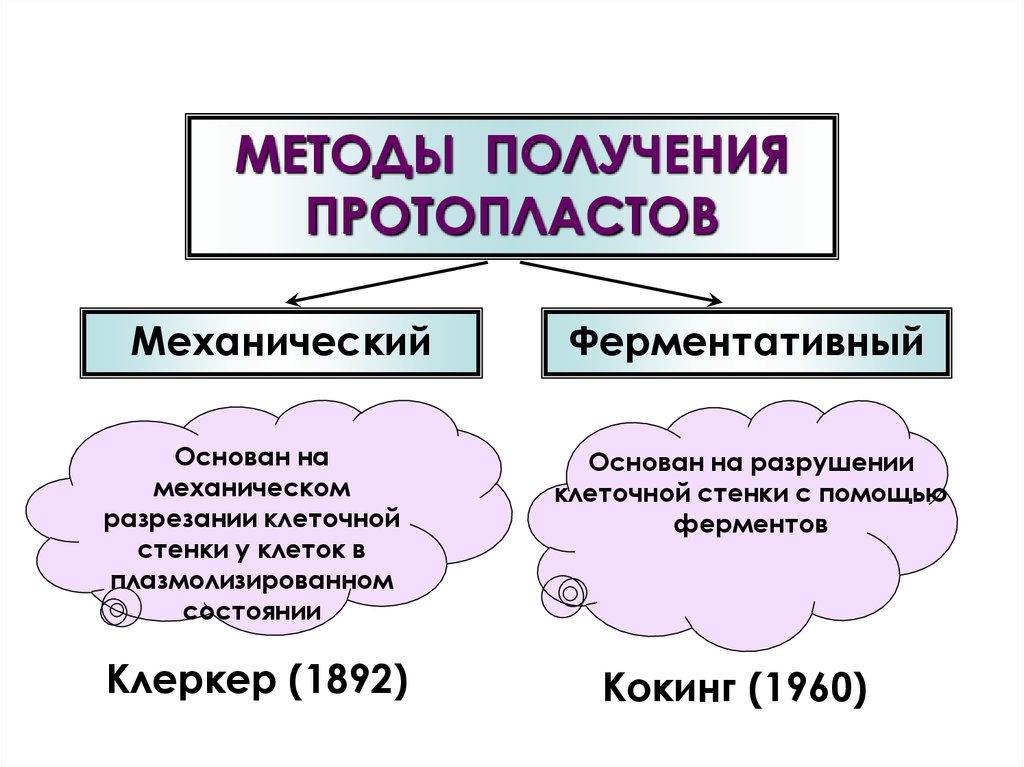
МЕТОДЫ ПОЛУЧЕНИЯПРОТОПЛАСТОВ
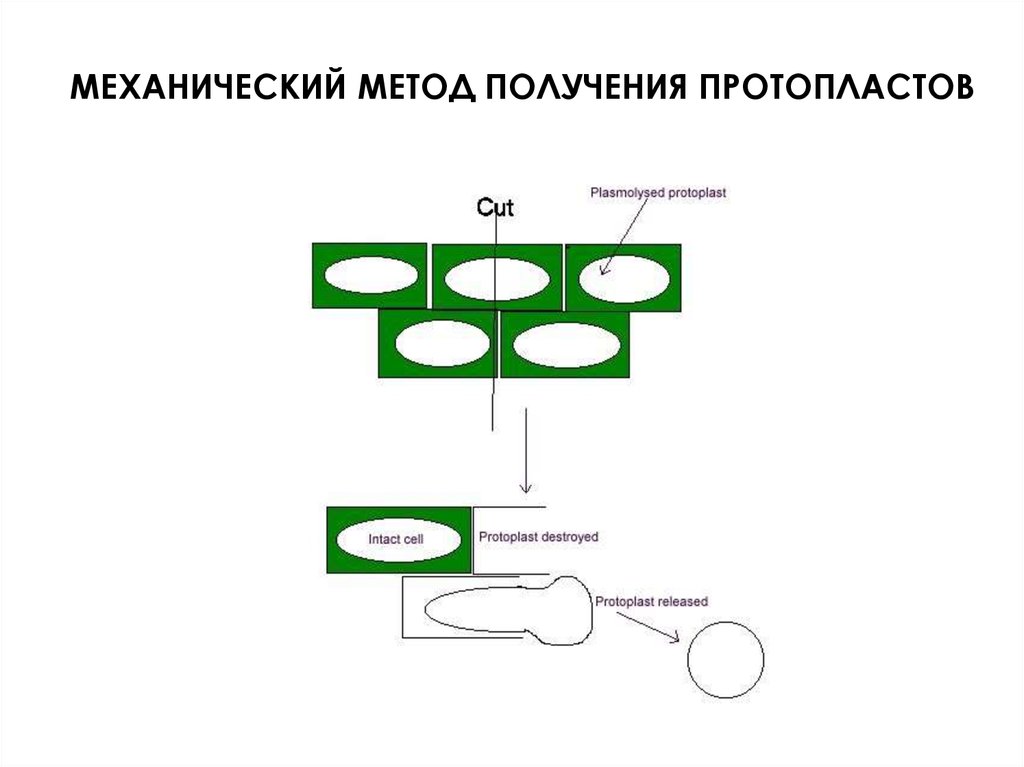
Механический
Основан на
механическом
разрезании клеточной
стенки у клеток в
плазмолизированном
состоянии
Клеркер (1892)
Ферментативный
Основан на разрушении
клеточной стенки с помощью
ферментов
Кокинг (1960)
38.
МЕХАНИЧЕСКИЙ МЕТОД ПОЛУЧЕНИЯ ПРОТОПЛАСТОВ39.
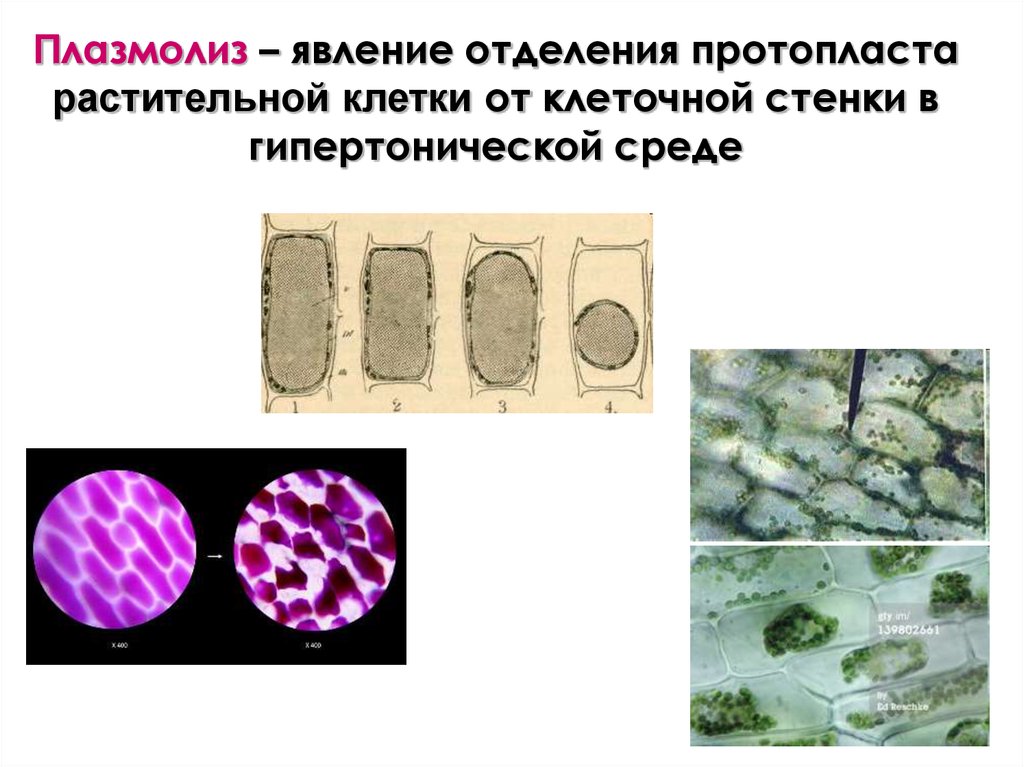
Плазмолиз – явление отделения протопластарастительной клетки от клеточной стенки в
гипертонической среде
40.
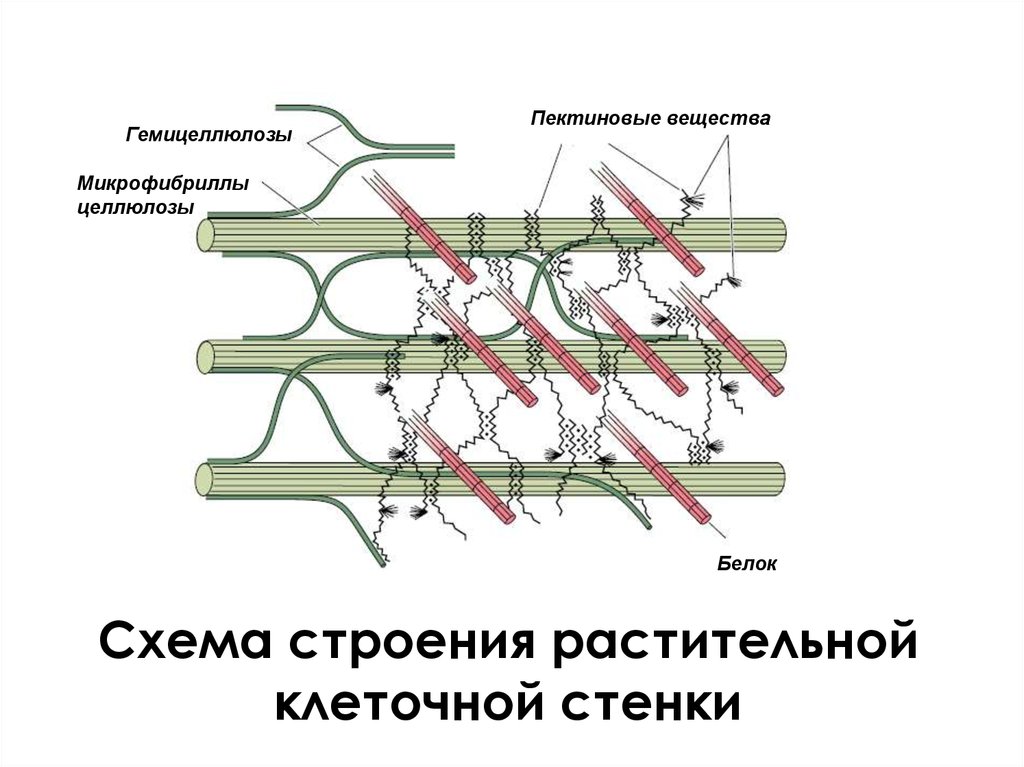
ГемицеллюлозыПектиновые вещества
Микрофибриллы
целлюлозы
Белок
Схема строения растительной
клеточной стенки
41.
Компонентыклеточной стенки
Целлюлоза
Гемицеллюлоза
Пектиновые
вещества
Белки
Фермент
Целлюлаза
Гемицеллюлаза
Пектиназа
Протеаза
На практике часто используются
ферментные препараты, включающие
комплекс из нескольких гидролитических
ферментов
Состав ферментативной смеси должен наиболее
полно соответствовать составу клеточной стенки!
42.
Основные компонентыпитательных сред для
культивирования
растительных клеток:
макроэлементы;
микроэлементы;
источник углерода;
витамины;
регуляторы роста
43.
РЕГУЛЯТОРЫ РОСТА РАСТЕНИЙСодержание регуляторов роста
является определяющим фактором
для успешного роста культур
клеток растений
•АУКСИНЫ
•ЦИТОКИНИНЫ
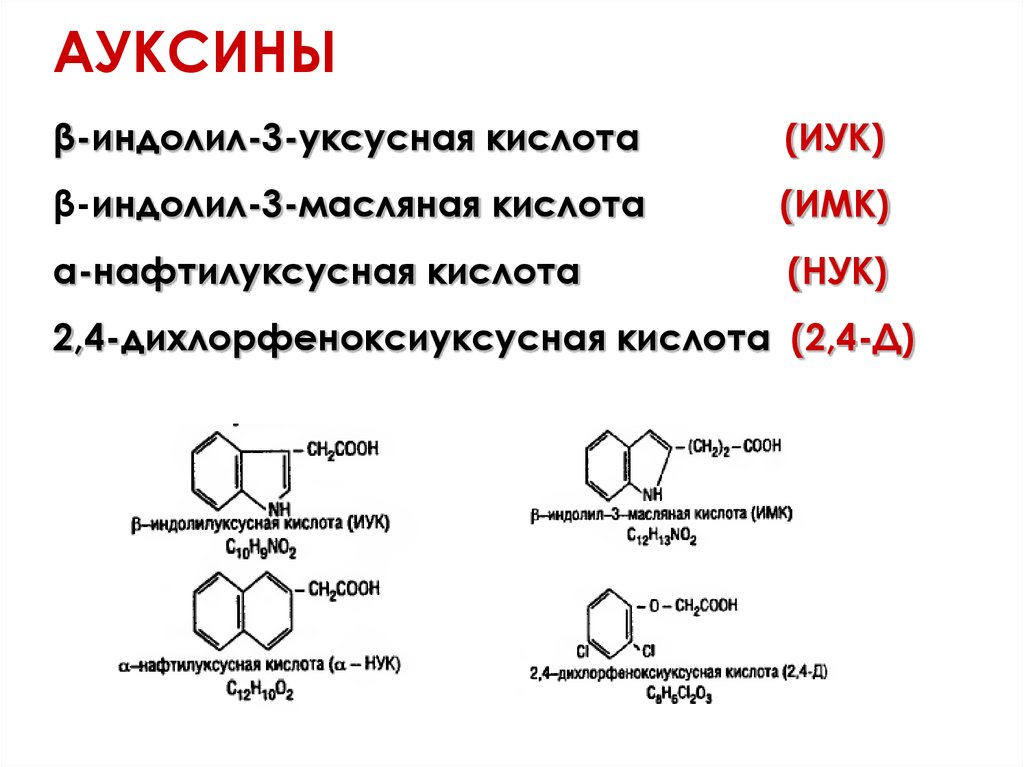
44.
АУКСИНЫβ-индолил-3-уксусная кислота
(ИУК)
β-индолил-3-масляная кислота
(ИМК)
α-нафтилуксусная кислота
(НУК)
2,4-дихлорфеноксиуксусная кислота (2,4-Д)
45.
АУКСИНЫ НЕОБХОДИМЫ ДЛЯ:•стимуляции деления и растяжения клеток
каллусных и суспензионных культур;
•стимуляции образования корней (ризогенеза);
•в сочетании с другими фитогормонами для
формирования у протопластов клеточных
стенок
46.
Стимуляция закладки корней (ризогенеза) учеренков под действием ауксинов
47.
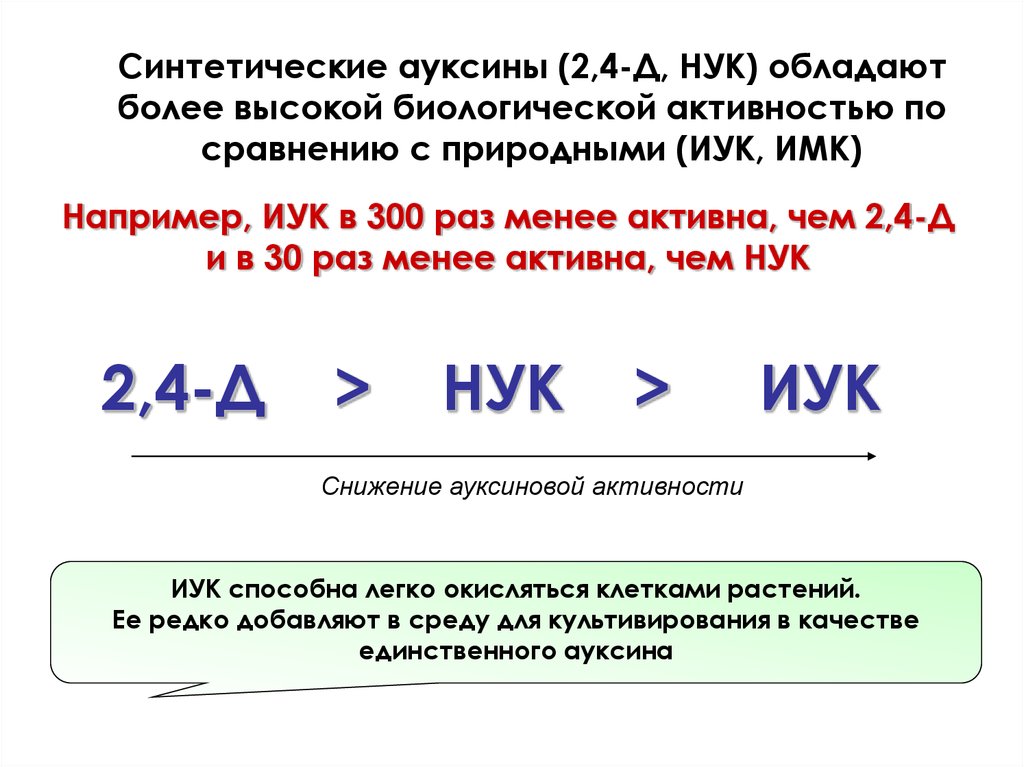
Синтетические ауксины (2,4-Д, НУК) обладаютболее высокой биологической активностью по
сравнению с природными (ИУК, ИМК)
Например, ИУК в 300 раз менее активна, чем 2,4-Д
и в 30 раз менее активна, чем НУК
2,4-Д
>
НУК
>
ИУК
Снижение ауксиновой активности
ИУК способна легко окисляться клетками растений.
Ее редко добавляют в среду для культивирования в качестве
единственного ауксина
48.
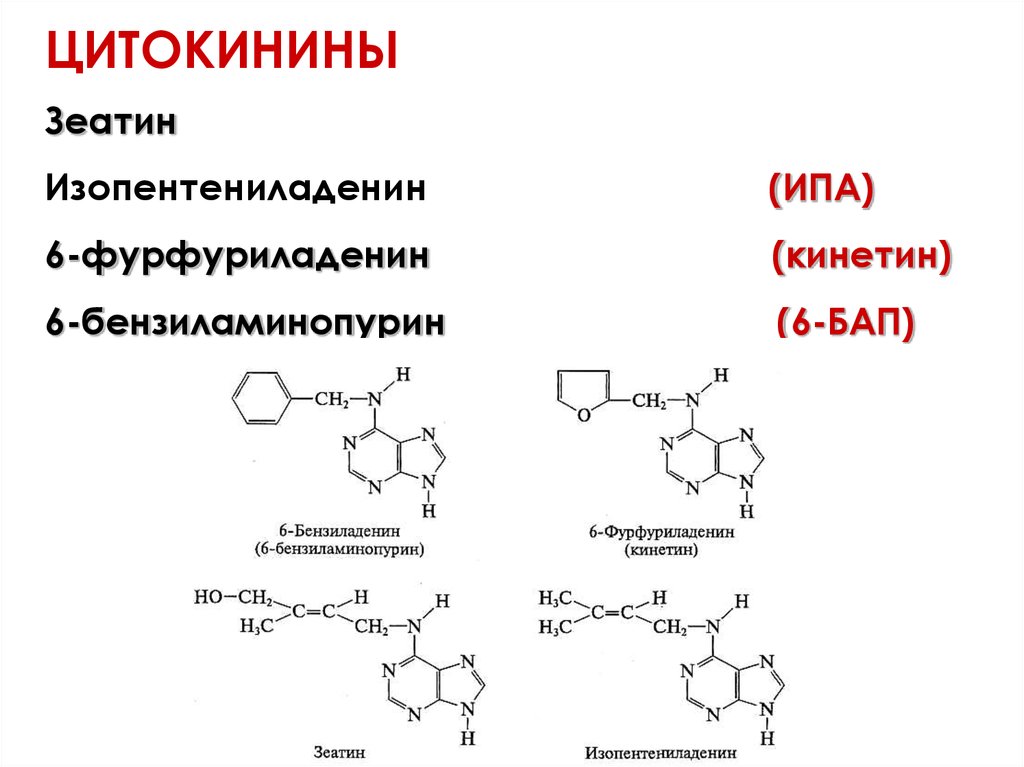
ЦИТОКИНИНЫЗеатин
Изопентениладенин
(ИПА)
6-фурфуриладенин
(кинетин)
6-бензиламинопурин
(6-БАП)
49.
6-БАП ≥ зеатин > кинетинСнижение цитокининовой активности
Зеатин термолабилен, поэтому его
нельзя автоклавировать
50.
ЦИТОКИНИНЫ ВКЛЮЧАЮТ ВСОСТАВ СРЕД ДЛЯ:
•стимуляции клеточных делений в каллусных и
суспензионных культурах, в культурах
протопластов;
•образования побегов (стеблевой морфогенез)
51.
ФИЗИЧЕСКИЕ УСЛОВИЯКУЛЬТИВИРОВАНИЯ:
•условия освещения;
Каллусные культуры и клеточные суспензии выращиваются либо
темноте, либо под лампами белого света.
•температура;
Для большинства культур поддерживается в термостатах на
уровне 26 1 С.
•условия аэрации;
Важны для суспензионных культур. Зависят от эффективности
перемешивания питательной среды и подачи стерильного воздуха
(в случае культивирования в биореакторах).
•влажность воздуха
В культуральной комнате должна составлять 60–70 %
52.
Ростовой циклкаллусных и
суспензионных
культур
53.
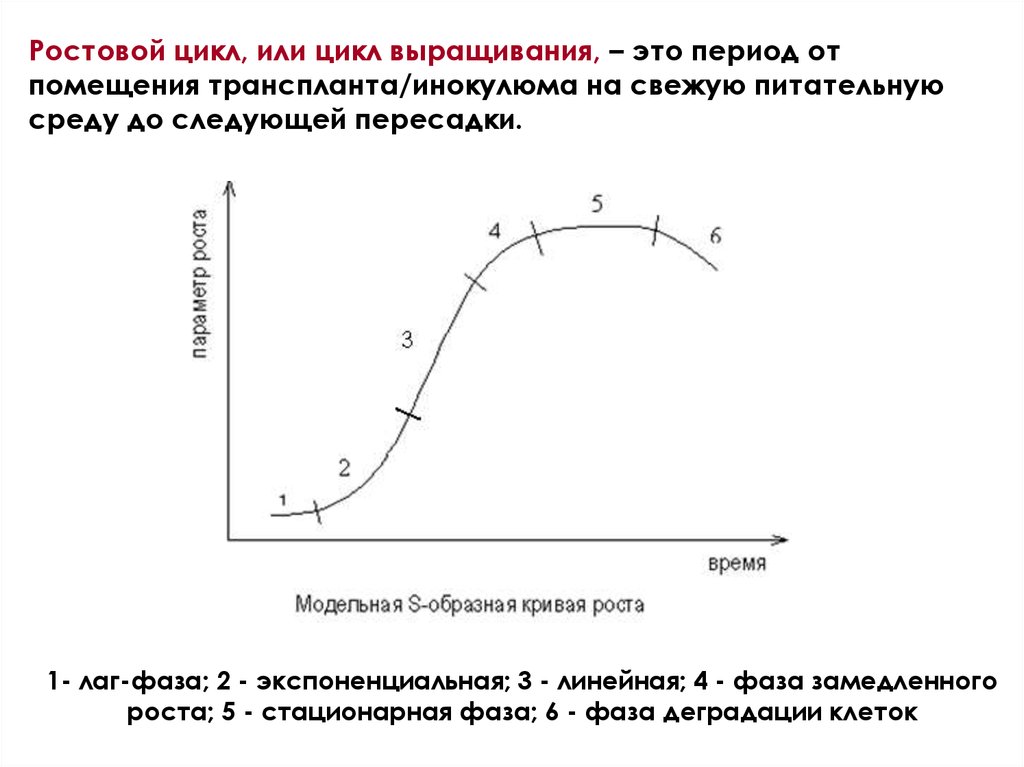
Ростовой цикл, или цикл выращивания, – это период отпомещения транспланта/инокулюма на свежую питательную
среду до следующей пересадки.
1- лаг-фаза; 2 - экспоненциальная; 3 - линейная; 4 - фаза замедленного
роста; 5 - стационарная фаза; 6 - фаза деградации клеток








































 Биология
Биология








