Похожие презентации:
Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
1. Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
Лекция №6по курсу «Анализ и контроль
качества лекарственных средств»
1
2. Жидкостная хроматография
• метод разделения, в котором подвижная фазапредставляет собой жидкость, а неподвижная –
твердую или жидкую фазу (не смешивающуюся с
подвижной фазой).
• Различают:
• А. колоночную (низкого и высокого давления – ВЭЖХ
или ЖХВД) и планарную (ТСХ) хроматографии.
• Б. по полярности неподвижной/подвижной фаз и по
механизму удерживания/разделения:
• - прямо-фазовую ЖХ (НФ – полярная, ПФ –
неполярные жидкости)
• - обращенно-фазовую ЖХ (НФ – неполярная или
среднеполярная, ПФ – полярные жидкости).
• - ионообменная или ионная.
• - эксклюзионная (гель-хроматография).
2
3.
34. Оборудование (принципиальная схема)
45. Варианты проведения ЖХ
• 1. Изократический режим – постоянный состав ПФ втечение всего анализа (разделение родственных
веществ, мало отличающихся по полярности).
• 2. Градиентный режим – изменяется состав ПФ
(линейный градиент – с постоянной скоростью и
нелинейный градиент – изменение состава с
переменной скоростью) – для разделения веществ,
отличающихся по полярности (например, смесей
водо- и жирорастворимых витаминов), для
повышения эффективности разделения.
5
6. Хроматографические колонки
• Стальные трубки внутренним диаметром 2-5 мм,длиной 5-30 см, с пористыми фильтрами с обоих
концов. Для защиты аналитической колонки
используются сменные предколонки (длиной 1-2 см).
6
7. Неподвижные фазы
• Общие требования:• 1. Для обеспечения высокой эффективности
разделения – размер частиц сорбента должен
быть четко установленного размера (1,8 – 10
мкм), четко сферической формы.
• 2. Должен быть устойчивым к повышенному
давлению (нехрупким), к химическим
веществам (устойчивость при рН 2-8) и
температуре (до 60-80оС).
• 3. Обладать высокой удельной поверхностью
(60-300 м2/г) и определенным размером пор
(10-300 нм).
• 4. Обратимая сорбция разделенных
соединений.
7
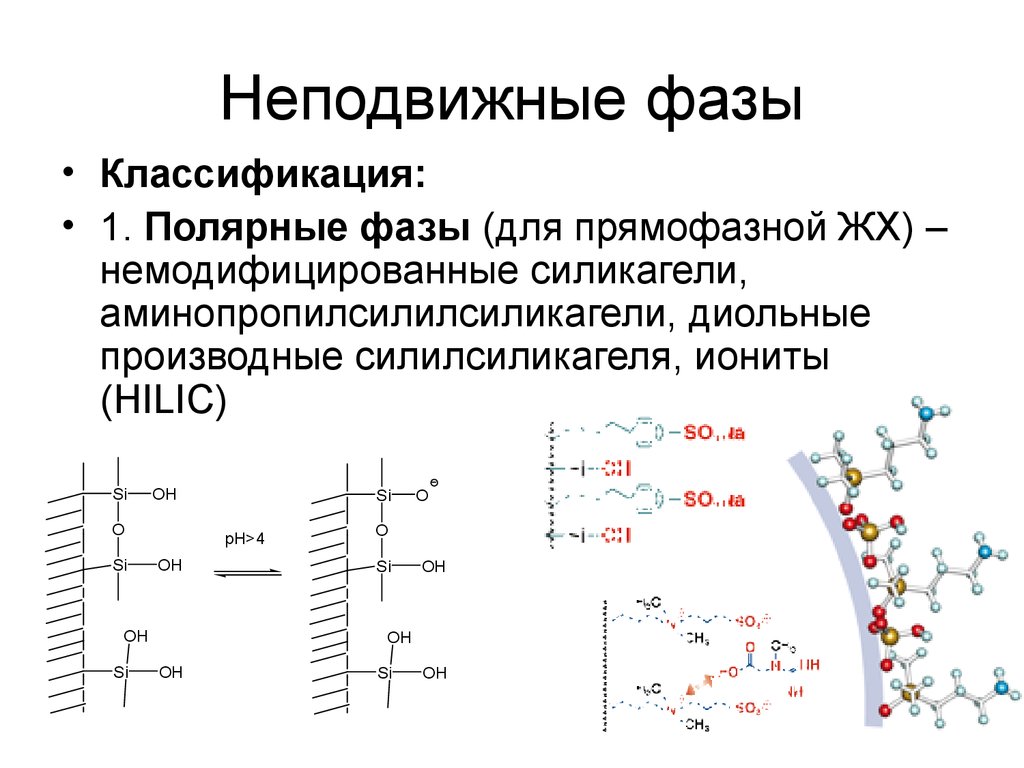
8. Неподвижные фазы
• Классификация:• 1. Полярные фазы (для прямофазной ЖХ) –
немодифицированные силикагели,
аминопропилсилилсиликагели, диольные
производные силилсиликагеля, иониты
(HILIC)
Si
OH
O
Si
pH>4
OH
OH
Si
Si
O
O
Si
OH
OH
OH
Si
OH
8
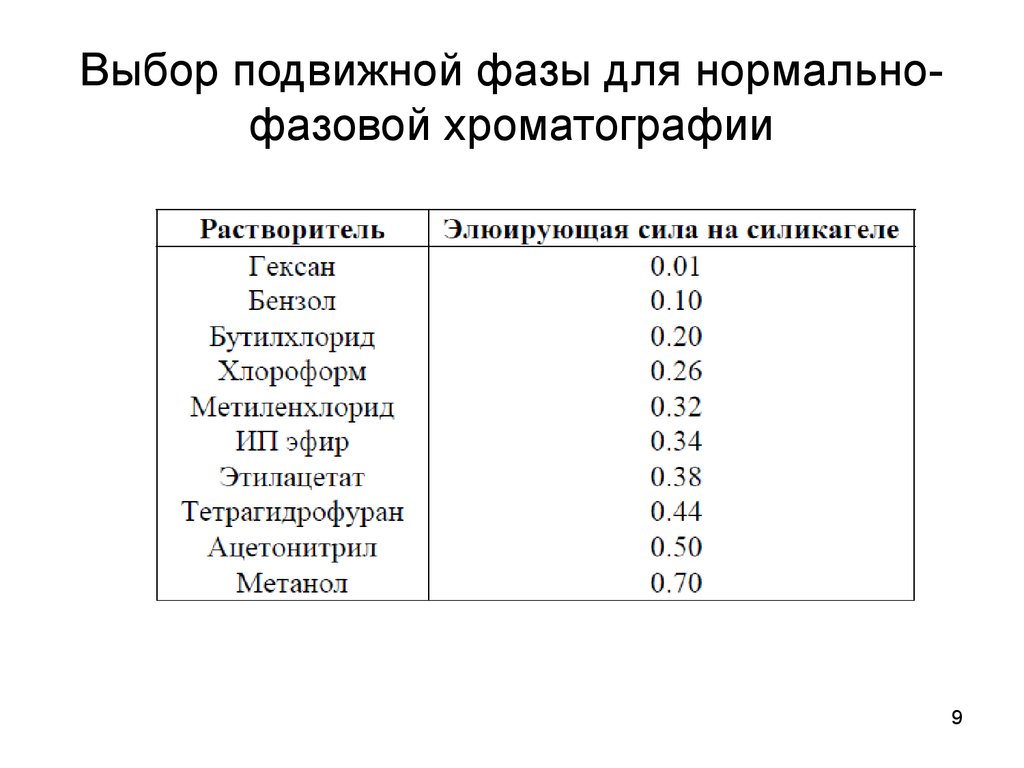
9. Выбор подвижной фазы для нормально-фазовой хроматографии
Выбор подвижной фазы для нормальнофазовой хроматографии9
10. Неподвижные фазы
2. Среднеполярные фазы (для обращеннофазовой ЖХ) – химически модифицированныесиликагели с привитыми цианопропильными
(СN), пентафторбензильными (PFP),
фенильными (Ph), фенил-гексильными группами.
10
11. Неподвижные фазы
3. Неполярные фазы (для обращеннофазовой ЖХ) – химическимодифицированные силикагели с привитыми
октильными (С8), октадецильными (С18),
фенильными и октадецильными (С18-Ph), и
др.
11
12.
1213. Принципы разделения
• 1. Полярные фазы –• 1.1. для разделения неполярных и
малополярных веществ (слабо
адсорбируются НФ) – малополярные
элюенты (гексан (гептан) + низкая доля
полярного растворителя, дихлорметан +
низкая доля полярного растворителя).
• 1.2. для разделения полярных веществ
(сильно адсорбируются НФ) – высокая доля
полярных растворителей (метанол,
ацетонитрил, вода), необходимо
устанавливать рН (от 2 до 9), добавлять
буферный раствор (ионная сила).
13
14. Принципы разделения
• 2. Средне- и неполярные фазы:• 2.1. Для разделения неполярных веществ
используются ПФ с высоким (40-100%) содержанием
органического растворителя (ацетонитрил, метанол,
тетрагидрофуран).
• 2.2. Для разделения ионизируемых органических
веществ (кислот, оснований, амфолитов, ионов)
необходимо использовать буферные растворы (рН 28 или для ряда колонок – 1-10).
• 2.3. Для разделения органических ионов и
сильнополярных веществ – прибавляют ион-парные
реагенты (алкилсульфонаты, четвертичные
аммониевые соли).
14
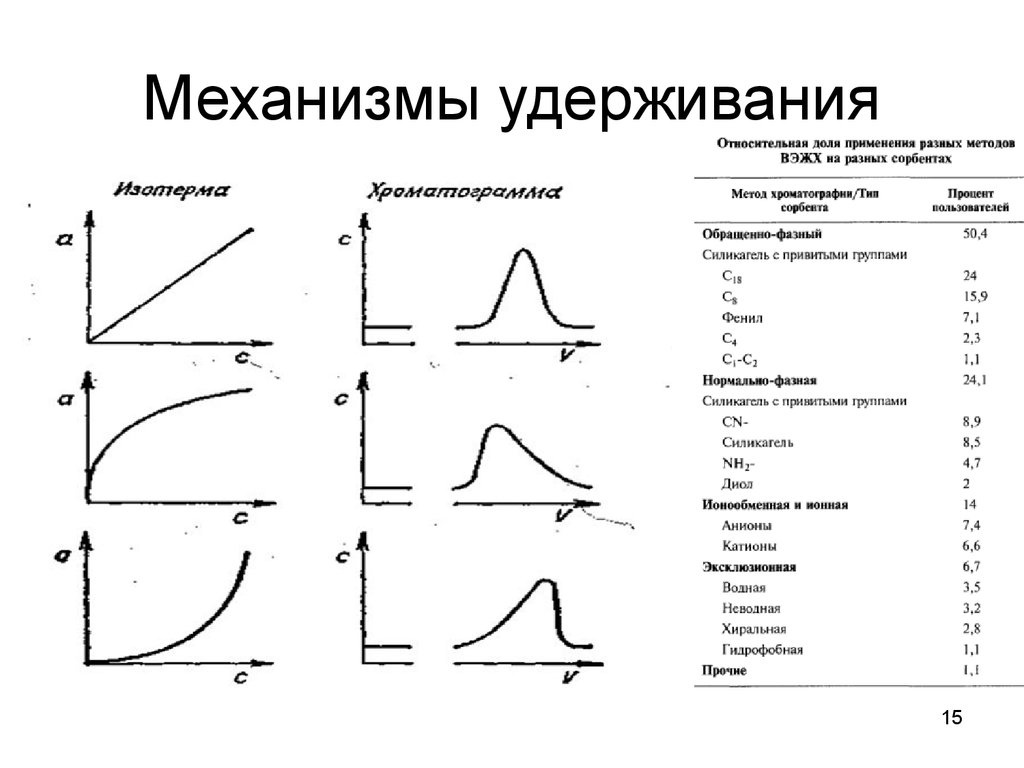
15. Механизмы удерживания
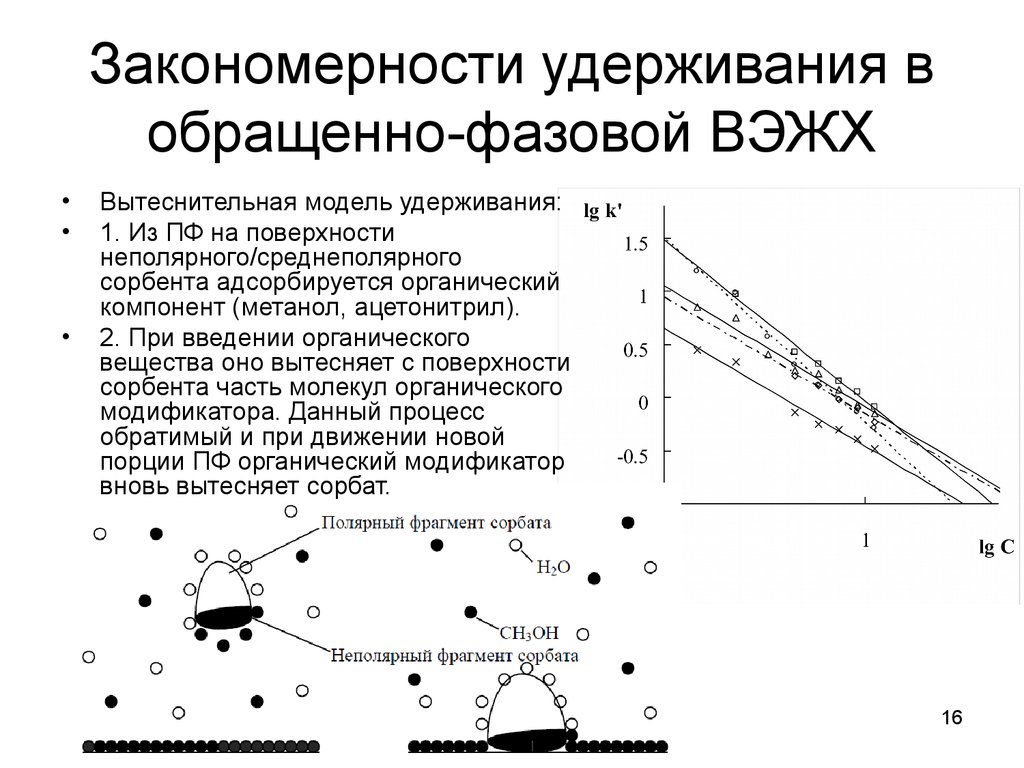
1516. Закономерности удерживания в обращенно-фазовой ВЭЖХ
Вытеснительная модель удерживания:
1. Из ПФ на поверхности
неполярного/среднеполярного
сорбента адсорбируется органический
компонент (метанол, ацетонитрил).
2. При введении органического
вещества оно вытесняет с поверхности
сорбента часть молекул органического
модификатора. Данный процесс
обратимый и при движении новой
порции ПФ органический модификатор
вновь вытесняет сорбат.
16
17. Влияние рН ПФ и температуры
• На неполярных фазах за счет дисперсионныхвзаимодействий лучше удерживаются
неионизированные молекулы. При
ионизации молекул удерживание при прочих
равных условиях уменьшается.
• Температура незначительно влияет на
удерживание органических молекул в водноорганических фазах. При повышении
температуры уменьшается вязкость ПФ и
давление на колонке (возможно работать на
более высоких скоростях ПФ).
17
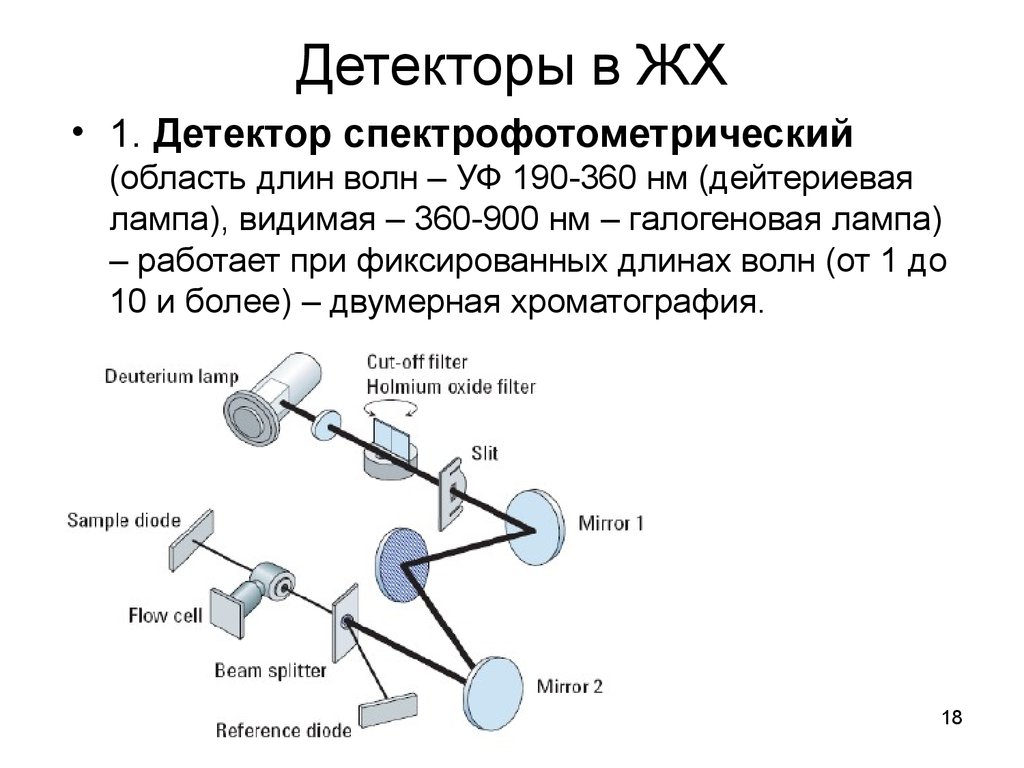
18. Детекторы в ЖХ
• 1. Детектор спектрофотометрический(область длин волн – УФ 190-360 нм (дейтериевая
лампа), видимая – 360-900 нм – галогеновая лампа)
– работает при фиксированных длинах волн (от 1 до
10 и более) – двумерная хроматография.
18
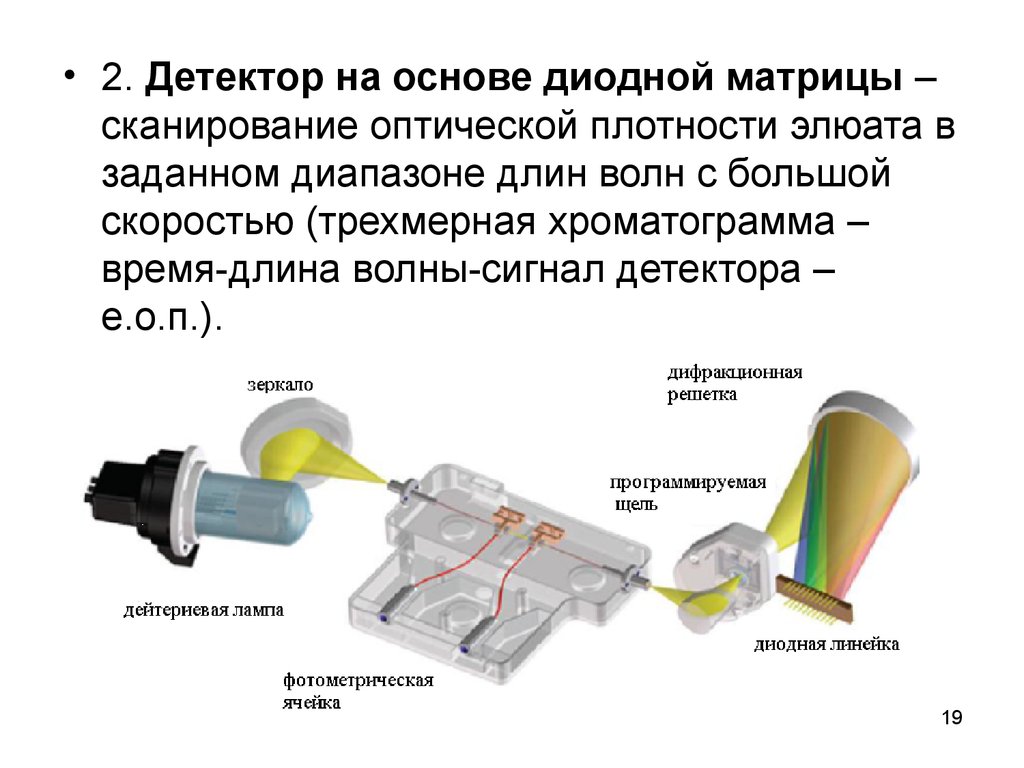
19.
• 2. Детектор на основе диодной матрицы –сканирование оптической плотности элюата в
заданном диапазоне длин волн с большой
скоростью (трехмерная хроматограмма –
время-длина волны-сигнал детектора –
е.о.п.).
19
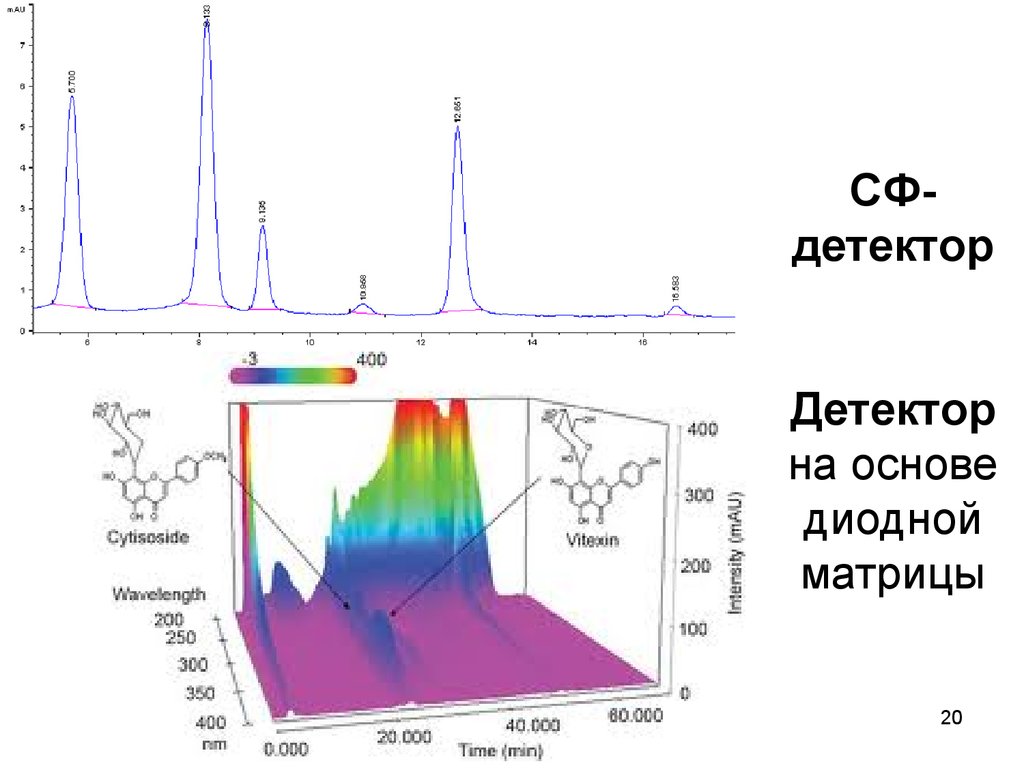
20. СФ-детектор Детектор на основе диодной матрицы
СФдетекторДетектор
на основе
диодной
матрицы
20
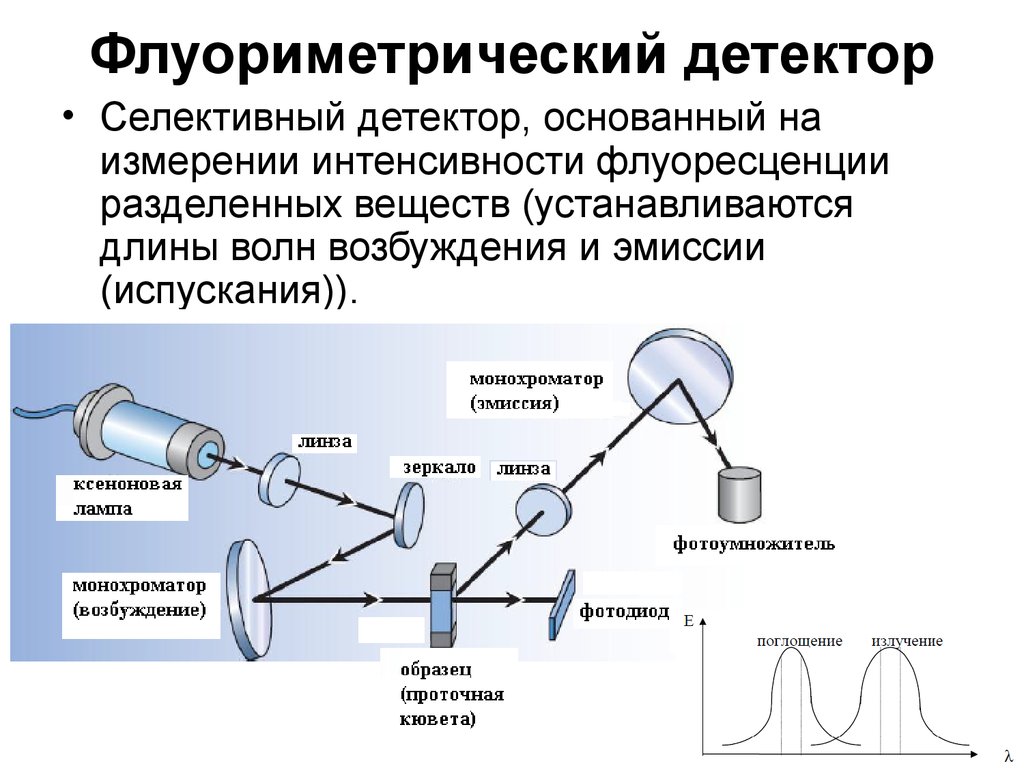
21. Флуориметрический детектор
• Селективный детектор, основанный наизмерении интенсивности флуоресценции
разделенных веществ (устанавливаются
длины волн возбуждения и эмиссии
(испускания)).
21
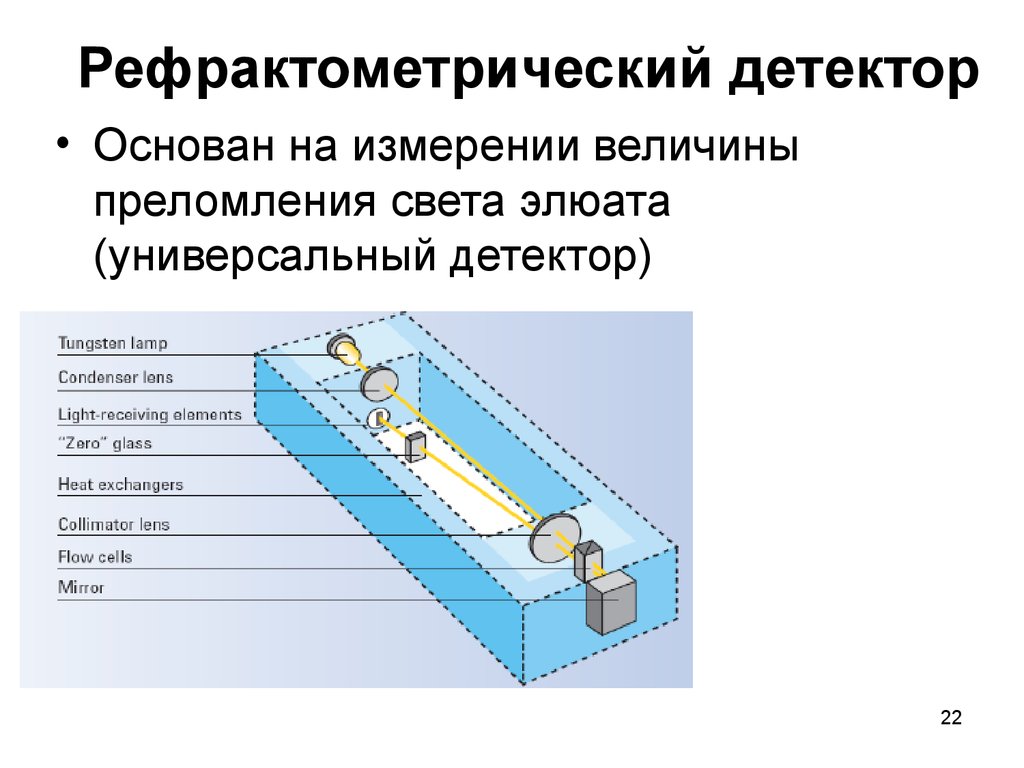
22. Рефрактометрический детектор
• Основан на измерении величиныпреломления света элюата
(универсальный детектор)
22
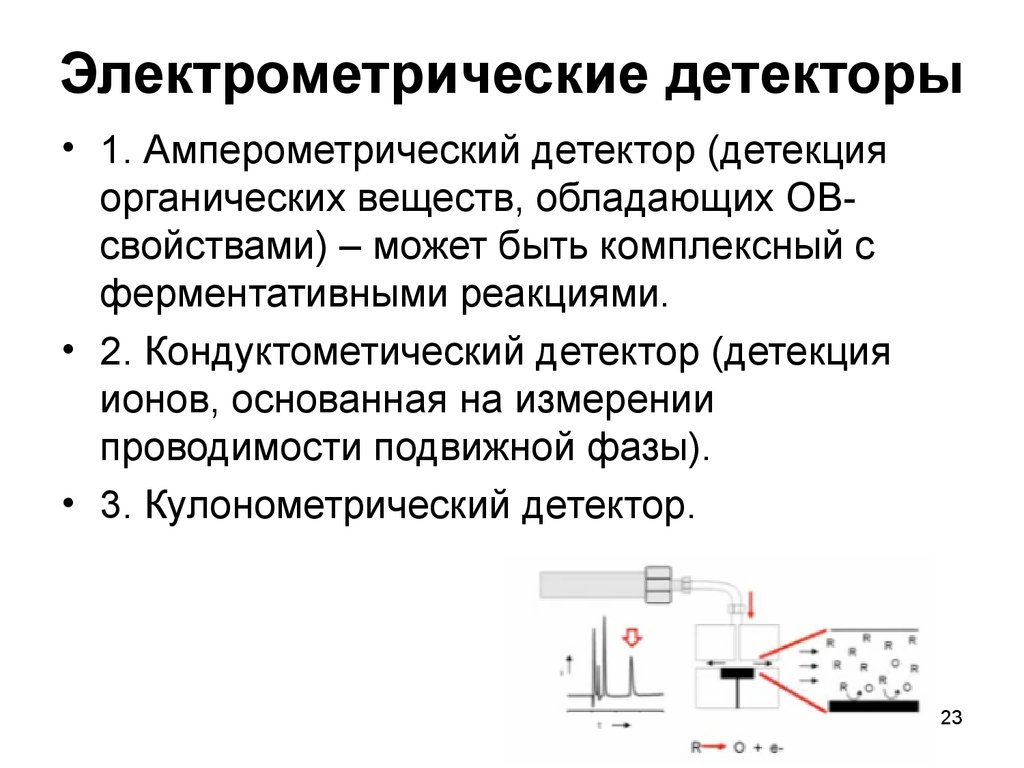
23. Электрометрические детекторы
• 1. Амперометрический детектор (детекцияорганических веществ, обладающих ОВсвойствами) – может быть комплексный с
ферментативными реакциями.
• 2. Кондуктометический детектор (детекция
ионов, основанная на измерении
проводимости подвижной фазы).
• 3. Кулонометрический детектор.
23
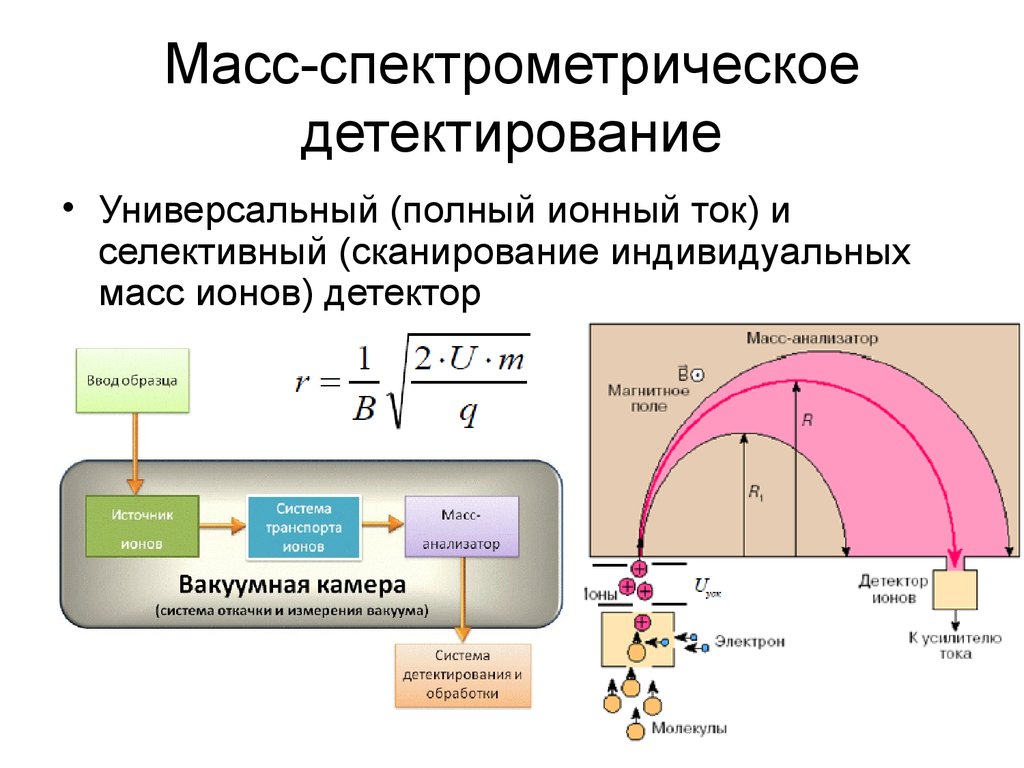
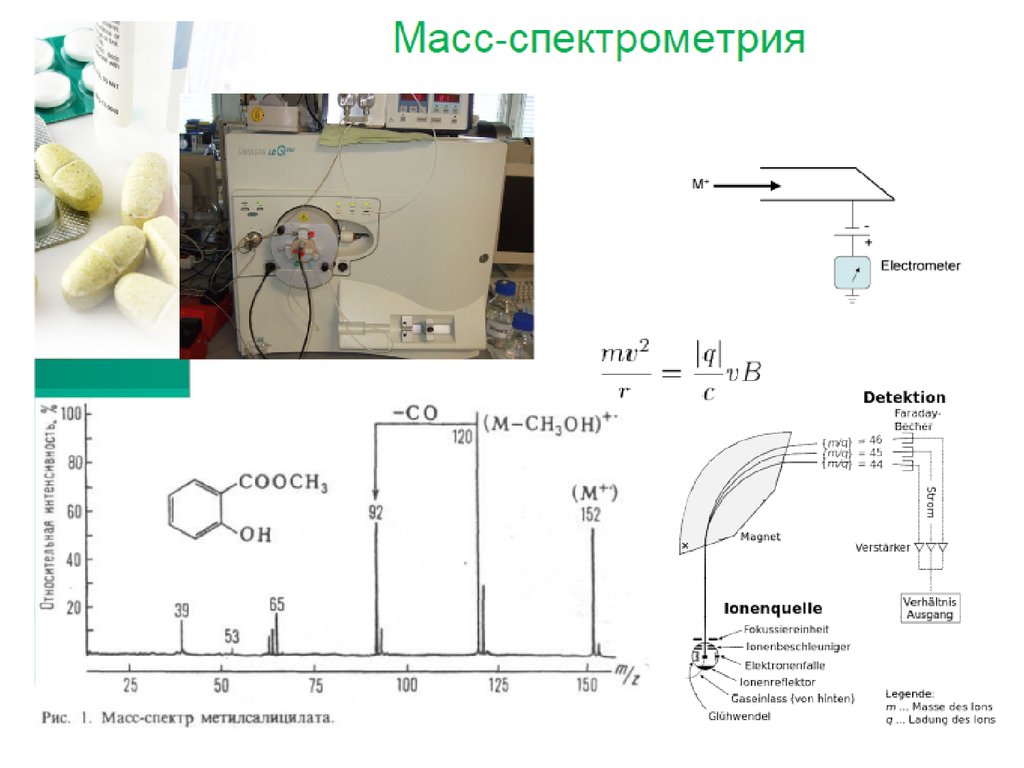
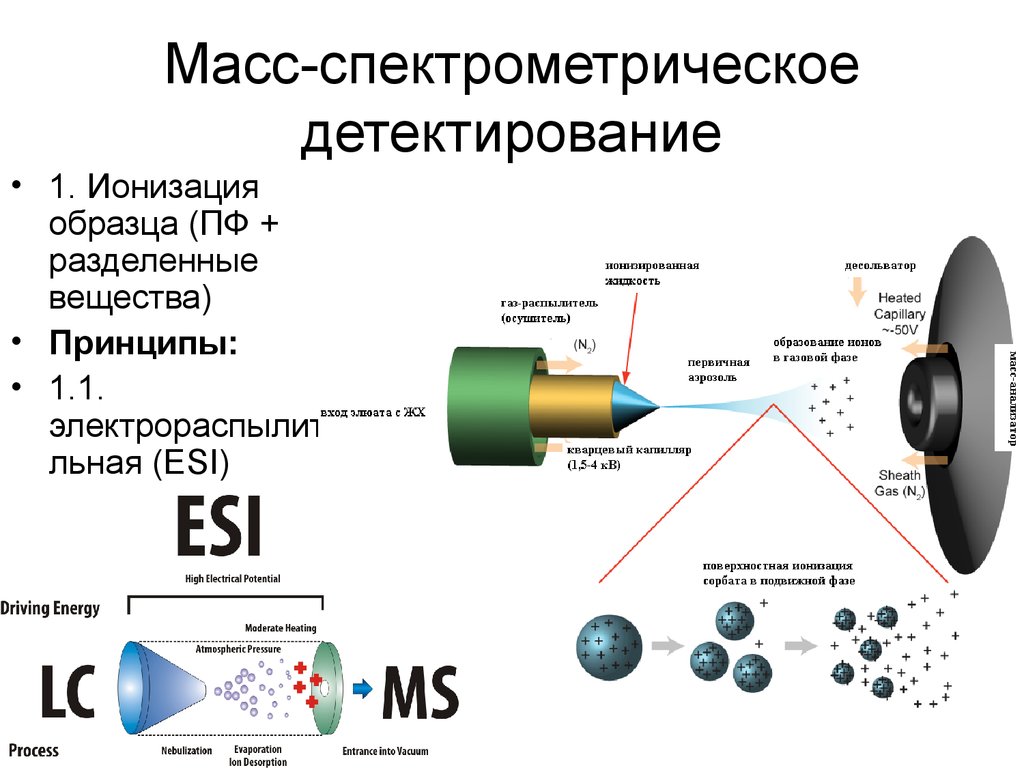
24. Масс-спектрометрическое детектирование
• Универсальный (полный ионный ток) иселективный (сканирование индивидуальных
масс ионов) детектор
24
25.
2526. Масс-спектрометрическое детектирование
• 1. Ионизацияобразца (ПФ +
разделенные
вещества)
• Принципы:
• 1.1.
электрораспылите
льная (ESI)
26
27.
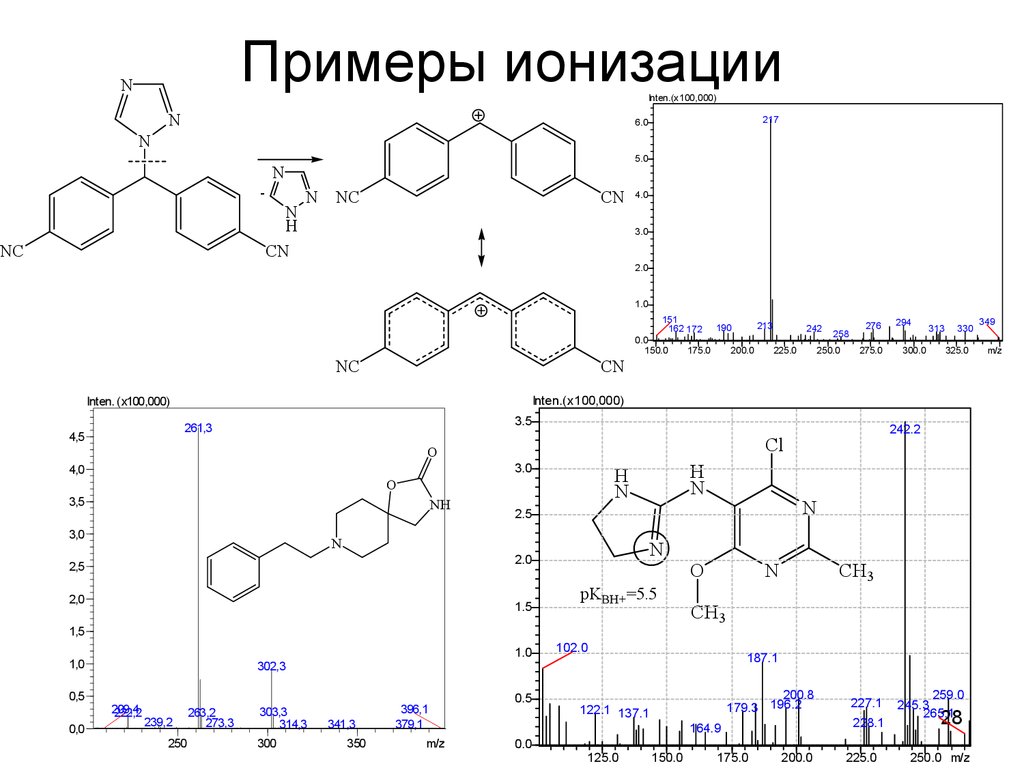
2728. Примеры ионизации
NInten.(x100,000)
N
217
6.0
N
5.0
N
-
N
H
CN
NC
N
NC
CN
4.0
3.0
2.0
1.0
151
162 172
0.0
150.0
NC
175.0
200.0
275.0
294
300.0
313
330
325.0
3.0
NH
3,0
N
2.0
2,0
1.5
pKBH+=5.5
1,5
1,0
1.0
302,3
239,2
250
263,2
273,3
303,3
314,3
300
341,3
350
396,1
379,1
m/z
N
2.5
N
2,5
H
N
H
N
O
3,5
242.2
Cl
O
0,0
250.0
276
Inten.(x100,000)
261,3
209,4
222,2
225.0
258
3.5
4,0
0,5
242
CN
Inten. (x100,000)
4,5
213
190
0.5
O
N
CH3
CH3
102.0
187.1
200.8
179.3 196.2
122.1 137.1
228.1
164.9
0.0
125.0
150.0
175.0
227.1
200.0
225.0
259.0
245.3
265.1
28
250.0 m/z
349
m/z
29. Масс-спектрометрическое детектирование
• 1.2. Химическая ионизация при атмосферномдавлении:
29
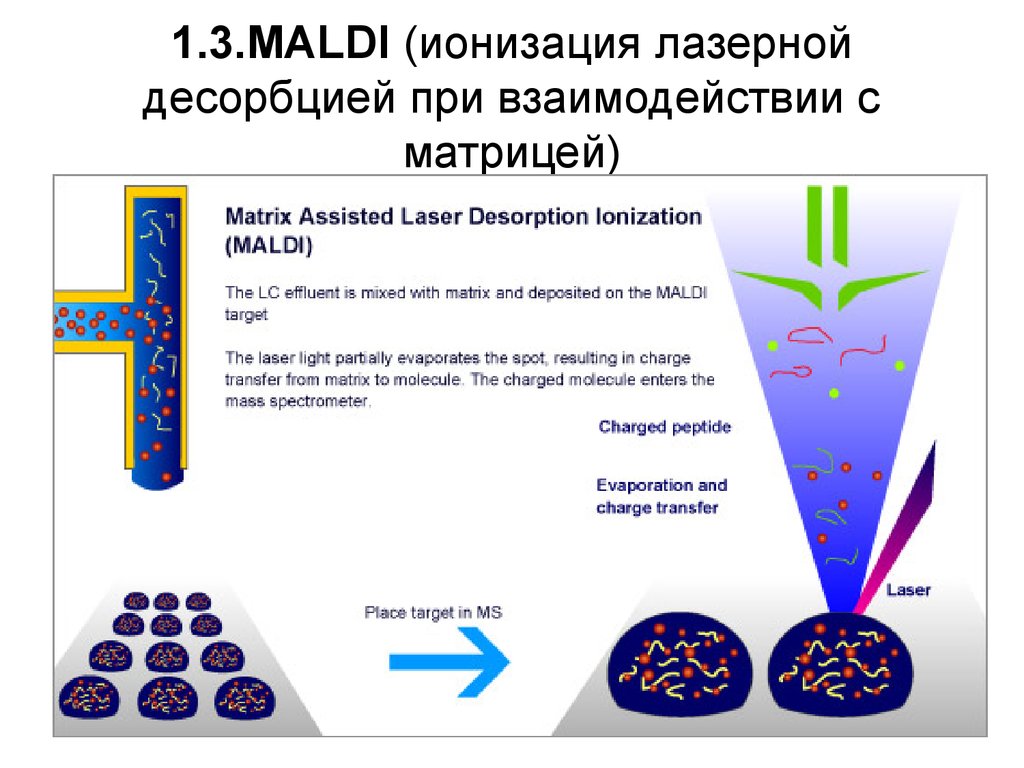
30. 1.3.MALDI (ионизация лазерной десорбцией при взаимодействии с матрицей)
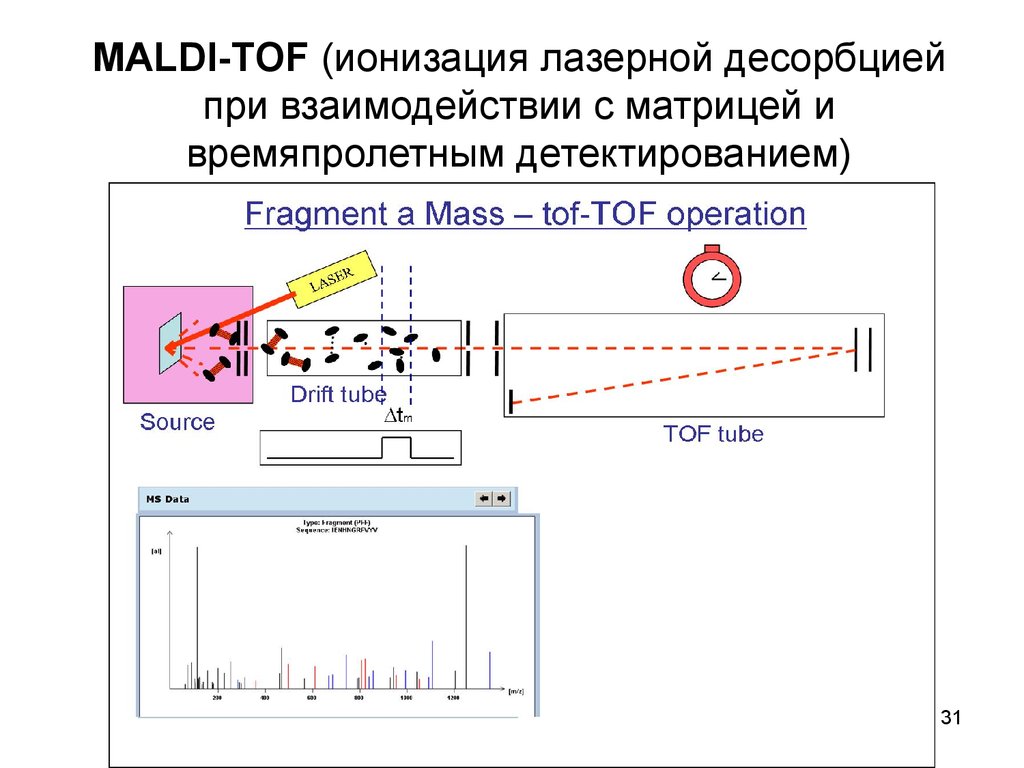
3031. MALDI-TOF (ионизация лазерной десорбцией при взаимодействии с матрицей и времяпролетным детектированием)
3132. Масс-анализаторы
• А. непрерывные масс-анализаторы• 1. Магнитный и электростатический секторный массанализатор (Sector)
• 2. Квадрупольный масс-анализатор (Quadrupole mass
analyzer)
• Б. импульсные масс-анализаторы
• 1. Времяпролётный масс-анализатор (Time-of-flight mass
spectrometry)
• 2. Ионная ловушка (Ion trap)
• 3. Квадрупольная линейная ловушка (Quadrupole ion trap)
• 4. Масс-анализатор ионно-циклотронного резонанса с
Фурье-преобразованием (Fourier transform ion cyclotron
resonance)
• 5. Орбитрэп (Orbitrap)
32
33. Масс-спектрометрическое детектирование
• Достоинства:• 1. Высочайшая чувствительность органических веществ,
биополимеров (10-15 г/пробе).
• 2. Высокая специфичность детекции (последовательная массспектрометрия (дочерних ионов)).
• 3. Метод сбора информации о структуре молекул (точность
установления молярных масс – до 0,0001-0,000001 а.е.м.).
• 4. Широкий линейный диапазон – 106-107.
• 5. Наличие баз данных по масс-спектрам огромного числа
органических веществ (для ГХ/МС).
• 6. Основной детектор при проведении биоэквивалентных
испытаний, допинг-контроля, судебно-химической экспертизы,
исследования метаболизма, генеза БАВ и др.
• Недостатки:
• 1. Сложность и высокая стоимость оборудования и расходных
материалов.
• 2. Необходимо дополнительное обучение непосредственно массспектрометрии и интерпретации спектров.
33
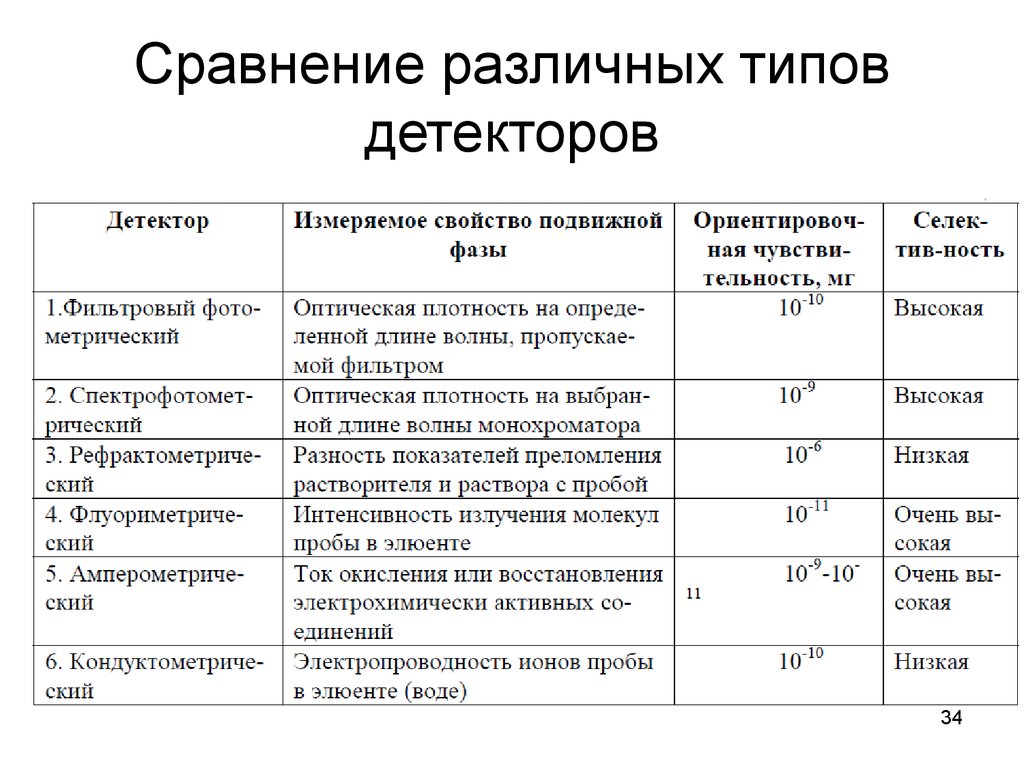
34. Сравнение различных типов детекторов
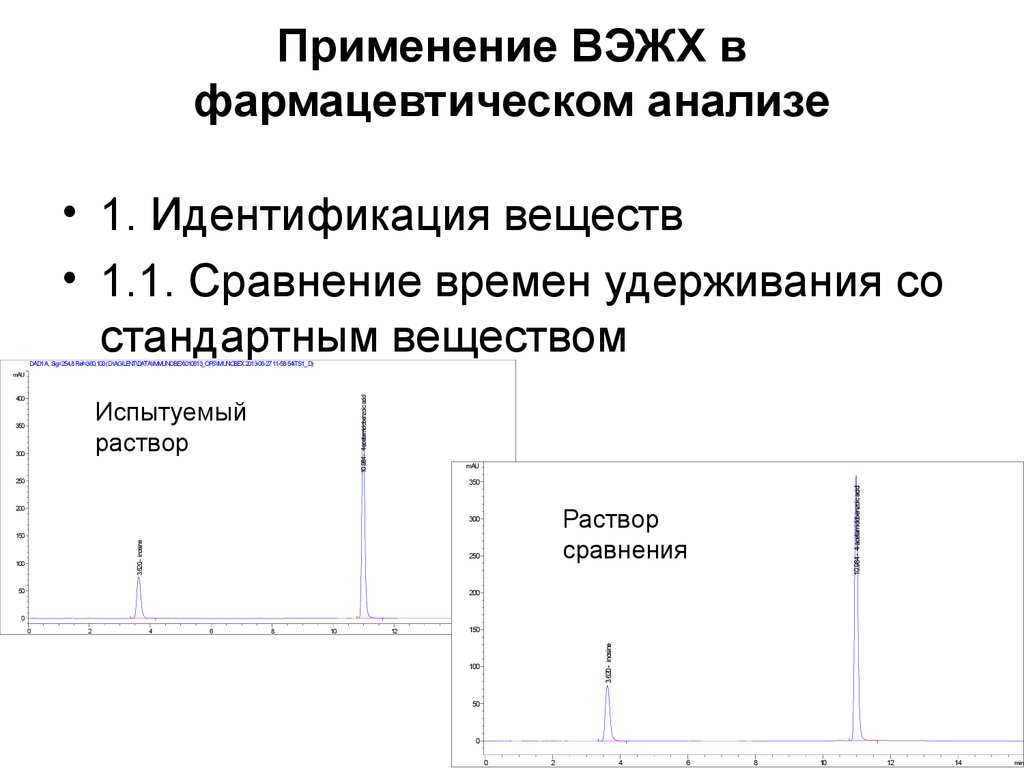
3435. Применение ВЭЖХ в фармацевтическом анализе
• 1. Идентификация веществ• 1.1. Сравнение времен удерживания со
стандартным веществом
DAD1 A, Sig=254,8 Ref=360,100 (D:\AGILENT\DATA\IMMUNOBEX\010613_OPS\IMUNOBEX 2013-06-27 11-58-54\TS1_.D)
400
10.984 - 4-acetamidobenzoic acid
mAU
Испытуемый
раствор
350
300
mAU
250
Раствор
сравнения
200
300
3.620 - inosine
150
100
250
50
10.984 - 4-acetamidobenzoic acid
350
200
0
2
4
6
8
10
12
14
150
min
3.620 - inosine
0
100
50
35
0
0
2
4
6
8
10
12
14
min
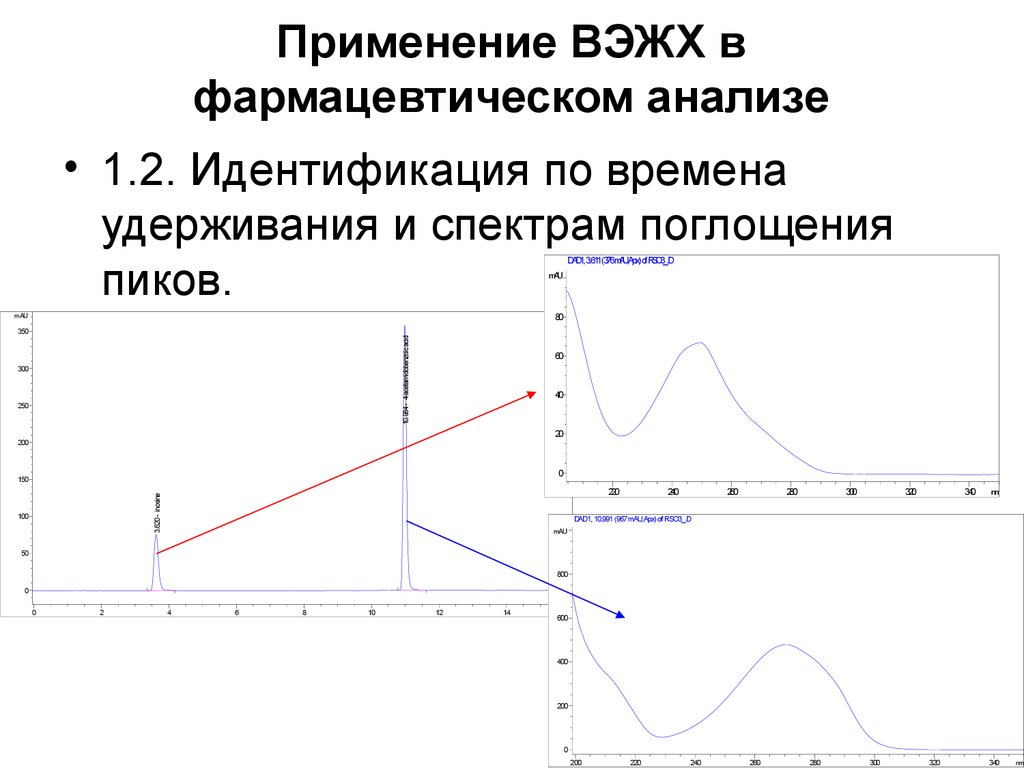
36. Применение ВЭЖХ в фармацевтическом анализе
• 1.2. Идентификация по временаудерживания и спектрам поглощения
пиков.
DAD1, 3.611(376mAU,Apx) of RSO3_.D
mAU
mAU
80
10.984 - 4-acetamidobenzoic acid
350
300
250
60
40
20
200
0
150
3.620 - inosine
220
100
240
260
280
300
320
340
nm
DAD1, 10.991 (967 mAU,Apx) of RSO3_.D
mAU
50
800
0
0
2
4
6
8
10
12
14
min
600
400
200
36
0
200
220
240
260
280
300
320
340
nm
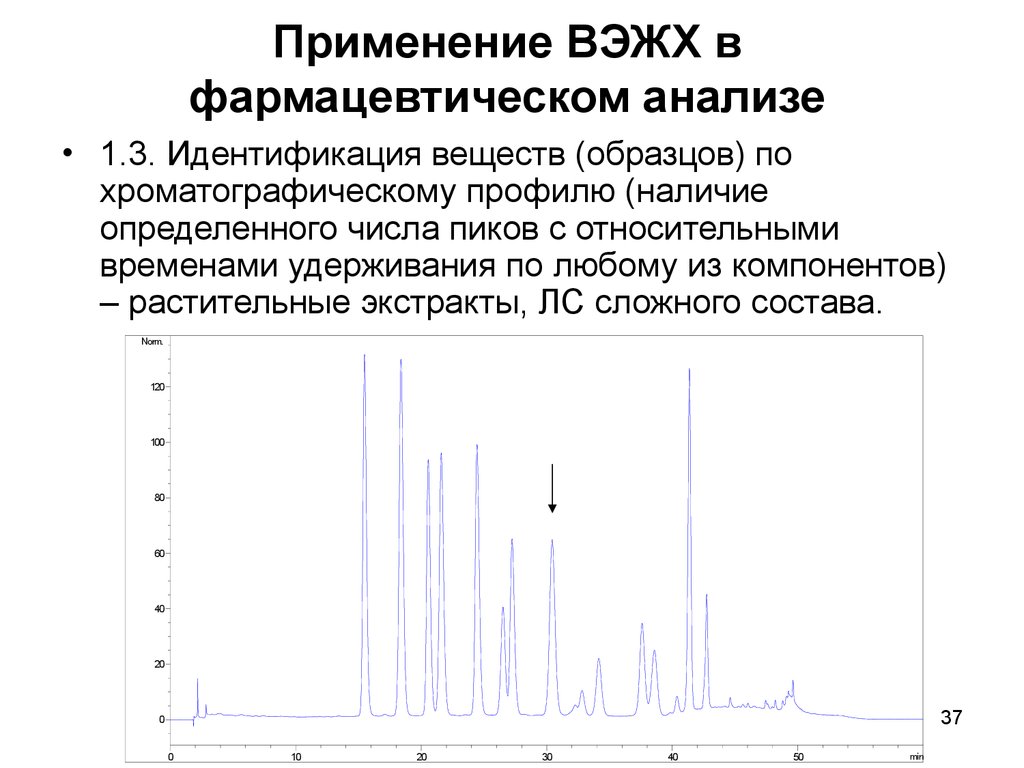
37. Применение ВЭЖХ в фармацевтическом анализе
• 1.3. Идентификация веществ (образцов) похроматографическому профилю (наличие
определенного числа пиков с относительными
временами удерживания по любому из компонентов)
– растительные экстракты, ЛС сложного состава.
Norm.
120
100
80
60
40
20
37
0
0
10
20
30
40
50
min
38. Применение ВЭЖХ в фармацевтическом анализе
• 2. Определение специфических (родственных) примесей –полуколичественный анализ
• 2.1. По стандартному образцу примеси
38
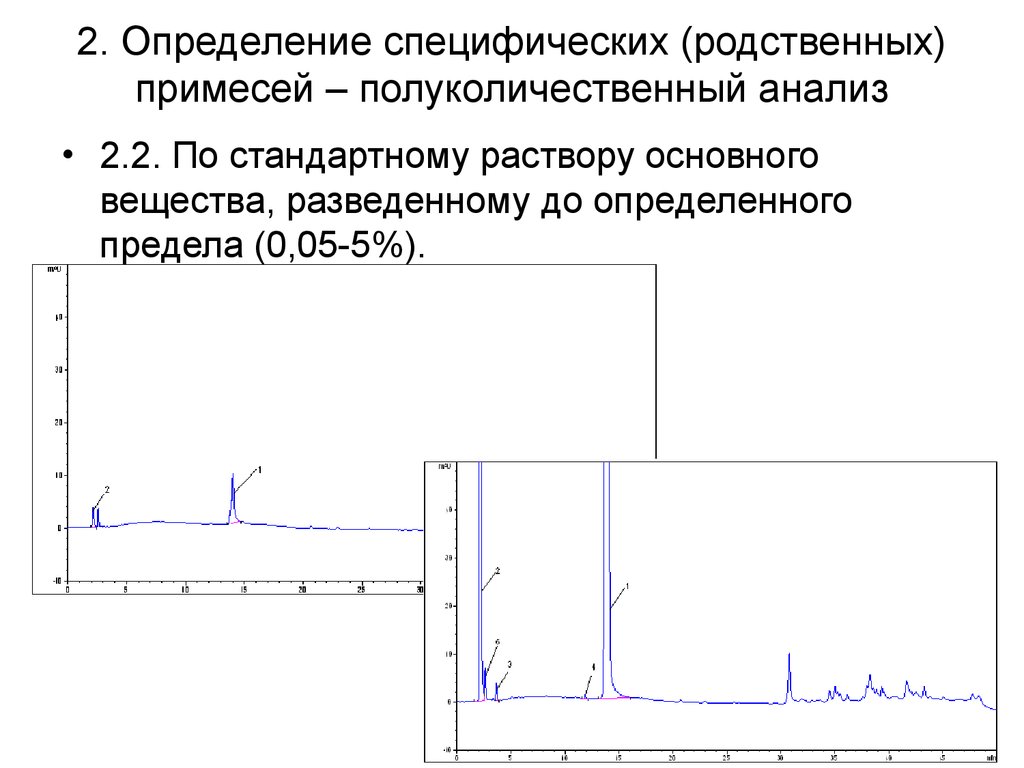
39. 2. Определение специфических (родственных) примесей – полуколичественный анализ
• 2.2. По стандартному раствору основноговещества, разведенному до определенного
предела (0,05-5%).
39
40. 2. Определение специфических (родственных) примесей – полуколичественный анализ
• 2.3. Методом внутренней нормализацииD at af ile N am e: t s _t s _06. 02. 2013_001. lc d
Sam ple N am e: t s
2,25
mAU
237nm4nm (1,00)
2,00
1,75
1,50
1,25
1,00
0,75
0,50
0,25
0,00
-0,25
-0,50
-0,75
-1,00
16.840
Norm.
140
15,0
120
20,0
25,0
30,0
35,0
min
100
80
60
40
20
40
30.663
10,0
24.401
5,0
7.607
-1,75
29.325
-1,50
27.934
-1,25
0
0
5
10
15
20
25
30
35
40
min
41. Определение специфических (родственных) примесей
• 2.4. Количественноеопределение (например,
токсичные примеси) –
методом градуировочного
графика
41
42. 2.5. Определение энантиомерной чистоты
4243. Применение ВЭЖХ в фармацевтическом анализе
• 3. Определение основных показателей готовыхлекарственных средств – однородность
дозированных единиц, тест «Растворение»,
количественное определение стабилизаторов,
консервантов, красителей и др.
• 4. Определение пластификаторов в упаковочных
материалах.
• 5. Определение остаточных количеств пестицидов
(гербицидов, инсектицидов) в ЛРС, продуктах из
ЛРС.
• 6. Определение остаточных количеств активных
фармацевтических ингредиентов на
оборудовании (контроль отмывки оборудования),
в сточных водах.
43
44. Капиллярный электрофорез
• Метод капиллярного электрофореза (КЭ) основан наразделении заряженных компонентов сложной смеси в
кварцевом капилляре под действием приложенного
электрического поля за счёт подачи высокого
напряжения к концам капилляра.
• Наиболее распространёнными вариантами метода КЭ
являются: 1 капиллярный зонный электрофорез (КЗЭ)
• 2. мицеллярная электрокинетическая хроматография
(МЭКХ).
• КЗЭ - метод разделения, реализуемый в капиллярах и
основанный на различии в электрокинетических
подвижностях заряженных частиц как в водных, так и в
неводных электролитах.
44
45. Капиллярный электрофорез
МЭКХ - вариант капиллярного электрофореза, который
позволяет проводить разделение соединений ионного и
нейтрального характера при использовании ПАВ. Разделение
электро-нейтральных соединений осуществляется благодаря
введению в состав ведущего электролита поверхностноактивных веществ - мицеллообразователей. Чаще всего
используют анионный ПАВ (например, ДДС) в концентрациях,
превышающих критическую концентрацию мицелообразования,
что приводит к формированию так называемой
«псевдостационарной фазы», и аналиты распределяются
между мицеллой и буферным электролитом согласно их
гидрофобности.
45
46.
После подачи к концам капилляра высокого напряжения (до 30
кВ), компоненты смеси начинают двигаться по капилляру с
разной скоростью, зависящей в первую очередь от заряда и
величины ионного радиуса и, соответственно, в разное время
достигают зоны детектирования. Полученная
последовательность пиков называется
электрофореграммой, при этом качественной
характеристикой вещества является параметр удерживания
(время миграции), а количественной – высота или площадь
пика, пропорциональная концентрации вещества.
46
47. Основные параметры КЭ
1. Время миграции (tм) - время, необходимое компоненту для
прохождения им эффективной длины капилляра (Lэфф) от зоны ввода
пробы (начала капилляра) до зоны детектирования;
2. Электроосмотический поток (ЭОП) - течение жидкости в
капилляре под действием приложенного электрического поля.
Время, необходимое жидкости для преодоления эффективной
длины капилляра вследствие возникающего ЭОП, называют
временем ЭОП (tэоп) и экспериментально определяют из
электрофореграммы по времени миграции нейтрального компонента
– маркера ЭОП.
3. Подвижность ЭОП (μэоп) - представляет собой отношение
скорости ЭОП к напряженности электрического поля. Скорость ЭОП
положительна при направлении движения жидкости от входного
участка капилляра к детектору и отрицательна при обратном
направлении. В свою очередь, скорость ЭОП вычисляют по
формуле:
νэоп= Lэфф / tэоп.
47
48.
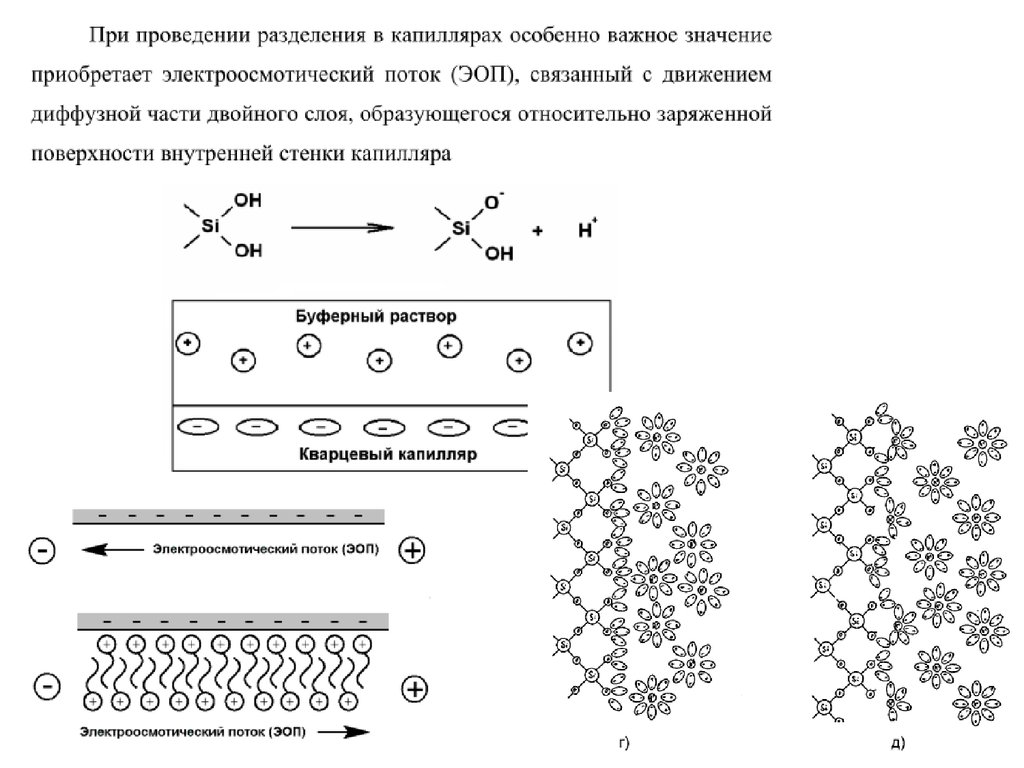
4849. Механизм ЭОП
4950. Электроосмотический поток
• Уникальной особенностью ЭОП является плоскийпрофиль потока в капилляре. Такой профиль выгоден,
поскольку уменьшается размывание зон разделяемых
веществ. Следует отметить, что эффективность разделения
в капиллярном электрофорезе прямо пропорциональна, а
время анализа – обратно пропорционально напряжению,
приложенному к электродам. Разделение в КЭ может быть
выполнено как с положительной, так и отрицательной
полярностью электродов. Зная значения рКа для
компонентов пробы, можно выбрать буфер с подходящим
значением рН и полярность электродов, чтобы образец
двигался в сторону детектора. Скорость миграции зависит
от напряженности электрического поля, которая обычно
составляет 200-400 В/см.
50
51. Капилляры для разделения
Подавляющее большинство разделений в КЭ проводят с
использованием кварцевых капилляров имеющих внешнее
полимерное покрытие, обычно - полиимидное, улучшающее их
механическую прочность, и значительно реже полимерные
капилляры, например из тефлона. Внутренний диаметр
капилляров колеблется в пределах от 25 до 200 микрон, а длина
капилляра в зависимости от поставленной задачи – от
нескольких сантиметров до 1 метра. Поскольку внешнее
полиимидное покрытие непрозрачно в УФ-области, то участок
покрытия удаляют и создают окно для УФ-детектирования.
Капилляр закрепляется в специальной пластиковой кассете.
Надежное термостатирование капилляра является основным
условием получения воспроизводимых времен миграции
определяемого соединения и площади результирующего пика,
что важно для количественного анализа. Используют капилляры
с внутренним диаметром 25-50 мкм, что является
компромиссным решением между достаточно высокой
51
чувствительностью и эффективностью разделения.
52. Ввод образца
Проба может быть введена в капилляр электрофоретическим,
электрокинетическим или вытеснительным способом. Объем вводимой
пробы не превышает 2 нл, относительное стандартное отклонение
составляет 0,03-0,04. При электрофоретическом вводе пробы, к концам
капилляра прикладывается высокое напряжение на фиксированный
промежуток времени, при этом входной конец капилляра погружают в
раствор пробы. Ионы пробы перемещаются в капилляр пропорционально их
электрофоретической подвижности. В случае электрокинетического ввода,
компоненты пробы попадают в капилляр за счет комбинации
электроэндоосмотического давления и электрофоретической подвижности.
Вытеснительный ввод пробы достигается либо за счет создания
избыточного внешнего давления инертного газа, приложенного к резервуару
с образцом, либо за счет создания вакуума на выходе из капилляра или
путем изменения уровня/высоты резервуара, содержащего образец,
относительно резервуара с буферным раствором на выходе из капилляра
(так называемое гравитационное введение пробы).
52
53. Детектирование
Детектирование
53
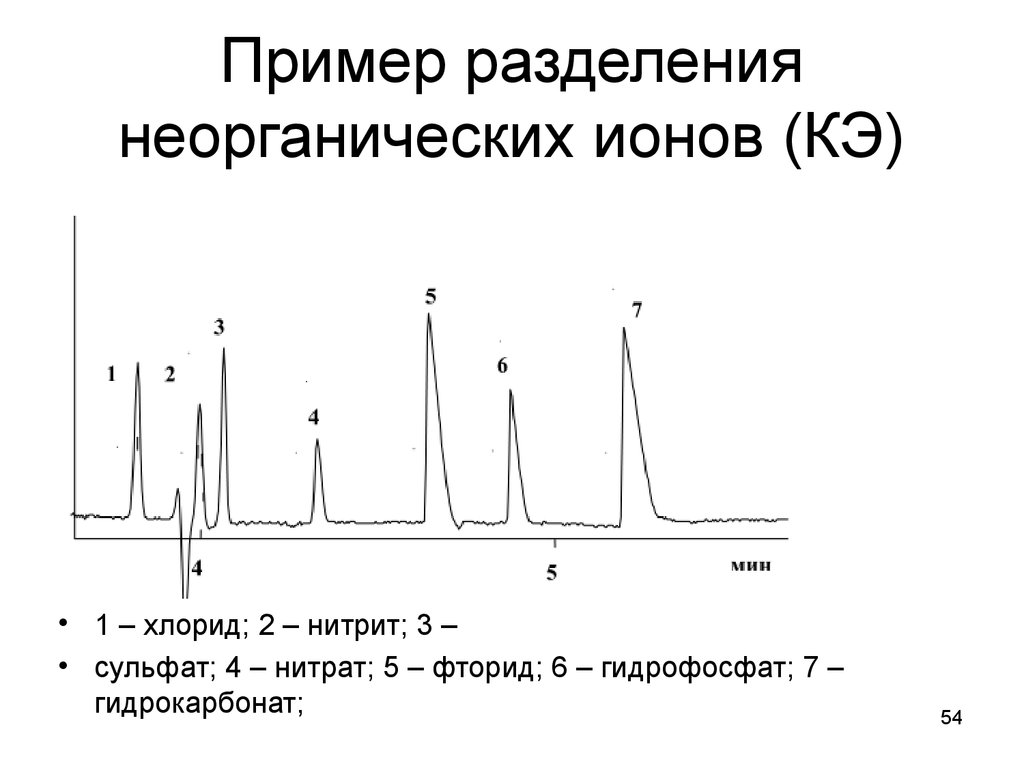
54. Пример разделения неорганических ионов (КЭ)
• 1 – хлорид; 2 – нитрит; 3 –• сульфат; 4 – нитрат; 5 – фторид; 6 – гидрофосфат; 7 –
гидрокарбонат;
54
55.
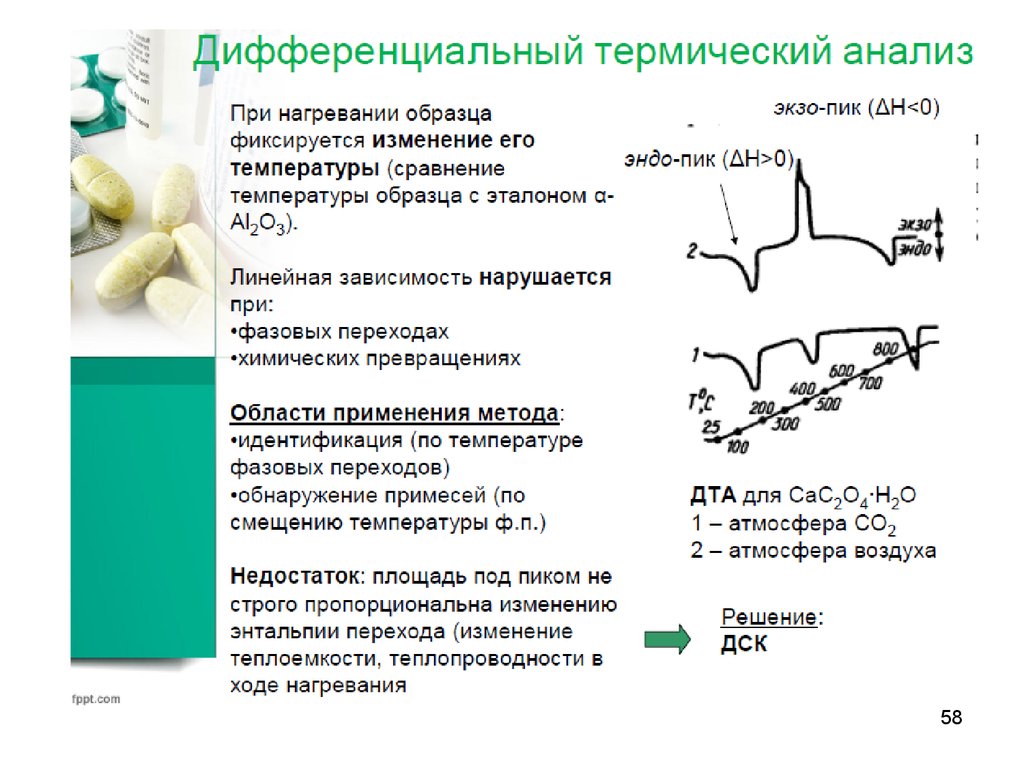
5556. Термические методы анализа
• Основаны на установлении зависимостей различныхфизических или физико-химических свойств веществ
от температуры (градиента температуры).
• А – Термогравиметрия
• Б – Дифференциальный термический
анализ
• В – Дифференциальная сканирующая
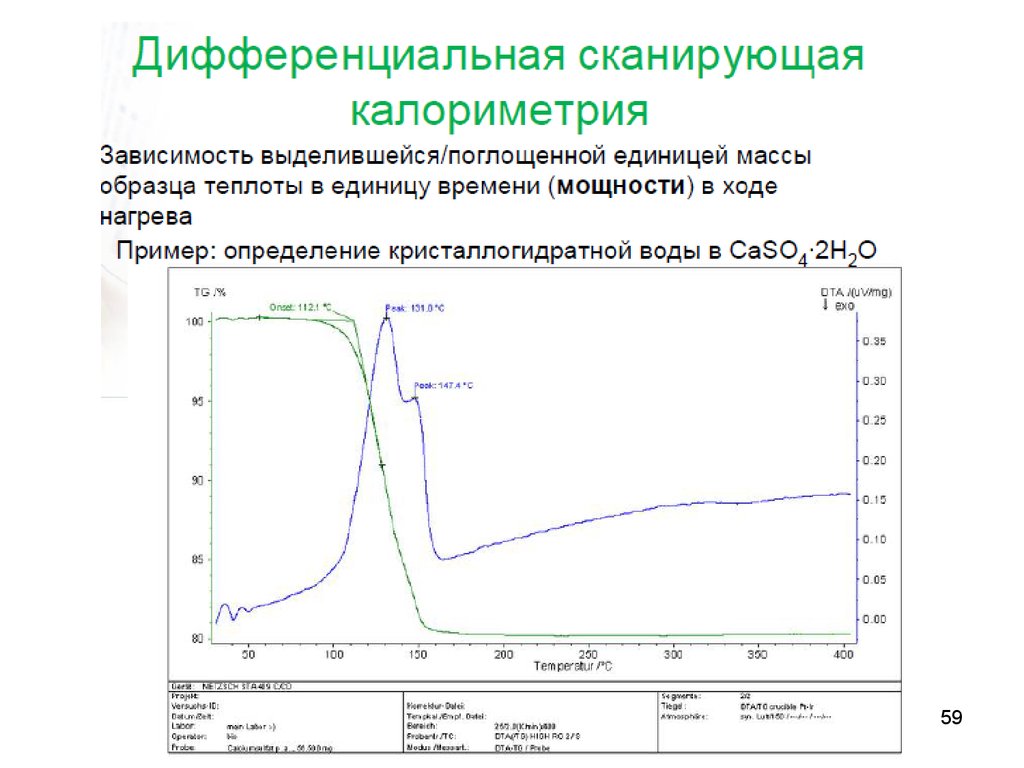
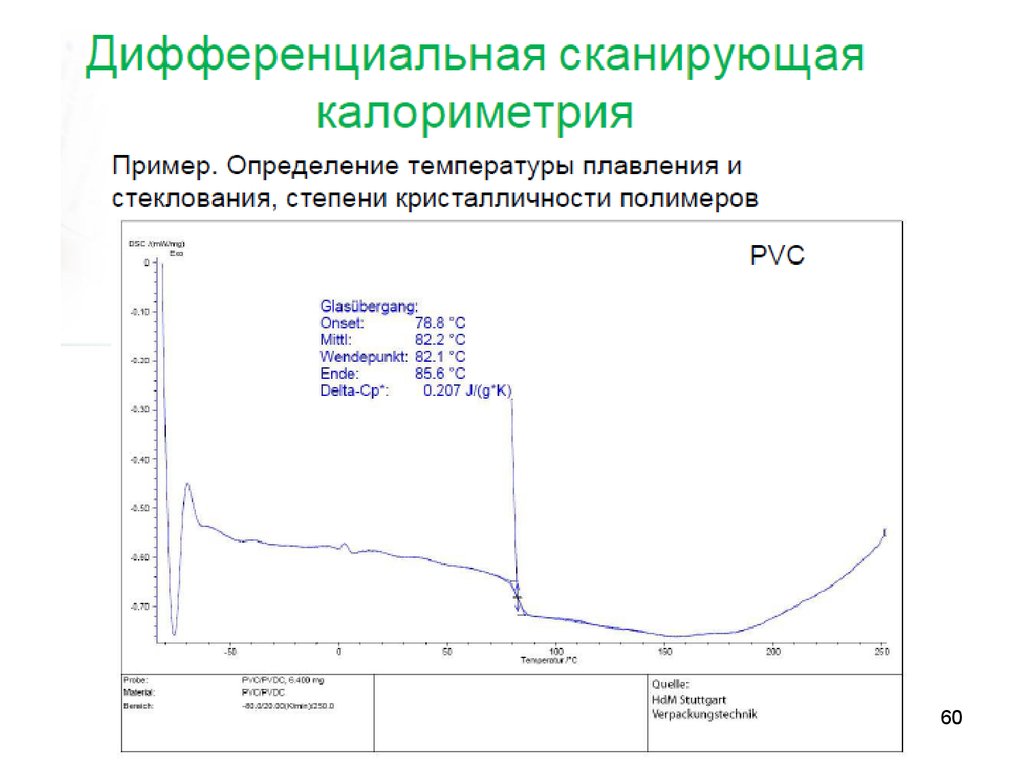
калориметрия
56



































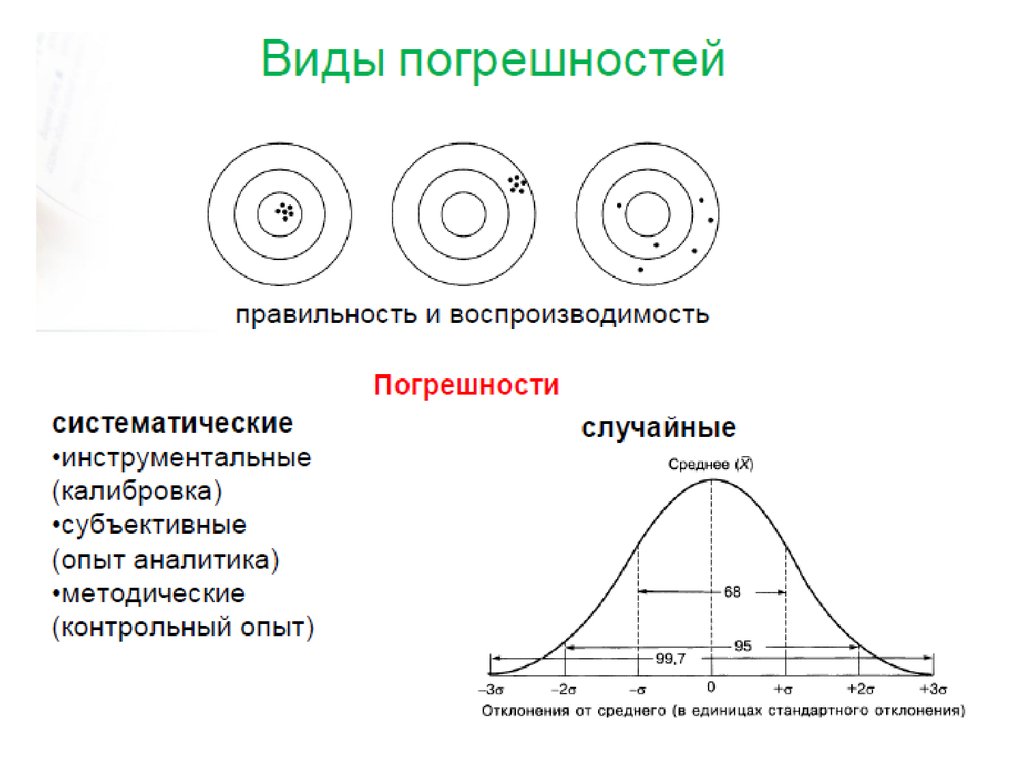







 Физика
Физика








