Похожие презентации:
Группа веществ, изолируемых из биологического объекта путём минерализации («Металлические» яды)
1.
Лекция 1. Группа веществ изолируемых избиологического объекта путём минерализации
(«Металлические» яды).
Вопросы:
1. «Металлические» яды. Общая характеристика.
2.
Классификация
методов
минерализации
биологического
материала.
Назначение.
Достоинства, недостатки.
3. Способы денитрации минерализата.
2.
1.«Металлические» яды.Общая характеристика.
Элементы группы «металлических» ядов:
1. Естественно содержащиеся в организме:
Pb, Mn, Cr, Ag, Cu, Cd, Zn, Hg, As
2. Примесные элементы:
Ba, Bi, Sb, Tl
3.
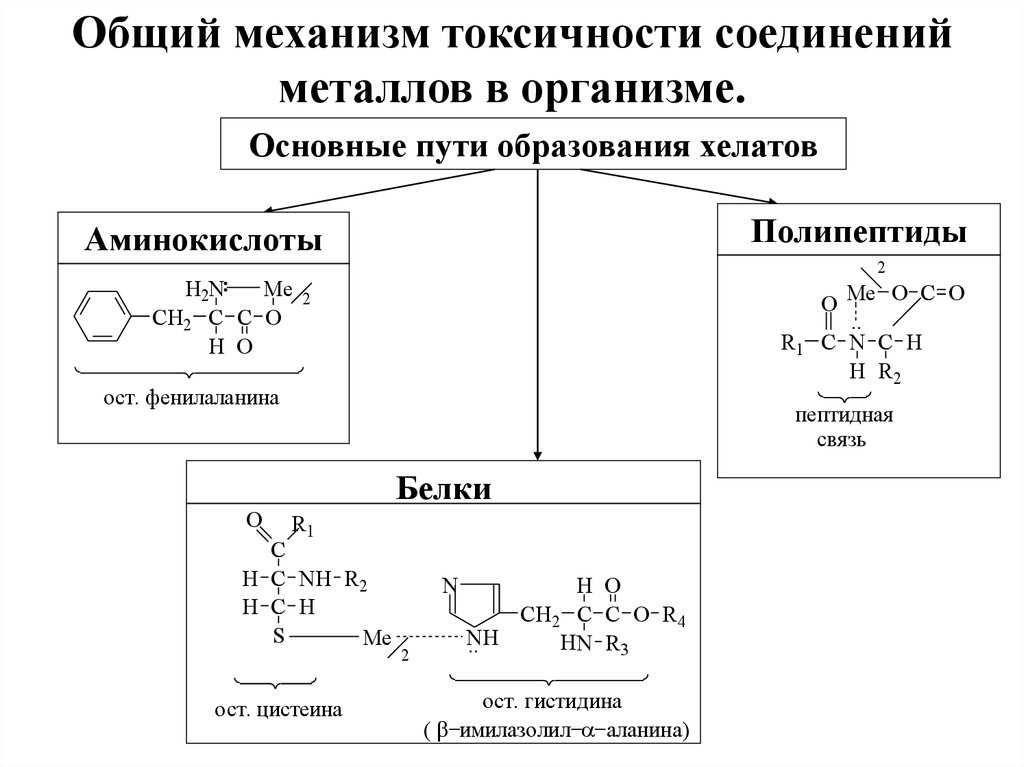
Общий механизм токсичности соединенийметаллов в организме.
Основные пути образования хелатов
Полипептиды
Аминокислоты
H2N
Me
СН2 С С О
Н О
2
2
R1
ост. фенилаланина
пептидная
связь
Белки
O
O Me O C O
..
C N C H
H R2
R1
C
H C NH R2
H C H
S
Me
ост. цистеина
N
2
H O
CH2 C C O R4
NH
HN R3
..
ост. гистидина
( имилазолил аланина)
4.
История развития методов минерализации.1. А.П. Нелюбин [1816] – показал, что металлы в
организме образуют прочные комплексы; он предложил
разрушение комплексов с помощью азотной кислоты.
2. М. Орфила [1821] – предложил применять смесь
концентрированных серной и азотной кислот.
3. А.В. Степанов [1920] – предложил серную кислоту и
нитрат аммония вместо азотной кислоты.
4. Ф.В. Зайковский [НИИСМЭ]; [1951-57] – ввёл этап
денитрации при минерализации биологического объекта.
5. А.Н. Крылова, А.Ф. Рубцов [60 гг] – частный метод
(деструктивный) изолирования из объекта ртути.
5.
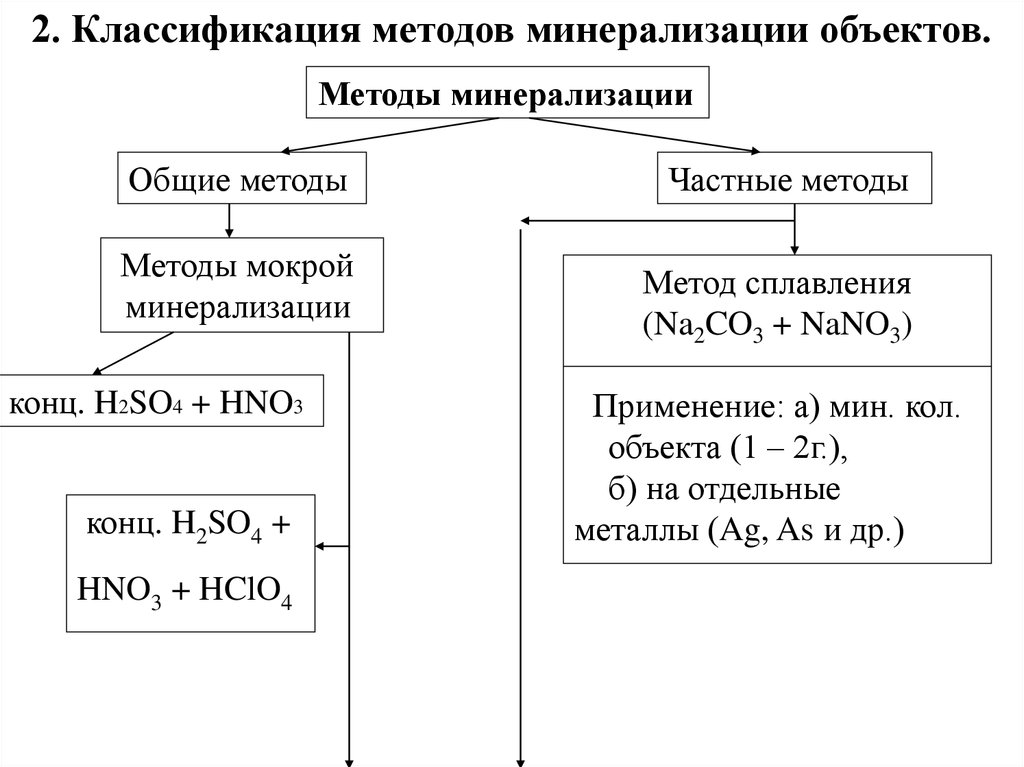
2. Классификация методов минерализации объектов.Методы минерализации
Общие методы
Методы мокрой
минерализации
конц. H2SO4 + HNO3
конц. H2SO4 +
HNO3 + HClO4
Частные методы
Метод сплавления
(Na2CO3 + NaNO3)
Применение: а) мин. кол.
объекта (1 – 2г.),
б) на отдельные
металлы (Ag, As и др.)
6.
конц. H2SO4 + H2O2Метод сухого
озоленения
(t = 300 – 4000, при
доступе воздуха)
Применение: спец.
исследование на
Cu, Mn, Bi, Zn
Метод деструкции
объекта (Hg)
7.
Достоинства метода к.H2SO4 и HNO3:1. Быстрое достижение полноты разрушения
органических компонентов;
2. Высокая чувствительность;
3. Сравнительно малые объёмы получаемого
минерализата.
Недостатки:
1. Значительные потери ртути (95 – 98%);
2. Длительность минерализации.
8.
Достоинства метода к.H2SO4, HNO3 и HClO4:1. Полнота окисления органических веществ;
2.Окисление большинства поливалентных ионов до
высшей валентности;
3. Сокращение времени минерализации в 2 – 3 раза;
4. Небольшой расход окислителей по объёму;
5. Малые объёмы минерализата.
Недостатки:
1. Потери больших количеств ртути;
2. Необходима особая осторожность из-за
взрывоопасности и токсичности хлорной кислоты.
9.
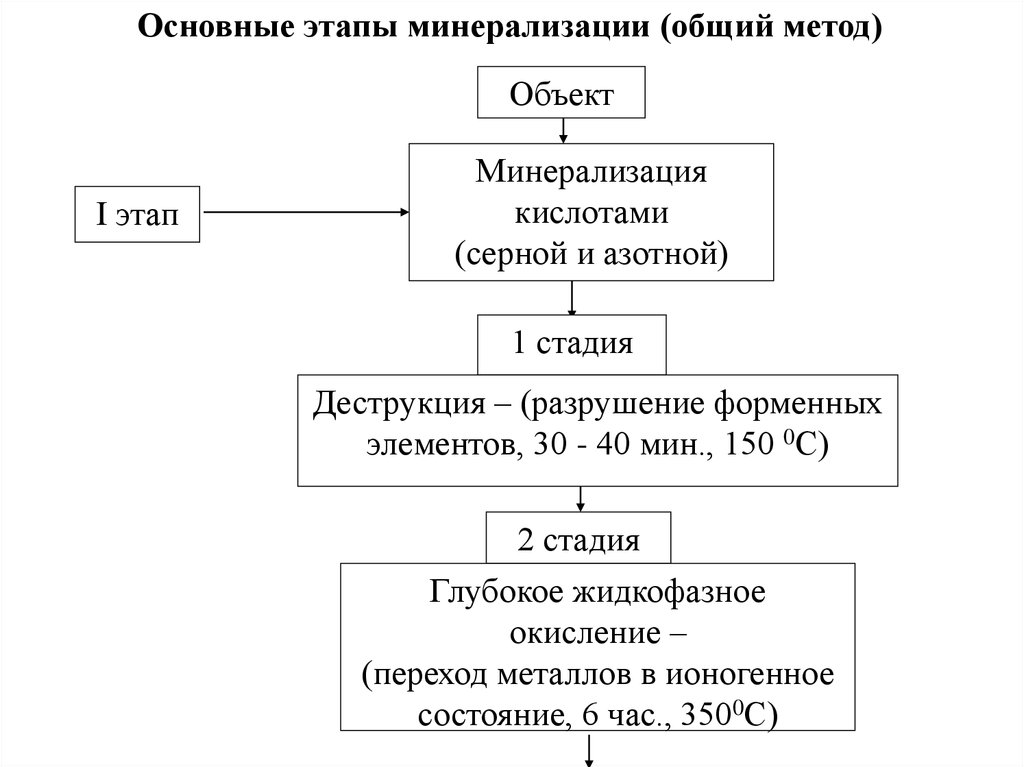
Основные этапы минерализации (общий метод)Объект
I этап
Минерализация
кислотами
(серной и азотной)
1 стадия
Деструкция – (разрушение форменных
элементов, 30 - 40 мин., 150 0С)
2 стадия
Глубокое жидкофазное
окисление –
(переход металлов в ионогенное
состояние, 6 час., 3500С)
10.
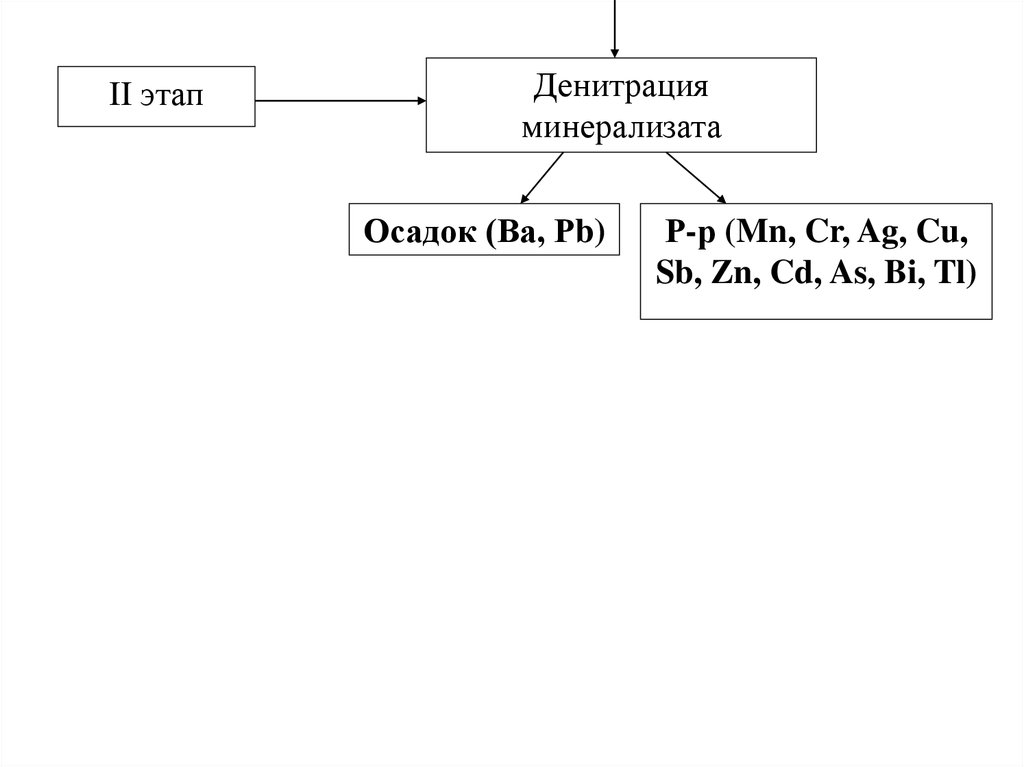
II этапДенитрация
минерализата
Осадок (Ва, Рb)
Р-р (Mn, Cr, Ag, Cu,
Sb, Zn, Cd, As, Bi, Tl)
11.
3. Денитрация минерализата.Окислители и источники окислителей:
изб. HNO3; HNO2; NO; NO2;
нитрозилсерная кислота
12.
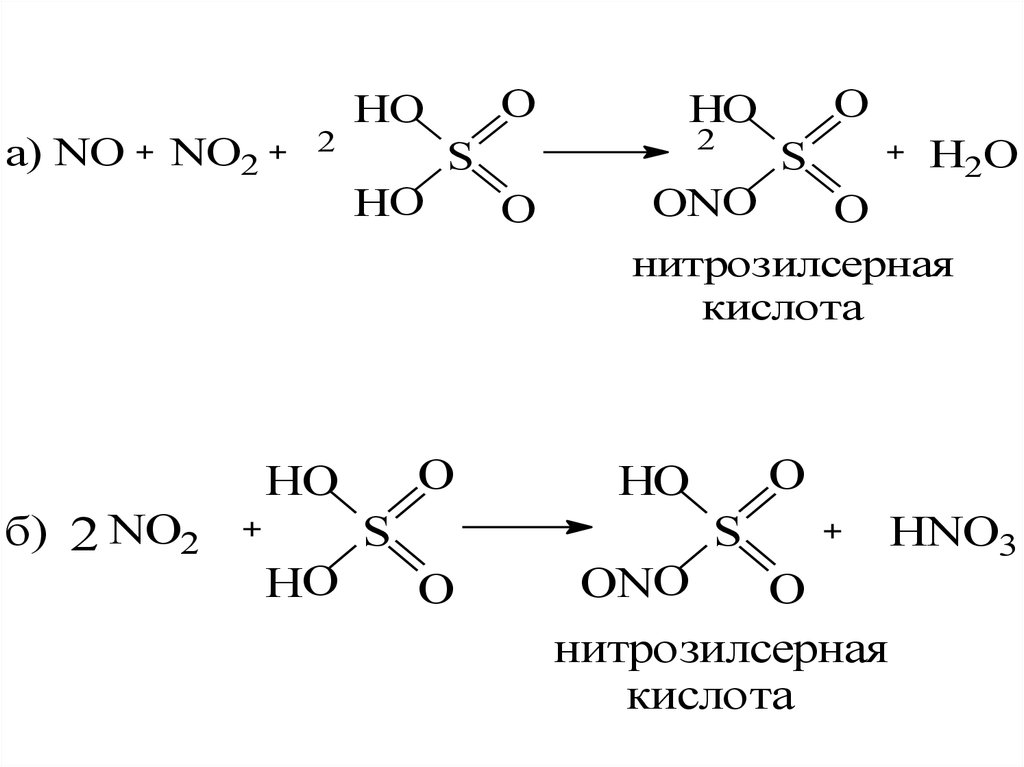
а) NONO2
2
HO
O
O
2
S
ONO
O
HO
S
O
H2O
O
нитрозилсерная
кислота
S
HO
O
HO
S
HO
б) 2 NO2
O
HO
ONO
O
нитрозилсерная
кислота
HNO3
13.
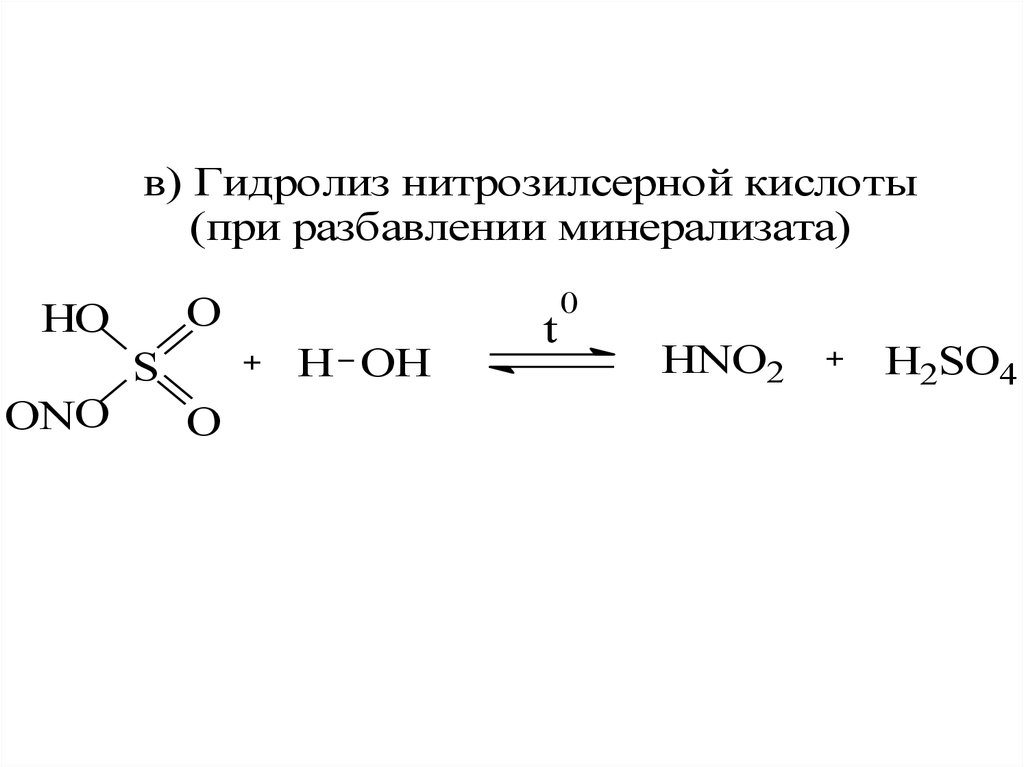
в) Гидролиз нитрозилсерной кислоты(при разбавлении минерализата)
O
HO
H OH
S
ONO
O
t
0
HNO2
H2SO4
14. В качестве восстановителей используются: - сульфит натрия; - мочевина; - формальдегид.
15.
Денитрация минерализата формальдегидом:4 HNO3 + 3 CH2O = 3 CO2 ↑ + 4 NO ↑ + 5 H2O
4 HNO2 + 2 CH2O = 2 NO↑ + N2↑ + 2 CO2 ↑ + 4
H 2O
2 NO + 2 O2 = 2 NO2↑
4 HNO3 + 5 CH2O = 5 CO2 ↑ + 2 N2 ↑ + 7 H2O










 Химия
Химия








