Похожие презентации:
Группа веществ, изолируемых из объектов путём минерализации биологического материала (Продолжение)
1.
Лекция 2. Группа веществ, изолируемых изобъектов путём минерализации биологического
материала (Продолжение). Дробный метод
анализа «металлических» ядов в минерализате.
Вопросы:
1. Общая характеристика, методологические
аспекты дробного метода анализа.
2. Исследование минерализата на наличие свинца
и бария в осадке.
3. Исследование минерализата, после отделения
осадка, на группу «металлических» ядов.
2.
Общая характеристика, методологическиеаспекты
дробного
метода
анализа
«металлических» ядов.
В
химико-токсикологическом
анализе
«металлических» ядов совокупность методов
анализа можно разделить (классифицировать) на 3
большие группы:
а) химические;
б) физико-химические;
в) физические.
3.
На современном этапе (с точки зренияметодологии) при ненаправленном химикотоксикологическом анализе группы токсикантов
широко используются скрининговые (системные)
программы,
включающие
предварительные
исследования (тесты) и подтверждающие тесты.
На
предварительном
этапе
химикотоксикологического анализа «металлических» ядов
получили известность и практическое применение
скрининговые
исследования
с
помощью
достаточно
доступных
химических
тестов
(реакций).
4.
История развития системных методов анализа«металлических» ядов.
Сравнительно долгое время в аналитической
практике соединений металлов использовался
классический системный (сероводородный) метод
анализа, который в окончательном варианте
сформировал в 1842 г Фрезениус К.Р.
Системный (сероводородный) метод включал 2
этапа:
а) Предварительное разделение катионов металлов
на 5 аналитических групп (с использованием
групповых осадителей – групповое обнаружение):
5.
Аналитические группы (сероводородный методанализа
по
Фрезениусу
(1842
г)).
+
+
+
1 гр. K , Na , NH4 (общего реактива нет)
2 гр. Mg2+ , Ca2+ , Ba2+ , Sr 2+ (осаждение в виде
карбонатов и фосфатов)
3+
2+
2+
3+
3+
2+
2+
3+
3 гр. Mn ,Cr ,Zn , Al , Fe , Ni , Co , Tl
(осаждение сероводородом в щелочной среде)
2+
2+
+
3+
2+
2+
4 гр. Cu , Cd , Ag , Bi , Hg , Pb (осаждение
сероводородом в кислой среде)
3+
3+
2+
5 гр. As , Sb , Sn (осаждение сероводородом в
кислой среде, осадки растворимы (в отличие от
сульфидов 4 аналитической группы) – в
полисульфиде аммония).
6.
б) Второй этап сероводородного методавключал
дальнейшее
разделение
и
идентификацию отдельных катионов внутри
аналитических
групп,
с
помощью
дополнительных
химических
реакций
(внутригрупповая идентификация).
7.
Сероводородный метод анализа соединенийметаллов длительное время использовался как в
аналитической практике, так и в химикотоксикологическом анализе (более 100 лет, вплоть
до 70 гг XX века).
Однако, имел недостатки:
1. Длительность исследования (несколько дней).
2. Применение многочисленных операций по
осаждению, растворению, фильтрованию и др.
Это вызывало значительные потери соединений.
3. Невозможность совместить качественный
анализ с количественным определением при
использовании одной навески объекта.
4. Токсичность газообразного сероводорода.
8.
В связи с перечисленными недостатками,в настоящее время в судебно-химической
(химико-токсикологической)
практике,
данный метод не используется, а вытеснен
(начиная с 1975 г) дробным методом анализа
«металлических» ядов. На современном
этапе является основным скрининговым
методом при исследовании изучаемой
группы токсикантов в минерализате.
9.
Дробный метод анализа«металлических» ядов (определение,
характеристика).
Прежде всего следует отметить, что
основы дробного метода анализа соединений
металлов применительно к аналитической
химии были разработаны Н.К. Тананаевым
в 1920 г.
Создателем (разработчиком) системного
дробного метода анализа для целей химикотоксикологической практики является А.Н.
Крылова (1975 г, НИИ судебной медицины).
10.
Общее определение дробного методаанализа «металлических» ядов.
Дробный метод анализа предусматривает
обнаружение
искомого
металла
в
присутствии других элементов без их
предварительного разделения на отдельные
аналитические
группы.
При
этом,
исследования
проводят
в
отдельных
небольших
порциях
минерализата
(дробными порциями).
11.
Основные достоинства метода.1. Максимальное применение специфических
дробных реакций.
2. Большая чувствительность реакций в
сочетании с возможностью обнаружения
искомых
металлов
в
присутствии
естественно-содержащихся элементов.
3. Сочетание качественного анализа с
количественным
определением
при
использовании одной навески объекта
(минерализата).
12.
4. Простота и доступность дробного методадля химико-токсикологических лабораторий
(в т.ч. не используется газообразный
сероводород).
5. Максимальное сокращение времени на
анализ (по сравнению с системным
сероводородным методом).
13.
Методологические аспекты дробного методаанализа.
Основные условия и приёмы, использованные
А.Н. Крыловой при дробном исследовании
«металлических» ядов в минерализате.
А. Условия (основные):
1. Максимальное применение специфических
реакций, позволяющих обнаружить искомый
металл в присутствии посторонних (фоновых)
металлов.
2. Применение приёмов маскировки, с помощью
которых устраняют влияние мешающих ионов.
14.
Б. Основные приёмы маскировки мешающихионов:
1. Применение для маскировки мешающих
(фоновых)
металлов
неорганических
комплексообразователей:
а) цианидов:
Fe2(SO4)3 + 6 KCN → 2 Fe(CN)3 + 3 K2SO4
Fe(CN)3 + 3 KCN → K3[Fe(CN)6]
гексацианоферриат калия
15.
б) фторидов:+
3+
Fe + 6 NaF → Na3[FeF6] + 3 Na
гексафторферриат натрия
в) фосфатов:
Fe2(SO4)3 + 2 H3PO4 → 2 FePO4 + 3 H2SO4
фосфат железа
FePO4 + H3PO4 → H3[Fe(PO4)2]
дифосфоферриат водорода
г) тиосульфатов:
Fe2(SO4)3 + 3 Na2S2O3 → Fe2(S2O3)3 + 3 Na2SO4
Fe2(S2O3)3 + Na2S2O3 → 2 Na[Fe(S2O3)2]
дитиосульфоферриат натрия
16.
2. Применение для маскировки мешающих(фоновых)
металлов
органических
комплексообразователей
(виннокаменная,
лимонная кислоты и др.).
3. В целях маскировки мешающих ионов
осуществляют разбавление минерализата до
предела чувствительности химической реакции (на
исследуемый металл), во избежание обнаружения
естественно-содержащихся элементов.
4. В целях маскировки мешающих ионов,
осуществляют варьирование рН среды или строгое
соблюдение величин рН среды (особенно при
комплексообразовании свинца, меди, кадмия и др.).
17.
5. В целях маскировки посторонних ионовиспользуют малые объемы минерализата
(особенно при исследовании марганца,
хрома,
мышьяка,
с
применением
высокочувствительных реакций).
6. Использование приёма селективной
экстракции искомого металла в составе
комплекса с органическими реагентами
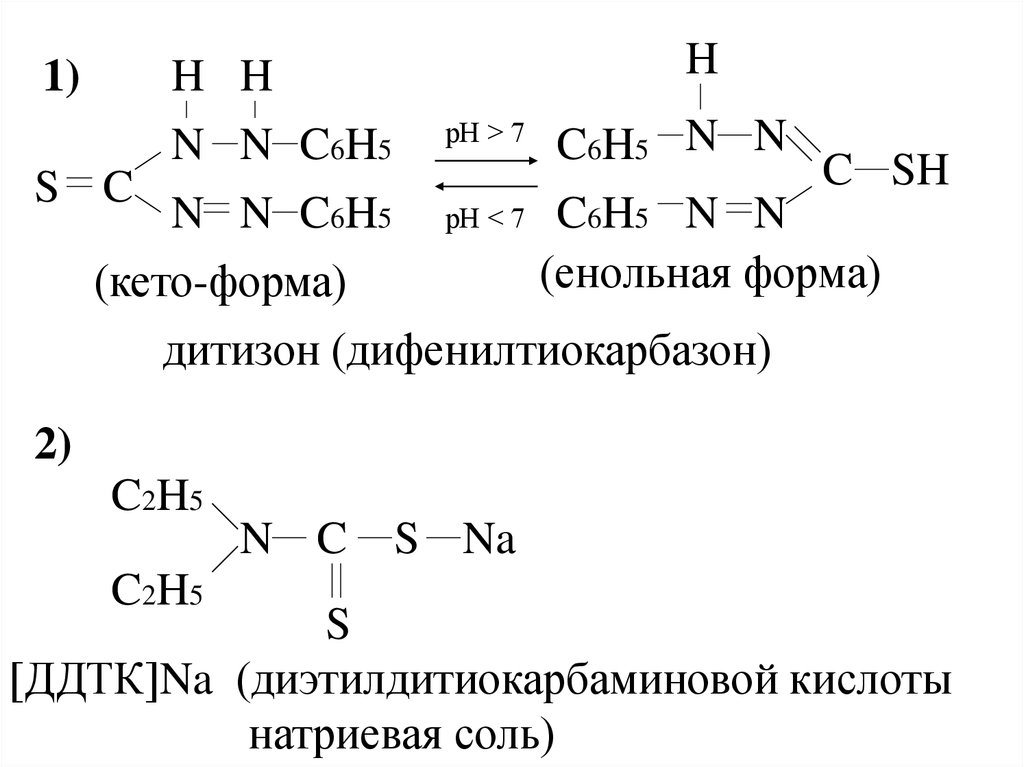
(дитизон, диэтилдитиокарбамат натрия).
18.
HH H
N N C6H5 рН > 7 C6H5 N N
C SH
S C
N N C6H5 рН < 7 C6H5 N N
(енольная форма)
(кето-форма)
дитизон (дифенилтиокарбазон)
1)
2)
C2H5
N C
C2H5
S Na
S
[ДДТК]Na (диэтилдитиокарбаминовой кислоты
натриевая соль)
19.
7. Применение определённой последовательностианализа отдельных «металлических» ядов:
а) Исследованию на ионы серебра предшествуют
2+
исследования на ионы марганца и хрома (Mn , Cr
3+
+
→ Ag ) [оказывают влияние – Cl ]
2+
2+
б) Pb → Ba [PbSO4 – оказывают влияние на
перекристаллизацию BaSO4↓]
2+
в) Cu → Sb
осадок CuS↓]
3+
3+
г) Sb → As
3+
[оказывает влияние окрашенный
[оказывает влияние SbH3↑].
20.
Пример селективной экстракции на примересвинца.
Сущность. Искомый металл изолируют от
сопутствующих элементов, с использованием
комплексообразователя – дитизона.
Приём состоит из 2х этапов:
1 этап – В основе первого этапа лежит селективная
экстракция искомого металла из минерализата в
слой органического растворителя в виде
дитизоната свинца (при рН 7,5-8,0). Органическую
фазу отделяют и используют для второго этапа.
21.
2 этап – На втором этапе производитсяреэкстрагирование свинца в водную фазу в
ионогенном состоянии (из кислой области, с
использованием
раствора
минеральной
кислоты).
22.
Приём селективной экстракции свинца изминерализата
1 этап – селективная экстракция в виде дитизоната
свинца:
рН 8,0
SH
(СH3COO)2Pb + 2 H5C6 N N C
N NH C6H5
(водно-кислая фаза)
дитизон (енольная форма, хлороформный раствор)
S
Pb/2
H5C6 N N C N NH
¨
C6H5
дитизонат свинца (хлороформный слой)
+ 2 СH3COOH
23.
2 этап – реэкстрагирование свинца в водную фазу:S
H5C6 N N C N NH
¨
Pb/2
+
2 HNO3
C6H5
S
Pb(NO3)2 + 2 N N C NH NH
H5C6
(водная фаза)
C6H5
дитизон (хлороформный слой)
24.
2. Исследование минерализата на наличиесвинца и бария в осадке.
Прежде чем приступить к рассмотрению схем
анализа отдельных «металлических» ядов в
минерализате
в
методологическом
плане
необходимо подчеркнуть и выделить общие этапы
аналитической детекции, которые характерны для
большинства представителей рассматриваемой
группы (по А.Н. Крыловой).
25.
Общие этапы дробного анализа «металлических» ядов(по А.Н. Крыловой)
Men+
1 этап
Предварительные тесты (групповые)
[отрицательное химико-токсикологическое
значение]
2 этап
Изолирование «металлических» ядов от
сопутствующих ионов (маскировка)
[в отдельных случаях 2 этап сочетается с 1
этапом]
3 этап
Подтверждающие тесты
[селективные условия, свойства]
26.
Схема исследования свинца и бария в минерализатедробным методом (по А.Н. Крыловой).
осадок (PbSO4 ) осадок (BaSO4)
нас. CH3COONH4
фильтрат (CH3COO)2Pb
Pb < 2 мг
Качественное
обнаружение
экстр. хлороформ
рН 7 - 8
Pb(HDz)2
(экстракт –
пурп.-кр.окр.)
Pb > 2 мг
1 V
4
Качественное Количественное
обнаружение определение
экстракция
хлороформ
Комплексоном.,
Бихромато-йодометрич.
м-ды
27.
количественноеопределение
ФЭК
реэкстрагирование
0,1 н HCl
1 V
3
Реэкстракт
V ≤ 2 мл V > 2 мл
2 V
3
Микрохимические реакции
Макрохимические реакции
CsPbJ3
PbSO4 PbS PbJ2 PbCrO4
K2CuPb(NO2)6
28.
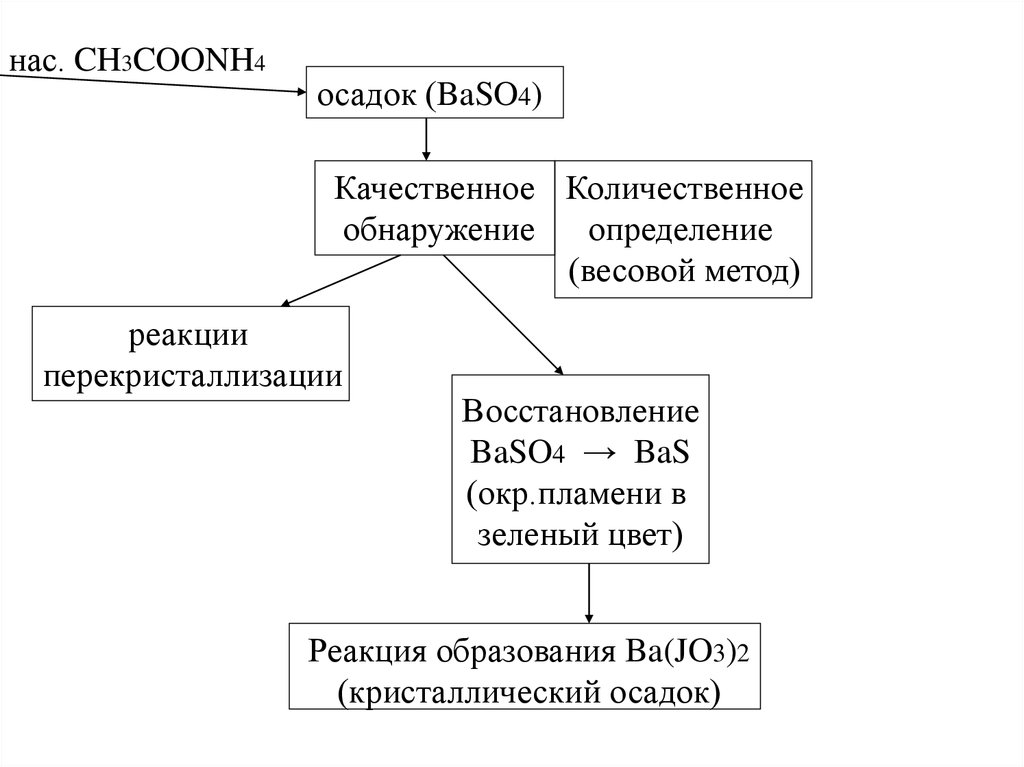
нас. CH3COONH4осадок (BaSO4)
Качественное Количественное
определение
обнаружение
(весовой метод)
реакции
перекристаллизации
Восстановление
BaSO4 → BaS
(окр.пламени в
зеленый цвет)
Реакция образования Ba(JO3)2
(кристаллический осадок)
29.
Исследование минерализата (после отделения осадка)Mn2+
Естественное содержание
Mn2+
Mn2+
Mn2+
KJO
4
MnO4(красно-фиолетовое)
Превышает нормы
KJO
MnO44
(
MnO
4
NH 4 ) 2 S 2O8
(красно-фиолетовое)
Условия: 10% р-р AgNO3 ;
NaH2PO4 – комплексо-образователь
30.
Cr3+Предварительная (отрицательное значение)
Cr3+
6+
(
Cr
NH 4 ) 2 S 2O8
Cr6+ + Д' → Cr 2+ + Д''
дифенилкарбазид дифенилкарбазон
N
С
N
O
C6H5
Cr
N N C6H5
(красно-фиолетовое окрашивание)
Условия: рН 1,7 ± 0,2
NaH2PO4 – комплексо-образователь
Дополнительная реакция
H2CrO6 (H3CrO8) – надхромовые кислоты
(сине-голубое окрашивание)
31.
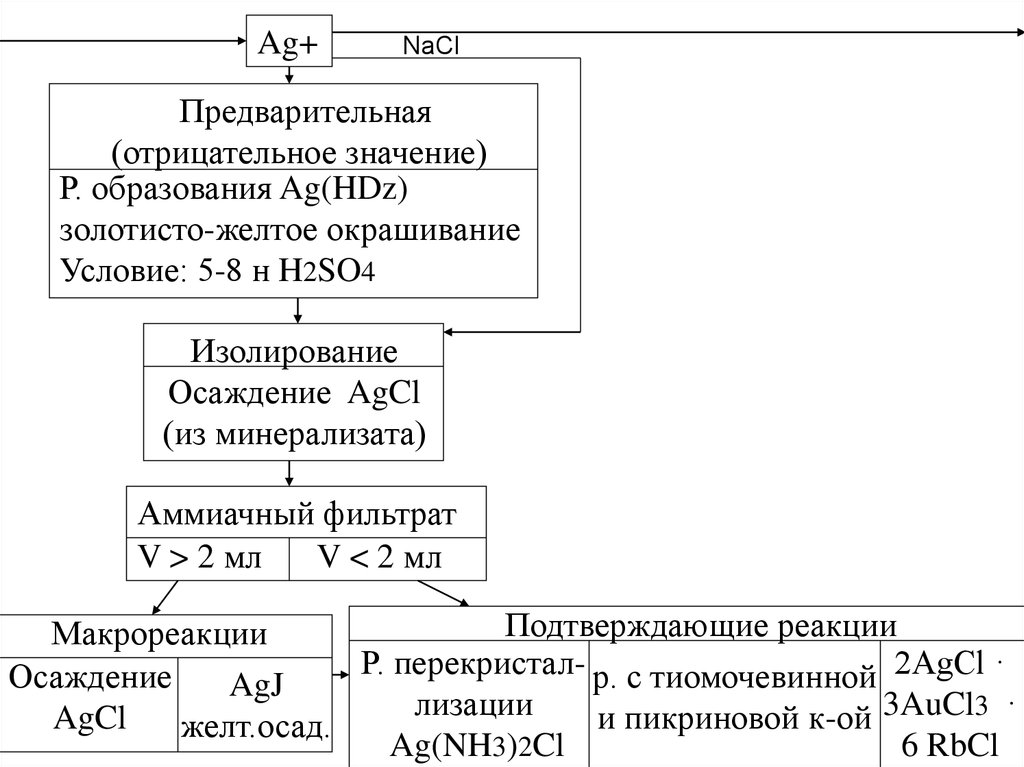
Ag+NaCl
Предварительная
(отрицательное значение)
Р. образования Ag(HDz)
золотисто-желтое окрашивание
Условие: 5-8 н H2SO4
Изолирование
Осаждение AgCl
(из минерализата)
Аммиачный фильтрат
V > 2 мл
V < 2 мл
Подтверждающие реакции
Макрореакции
Р. перекристал- р. с тиомочевинной 2AgCl ·
Осаждение
AgJ
лизации
3AuCl3 ·
AgCl
и
пикриновой
к-ой
желт.осад.
Ag(NH3)2Cl
6 RbCl
32.
Cu 2+экстракция
хлороформ (ДДТК)2Pb (рН – 3,0)
Изолирование, предварительное обнаружение (ДДТК)2Cu
желто-коричневое окрашивание
реэкстракция
HgCl2 (рН – 5,0)
Реэкстракт CuCl2
Подтверждающие реакции
CuZn[Hg(SCN)4]2
CuCd[(FeCN)6] Пиридин-роданидный
розово-лиловый
лиловый осадок комплекс (зеленый цвет)
осадок
33.
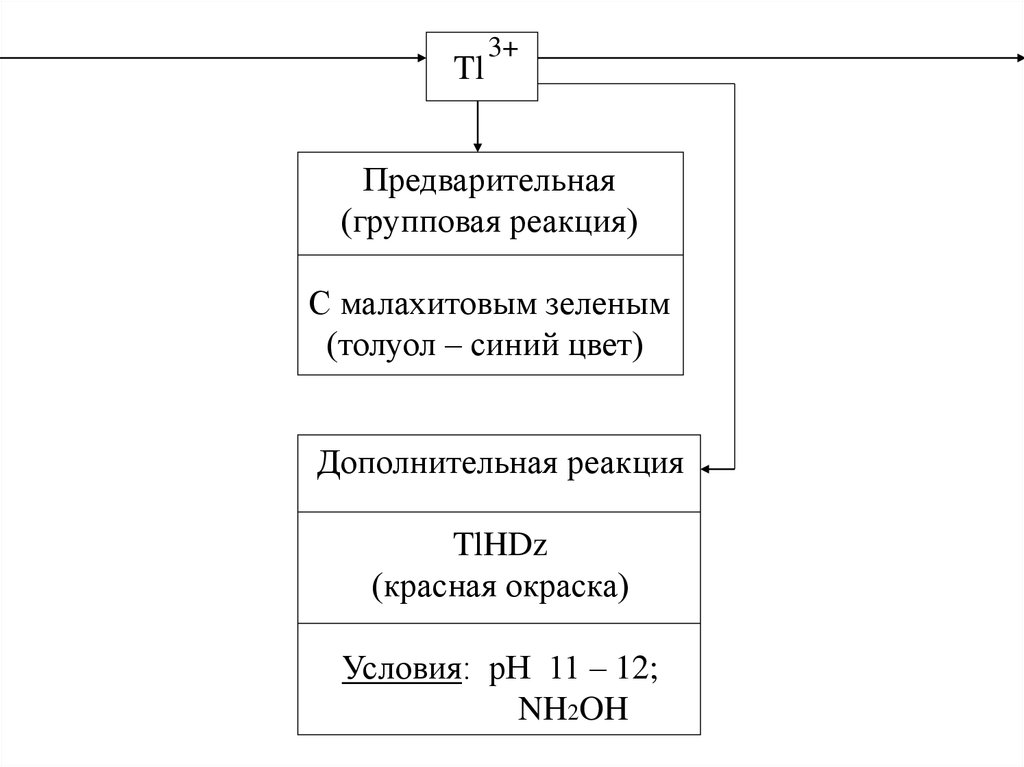
Tl3+
Предварительная
(групповая реакция)
С малахитовым зеленым
(толуол – синий цвет)
Дополнительная реакция
TlHDz
(красная окраска)
Условия: рН 11 – 12;
NH2OH
34.
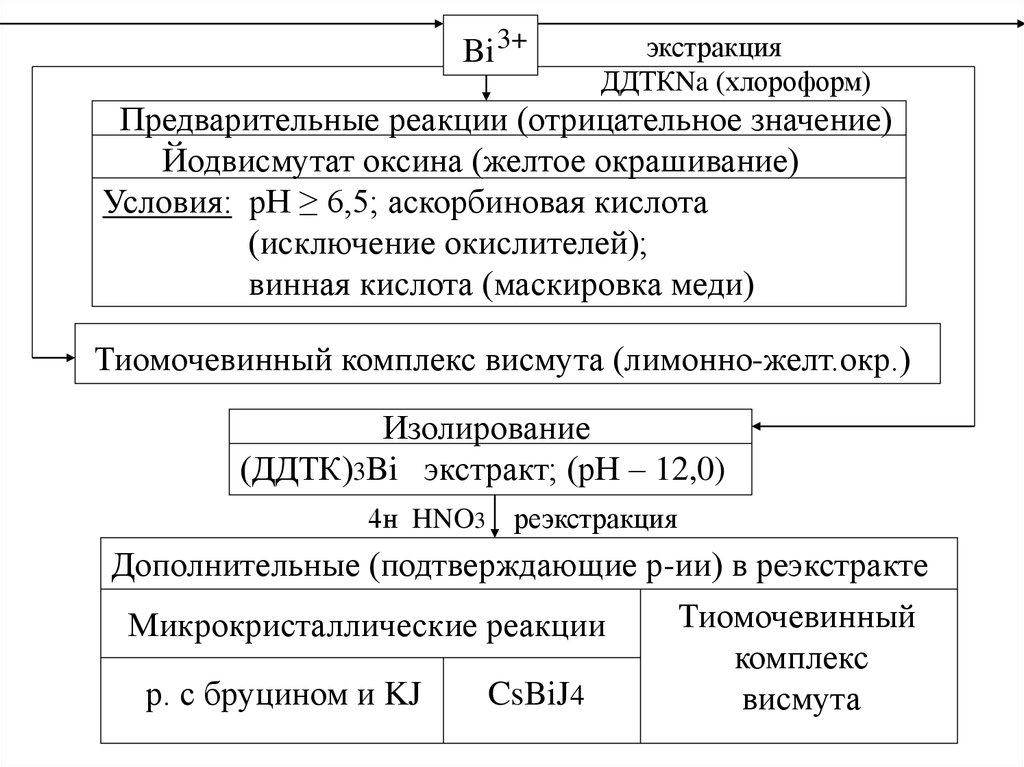
Bi 3+экстракция
ДДТКNa (хлороформ)
Предварительные реакции (отрицательное значение)
Йодвисмутат оксина (желтое окрашивание)
Условия: рН ≥ 6,5; аскорбиновая кислота
(исключение окислителей);
винная кислота (маскировка меди)
Тиомочевинный комплекс висмута (лимонно-желт.окр.)
Изолирование
(ДДТК)3Bi экстракт; (рН – 12,0)
4н HNO3 реэкстракция
Дополнительные (подтверждающие р-ии) в реэкстракте
Тиомочевинный
Микрокристаллические реакции
комплекс
р. с бруцином и KJ
CsBiJ4
висмута
35.
Cd 2+ДДТКNa
экстракция хлороформ, рН > 12,0
Изолирование
экстракт (ДДТК)2Cd
1н HCl реэкстракция
Реэкстракт CdCl2
Предварительные реакции (отрицательное значение)
CdS желтый осадок Cd2[Fe(CN)6] ферроцианид кадмия
(рН – 5,0)
белый осадок (рН – 5,0)
Подтверждающие микрокристаллические реакции
H2CdBr4 · (бруцин)2
(комплекс бромида
кадмия с бруцином)
Cd(C6H5N)2Br2
комплекс бромида
кадмия с пиридином
36.
Zn2+Предварительная реакция (отрицательное значение)
Zn(HDz)2
(пурпурно-красное окрашивание хлороформного слоя)
Условия: рН 4,5 – 5,0; лимонная кислота(для маскировки железа)
тиомочевина (для маскировки кадмия, меди)
ДДТКNa
экстракция хлороформ (рН – 8,5)
Изолирование
экстракт (ДДТК)2Zn
1н HNO3 реэкстракция
Реэкстракт ZnCl2
Подтверждающие реакции
Макрохимические реакции
МикрокристалK2Zn3[Fe(CN)6]2
лические р-ии
ZnS
гексацианоферрат калия, цинка
белый осадок
ZnHg(SCN)4
(белый осадок)
































 Химия
Химия








