Похожие презентации:
Окислительно-восстановительные процессы. Рн, нейтрализация
1. ОВП ПРОЦЕССЫ, рн, нейтрализация
ОВП ПРОЦЕССЫ, РН,НЕЙТРАЛИЗАЦИЯ
17/12 2015
2.
Окислительно-восстановительные реакции ОВР – ионные реакции, сопровождающиесяReduction-oxidation reaction (Redox)
изменением степени окисления* атомов в
молекулах реагирующих веществ.
*Количество отданных или принятых атомом электронов называется степенью окисления атома в молекуле.
KMnO4→K+ + MnO4-
+ + NO КNO
→Na
2
2
ст.ок. О: – 2
ст.ок. О: – 2
ст.ок. О: – 2
ст.ок. Mn: + 7
ст.ок. N: + 3
ст.ок. Mn: + 7
Н2SO4
1) Смесь обесцветилась
2) В конечной смеси практически нет NO2‒, MnO4‒, но есть NO3‒, Mn2+.
ст.ок. N: + 5
ст.ок. Mn: + 2
3.
4.
MnO4-+
8Н+ +5е
Mn2+
реакция восстановления (принимает электроны),
MnO4‒ - окислитель Ox
+ 4Н2О
число Mn слева и справа одинаковое;
О слева – 4, справа – 0;
слева – это 8 «–», справа – 0;
в кислой среде Н+, Н2О→ Н+, Н2О;
чтобы уравнять число минусов добавляем в левую часть 8 Н+,
потому что не можем добавить «–» справа;
6) добавляем в правую часть 4 Н2О, чтобы число атомов Н было
одинаковым;
1) уравниваем число атомов, которые меняют
степень окисления;
2) считаем число атомов О в левой и правой частях;
3) каждый О – это 2 «–»;
4) в кислой среде Н+, Н2О→ Н+, Н2О;
5) уравниваем число «–» по кислооду;
6) уравниваем число атомов Н при помощи молекул
Н2О;
1)
2)
3)
4)
5)
7) считаем заряды частиц, добавляем нужное кол-во
е.
7) слева – 1 «–» и 8 «+» = 7 «+», а справа – 2 «+», разница в 5 «+»,
добавляем 5 е, потому что 1 е – это 1 «–».
NO2- + Н2O - 2е
NO3- + 2Н+
реакция окисления (отдает электроны),
NO2‒ - восстановитель Red
ЧИСЛО ПРИНЯТЫХ И ОТДАНЫХ ЭЛЕКТРОНОВ ДОЛЖНО БЫТЬ ОДИНАКОВЫМ
5.
x5x2
6.
K2Cr2O7 + H2O2 + KOH → …Cr2O72-+ H2O2+OH- →
ст. ок. Cr: +6 – больше быть не может, поэтому Cr2O72- - окислитель, значит Н2О2 – восстановитель
CrO4
2-
H+ OHCr2O7
-
OH
H2O
2-
[Cr(OH)6]3-(P), CrO33-(TB)
Cr(OH)3
3+
+
H
Cr
в щелочной среде ОН-, Н2О→ ОН-, Н2О
Cr2O72- + 7Н2О + 6е → 2Cr(OH)63- + 2
7O – 14 «-»
12ОН -12 «-»
H2O2 + 2OH– – 2e– → O2 + 2H2O
-2
-4
1) уравниваем число атомов, которые меняют
ОН- степень окисления;
2) считаем число атомов О и Нв левой и правой
частях;
3) каждый О – это 2 «–», каждый Н – это 1 «+»;
4) в кислой среде Н+, Н2О→ Н+, Н2О;
5) уравниваем число «–» по кислооду;
6) уравниваем число атомов Н при помощи молеку
Н2О;
7) считаем заряды частиц, добавляем нужное кол-в
е.
7.
x1x2
Cr2O72- + 7Н2О + 6е → 2Cr(OH)63- + 2 ОН-
x3
x6
H2O2 + 2OH– – 2e– → O2 + 2H2O
Cr2O72- + 7Н2О + 3Н2О2 + 6ОН-→ 2Cr(OH)63- + 2 ОН- + 3О2 + 6Н2О
Cr2O72- + Н2О + 3Н2О2 + 4ОН-→ 2Cr(OH)63- + 3О2
K2Cr2O7 + 3H2O2 +4 KOH + Н2О→ 2K3[Cr(OH)6]+3O2
8.
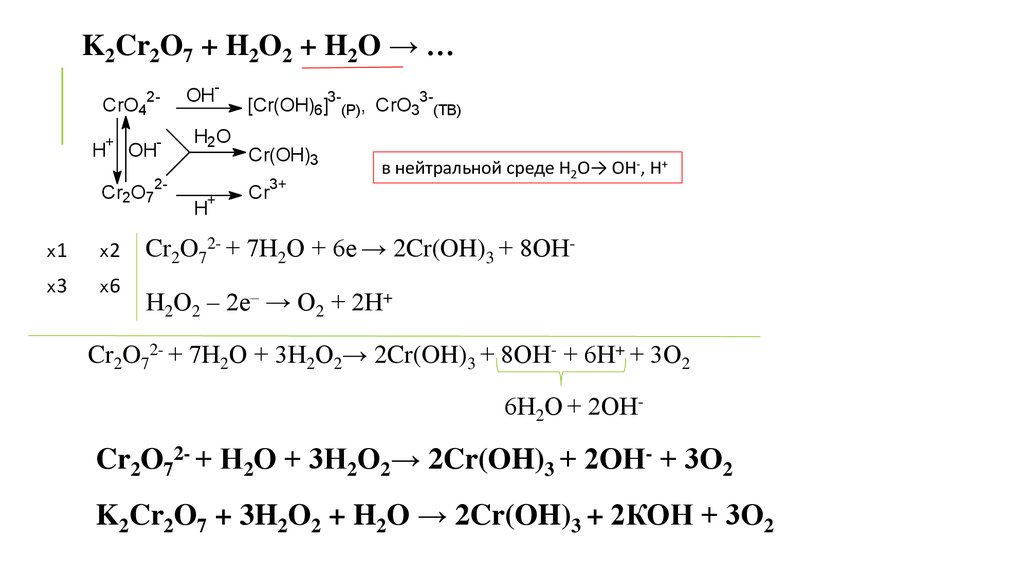
K2Cr2O7 + H2O2 + H2O → …CrO4
+
H
2-
OH
Cr2O7
x1
x2
x3
x6
-
OH
H2O
2-
[Cr(OH)6]3-(P), CrO33-(TB)
Cr(OH)3
3+
+
H
в нейтральной среде Н2О→ ОН-, Н+
Cr
Cr2O72- + 7Н2О + 6е → 2Cr(OH)3 + 8ОНН2О2 – 2е– → О2 + 2Н+
Cr2O72- + 7Н2О + 3Н2О2→ 2Cr(OH)3 + 8ОН- + 6Н+ + 3О2
6Н2О + 2ОН-
Cr2O72- + Н2О + 3Н2О2→ 2Cr(OH)3 + 2ОН- + 3О2
K2Cr2O7 + 3H2O2 + H2O → 2Cr(OH)3 + 2КОН + 3О2
9.
в кислой среде Н+, Н2О→ Н+, Н2Ов щелочной среде ОН-, Н2О→ ОН-, Н2О
в нейтральной среде Н2О→ ОН-, Н+
Cr2O72- + 2SО2 + 6Н+→2Cr3++S2O82-+3H2O
Cr2O72- +14H+ +6e →2Cr3+ + 7H2O
2SO2 +4H2O – 6e→S2O82-+8H+
Cr2O72- +14H+ +2SO2 + 4H2O→2Cr3+ + 7H2O + S2O82-+8H+
10.
Електроліти у водному розчині дисоціюють на іони.Дисоціація – це розпад молекули на іони під дією додаткової енергії. У розчині
додаткова енергія утворюється завдяки процесу сольватації молекул розчиненої
речовини.
Кількісно процес дисоціації описують за допомогою:
а) ступеню дисоціації – відношення концентрації молекул, що розпалися на іони, до загальної аналітичної
концентрації молекул (вихідної концентрації розчинених молекул):
C 100
C0
б) константи дисоціації – константа рівноваги процесу дисоціації
An Bm n A
m
m B
n
Kc Kд
B A
n m
m
An Bm
n
11.
Молярна концентрація (аборозчиненої речовини в 1 л розчина.
CM
ν реч
Vp
m реч
M Vp
N реч
N A Vp
молярність)
—
кількість
, моль/л.
Молярна концентрація еквіваленту (або нормальність) — кількість моль-еквівалентів
розчиненої речовини в 1 літрі розчина.
CH
ν E реч
Vp
m реч
E Vp
, моль/л.
12.
Приклад 2. У 64 мл води розчинили 16 г NaOH та отримали розчин з ρ = 1,22 г/мл. Визначте ω, СМ, СН, та Сmотриманого розчину.
Розв’язання. Щоб знайти ω використаємо формули:
ω
m реч 100
mр
m реч 100
m реч m роз
m реч 100
m реч Vроз ρ роз
16 100
20 %
16 64 1
ν реч
m реч
m реч 1000 ρ p
.
16 1000 1,22
C
6,1 (моль/л).
M
Молярність знайдемо з формулою:
Vp
M реч Vp M реч (m реч m роз ) 40 (16 64)
ν E m реч
Нормальність розрахуємо за формулою: C H
Vp E Vp
, для NaOH Е = М, тому що кисотність цієї основи дорівнює одиниці. Тоді:
CH
mреч 1000 ρ p
E (m реч mроз )
16 1000 1,22
6,1
40 (16 64)
(моль/л).
Моляльність розчину дорівнюватиме:
Cm
ν реч 1000
mроз
mреч 1000
16 1000
6,25
M mроз
40 64
(моль/кг).
13.
РЕАКЦИИ НЕЙТРАЛИЗАЦИИВ реакциях между сильными кислотами и щелочами, протекающими в растворах, всегда выделяется
одно и то же количество теплоты в расчете на 1 моль образующейся воды, а именно 58 кДж/моль.
14.
В водных растворах концентрации ионов Н+ и ОНвзаимосвязаны выражением константы диссоциации воды:15.
13. Знайдіть рН та рОН в розчинах:а) 0,05 M HCl;
б) 1М КОН;
а) 0,05 M HCl;
HCl → Н+ + Сl- сильная кислота, диссоциирует полностью,
Поэтому С (Н+) = С (HCl) = 0,05 моль/л
рН= ‒ lg0,05=1,30
б) 1 M КОН;
KOH → OН- + K+ сильное основание, диссоциирует полностью,
Поэтому С (ОН-) = С (КОН) = 1 моль/л
рОН= ‒ lg1=0
рН=14-рОН=14
16.
6. Константа дисоціації нітритної кислоти дорівнює 5,1·10–4. Знайдіть рН в0,01 М.
17.
18.
19.
80 ml 4ммоль НСООН, рН? pKa=3,7525 мл, NaOH, 0,15 mol/l
Кислые буф. Раст- раствор слабой кислоты и ее соли СН3СООН + СH3COONa
Щелочной буф. Раствор – раствор слабого основания и его соли NH4OH +
NH4Cl
рН=рК + lg(Cc/Ck)=4,93
1) HCOOH + NaOH=H2O+HCOONa
0,004
0,00375
0,00025
0,00375
0,00375
-
0,00375
0,00375
n(HCOOH)=0,004 mol
n(NaOH)=C*V=0,025*0,15=0,00375 mol
2) HCOOH=H+ + HCOOрН=рК + lg(Cc/Ck)
Cc=ns/V=0,00375/0,105=0,0357 Ck= 0,00025/ 0,105=0,00238



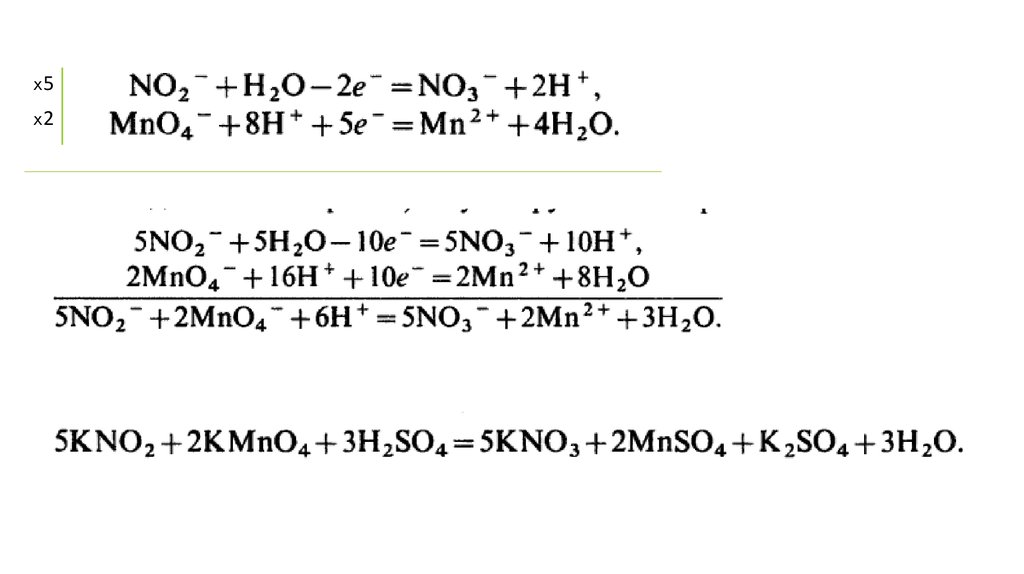













 Химия
Химия








