Похожие презентации:
Неметаллы: общая характеристика
1. Неметаллы: общая характеристика
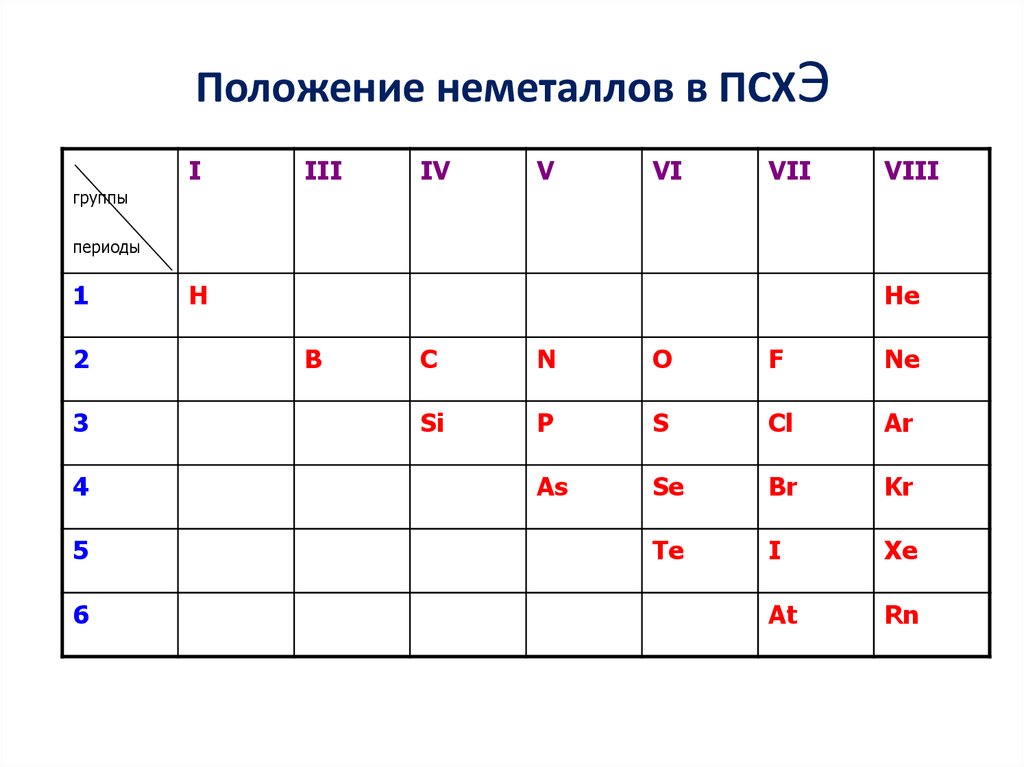
9 класс2. Положение неметаллов в ПСХЭ
IIII
IV
V
VI
VII
VIII
группы
периоды
1
2
3
4
5
6
H
He
B
C
N
O
F
Ne
Si
P
S
Cl
Ar
As
Se
Br
Kr
Te
I
Xe
At
Rn
3. Особенности атомного строения неметаллов
Небольшой атомный радиусНа внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО
4.
• Электроотрицательность – свойствоатомов химических элементов поляризовать
химическую связь, оттягивать к себе общие
электронные пары.
• Ряд активности неметаллов характеризует их
окислительные способности, т.е. меру их
неметалличности.
• Чем выше значение Э.О., тем:
• больше способность оттягивать электронную
плотность атомов;
• больше неметаллические свойства атома;
• больше окислительные свойства.
Назовите самый активный неметалл
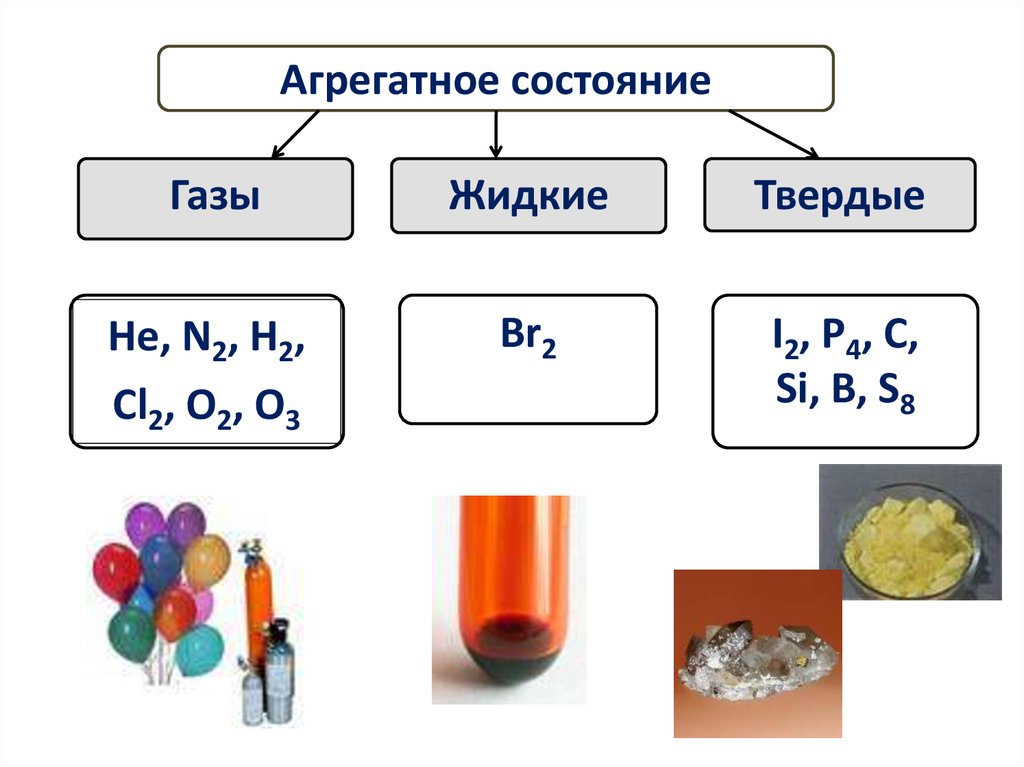
5. ФИЗИЧЕСКИЕ СВОЙСТВА неметаллов
ФИЗИЧЕСКИЕ СВОЙСТВАНЕМЕТАЛЛОВ
6.
Агрегатное состояниеГазы
Жидкие
Твердые
Не, N2, Н2,
Cl2, O2, O3
Br2
I2, P4, C,
Si, B, S8
7. Цвет неметаллов
ЧЕРНЫЙБЕЛЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР
8. Цвет неметаллов
КРАСНЫЙФОСФОР
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД
9. Температура плавления
• 3 8000 С – у графита• - 2100 С - азота
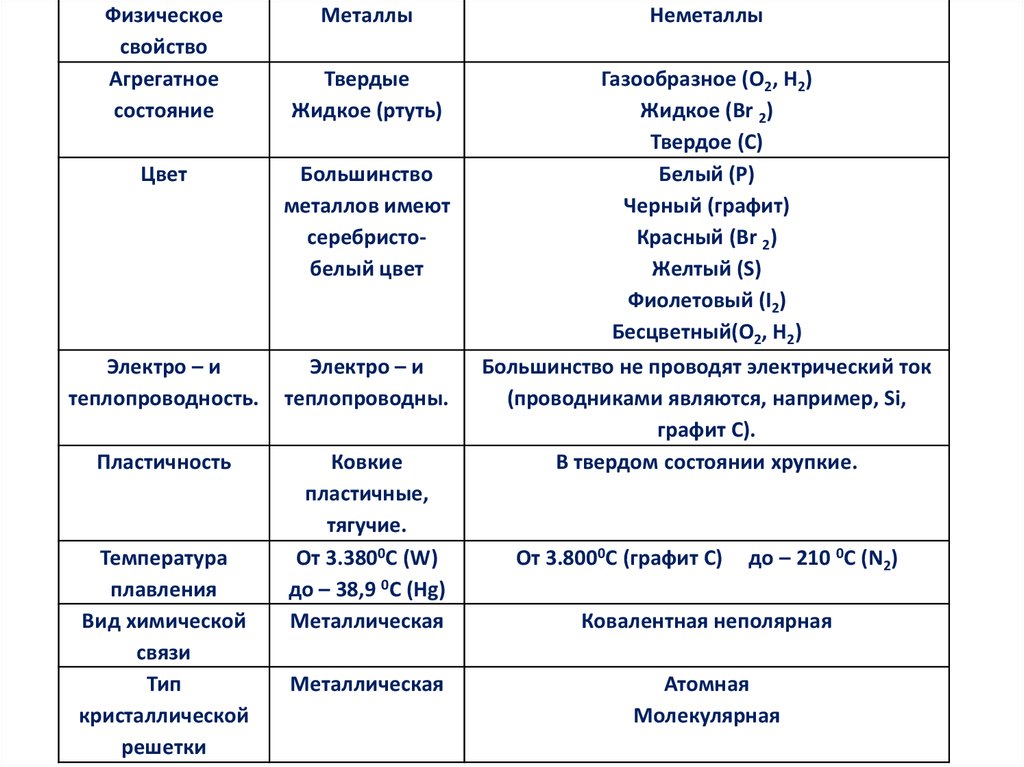
10.
Физическоесвойство
Агрегатное
состояние
Металлы
Неметаллы
Твердые
Жидкое (ртуть)
Газообразное (О2, Н2)
Жидкое (Br 2)
Твердое (C)
Белый (Р)
Черный (графит)
Красный (Br 2)
Желтый (S)
Фиолетовый (I2)
Бесцветный(О2, Н2)
Цвет
Большинство
металлов имеют
серебристобелый цвет
Электро – и
теплопроводность.
Электро – и
теплопроводны.
Пластичность
Ковкие
пластичные,
тягучие.
От 3.3800С (W)
до – 38,9 0С (Hg)
Металлическая
Температура
плавления
Вид химической
связи
Тип
кристаллической
решетки
Металлическая
Большинство не проводят электрический ток
(проводниками являются, например, Si,
графит С).
В твердом состоянии хрупкие.
От 3.8000С (графит С)
до – 210 0С (N2)
Ковалентная неполярная
Атомная
Молекулярная
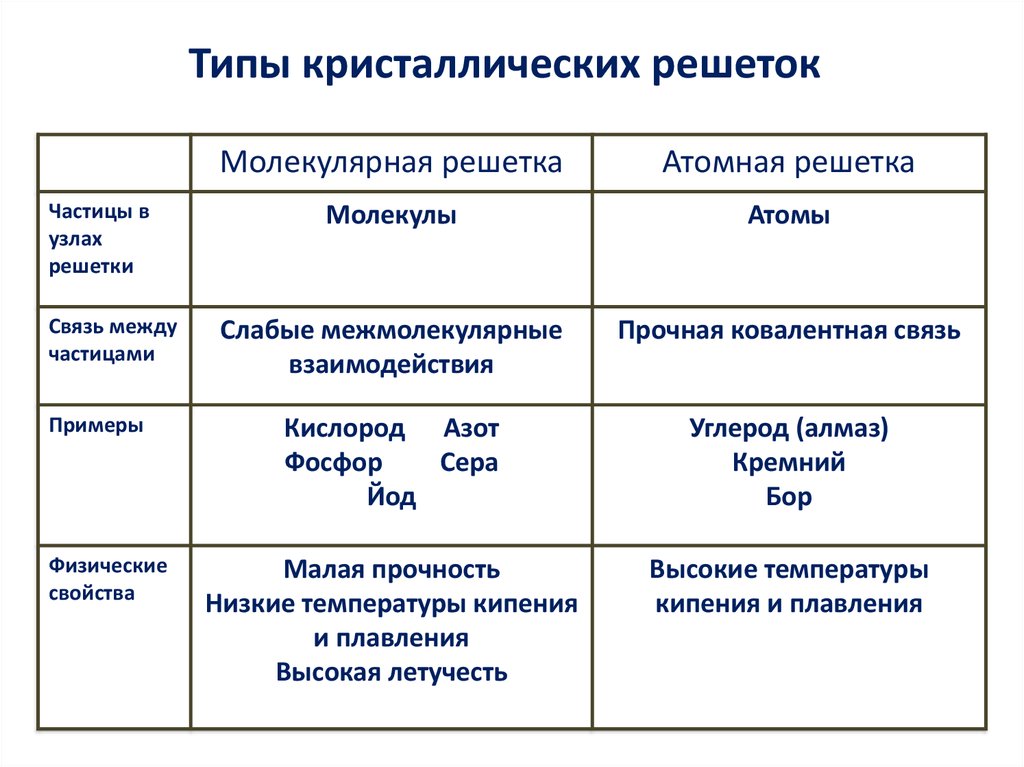
11. Типы кристаллических решеток
Частицы вузлах
решетки
Связь между
частицами
Примеры
Физические
свойства
Молекулярная решетка
Атомная решетка
Молекулы
Атомы
Слабые межмолекулярные
взаимодействия
Прочная ковалентная связь
Кислород Азот
Фосфор
Сера
Йод
Углерод (алмаз)
Кремний
Бор
Малая прочность
Низкие температуры кипения
и плавления
Высокая летучесть
Высокие температуры
кипения и плавления
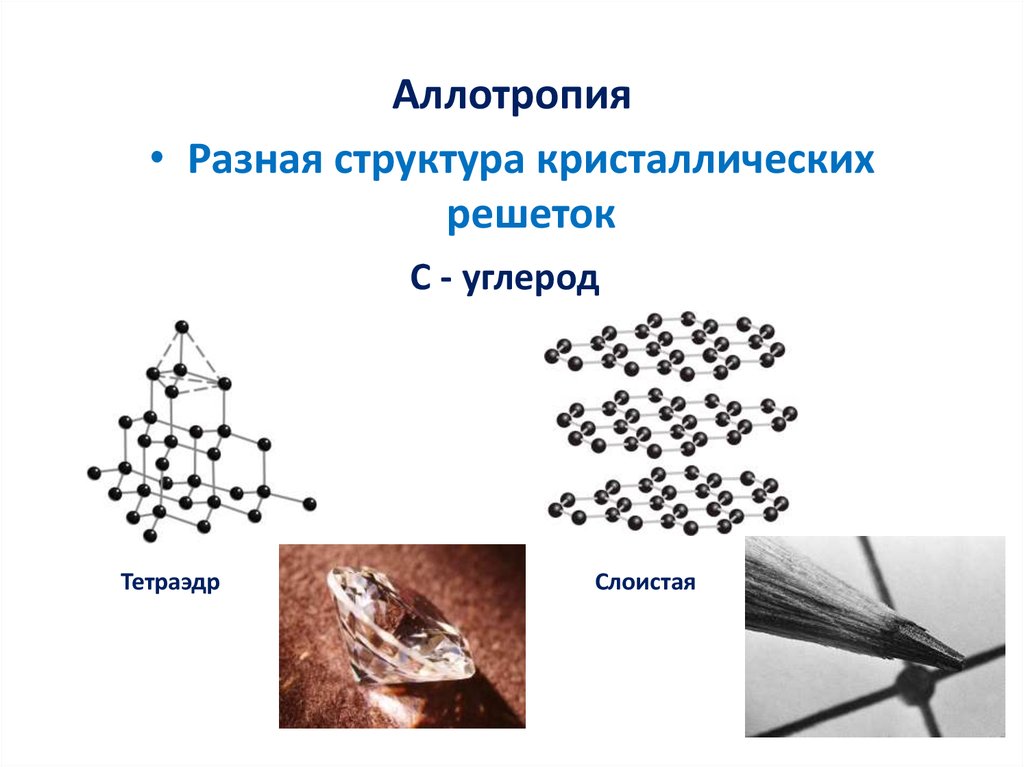
12. Аллотропия
• Разная структура кристаллическихрешеток
С - углерод
Тетраэдр
Слоистая
13. Аллотропия
• Разное типы кристаллических решетокР - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
14. Аллотропия
• Разный состав молекулО - кислород
Кислород
Озон
15. Озон О3
• Светло - синий газ с сильным запахом• Имеет запах свежести
• Появляется после грозы
16. Озон в природе
Содержится в воздухе сосновых лесов иморского побережья
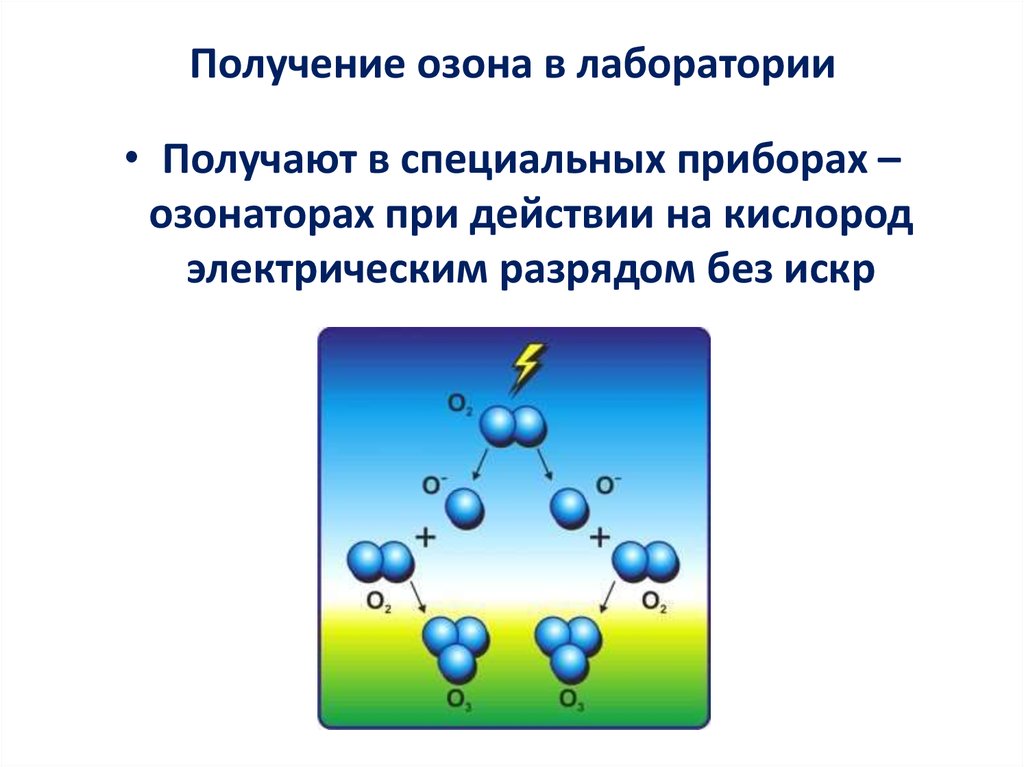
17. Получение озона в лаборатории
• Получают в специальных приборах –озонаторах при действии на кислород
электрическим разрядом без искр
18. Значение озона для Земли
• Задерживает ультрафиолетовые лучи, которыеразрушительно действуют на клетки живых организмов
• Озоновый слой расположен на высоте 20 – 25 км
19.
В конце 18 века Лавуазье установил, что воздух –не простое вещество, а смесь газов
М(возд.)= 29 г/моль; ρ(возд.)= 1,29 г/л; W(О2 )=21%.
20. Состав воздуха
21. Постоянные составные воздуха
• Азот• Кислород
• Благородные
газы
22. Переменные составные воздуха
• Углекислый газ• Водяные пары
• Озон
23. Случайные составные воздуха
• Пыль• Микроорганизмы
• Пыльца растений
• Оксиды серы и азота
24. Домашнее задание
• § 15• Составить кроссворд по неметаллам


















 Химия
Химия








