Похожие презентации:
Анализ смеси катионов первойтретьей аналитических групп по систематическому анализу. Химическое равновесие
1. Тема лекции Анализ смеси катионов первой-третьей аналитических групп по систематическому анализу Химическое равновесие. Ионная
Тема лекцииАнализ смеси катионов первойтретьей аналитических групп по
систематическому анализу
Химическое равновесие.
Ионная сила растворов.
1
2. Логарифмы
3. Математика
• Логарифмы - характеристика имантисса.
• Переход от логарифма к числу.
• Логарифмы – натуральный и
десятичный, переход от одного
к другому.
4.
План лекции:1. Химические методы обнаружения
неорганических веществ. Реакции
обнаружения смеси катионов I -3
аналитических групп.
2. ЛОГАРИФМЫ
3. Ионная
сила растворов.
5. Анализ смеси катионов первой-третьей аналитических групп по систематическому анализу
6.
7. Анализ раствора без осадка
• Предварительныеиспытания –
действие щелочью с
целью обнаружить
ион аммония,
подтверждение –
реактив Несслера
• Действие
групповых
реагентов –
HCl, H2SO4
8. CИСТЕМ.ХОД АНАЛИЗА НА 1ГРУППУ
9. ПРИНЦИПИАЛЬНОЕ ОТЛИЧИЕ
•УЧЕТ ИУСТРАНЕНИЕ
МЕШАЮЩЕГО
ВЛИЯНИЯ ИОНОВ
10. Анализ смеси катионов Li+, Na+, K+, NH4+
• Сразу удаляют аммоний прокаливаем вщелочной среде, затем Li+– осаждением
фторидом аммония или
гидроортофосфатом натрия.
• Ионы Na+, K+, определяют дробными
реакциями
11. Первая аналитическая группа катионов -Li+, Na+, K+, NH4+
Перваяаналитическая
группа катионов +
+
+
Li , Na+, K , NH4
12. Анализ смеси катионов Li+, Na+, K+, NH4+
• Сразу удаляют аммоний прокаливаем вщелочной среде, затем Li+– осаждением
фторидом аммония или
гидроортофосфатом натрия.
• Ионы Na+, K+, определяют дробными
реакциями
13. Анализ смеси катионов II аналитической группы по систематическому анализу
14. Действие групповых реагентов –HCl, H2SO4
Действие групповых реагентов –HCl, H2SO4
• Осадок при
действии HCl есть катионы
второй
аналитической
группы
• Осадок при
действии H2SO4
- есть катионы
третьей
аналитической
группы и,
возможно, Pb2+
15. Растворимость хлорида свинца
•ρ*(PbCl2)=0,98г/100г воды•ρ*(PbSO4)=0,0045г/100г
воды
16. Парадоксальный вывод при образовании осадков при прибавлении обеих кислот
•В растворе могутприсутствовать
только катионы
свинца
17. ОтделениеPbCl2
• Осадок обрабатываютгорячей водой, при этом
PbCl2 растворяется. При
необходимости процедуру
повторяют несколько раз.
18. Реакция дитизона с ионами свинца, дитизонат свинца окрашивает слой хлороформа в красный цвет
19. Дополнение
• Экстракция – явлениераспределения вещества между
двумя несмешивающимися
жидкостями. Это способ
выделить соединение металла с
органическими лигандами в слой
органической фазы (В ДАННОМ
СЛУЧАЕ ХЛОРОФОРМ)
20. Продолжение хода анализа
• Наличие осадка после удаленияPbCl2
• Осадок обрабатывают раствором
аммиака: при этом AgCl
растворяется с образованием
[Ag(NH3)2]+ (раствор 2) и остается
осадок. При наличии Hg22+ осадок
чернеет – его отделяют
центрифугированием.
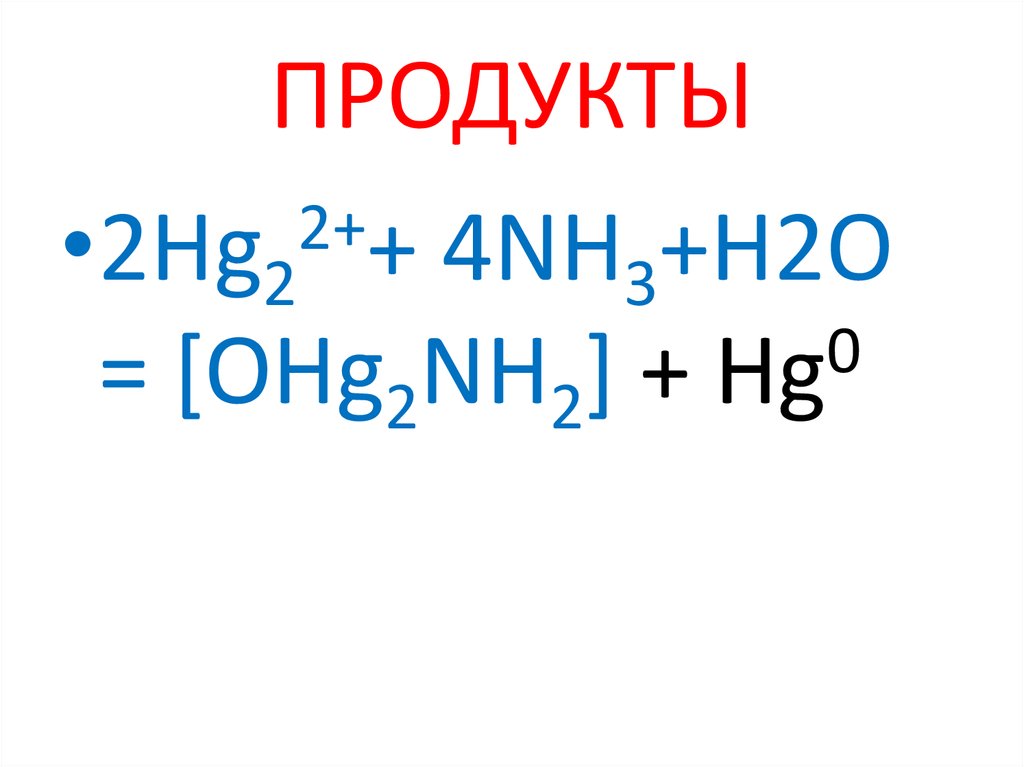
21. ПРОДУКТЫ
2+•2Hg2 + 4NH3+H2O
0
= [OHg2NH2] + Hg
22. Определение серебра
• К раствору, содержащему аммиакатсеребра, прибавляют азотную кислоту –
выпадение белого осадка AgCl указывает на
наличие ионов Ag+. При добавлении
иодида калия к раствору аммиаката
серебра выпадает желтый осадок AgI.
23. Анализ смеси катионов III аналитической группы по систематическому анализу
24. Осадок не образовался при действии H2SO4 или (NH4)2SO4
• Добавление этанолаприводит к выпадению
сульфата кальция – в
присутствии этанола его
растворимость резко
уменьшается.
25. Операции с осадком
Перевод сульфатов в карбонаты проводятпосредством многократной обработки
осадка насыщенным раствором карбоната
натрия при нагревании. Осадок карбонатов
отделяют центрифугированием и
промывают водой, растворяют в 2 М
CH3COOH и в полученном растворе
обнаруживают катионы III аналитической
группы.
26.
27. Обнаружение ионов бария
• Обнаружение ионов бария проводят по реакции сK2Cr2O7 в присутствии CH3COONa+ CH3COOН. Если
выпадает желтый осадок, то ионы бария
осаждают в виде BaCrO4 и отделяют
центрифугированием , при этом в растворе
остаются ионы Sr2+ и Ca2+ (раствор 2). Ионы Cr2O72мешают обнаружению ионов Ca2+ и Sr2+, поэтому
раствор 2 обрабатывают при нагревании
раствором карбоната аммония. Выпавший осадок
карбонатов стронция и кальция центрифугируют
(осадок 4).
28. Обнаружение стронция
• Осадок 4 растворяют при нагревании в 2 МCH3COOH (раствор 3). К раствору 3
прибавляют насыщенный раствор сульфата
аммония и нагревают. Выпавший осадок
SrSO4 отфильтровывают (осадок 5).
Фильтрат содержит ионы [Ca(SO4)2]2(раствор4).
29. Обнаружение кальция
• Раствор 4 упаривают донебольшого объема и проводят
обнаружение ионов кальция по
реакции с (NH4)2C2O4. Выпадение
белого осадка, нерастворимого в
уксусной кислоте, указывает на
наличие ионов Ca2+.
30. Химическое равновесие в растворах
31. Идеальные растворы
• Растворы, для которыхнаблюдается совпадение
термодинамических свойств
на основе расчета
концентраций на основе
масс веществ, называются
идеальными
32. Идеальность растворов
• Наблюдается лишь дляпредельно разбавленных
растворов при невысоких
(комнатных)
температурах
33. Отклонения от идеальности
• В реальных растворахнаблюдаются эффекты
взаимного влияния ионов
- притяжение и
отталкивание. Это
приводит к отклонению
от идеальности
34. Активность вещества в растворе
• Активность (α ) – это такаяконцентрация вещества в растворе,
при использовании которой свойства
данного раствора могут быть описаны
теми же уравнениями, что и свойства
идеального раствора. Активность
иногда называют эффективной или
действующей концентрацией.
35. Размерность активности
• Размерность имеет ту же размерность,что и величина, характеризующая
состав раствора, вместо которой эта
активность используется. Например,
активность в смысле «активная
молярная концентрация» имеет
размерность моль/л, в смысле
«активная моляльность» - моль/кг.
36. Коэффициенты активности
• Отношение активностивещества в данном
растворе к его
концентрации называется
коэффициентом
активности.
37. Индивидуальные коэффициенты активности
В зависимости от способаописания количественного
состава раствора различают
молярный (у), моляльный (ɣ) и
рациональный (f) /на основе
молярных долей вещества/
коэффициенты активности.
38. Выражение коэффициентов активности
39. Среднеионные коэффициенты активности
Для характеристикиактивности электролитов
используются среднеионные
коэффициенты активности,
которые можно определть
экспериментально;
40. Индивидуальные коэффициенты активности ионов:
• Характеризуют активностьотдельных ионов, входящих в
состав электролита. Поскольку
отдельных ионов (только катионов
или только анионов) в растворе не
существует, их получают
расчетным путем
41. Ионная сила раствора
42. Активность растворенного вещества
• Зависит от концентрациирастворенного электролита
(для неэлектролитов она
равна нулю) и квадрата
заряда ионов
43. Ионная сила раствора – математическое выражение
I1
2
I 12 C z
2
C z
i
i
i
2
i
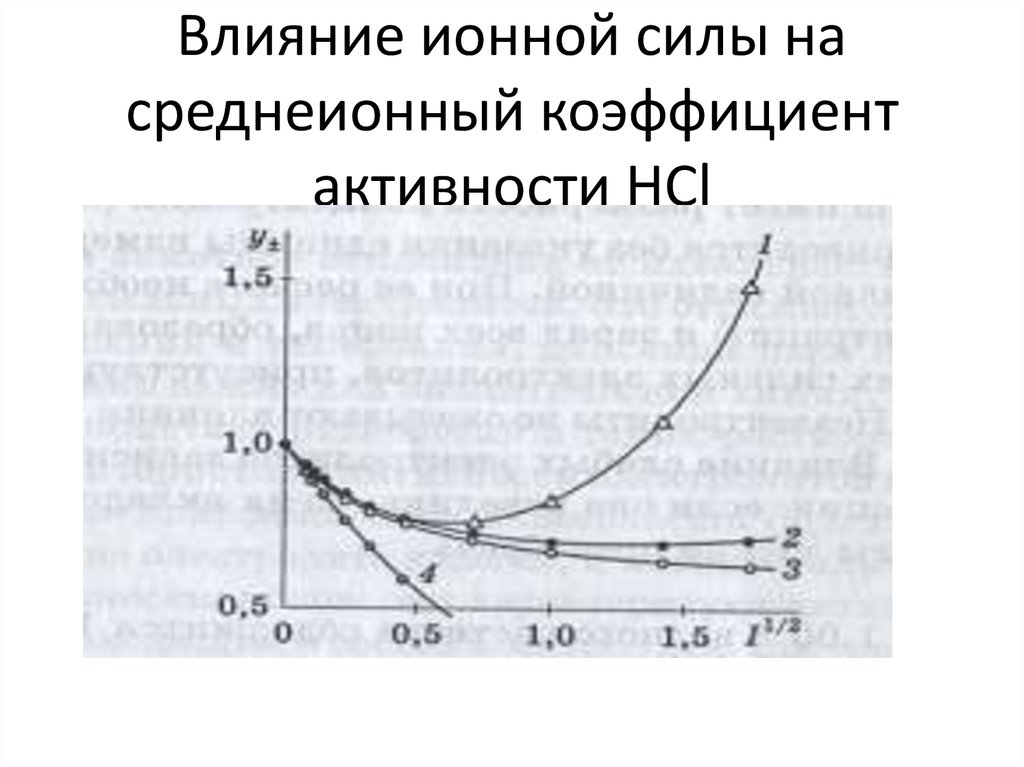
44. Влияние ионной силы на среднеионный коэффициент активности HCl
45. Расчетные формулы
Ионная силараствора
РАСЧЕТНЫЕ ФОРМУЛЫ
46. Предельный закон Дебая-Хюккеля (I<0,01моль/л), А=0,511
Предельный закон ДебаяХюккеля (I<0,01моль/л), А=0,51147. Расширенное уравнение Дебая-Хюккеля (С=0,01-0,1 моль/литр)
Расширенное уравнение ДебаяХюккеля (С=0,01-0,1 моль/литр)48. Коэффициенты расширенного уравнения Дебая-Хюккеля
• А- аналогично предельномууравнению;
• В=0,328 – эмпирическая константа;
• (α) - эмпирическая константа,
характеризующая размер ионной
атмосферы в ангстремах (1Α – 0.1нм)
49. Значения эмпирической константы а для некоторых ионов
50. Уравнение Дэвиса (I=0,1 – 1) В α =1
51. РАСЧЕТНЫЕ ЗАДАЧИ ПО ИОННОЙ СИЛЕ РАСТВОРА
• 1. ИОННАЯ СИЛА ОДНОГО ВЕЩЕСТВА• 2. ИОННАЯ СИЛА ДВУХ ВЕЩЕСТВ
• 3. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ
ОСАДКА ( СТЕХИОМЕТРИЯ ИЛИ ИЗБЫТОКНЕДОСТАТОК)
• 4. ИОННАЯ СИЛА ПРИ ОБРАЗОВАНИИ
КОМПЛЕКСНОГО ИОНА (СТЕХИОМЕТРИЯ
ИЛИ ИЗБЫТОК-НЕДОСТАТОК)

















































 Химия
Химия








