Похожие презентации:
Аналитические реакции катионов I аналитической группы. Лекция 3
1. Аналитические реакции катионов I аналитической группы
+K ,
+
Na ,
NH4
+
2. Характеристика I аналитической группы катионов
• К и Na входят в I группу периодической системы химическихэлементов.
• К и Na обладают ярко выраженными металлическими свойствами.
• Ионы К и Na имеют законченные восьмиэлектронные оболочки.
• Большинство солей К, Na и аммония и их гидроксиды хорошо
растворимы в воде.
• KOH, NaOH – сильные щелочи, диссоциирующие в водных
растворах полностью.
• Соли K и Na, образованные слабыми кислотами, подвергаются
гидролизу (рН>7).
• Соли K и Na, образованные сильными кислотами, гидролизу не
подвергаются (рН 7).
• NH4OH – слабое основание.
• Соли,
образованные
NH4OH
и
сильными
кислотами,
подвергаются гидролизу (рН<7).
• Cоли аммония разлагаются при нагревании, поэтому они могут
быть удалены прокаливанием.
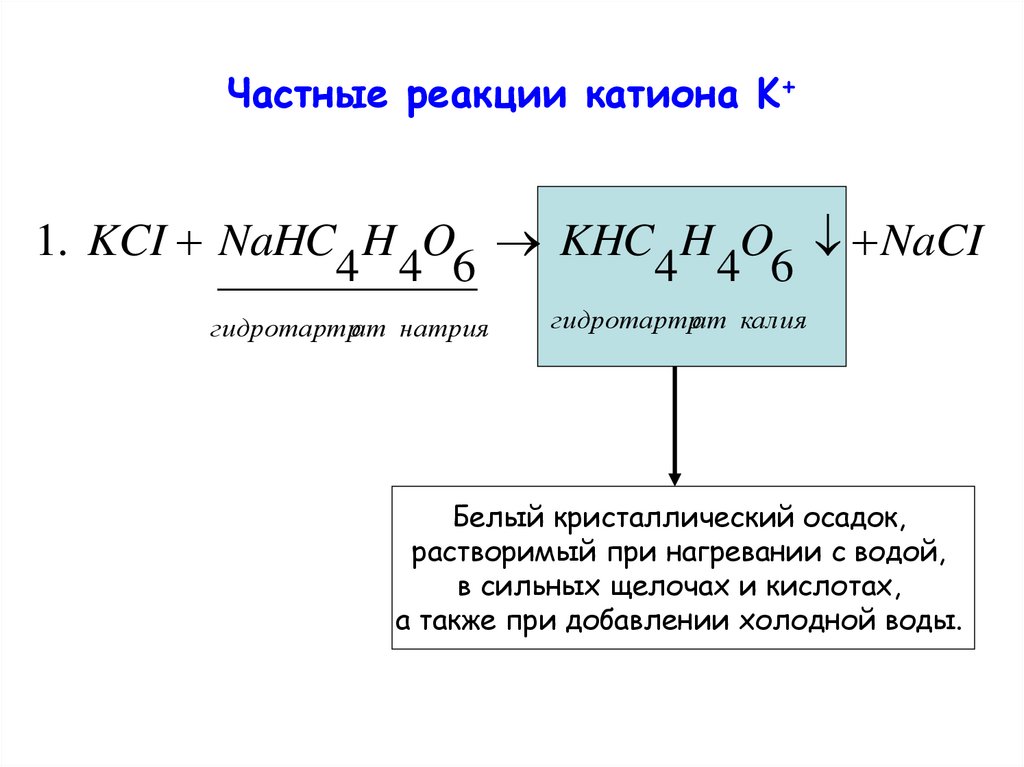
3. Частные реакции катиона K+
1. KCI NaHC H O KHC H O NaCI4 4 6
4 4 6
гидротартрат натрия
гидротартрат калия
Белый кристаллический осадок,
растворимый при нагревании с водой,
в сильных щелочах и кислотах,
а также при добавлении холодной воды.
4.
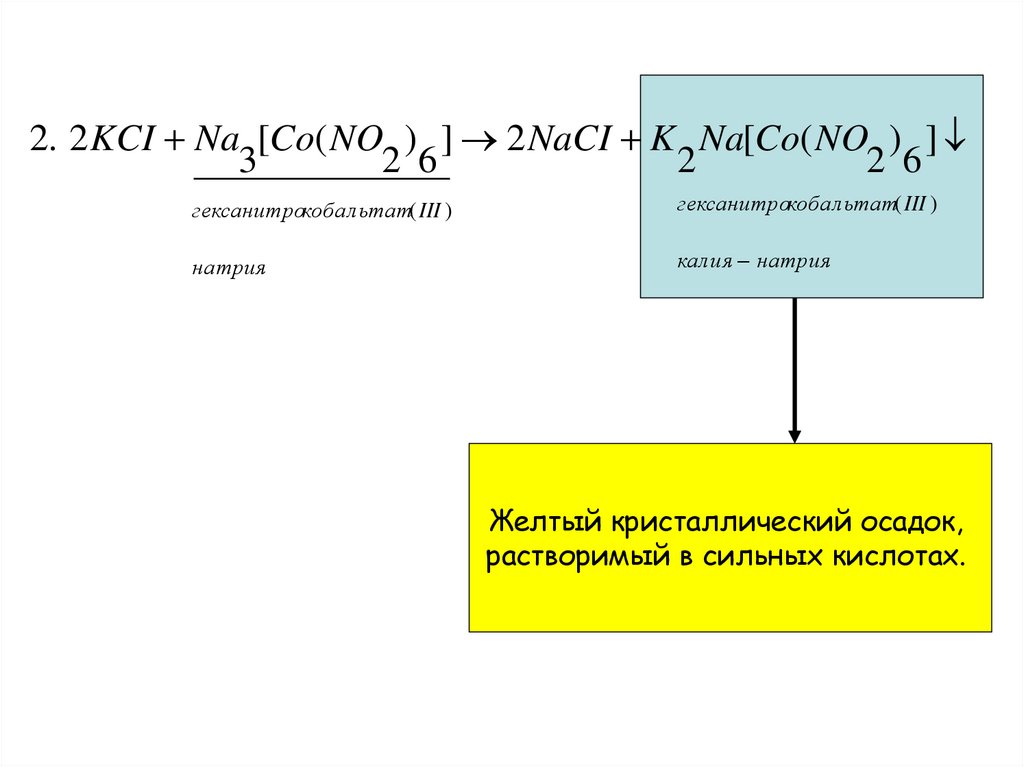
2. 2 KCI Na [Co( NO ) ] 2 NaCI K Na[Co( NO ) ]3
2 6
2
2 6
гексанитрокобальтат( III )
гексанитрокобальтат( III )
натрия
калия натрия
Желтый кристаллический осадок,
растворимый в сильных кислотах.
5.
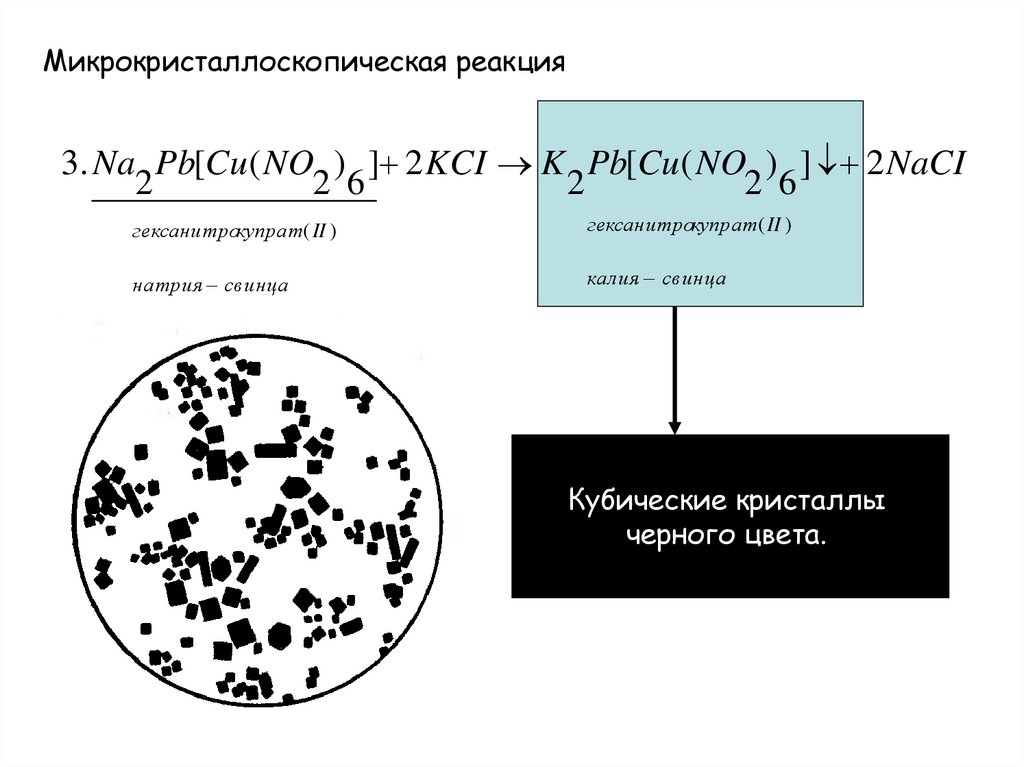
Микрокристаллоскопическая реакция3. Na Pb[Cu( NO ) ] 2 KCI K Pb[Cu( NO ) ] 2 NaCI
2
2 6
2
2 6
гексанитрокупрат( II )
гексанитрокупрат( II )
натрия свинца
калия свинца
Кубические кристаллы
черного цвета.
6.
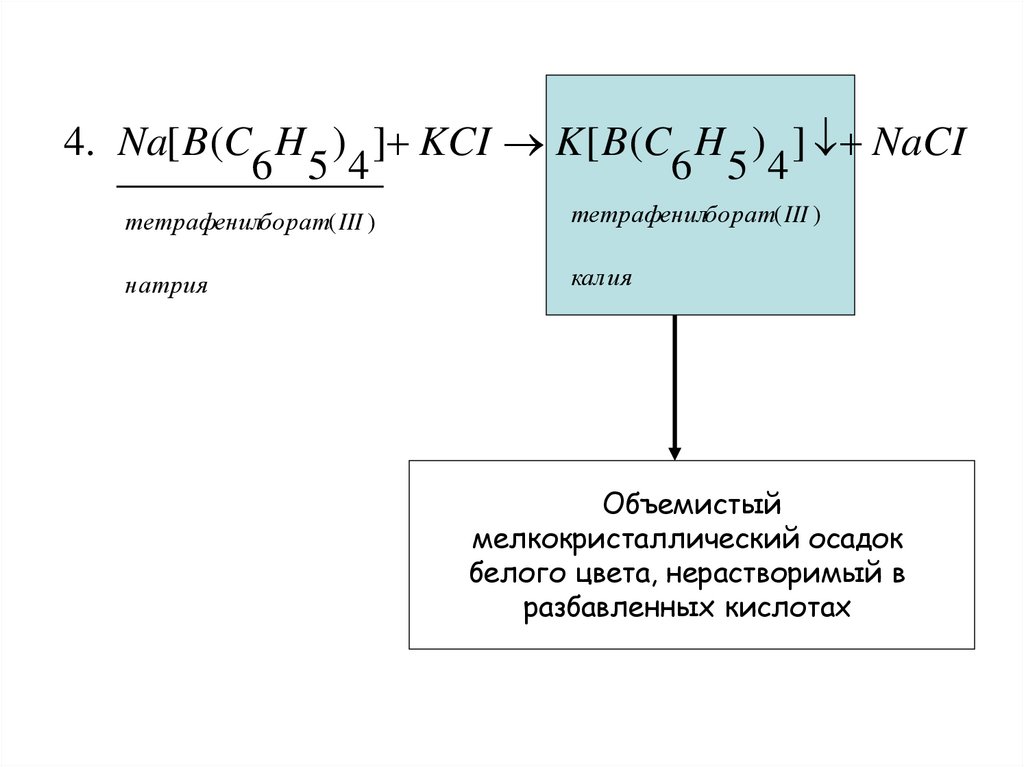
4. Na[ B(C H ) ] KCI K [ B(C H ) ] NaCI6 5 4
6 5 4
тетрафенилборат( III )
тетрафенилборат( III )
натрия
калия
Объемистый
мелкокристаллический осадок
белого цвета, нерастворимый в
разбавленных кислотах
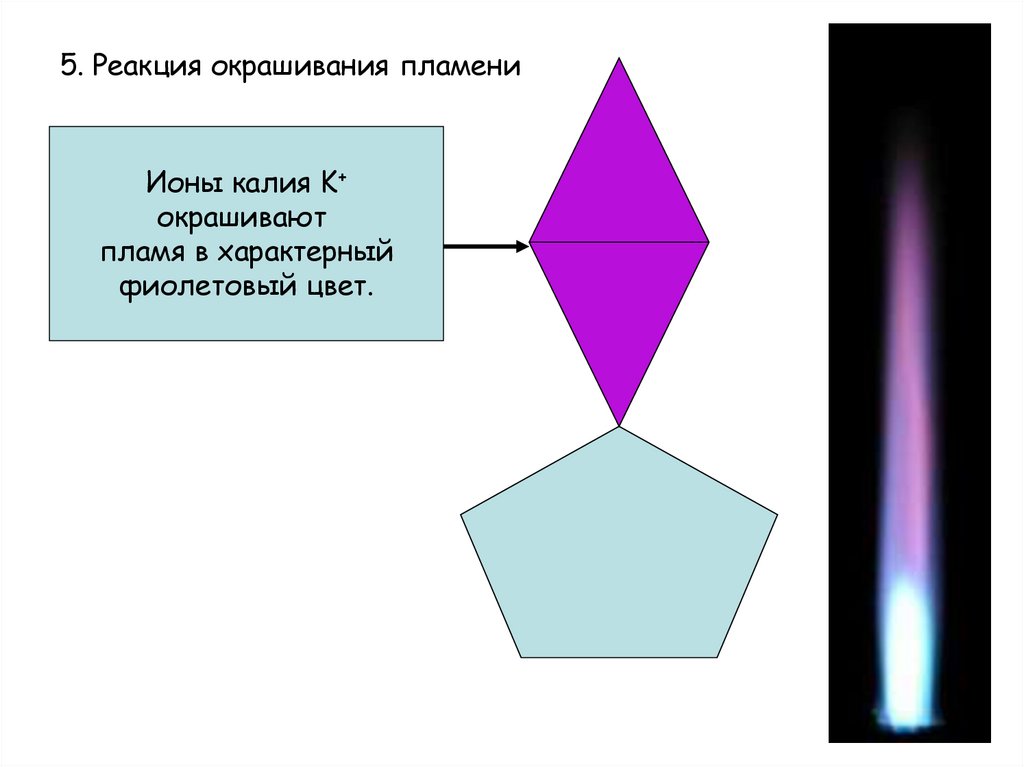
7. 5. Реакция окрашивания пламени
Ионы калия K+окрашивают
пламя в характерный
фиолетовый цвет.
8.
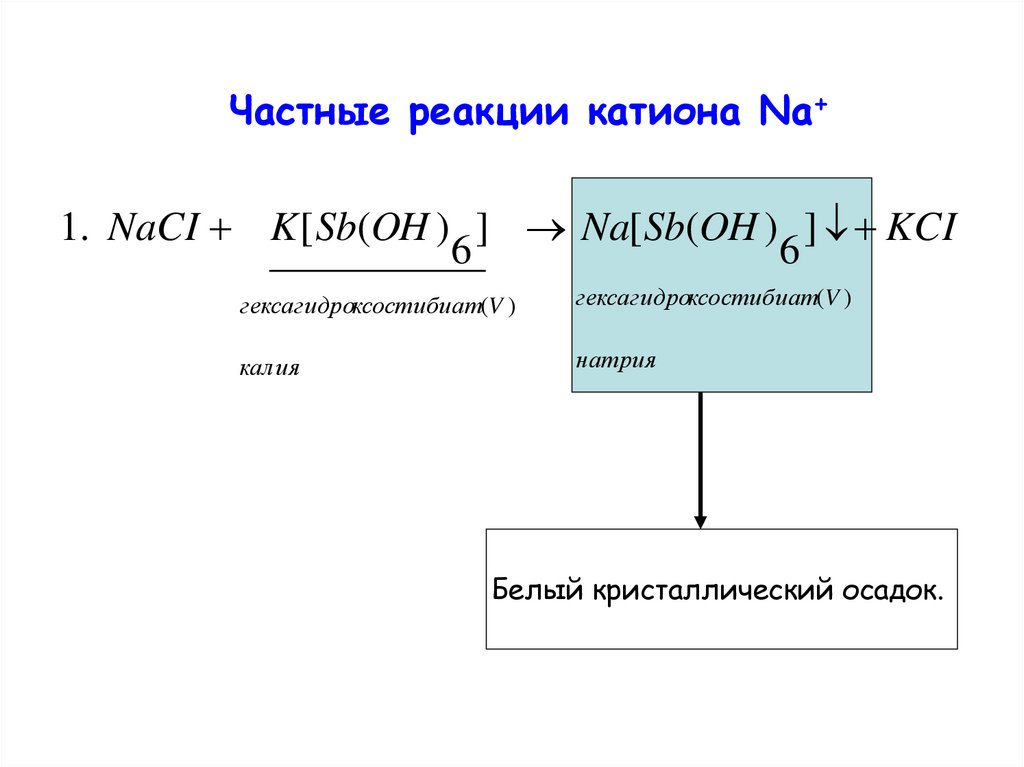
Частные реакции катиона Na+1. NaCI K [ Sb(OH ) ] Na[ Sb(OH ) ] KCI
6
6
гексагидроксостибиат(V )
гексагидроксостибиат(V )
калия
натрия
Белый кристаллический осадок.
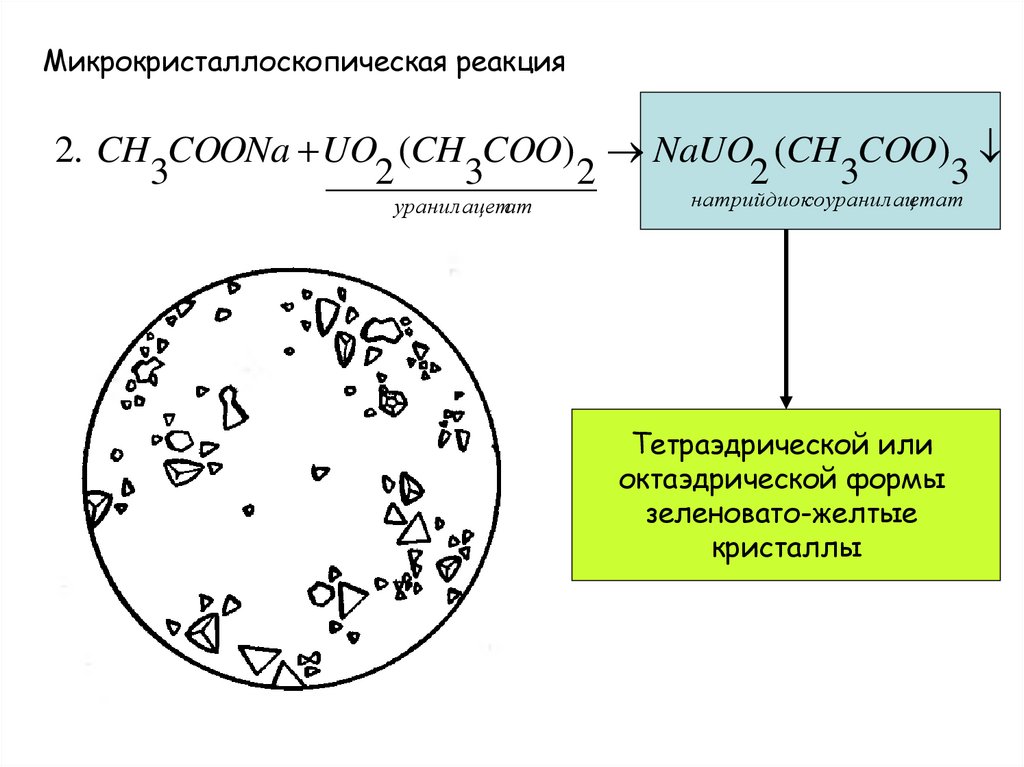
9.
Микрокристаллоскопическая реакция2. CH COONa UO (CH COO) NaUO (CH COO)
3
2
3
2
2
3
3
уранилацетат
натрийдиоксоуранилацетат
Тетраэдрической или
октаэдрической формы
зеленовато-желтые
кристаллы
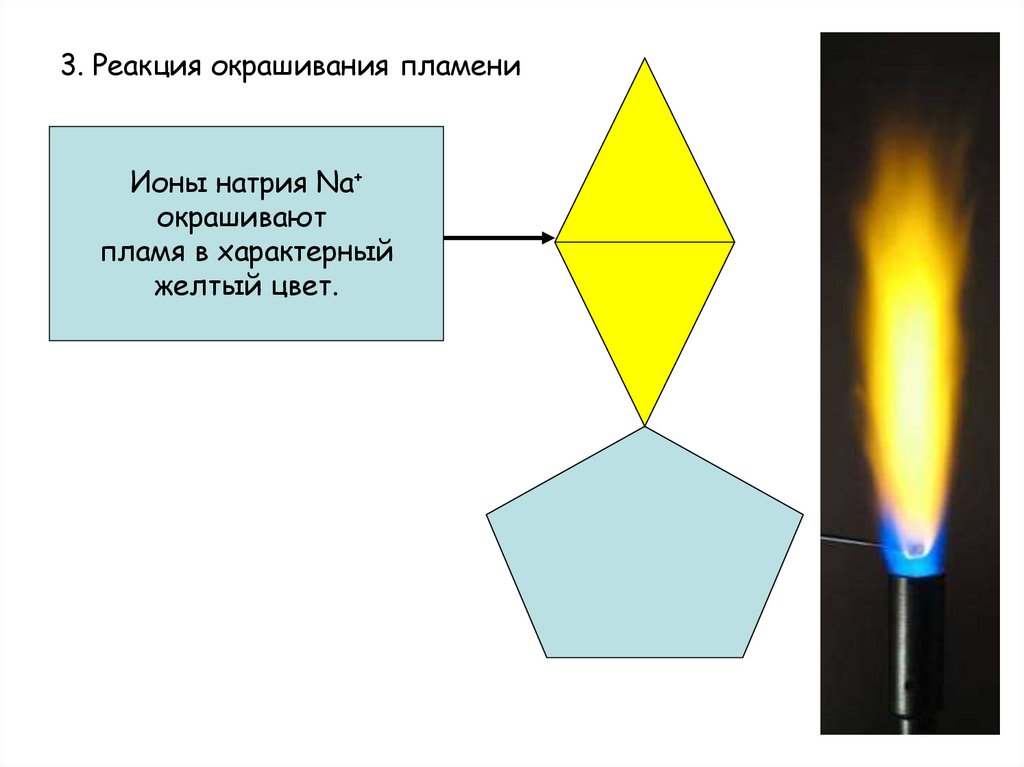
10. 3. Реакция окрашивания пламени
Ионы натрия Na+окрашивают
пламя в характерный
желтый цвет.
11.
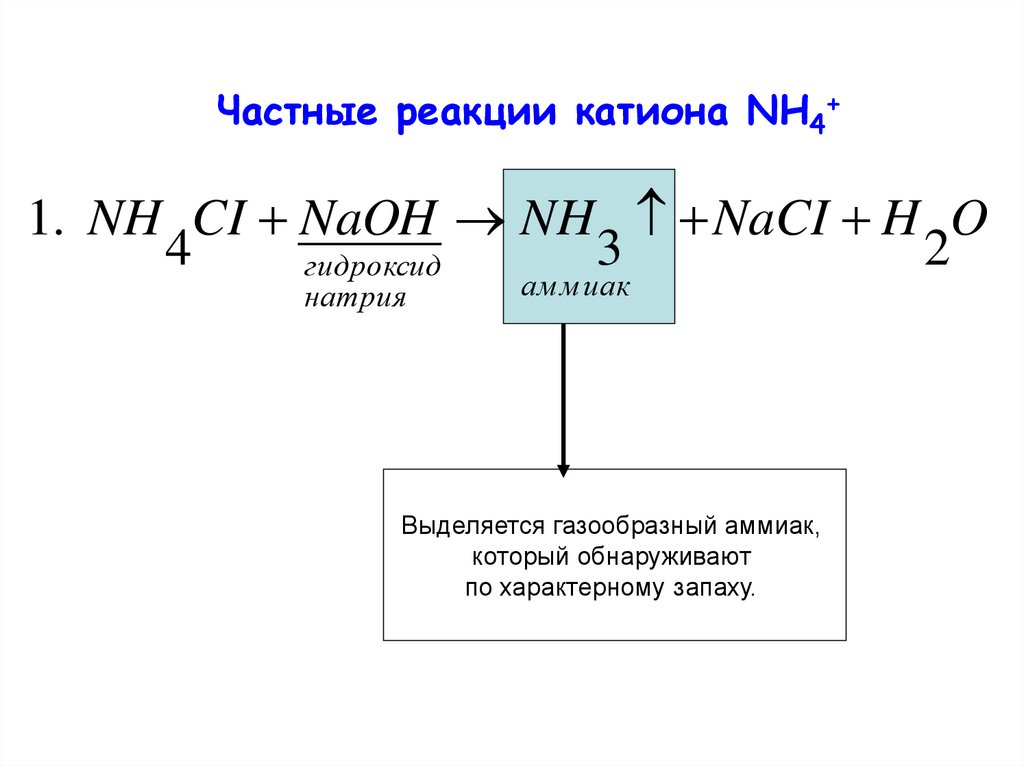
Частные реакции катиона NН4+1. NH CI NaOH NH NaCI H O
4
3
2
гидроксид
натрия
ам м иак
Выделяется газообразный аммиак,
который обнаруживают
по характерному запаху.
12.
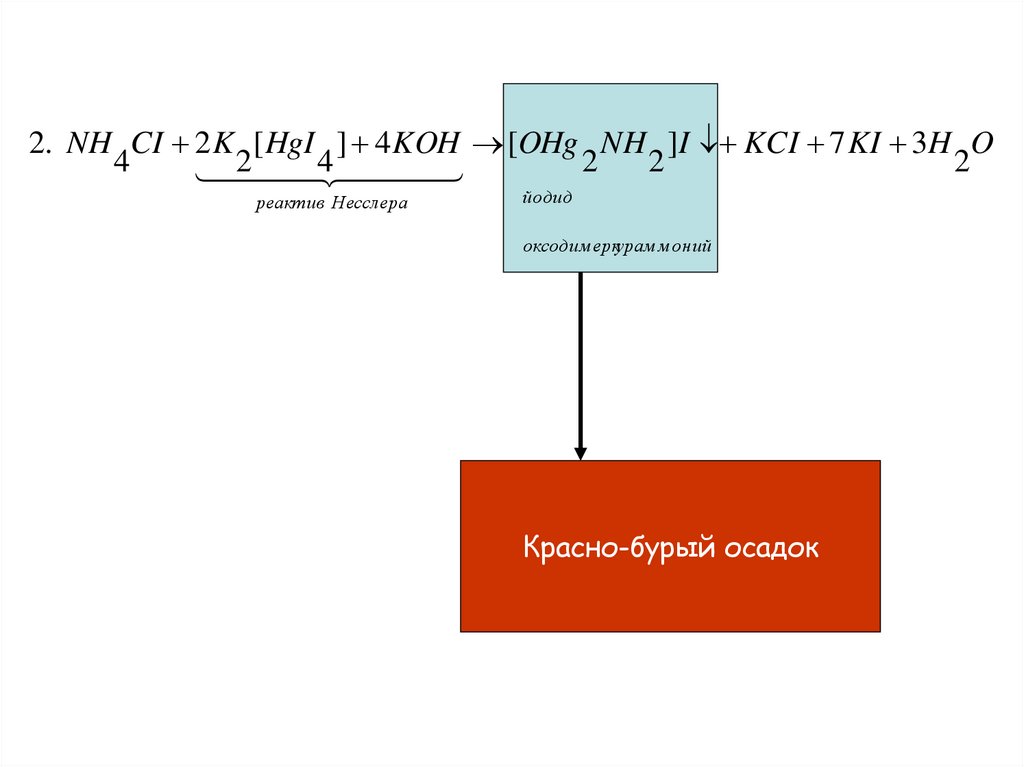
2. NH CI 2 K [ HgI ] 4 KOH [OHg NH ]I KCI 7 KI 3H O4
2
4
2
2
2
реактив Несслера
йодид
оксодим еркурам м оний
Красно-бурый осадок
13.
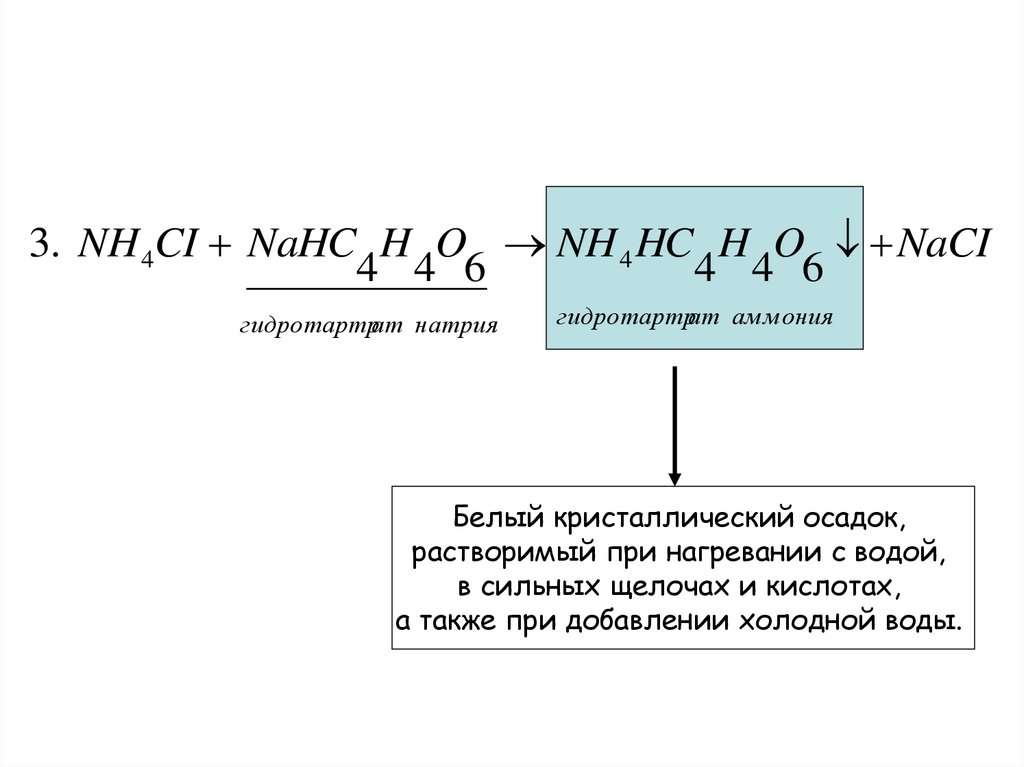
3. NH 4CI NaHC H O NH 4 HC H O NaCI4 4 6
4 4 6
гидротартрат натрия
гидротартрат аммония
Белый кристаллический осадок,
растворимый при нагревании с водой,
в сильных щелочах и кислотах,
а также при добавлении холодной воды.
14.
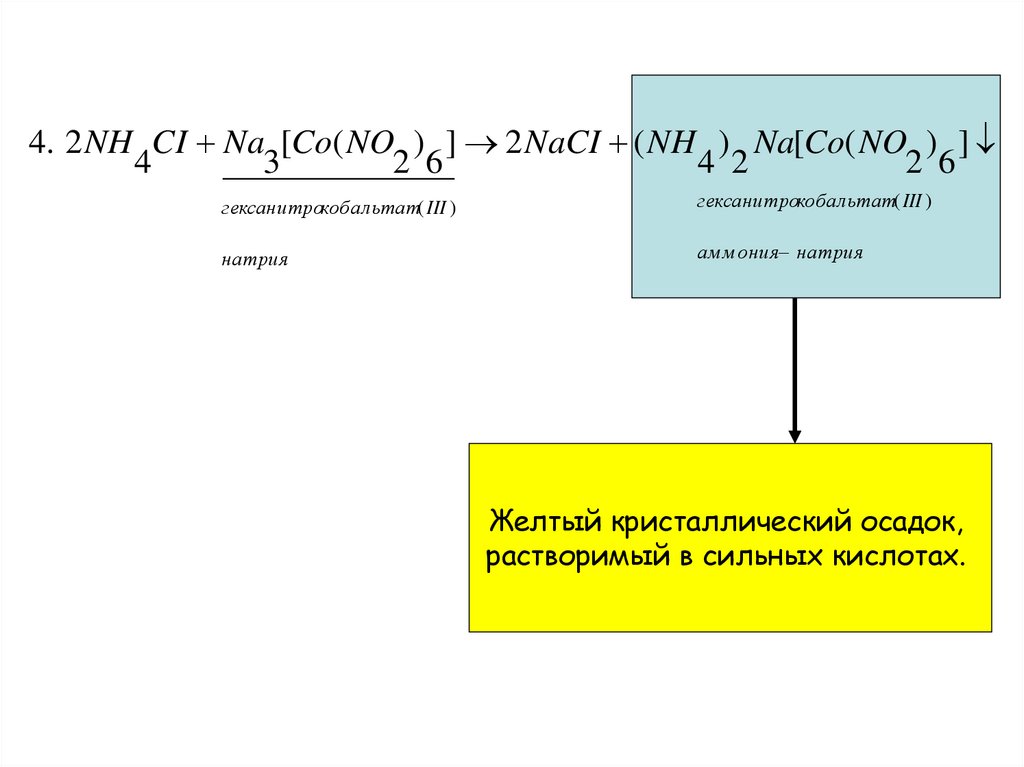
4. 2 NH CI Na [Co( NO ) ] 2 NaCI ( NH ) Na[Co( NO ) ]4
3
2 6
4 2
2 6
гексанитрокобальтат( III )
гексанитрокобальтат( III )
натрия
ам м ония натрия
Желтый кристаллический осадок,
растворимый в сильных кислотах.
15.
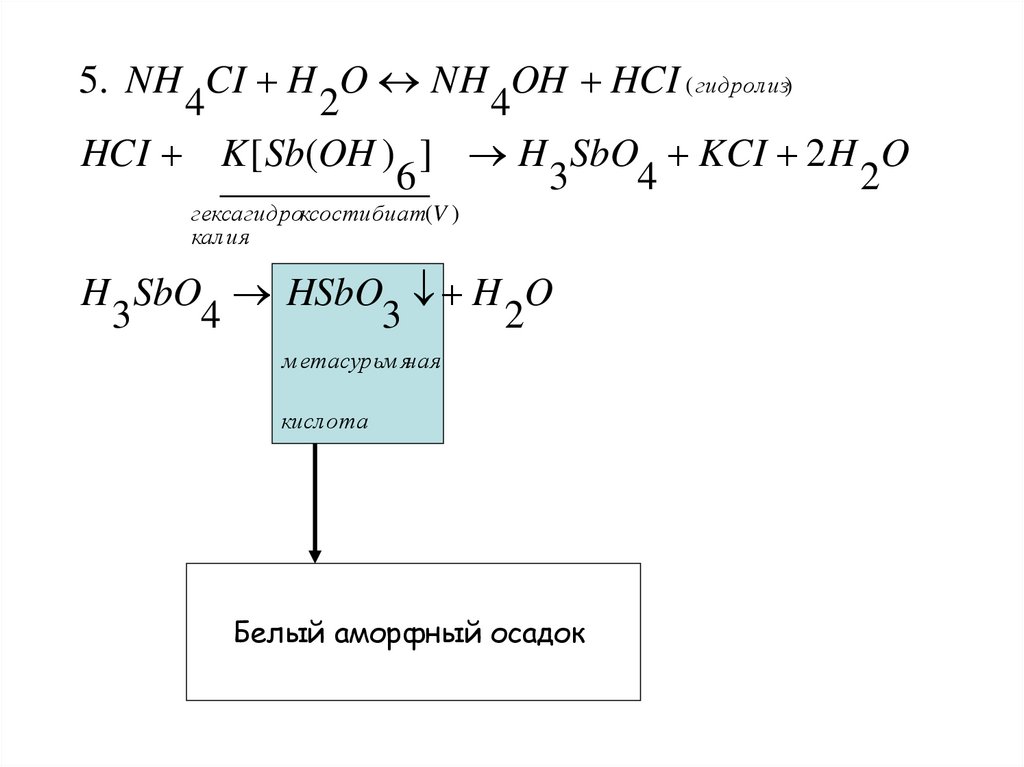
5. NH CI H O NH OH HCI ( гидролиз)4
2
4
HCI K [ Sb(OH ) ] H SbO KCI 2 H O
6
3
4
2
гексагидроксостибиат(V )
калия
H SbO HSbO H O
3
4
3
2
м етасурьм яная
кислота
Белый аморфный осадок
16.
Аналитические реакциикатионов II аналитической
группы
+
Ag ,
2+
Pb ,
[Hg2
2+
]
17. Характеристика II аналитической группы катионов
• Эти элементы находятся в разных группах периодическойсистемы.
• Они имеют либо законченные 18-электронные внешние слои,
либо оболочки, содержащие 18+2 электронов в двух наружных
слоях, что обуславливает одинаковое отношение их к
галогенид-ионам.
• Групповой реагент – соляная кислота.
• Катионы второй группы при взаимодействии с HCl образуют
труднорастворимые в воде и в разбавленных кислотах осадки.
18.
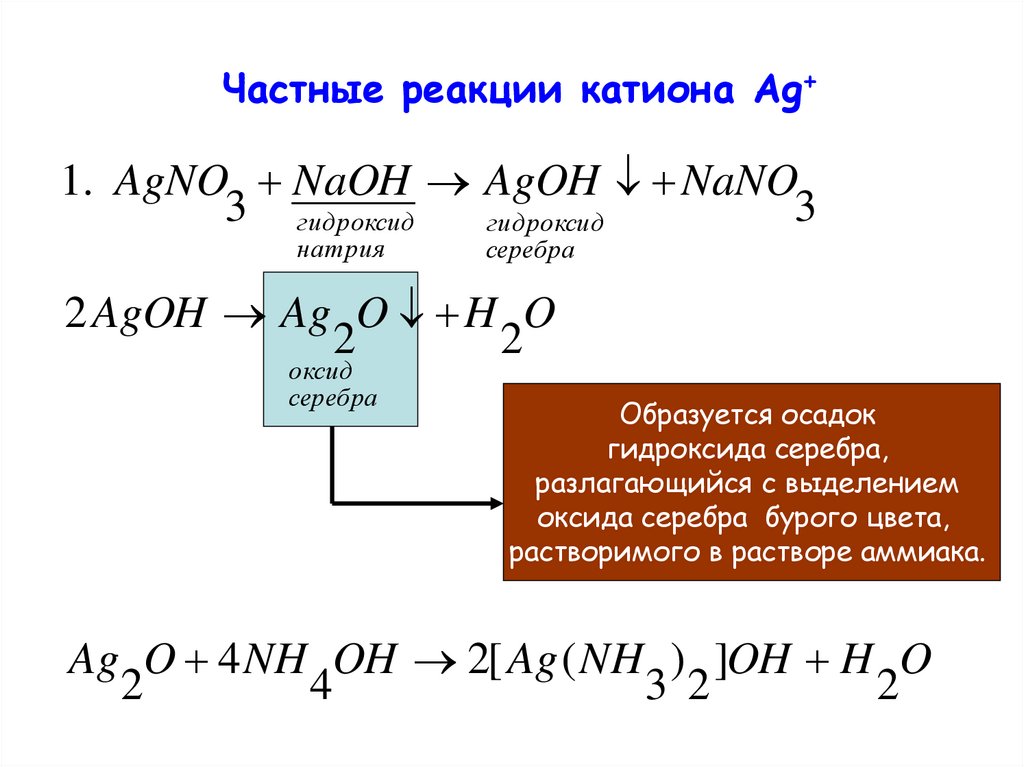
Частные реакции катиона Ag+1. AgNO NaOH AgOH NaNO
3 гидроксид
3
гидроксид
натрия
серебра
2 AgOH Ag O H O
2
2
оксид
серебра
Образуется осадок
гидроксида серебра,
разлагающийся с выделением
оксида серебра бурого цвета,
растворимого в растворе аммиака.
Ag O 4 NH OH 2[ Ag ( NH ) ]OH H O
2
4
3 2
2
19.
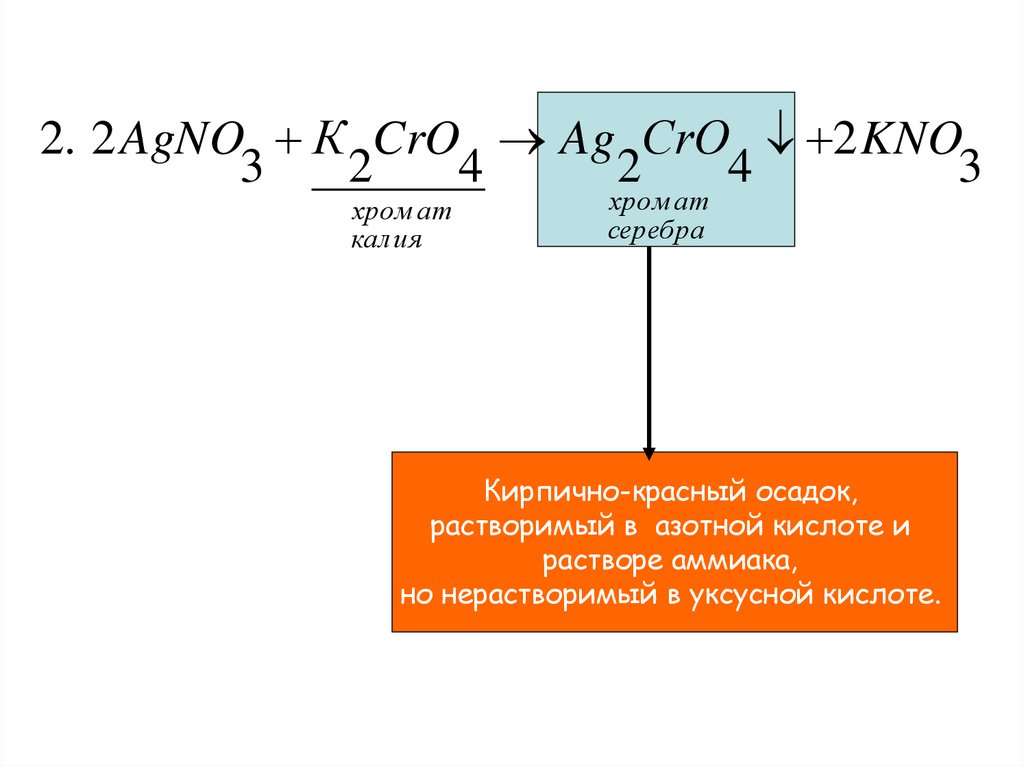
2. 2 AgNO К CrO Ag СrO 2 KNO3
2
4
2
4
3
хром ат
калия
хром ат
серебра
Кирпично-красный осадок,
растворимый в азотной кислоте и
растворе аммиака,
но нерастворимый в уксусной кислоте.
20.
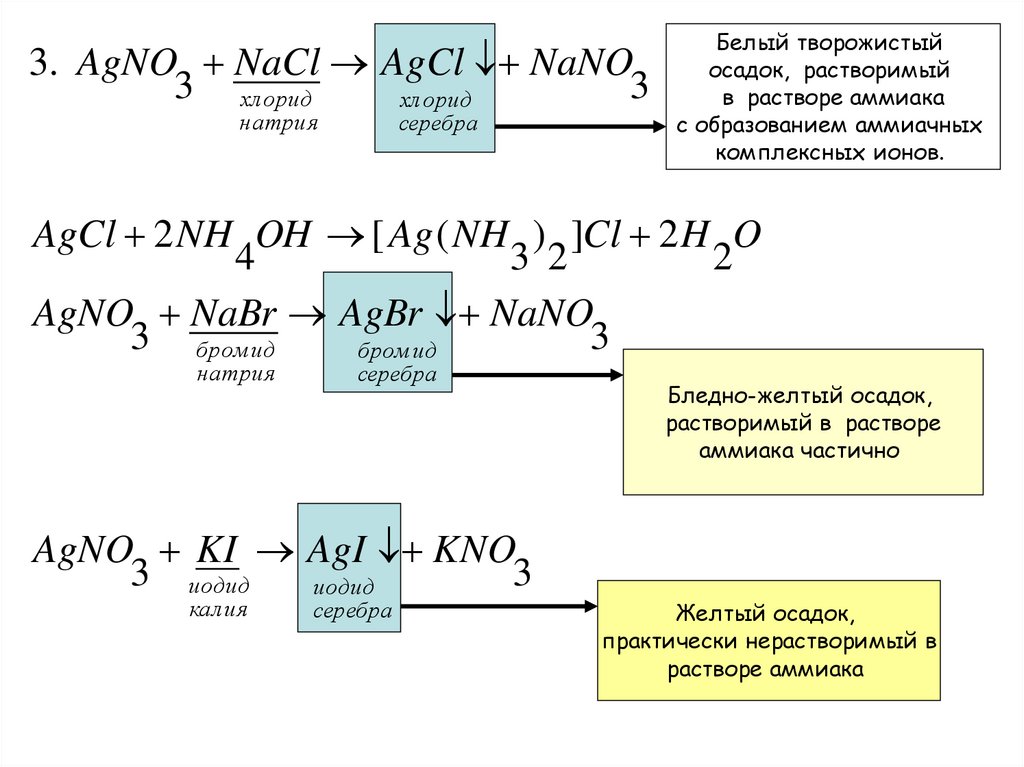
3. AgNO NaCl AgCl NaNO3 хлорид
3
хлорид
натрия
серебра
Белый творожистый
осадок, растворимый
в растворе аммиака
с образованием аммиачных
комплексных ионов.
AgCl 2 NH OH [ Ag ( NH ) ]Cl 2 H O
4
3 2
2
AgNO NaBr AgBr NaNO
3 бром ид
3
бром ид
натрия
серебра
AgNO KI AgI KNO
3 иодид
3
иодид
калия
серебра
Бледно-желтый осадок,
растворимый в растворе
аммиака частично
Желтый осадок,
практически нерастворимый в
растворе аммиака
21.
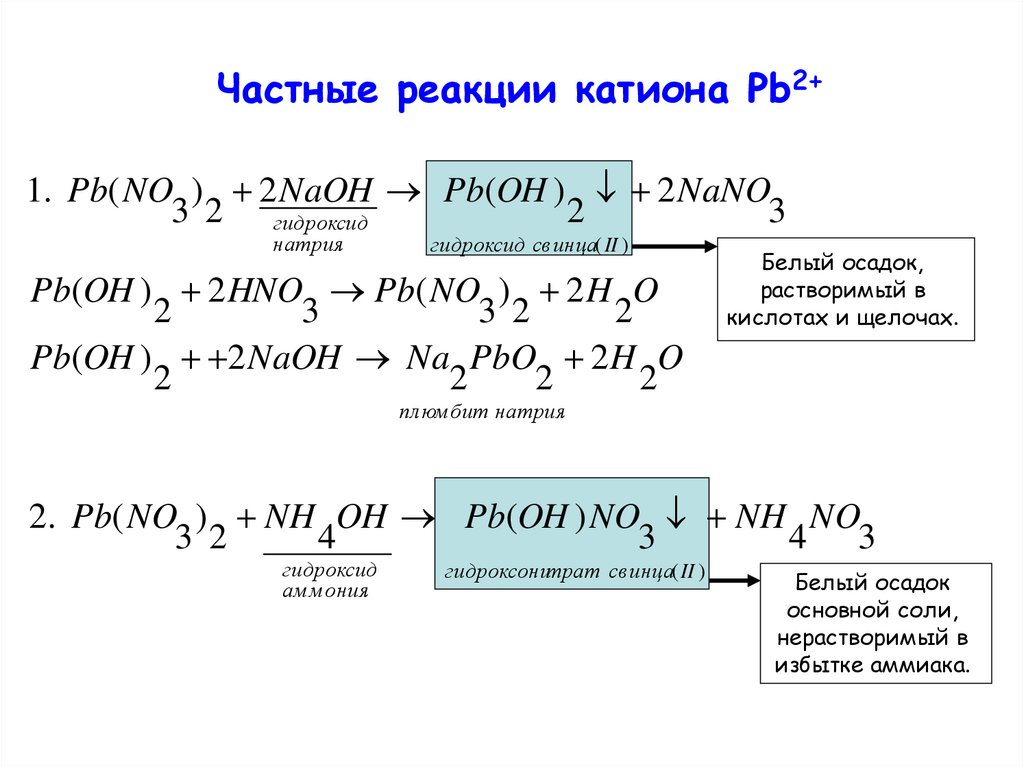
Частные реакции катиона Pb2+1. Pb( NO ) 2 NaOH Pb(OH ) 2 NaNO
3 2 гидроксид
2
3
натрия
гидроксид св инца( II )
Pb(OH ) 2 HNO Pb( NO ) 2 H O
2
3
3 2
2
Pb(OH ) 2 NaOH Na PbO 2 H O
2
2
2
2
Белый осадок,
растворимый в
кислотах и щелочах.
пл юм бит натрия
2. Pb( NO ) NH OH Pb(OH ) NO NH NO
3 2
4
3
4 3
гидроксид
ам м ония
гидроксонитрат св инца( II )
Белый осадок
основной соли,
нерастворимый в
избытке аммиака.
22.
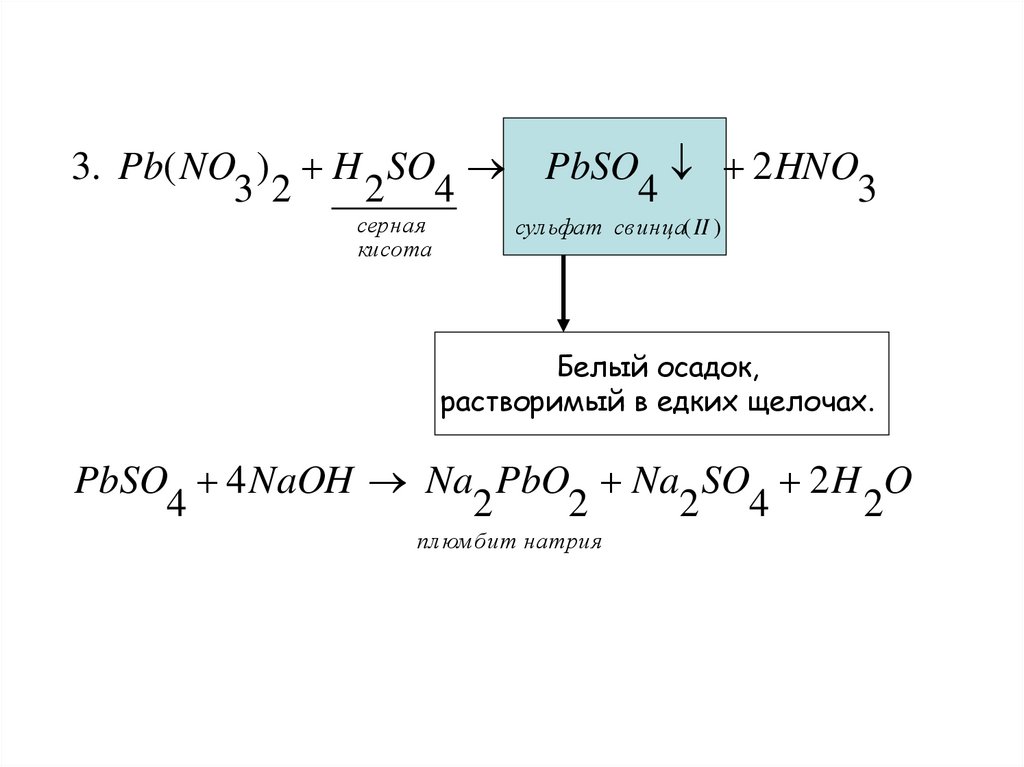
3. Pb( NO ) H SO PbSO 2 HNO3 2
2 4
4
3
серная
кисота
сул ьфат св инца( II )
Белый осадок,
растворимый в едких щелочах.
PbSO 4 NaOH Na PbO Na SO 2 H O
4
2
2
2 4
2
пл юм бит натрия
23.
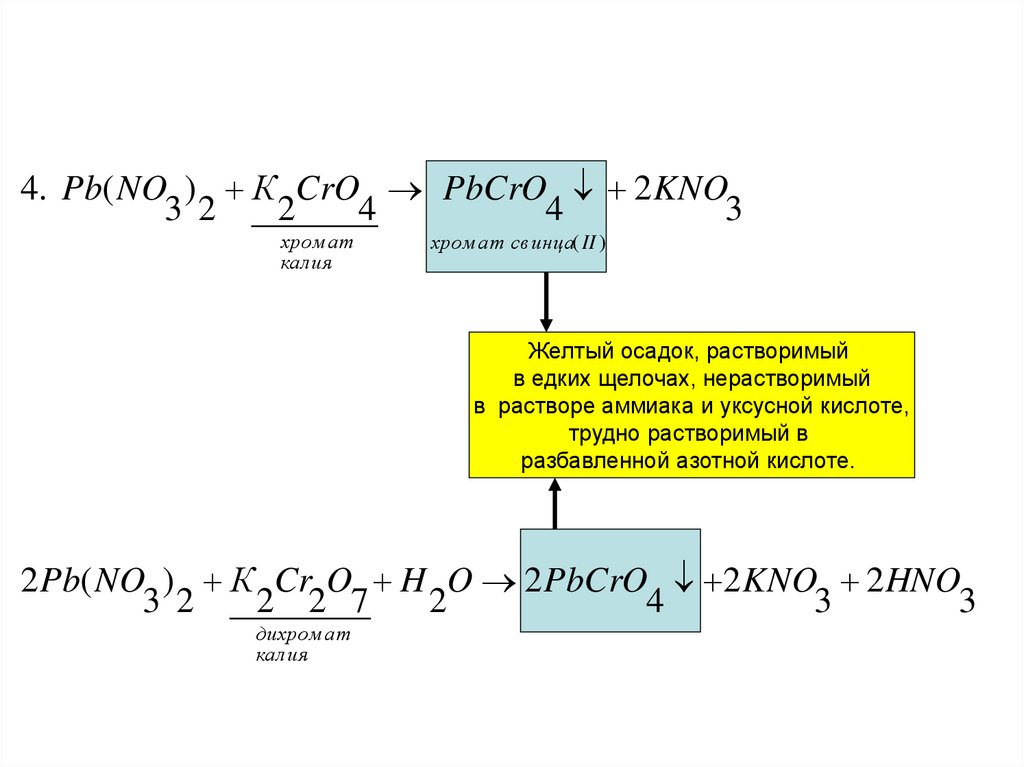
4. Pb( NO ) К CrO PbCrO 2 KNO3 2
2
4
4
3
хром ат
калия
хром ат свинца( II )
Желтый осадок, растворимый
в едких щелочах, нерастворимый
в растворе аммиака и уксусной кислоте,
трудно растворимый в
разбавленной азотной кислоте.
2 Pb( NO ) К Cr O H O 2 PbCrO 2 KNO 2 HNO
3 2
2 2 7
2
4
3
3
дихром ат
калия
24.
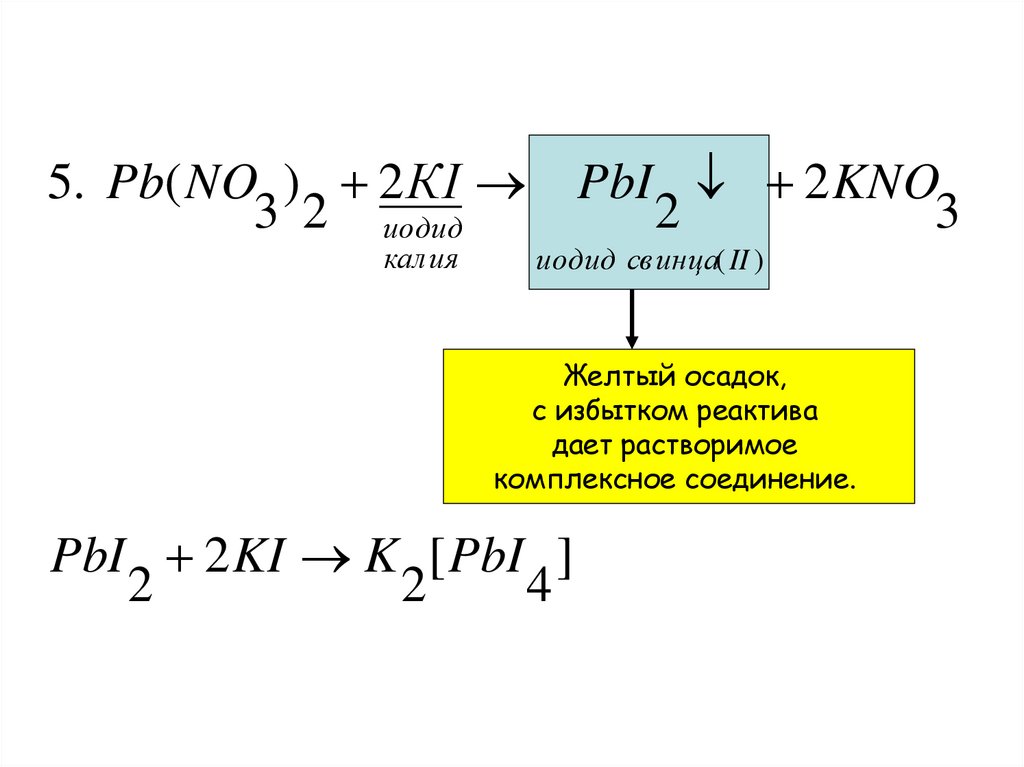
5. Pb( NO ) 2 КI3 2 иодид
калия
PbI 2 KNO
2
3
иодид св инца( II )
Желтый осадок,
с избытком реактива
дает растворимое
комплексное соединение.
PbI 2 KI K [ PbI ]
2
2
4
25.
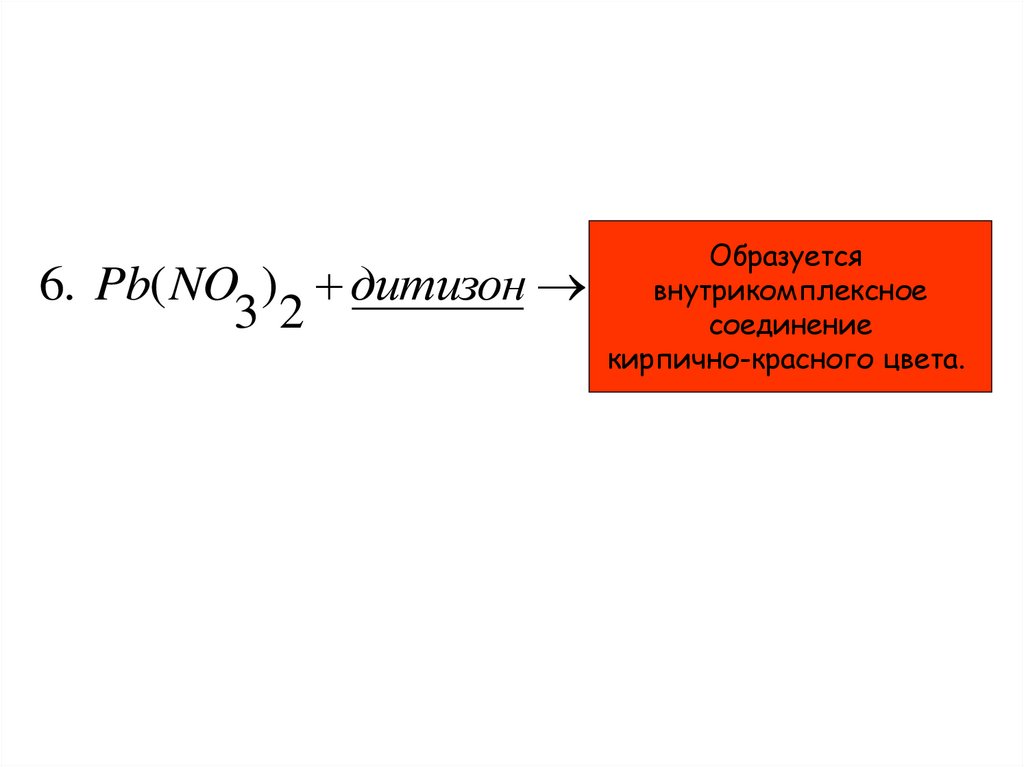
6. Pb( NO ) дитизон3 2
Образуется
внутрикомплексное
соединение
кирпично-красного цвета.
26.
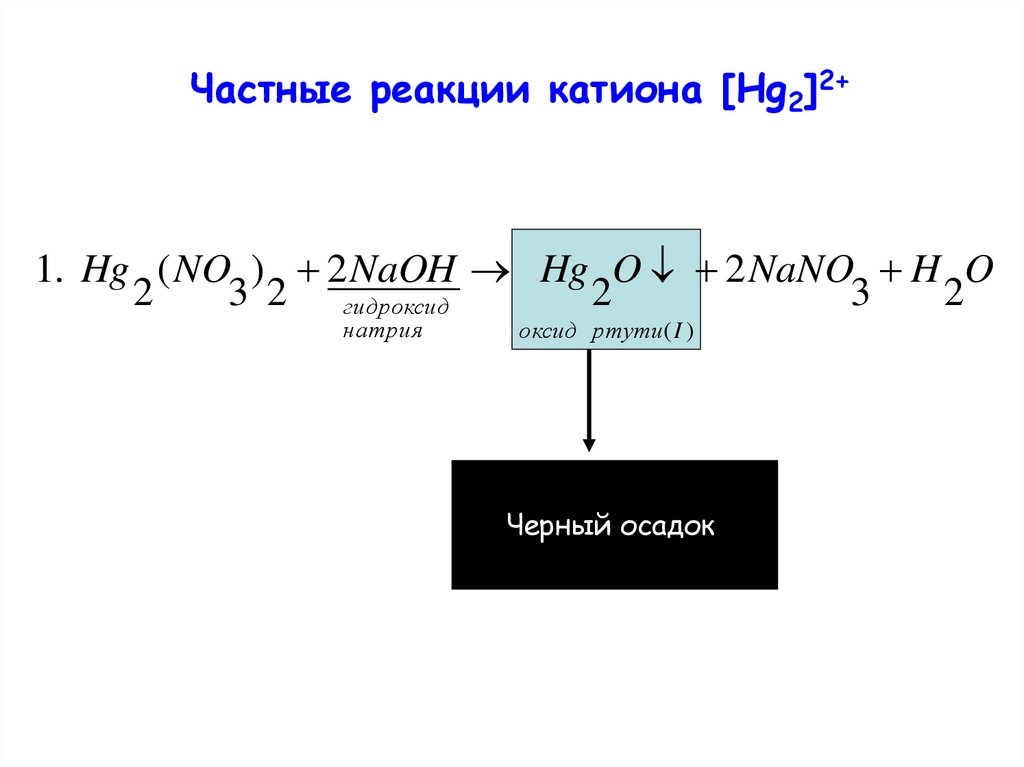
Частные реакции катиона [Hg2]2+1. Hg ( NO ) 2 NaOH Hg O 2 NaNO H O
2
3 2 гидроксид
2
3
2
натрия
оксид ртути( I )
Черный осадок
27.
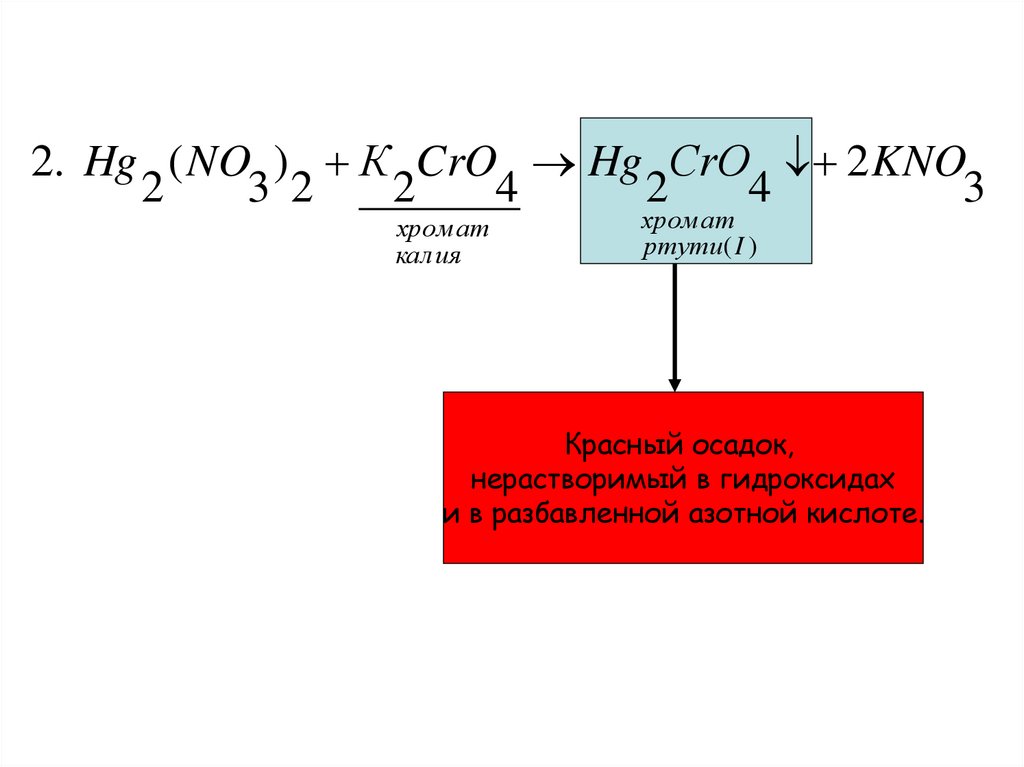
2. Hg ( NO ) К CrO Hg СrO 2 KNO2
3 2
2
4
2
4
3
хром ат
калия
хром ат
ртути( I )
Красный осадок,
нерастворимый в гидроксидах
и в разбавленной азотной кислоте.
28.
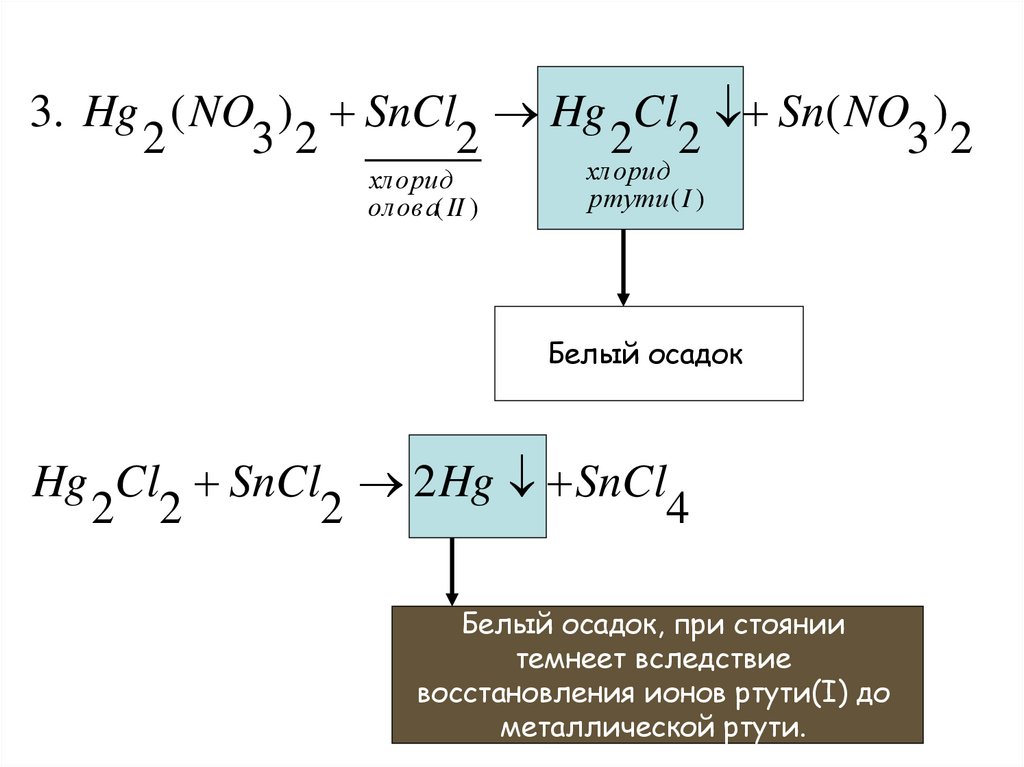
3. Hg ( NO ) SnCl Hg Cl Sn( NO )2
3 2
2
2 2
3 2
хлорид
олова( II )
хлорид
ртути( I )
Белый осадок
Hg Cl SnCl 2 Hg SnCl
2 2
2
4
Белый осадок, при стоянии
темнеет вследствие
восстановления ионов ртути(I) до
металлической ртути.
29.
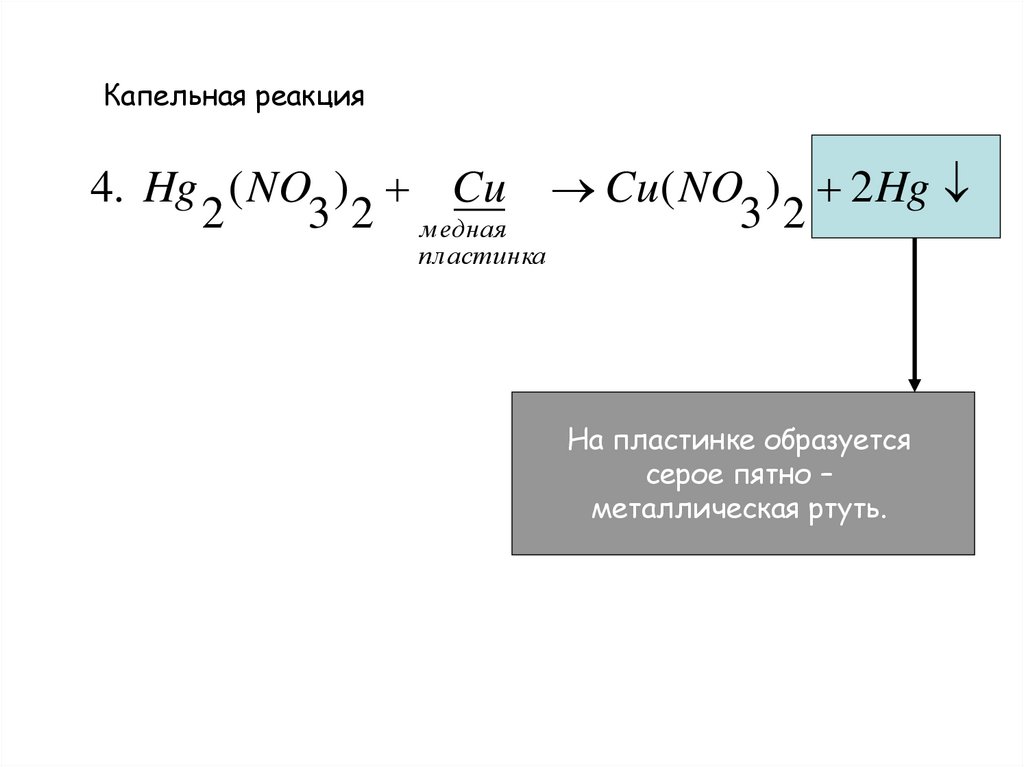
Капельная реакция4. Hg ( NO ) Cu Cu( NO ) 2 Hg
2
3 2 м едная
3 2
пластинка
На пластинке образуется
серое пятно –
металлическая ртуть.
30.
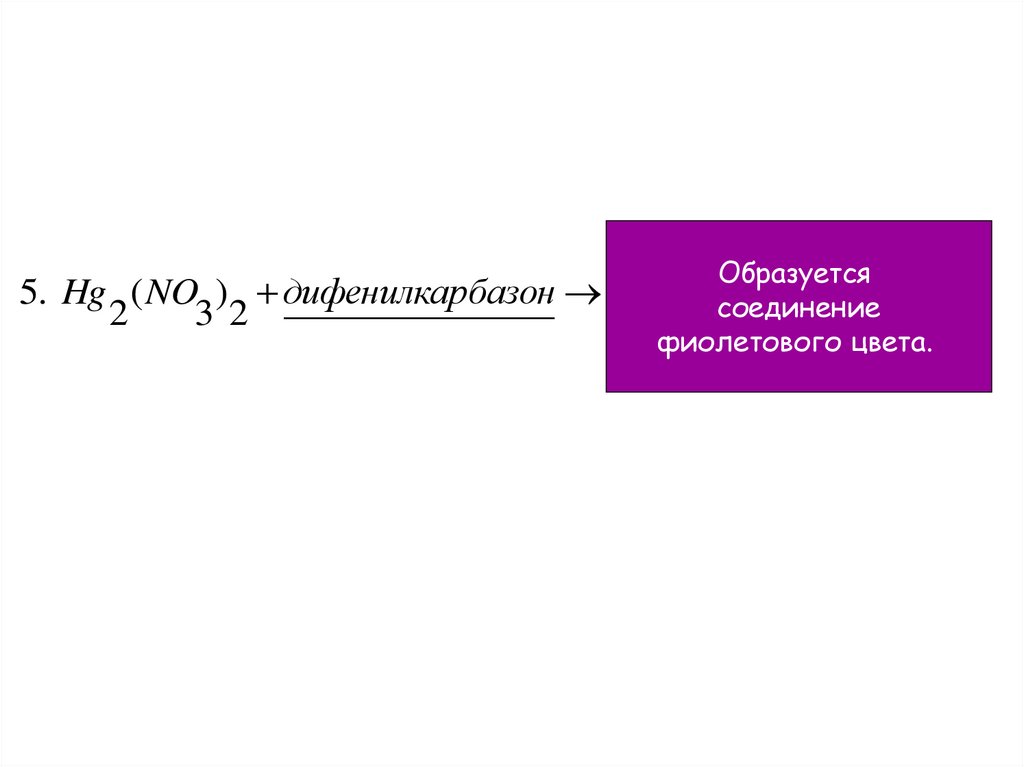
5. Hg ( NO ) дифенилкарбазон2
3 2
Образуется
соединение
фиолетового цвета.




 Химия
Химия








