Похожие презентации:
Гидролиз органических веществ
1.
2.
3.
Гидролиз – это реакцияобменного разложения
веществ водой.
Hydro – вода
Lysis – разложение, распад.
4. Сила оснований
• Сильные основания – это основания,образованные щелочными и
щелочноземельными металлами (LiOH,
NaOH и т.д)
• Все остальные основания - слабые
5. Сила бескислородных кислот
• Слабые – H2S, HF,H2Se• Остальные кислоты – сильные:HCl,HBr,HI
6. Сила кислородсодержащих кислот
• Любую кислоту можно представить ввиде
ЭОm(ОН)n
• Если
m=0,1-слабые
m=2,3-сильные
• Пример H2SO4
SО2(ОН)2 - сильная
• Пример H3PO4
PО1(ОН)3 - слабая
7.
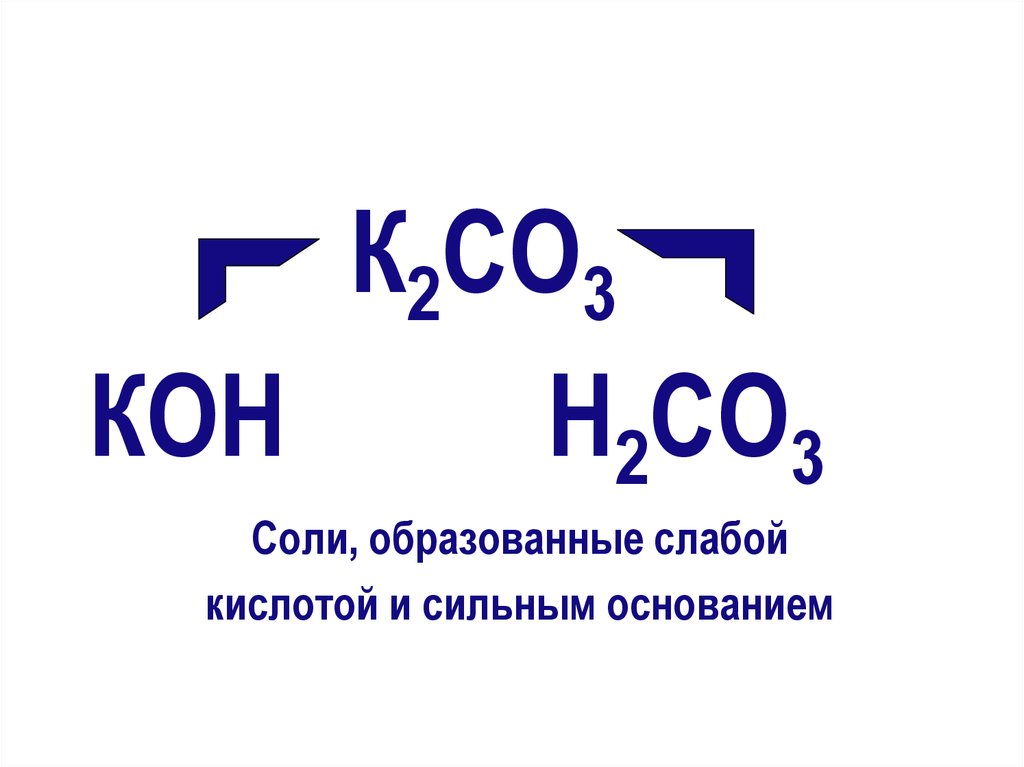
К2СO3КОН
Н2СO3
Соли, образованные слабой
кислотой и сильным основанием
8.
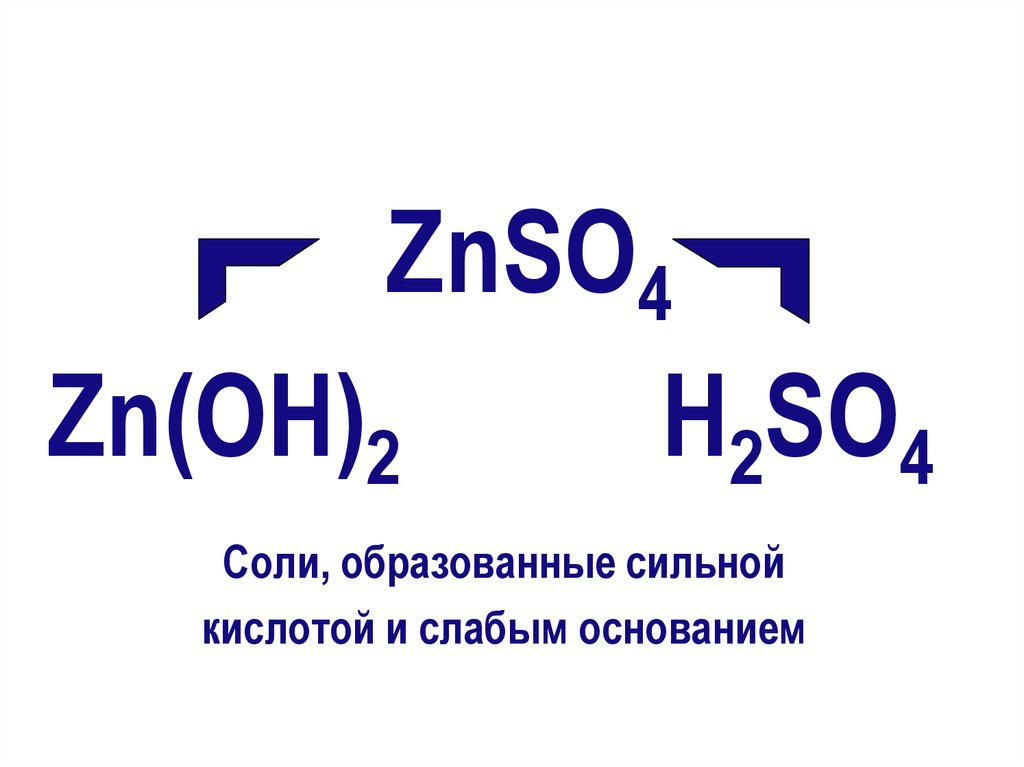
ZnSO4Zn(ОН)2
Н2SO4
Соли, образованные сильной
кислотой и слабым основанием
9.
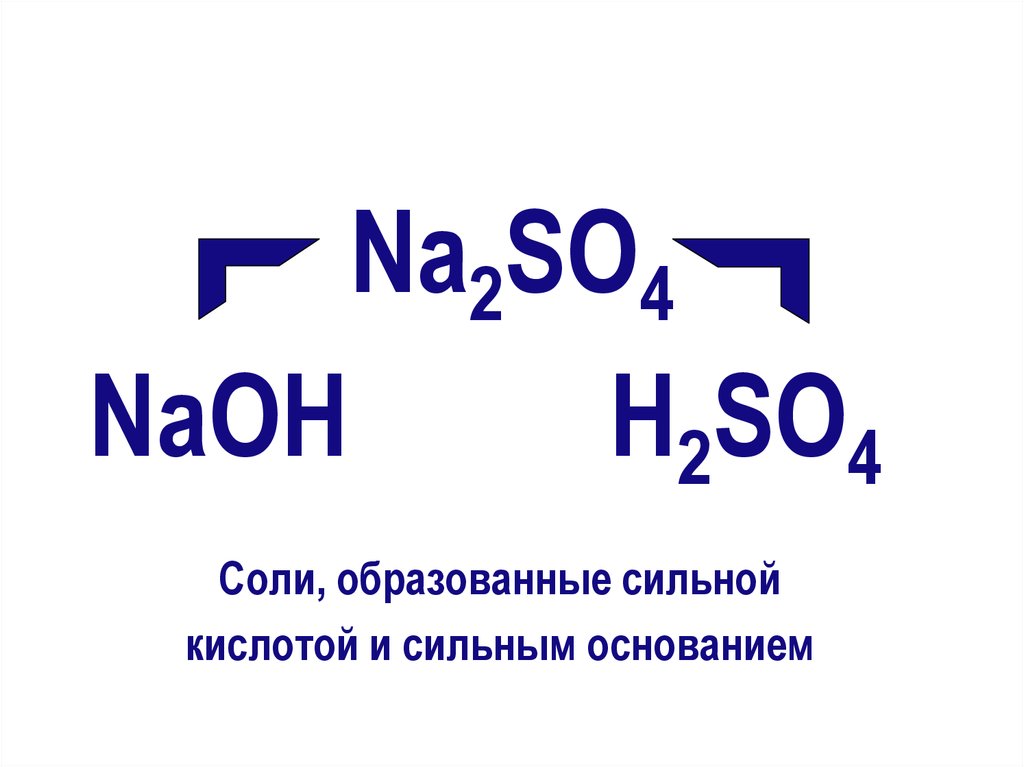
Na2SO4NaОН
Н2SO4
Соли, образованные сильной
кислотой и сильным основанием
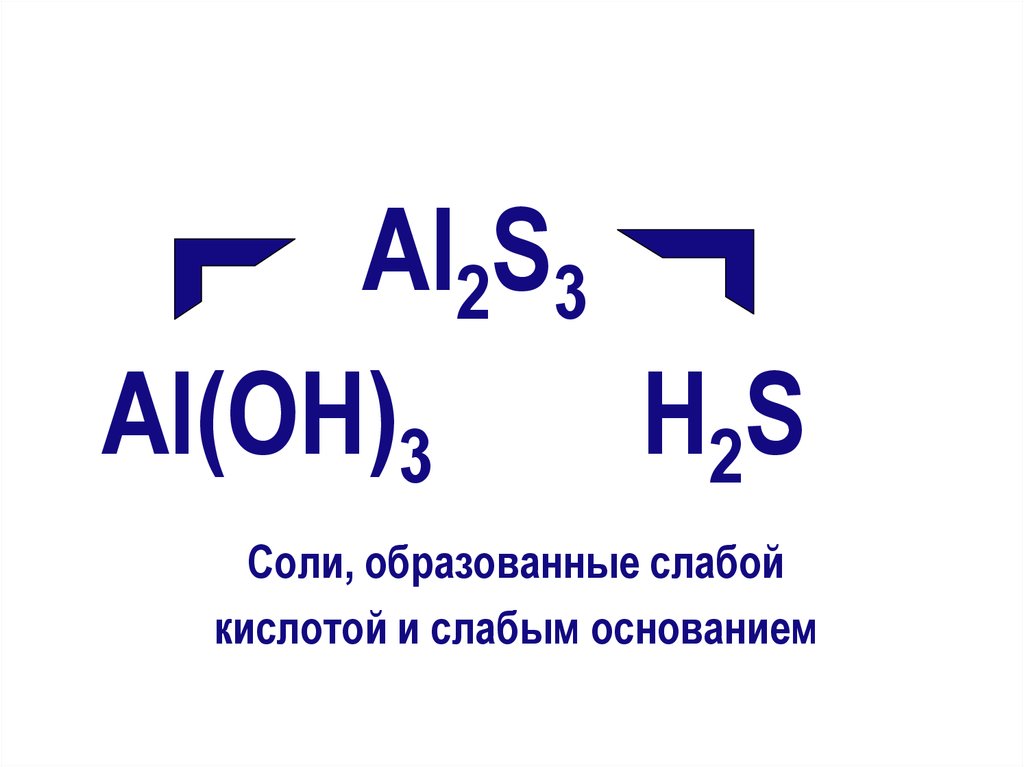
10.
Al2S3Al(ОН)3
Н2S
Соли, образованные слабой
кислотой и слабым основанием
11.
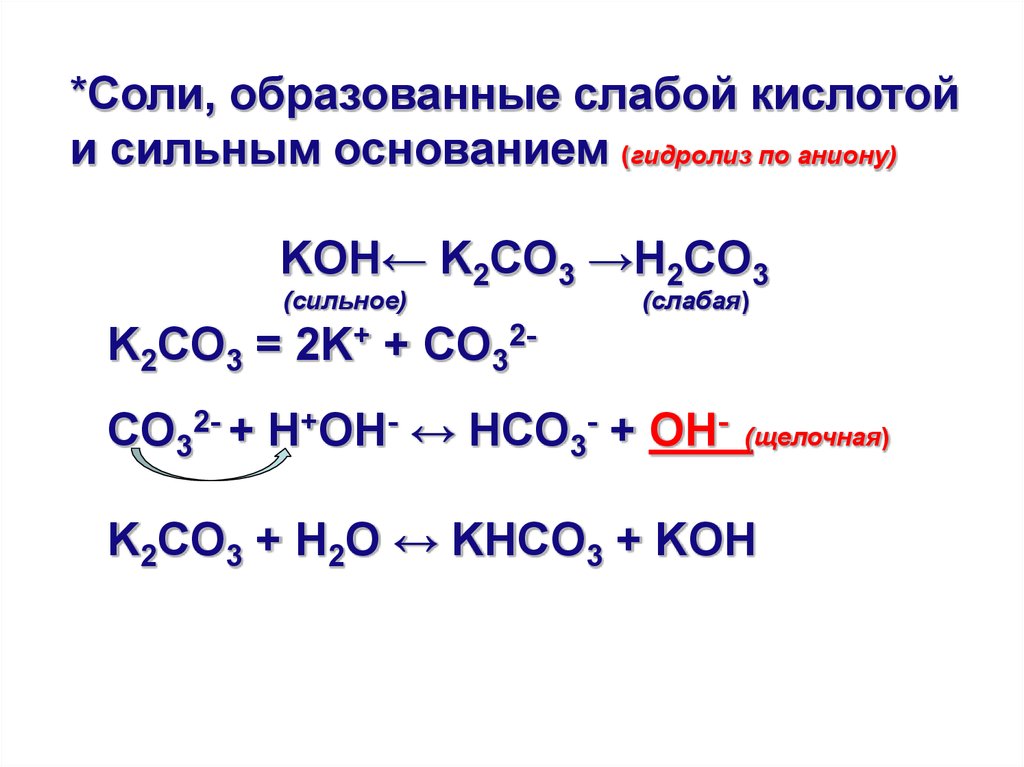
*Соли, образованные слабой кислотойи сильным основанием (гидролиз по аниону)
KOH← K2CO3 →H2CO3
(сильное)
(слабая)
K2CO3 = 2K+ + CO32CO32- + H+OН- ↔ HCO3- + OH-
(щелочная)
K2CO3 + H2O ↔ KHCO3 + KOH
12.
• Гидролиз сульфитанатрия
• Гидролиз силиката лития
• Гидролиз фосфата калия
13.
*Соли, образованные сильной кислотойи слабым основанием (гидролиз по катиону)
Zn(OH)2 ← ZnSO4 → H2SO4
( слабое)
( сильная)
ZnSO4 = Zn2+ + SO42Zn2+ + H+OН- ↔ ZnOH+ + H+ (кислая)
2ZnSO4 + 2H2O ↔ (ZnOH)2SO4 + H2SO4
14.
• Гидролиз нитрата алюминия• Гидролиз хлорида
железа (III)
• Гидролиз иодида аммония
15.
*Соли, образованные слабой кислотой ислабым основанием (гидролиз по катиону и аниону)
Al(OH)3 ← Al2S3 → H2S
( слабое)
( слабая)
Al2S3 =2 Al3+ + 3S22 Al3+ + 3S2- +6 H+OН- →2 Al(OH)3↓ + 3H2S↑
Al2S3 +6H2O→ 2 Al(OH)3↓ + 3H2S↑
необратимый гидролиз неорганических веществ
16.
*Соли, образованныесильной кислотой и
сильным основанием
гидролизу не
подвергаются
рН = 7
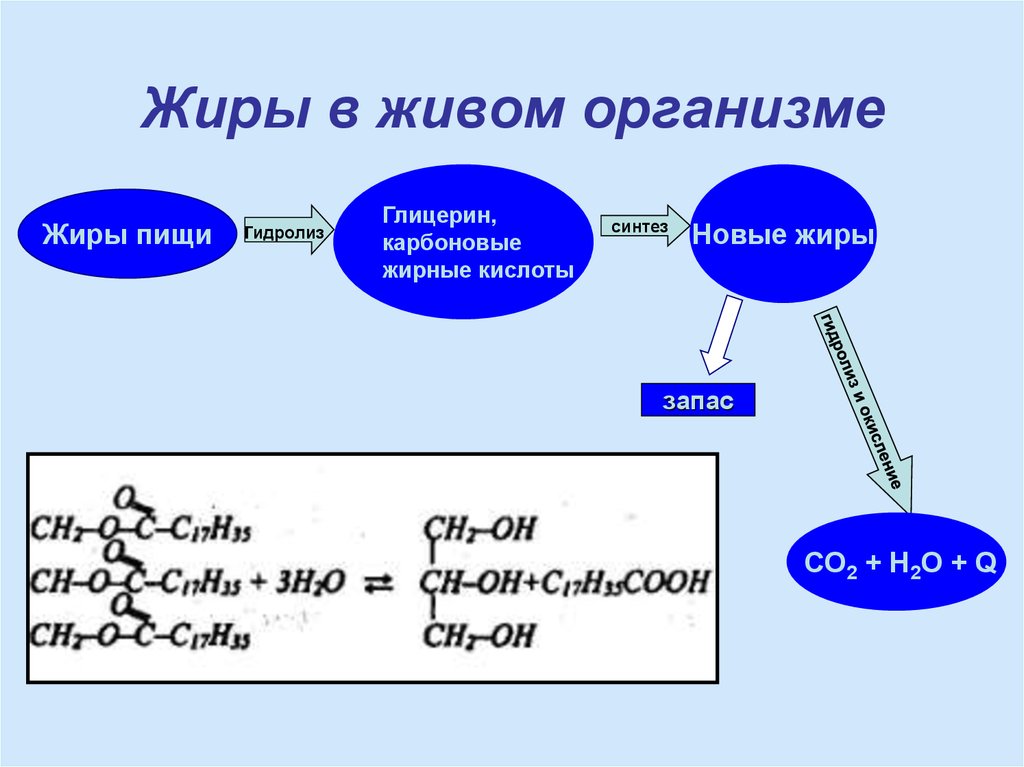
17. Жиры в живом организме
Жиры пищигидролиз
Глицерин,
карбоновые
жирные кислоты
синтез
Новые жиры
запас
СО2 + Н2О + Q
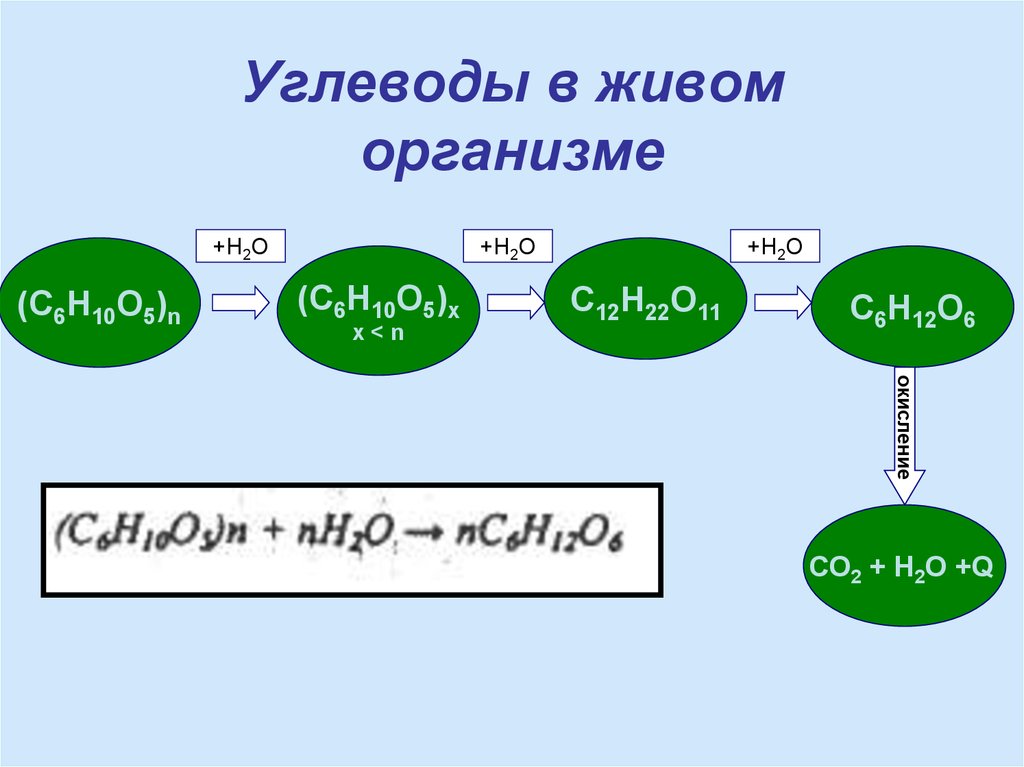
18. Углеводы в живом организме
+H2O(С6Н10О5)n
+H2O
(C6H10O5)x
x<n
+H2O
C12H22O11
C6H12O6
окисление
СО2 + Н2О +Q
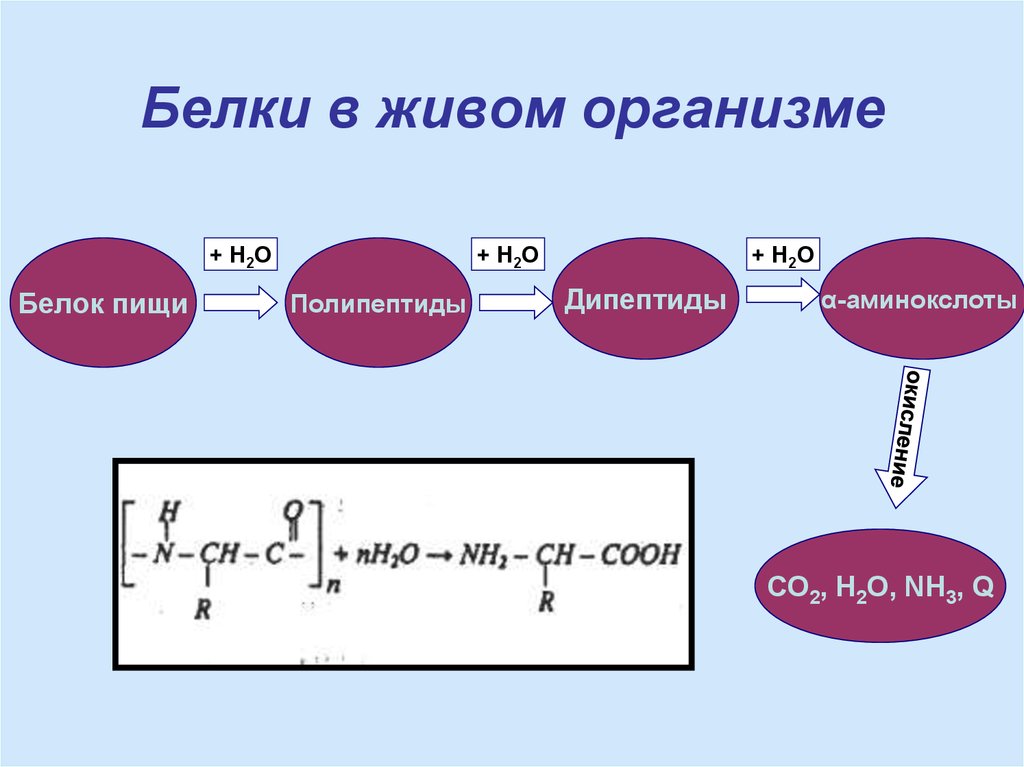
19. Белки в живом организме
+ Н2ОБелок пищи
+ Н2О
Полипептиды
+ Н2О
Дипептиды
α-аминокслоты
СО2, Н2О, NH3, Q
20.
• Выполнить задания по аналогии. Вначале следующего урока будет
проведена проверочная работа. Для
каждого варианта 2 вещества(одно из
задания и новое вещество)











 Биология
Биология








