Похожие презентации:
Технология получения полимеров
1. Технология получения полимеров
Д.х.н., профессор Ефимов ВалентинАлександрович
2.
Введение (цели и задачи курса)Данный курс содержит основные теоретические
представления
о
различных
типах
реакций
полимеризации.
В частности, в нем рассматриваются механизмы
синтеза основных полимеров, выпускаемых в мире,
также вопросы технологии их получения и их свойства.
а
3.
Практически всё, что окружает нас: одежда,обувь,
мебель,
продукты
питания,
книги,
строительные и отделочные материалы, да и мы
сами
-
содержит
или
состоит
из
высокомолекулярных соединений.
Кроме того, возникновение жизни на Земле
обусловлено
органических
появлением
полимерных
"первичном бульоне".
простейших
соединений
в
4.
Основные этапы формирования Химиивысокомолекулярных соединений как
самостоятельной науки
1831 г
Бонастр синтез стирола
(Франция)
1839 г
полистирол
1838 г
поливинилиден
хлорид
18261882
гг
Фарадей,
Вильямс
анализ состава
НК - мономер
изопрен
1932 г
С.В.
Лебедев
каучук СКБ
5.
1930-едоказано существование свободнорадикального и
ионного механизмов полимеризации
1930-е
Уо́ллес
Карозерс
1935 г
Уо́ллес
Карозерс
развиты представления о поликонденсации
(функциональность мономера, линейная и
трехмерная поликонденсация).
Нейлон-66
1938 г
Германия
1940-е
Г.
Штаудингер
19401960-е
1950-е
эмульсионная
полимеризация
R = (CH2)4, R' = (CH2)6
каучуки СКС, СКН
Полимеры рассматриваются как качественно
новый объект исследования химии и физики
Закономерности поликонденсации, создание теорий растворов
и статистической механики ВМС
Циглер и
Дж. Натта
комплексных металлоорганических
каталитических системы синтез на основе
диенов стереорегулярных полимеров
6.
1. Основные понятияПОЛИМЕРНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Тип вещества
Mn
Низкомолекулярные
< 500
Олигомеры
500....5000
Плейномеры
термин относится к олигомерам
с концевыми
функциональными группами
Высокомолекулярные
> 5000
соединения
Полимер – это вещество, состоящее из множества молекул большой
молекулярной массы одинаковой химической природы (макромолекул). Каждая
молекула полимера построена из многократно повторяющихся атомов или групп
атомов (называемых составными звеньями), соединенных между собой
химическими связями. Количество составных звеньев в молекулах полимеров
настолько велико, что формируется в целом комплекс свойств, который
практически не изменяется при добавлении или удалении одного или нескольких
составных звеньев.
7.
Классификация полимеров по происхождению- природные: натуральный каучук, целлюлоза,
крахмал, хитин, белки и др.
- синтетические полимеры (не существующие в
природе): полиэтилен, полипропилен, полистирол,
полибутадиен и др.
- искусственные, получаемые модификацией
природных полимеров: нитроцеллюлоза,
метилцеллюлоза, ацетатцеллюлоза и др.
8.
Классификация полимеров по областямприменения
- пластические массы - полимеры, у которых
температура стеклования выше температуры
эксплуатации (Тст>Тэксп): полистирол, ПВХ,
полиметилметакрилат, полиуретан,
полидициклопентадиен и др.
- каучуки (Тст<Ткомн): полибутадиен, полиизобутилен
и др.
- синтетические и искусственные волокна:
полиакрилонитрил, полиэтилентерефталат,
поликапролактам, найлон-66, вискоза и др.
- плёнки: лаки, краски, эмали
- биологические полимеры (биополимеры)
9.
Классификация полимеров по объемупроизводства
- крупнотоннажные,
- среднетоннажные,
- мелкотоннажные
Ассортимент мирового производства крупнотоннажных полимеров
10.
млн. тДинамика производства пластиков
Мир
Европа
11.
МИРОВОЕ ПОТРЕБЛЕНИЕ ПЛАСТИКОВ в 2007 – 2015 г.г.12.
Номенклатура полимеровСоставные части макромолекул
Составные звенья (СЗ) – это все возможные фрагменты, т.е.
атомы или группы атомов, которые входят в состав цепи и
многократно повторяются в ней
13.
Составные части макромолекулНаименьшее составное звено, повторением которого может
быть описано строение регулярного полимера, называется
составным повторяющимся звеном
14.
Номенклатура полимеровМономер
Структура
полимерной цепи
систематические
названия
ИЮПАК
СН2=СН2
[-СН2-СН2-]n
полиэтилен
полиметилен
полипропилен
поли(1-метил)этилен
поли(метилметакр
илат)
поли[1(метоксикарбонил)эти
лен]
полиизобутилен
поли(1,1диметилэтилен)
полистирол
поли(1-фенилэтилен)
CH 3
C
CH 2
CH 3
CH
CH 2
n
15.
МономерСтруктура
полимерной цепи
[-Sn(CH3)3-S=C=N-]n
систематические
названия
ИЮПАК
катенаполи[(триметилолово- -(тиоцианатоS:N)]
16.
2 Введение в теорию полимеризационныхпроцессов
Основные типы процесса синтеза полимеров
- цепная и ступенчатая полимеризация - макромолекулы
образуются за счет раскрытия ненасыщенных связей или циклов
- поликонденсация (иногда называемая ступенчатой
полимеризацией) - макромолекулы соединяются путем реакций
функциональных групп
Полимеризацией называется реакция, в ходе которой
молекулы мономера последовательно присоединяются к
активному центру, находящемуся на конце растущей цепи
Основные типы:
- радикальная полимеризация,
- ионная полимеризация,
- ионно-координационная полимеризация.
17.
Основные параметры процесса ПМ- термодинамические
- кинетические
Термодинамические параметры
Термодинамические параметры характеризуют возможность протекания
процесса в данных конкретных условиях. Они описывают энергетические
изменения, происходящие в системе в результате реакции полимеризации.
Термодинамическое условие протекания реакции полимеризации
G = H - T S < 0
G, H, S - изменение изобарно-изотермического потенциала (свободной энергии
Гиббса), энтальпии и энтропии системы при превращении мономера в полимер
Обычно при полимеризации мономеров с кратными связями H < 0 и S < 0,
т.е. существует некая предельная температура Tпр,, ниже которой возможен
процесс полимеризации: G < 0 при H > T S, или
H
T Tпр
S
18.
Тепловой эффект реакции полимеризации- H = Q = 2 ЕС-С - ЕС=С = 2 264 - 425 =103
кДж/моль
Тепловые эффекты реакций полимеризации некоторых мономеров
Мономер
Этилен
Винилацетат
Метилакрилат
Акрилонитрил
Изопрен
1,3-Бутадиен
Стирол
Хлоропрен
Метилметакрилат
Изобутилен
α-Метилстирол
Формальдегид
Ацетальдегид
Ацетон
Тепловой эффект полимеризации
−HΔ, кДж/моль
93,6
89,9
78,5
76,8
75,2
72,6
70,2
68,0
54,6 (55.3)
53,8
35,3
21.0
0
0
Тп, оС
351
397
197
61
120
-31
-173
19.
Для производных этилена 2 ЕС-С > ЕС=С, поэтому полимеризациятаких мономеров - процесс экзотермический.
При T > Tпр и G > 0 полимеризация термодинамически запрещена
и возможна лишь деполимеризация макромолекул.
При T = Tпр и G 0 в системе устанавливается полимеризационно-деполимеризационное равновесие:
kp
∼Mn* + М < ---- >∼Мn+1*
kd
kp[Mn*][Mр]=kd[Mn+1*],
где [Mp] - равновесная концентрация мономера.
20.
kр1
K равн
k d М р
G G RT ln K равн
где Gо = - RTlnKp - стандартный потенциал при Р = 1 атм и Т = 293 К
G H T S RT ln K равн
Величины G , H , S
- называются стандартными и относятся к
превращению чистого мономера (или одного моля мономера в растворе)
в аморфный полимер
ln М р
H S
RTпр
R
21.
Кинетические параметрыКинетические параметры позволяют описать скорость
реакции, а также определить характер энергетических
затрат, необходимых для преодоления энергетического
барьера реакции. Они определяются механизмом
реакции.
Способность мономеров к полимеризации зависит от
этих параметров. Если термодинамически реакция не
разрешена, то ее нельзя провести ни при каких
условиях. Однако, если термодинамика разрешает
проведение процесса, то это не значит, что он может
быть проведен в любых условиях. В этом случае
определяющую роль играют кинетические параметры.
22.
Длина цепиДля
цепных
реакций
существует
понятие
длины
кинетической
цепи,
равной
числу
химических
актов,
возбужденных одной исходной активной частицей, например
радикалом.
При
полимеризации
развитие
кинетической
цепи,
сопровождается ростом материальной цепи - макромолекулы.
В зависимости от механизма полимеризации длина
кинетической цепи может быть равна длине материальной цепи,
но может быть больше или меньше ее.
Полимеризация вызывается первичными активными
центрами, образующимися из специально вводимых соединений
- инициаторов при радикальной полимеризации,
- катализаторов при каталитической,
или в результате физического воздействия на систему.
23.
Элементарные стадии процесса полимеризацииПроцессы полимеризации могут протекать как в присутствии
инициаторов, так и под воздействием разнообразных
каталитических систем.
Различие между ними заключается в том, что распад
инициаторов приводит к образованию первичных активных
центров и они в виде осколков входят в полимерную цепь.
Катализаторы ускоряют процесс полимеризации (снижают
энергетический барьер реакции), но в состав цепи не входят.
Полимеризационные процессы в общем случае протекают в
три этапа:
- зарождение цепи,
- рост полимерной цепи,
-обрыв полимерной цепи
24.
Методы проведения процессаПолимеризация
мономера
может
проводиться
в
растворителе и в отсутствие растворителя. В последнем случая
процесс называется полимеризацией в массе (мономера) или
полимеризацией в блоке.
Если образующийся полимер растворим в мономере и
растворителе, то полимеризация протекает без разделения фаз и
называется гомогенной.
Если они несовместимы, то образующийся полимер
выделяется в отдельную фазу, и такая полимеризация называется
гетерофазной.
Внешним признаком гетерофазной полимеризации является
помутнение полимеризующейся системы.
25.
Радикальная полимеризацияРадикальная полимеризация – полимеризация, инициируемая
свободными радикалами, генерируемыми в реакционной среде.
В этом случае в качестве активного центра выступает
свободный радикал.
По радикальному механизму полимеризуется
мономеров, которые имеют двойную связь С=С.
C
C
большинство
26.
HR1H
C
C
R2H
R1
R1
C
C
R1
C
R2
R2
R2
H
R2 C
C
C
C
27.
Мономеры, способные вступать в реакциюрадикальной полимеризации
Активность
мономеров
в
процессе
полимеризации зависит от их природы и строения.
радикальной
Легко полимеризующимися производными этилена являются:
- мономеры с явной системой сопряженных двойных связей,
- мономеры, имеющие неявную систему сопряжения двойных
связей,
- мономеры, имеющие систему сопряжения двойной связи с
неподеленной парой электронов
СН2=СН---СН=СН2
1 2 3 4
28.
Введение заместителей в молекулу бутадиенаприводит к изменению ее активности в реакции
полимеризации
Введение малополярных заместителей (типа СН3)
в положение 2 приводит к повышению активности
мономера в радикальной полимеризации. Аналогичный
эффект наблюдается при введении малополярного
заместителя в положение 3. В то же время введение
таких заместителей в положение 1 или 4 приводит к
снижению скорости радикальной полимеризации.
Введение полярных заместителей даже в
положение 1 или 4 увеличивает скорость реакции.
Эффект
более
значителен,
если
полярный
заместитель вводится в положение 2 или 3.
29.
Относительные скорости полимеризацииразличных диеновых мономеров
Мономер
Формула
Относительная
скорость реакции
СН2=СН-СН=СН2
1,0
изопрен
СН2=С(СН3)-СН=СН2
1,25
пиперилен
СН2=СН-СН=СН-СН3
0,38
3,75
хлоропрен
СН2=С(СН3)С(СН3)=СН2
СН2=С(Сl)-СН=СН2
1-хлор-1,3-бутадиен
СН(Сl)=СН-СН=СН2
8,75
2,3-дихлор-1,3-бутадиен
СН2=С(Сl)-С(Сl)=СН2
2500
СН2=С(Br)-СH=СН2
1250
СН2=С(I)-СH=СН2
1875
1,3-бутадиен
2,3-диметил-1,3-бутадиен
2-бромбутадиен-1,3
2-иодбутадиен-1,3
875
30.
Мономеры с неявной системой сопряжения двойных связейстирол,
-метилстирол,
нитрил акривой кислоты, CH2=CH-C≡N (НАК),
акролеин СН2=СН-С(=О)Н
Мономеры, имеющие сопряжение двойной связи с неподеленной
парой электронов
хлористый винил
СН2=СНСl
СН2=СН
:Сl:
хлористый винилен
Н2=С(Cl)2
метилвиниловый эфир СН2=СН-О-СН3
31.
Механизм радикальной полимеризацииРадикальная полимеризация инициируется свободными
радикалами - активными частицами, имеющими неспаренный
электрон.
Свободные радикалы могут возникнуть в результате действия
на систему физических факторов, а также чисто химическим путем
- при гомолитическом распаде соединений с относительно
невысокими энергиями связи или в результате протекания
окислительно-восстановительных процессов.
Радикальная полимеризация является цепным процессом. И
как всякий цепной процесс протекает через три этапа.
Элементарные реакции радикальной полимеризации
Инициирование
Рост цепи
Обрыв цепи
Передача цепи
Ингибирование
32.
ИнициированиеИнициирование - образование
свободных радикалов
активных
центров
в
виде
Свободный радикал - нейтральная, активная частица, имеющая 1
или несколько неспаренных электронов
H
RH2C.
R:C.
H
Возможные пути инициирования
Свободные радикалы могут возникнуть в результате действия
на систему физических факторов, а также чисто химическим путем
- при гомолитическом распаде соединений (инициаторов) с
относительно невысокими энергиями связи или в результате
протекания окислительно-восстановительных процессов.
33.
Гомолитический распад активируется под действиемтепла, света, различных активных излучений и других
энергетических воздействий.
Для того, что бы молекула перешла в активное состояние,
необходимо, чтобы она приобрела определенное количество
избыточной энергии. Избыточная энергия, необходимая для
преодоления энергетического барьера реакции называется
энергией активации.
Чем выше энергия активации, тем меньшее число
молекул в данных условиях являются активными.
34.
Для перевода молекул в активное состояние существуютследующие методы
1 Инициирование под действием физических факторов:
- термическое инициирование,
- фотохимическое инициирование,
- радиационное инициирование
2. Химическое инициирование - под воздействием
специальных веществ – инициаторов.
Инициаторы способны распадаться на свободные радикалы:
- под действием тепла,
- в присутствии окислительно-восстановительных систем.
35.
Инициирование под действием физических факторовТермическое инициирование
Мономолекулярный механизм инициирования Штаудингера
Реакция
Тепловой эффект
СН2=СНR CН2-С НR
Образование С-С
Образование С=С
Образование -связи
Энергия
затрачивается
Величина Т.Э.,
ккал/моль
- 61,2
79,3
140,5
140,5-79,3=61,2
Бимолекулярный механизм инициирования
Реакция
СН2=СНR + СН2=СНR
С Н(R)-CН2-CН2-С Н(R)
Разрыв двух -связей
Образование С-С
Образование из двух связей одной С-С
Тепловой
эффект
Энергия
затрачивается
затрачивается
выделяется
затрачивается
Величина Т.Э.,
ккал/моль
- 43,1
122,4
79,3
122,4 -79,3=43,1
36.
Экспериментально установлено, что растущая полимернаяцепь
монорадикал,
поскольку
длинные
гибкие
макромолекулы делают возможным столкновение концов
макромолекулы и их взаимодействие.
Доказано, что бирадикал на начальных стадиях процесса
превращается в монорадикал путем внутримолекулярного
переноса цепи:
37.
Фотохимическое инициированиеИнициирование связано с поглощением молекулой мономера кванта
световой энергии, энергия которого определяется в виде
Е = h
При действии УФ-света на мономера могут образоваться свободные
радикалы:
h
1
M M
R R
2
Если мономер не поглощает свет в используемой области, то
необходимо использование фотосенсибилизатор (соединение с развитой
системой со-пряжения, например, бензофенон С6Н5СОС6Н5).
В некоторых случаях добавка может действовать как фотоинициатор
(сама распадается на радикалы, например, перекиси).
h
Z Z
Z M
Z M
R1 R 2
Скорость фотоинициируемой полимеризации пропорциональна корню
квадратному из интенсивности облучения и концентрации фотосенсибилизатора.
К процессам радикальной полимеризации на свету способны стирол,
ММАК, МВК, МАК.
38.
Радиационно-химическое инициированиеПротекает под воздействием ионизирующих излучений ( , , излучение). При этом образуются активные частицы либо в виде
свободных электронов, либо в виде ионов. Обычно при умеренных
температурах образуются свободные радикалы, при низких – ионы.
Молекулы мономера при действии ускоренных электронов или излучения ионизируются, а затем дают радикалы:
,e
M M e
M
R1 R 2
M
R1 R 2
R 2 e
R 2
Энергия возбуждения может превысить энергию разрыва химической
связи, в результате молекула распадается на радикалы. Таким образом
можно инициировать привитую полимеризацию.
Термический,
фотои
радиационно-химический
способы
инициирования хотя и обладают рядом преимуществ, сопровождаются
различными побочными реакциями (разветвления, деструкции и т.д.),
поэтому чаще используют химическое инициирование.
39.
Химическое инициированиеХимическое инициирование является наиболее распространенным
способом перевода молекул в активное состояние. Оно протекает в
присутствии специально вводимых веществ - инициаторов, которые могут
распадаться с образованием свободных радикалов двумя способами:
- под действием тепла,
- в присутствии окислительно-восстановительных систем.
Инициаторы должны удовлетворять следующим требованиям:
- легкая доступность,
- дешевизна,
- стабильность при комнатной температуре,
- легкий распад при сравнительно невысоких (до 150 оС) температурах с
заметной скоростью на свободные радикалы.
Энергия разрыва связей
Связь
О―О
С―С
С―О
С=О
Энергия разрыва, кДж/моль
146
345
357
741
40.
В качестве инициаторов используются следующие классы соединений:пероксиды ROOR,
гидроперекиси ROOН,
азо- (R1-N=N-R2) и диазосоединения (RR’CN2),
ди- и полисульфиды,
металлорганические соединения.
Природа образующихся свободных радикалов
применяемого инициатора и механизма его разложения.
зависит
от
типа
Наиболее часто применяемые инициатора радикальной полимеризации
Название
инициатора
Структурная формула
Основные
характеристики
Пероксид бензоила
(ПБ)
1/2 в бензоле:
при 50 °С – 227 ч,
при 80 °С – 5,65 ч
Пероксид
дитретичного
бутила
1/2 в бензоле:
при 110 °С – 65 ч,
при 130 °С – 6,4 ч,
при 150 °С – 0,8 ч
41.
30…50 °С –эффективная
температура
разложения
Пероксодисульфат
(персульфат)
калия (аммония)
Третбутилпербензоат
O
CH3
C
O
O
C
CH3
CH3
Пероксид
водорода
1/2 в бензоле:
при 90 °С – 70 ч,
при 110 °С – 6,0 ч,
при 130 °С – 0,7 ч
H-O-O-H
Гидропероксид
третичного бутила
CH3
H3C
C
O
O
H
CH3
Гидропероксид
изопропилбензола
(гипериз)
130-140 оС –
эффективная
температура
разложения
42.
Гидропероксидп-ментана
Гидропероксид
пинана (гипин)
130-140 оС –
эффективная
температура
разложения
Динитрил
азобис-изомасляной
кислоты
(ДИНИЗ, ДАК)
1/2 в бензоле:
при 50 °С – 75,9 ч,
при 80 °С – 1,28 ч
Диазоаминобенз
ол
120…130 °С
эффективная
температура
разложения
N
H
N
N
–
43.
1/ 2Период полураспада (τ1/2):
ln 2 0,693
ki
ki
Распад пероксида бензоила
Распад третичных гидропероксидов
Гидропероксид третичного бутила может распадаться, давая
органический радикал и кетон:
H3C
C
CH3
CH3
CH3
CH3
O
O
H
H3C
C
CH3
O
+
OH
C
CH3
O
+ CH3
44.
Распад динитрила азо(бис)изомасляной кислоты0
(CH 3)2-C -N= N -C -(CH 3)2
CN
50-70 C
2(CH 3)2C . + N 2
CN
Распад диазобензола
CN
60-75 оС
N2 + (С6Н5) + (С6Н5NH )
С6Н5-N=N-NH-С6Н5
Эффективность инициирования (f) - отношение количества осколков
инициатора, вошедших в состав макромолекулы, к общему количеству
свободных радикалов, образовавшихся в данных условиях.
Инициатор
Тприменения, С
120-140
Еин ,
кДж/моль
166.7
1.00 (стирол)
Пероксид бензоила
60-90
130.2
0.83 (стирол)
ДИНИЗ
Персульфат калия
40-70
25-30
123.9
Пероксид третбутила
f
0.5-0.7
1,0
45.
Эффект клетки (эффект Франко-Рабиновича)Уменьшение количества свободных радикалов в жидкой фазе по
сравнению с газовой фазой.
При распаде инициатора в газовой фазе свободные радикалы разлетаются
на расстояние свободного пробега.
В жидкой фазе вследствие высокой вязкости среды скорость разбегания
значительно ниже.
Свободные радикалы существуют некоторое время в окружении молекул
мономера, растворителя (как бы находятся в клетке) и этого времени
достаточно для того, что бы прошел процесс их рекомбинации.
Разделение радикальной пары протекает:
- за счет диффузии,
- за счет взаимодействия свободного радикала с молекулой мономера (или
с молекулой среды).
1.
ROOR
[RO …О R]
2. Если радикалы не успевают выйти из клетки, то происходит обратный
процесс рекомбинации за счет обратимости процесса
[RO …O R]
ROOR
46.
3. Выход из клетки:- за счет диффузии
[RO …O R]
RO + O R
- за счет взаимодействия с молекулой мономера или растворителя
(способ эстафетной передачи)
[RO …O R] + М1
ROМ1
+
O R
Полимеризация в массе. Увеличение выхода полимера сопровождается
ростом вязкости системы, что затрудняет выход радикалов из клетки. При этом
выход из клетки происходит за счет взаимодействия радикала с молекулой
полимера, т.е. происходит передача цепи на полимер. Поэтому при
полимеризации в массе обычно происходит образование разветвленных и
сшитых полимеров.
Основной недостаток большинства химических инициаторов заключается
в необходимости проведения процесса полимеризации при повышенных
температурах. Даже наиболее активные инициаторы промышленного типа –
персульфаты калия и аммония – позволяют проводить процесс при
температуре около 40…50 °С (таблица 7). Между тем при снижении
температуры полимеризации существенно улучшаются технические свойства
многих полимеров.
47.
Окислительно-восстановительное инициирование1 При введении в реакционную систему, наряду с основным инициатором
– окислителем, достаточно эффективных восстановителей свободные
радикалы образуются при более низкой температуре. Таким образом,
окислительно-восстановительное
инициирование
свободно
от
вышеуказанного недостатка химического инициирования.
2 В присутствии окислительно-восстановительных систем (ОВС) эффект
клетки отсутствует, поскольку распад инициатора протекает с образованием
одного радикала.
3 ОВС обладают более низкой энергией активации образования радикалов
(~40 кДж/моль) в сравнении с обычными инициаторами (~120…160 кДж/моль).
Поэтому ОВС можно применять в широком интервале температур.
Окислительно-восстановительные системы делятся на три типа:
1. Системы, приводящие к образованию одиночного радикала.
2. Системы, приводящие к образованию 2 R (Гидрохинон-Сульфидная).
3. Системы, приводящие к образованию промежуточных соединений,
которые быстро распадаются на свободные радикалы.
48.
Системы, приводящие к образованию одиночного радикала- Инициирующая система пероксид водорода – соль двухвалентного железа:
H-O-O-H + Fe2+ НO + HO¯ + Fе3+
- Инициирующие системы на основе органических окислительновосстановительных систем (пероксид бензоила – диметиланилин):
O
C
O
O
O
CH3
C
+
N
CH3
O
C
CH3
O
+
N
CH3
+
O
O
O
-
49.
- Железо-трилон-ронгалитная система.Обратимые окислительно-восстановительные системы нашли широкое
применение в процессах синтеза каучуков по технологии низкотемпературной
эмульсионной полимеризации.
Схема работы обратимой окислительно-восстановительной системы :
RO + M
Окислитель Восстановитель
(основной)
ROOH + Fe2+
RO
в комплексе
с трилоном Б
¯
+ Fe3+ +
OH
ROM полимеризация
при Т=5-10 оС
в комплексе
с трилоном Б
Ронгалит
дополнительный восстановитель
ТРИЛОН Б - торговое название (фирма БАСФ) динатриевой соли
этилендиаминтетрауксусной кислоты
O
O
OH
N
HO
ONa
N
O
O
ONa
50.
В данном рецепте Fe2+ может использоваться в виде пирофосфатных илиэтилендиаминотетраацетатных комплексов.
Структура комплекса с динатриевой солью этилендиаминтетрауксусной
кислоты :
O
Na
O
C
O
Na
O
C
O
C
H2
H2C
N
C
H2
C
O
Fe
H2C
C
H2
N
C
H2
+ H 2O
C
O
Наличие координационных связей между атомами железа и азота приводит к
снижению степени диссоциации соли, что обеспечивает постепенное и
равномерное расходование ионов Fe2+.
В качестве дополнительного восстановителя применяют ронгалит, при
окислении которого ионами Fe3+ происходит регенерация ионов Fe2+.
O
2Fe3+ + 2HO¯ + HO
C
H2
S
O
O
2+
Na 2Fe +
HO
C
H2
S
O
Na
+ H2O
O
ронгалит (натриевая соль формальдегидсульфоксиловой кислоты)
51.
Стадия роста полимерной цепиПервичные свободные радикалы, образовавшиеся по любому из
выше перечисленных способов, далее взаимодействуют с молекулой
мономера. В результате образуется новый свободный радикал, который
длиннее первичного на одно мономерное звено. Далее этот процесс
повторяется многократно. Новые свободные радикалы имеют ту же
природу, что и предыдущие.
R + M1
R M1 + M2
R M1
R M1M2
…………………………………
R Mn-1 + Mn
R Mn
Стадия роста цепи характеризуется малой энергией активации
(12 40 кДж/моль) и большой скоростью реакции (для большинства
мономеров kр = 102 104 л/моль с).
Константы скорости и энергия активации роста цепи зависят от
природы мономера и параметров реакционной среды.
52.
В ходе реакции происходит выделение тепла.Разрыв
CH
R + H2C
X
+
R
-
C
H2
CH
+ 75,8 кДж/моль
X
Образование = 332,3 кДж/моль
Разрыв -связи = - 256,5 ккал/моль
332,3 - 256,5 = 75,8 ккал/моль
При радикальной полимеризации обычно образуются полимеры,
имеющие атактическую структуру.
В этом процессе практически нельзя получить
стереорегулярные полимеры.
Атактические полимеры - это полимеры, содержащие звенья всех
структурных видов, возможные для данного мономера.
Например, диены могут входить в макромолекулу как звенья в
положении 1,4 и 1,2 (1.3-бутадиен). Для изопрена и хлоропрена
возможно так же присоединение в положение 3,4. При этом
присоединение мономерных звеньев может идти различным путем:
голова к голове, голова к хвосту, хвост к хвосту. При радикальной
полимеризации получаются статистические полимеры.
53.
Стадия обрыва полимерной цепиВозможные пути обрыва цепи
1. Рекомбинация (Основной)
Взаимодействие растущего полимерного радикала с любым другим
свободным радикалом, присутствующим в системе. В этом случае
происходит спаривание неспаренных электронов.
H
H
H2C
CH + CH
CH2
HC
C
C
CH
2
X
X
2
X
X
неактивная полимерная
цепь (основной случай)
2. Диспропорционирование
Реакция перераспределения водорода - заключается в передаче атома
водорода от одного свободного радикала к другому свободному
радикалу. В результате образуется две неактивные полимерные цепи, из
которых одна имеет на конце двойную связь.
H2C
CH
X
+
CH
X
CH2
HC
CH
X
+
H2C
X
CH2
54.
3. Столкновении свободных полимерных радикалов спримесями, находящимися в реакционной среде.
В результате образуется новый свободный радикал, который
является малоактивным.
RM n + X
RMnX
4. Реакции передачи или переноса цепи
RM n
+ XН
RMnН + X
агент
передачи цепи
X + М1
XМ 1 + М2
новый активный
центр
XМ 1
XМ1М 2
Таким образом, в присутствии агента передачи цепи происходит
образование нового свободного радикала.
55.
При этом могут возникнуть следующие ситуации:а) активность нового свободного радикала может быть равна
активности предшествующего радикала. В этом случае скорость
процесса радикальной полимеризации не будет изменяться, а будет
происходить только снижение ММ.
б) активность нового свободного радикала может быть меньше
активности предшествующего радикала. При этом наблюдается
снижение как скорости, так и ММ.
в) активность нового свободного радикала может быть значительно
меньше активности предшествующего радикала. В этом случае агент
передачи цепи может выступать замедлителем или ингибитором
процесса радикальной полимеризации.
Агентами передачи цепи могут выступать:
растворитель,
мономеры,
специальные агенты передачи цепи,
инициатор,
полимер,
другие примеси.
56.
Способность к участию в передаче цепи при полимеризациихарактеризуют константами передачи цепи на мономер, на
растворитель, на ингибитор и т.д.:
ks
kM
kи
CS , CM
, Cи
kp
kp
kp
Передача цепи на растворитель
Растворитель
ММ
С6Н6
90.000
Вода + спирт
Ацетон
166.000
75.000
Эффективными агентами передачи цепи при радикальной
полимеризации являются хлорированные углеводороды: СCl4, CHCl3.
Мn + CCl4
C Cl3 + М1
МnCl + C Cl3
М1 CCl3
Наиболее высокое значения СS = 9 10-3 имеет СCl4. Наиболее инертным
растворителем является бензол СS=10-5
57.
Передача цепи на мономерk
R CH 2 CH OCOCH 3
M
RH CH 2 CH OCO C H 2
Для большинства мономеров значение См невелико (0.1 5) 10-4.
Однако при полимеризации мономеров, содержащих подвижные атомы
водорода, значение См существенно увеличивается, например для винилацетата
См = 2 10-3, а для аллиловых мономеров аномально велика (один акт передачи
цепи на 4 10 актов присоединения мономера, поэтому их скорость
полимеризации низка и получаются низкомолекулярные продукты).
Процессы, в результате которых получаются низкомолекулярные полимеры,
называются процессами теломеризации.
Передача цепи на агент передачи цепи
Чаще всего в процессах радикальной полимеризации применяют
специальные агенты передачи цепи, добавка которых в рецепт (в небольших
количествах) приводит к резкому снижению ММ. Такие вещества называют
регуляторами длины молекулярной цепи. В качестве таких регуляторов
применяют
тр-ДДМ (тр-С12Н25SH),
н-BuSH (СS=2.2),
58.
Бис(изопропилксантоген)дисульфид, дипроксидCBr4 (СS=1.4)
M n + RSН
RS + M1
M n + RS―SR
MnН + RS
RS M1
MnRS + RS
Дипроксид, как регулятор ММ, является более активным, чем
трет-ДДМ. В то же время при проведении процесса радикальной
полимеризации Дипроксид быстро расходуется, и при конверсии
порядка 40 % наблюдается сильное увеличение ММ.
Трет-ДДМ расходуется постепенно и обычно сохраняется до
конца процесса полимеризации. Как следствие, ММ полимера при
увеличении его выхода растет в меньшей степени. Поэтому трет-ДДМ
используют чаще, а при применении Дипроксида используют
дробную подачу (в два приема).
59.
Передача цепи на инициаторРазличные инициаторы обладают различной константой передачи
цепи.
Азонитрилы не участвуют в реакции передачи цепи и для них
константа равна 0.
Многие пероксиды характеризуются весьма значительными
константами передачи цепи.
Среди инициаторов наиболее сильными агентами передачи цепи
являются гидропероксидные соединения.
M n + RООН
MnН + RОО
RОО + M1
RОО M1
При получении низкомолекулярных полимеров иногда пользуются
этим методом и увеличивают количество инициатора в десятки раз
(обычно в 5).
60.
Передача цепи на полимерВ том случае, когда мономера в реакционной среде немного, обычно
происходит процесс передачи цепи на полимер. При этом образуется
полимерный радикал и образуются разветвленные и перекрещенные цепи.
1/Pn = 1/Po + ks[S]/[M]
где Po - среднечисловая степень полимеризации полимера, полученного в
отсутствие агента передачи цепи,
Pn - среднечисловая степень полимеризации полимера, полученного в
присутствии агента передачи цепи,
ks - константа передачи цепи,
[S] - концентрация агента передачи цепи,
[M] - концентрация мономера.
Определение ks
Синтезируют набор полимеров, полученных при различных значениях [S].
Определяют Pn для всех полимеров и строят зависимость
1/Pn = f([S]/[M])
61.
1/Pntg = ks
1/Pо
[S]/[M]
ks оценивают для полимеров, полученных при низких степенях
превращения мономера. В этом случае концентрация полимера низка и
ею пренебрегают.
62.
Реакции замедления и ингибирования процесса радикальнойполимеризации
В зависимости от того, какое влияние оказывает введенное вещество на
скорость процесса, различают замедлители или собственно ингибиторы
процесса радикальной полимеризации.
1 - кинетическая кривая, полученная при проведении процесса в отсутствие
ингибиторов и замедлителей,
2 - хинон = 0,005 %, задержка 2 часа,
3 - хинон = 0,01 %, задержка 4 часа.
4 - кинетическая кривая, полученная при проведении процесса в присутствии
замедлителя,
5 - кинетическая кривая, полученная при проведении процесса в присутствии
замедлителя и ингибитора.
63.
Время задержки процесса полимеризации называют индукционнымпериодом. Индукционный период зависит от количества введенного
ингибитора. И является периодом времени, в течение которого он
расходуется.
O
O
OH
NH2
O
O
OH
NH2
Хинон
(бензохинон)
нафтахинон
гидрохинон
п-фенилендиамин
Гидрохинон
и
п-фенилендиамин
ингибируют
процесс
полимеризации лишь в присутствии кислорода, поскольку истинными
ингибиторами являются соединения, имеющие хиноидную структуру
В качестве замедлителей могут использоваться О2, I2, Нафтам-2 (Nфенил-2-нафталамин) и др. Механизм действия замедлителей и
ингибиторов одинаков, разница только в силе их действия.
64.
Механизм действия замедлителей и ингибиторовВажным фактором является то обстоятельство, что многие
ингибиторы проявляют ингибирующее действие лишь в присутствии О2.
Истинные ингибиторы - соединения, имеющие хиноидную структуру.
При этом протекают следующие реакции
NH2
O
OH
1/2 O2
1/2 O2
- H2O
- H2O
O
OH
O
OR
+ R
O
NH
O
NH2
NH
п-хинондиимин
65.
Образующийся хинон взаимодействует со свободными радикалами,давая семихиноидный радикал (бензоидная структура).
Переход в бензоидную структуру является наиболее энергетически
выгодным процессом, поскольку он идет с выделением тепла.
Семихиноидный радикал ― стабильный радикал, т.к. неспаренный
электрон радикала находится в сопряжении с -электронами
бензольного кольца. Этот радикал неспособен реагировать с
мономерами. Но он способен реагировать со свободными радикалами.
OR
OR
+ R
O
OR
Константа Си = 518 для бензохинона при полимеризации стирола
при 50 С.
Хиноны являются своеобразными ловушками для свободных
радикалов, поскольку выводят свободные радикалы из зоны реакции.
Однако сами при этом так же расходуются. В связи с этим
индукционный период пропорционален количеству ингибитора.
66.
Замедлители по своему действию отличаются от ингибиторов тем,что скорость их взаимодействия со свободными радикалами значительно
меньше, т.е. они выводят из сферы реакции только часть свободных
радикалов. Оставшаяся малая часть продолжает реагировать с мономером.
Общая скорость реакции в этом случае уменьшается, а замедление зависит
от соотношения скоростей двух реакций: полимеризации и замедления.
N
H
+
RMn
N-Фенил-β-нафтиламин
(Неозон Д)
N
+ RMnH
67.
Роль кислорода в процессах радикальнойполимеризации
Кислород может выполнять две роли:
• При Т 50 оС кислород выступает как инициатор процесса
радикальной полимеризации.
• При Т 50 оС кислород выступает ингибитором процесса
радикальной полимеризации
Примеры
1 Полимеризация ММА в вакууме при 100 оС
Метилметакрилат (ММА) — Сложный метиловый эфир
метакриловой кислоты
2 Полимеризация этилена. Т =200 оС, Р=150МПа.
.
R
+ O2
.
ROO + R.
.
ROO
ROOR
68.
Реакции разветвления и перекрещивания цепейРеакции разветвления и перекрещивания цепей обычно называют
вторичными (побочными) реакциями.
Образующиеся структуры значительно ухудшают свойства
получаемых полимеров.
Такие полимеры плохо обрабатываются, становятся
нерастворимыми.
В связи с этим при проведении радикальной полимеризации
необходимо стремиться к получению полимеров линейной структуры.
Поэтому радикальную полимеризацию обычно прекращают при
выходе полимера 65-70 % (для каучуков). Замечено, что с понижением
температуры реакции вероятность побочных реакций значительно
снижается.
Это связано с тем, что энергия активации побочных реакций
значительно выше, чем энергия активации реакции роста полимерных
цепей в линейном направлении.
Следовательно, чем ниже температура, тем больше вероятность
получения полимеров линейной структуры.
69.
Некоторые особенности полимеризации диеновПри полимеризации диенов в зависимости от условий проведения
процесса могут получаться полимеры различных форм, а именно:
• димеры циклического строения (Т 50 оС),
• линейные и разветвленные димеры и тримеры (Т 50 оС),
• сшитые, трехмерные полимеры (Т 50 оС).
Данное обстоятельство связано с различием энергий активации
процессов димеризации и полимеризации (первая выше второй).
Димеры диенов (дивинила) имеют циклическое строение
+
Димеры дивинила такого строения неспособны к радикальной
полимеризации, поэтому нежелательны.
70.
Аутополимеризация(самопроизвольная полимеризация)
Аутополимеризация - процесс самопроизвольной полимеризации,
протекающий без специального внешнего воздействия. При этом
образуются аутополимеры: губчатые полимеры, омега-полмеры.
Такое явление обычно наблюдается при хранении мономеров, не
заправленных ингибиторами, и в присутствии следов кислорода.
Такие полимеры не растворяются и даже не набухают. Они не
вулканизуются и технически не ценны.
Кроме того, образование таких полимеров опасно, т.к. даже
небольшие количества такого полимера быстро увеличиваются в объеме.
Они могут образовываться в аппаратах или арматуре, и их образование
представляет большую опасность, так как может привести к забивке или
разрыву стенок сосудов и трубопроводов.
Для ингибиторов полимеризации Си 1 (предотвращают
самопроизвольную полимеризацию мономера при хранении).
Ингибиторы могут присоединяться к радикалу с образованием
стабильного радикала, неспособного продолжать кинетическую цепь,
или насыщенного соединения (если ингибитор - стабильный радикал).
71.
Передача цепи на полимерКроме всего прочего возможна передача цепи на полимер, особенно
при полимеризации до глубоких степеней превращения (так получают
промышленные полимеры в блоке).
При этом увеличивается разветвленность макромолекул:
1
C p 1 ln(1 x)
x
где - плотность ветвления (число ветвлений на одно
элементарное звено), Ср - константа передачи на полимер, х - степень
конверсии.
Для уменьшения влияния ветвления (возможны сшивки!) вводят
регуляторы или проводят процесс полимеризации гетерофазно.
72.
Гель-эффект (эффект Тромсдорфа)Время жизни растущих макрорадикалов мало (10-6-10-9 с), однако
при снижении температуры и увеличении вязкости системы оно
возрастает вследствие уменьшения подвижности макрорадикалов и
снижения скорости обрыва цепи, поскольку при обрыве цепи акту
обрыва предшествует диффузия одного клубка - макрорадикала в
другой.
Например, при полимеризации в массе при 15-25% превращения
мономера в полимер вязкость увеличивается в 10 000 - 100 000 раз.
С повышением вязкости системы диффузия клубка в клубок
замедляется и, начиная с некоторой глубины полимеризации,
лимитирует обрыв цепи. Вследствие этого число активных центров
растет и скорость полимеризации увеличивается.
Ускорение полимеризации на глубоких стадиях, вызванное
увеличением вязкости системы и диффузионными затруднениями стадии
обрыва цепи и носит название Гель-эффект или эффекта Тромсдорфа.
Гель-эффект уширяет ММР до коэффициента полидисперсности 510. Часто справедливо равенство kо =const, т.е. чем выше вязкость, тем
меньше вероятность обрыва цепи.
73.
Кинетический анализ реакции инициированнойрадикальной полимеризации
На кинетике реакции полимеризации и свойствах образующегося
полимера отражается
множество факторов: вязкость среды
(иммобилизация растущих цепей из-за гель-эффекта или образовании
нерастворимого полимера), температура, давление, активность
мономера, способ инициирования, способ проведения полимеризации,
наличие примесей и т.д.
Общее кинетическое уравнение полимеризации может быть
выведено без учета реакций передачи цепи. Если допустить, что
активность макрорадикала не зависит от его длины и мономер
расходуется только на стадиях инициирования и роста цепи, то скорость
полимеризации (или скорость расходования мономера) можно описать
уравнением:
dM
и р
d
Где и , р - скорости инициирования и роста.
74.
dMр k р R M
d
Концентрацию радикалов, которую трудно измерить, можно
исключить из рассмотрения, используя принцип Боденштейна или
принцип стационарности. Согласно этому принципу, концентрация
свободных радикалов является постоянной величиной, т.е.
d R
0
d
2
и о k и I k о R
Тогда для стационарного участка процесса полимеризации:
kи
k p
kо
0. 5
I 0.5 M
Из уравнения следует, что скорость полимеризации увеличится в
2 раз при удвоении скорости инициирования, это объясняется
бимолекулярностью реакций обрыва. Пропорциональность скорости
полимеризации от концентрации мономера выполняется не всегда и,
как правило, степень больше 1, что связано с участием мономера на
стадии инициирования и в реакциях передачи цепи.
75.
Среднечисленная степень полимеризацииДлина кинетической цепи (т.е. количество присоединившихся
молекул мономера, приходящееся на один образовавшийся активный
центр) находяти из соотношения скорости полимеризации к скорости
инициирования (или обрыва на стационарном участке):
k р M
0. 5
и
k k
0. 5
о
I
0. 5
Средняя степень полимеризации при рекомбинационном обрыве цепи:
p 2
при диспропорционировании:
p
76.
Во многих случаях встречаются оба эти два варианта обрыва цепи:p
k р M
1 1 k 0.5 k 0.5 I 0.5
о
и
2
где - доля макрорадикалов, обрывающих цепь по механизму
диспропорционирования, а (1- ) - доля макрорадикалов, гибнущих при
рекомбинации.
Т.е. увеличение концентрации радикалов и, следовательно, скорости
радикальной полимеризации приводит к образованию макромолекул
меньшей молекулярной массы.
Длина кинетической цепи при Т=const определяется природой
мономера и не зависит от способа инициирования, а также от природы
инициатора.
77.
С учетом реакций передачи цепи:p
где
р
о пе р
(
k
M
k
S
)
R
пер M
S
Выражая концентрацию радикала через скорость полимеризации
р и используя константы передачи на мономер и растворитель,
получаем:
S
1 1 1 k о р
2
2 CM CS
M
p 2 kр
M
Если проводить полимеризацию в присутствии разных количеств
инициатора и определить значения p и р , то, используя (как правило
линейную) зависимость
р
1
, можно определить значения
2
p M
константы СМ, а также отношение констант обрыва и роста.
78.
Например, отношениеkр
k
0. 5
о
определяющее скорость полимеризации
различных мономеров при [M]=const, [I]=const при 60 С для
полимеризующегося с высокой скоростью винилацетата равна 0.33, а для
стирола 0.022.
Молекулярно-массовое распределение
При радикальной полимеризации ММР обычно получается
широким, а конкретный тип распределения в условиях гомогенного
процесса определяется механизмом ограничения растущих цепей:
в случае диспропорционирования и (или) передачи Mw /Mn 2
(распределение ФЛОРИ), а при обрыве рекомбинацией Mw /Mn 1.5
(распределение Шульца).
При параллельном осуществлении обеих реакций бимолекулярного
обрыва - это отношение имеет промежуточное значение.
При полимеризации до глубоких степеней превращения мономеров
или при образовании нерастворимого полимера наблюдается
значительное уширение ММР, вплоть до появления полимодального
ММР.
79.
Влияние различных факторовна процесс радикальной полимеризации
Влияние температуры
Скорость реакции радикальной полимеризации увеличивается с
ростом температуры.
Температурный коэффициент большинства химических реакций
близок к 2, т.е. применимо правило Вант-Гоффа:
"повышение температуры на 10о приводит к увеличению скорости
реакции приблизительно в два раза".
(t
-t
)/10
2
1
k
kT2 / T1 = 2
где kТ2 и kТ1 - константы скорости реакции при температурах t2-t1,
соответственно.
Следствие: чем больше энергия активации, тем большее влияние
оказывает изменение температуры на скорость радикальной
полимеризации.
80.
Энергии активации и константы скорости ростацепи для некоторых мономеров
Мономер
винилхлорид
метилметакрилат
стирол
дивинил
изопрен
Е,
кДж/моль
15,6
19,8
30,4
39,1
41,2
30 оС
6,8
0,35
0,049
0,025
0,011
k, м3/моль с
60 оС
увеличение
12,3
1,8
0,7
2
0,145
2,95
0,1
4
0,05
4,54
Увеличение скорости полимеризации связано не только с ростом k2,
но и с образованием большего количества активных центров
V2 = k2 [M n] [M]
Но одновременно с увеличением скорости расходования мономера
увеличивается и скорость обрыва цепи.
V3 = k3 [M n]2
Учитывая значения показателя степени у [M n], скорость обрыва
цепи увеличивается во много раз больше, чем скорость роста
полимерной цепи. Следствие: при повышении температуры
наблюдается значительное снижение ММ полимера
81.
Влияние инициатораС увеличением концентрации инициатора [I] увеличивается число
свободных радикалов [R ]. Следствия:
- скорость реакции возрастает (за счет увеличения числа активных
центров).
- степень полимеризации и ММ уменьшаются.
Влияние давления
Повышение давления до нескольких МПа практически не оказывает
влияния на процесс радикальной полимеризации.
Однако значительное повышение давления до 300-500 МПа
приводит
к
увеличению
скорости
процесса
радикальной
полимеризации.
Особенностью поведения процесса при высоких давлениях является
тот факт, что оно практически не влияет на ММ.
82.
Способы проведения радикальной полимеризацииРадикальную полимеризацию проводят в основном:
- в блоке (массе),
- растворе,
- эмульсии,
- суспензии,
- газовой фазе.
При этом процесс может протекать в гомогенных или гетерогенных
условиях.
Кроме того, фазовое состояние исходной реакционной смеси может
также меняться в ходе полимеризации.
Полимеризация в блоке (в массе)
«+»: Процесс проводится в отсутствие растворителя, благодаря
чему не происходит загрязнения полимера, возможность получения
полимера в форме сосуда, в котором проводится процесс без какой-либо
дополнительной обработки.
«―»: Процесс трудно поддается регулированию вследствие
высокой экзотермичности полимеризации. Рост вязкости среды, что
затрудняет отвод тепла и приводит к местным перегревам и деструкции
полимера, неоднородности его по молекулярной массе.
83.
Полимеризация в раствореОтсутствуют многие недостатки блочной полимеризации:
- устраняется возможность местных перегревов, поскольку теплота
реакции легко снимается растворителем, выполняющим также роль
разбавителя,
- уменьшается вязкость реакционной системы, что облегчает ее
перемешивание.
Недостатки:
- в ряде растворителей возрастает доля реакций передачи цепи, что
приводит к уменьшению молекулярной массы полимера,
- полимер может быть загрязнен остатками растворителя, который
не всегда легко удаляется из полимера.
Полимеризацию в растворе проводят двумя способами:
- для полимеризации применяют растворитель, в котором
растворяется и мономер, и полимер. Получаемый раствор используют
как таковой или выделяют полимер осаждением либо испарением
растворителя.
- полимеризацию проводят в жидкости, в которой растворяется
мономер, но не растворяется полимер. Полимер по мере образования
выпадает в твердом виде и быть отделен фильтрованием.
84.
Полимеризация в суспензии(Бисерная или гранульная полимеризация) широко используется для
синтеза различных полимеров.
Мономер диспергируют в воде в виде мелких капелек. Устойчивость
дисперсии достигается механическим перемешиванием и введением в
реакционную систему специальных добавок - стабилизаторов.
При полимеризации в суспензии применяют растворимые в
мономере инициаторы. Процесс осуществляется в каплях мономера,
которые можно рассматривать как микрореакторы блочной
полимеризации.
Достоинство - хороший отвод тепла.
Недостаток - возможность загрязнения полимера остатками
стабилизатора.
Газофазная полимеризация
Мономер (например, этилен) находится в газообразном состоянии.
В качестве инициаторов могут использоваться кислород и пероксиды.
Процесс протекает при высоком давлении.
85.
Твердофазная полимеризацияЭто полимеризация мономеров, находящихся в кристаллическом
или стеклообразном состоянии. При этом молекулы мономера жестко
фиксированы в пространстве и подвижность их крайне ограничена, что
определяет особенности кинетики процесса и структуру образующихся
макромолекул. Для инициирования полимеризации используют
ускоренные электроны или -излучение.
Существует два крайних случая перехода мономерного кристалла в
полимер (возможно множество промежуточных случаев):
- структура мономерного кристалла существенно определяет
структуру полимера, т. н. топотактический процесс (например,
полимеризация сопряженных диацетиленов или триоксана).
(Другой пример топотактической полимеризации - радиационнохимическая полимеризация 2,3-диметилбутадиена-1,3 в гексагональных
кристаллах мочевины, в которых образуются каналы, заполненные
линейными последовательностями мономеров, причем полимер
получается стереорегулярным.);
- полимер возникает как самостоятельная фаза в протяженных
дефектах кристаллической решетки мономера, что приводит к
дальнейшей ломке мономерного кристалла; образующаяся полимерная
фаза аморфна (например, полимеризация акриламида).
86.
Полимеризация в эмульсии(Латексная полимеризация - ЛП). Латекс - водная коллоидная
дисперсия полимерных частиц размером 10-4-10-5 см). ЛП является
широко распространенным способом получения полимеров.
При эмульсионной полимеризации (ЭП) в качестве дисперсионной
среды используют воду, в качестве эмульгатора - различные мыла.
Для инициирования процесса применяют водорастворимые
инициаторы, окислительно-восстановительные системы.
Полимеризация может протекать в молекулярном растворе
мономера в воде, на поверхности раздела капля мономера ― вода , на
поверхности или внутри мицелл мыла, на поверхности или внутри
образующихся полимерных частиц, набухших в мономере.
Достоинства ЭП:
- возможность осуществления процесса с большими скоростями
с образованием полимера высокой молекулярной массы,
- легкость теплоотвода;
Недостатки:
- необходимость удаления остатков эмульгаторов,
- большое количество сточных вод, требующих специальной
очистки.
87.
Эмульсионная радикальная полимеризацияПроцесс впервые реализован в Германии в 1938 году,
- в США 1942 год,
- в СССР 1949 год.
В настоящее время ЭП является одним из основных методов
получения синтетических латексов и полимеров.
Методом ЭП обычно получают бутадиенстирольные латексы и
полимеры,
C
H2
C
n
C
H2
C
H
C
H
C
H2
m
CH3
(со)полимеры на основе -метилстирола
C
H2
C
C
H2
C
H
C
H
C
H2
88.
сополимеры (мет)акриловой кислоты, (мет)акриламида и нитрилаакриловой кислоты общей структурной формулы
R
R
H2
C
C
m
C
H2
C
n
C
H2
O
p
C
C
COOMe
H
C
NH2
N
где R -H или -CH3;
сополимеры хлоропрена и бутадиена-1,3 и т.д.
C
H2
C
H
C
Cl
C
C
n
H2
H2
C
H
C
H
C
H2 m
89.
Достоинства эмульсионной полимеризации:• Возможность осуществления процесса в непрерывном
режиме, что обеспечивает однородность получаемого
продукта.
• Низкая вязкость реакционной среды (дисперсия
полимера в воде), что позволяет более легко отвести тепло
реакции.
• Возможность получения широкого ассортимента
латексов и полимеров за счет использования различных по
природе мономеров, осуществления сополимеризации и
смесей латексов.
• Возможность получения масло и саженаполненных
латексов и СК.
• Полная автоматизация.
• Высокая безопасность процесса.
90.
Недостатки:Невозможность регулирования микроструктуры полимеров
особенно при полимеризации малополярных мономеров. Такие
полимеры содержат 80-90 % транс-звеньев.
Многокомпонентность системы.
Загрязнение полимера и окружающей среды компонентами
системы.
Для проведения процесса ЭП обязательно требуется наличие 2-х
фаз:
дисперсионная среда (вода)
дисперсная фаза (мономеры.
В рецепт кроме того обязательно должны входить:
инициаторы (водо- или маслорастворимые),
эмульгаторы - соли канифоли (д-резинаты), соли СЖК (С12-С18),
сульфаты (алкилсульфанат, сульфанол), полиионоактивные, амфотерные
и неионогенные ПАВ и полимерные ПАВ. В качестве дополнительного
стабилизатора выступает лейканол.
Регуляторы ММ - т-ДДМ, Дипроксид,
Активирующая группа (ОВС).
91.
Механизм эмульсионной полимеризации и топологияпроцесса
Топохимия рассматривает место, где протекают элементарные
реакции эмульсионной полимеризации.
Образование ВМС при проведении процесса ЭП протекает по
цепному радикальному механизму. Наличие водной фазы и коллоидное
состояние диспергированного мономера определяют особенности
топохимии процесса ЭП. Все преимущества и все недостатки процесса
ЭП определяются гетерогенностью системы и возможностью
локализации элементарных реакций ЭП в различных зонах.
Процесс может протекать в :
мицеллах,
адсорбционных слоях эмульгатора,
водной фазе,
каплях мономера,
микрокаплях мономера.
92.
Трудность создания единой теории ЭП обусловливаетсяследующим:
Многофазность эмульсионной системы.
Многообразие параметров, определяющих механизм и кинетику
ЭП.
Такое многообразие обусловлено различием в реакционной
способности мономеров, участвующих в процессах ЭП, а так же разным
характером распределения мономеров по фазам.
Мицеллярная теория (Юрженко-Харкинса)
Эта теория развита и в основном применительно для неполярных и
малорастворимых в воде мономеров (бутадиен, изопрен, стирол, метилстирол и др.).
В 1950 годы Юрженко и Харкинс высказали предположение о том,
что процесс ЭП протекает в мицеллах эмульгатора. Топохимия процесса
эмульсионной полимеризации определяется природой и количеством
ПАВ и величиной поверхностного натяжения и коллоидной
растворимостью углеводородов в растворах, а так же природой
инициатора и др.
Анионоактивные и катионоактивные эмульгаторы в воде находятся в
форме ионов, молекул и мицелл.
93.
Минимальная концентрация эмульгатора,наблюдается образование мицелл, называется ККМ.
при
которой
Молекулярная растворимость эмульгатора в воде обычно мала.
Выше этой критической величины (ККМ) молекулы эмульгатора
собираются в группы от нескольких десятков до нескольких сотен и
образуют мицеллы. В связи с этим основная масса эмульгатора
находится в агрегированном состоянии в виде мицелл.
Мицеллы - агрегаты молекул НМС, абсолютно идентичных и
связанных между собой вторичными силами (силами Ван-дер-Ваальса).
Макромолекулы - длинные гибкие молекулярные цепи, звенья
которых соединены между собою главными валентными связями.
При низких концентрациях эмульгатора образуются в основном
сферическое мицеллы. Величина ККМ зависит от ряда факторов. В
частности, в присутствии электролитов наблюдается понижение ККМ.
94.
С17Н35 СООКСэмульгатора ККМ
Истинный раствор
Некоторый свободный объем
Сэмульгатора ККМ
Коллоидная система
95.
С мицеллообразованием тесно связан процесс солюбилизации коллоидной растворимости мономеров в растворах эмульгаторов.Известно, что большинство мономеров не растворяется в воде, однако
наблюдается их растворение в растворе мыл.
Мономер
Изопрен
Стирол
В воде
0
0,05
В растворе мыл
9
6,8
Количество мицеллярно-растворимого мономера сравнительно
невелико.
В одной мицелле обычно растворяется до 100 молекул мономера.
Остальной мономер существует в виде капель эмульсии, которые
также окружены молекулами эмульгатора. При этом молекула ПАВ
разворачивается углеводородной частью к капле, а полярной частью к
воде.
Эмульсионная система является наиболее стабильной в том случае,
когда степень адсорбционной насыщенности довольно велика.
Таким образом, в начале процесса практически весь эмульгатор
находится в виде мицелл, а мономер в основном в виде капель.
96.
В том случае, когда в эмульсионной системе процесс протекает вприсутствии водорастворимого инициатора, то свободные радикалы
образуются в водной фазе. Далее они диффундируют внутрь мицелл, где
уже находятся молекулы мономера, и начинается процесс
полимеризации.
В случае малорастворимого в воде инициатора, он попадает внутрь
мицелл вместе с мономером, где он распадается на свободные
радикалы и начинается процесс ЭП.
Реакция начинается не в каждой мицелле, а лишь в одной из 700,
поскольку число свободных радикалов, которые образуются при
распаде даже очень активных инициаторов, значительно меньше числа
мицелл при обычных концентрациях эмульгатора в реакционной среде.
Вероятность протекания процесса в водной фазе в каплях
мономера очень низка. Рост полимерного радикала в мицеллах
осуществляется за счет мономера, находящегося в мицеллах. В свою
очередь молекулы мономера в мицеллах находятся в динамическом
равновесии с молекулами мономера, находящимися в водной фазе. В
связи с этим концентрация мономера в мицеллах является постоянной
до тех пор, пока существуют капли мономера. Они являются как бы
резервуаром, откуда мономер расходуется по мере необходимости.
97.
По ходу полимеризации мицеллы превращаются в ПМЧ, амолекулы мономера первоначально диффундируют и мицеллы, а затем в
ПМЧ. ПМЧ растут, и растущие полимерные цепи так же адсорбируют
на своей поверхности молекулы ПАВ. Поверхность постоянно
увеличивается и увеличивается количество эмульгатора, который
адсорбируется на поверхности частиц. Молекулы эмульгатора попадают
на поверхность ПМЧ из мицелл, в которых не начался процесс ПМ. При
выходе полимера 10-15% мицеллы исчезают.
1/700
699
в ПМЧ
в адсорбционные слои ПМЧ.
Кинетика процесса в соответствии с этой теорией была описана
Смитом и Эвертом
V = k2 [I]0,4 [Э]0,6 [M]
98.
Кинетическая кривая процесса ЭП0 - индукционный период,
1 - мицеллярный этап,
2 -стационарный этап,
3 - конечный этап.
99.
На мицеллярном этапе:
существуют мицеллы, ПМЧ и капли мономера,
концентрация мономера внутри частиц постоянна,
поверхностное натяжение постоянно,
число частиц и скорость процесса возрастают.
100.
Стационарный этап:существуют ПМЧ и капли мономера,
концентрация мономера внутри частиц постоянна,
поверхностное натяжение возрастает, поскольку ПМЧ постоянно
растут в объеме и их поверхность становиться все более и более
адсорбционно-ненасыщенной,
число частиц и скорость процесса постоянны.
Конечный этап
на этом этапе весь мономер перешел в ПМЧ, поэтому капель
мономера нет,
концентрация мономера внутри частиц падает,
поверхностное натяжение постоянно,
число частиц постоянно, а скорость процесса падает.
101.
Теория Медведева-ХомяковскогоСогласно этой модели объем ПМЧ не является основной зоной
реакции.
Адсорбционный слой имеет определенную толщину и объем и
считается, что процесс полимеризации начинается в адсорбционных
слоях эмульгатора.
Теория микроэмульгирования
Согласно этой теории роль мицелл в образовании ПМЧ не является
определяющей.
Основное значение отводится процессам микроэмульгирования,
причем определяющим фактором является дробление капель мономера,
что приводит к резкому увеличению поверхности раздела мономер водная фаза.
Перенос молекул мономера к растущим ПМЧ происходит не путем
диффузии, а путем непосредственного контакта ПМЧ с каплями
мономера или между собой.
102.
СОПОЛИМЕРИЗАЦИЯСополимеризацией
называют
совместную
полимеризацию двух или более мономеров.
Она широко используется в практике, поскольку является
простым и очень эффективным методом модификации
свойств полимеров. Сополимеризация может быть как
радикальной, так и ионной.
Наиболее
распространена
и
изучена
бинарная
сополимеризация.
Для этого случая можно вывести кинетически (или
статистически) без конкретизации механизма и природы
активных центров уравнение состава сополимера зависимость между составами сополимера и исходной смеси
мономеров (т.к. как правило они не равны).
103.
Допущения:- постоянная скорость инициирования;
- реакционная способность активного центра постоянна;
- все стадии необратимы;
- мономер расходуется только на рост цепи;
- существует стационарное состояние;
- гомофазная полимеризация;
- сополимер получается с Мn 104.
- степень конверсии мономеров < 5%, когда состав мономерной
смеси мало отличается от исходной.
В этом случае можно записать четыре реакции роста цепи:
k
11
m1 M 1
m
1
2
k
12
M 2
k 22
m M 2
k
21
m 2 M 1
1
m1 m
m1 m 2
m2 m2
m2 m1
m M
m M
k11 m1 M 1
k12
k 22
1
2
2
2
k 21 m2 M 1
104.
Скорости исчерпания мономеров при сополимеризацииравны:
d M 1
dt
d M 2
dt
k11 m1 M 1 k 21 m2 M 1
k 22 m2 M 2 k12 m1 M 2
Поделив эти выражения, получаем отношения
концентраций мономерных звеньев в образующемся
сополимере:
d M 1
d M 2
m M k m M
k11 m1 M 1 k 21 m2 M 1
k 22
2
2
12
1
2
105.
В стационарном состоянии устанавливаются стационарныеконцентрации активных центров каждого типа. Условием этого вида
стационарности является:
k12 m1 M 2 k 21 m2 M 1
откуда
m
1
.
k 21 M 1
m 2
k12 M 2
Подставив это значение в выражение отношений концентраций
мономерных звеньев, после упрощения получим дифференциальное
уравнение состава сополимера Майо-Льюиса:
M r M M
d M M r M M
d M1
1
1
1
2
2
2
2
2
1
где r1 k11 k12
r2 k 22 k 21 - константы сополимеризации, или
относительные активности мономеров, равные отношению констант
скоростей присоединения к радикалам своего и “чужого” мономеров.
и
106.
Параметры r1 и r2 для любой пары мономеров определяются толькоприродой этих мономеров и температурой и не зависят от растворителя,
инициатора и агента передачи цепи.
Это уравнение связывает мгновенные (текущие) концентрации
мономеров в сополимере и мономерной смеси через величины
относительных активностей мономеров.
По уравнению можно найти константы r1 и r2 при сополимеризации
до 5-7% глубины превращения мономеров. При этом условии
отношение [M1]/[M2] можно считать равным заданному, а мгновенный
состав - равным среднему составу сополимера, образованного на
начальной стадии, т.е.
m
d M m
Тогда
d M1
1
2
2
m M r M M
m M r M M
1
1
1
1
2
2
2
2
2
1
107.
Таким образом химический состав сополимера (при малых степеняхпревращения) зависит от концентраций мономеров и их констант
сополимеризации.
Вместо абсолютных молярных концентраций удобнее применять
относительные молярные доли.
Уравнение состава может быть решено графически или
аналитически.
Графическим выражением уравнения состава являются кривые
состава сополимера, вид которых определяется константами r1 и r2 :
108.
Кривая1
Константы
r1 = r2 =1
идеальная
сополимеризация
2
r1 > 1 и r2 < 1
(также кривая 4)
3
4
5
6
7
8
Распределение звеньев
состав
сополимера
равен
составу
мономерной смеси, распределение звеньев в
цепи сополимера статистическое
сополимер обогащен более активным
мономером во всей области состава,
распределение
звеньев
в
цепи
статистическое
r1 < 1 и r2 < 1
характерно
чередование
мономерных
азеотропная
звеньев, но оно не регулярное. Активные
сополимеризация при центры охотнее присоединяют “чужие”
М1=0.5
мономеры
r1 < 1 и r2 > 1
см. кривую 2
r1 0 и r2 0
строгое чередование мономерных звеньев,
условие r1 = 0
при любом составе мономерной смеси
означает,
образуется сополимер состава 1:1
что k11=0 или k12>>k11 (случай для мономеров не дающих
гомополимеров,
но
образующих
сополимеры)
r1 0 и r2 < 1
см. кривую 3
r1 0 и r2 > 1
r1 > 1 и r2 > 1
протекает раздельная гомополимеризация
(кривая зеркальна
мономеров без образования сополимера, в
кривой 3)
крайнем случай блок-сополимеризация
109.
Статистический анализ чередования звеньев в цепи сополимерауказывает на три случая:
при r1 r2 =1 звенья обоих типов размещаются в полимерной цепи по
закону случая;
при r1 r2 < 1 вероятность чередования звеньев увеличивается;
при r1 r2 0 в пределе можно регулярно чередующийся сополимер.
Точка пересечения кривой 3 (или кривой 8) с прямой 1
соответствует азеотропной сополимеризации (когда состав сополимера
равен составу мономерной смеси).
В промышленных процессах, когда ставится задача получения
возможно однородного продукта, руководствуются следующими
положениями:
• Подбирают мономерные пары с константами сополимеризации,
близкими к 1, так чтобы состав мономерной смеси минимально
изменялся по ходу реакции;
• Реакцию проводят по
возможности ближе (или в точке)
азеотропного состава;
• Ограничиваются минимально возможными конверсиями;
• Сохраняют состав мономерной смеси постоянным добавлением по
ходу реакции более активного сомономера в реакционную смесь.
110.
Дифференциальный и интегральный составысополимеров
Дифференциальный состав сополимера - состав
сополимера, образующегося в каждый данный момент
времени.
Интегральный - состав сополимера, образовавшегося к
данному моменту времени.
В тех случаях, когда сополимер не имеет характера
азеотропа, он будет обогащен одним из мономеров.
При этом более активный мономер будет расходоваться
более быстро и в начале процесса сополимеризации
сополимер будет обогащен более активным мономером.
111.
ПримерИзменение дифференциального и интегрального
составов сополимера в ходе радикальной сополимеризации
стирола (25) и бутадиена (75) rстир = 0,78, rдив = 1,39
Содержание звеньев стирола, %
Выход, % Дифференциальный Интегральный
состав
состав
1..2
17,2
17,2
20
18,8
17,9
40
20,6
18,7
60
23,3
19,7
80
29,5
21,2
90
36,4
22,5
100
100
25
112.
Константы сополимеризации и их определениеДля определения констант сополимеризации необходимо знать:
состав сополимера,
состав исходной шихты,
провести не менее 2-х опытов (8-10).
Состав сополимера определяют по данным:
элементного анализа,
приборных физических методов анализа
а) показатель преломления,
б) по плотности,
в) спектральные методы (УФ, ИК, ЯМР).
Если процесс сополимеризации проводить до невысоких конверсии, то
можно использовать основное уравнение в дифференциальной форме.
Если процесс проводить более глубоко (боле 15%), то необходимо
использовать основное уравнение в интегральной форме.
В настоящее время константы сополимеризации определяют путем
решения уравнения сополимеризации при различных степенях превращения
мономера с помощью расчетных методов. Такой метод позволяет быстро и с
большой точностью рассчитать состав сополимера.
113.
ИОННАЯ ПОЛИМЕРИЗАЦИЯИонная полимеризация - это цепной процесс, в котором
присоединение
мономера
к
растущим
цепям
происходит
гетеролитически.
Активными центрами на концах цепей являются ионы, образующие
с противоионами пару, которые генерируются под действием
катализаторов или ионизирующих излучений.
Степень разделения компонентов ионной пары может быть различна.
Обычно выделяют три характерных случая:
Степень разделения
компонентов ионной
пары
Катионный
активный центр
Анионный активный
центр
поляризованная
связь
тесная ионная пара
m A
m К
m A
m К+
свободные ионы
m
m
114.
Каждая из форм активного центра существенно отличается поактивности.
Поэтому для ионной полимеризации характерно большее влияние
природы реакционной среды на скорость процесса и структуру
образующегося полимера, так как в системе могут сосуществовать
ионные центры различного типа, причем их соотношение изменяется
при изменеии температуры.
При изменении диссоциирующей и сольватирующей способности
среды процессы ионной полимеризации осложняются различными
сопутствующими
эффектами
(изомеризацией,
димеризацией,
образованием нестереорегулярного полимера и др.).
Влияние механизма полимеризации стирола на скорость роста цепи (298К)
Механизм
kр, л/моль с
Радикальный
35
Катионный
свободные ионы
3.5 106
ионные пары
7.7
Анионный
свободные пары
6.5 104
ионные пары
80
115.
Ионная полимеризация протекает через последовательныеэлементарные стадии инициирования, роста цепи, передачи и
обрыва цепи.
Внедрение мономера в растущую полимерную цепь
осуществляется между заряженным концом растущей макроцепи
и противоионом, при этом могут создаваться условия
способствующие упорядочению структуры полимера.
Особенностью ионных полимеризационных процессов
является малая вероятность кинетического обрыва цепи, поэтому
растущие цепи сохраняют активность и после исчерпания
мономера.
Такие цепи называют “живыми”.
Этот эффект используют для получения блок-сополимеров.
Значения энергий активации ионной полимеризации
значительно ниже по сравнению с радикальной полимеризацией,
поэтому они проводятся при низких температурах, часто
отрицательных, так как при понижении температуры
увеличивается устойчивость ионых пар.
116.
Существенный характер имеет выбор растворителя. Нуженрастворитель,
который
обладает
хорошей
сольватирующей
способностью, не замерзает при понижении температуры, а также не
реагирует с катализаторами ионной полимеризации.
Наиболее подходящими растворителями, отвечающими этим
требованиям, являются: CH3Cl хлористый метил, C5H12 пентан, Ph-NO2
нитробензол и некоторые другие.
В таких растворителях при увеличении сольватирующей
способности увеличивается расстояние между ионами в ионной паре, а
следовательно изменяется активность центра полимеризации.
Решающее значение имеет химическое строение мономера.
Винильные
мономеры
с
электронодонорными
заместителями
(изобутилен, виниловые эфиры) полимеризуются по катионному
механизму, а с электроноакцепторными (акрилонитрил, акрилаты) по
анионному. Стирол полимеризуется по различным механизмам, так как
за счет сопряжения с кольцом могут стабилизироваться и
положительные, и отрицательные, и радикальные центры.
Ионная полимеризация хуже изучена, чем радикальная. Нет единой
кинетической схемы и каждый случай описывается своими
особенностями кинетики.
117.
КАТИОННАЯ ПОЛИМЕРИЗАЦИЯВпервые катионную полимеризацию осуществил Бутлеров в
1877 году путем полимеризации изобутилена в присутствии
серной кислоты.
Активный центр: растущая цепь имеет положительный
заряд - карбокатион.
Мономеры: производные этилена с электронодонорными
заместителями, карбонильные гетероциклические соединения,
нитрилы. Для ряда мономеров полимеризация возможна лишь по
катионному механизму (изобутилен, триоксан, тетрагидрофуран).
Способность винилового мономера к реакциям роста по
катионному механизму зависит от степени нуклеофильности
двойной связи и возможности образования нуклеофильными
группами мономера необратимых комплексов с электрофильными
агентами (катионом или кислотой Льюиса).
118.
Катализаторы:- протонные кислоты: HClO4, H2SO4, H3PO4, HCl и др.;
- апротонные кислоты (кислоты Льюиса, катализаторы ФриделяКрафтса),
относящихся
обычно
к
группе
координационноненасыщенных солей металлов, т. е. MeXn (где Me - металл, X - чаще
всего галоген): BF3, AlCl3, SnCl4, TiCl4, FeCl3 и др.
Активны в присутствии сокатализаторов - галогеналкилов, воды,
спиртов и других соединений, являющихся донорами ионов водорода.
Излучения высокой энергии и ряд других реагентов: карбениевые
Ph3C+, оксониевые R3O+ соли с комплексным противоионом ([SbCl6] ,
[PF6] ), алкилпроизводные металлов ZnR2, AlR3, галогенов и межгалогенных
соединений: I2, ICl, IBr.
Активность катализаторов может быть разная - например,
полимеризация изобутилена в присутствии BF3 происходит со взрывом,
с AlBr3 за несколько минут, а с TiCl4 в течение часов.
119.
Реакция инициирования заключается во взаимодействии катиона смономером. В простейших, но довольно редких случаях, катионы
получают при диссоциации катализатора, например:
H +СlO4 ,
HClO4
но гораздо чаще в результате диссоциации комплекса катализатора и
сокатализатора:
BF3 H 2 O BF3 H 2 O BF3 (OH) H
BF3 Et 2 O BF3 Et 2 O Et
BF (OEt)
3
RHal SnCl 4 R SnCl 4 Hal
Затем при взаимодействии с мономером катионы смещают на себя
электронную плотность -связи с последующим образованием -связи
катиона с -углеродным атомом мономера (по отношению к
заместителю):
k
BF3 (OH ) H CH2 C H R
H CH2 C HR BF3 (OH )
Џ’
120.
Рост цепи в катионной полимеризации происходит путемприсоединения мономера к макрокатионам или путем его внедрения по
ионной паре, находящейся на концах растущих цепей:
H CH 2 CHR
n
CH 2 C H R BF3 OH
H CH 2 CHR
n 1
k
CH 2 CHR р
CH 2 C HR BF3 OH
Скорость роста зависит от степени разделения ионов в ионной паре.
Наиболее активными являются свободные ионы. Поэтому увеличение
полярности растворителя, как правило, приводит к возрастанию
скорости катионной полимеризации, из-за увеличения степени
диссоциации ионной пары.
Поскольку реакция диссоциации ионной пары обычно
экзотермическая, часто энергия активации процесса катионной
полимеризации отрицательна. Т.е. понижение температуры приводит к
увеличению скорости катионной полимеризации.
121.
Обрыв цепи чаще всего происходит в результате мономолекулярнойреакции дезактивации активного центра путем внутримолекулярной
передачи катиона водорода:
CH 2 C HR BF3 OH
CH
CHR BF3 H 2 O
При этом возможна также рекомбинация ионной пары:
CH 2 C HR AlCl 4
CH
2
CHClR AlCl 3
Передача цепи на мономер играет исключительную роль в
катионной полимеризации, поскольку она определяет предельные
значения молекулярной массы полимеров. Эта реакция протекает в
результате межмолекулярной передачи катиона водорода:
CH 2
C HR BF3 OH
CH
CH 2 CHR
CHR CH 3 C HR [BF3 (OH)]
122.
Энергия активации этого процесса положительна, поэтому дляувеличения молекулярной массы полимера катионную полимеризация
проводят при низких температурах (до -80 С). При этом увеличивается
молекулярная масса и растет скорость процесса катионной
полимеризации.
Кинетика катионной полимеризации
В большинстве случаев скорость катионной полимеризации
пропорциональна концентрациям мономера и катализатора. Однако в
результате существования различных форм активных центров,
отличающихся по активности (разница в скоростях примерно в 106 раз),
часто зависимость скорости процесса имеет более сложный вид.
Соотношение различных типов катионноактивных центров зависит
от диэлектрической проницаемости среды , основности компонентов и
наличия примесей, способных взаимодействовать с катализатором.
Например, в среде CCl4 активные центры более чем на 95% имеют
ковалентную форму, а в CH3NO2 - ионную.
Другой пример: полимеризация стирола в присутствии HClO4 при
25 С в смеси дихлорэтана и четыреххлористого углерода ускоряется в
10 000 раз при изменении в пределах 2.3-9.7 (путем изменения
соотношения растворителей).
123.
Иногда в процессе полимеризации происходит заметное изменениесоотношения между активными центрами, находящимися в виде ионных
пар и свободных ионов, что фиксируется по изменению . Кроме того,
активные центры могут находиться в несольватированной форме, а
также в форме, сольватированной мономером, полимером и
растворителем.
Уравнение баланса активных центров в момент времени для этой
системы имеет вид:
К К k К М k К П k К S
0
M
П
S
где К 0 - общая концентрация активных центров, К - концентрация несольватированных центров, kM, kп, kS - константы скорости
комплексообразования центров с мономером, полимером и
растворителем.
При росте цепи преимущественно на центрах, сольватированных
мономером, уравнение скорости полимеризации можно записать в виде:
k р k M M K 0
2
dM
k р M К M
d
1 k M M k П П k S S
124.
Отсюда следует, что константа скорости роста цепи kр зависит отконцентрации и сольватирующей способности всех компонентов
системы.
Промышленно катионная полимеризация используется для
получения полиизобутилена, бутилкаучука, поливинилизобутилового
эфира, сополимеров этиленоксида, а также большого числа
разнообразных олигомерных продуктов.
125.
АНИОННАЯ ПОЛИМЕРИЗАЦИЯСистематическое изучение анионной полимеризации ненасыщенных
соединений началось в 1920-х годах Лебедевым, Циглером и др.
Активный центр при анионной полимеризации несет частичный
или полный отрицательный заряд.
Мономеры, склонные к анионной полимеризации, имеют
пониженную электронную плотность С=С-связи электроноакцепторным
заместителем (акрилаты, акрилонитрил, этиленоксид, альдегиды,
лактоны, лактамы, силоксаны) или имеют повышенную энергию
сопряжения (стирол, диены). Кроме того, к анионной полимеризации
также склонны многие из карбонилсодержащих соединений и
гетероциклов, имеющие связи С=С, С=О, C=N и др.
Катализаторами являются сильные основания, основания Льюиса,
т.е. доноры электронов - щелочные металлы, производные металлов I и
II группы (алкилы, арилы, алкоголяты, амиды). Процессы,
развивающиеся с участием переходных металлов, относят обычно к
координационно-ионной полимеризации. Кроме того анионная
полимеризация может быть вызвана электрическим током и
излучениями высокой энергии.
126.
Реакция инициирования может осуществляться двумяспособами:
- по типу кислотно-основного взаимодействия, в результате
присоединения к мономеру аниона или соединения, включающего
анион, например, инициирование анионной полимеризации
виниловых мономеров амидом натрия в жидком аммиаке при
низкой температуре:
NaNH
2
2
CH 2 CHR
Na NH NH 2 CH 2 C HRNa
- по типу окисления-восстановления, в результате переноса
электрона между молекулами мономера и катализатора; например,
при реакции металлов I группы, а также металлорганические
соединения элементов I и II групп. Акту инициирования с
участием металла предшествует стадия образования комплекса с
переносом заряда (КПЗ) между катализатором и мономером:
M Na
M Na
Na M M Na
127.
или между металлом и ареном:На второй стадии мономер вытесняет нафталин из нафтилинида
натрия, в результате чего получается, как и в первой системе, анионрадикал мономера. Далее происходит рекомбинация анион-радикалов с
образованием дианионов, к которым присоединяется мономер.
Процессы по типу окисления-восстановления характерны также для
электрохимического и радиационно-химического инициирования. В
принципе, при таком механизме возможно параллельное развитие
анионных и радикальных реакций, однако в реально изученных
системах случаи с заметным участием радикальных процессов не
обнаружены.
128.
Особенностьюанионной
полимеризации
неполярных
мономеров является ассоциация катализатора и растущих цепей в
неполярных растворителях и диссоциация ионных пар на
свободные ионы в полярных средах.
Активность анионного катализатора - металлалкила MeR
находится в прямой зависимости от полярности связи Me-C, а
также от растворителя, причем активные центры могут
существовать в виде различающихся по реакционной
способности
и
стереоспецифичности
ковалентных
поляризованных молекул (II), их ассоциатов (I), ионных пар
разной степени сольватации (III,IV), свободных ионов (V):
( P Me )
I
n
P Me
II
S
S
P , Me S
III
P , Me Sn P Me Sn
IV
V
129.
Полимеризация неполярных мономеров (стирола, бутадиена,изопрена)
в
углеводородных
растворителях
нередко
сопровождается
индукционными
эффектами
вследствие
недостаточной скорости инициирования. Эти эффекты можно
исключить введением в систему промоторов электронодонорного
типа, которые образуют с инициатором стехиометрические
комплексы (простые эфиры, алкиламины и др.):
R-Me + nD
R-Me nD.
Присутствие электронодонора в координационной сфере
металла приводит к обеднению электронами и ослаблению связи
Ме-С. В реакциях, протекающих с разрывом связи Ме-С, это
равнозначно повышению активности катализатора. Например, это
явление благоприятствует 1,2 (3,4)-присоединению диенов и
образованию синдиотактического полиметилметакрилата.
130.
Рост цепи для анионной полимеризации характерен относительнойстабильностью активных центров.
Например, для неполярных полимеров в углеводородных
растворителях суммарный процесс включает практически лишь стадии
инициирования и роста цепи (т. н. “живые полимеры”, впервые описаны
М.Шварцем (США)).
Это позволяет создать условия для исследования механизма
анионной полимеризации, а также для решения различных
синтетических задач: получение полимеров с заданным ММР, в т. ч.
практически монодисперсных; синтеза полимеров и олигомеров с
концевыми функциональными группами, способными к дальнейшим
превращениям поликонденсационного или полимеризационного типа, а
также блок-сополимеров, привитых сополимеров и различных
полимеров с регулируемым типом разветвления и др.
Участие противоиона в актах роста цепи обусловливает большие
возможности воздействия на микроструктуру полимера, вплоть до
образования в некоторых случаях стереорегулярных и оптически
активных полимеров.
131.
В наибольшей степени ориентирующее влияние противоионапроявляется в углеводородной среде, где присутствует Li,
наиболее
стереоспецифичного
из
щелочных
металлов,
образуются 1,4-полиены (с преобладанием цис-структуры в
случае изопрена или с равным содержанием цис- и трансструктур
в
случае
бутадиена)
и
изотактический
полиметилметакрилат. Среди щелочно-земельных металлов
образованию цис-1,4-полидиенов и изотактического ПММА в
наибольшей степени способствует Ва.
Реакции обрыва и передачи цепи характерны для анионной
полимеризации мономеров с полярными функциональными
группами.
Это
всегда
более
сложный
процесс,
сопровождающийся дезактивацией активных центров при
взаимодействии с функциональными группами мономера и
полимера. Энергия активации побочных реакций (как и передача
цепи на растворитель в случае веществ с подвижным атомом
водорода, например, толуола), как правило, выше, чем энергия
роста цепи; поэтому понижение температуры способствует
обычно подавлению побочных реакций.
132.
Чаще всего общей реакцией обрыва цепи является перенос гидридиона на противоион или мономер:CH 2
C HR AlR 2
CH 2 CHR R 2 AlH
CH 2 C HRK CH 2 CHR
CH 2 CHR CH 3 C HRK
Кинетика полимеризации
Анионная полимеризация характеризуется большим разнообразием
механизмов реакций и кинетических схем. В каждом конкретном случае
выбор инициаторов и условий проведения процесса обусловлен
необходимостью синтеза полимера определенной структуры и ММР.
Скорость анионной полимеризации особенно при умеренных
температурах намного выше скорости радикальной полимеризации. Это
связано с более высокой действующей концентрацией активных частиц
(в пределе она может быть равна исходной концентрации инициатора).
Например, для стирола при 30 С порядок абсолютной константы
скорости роста цепи (в л/моль с) при переходе от литиевых ассоциатов II
до свободных анионов (V) меняется от 10-1 до 105.
133.
Общаякинетическая
картина
анионной
полимеризации
существенно осложнена упомянутой выше множественностью форм
существования активных центров. Помимо указанных играют роль и
,
более сложные образования, например, ионные
тройники типа Р , Ме ,
Р . Поэтому даже в случае живущих полимеров при быстрой стадии
инициирования, когда суммарная концентрация растущих цепей равна
исходной концентрации инициатора [С0], общая скорость реакции роста
цепи ( р) далеко не всегда описывается простым уравнением:
р= kр [C0][M]
p x
С
n M0
0
где [M0] и [M] - начальная и текущая концентрации мономера, х=1[M]/[M0] - степень превращения мономера, n - число растущих концов в
макромолекуле.
134.
Часто наблюдаются более сложные зависимости общего вида:р k р i A M
i
где учитывается вклад различных форм активных центров.
Обычно порядок реакции по инициатору варьирует от 1 до 0, а
порядок по мономеру в большинстве случаев равен 1.
135.
ИОННО-КООРДИНАЦИОННАЯ ПОЛИМЕРИЗАЦИЯЕсли акту внедрения мономера в растущую полимерную цепь
предшествует акт его координации на активном центре, то такой
процесс
называют
ионно-координационной
полимеризацией.
Координация мономера может иметь место как при анионной, так и при
катионной полимеризации, но для анионной полимеризации она более
характерна.
В 1954 году А.А.Коротков получил из изопрена стереорегулярный
каучук, применив в качестве катализатора литийорганические
соединения. При полимеризации на литии или литийорганических
соединениях стереорегулярный цис-1,4-полиизопрен образуется лишь в
углеводородных средах.
Это объясняется координацией мономера на полярном, но
недиссоциированном активном центре C Li , в результате чего
мономерное звено принимает конфигурацию, соответствующую цис-1,4структуре:
136.
Добавление всего лишь нескольких процентов электронодонорногосоединения (эфира, тетрагидрофурана, алкиламина) резко меняет
микроструктуру полиизопрена, становится преобладающей транс-1,4(80-90%) и 3,4-структура (10-20%).
Электронодонорное соединение поляризует связь C Li до
разделения на ионы:
CH
2
Li
nR 2 O
CH 2
Li(OR )
2 n
137.
В этом случае происходит координация иона Li+ с концевымзвеном макроиона, которое имеет аллильную структуру. В
аллильной структуре -электроны делокализованы. С учетом
этого координацию иона Li+ с макроионом можно представить
циклической структурой:
что приводит к транс-1,4- и 3,4-структуре.
138.
В 1955 году немецкий химик Карл Циглер (для полученияполиэтилена в мягких условиях 50-80 С и 1 МПа) и итальянский химик
Джулио Натта для получения кристаллизующихся полипропилена и
полистирола предложили каталитическую систему из триэтилалюминия
и хлорида титана.
В частности Натта с сотрудниками в Милане исследовал методом
дифракции рентгеновских лучей полимеры, полученные из пропилена, и
обнаружил, что некоторые изученные полимеры, полученные
полимеризацией мономера под действием продуктов реакции
триалкилалюминия с хлоридом титана (катализатор Циглера) или под
действием трехокиси хрома, нанесенной на окись алюминия, имеют
значительно более регулярную структуру, чем другие полимеры
полипропилена.
Стереорегулярность полимера сильно влияет на его физические
свойства. Например, обычный атактический полипропилен - мягкий
резиноподобный материал, тогда как изотактическая модификация
представляет волокнистый материал, который можно прясть и ткать.
Поэтому не удивительно, что Натта и Циглер получили Нобелевскую
премию в 1963 году за открытие стереорегулярных полимеров и
катализаторов, необходимых для их получения.
139.
Типичнымикатализаторами
ионо-координационнной
полимеризации являются соединения переходных металлов d-групп (IVVIII группы - Ti, V, Cr), образующие при взаимодействии с
алюминийалкилом (или другими органическими соединениями
непереходных металлов I-III групп) -связь (I) Ме-С, но сохраняющие
способность к образованию -связи (II) - так называемые группа
катализаторов Циглера-Натта:
140.
В акте координации мономер выступает в роли донора электронов, а переходный металл катализатора Ti, благодаря наличиювакантных d-орбиталей, является акцептором (II). Образование комплекса мономер-Ti приводит к ослаблению связи Ti-C, внедрение
мономера по этой связи облегчается (III).
Рост цепи осуществляется путем внедрения мономера по типу
“голова к хвосту”, что связано с преодолением относительно низких
активационных барьеров, чем при присоединению по другим типам.
Акт координации приводит к определенной ориентации молекулы
мономера, обеспечивая раскрытие двойной связи и отбор строго
определенной конформации мономера при внедрении в полимерную
цепь. В этом случае полимерная цепь будет иметь стереорегулярную
изотактическую структуру.
Если отбираемые в акте внедрения конформации мономера
противоположны
и
чередуются
регулярно,
то
образуется
стереорегулярная синдиотактическая последовательность.
Известны гетерогенные и гомогенные катализаторы Циглера-Натта,
на первых в основном получаются изотактические, а на вторых могут
быть получены и синдиотактические полимеры.
141.
Стереоспецифичность каталитических систем типа ЦиглераНатта обусловлена влиянием лигандного окружения вкоординационной сфере переходного металла, тогда как в
реакциях
радикальной
и
ионной
полимеризации
стереорегулирование осуществляется концевым звеном растущей
макроцепи.
Таким образом, инициирование стереоспецифической
полимеризации протекает по трехстадийному механизму координации, ориентации и внедрения.
В этих процессах интенсивность реакций ограничения роста
цепи зависит от температуры. Обрыв цепи происходит в
результате тех же реакций, что и при анионной полимеризации, в
частности реакции переноса гидрид-иона на мономер или
противоион. Кроме того молекулярную массу образующегося
полимера можно регулировать также введением в реакционную
среду агентов передачи цепи - водорода и алюминийгидрида.
142.
Скорость роста цепи может быть выражена кинетическимуравнением, похожим на подобное для анионной полимеризации:
р k р I M
где [I] и [M] - концентрации инициатора и мономера, а и порядки реакции по инициатору и мономеру.
Катализаторы Циглера-Натта широко используются для
полимеризации этилена, пропилена, диенов и некоторых
полярных и гетероциклических мономеров.
В промышленности методом анионно-координационной
полимеризации получают стереорегулярные каучуки (СКИ-3,
СКИ-5, СКД) и полиолефины (полиэтилен низкой плотности ПЭНП) и др.
143.
ПОЛИКОНДЕНСАЦИЯПоликонденсация - это синтез полимеров взаимодействием би- или
полифункциональных мономеров или олигомеров, обычно сопровождающийся
выделением
низкомолекулярного
продукта
(воды,
спирта,
аммиака,
галогеноводорода, соответствующих солей и др.). Например, получение сложных
полиэфиров:
Kp
nHOOC-(CH2)4-COOH + nHO-(CH2)2-OH
HOOC-(-(CH2)4-COO-(CH2)2-)-OH + (2n-1)H2O
Реакционными (активными) центрами при поликонденсации можно считать
функциональные группы.
Процессы поликонденсации играют большую роль в природе и технике.
Поликонденсация лежит в основе образования всех природных ВМС: белков,
целлюлозы, крахмала, нуклеиновых кислот и др.
Первое промышленное производство синтетического полимера - фенолоформальдегидной смолы (Лео Бакеланд, 1909), основано на реакции
поликонденсации.
144.
Большой вклад в развитие знаний о процессах поликонденсациивнесли отечественнве ученые: В.В. Коршак, Г.С. Петров, К.Д.
Андрианов, американские ученые У. Карозерс, П. Флори, П. Морган. В
настоящее время по методу поликонденсации получают более 30% от
общего объема производства полимеров.
145.
КЛАССИФИКАЦИЯ И ТЕРМИНОЛОГИИПоликонденсация бифункциональных мономеров называется
линейной.
Поликонденсация, в которой участвует хотя бы один мономер,
имеющий более двух функциональных групп, трехмерной.
В каждом случае образуются, соответственно, линейные и
сетчатые полимеры
Важная
разновидность
поликонденсации
полициклоконденсация, при которой продукт линейной
поликонденсации подвергается внутримолекулярной циклизации
(протекает в две стадии: линейная поликонденсация, а затем
собственно
циклизация).
Применяется
для
получения
термостойких полимеров.
146.
По типу (и числу) участвующих в реакции мономеров различают:- гомополиконденсацию (участвует один мономер с различными
функциональными группами, например, получение полиамида из
аминокислоты - гетерофункциональная поликонденсация, или простого
полиэфира из гликоля - гомофункциональная поликонденсация);
- гетерополиконденсацию, когда взаимодействуют мономеры с
различными функциональными группами, например, получение
сложного полиэфира из гликолей и двухосновных кислот (иногда
встречается термин - сополиконденсация).
Поликонденсация - ступенчатый процесс, при котором мономеры,
взаимодействуя друг с другом, исчерпываются на сравнительно ранней
стадии реакции, а высокомолекулярный полимер образуется обычно в
результате реакции ранее образовавшихся олигомеров и полимерных
цепей при глубине превращения функциональных групп, близкой к
100% - в отличии от полимеризации, там высокомолекулярные
продукты образуются при невысоких степенях конверсии мономера.
Причем промежуточные олигомерные продукты при поликонденсации
можно выделить
147.
При поликонденсации часто возможны обратная и различныеобменные реакции. В зависимости от вклада этих реакций
различают равновесную (обратимую) поликонденсацию, когда
вклад указанных, особенно обратной, реакций велик и
неравновесную (необратимую), когда эти реакции не оказывают
практически влияния на процесс образования полимера.
К первой условно относят поликонденсацию с константой
равновесия (Кр ) больше 103, ко второй - с Кр менее 103 (обычно
0.1-10). При неравновесной поликонденсации обычно образуются
значительно более высокомолекулярные полимеры (ММ 100
000), чем при равновесной (ММ 20 000-30 000).
МОНОМЕРЫ
В качестве мономеров в поликонденсации используют
соединения, содержащие в молекуле не менее двух
функциональных групп. Их можно разделить на три основных
типа:
148.
1) Мономеры (например, диамины или дихлорангидридыдикарбоновых кислот), содержащие в молекулах одинаковые
функциональные группы, не способные в определенных условиях
реагировать между собой. Полимер в этом случае образуется в
результате
поликонденсации
разных
взаимодействовать друг с другом, например
мономеров,
способных
nH 2 NRNH 2 nClOCR COCl
HNRNHCOR CO n 2nHCl
2) Мономеры (например, гидроксикислоты или аминокислоты),
содержащие различные функциональные группы, которые способны
реагировать друг с другом, приводя к образованию полимера,
например:
nH 2 NRCOOH
RCONH n nH 2 O
3) Мономеры, содержащие одинаковые функциональные группы,
способные реагировать между собой в данных условиях,
например, гликоли, поликонденсация которых приводит к образованию
простых полиэфиров:
nHOROH
OR n nH 2 O
149.
Вусловиях
поликонденсации
возможны
случаи,
когда
функциональные группы одного или нескольких мономеров реагируют
как друг с другом, так и между собой, обусловливая появление
разнозвенности полимеров. Примером может служить образование,
наряду
со
сложноэфирными,
простых
эфирных
связей
(диэтиленгликольных фрагментов) при синтезе полиэтилентерефталата
из диметилтерефталата и этиленгликоля:
COOCH 3 + m HO-(CH2)2-OH
n H3COOC
H3COOC
O-(CH 2)2-O-(CH 2)2- -OH + x H2O + y CH3OH
n
Функциональность и активность функциональных групп мономера
зависит от его строения, условий поликонденсации и природы
реагирующего с ним мономера. При этом из определенных
полифункциональных мономеров (мономеры с числом функциональных
групп больше двух) получают как линейные, так и сетчатые полимеры.
150.
Примаер: при поликонденсации тетрафункциональныхмономеров -бис-(о-фенилендиаминов) с бис-( -дикетонами)
образуются линейные, плавкие и растворимые
полифенилхиноксалины
тогда как при реакции этих же тетрафункциональных мономеров с
дихлорангидридами
дикарбоновых
кислот
получаются
разветвленные и сетчатые полиамиды
Поэтому
различают
возможную,
практическую
и
относительную (определяется как отношение практической
функциональности
к
возможной)
функциональности
мономеров.
151.
Часто ограничиваются рассмотрением средней функциональности:nf
f
n
т.е. среднее количество функциональных групп, приходящихся на одну
молекулу.
Для поликонденсации чаще всего используются мономеры с амино-,
кар-бокси-, гидрокси-, меркаптогруппами, из которых получают
важнейшие типы поликонденсационных полимеров.
В отличие от полимеризации, при которой для получения
определенного
полимера
обычно
требуется
один
мономер,
поликонденсационные полимеры одного типа можно синтезировать из
мономеров с самыми разнообразными функциональными группами. В
принципе можно использовать любые реакции образования химических
связей С-С, С-О и др.
152.
Например,при
получении
сложных
полиэфиров
гидроксилсодержащие
мономеры
могут
быть
заменены
на
галогенсодержащие или сложные эфиры, а вместо карбоновых кислот
можно использовать их хлорангидриды, эфиры, соли, ангидриды и т.п.
Естественно, что при такой замене меняются закономерности и
условия поликонденсации, тип катализа, характер концевых групп в
образующихся макромолекулах и, кроме того, появляются возможности
получения полимеров с заданным комплексом технологических и
эксплуатационных свойств.
ОСНОВНАЯ И ПОБОЧНЫЕ РЕАКЦИИ
В общем виде схема основной реакции поликонденсации - роста
цепи - может быть представлена следующим образом:
X-(-R1-)n-X + Y-(-R2-)m-Y
X-(-R1-)n-(-R2-)mY + xy
где n и m - любое целое число, включая единицу, Х и Y-исходные
функциональные
группы, xy - низкомолекулярный продукт
поликонденсации.
153.
При этом взаимодействие мономеров или образовавшихсяолигомеров друг с другом (и олигомеров и мономеров между
собой) подчиняется практически одним и тем же законам.
Поскольку
в
отличие
от
полимеризации,
при
поликонденсации мономеры исчерпываются уже при
невысоких степенях завершенности реакции, рост цепи
высокомолекулярного полимера происходит преимущественно в
результате многократного соединения между собой олигомерных
или полимерных молекул по концевым функциональным группам
(принцип многократного удвоения), при этом число молекул в
системе уменьшается (в этом ступенчатый характер
поликонденсации).
Уменьшается в ходе поликонденсации и количество исходных
функциональных групп - реакционных (активных) центров, хотя в
ряде случаев образующиеся при поликонденсации связи могут
разрываться под действием исходных реакционных центров или
под действием функциональых групп низкомолекулярных
продуктов поликонденации.
154.
Таким образом росту полимерной цепи при равновеснойполиконденсации сопутствует обратная реакция полимера с
выделяющимся низкомолекулярным продуктом, что ограничивает
молекулярную массу полимера.
При поликонденсации функциональные группы мономеров,
олигомеров и полимерных цепей расходуются не только на рост цепи, но
и на побочные реакции (реакции с монофункциональными примесями
или со специально введенными в процесс веществами, могут менять
свою функциональность группы, например, декарбоксилирование
карбоновых кислот и др.), что также лимитирует молекулярную массу
образующегося полимера.
При поликонденсации возможны также циклизация и обменные
реакции.
Циклизация может быть внутримолекулярной, когда кольца
образуются при реакции функциональных групп одной молекулы, или
межмолекулярной при взаимодействии двух или более молекул
одинаковой или различной природы, например:
155.
Возможностьфакторов:
циклизации
определяется
соотношением
двух
1) снижения вероятности образования цикла по мере увеличения его
размера (увеличение энтропии активации);
2) напряженности цикла, которая уменьшается при увеличении его
размера вплоть до 6-членного, затем возрастает при изменении числа
членов в цикле от 6 до 9-11, а затем вновь снижается при переходе к еще
большим циклам.
156.
В результате совместного действия обоих этих факторов приполучении методом поликонденсации различных полимеров возможно
образование больших циклов (20-40-членных). Циклообразованию
способствует проведение реакции в сильно разбавленных растворах.
Обменные реакции особенно эффективны при повышенных
температурах поликонденсации. Их делят на два основных типа:
1) реакции обмена образовавшихся при поликонденсации групп
(сложноэфирной, амидной или др.) и даже некоторых циклов (например,
имидного) с функциональными группами мономеров или примесей
(например, алкоголиз, ацидолиз, аминолиз);
2) реакции межцепного обмена между образовавшимися при
полимеризации одно- или разнотипными группами (например, эфиролиз,
амидолиз).
Эффективность обменных реакций зависит от соотношения
скоростей основной и побочных реакций. Обменные реакции могут
существенно
влиять
на
молекулярную
массу
и
ММР
поликонденсационного полимера, микроструктуру сополимера.
157.
В ряде случаев обменные реакции положены в основу полученияполиконденсационных гомо- и сополимеров, например, синтез
полиэтилентерефталата
переэтерификацией
диметилтерефталата
этиленгликолем (см. реакцию выше).
Ограничение роста полимерной цепи может быть обусловлено и
чисто физическими причинами, например, преждевременным
выпадением полимера из реакционной среды в осадок при
поликонденсации в растворе (особенно если это сопровождается его
кристаллизацией), однако если выпадающий из раствора полимер
набухает в реакционной среде, рост цепи часто не прекращается.
158.
КИНЕТИКА, КАТАЛИЗ, МОЛЕКУЛЯРНО-МАССОВОЕРАСПРЕДЕЛЕНИЕ
Своеобразие поликонденсации, существенно отличающее ее от
полимеризации, заключается в следующем:
исчезновение мономеров в реакционной среде, как уже отмечалось,
наступает задолго до образования полимера достаточно высокой степени
полимеризации, или молекулярной массы;
в большинстве случаев (при поликонденсации в гомогенных
условиях) получение полимера высокой молекулярной массы возможно
лишь при очень высокой (близкой к количественной) степени
завершенности реакции (глубине превращения).
Это наглядно иллюстрирует следующая зависимость средней
полимеризации ( p ) полимера от степени завершенности реакции (х):
1
p
1 x
степени
159.
Поэтому особенно важно изучение кинетики поликонденсации припротекании в гомо- или гетерогенных условиях.
Кинетика поликонденсации, включающей бесконечное число актов
роста цепи, как правило, с трудом поддается количественному анализу.
Для его упрощения вводят следующие допущения (допущения Флори):
1) реакционные способности обеих однотипных функциональных
групп бифункционального мономера одинаковы;
2) реакционная способность одной функциональной группы
бифункционального мономера не зависит от того, прореагировала или
нет другая группа;
3) реакционная способность функциональной группы не зависит от
размера молекулы, с которой она связана.
При этом описание кинетики поликонденсации становится таким
же, как кинетики аналогичных реакций низкомолекулярных
соединений.
160.
Во многих случаях указанные допущения перестают бытьсправедливыми: имеются бифункциональные мономеры, у
которых однотипные функциональные группы различны по
активности или у которых реакционная способность второй
функциональной группы уменьшается или возрастает после того,
как прореагировала первая.
Кинетику поликонденсации описывают обычно до степени
завершенности реакции 0,90-0,95, т.е. когда высокомолекулярный
полимер в реакционной системе практически еще отсутствует.
Кинетическое исследование реакций поликонденсации, в
которых допущения Флори не выполняются, а также
заключительных стадий поликонденсации (собственно реакций
полимерообразования), когда существенную роль начинают
играть диффузионные факторы, требует применения более
сложных кинетических уравнений и систем уравнений, которые
численно решаются с помощью вычислительной техники.
161.
Кинетическая и другие характеристики равновеснойнеравновесной поликонденсации сильно различаются.
и
Равновесная поликонденсация характеризуется малыми скоростями
[константа скорости 10-3 ~ 10-5 л/(моль с)], сравнительно большими
значениями энергии активации (80-160 кДж/моль), она может быть как
экзо-, так и эндотермической.
Неравновесная поликонденсация обычно протекает с высокой
скоростью [константа скорости до 105 л/(моль с)], как правило, она
сильно экзотермична и характеризуется низкими значениями энергии
активации (8-40 кДж/моль).
Максимально
возможная
молекулярная
масса
полимера,
получаемого
равновесной
поликонденсацией
определяется
термодинамическими факторами и может быть определена по
уравнению:
p Kp
x y
где
[xy]
концентрация
низкомолекулярного
поликонденсации в реакционной системе.
продукта
162.
МnИз
этого
соотношения
следует,
что
для
получения
высокомолекулярных полимеров поликонденсацию следует проводить в
условиях, максимально благоприятствующих удалению или связыванию
низкомолекулярного продукта, например, в вакууме, и токе инертного
газа, при высоких температурах, в случае связывания выделяющейся
кислоты растворителем.
В неравновесной поликонденсации молекулярная масса полимера не
определяется термодинамическими факторами; большое значение для
получения высокомолекулярных полимеров в этом процессе имеет
уменьшение вклада побочных реакций.
Например, как влияют условия синтеза полиамида на его
молекулярную массу:
Условия синтеза
в запаянной ампуле
в колбе с продувкой N2
в колбе с продувкой N2 c нагревом
4 000
14 000
26 000
под вакуумом 3 мм Hg столба
32 000
Мn
163.
Процессы поликонденсации можно проводить как в одну, так и внесколько стадий, каждая из которых может быть равновесной или
неравновесной, и в широком диапазоне температур. В этой связи важно
знать не только константу равновесия всего процесса или отдельных его
стадий, но и зависимость ее от температуры.
Кинетика поликонденсации в гетерогенных системах, когда
появляется граница раздела, должна учитывать распределение между
фазами реагентов, их поверхностную активность, различные процессы
массопереноса и другие факторы. Таким образом, кинетика
поликонденсации (межфазная поликонденсация) может определяться не
только химическим взаимодействием функциональных групп, но и
диффузионными факторами.
Для ускорения поликонденсации используют различные приемы:
- активацию функциональных групп (например, замена
карбоксильных групп на хлорангидридные или сложноэфирные группы,
содержащие остатки сильно кислых фенолов, например, нитрофенола);
- применение активных растворителей (ДМФА, ДМСО, N,Nдиметил-ацетамида, N-метилпирролидона);
164.
- введение активирующих агентов (например, пиридина итрифенилфосфита при поликонденсации дикарбоновых кислот и
диаминов);
- катализ.
Катализаторами служат карбоновые кислоты, их соли, алкоголяты,
третичные амины, сложные эфиры, фосфорные кислоты и многие другие
соединения или их смеси, ускоряющие отдельные стадии
поликонденсации, например, синтез полиэтилентерефталата в
присутствии ацетатов металлов и Sb2O3.
Некоторые соединения, например краун-эфиры, четвертичные
аммониевые и фосфониевые соли, применяемые для катализа
поликонденсации, протекающей в гетерогенных условиях, являются
катализаторами межфазного переноса, облегчая перенос реагентов из
одной фазы в другую, например, из водной в органическую.
Процессы поликонденсации могут быть:
- автокаталитическими (синтез полиамидокислот
тетракарбоновых
кислот
и
диаминов,
полиамидокислотой),
- - самокатализируемыми (синтез сложных
дикарбоновых кислот и диолов, катализируемый
кислотами.
из диангидридов
катализируемый
полиэфиров из
дикарбоновыми
165.
Катализаторы применяют как в истинно каталитическихколичествах (молярные проценты), так и в значительно больших
(например, в стехиометрических) в тех случаях, когда катализатор
выполняет также роль акцептора низкомолекулярного продукта
поликонденсации, например, поликонденсация бисфенолов и
дихлорангидридов дикарбоновых кислот в присутствии третичных
аминов (акцепторно-каталитическая поликонденсация).
ММР полимера, получаемого линейной поликонденсацией, часто
описывается уравнением:
Pn x n 1 (1 x )
где Pn - молярная или численная доля х-меров.
Это распределение обычно называется наиболее вероятным или
распределением Флори.
Необходимым условием образования высокомолекулярного полимера
при линейной поликонденсации является стехиометрическое
соотношение реагирующих функциональных групп.
166.
В этом случае справедливо уравнение Карозерса:2
p
2 xf
Например, при поликонденсации глицерина и фталевой кислоты
(или фталевого ангидрида):
f
а
при
3 2 2 3
2.4,
3 2
2p 2 2
2
x
fp
f
fp
p
x
2
2
0
0.83,
f
2.4
т.е. при этой глубине превращения возможно образование сшитого
полимера!
167.
Таким образомx к р ит.
2
f с р.
Если
f 1 , а х=1, тогда p 2 , т.е. полимер не образуется, а
.
только димер.
1
При f 2 p
, т.е. при х=0.9 p 10 , а при х=0.998 p 500
1 x
При отклонении от стехиометрического соотношения обычно
образуются более низкомолярные полимеры. Степень полимеризации
полимера, синтезируемого при избытке (или недостатке) одного из
мономеров, может быть определена по уравнению:
1 r
p
1 r 2rx
где r -стехиометрический разбаланс, т.е. соотношение количеств
функциональных групп обоих мономеров.
168.
При х = 1 указанное уравнение принимает вид:1 r
p
1 r
Поликонденсация при заданном избытке одного из мономеров способ регулирования молекулярной массы полимеров и получения
реакционноспособных полимеров или олигомеров (блоков) с
определенным типом функциональных групп; их затем используют в
синтезе высокомолекулярных полимеров.
Так поступают, например, при синтезе полиуретанов; вначале из
дикарбоновых кислот и избытка гликолей получают сложные полиэфиры
с концевыми группами ОН, а затем проводят их взаимодействие с
диизоцианатами.
Примеси монофункциональных соединений также уменьшают
степень полимеризации:
p 1N
где N - мольная доля монофункциональных соединений по
отношению к бифункциональным соединениям одинаковой химической
природы.



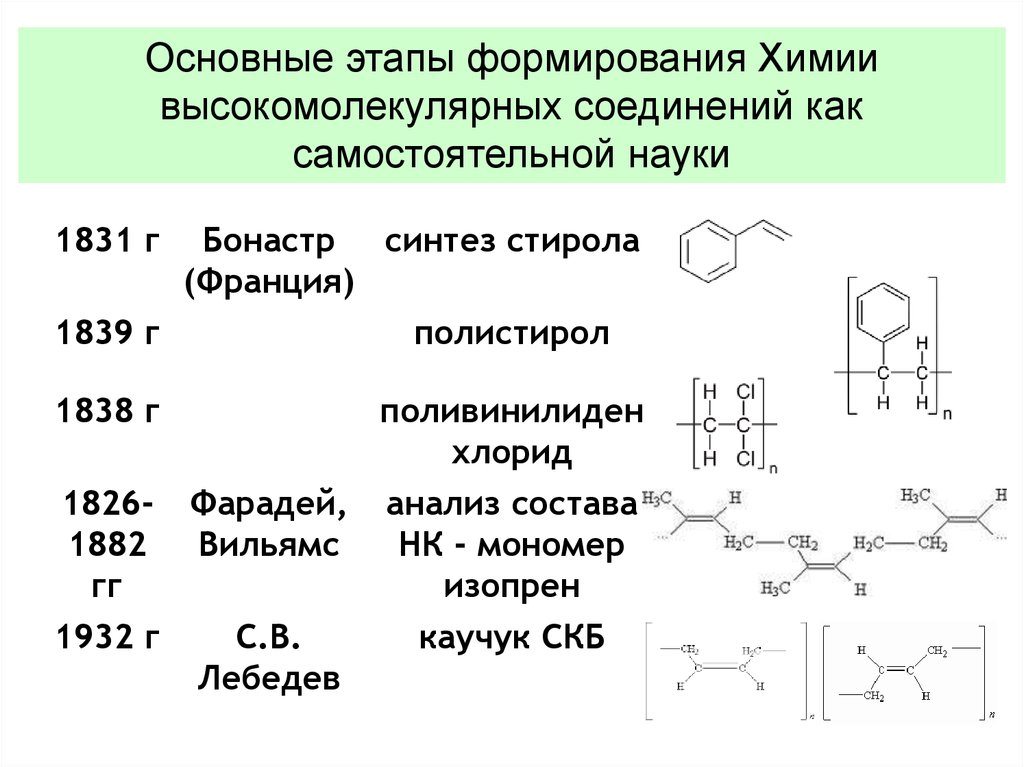
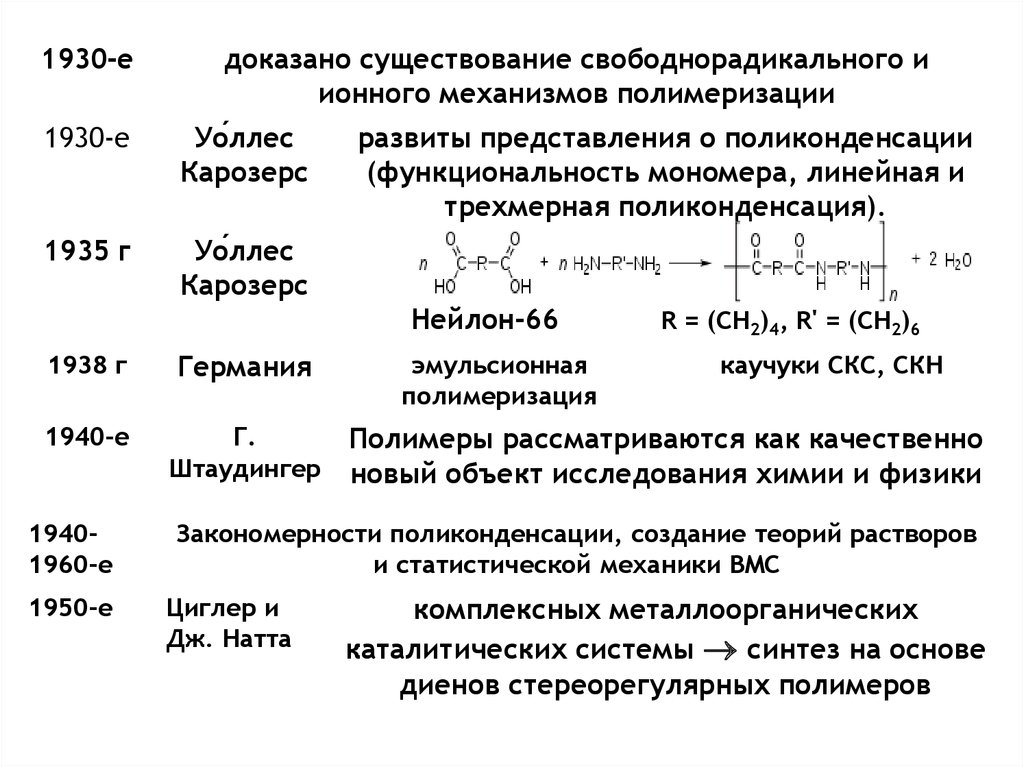



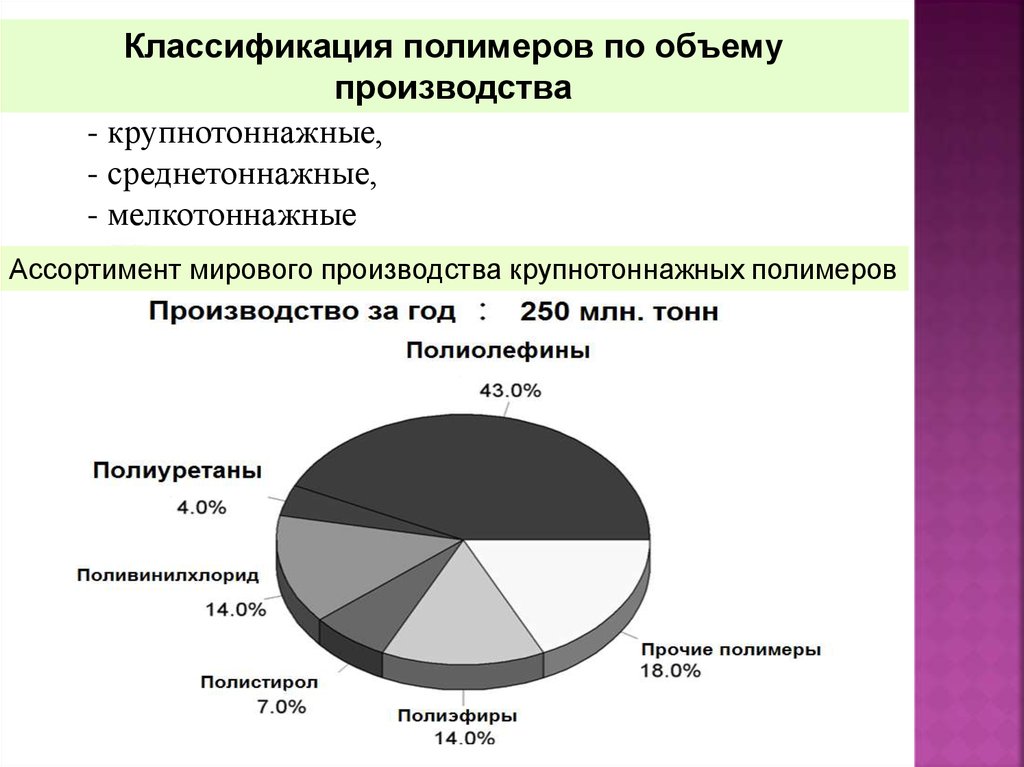



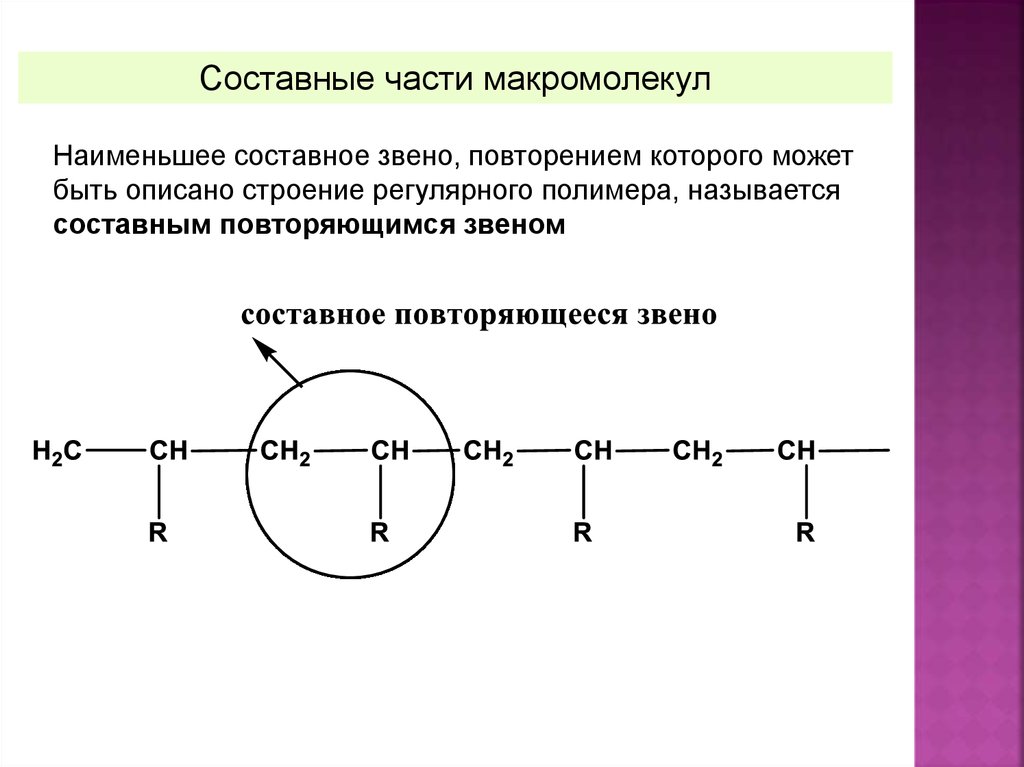
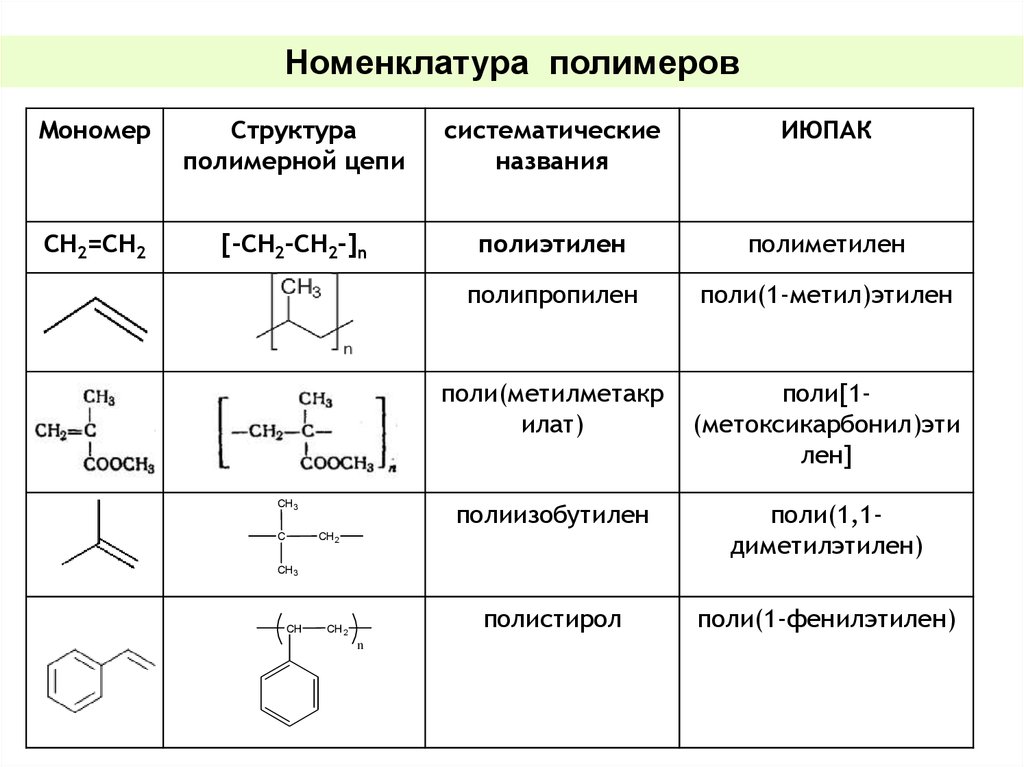



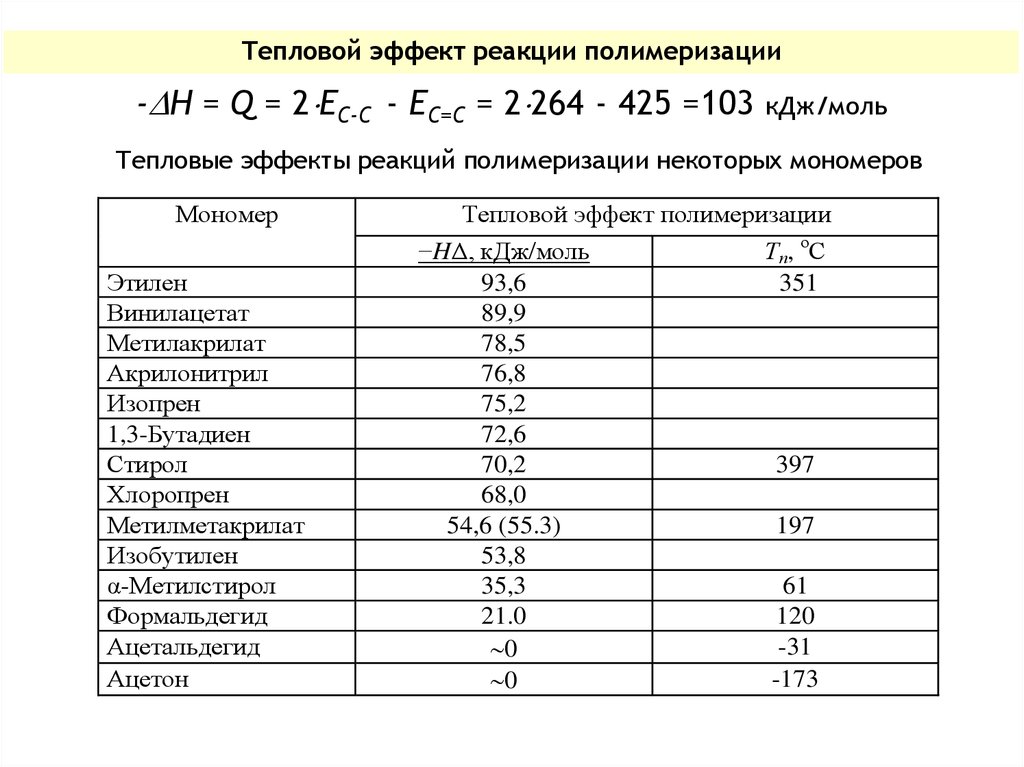







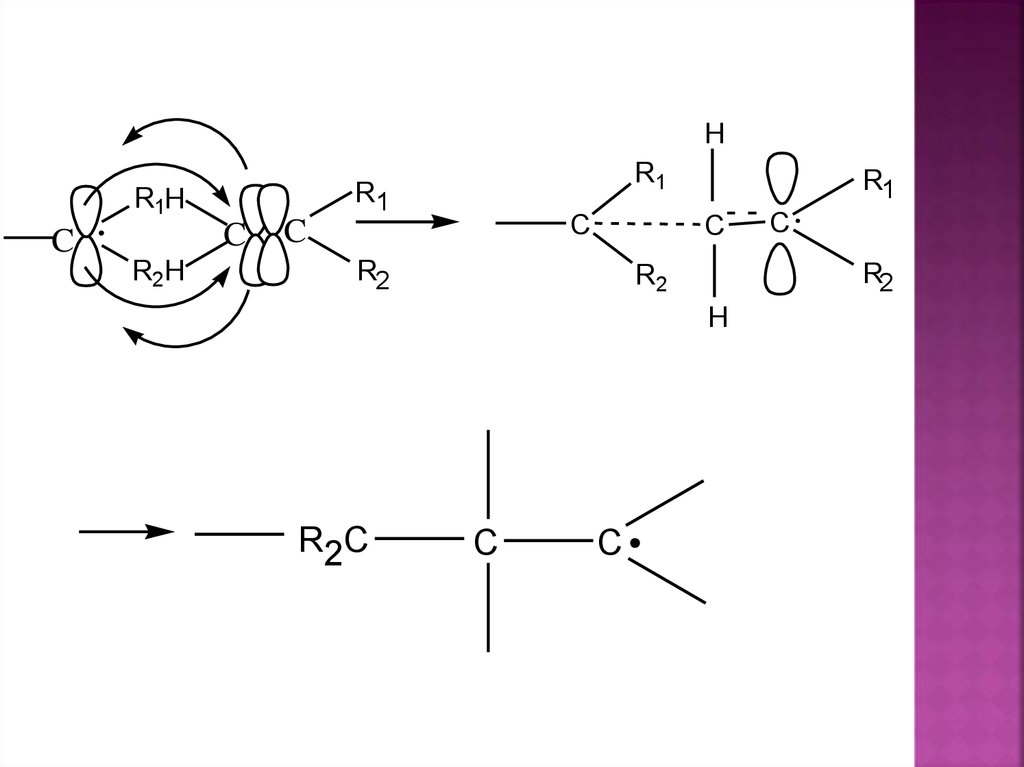



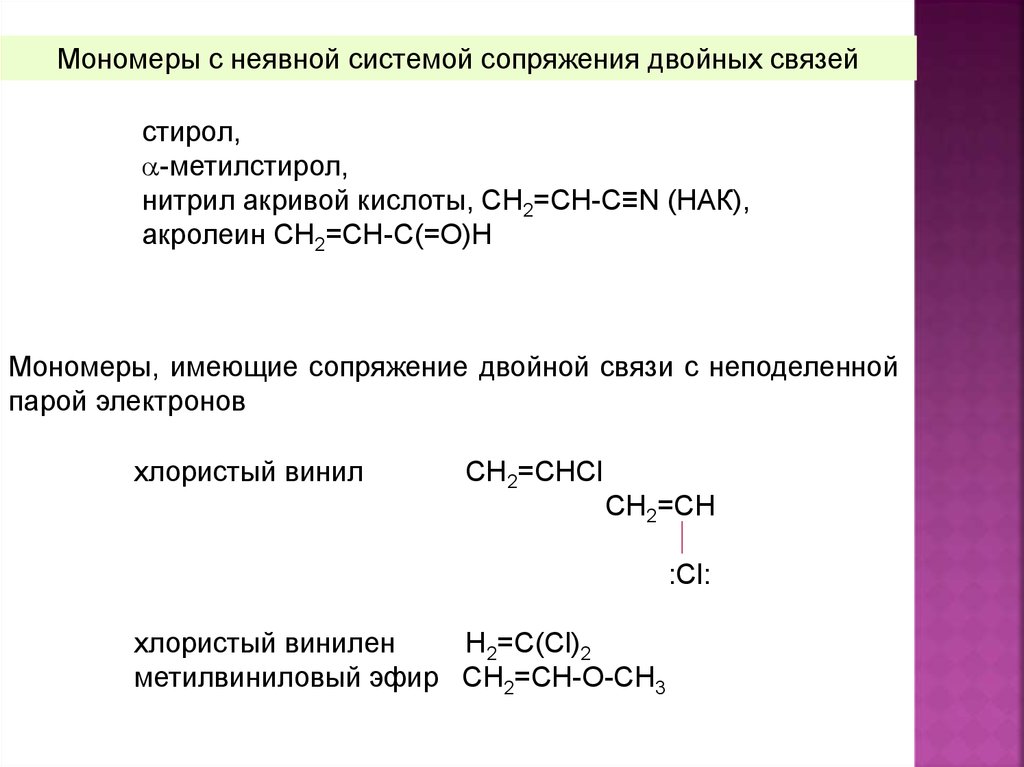

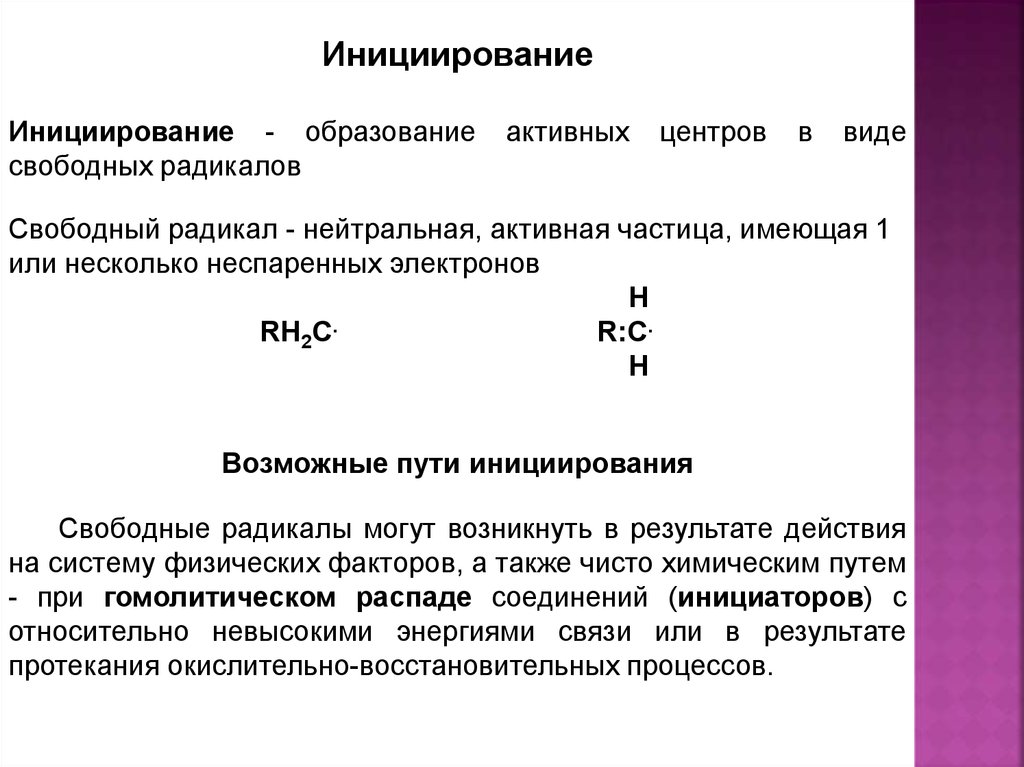






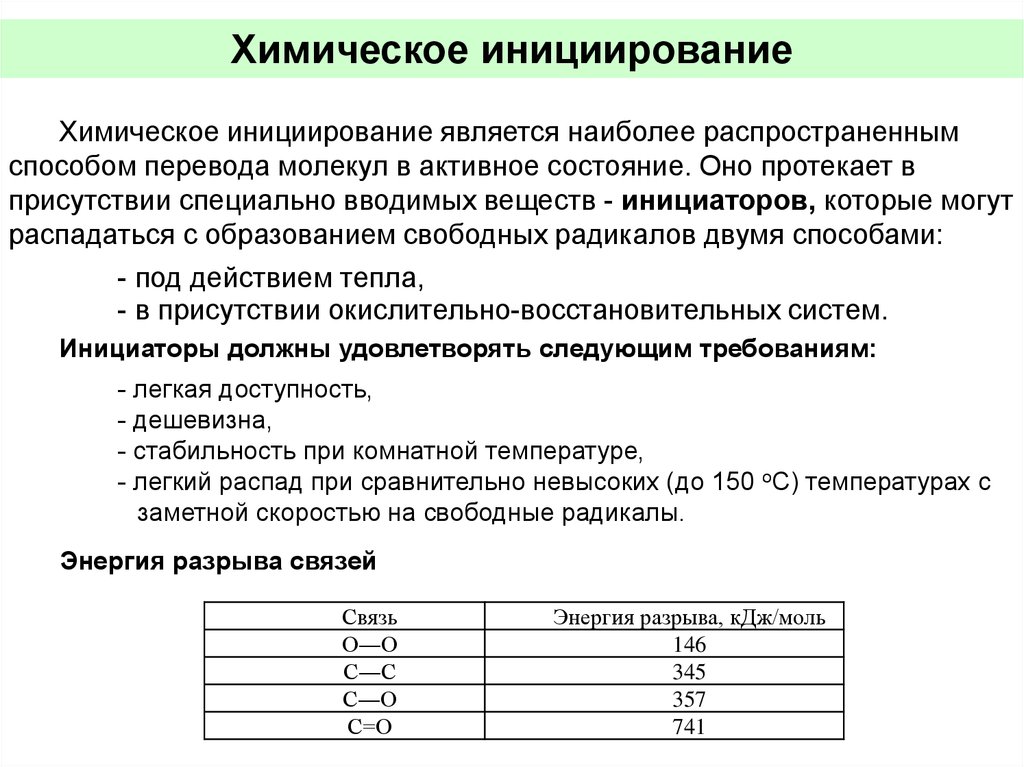
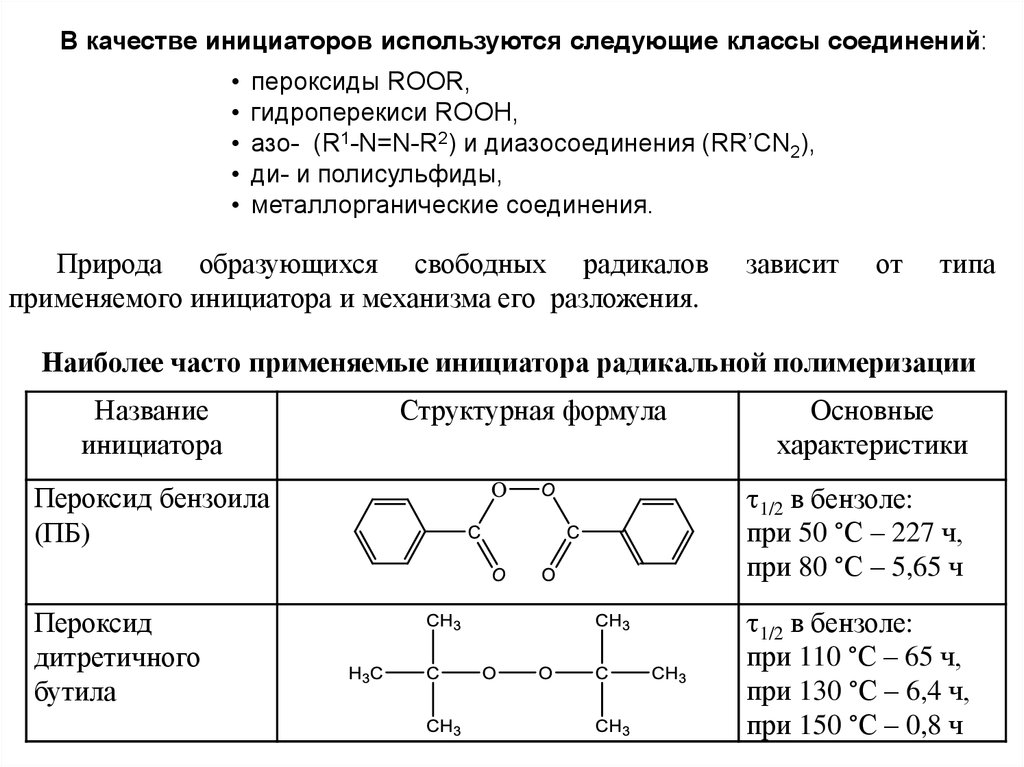
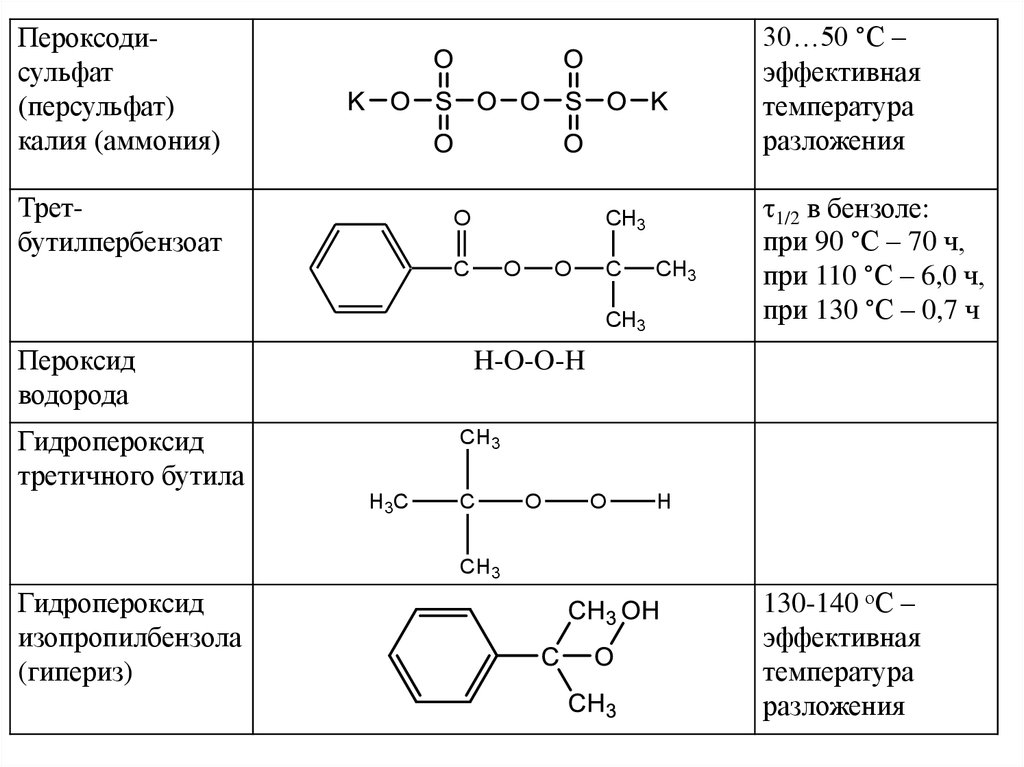
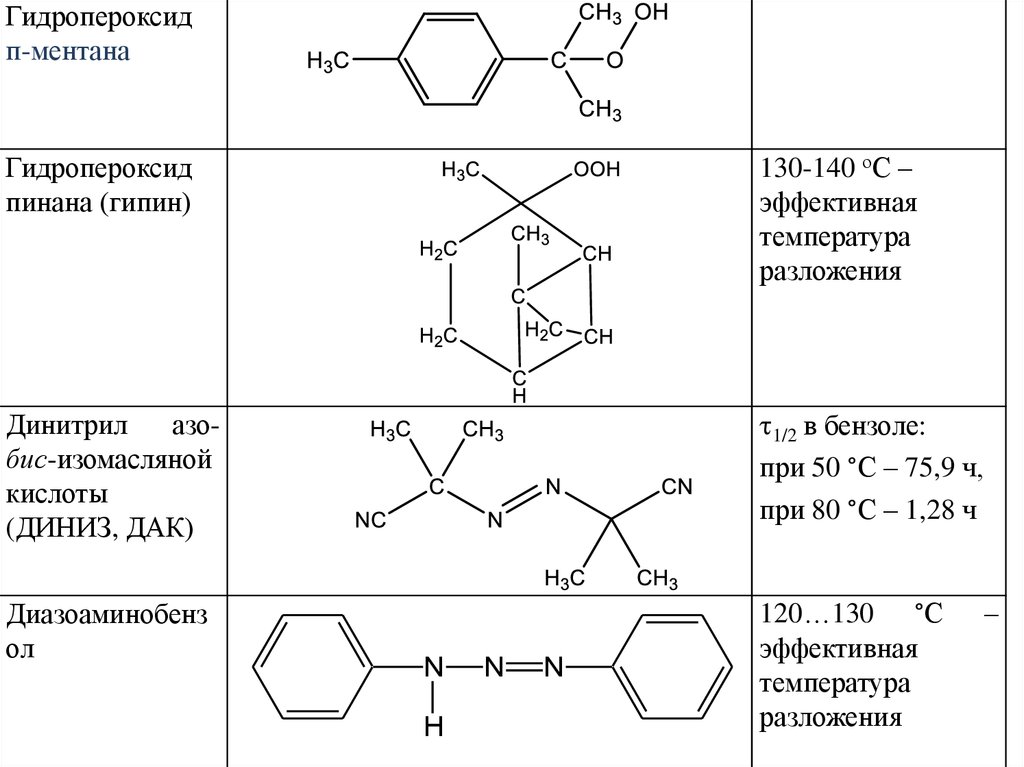
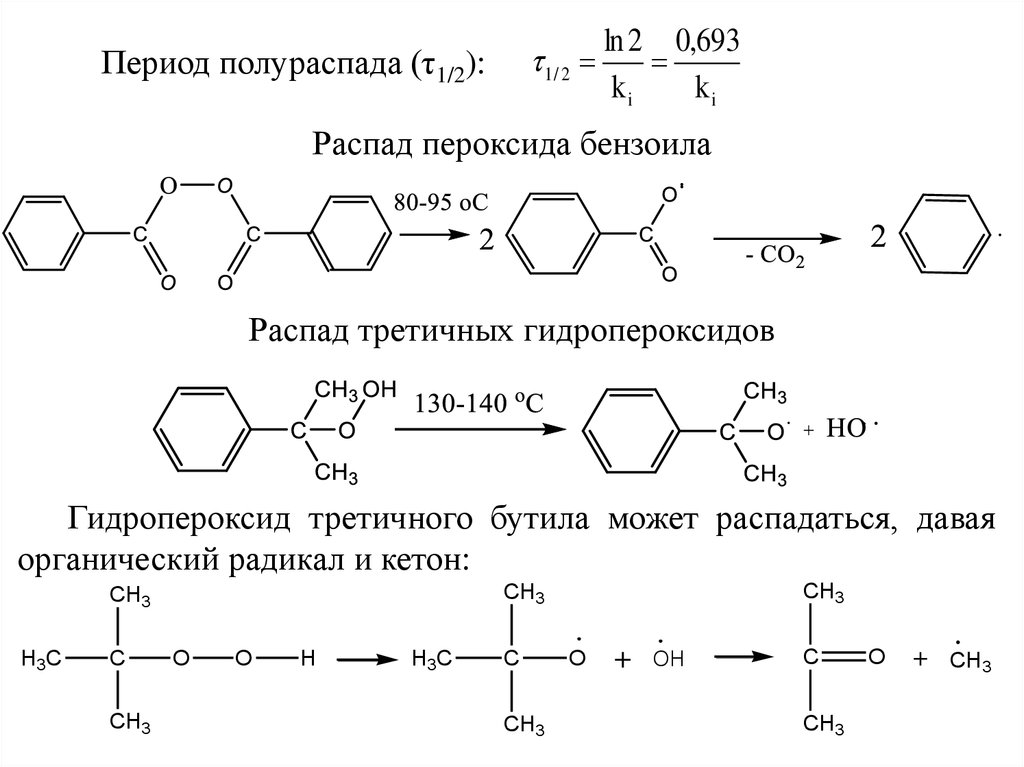




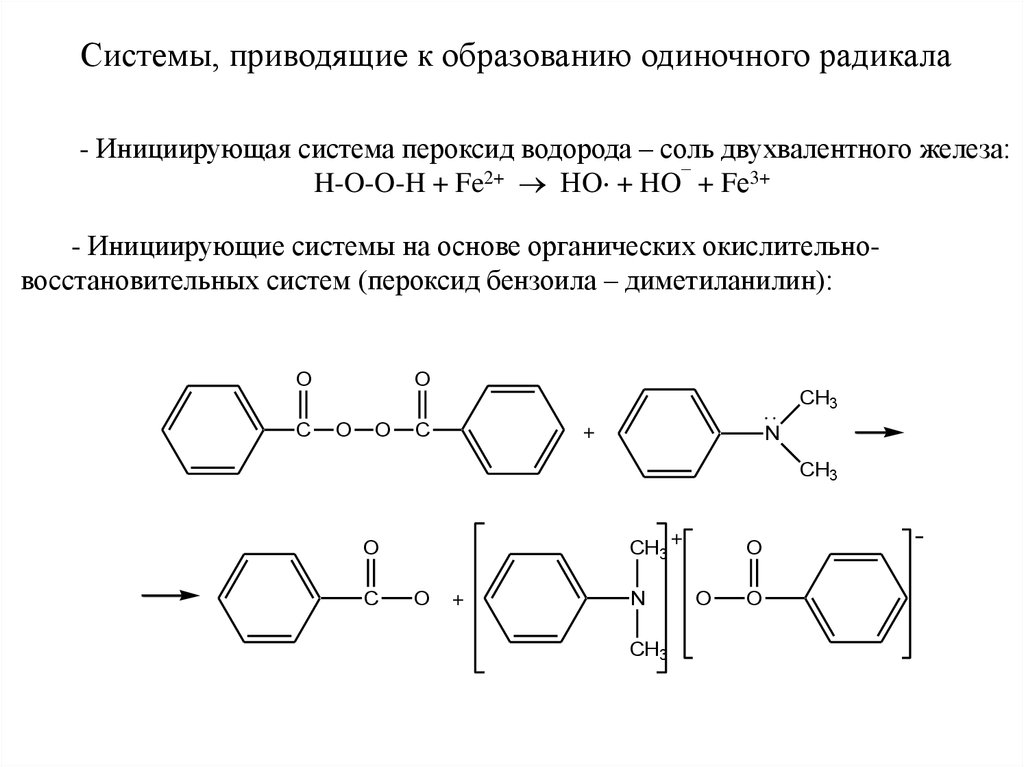
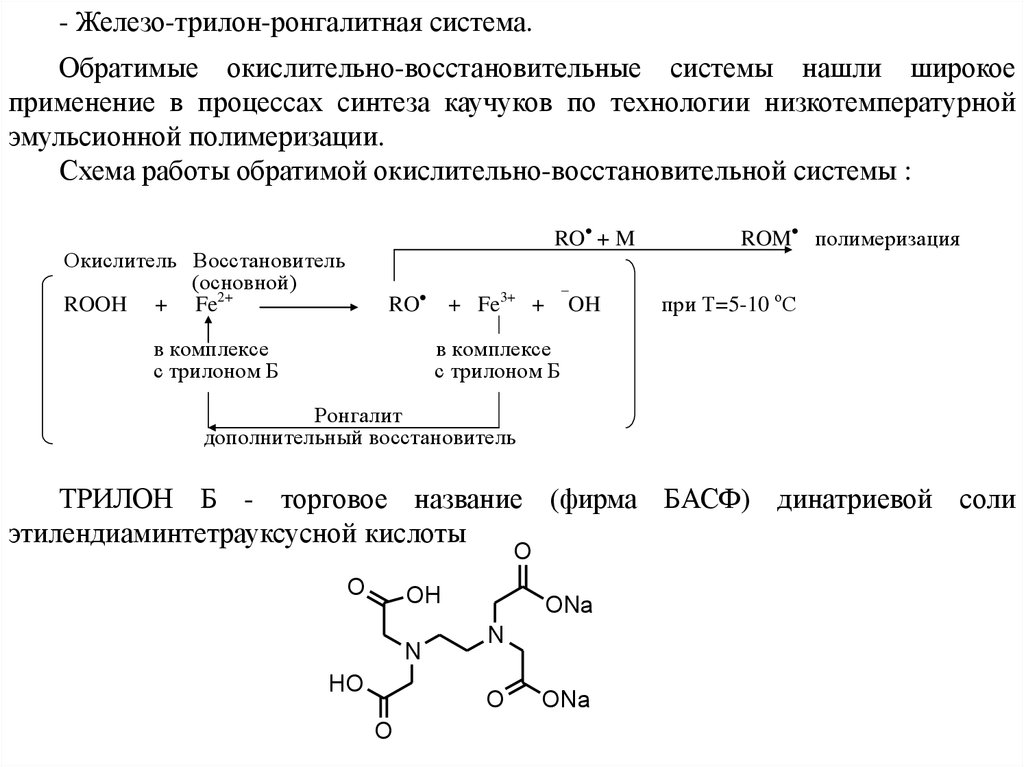
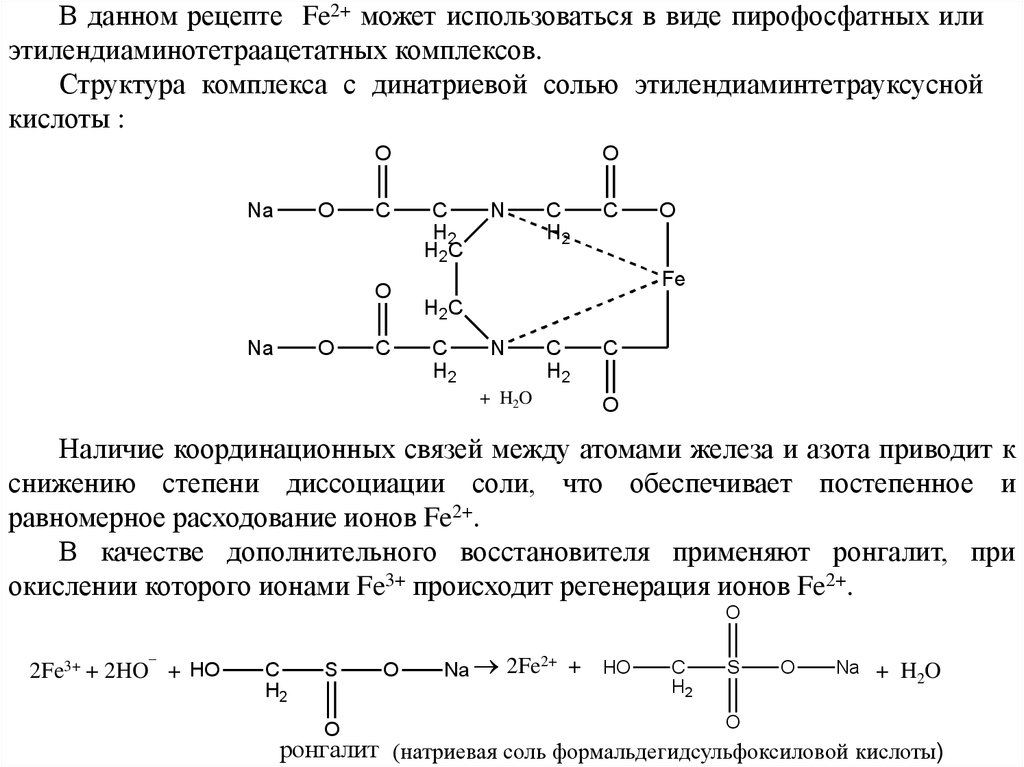











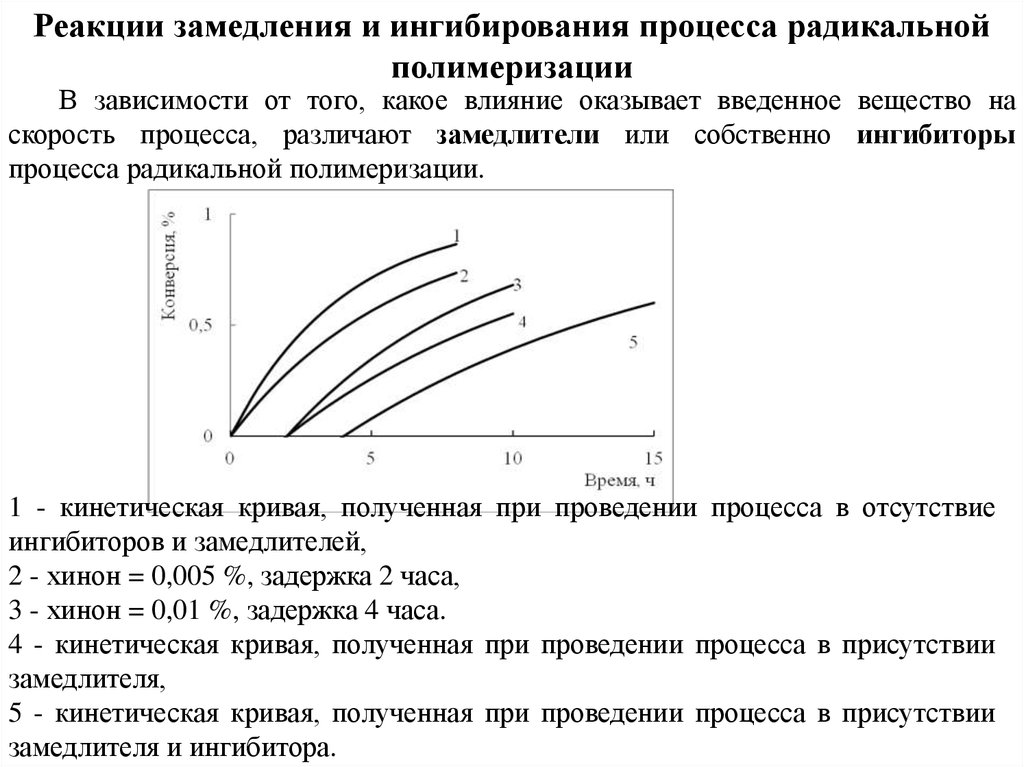
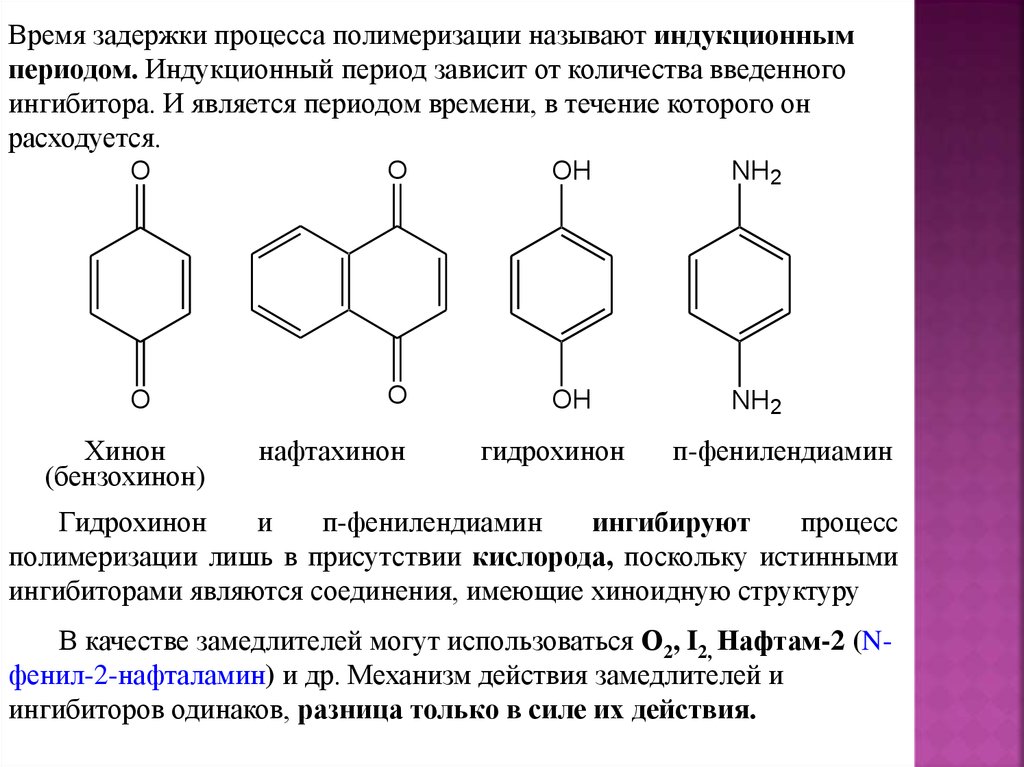
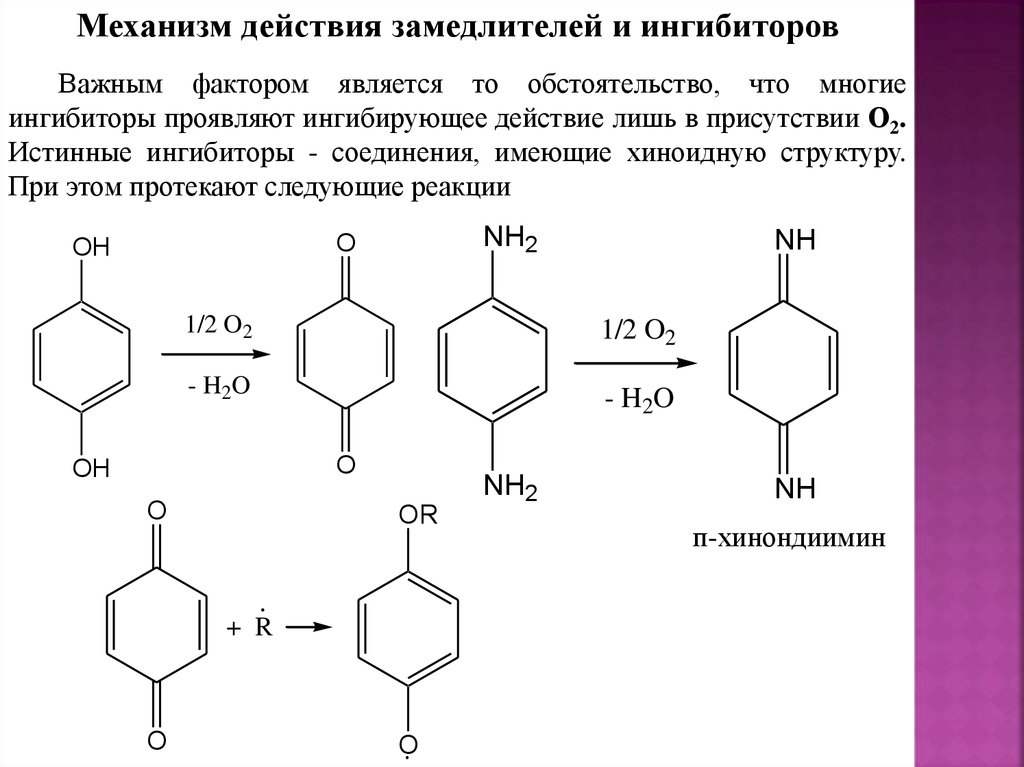
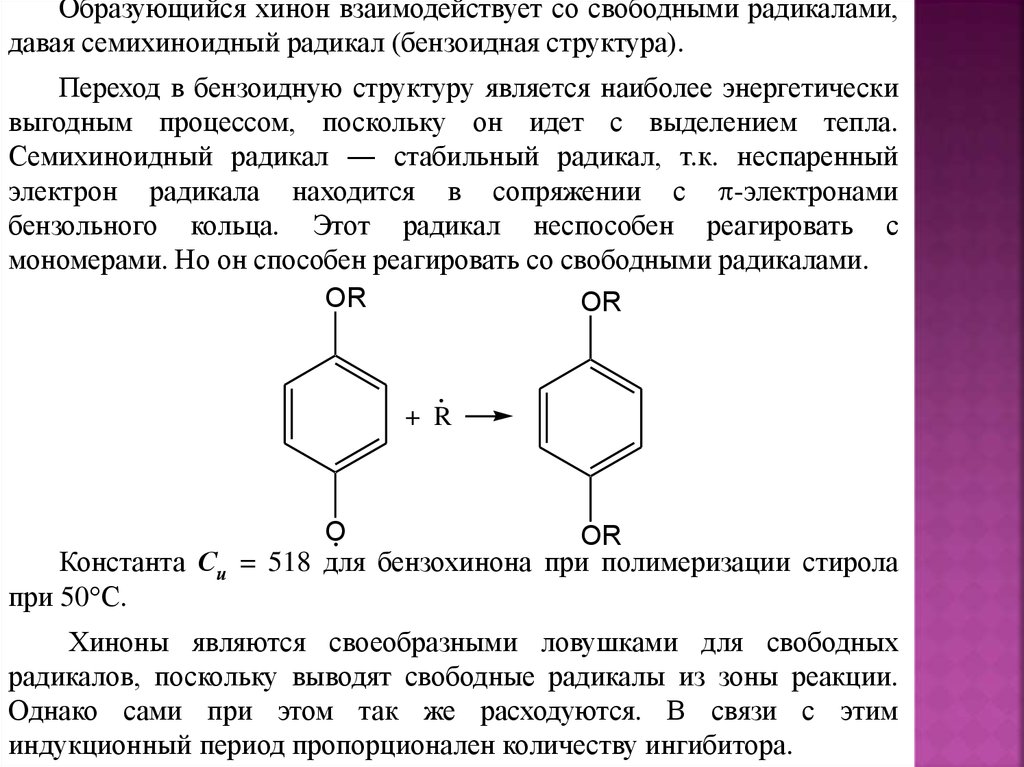



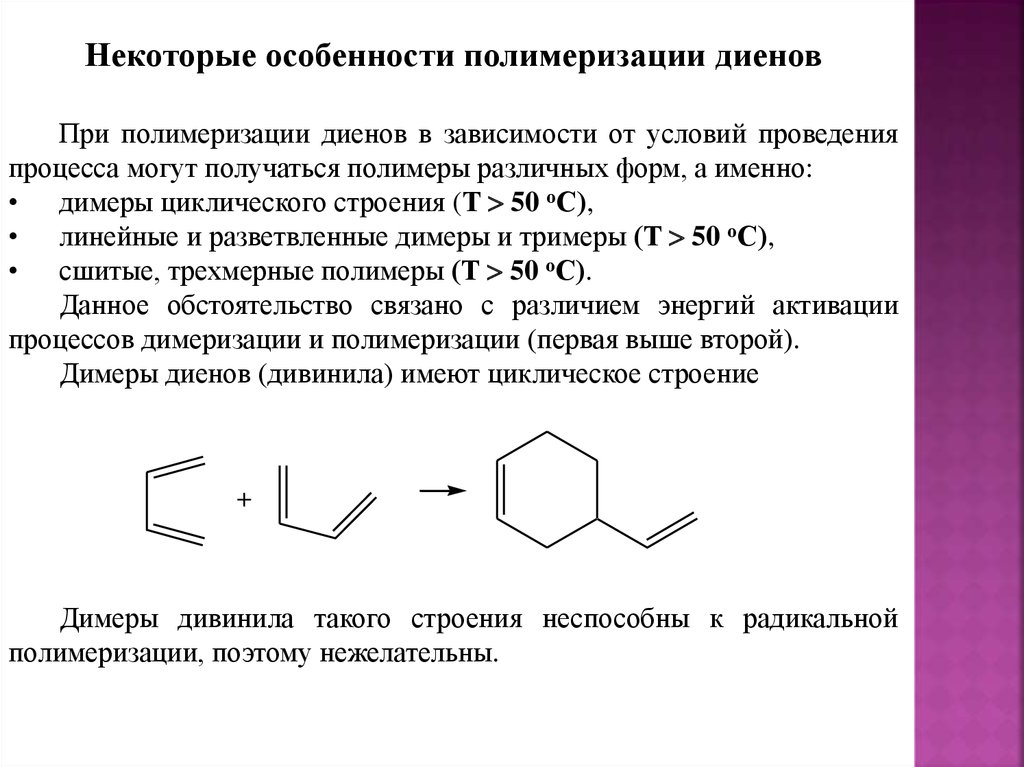










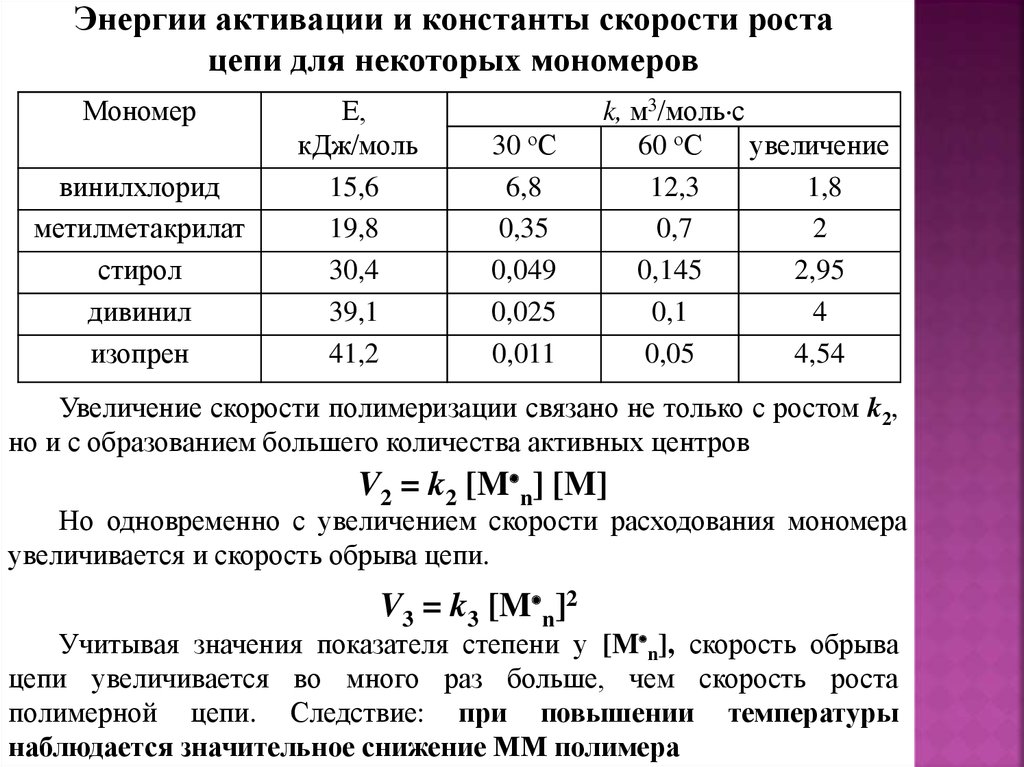






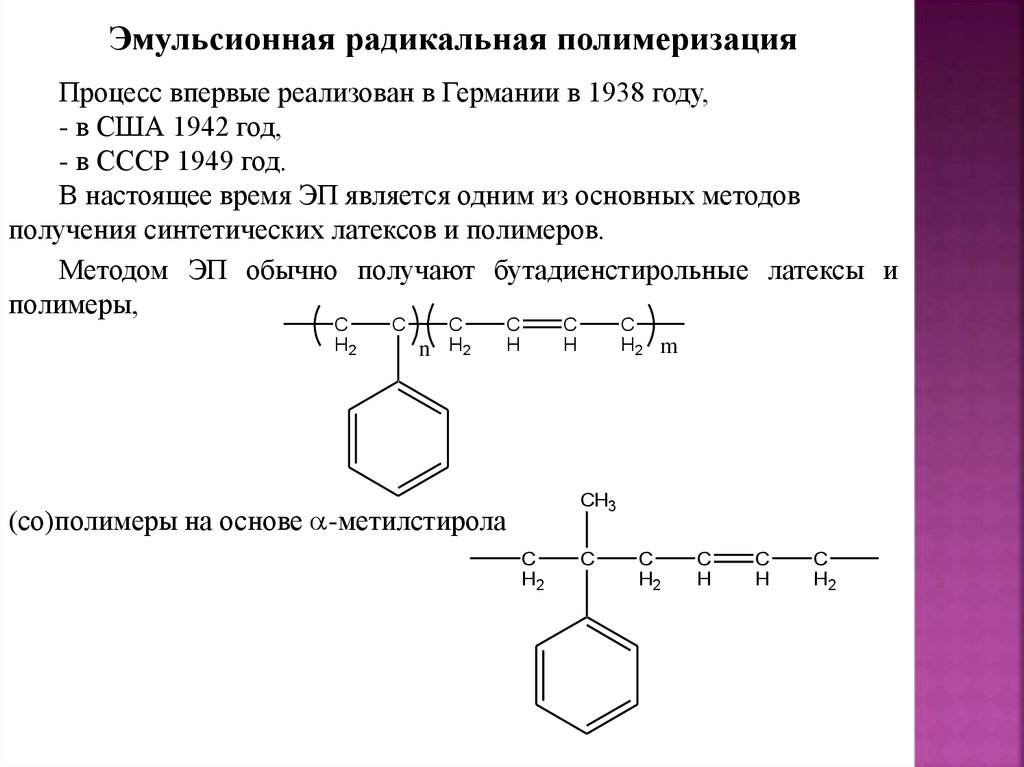










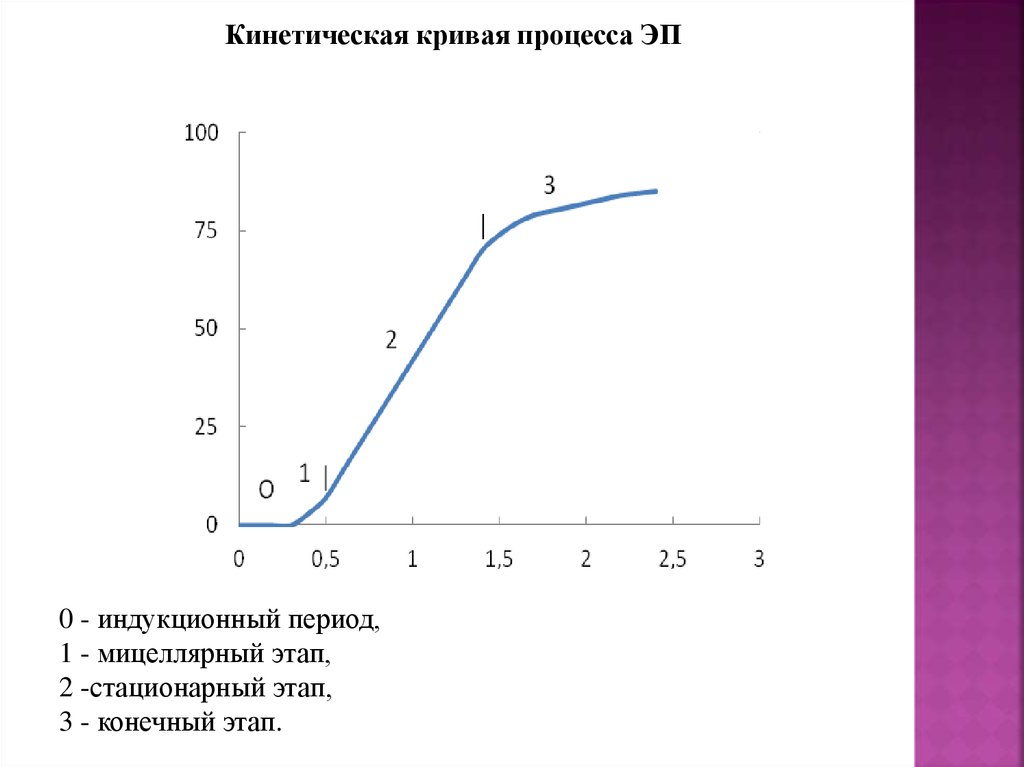
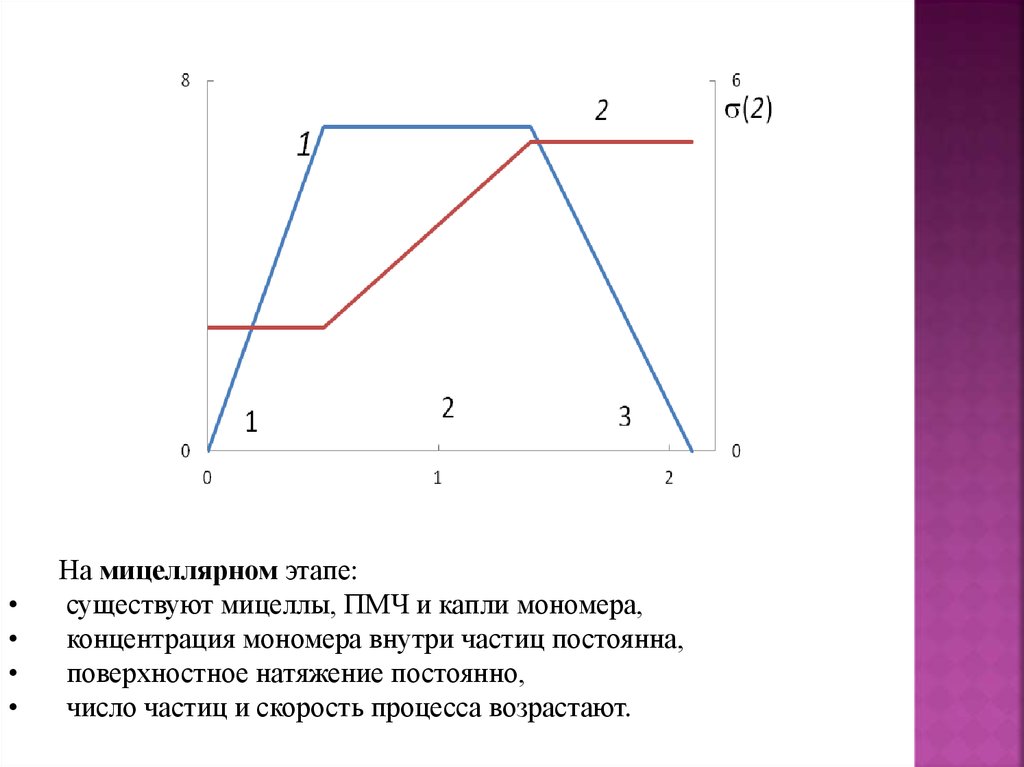







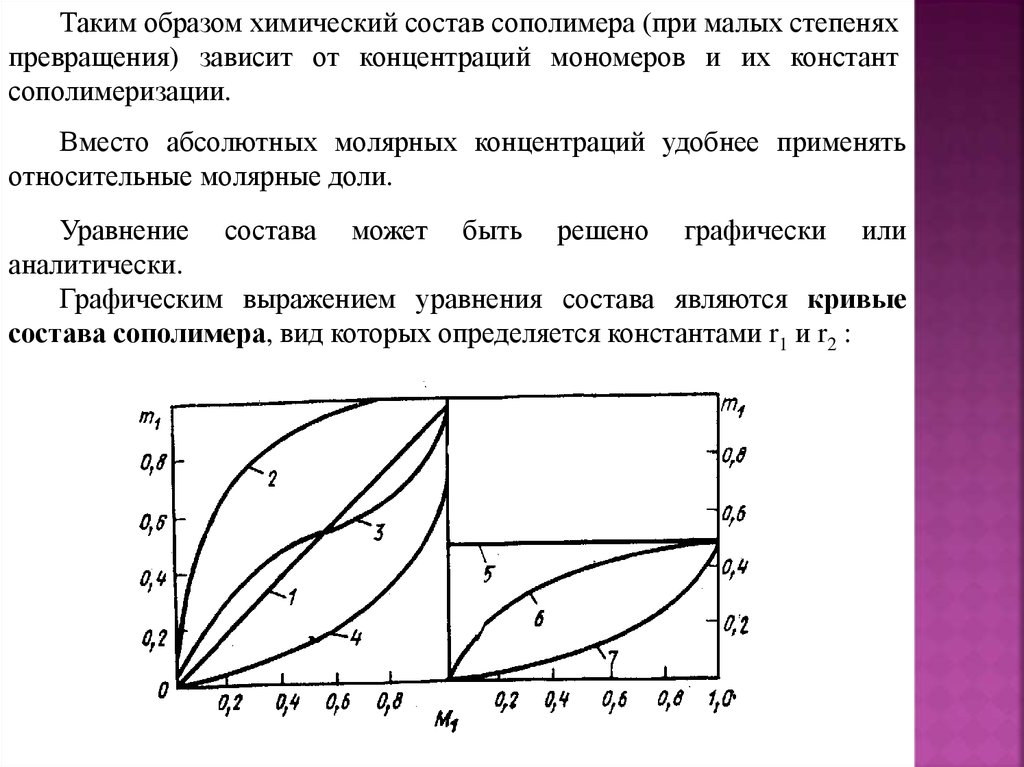
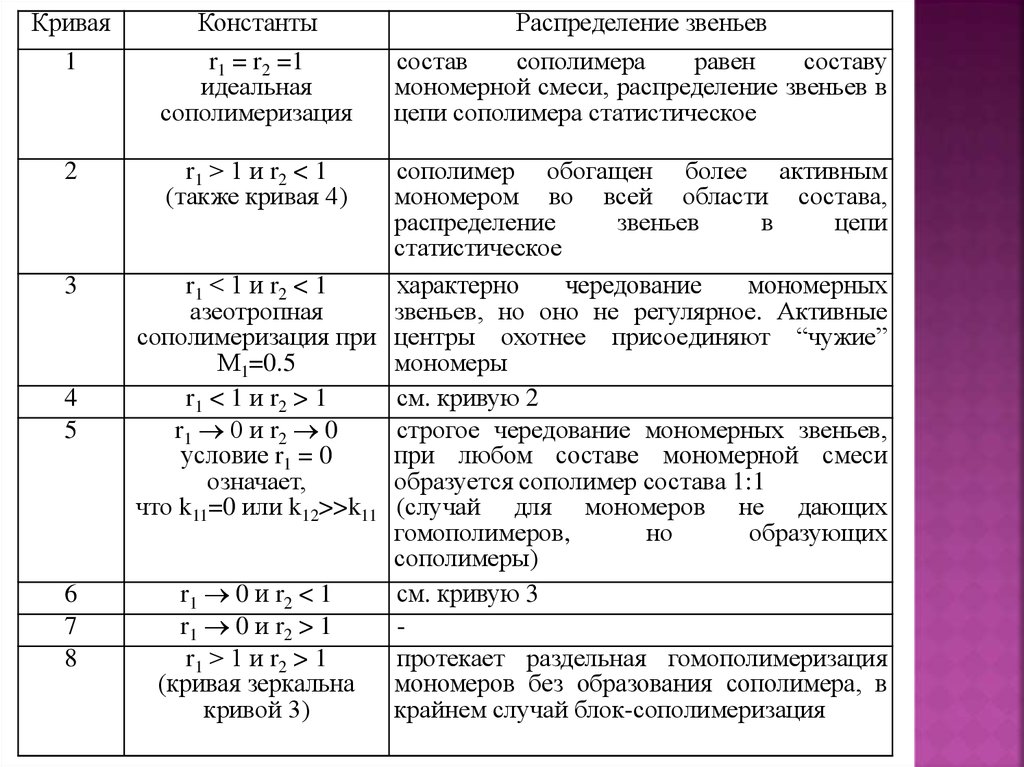





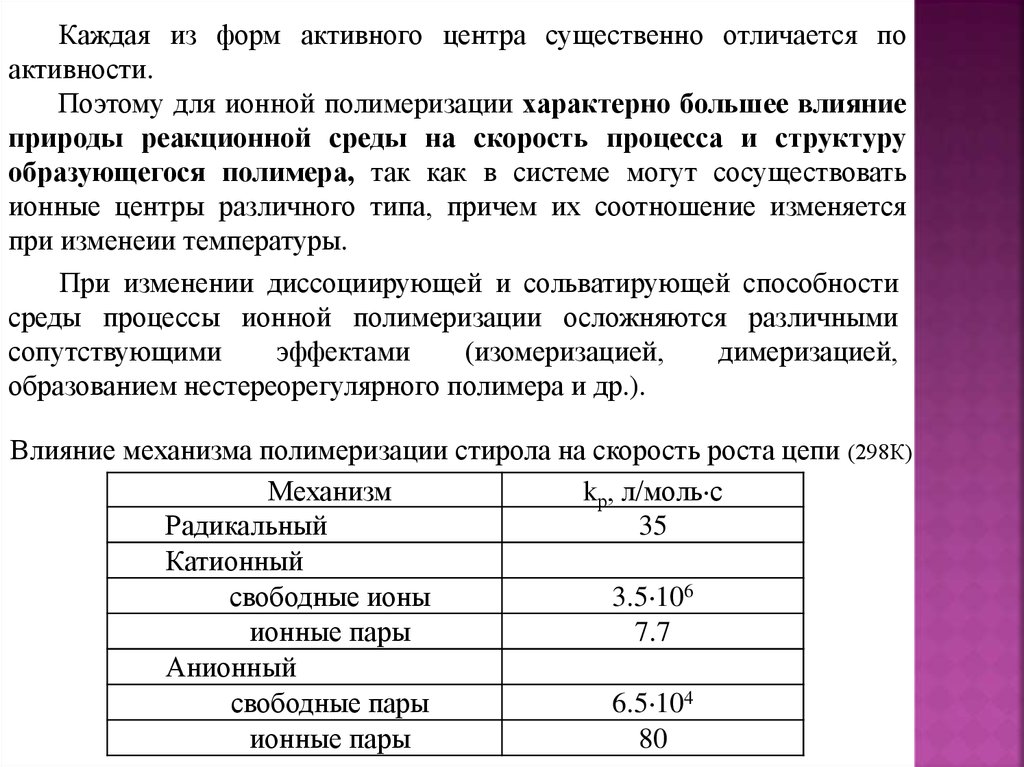












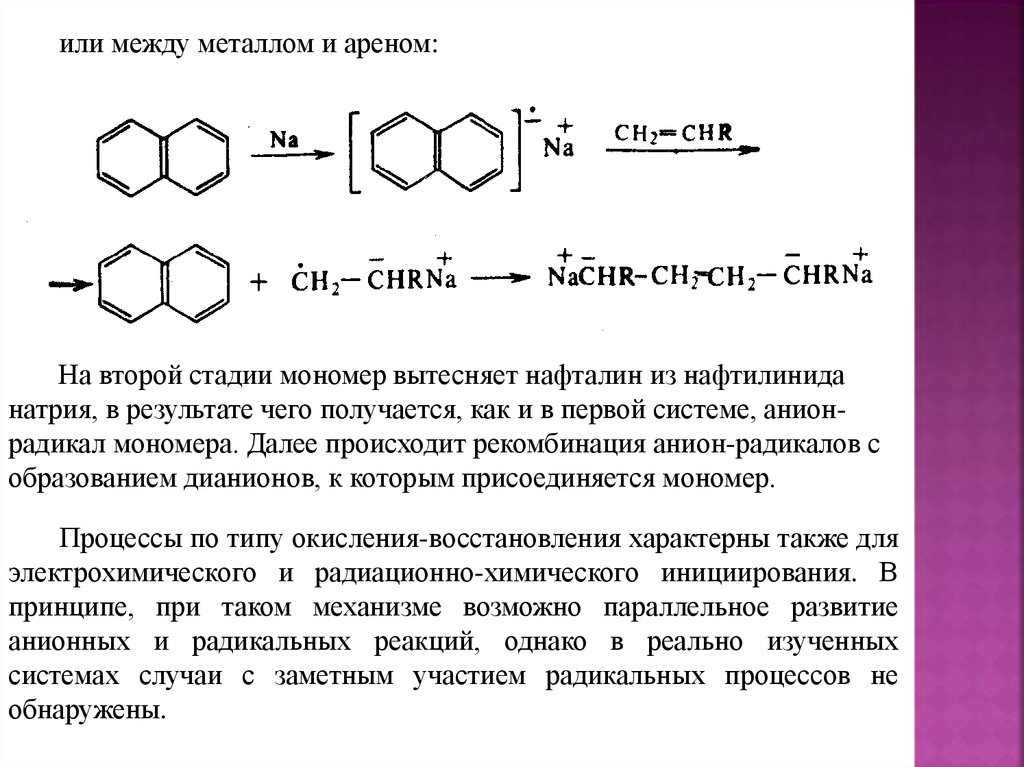








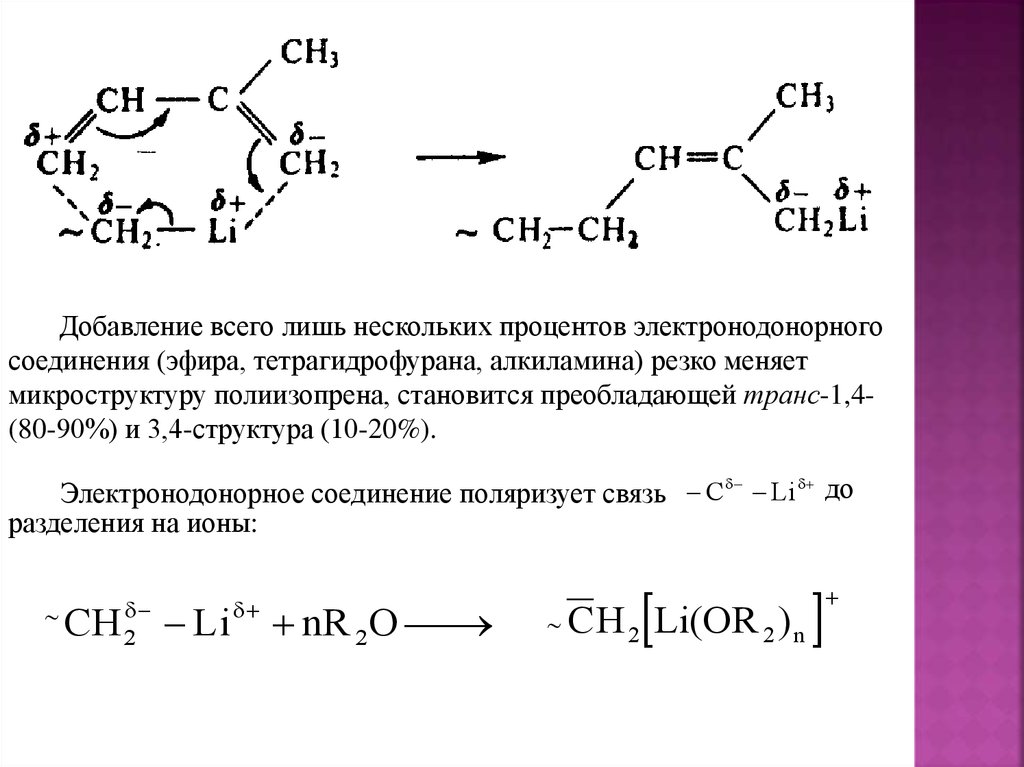
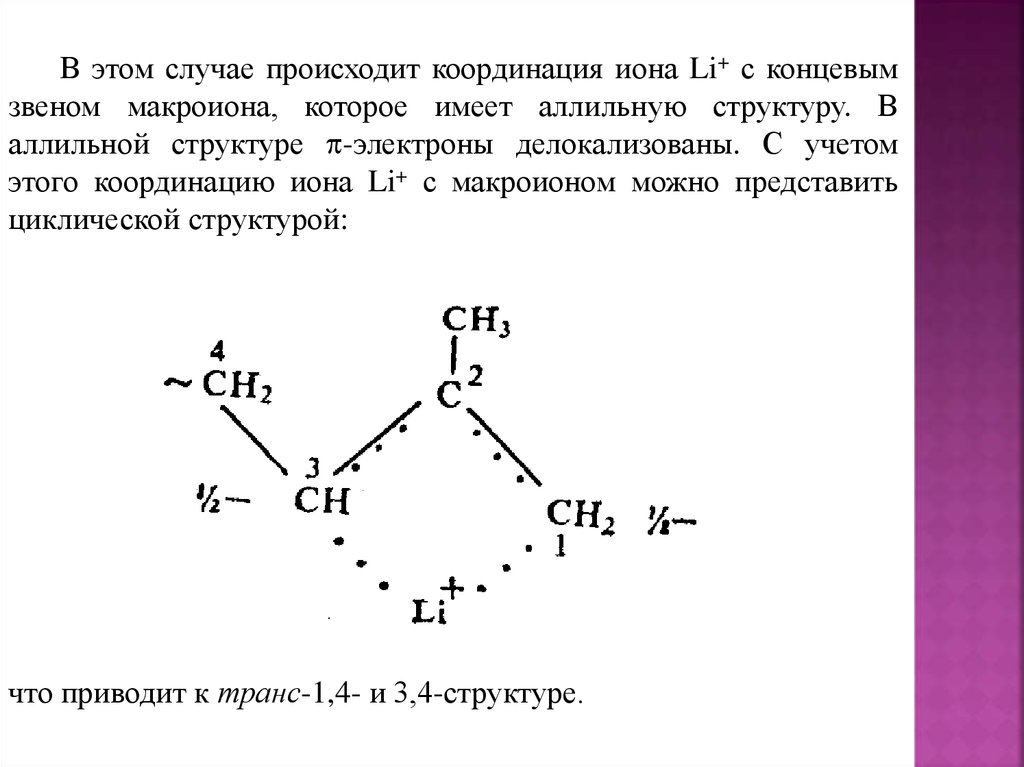











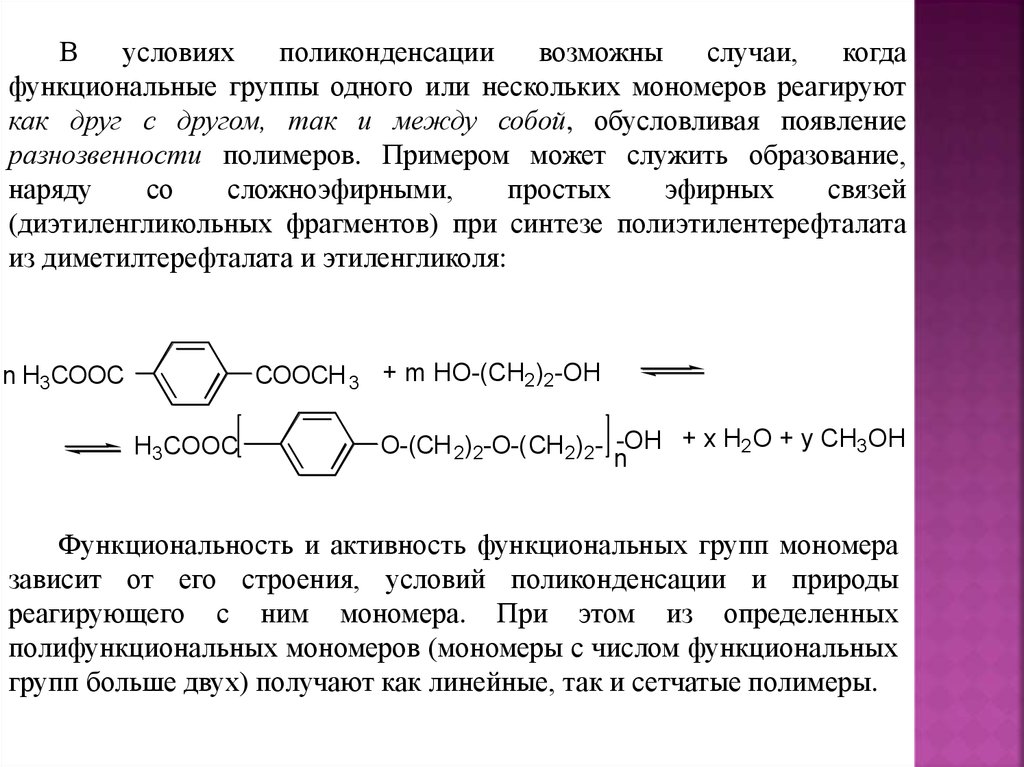
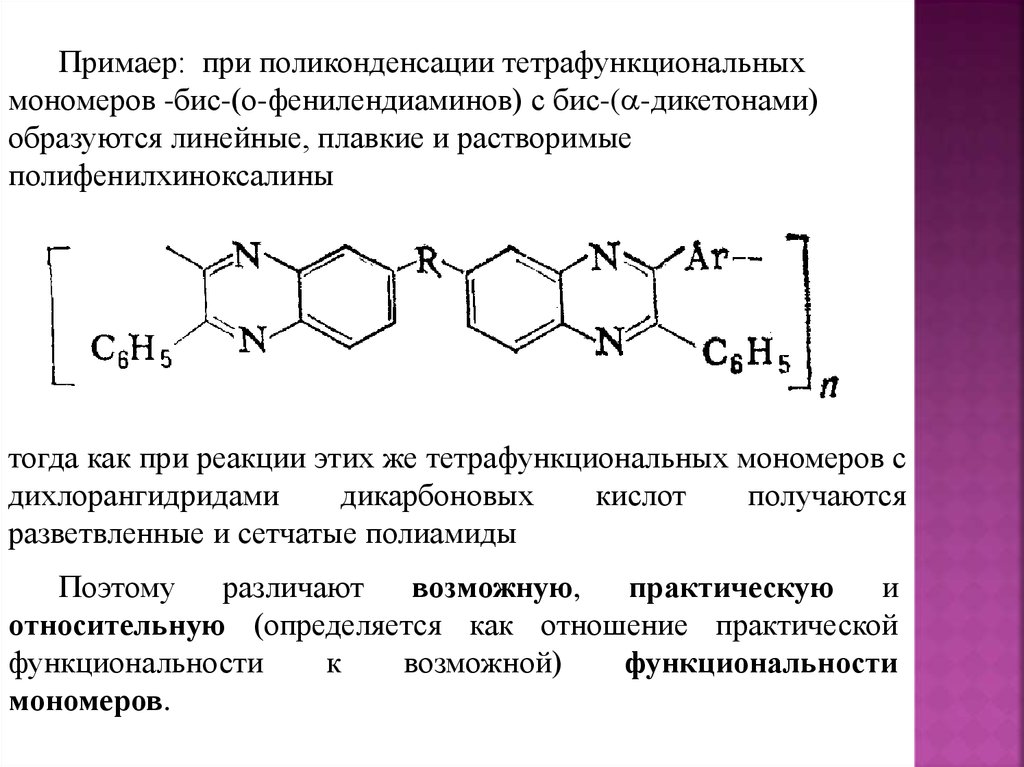




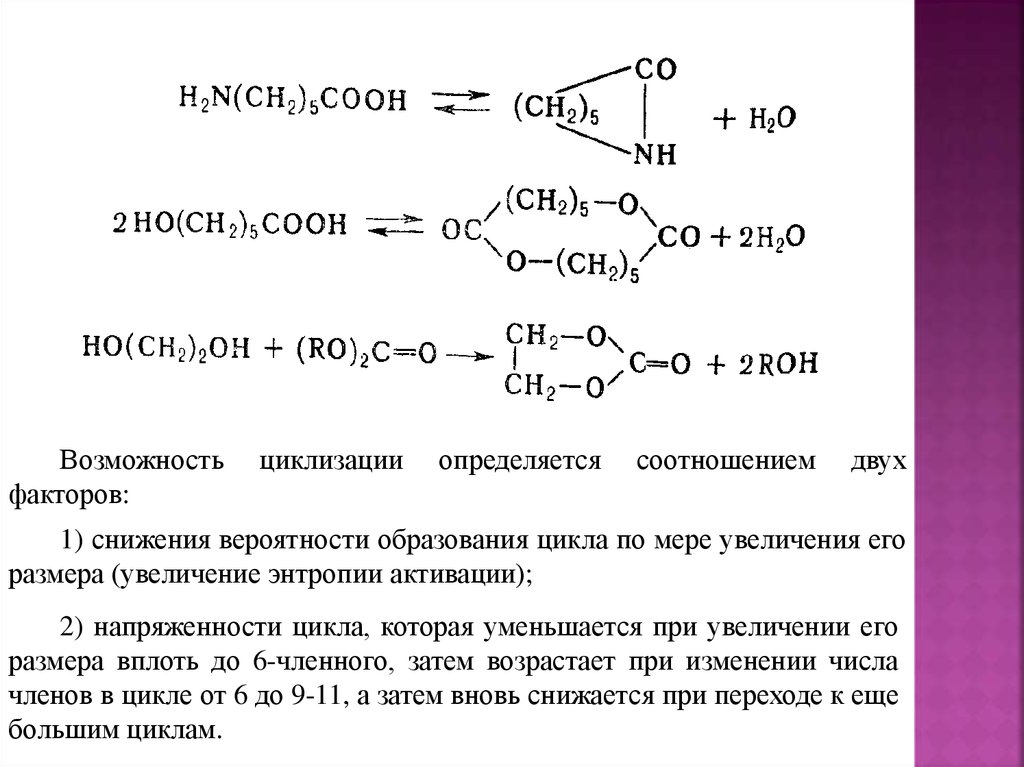






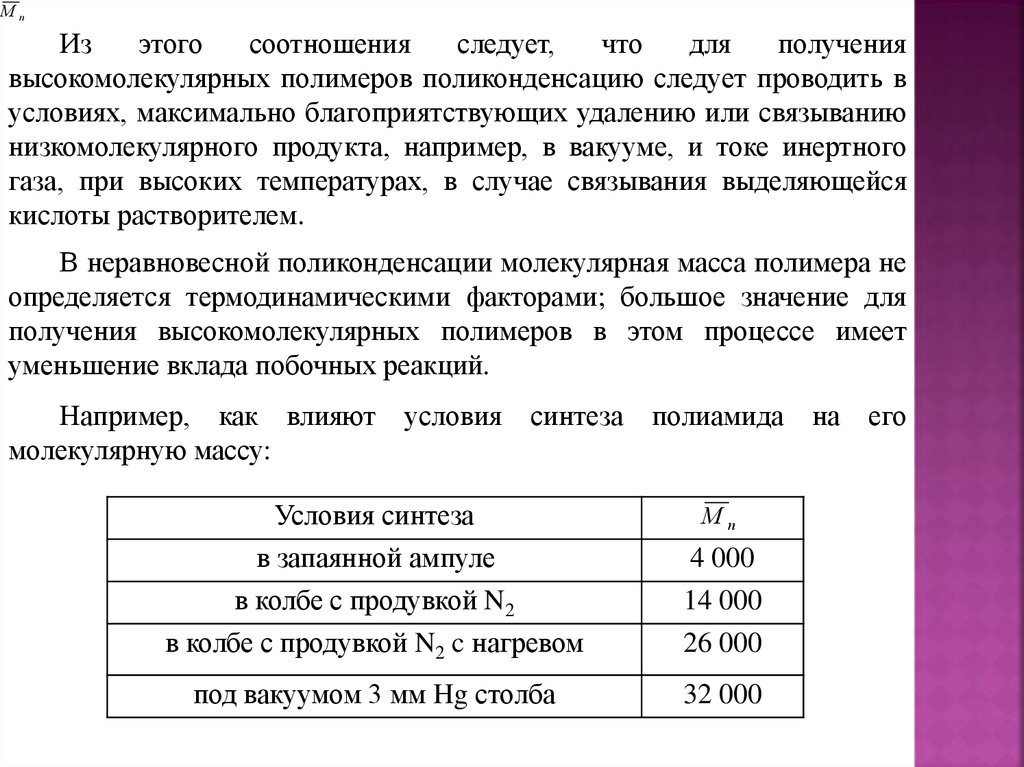













 Химия
Химия








