Похожие презентации:
Эволюция регуляторных и метаболических путей
1. Эволюция регуляторных и метаболических путей
2.
3.
А) Элементы пути,отвечающие на сигнал и
их транскрипционные
факторы:
Wnt — Tcf/Lef
Notch — Su(H)
Hh (Hedgehog) — Gli/Ci
TGF-β и RTK пути имеют различные
активаторы и репрессоры, для которых
может быть один и тот же сайт связывания
с транскрипционным фактором (второй
тип, B), либо разные сайты для активатора
и репрессора (третий тип, C)
4.
Hecht et al., 2013.Ландшафт мутабильности адренергического рецептора ADRB2 человека.
Смоделированы эффекты от замены аминокислоты «дикого типа» на все
остальные (красный — структура и функция меняется, зеленый —
нейтральность)
5.
(a) — Распределение на структуре белкаостатков, изменение которых с большей
вероятностью (краснее) изменит функцию, и
(b) — консервативность остатков среди
организмов (по базе данных)
6.
GO биологических процессов белков, вступающих в большое число белокбелковых взаимодействий7.
Yates, Sternberg, 2013.Некоторые белковые домены более устойчивы к несинонимичным заменам
(т.е. в данном случае реже проявляется клинический эффект), чем другие
8.
(a)(b)
(c)
(d)
(e)
(f)
(g)
Транскрипция увеличивает долю спонтанных мутаций (показано на E. coli и S.
cerevisiae)
Рекомбинационная репарация двунитевых разрывов увеличивает частоту точечных
мутаций
Гены, которые у S. cerevisiae ближе к рекомбинационным точкам экспрессируются
сильнее, чем большинство других
Важные гены сконцентрированы в регионах с низкой рекомбинацией (показано на S.
cerevisiae и C. elegans)
Менее важные гены чаще экспрессированы на более низком уровне, чем более важные
Более высоко экспрессированные белки обладают большим числом белков, с
которыми они вступают во взаимодействие (на S. cerevisiae, не подтверждено
некоторыми методами)
У более важных генов в среднем больше взаимодействий с другими.
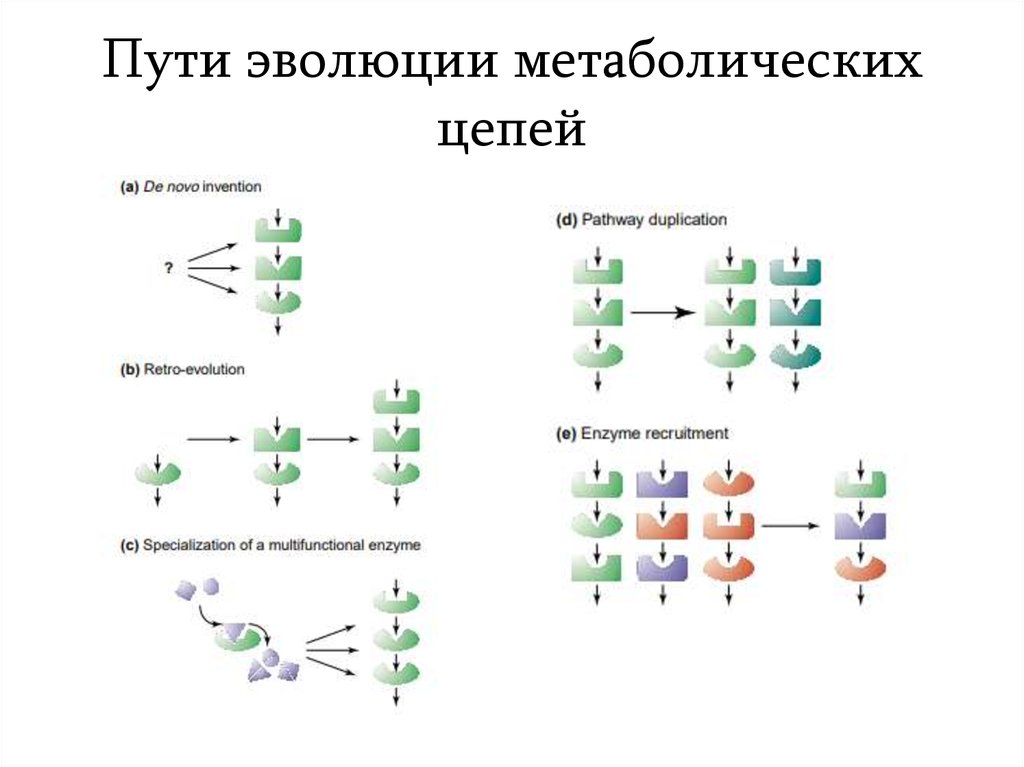
9. Пути эволюции метаболических цепей
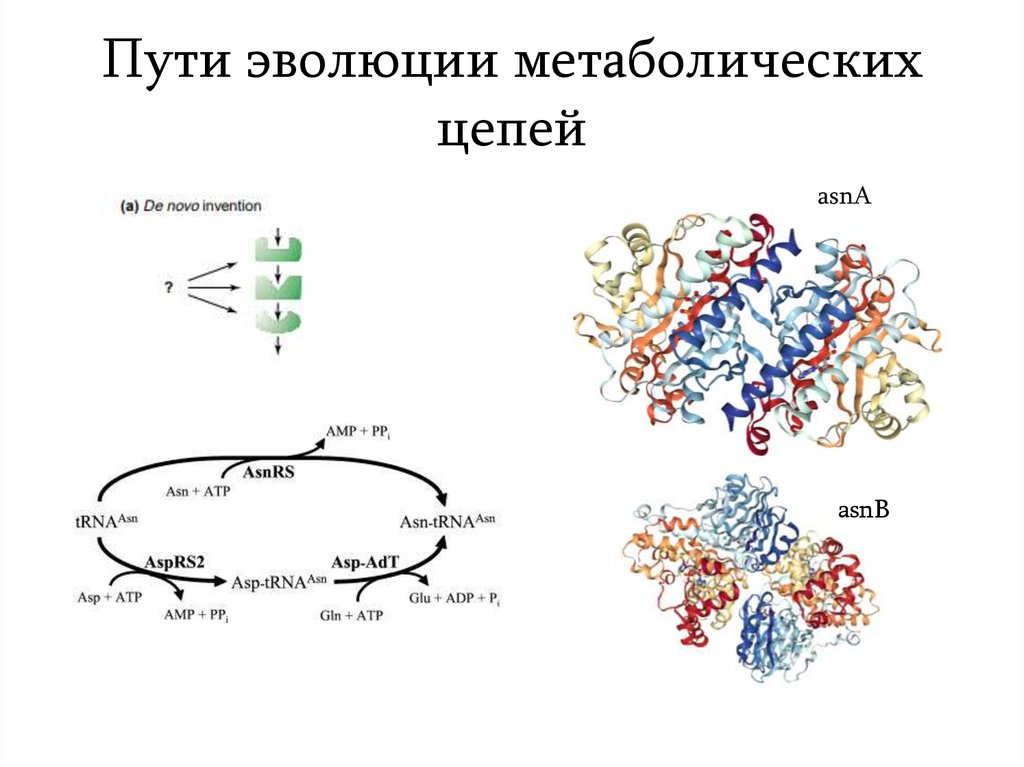
10. Пути эволюции метаболических цепей
asnAasnB
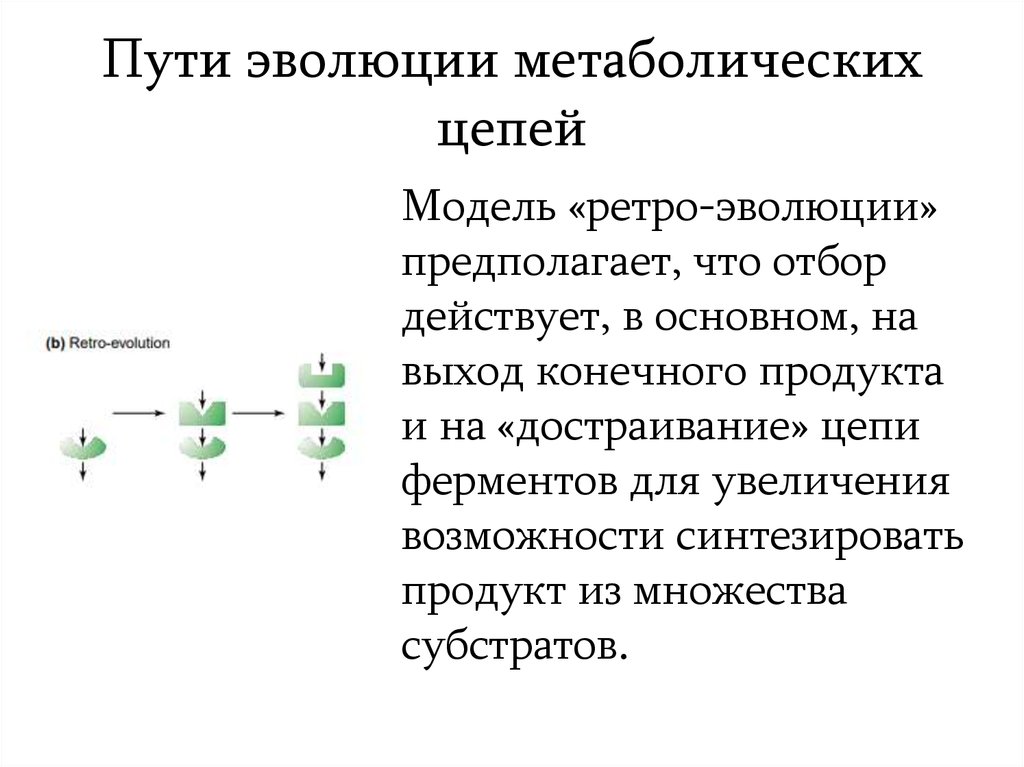
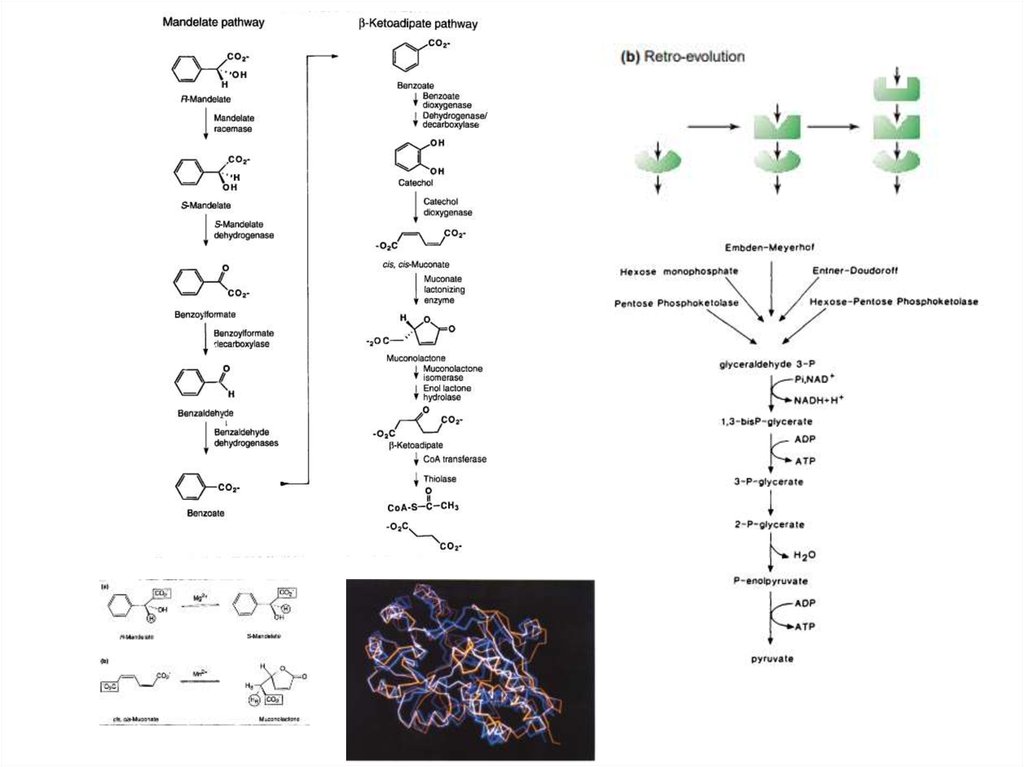
11. Пути эволюции метаболических цепей
Модель «ретро-эволюции»предполагает, что отбор
действует, в основном, на
выход конечного продукта
и на «достраивание» цепи
ферментов для увеличения
возможности синтезировать
продукт из множества
субстратов.
12.
13.
14.
15.
16. Мутации в активном центре
Мутация аспарагиновой кислоты (120) в аспарагинв металло-бета-лактамазе (E. coli) привела
изменению расстояния и перераспределению
заряда между ионами цинка, что привело к
невозможности расщепления антибиотиков.
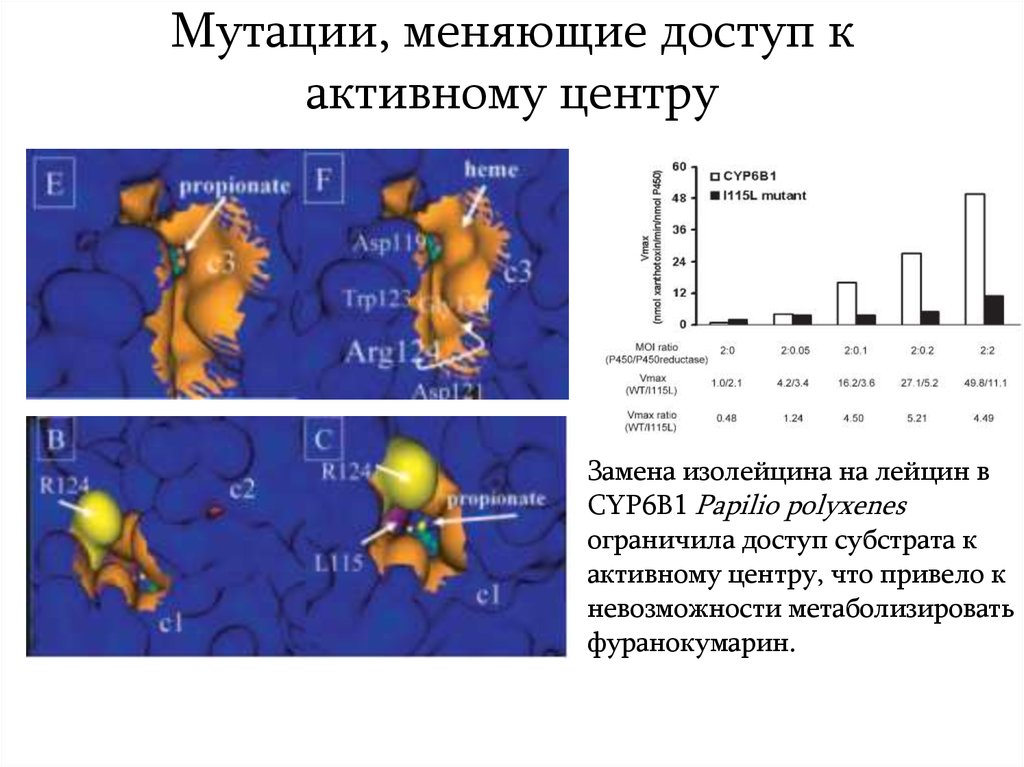
17. Мутации, меняющие доступ к активному центру
Замена изолейцина на лейцин вCYP6B1 Papilio polyxenes
ограничила доступ субстрата к
активному центру, что привело к
невозможности метаболизировать
фуранокумарин.
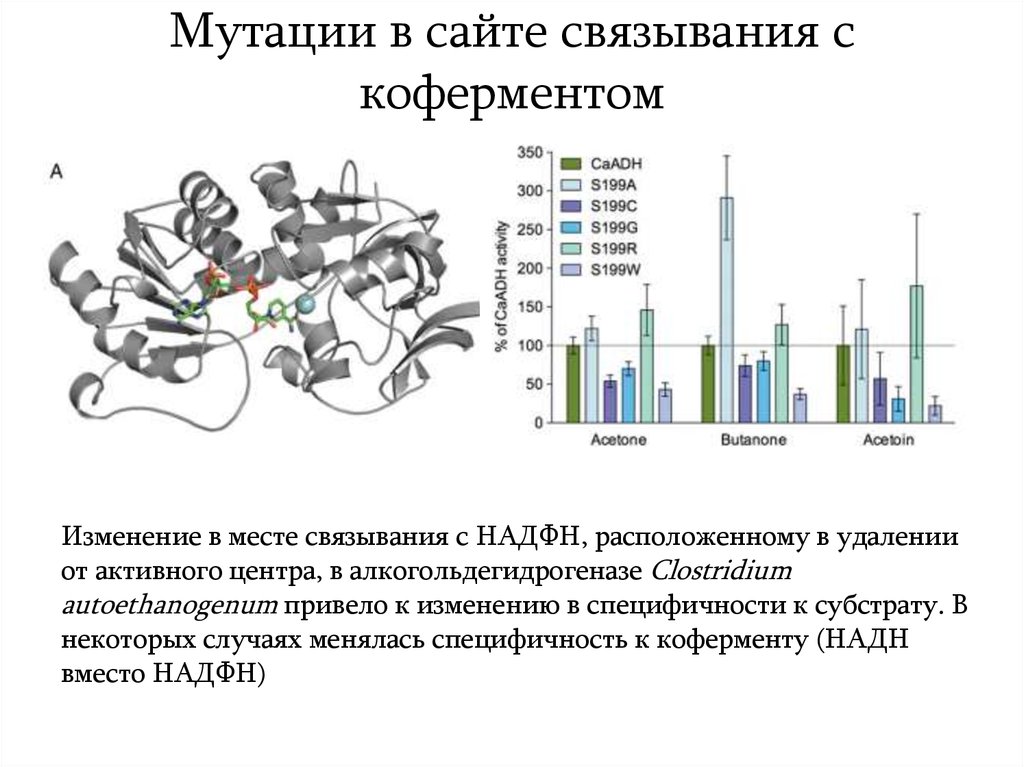
18. Мутации в сайте связывания с коферментом
Изменение в месте связывания с НАДФН, расположенному в удаленииот активного центра, в алкогольдегидрогеназе Clostridium
autoethanogenum привело к изменению в специфичности к субстрату. В
некоторых случаях менялась специфичность к коферменту (НАДН
вместо НАДФН)
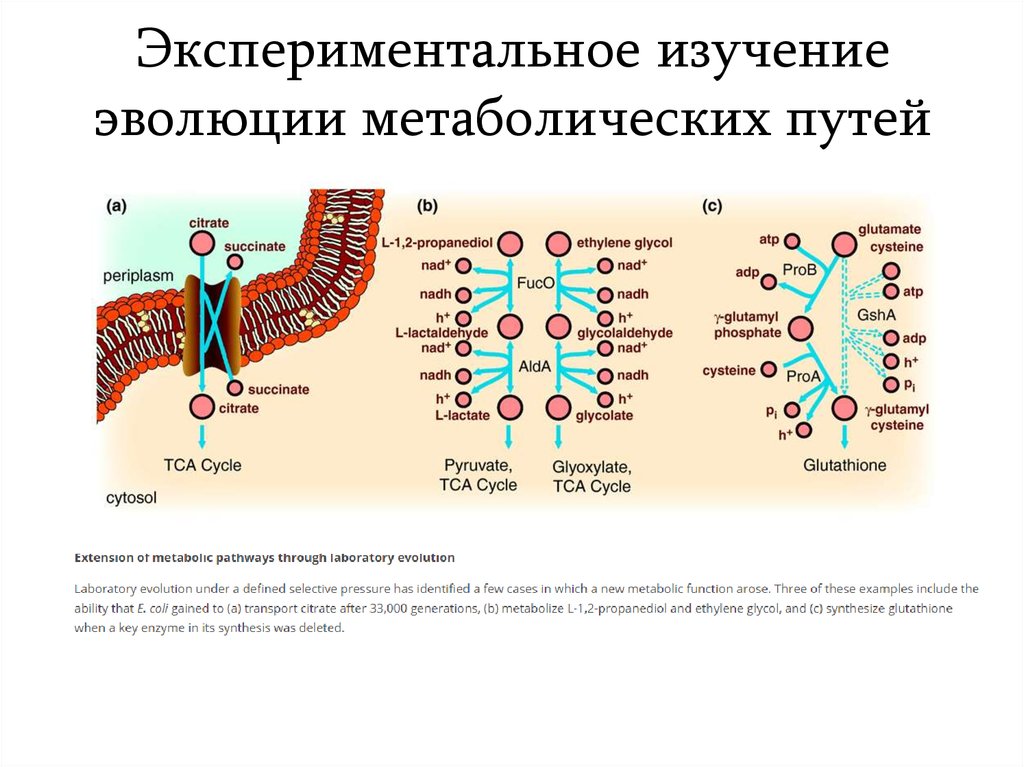
19. Экспериментальное изучение эволюции метаболических путей
20. Цена за аминокислоту
AlaCys
Asp
Glu
Phe
Oneletter
symbol
A
C
D
E
F
Gly
His
Ile
Lys
Leu
G
H
I
K
L
Met
M
Asn
Pro
Gln
Arg
Ser
Thr
Val
Trp
N
P
Q
R
S
T
V
W
Tyr
Y
Amino
acid
Precursor
metabolit
es
pyr
3pg
oaa
αkg
2 pep,
eryP
3pg
penP
pyr, oaa
oaa, pyr
2 pyr,
acCoA
oaa, Cys,
−pyr
oaa
αkg
αkg
αkg
3pg
oaa
2 pyr
2 pep,
eryP,
PRPP,
−pyr
eryP, 2
pep
Energetic cost
∼P
H
Total, ∼P
1.0
7.3
1.3
2.7
13.3
5.3
8.7
5.7
6.3
19.3
11.7
24.7
12.7
15.3
52.0
2.3
20.3
4.3
4.3
2.7
4.7
9.0
14.0
13.0
12.3
11.7
38.3
32.3
30.3
27.3
9.7
12.3
34.3
3.3
3.7
3.7
10.7
2.3
3.3
2.0
27.7
5.7
8.3
6.3
8.3
4.7
7.7
10.7
23.3
14.7
20.3
16.3
27.3
11.7
18.7
23.3
74.3
13.3
18.3
50.0
У высоко экспрессированных белков E. coli отбираются те
аминокислоты, чья энергетическая цена синтеза меньше














 Биология
Биология








