Похожие презентации:
Биофизические основы патологии клетки. Свободные радикалы и болезни человека
1. Свободные радикалы и болезни человека
Биофизические основыпатологии клетки
Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
2.
ПерекисноеОкисление
Липидов
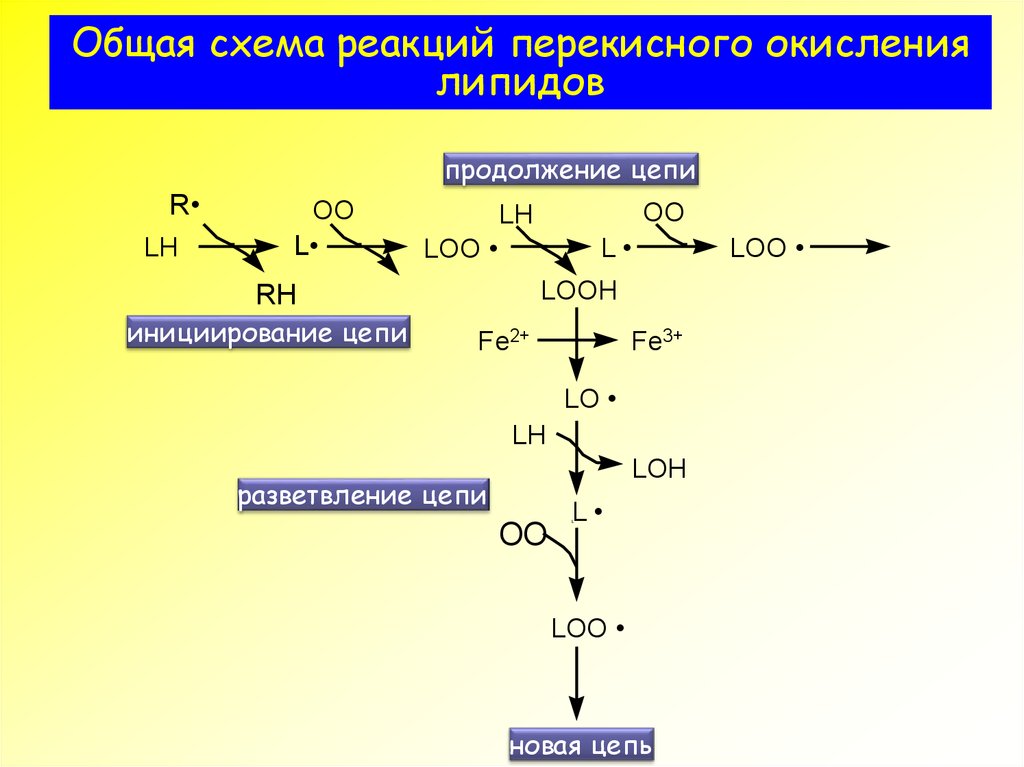
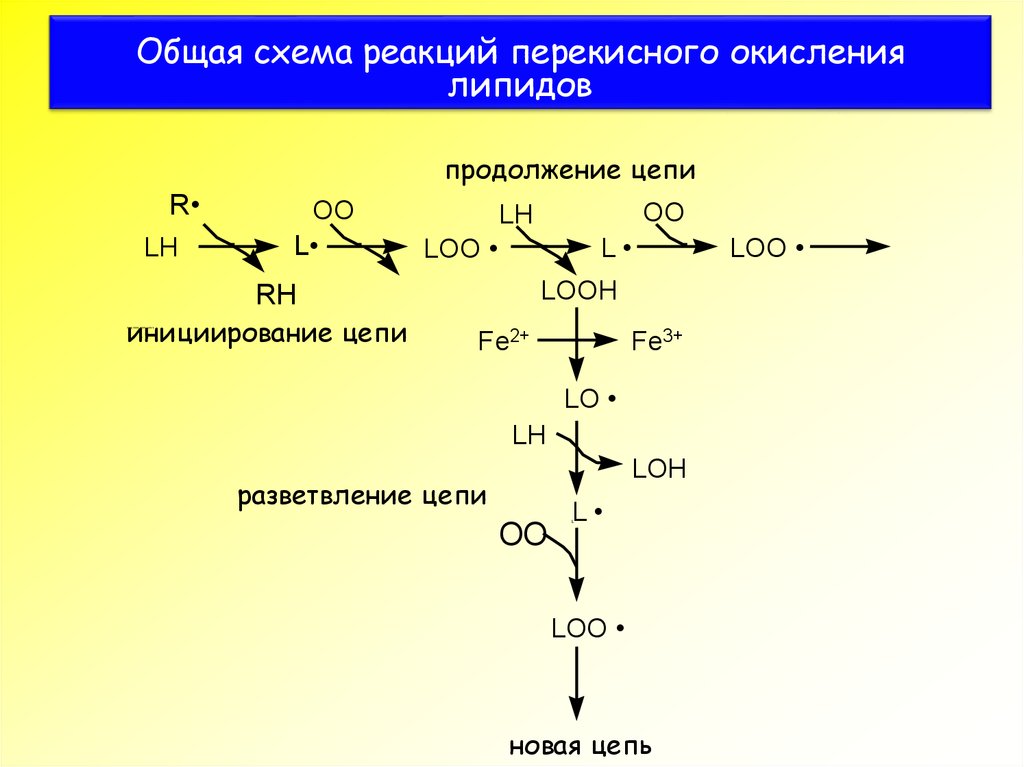
3. Общая схема реакций перекисного окисления липидов
продолжение цепиR
LH
OO
L
L
LOO
LOOH
RH
инициирование цепи
???€????‚‡??? €???
OO
LH
Fe2+
Fe3+
LO
LH
LOH
разветвление цепи
OO
L
L
LOO
новая цепь
LOO
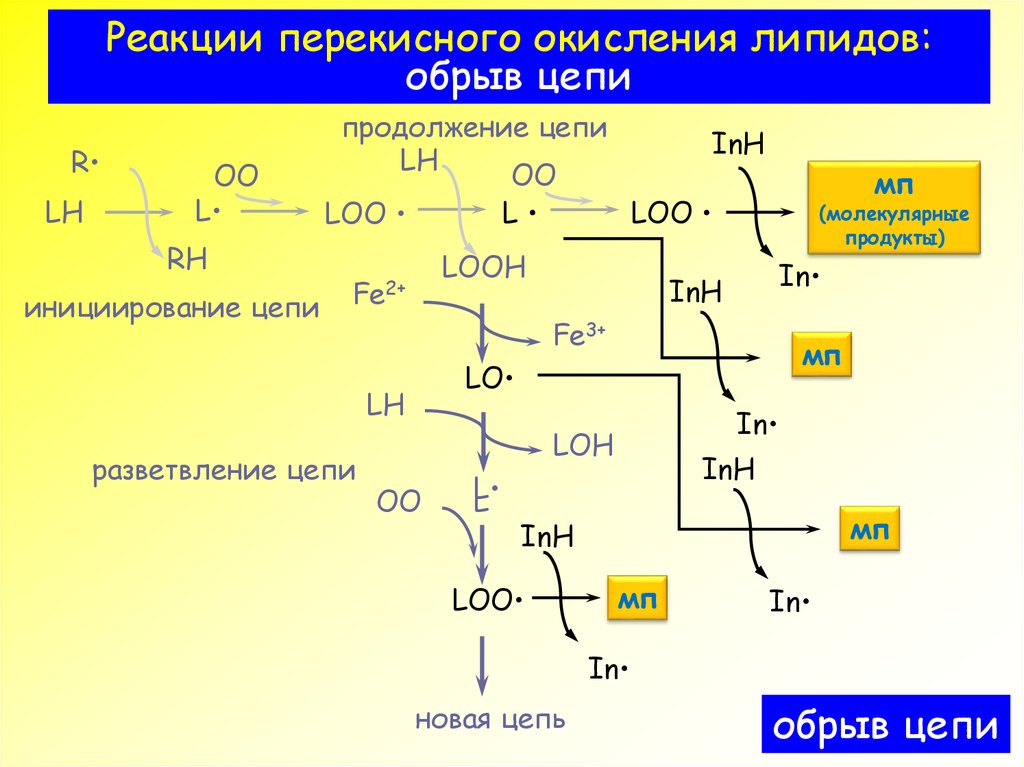
4. Реакции перекисного окисления липидов: обрыв цепи
RLH
OO
L
RH
инициирование цепи
продолжение цепи
InH
LH
OO
L
LOO
LOO
LOOH
Fe2+
(молекулярные
продукты)
In
InH
Fe3+
мп
LO
LH
разветвление цепи
мп
In
LOH
OO
L
L
InH
мп
InH
LOO
мп
In
In
новая цепь
обрыв цепи
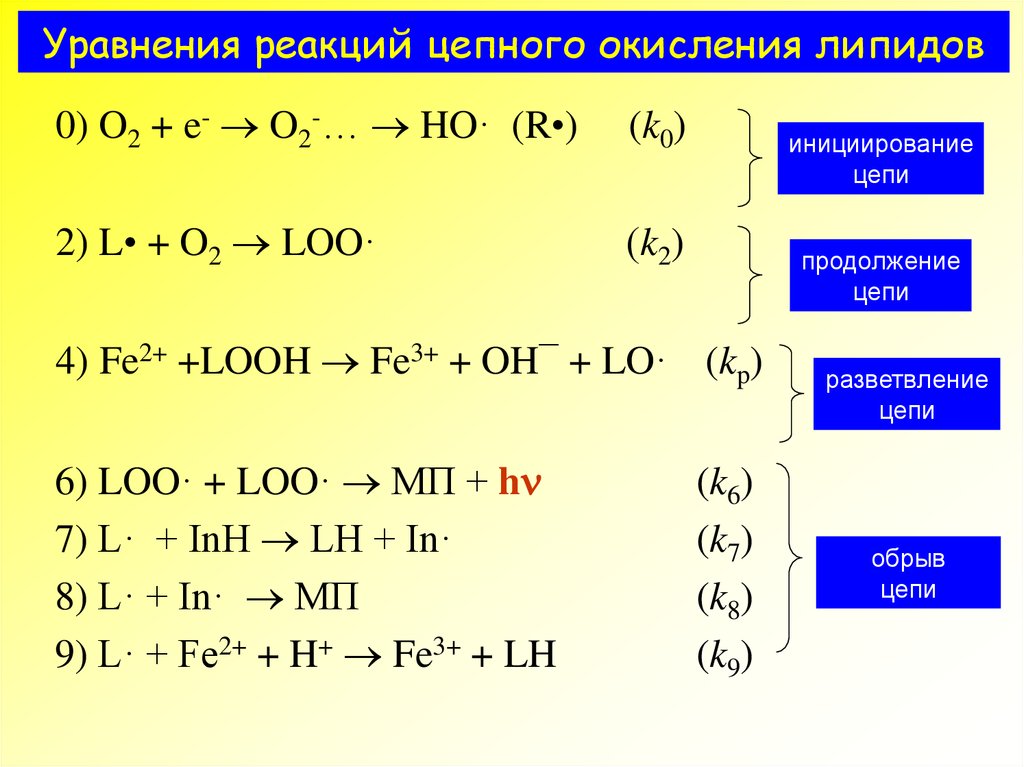
5. Уравнения реакций цепного окисления липидов
6) LOO· + LOO· МП + hnLO· + LO· МП
L· + L· МП
7) L· + InH LH + In·
LO· + InH LOH + In·
LOO· + InH LOOH + In·
8) L· + In· МП
LO· + In· МП
LOO· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
LO· + Fe2+ + H+ Fe3+ + LOH
LOO· + Fe2+ + H+ Fe3+ + LOOH
(k6)
(k7)
(k8)
(k9)
обрывцепи
6. Анализ кинетики ПОЛ
7. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
3) LOO· + LH LOOH + L
(k0)
(k1)
(k2)
(k3)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
5) LH + LO· LOH + L·
(k5)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
8. Уравнения реакций цепного окисления липидов
Скорости реакцийv0 =
0) O2 + e- O2-… HO·
v1 = k1 [LH][HO·]
1) LH + HO· L· + HOH
v2 = k2 [O2][L·]
2) L• + O2 LOO·
v3 = k3 [LH][LOO·]
3) LOO· + LH LOOH + L
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· vp = kp [Fe2+][LOOH]
v5 = k5 [LH][LO·]
5) LH + LO· LOH + L·
v6 = k6 [LOO·]2
6) LOO· + LOO· МП + hn
v7 = k7 [InH][L·]
7) L· + InH LH + In·
v8 = k8 [In·][L·]
8) L· + In· МП
v9 = k9 [Fe2+ ][L·]
9) L· + Fe2+ + H+ Fe3+ + LH
9. Кинетика перекисного окисления липидов
4030
20
10
МВ
СС
ЛП
20
50
Fe2+(мМ); CL (отн. Ед.)
ТБКАП (нмоль/мг белка )
БВ
16
ТБКАП
12
8
4
ХЛ
Fe2+
Fe2+
0
0
3
9
15
21
БВ – быстрая вспышка;
ЛП – латентный период;
МВ – медленная вспышка; СС – стационарное свечение
Владимиров, А., Т.Б. Суслова, В.И. Оленев, Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических
мембранах. П. Роль Fe(2+) в разитии цепного окисления липидов и сверхслабого свечения. Биофизика, 1969. 14: p. 836.
10. Упрощение схемы химических реакций
Для упрощения системы химических реакцийиспользуют два правила химической кинетики:
Правило 1: Скорость нескольких
последовательных реакций равна скорости
самой медленной из них
Правило 2: Скорость нескольких параллельных
реакций в наибольшей мере определяется
скоростью самой быстрой из них.
Иногда можно пренебречь остальными
реакциями при расчетах.
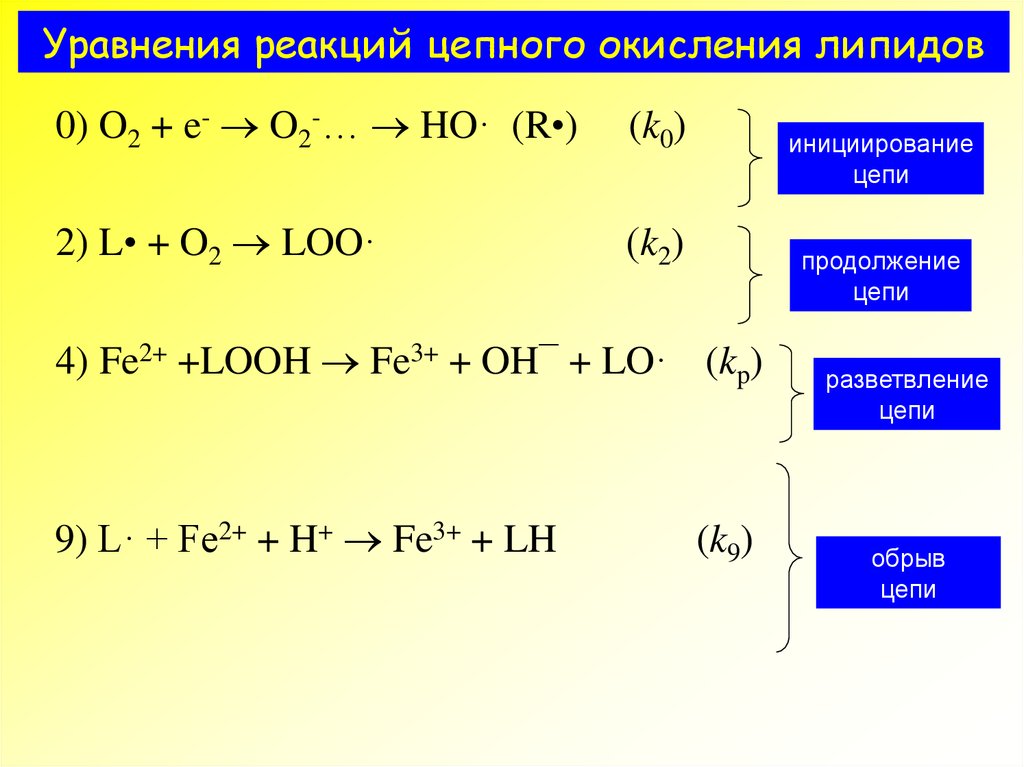
11. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
3) LOO· + LH LOOH + L
(k0)
(k1)
(k2)
(k3)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
5) LH + LO· LOH + L·
(k5)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
12. Скорость нескольких последовательных реакций равна скорости самой медленной из них
Пример 1: Вместо двух реакций продолжения цепи:2) O2 + L· LOO·
v2 = k2 [O2]L·]
3) LH + LOO· L· + LOOH
v3 = k3 [LH][LOO·]
Пишем одну:
L· + O2 (+ LH) LOOH + LOO·
v2+3 ≈ v2 [O2][L·]
Пример 2: Вместо двух реакций разветвления цепи:
4) Fe2+ + LOOH Fe3+ + LO· + OH¯
v4 = k4 [Fe2+] LOOH]
5) LO· + LH LOH + L·
v5 = k5 [LO·][LH]
Пишем одну:
Fe2+ + LOOH (+ LH) Fe3+ + L·
v4+5 ≈ k4 [Fe2+] LOOH]
Примечание:
На кинетику процесса в целом не влияют те продукты, которые не
участвуют в дальнейших реакциях. Поэтому на схеме реакций мы
можем их не указывать.
13. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
3) LOO· + LH LOOH + L
(k0)
(k1)
(k2)
(k3)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
5) LH + LO· LOH + L·
(k5)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
14. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
(k0)
(k1)
(k2)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
15. Скорость нескольких параллельных реакций в основном определяется самой быстрой из них
Пример 1: Скорость образования радикалов L· определяетсядвумя параллельно идущими реакциями:
1) LH + HO· L· + HOH
v1 = k1 [LH][HO·]
4) Fe2+ + LOOH Fe3+ + LO· + OH¯
v4 = k4 [Fe2+] LOOH]
При наличии Fe2+ скорость последней реакции гораздо выше,
чем первой (т.к. концентрация HO· обычно бывает очень
низкой). Поэтому основная масса радикалов образуется в
реакции обрыва цепей:
Fe2+ + LOOH Fe3+ + LO· + OH¯
v1+4 k4 [Fe2+] LOOH]
16. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
(k0)
(k1)
(k2)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
17. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)(k0)
2) L• + O2 LOO·
(k2)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
18.
Скорость нескольких параллельных реакций в наибольшеймере определяется скоростью самой быстрой из них.
Пример 4: Вместо четырех реакций обрыва цепи оставим две,
идущие в отсутствие ингибитора:
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
6) LOO· + LOO· МП + hn
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k9)
обрыв
цепи
19. Упрощенная схема реакций перекисного окисления липидов из 5 реакций
O2 + е- + LH … L·L· + O2 (+ LH) LOOH + L·
Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L·
LOO· + LOO· L=O + LOH + фотон
Fe2+ + L· + H+ Fe3+ + LH
(k0)
(k2)
(kp)
(k6)
(k9)
20. Скорость нескольких параллельных реакций в основном определяется самой быстрой из них
Пример 2: Скорость реакции обрыва цепейопределяется двумя параллельно идущими
реакциями:
Fe2+ + L· + H+ Fe3+ + LH
(k9)
LOO· + LOO· L=O + LOH + фотон (k6)
При наличии Fe2+ скорость первой реакции гораздо выше,
чем второй. Поэтому пока есть Fe2+, основная реакция
обрыва цепи – это реакция:
Fe2+ + L· + H+ Fe3+ + LH (k9)
21. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)(k0)
2) L• + O2 LOO·
(k2)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
6) LOO· + LOO· МП + hn
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k9)
разветвление
цепи
обрыв
цепи
22. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)(k0)
2) L• + O2 LOO·
(k2)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
9) L· + Fe2+ + H+ Fe3+ + LH
(k9)
разветвление
цепи
обрыв
цепи
23. Упрощенная схема реакций перекисного окисления липидов из 3 реакций
Если считать, что образование радикалов идет , восновном, за счет реакции с ионами Fe2+, то можно
удалить и реакцию (0). Тогда получим:
L· + O2 (+ LH) LOOH + L·
(k2)
Fe2+ + LOOH + LH Fe3+ + LOH + OH¯ + L· (kp)
Fe2+ + L· + H+ Fe3+ + LH
(k9)
24. Дифференциальные уравнения кинеткики в системе трех реакций
d[LOOH]v 2 - v p k2 O2 L k p Fe2+ LOOH
dt
d[L ]
v p v 9 k p Fe2+ LOOH k9 Fe2+ L
dt
d[Fe2 ]
v p v 9 k p Fe2+ LOOH k9 Fe2+ L
dt
25. Стационарное приближение Боденштейна – Семенова
d[L ]0
dt
2+
2+
k p Fe LOOH k9 Fe L
kp
L LOOH
k9
d[LOOH]
k2 O2 L k p Fe2+ LOOH
dt
k2
d[LOOH]
2+
O2 Fe k p LOOH
dt
k9
d[LOOH]
LOOH
dt
k2
2+
k p O2 Fe
k9
26. Триггерная функция Fe2+
1d[LOOH]
LOOH
dt
LOOH
3
LOOH 0
t
d[LOOH]
dt
LOOH 0
2
d[LOOH]
dt
LOOH
LOOH
4 ln LOOH
0
LOOH
e t
5
LOOH 0
LOOH L v ПОЛ
6 LOOH L v
ПОЛ-0
0
0
e
t
t
27. Триггерная функция Fe2+
LOOH L1 LOOH L
0
0
2
v ПОЛ
e t
v ПОЛ-0
k2
2+
k p O2 Fe
k9
3 При = 0
k2
Fe O2
Fe2+
крит
k9
2+
= kp([Fe2+]* – [Fe2+])
4
2+] > [Fe2+] *, < 0
При
[Fe
5
6 При [Fe2+] < [Fe2+] *, > 0
28. Железо как про- и антиоксидант
Скорость цепного окисленияЖелезо как про- и антиоксидант
[Fe2+] < [Fe2+] *
>0
[Fe2+] > [Fe2+] *
<0
29. Кинетика перекисного окисления липидов
4030
20
10
МВ
СС
ЛП
20
50
Fe2+(мМ); CL (отн. Ед.)
ТБКАП (нмоль/мг белка )
БВ
16
ТБКАП
12
8
4
ХЛ
Fe2+
Fe2+
0
0
3
9
15
21
БВ – быстрая вспышка;
ЛП – латентный период;
МВ – медленная вспышка; СС – стационарное свечение
Владимиров, А., Т.Б. Суслова, В.И. Оленев, Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических
мембранах. П. Роль Fe(2+) в разитии цепного окисления липидов и сверхслабого свечения. Биофизика, 1969. 14: p. 836.
30.
Хемилюминесценция приперекисном окислении липидов
31. Общая схема реакций перекисного окисления липидов
продолжение цепиR
LH
OO
L
L
LOO
LOOH
RH
инициирование цепи
???€????‚‡??? €???
OO
LH
Fe2+
Fe3+
LO
LH
LOH
разветвление цепи
OO
L
L
LOO
новая цепь
LOO
32. Уравнения реакций цепного окисления липидов
0) O2 + e- O2-… HO· (R•)1) LH + HO· L· + HOH
2) L• + O2 LOO·
3) LOO· + LH LOOH + L
(k0)
(k1)
(k2)
(k3)
инициирование
цепи
продолжение
цепи
4) Fe2+ +LOOH Fe3+ + OH¯ + LO· (kp)
5) LH + LO· LOH + L·
(k5)
6) LOO· + LOO· МП + hn
7) L· + InH LH + In·
8) L· + In· МП
9) L· + Fe2+ + H+ Fe3+ + LH
(k6)
(k7)
(k8)
(k9)
разветвление
цепи
обрыв
цепи
33. Схема хемилюминометра
Свето-непроницаемыйкожух
Предусилитель
Жидкий азот
шторка
Фотоумножитель
Усилитель
Счетчик импульсов
Кюветное отделение
Сосуд Дьюара
Измерительная ячейка
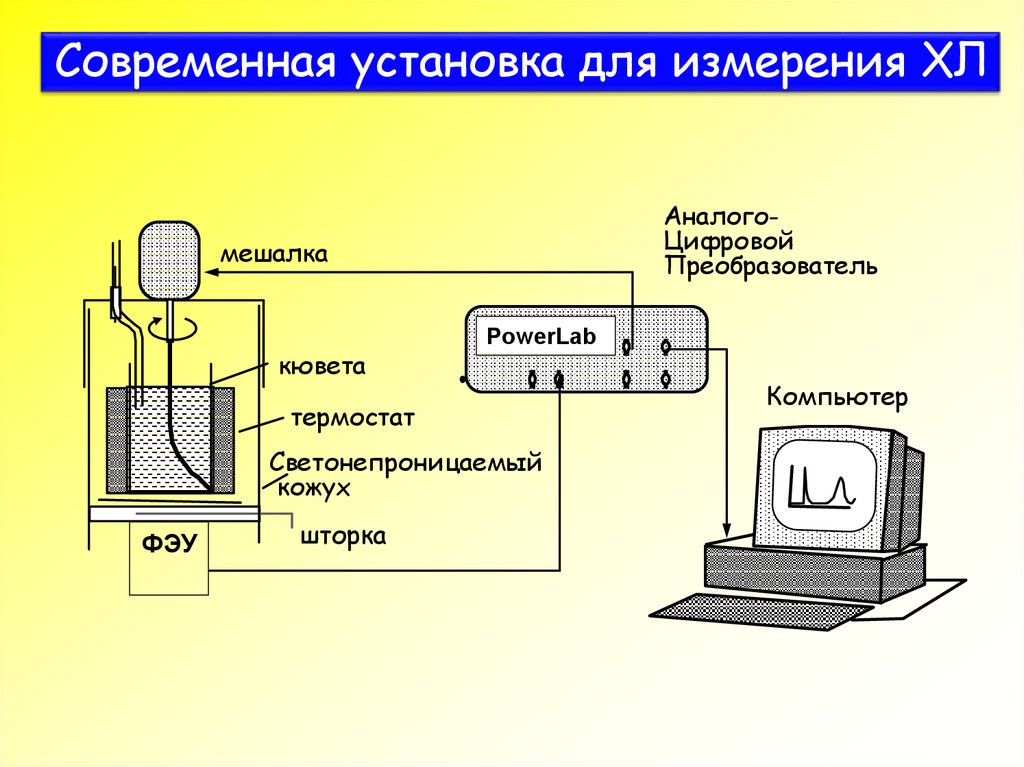
34. Современная установка для измерения ХЛ
АналогоЦифровойПреобразователь
мешалка
кювета
PowerLab
термостат
Светонепроницаемый
кожух
ФЭУ
шторка
Компьютер
35. Кинетика перекисного окисления липидов
МВЛП
20
10
0
Fe2+(мМ); CL (отн. Ед.)
ТБКАП (нмоль/мг белка )
30
МВ
СС
ЛП
20
50
40
СС БВ
Fe2+
16
ТБКАП
12
8
0
ХЛ
Fe2+
4
3
9
15
21
27
33
39
Владимиров, А., Т.Б. Суслова, and В.И. Оленев, Хемилюминесценция, сопряженная с
образованием липидных перекисей в биологических мембранах. П. Роль Fe(2+) в разитии
цепного окисления липидов и сверхслабого свечения. Биофизика, 1969. 14: p. 836-845
36. Кинетика перекисного окисления липидов
4030
20
10
0
МВ
СС
ЛП
20
50
Fe2+(мМ); CL (отн. Ед.)
ТБКАП (нмоль/мг белка )
БВ
16
ТБКАП
12
8
4
0
ХЛ
Fe2+
3
9
15
21
БВ – быстрая вспышка;
ЛП – латентный период;
МВ – медленная вспышка; СС – стационарное свечение
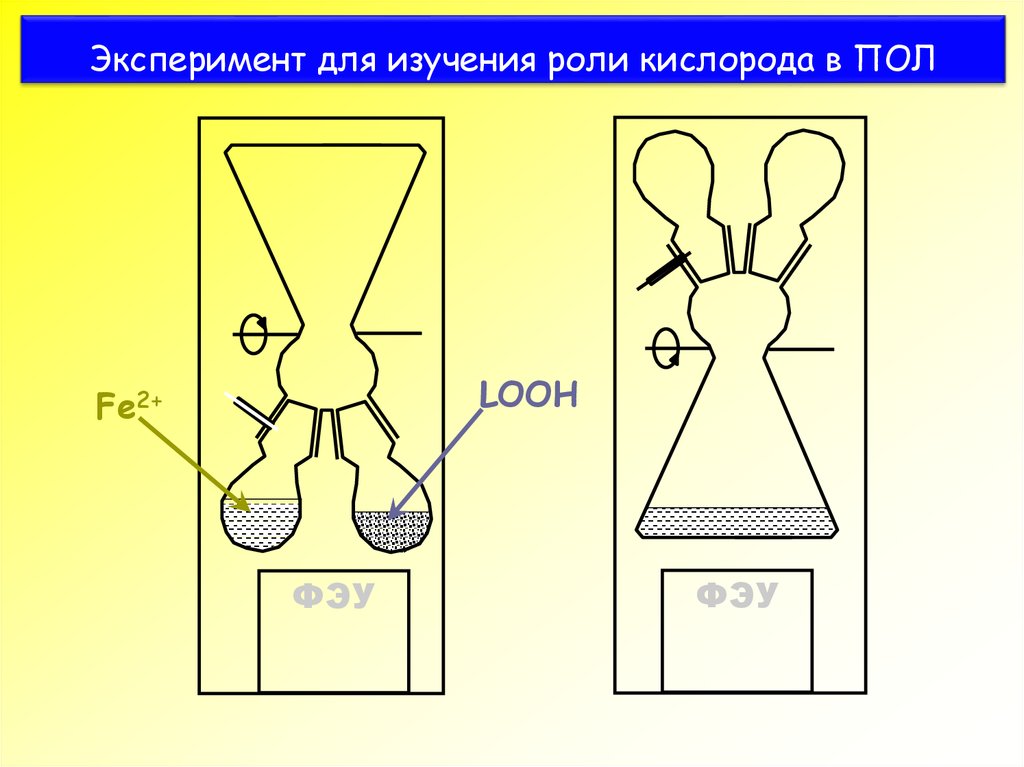
37. Эксперимент для изучения роли кислорода в ПОЛ
LOOHFe2+
ФЭУ
ФЭУ
38. Хемилюминесценция при ПОЛ, индуцированном ионами Fe2+
Олеиновая кислота-O2
Fe2+
Митохондрии
+O2
Fe2+
-O2
Fe2+
+O2
Fe2+
39. Реакции ПОЛ, протекающие в присутствии и в отсутствие О2
Без кислорода:В присутствии кислорода:
Fe2+ + LOOH Fe3+ + LO
Fe2+ + LOOH Fe3+ + LO
LO + LH LOH + L
LO + LH LOH + L
L + L
L + O2 LOO
LO + LO
L + L
L + LO
LO + LO
LOO + LOO L=O* LO + hn
L + LO
I = k6[LOO ]2
= 10-9 ÷ 10-15
LO + LOO
L + LOO
40. Роль ионов Fe в инициировании ПОЛ
Интенсивность ХЛ, отн. ед.Роль ионов Fe в инициировании ПОЛ
200
Контроль
150
100
+ ЭДТА
50
0
0
40
80
Время, мин
120
41. Кинетика ХЛ (быстрая вспышка) при различных [Fe2+]
Интенсивность ХЛ, отн. ед.140
3500 mM
120
100
350 mM
80
60
35 mM
40
20
0
0
0.6
1.2
Время, сек
1.8
2.4
42. Программа для моделирования кинетики KineticAnalyzer
Добавлениереагентов
Добавление
продуктов
Концентрации
Указание констант скорости
Авторы Д.Ю. Измайлов и Ю.А. Владимиров
43.
Моделирование кинетики ХЛ44. Сравнение кинетики ХЛ (медленная вспышка) и ее модели при разных [Fe2+]
27
10
14
Рассчитанные кривые
20
1,5
1
0,5
0
5
10
15
20
Время, мин
25
30
Интенсивность ХЛ, отн. ед.
Интенсивность ХЛ, отн. ед.
Измеренные кривые
0,6
7
10
14
20
0,5
0,4
0,3 Fe2+
0,2
0,1
0
10
20
Время, мин
30
45. Измерение длительности латентного периода при различных концентрациях липосом
Латентный период, минИзмерение длительности латентного периода при
различных концентрациях липосом
1
30
2
5 7
25
20
15
10
5
0
0
50
[Fe2+], mM
100
150
Цифры у кривых соответствуют концентрации липида в мг/мл
46. Влияние карнозина на Fe2+-индуцированную ХЛ в липосомах
Интенсивность ХЛ, отн. ед.10
8
Карнозин (мM)
6
8
4
2
0
4
2
Fe2+
0
0
8
4
Время, мин
12

































![Кинетика ХЛ (быстрая вспышка) при различных [Fe2+] Кинетика ХЛ (быстрая вспышка) при различных [Fe2+]](https://cf.ppt-online.org/files1/slide/e/eJKSY6jaw0UVmnRIlLx5opuDqAZPc2sCFrX4yQM138/slide-40.jpg)


![Сравнение кинетики ХЛ (медленная вспышка) и ее модели при разных [Fe2+] Сравнение кинетики ХЛ (медленная вспышка) и ее модели при разных [Fe2+]](https://cf.ppt-online.org/files1/slide/e/eJKSY6jaw0UVmnRIlLx5opuDqAZPc2sCFrX4yQM138/slide-43.jpg)


 Биология
Биология








