Похожие презентации:
Обессоливание воды. Ионный обмен
1. Обессоливание воды
Ионный обмен2. Жесткость воды
• Наличие в воде растворенных солей кальция имагния придает ей свойство, называемое
жесткостью воды. Растворенные соли распадаются
на ионы. Суммарная концентрация катионов
кальция (Ca2+) и магния(Mg2+) определяет общую
жесткость воды.
• Общая жесткость подразделяется на карбонатную
(временную) и некарбонатную (постоянную).
Причем карбонатная жесткость составляет до 70–
80% от общей жесткости. Обычно преобладает
жесткость, обусловленная ионами кальция (до
70%), однако в отдельных случаях магниевая
жесткость может достигать 50–60%.
3.
• Карбонатная (временная) жесткость. Образуетсяпри растворении в воде бикарбонатов кальция и
магния – Са(HCO3)2 и Mg(HCO3)2.При нагреве такой
воды неустойчивые бикарбонаты снова переходят в
нерастворимую форму – карбонаты CaCO3↓ и
MgCO3↓, образуется накипь (котельный камень).
Данный тип жесткости почти полностью
устраняется при кипячении воды и поэтому
называется временной жесткостью.
• Некарбонатная (постоянная) жесткость. Если вода
растворила по пути другие минералы, содержащие
кальций и магний, но не в виде карбонатов, а в
виде хлоридов или сульфатов CaCl2, CaSO4, MgCl2,
MgSO4. При нагревании они остаются в неизменном
виде.
4.
• Жесткость воды может быть уменьшена с помощьюобработки гашеной известью Са(OH)2 и
кальцинированной содой Na2CO3. Известь осаждает
карбонаты, сода осаждает другие соли кальция и
магния. Затем образовавшиеся осадки удаляются
фильтрацией. Этот способ применяется на
городских водозаборах в тех случаях, когда
жесткость превышает допустимые нормы. Требует
довольно громоздкого оборудования и больших
финансовых затрат.
Предварительная очистка воды недостаточна при
подготовке воды, потребляемой в качестве
добавочной для котлов и подпиточной для
тепловых сетей.
5.
Заключительная стадия подготовки воды,связанная с изменением ее ионного состава, вплоть
до полного удаления растворенных примесей,
реализуется с помощью ионообменной технологии,
а также мембранными или термическими
методами.
Сущность ионного обмена заключается в
способности специальных материалов (ионитов)
изменять в желаемом направлении ионный состав
обрабатываемой воды. Иониты представляют собой
нерастворимые высокомолекулярные вещества,
которые благодаря наличию в них специальных
функциональных групп способны к реакциям
ионного обмена.
6.
• Ионный обменКатионный обмен
Анионный обмен
• Na +
H +
Cl OHРегенерация
• NaCl
НCl
NaCl
NaОН
Способность ионитов к обмену ионами с раствором
определяется их строением. Иониты состоят из
нерастворимой твердой основы (матрицы), получаемой
чаще всего путем сополимеризации исходных
продуктов: стирола (Ar - CH = CH2) и дивинилбензола
(CH2 - CH = CH -CH2). Полученная в форме зерен
пространственная сетка углеводородных цепей матрица при помещении ее в воду способна
увеличивать свой объем в 1.1 - 2.0 раза за счет
взаимодействия с полярными молекулами H2O
7.
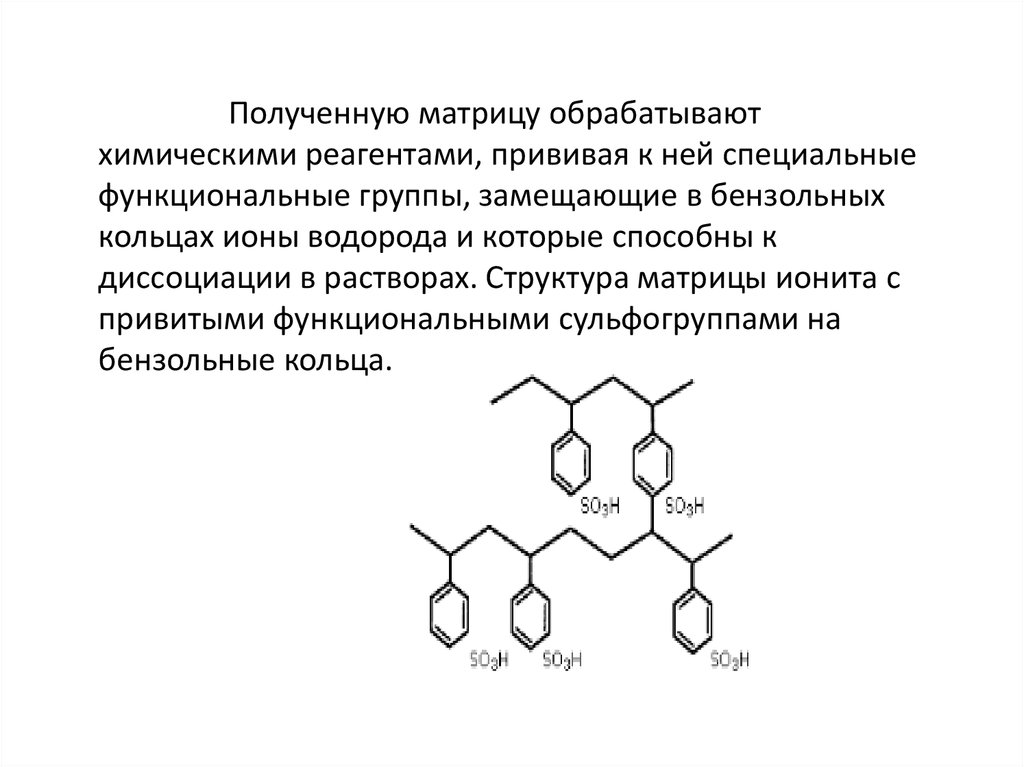
Полученную матрицу обрабатываютхимическими реагентами, прививая к ней специальные
функциональные группы, замещающие в бензольных
кольцах ионы водорода и которые способны к
диссоциации в растворах. Структура матрицы ионита с
привитыми функциональными сульфогруппами на
бензольные кольца.
8.
Структура элемента объема ионитов:а – катионит; б – анионит; 1 – матрица;
2 – потенциалообразующие фиксированные ионы;
3 – ионы диффузного слоя
9.
• Типичная реакция катионного обменазаписывается как:
2КNa + Са 2+ + 2Cl- = R2Ca + 2Na+ + 2Cl-.
• Реакция осуществляется, например, при
умягчении воды с помощью катионита в исходной
натриевой форме. Катионит поглощает из
раствора ионы-накипеобразователи кальция в
обмен на ионы Na+.
• Аналогично можно записать реакцию обмена
анионами на анионите, например:
ROH + Na+ + Cl- = RCl + Na+ + OH-.
10.
• Обратимость процессов обмена ионов позволяетмногократно использовать дорогостоящие иониты в
технологии обработки вод.
• После замены катионов Na+ в катионите ионами
Ca2+ (прямая реакция) обычно осуществляют
обратный процесс - регенерацию, приводящую к
восстановлению способности катионита извлекать
из обрабатываемой воды ионы Ca 2+.
• В ионообменной технологии большую роль играет
способность к преимущественной адсорбции одних
ионов по сравнению с другими, получившая
название селективности (избирательности) и
скорость установления ионообменного равновесия
(кинетика ионного обмена).
11. Схема ионообменного процесса в ионитном фильтре
12.
• При пропуске раствора, содержащего ионы B, черезионит, первоначально насыщенный ионами A,
протекая, раствор будет постоянно контактировать с
новыми слоями свежего (неиспользованного) ионита.
Со временем, верхние слои ионита отдадут все ионы A
и потеряют свою ионообменную способность, они как
бы истощатся (зона a). Вследствие этого переходная
зона, в которой происходит ионный обмен (зона b),
будет все дальше и дальше перемещаться вниз по
слою. При определенных условиях эта зона достигает
стационарной ширины. Распределение концентраций
обменивающихся ионов в этой зоне носит название
фронта фильтрования. В нижних слоях (зона c) ионит
еще полностью насыщен ионами A. Когда нижняя
граница переходной зоны достигнет конца слоя ионита,
наступит проскок иона B в фильтрат, что служит обычно
сигналом для отключения фильтра на регенерацию.
13. Технологические характеристики ионитов
• К физическим свойствам ионитов относятся:грануметрический состав (размер зерен),
насыпная масса, механическая прочность,
структура ионита и степень набухания в
водных растворах.
• К химическим свойствам относятся:
химическая стойкость, сила кислотности (для
катионитов) или основности (для анионитов),
обменная емкость, удельный расход реагентов
и отмывочной воды при заданной глубине
удаления из воды поглощаемых ионов,
термическая стойкость.
14.
• Крупность зерен промышленных ионитов находится впределах от 0.3 до 1.5 мм, при этом по данным ситового
анализа до 80% объема ионитов представлено зернами
диаметром от 0.5 до 1.0 мм.
• Насыпная масса ионита характеризуется массой
единицы его объема (т/м3, кг/дм3). Различают
значения насыпной массы ионита в воздушно-сухом
(gC) состоянии, а также во влажном (gB) состоянии
• Степень (коэффициент) набухания kн определяется
отношением значений gC и gB:
kн = gC/gB
kн и gB не являются постоянными величинами для
конкретного ионита, т.к. зависят от его ионной формы,
pH и состава примесей воды и других факторов,
принимая значения от 1.1 до 1.6 - 1.9.
15.
• Механическая прочность и осмотическая стабильностьзерен ионита влияет на потери материала в течение его
эксплуатации. Годовой износ отечественных ионитов,
используемых в различных установках для очистки
природных вод и конденсатов, колеблется от 10 до 35%.
• Химическая стойкость матрицы ионитов
обеспечивается степенью межмолекулярных связей,
достаточной для обеспечения ее нерастворимости. При
нормальных условиях срок службы ионитов может
достигать 10 и более лет.
• Обменная емкость ионитов является их важнейшей
технологической характеристикой. Способность к
ионному обмену определена наличием в ионитах
функциональных групп, которые у катионитов носят
кислотный характер -SO3H (сульфогруппа), -COOH
(карбоксильная группа), у анионитов - основной.
16.
• При работе ионитных фильтров фильтрованиепрекращается обычно в момент, когда
концентрация поглощаемого иона в обработанном
растворе достигнет заданного, весьма малого
значения, надежно определяемого аналитически. В
этом случае обменная емкость ионита
определяется как рабочая. Если фильтрование
заканчивается в момент проскока поглощаемого
иона при его концентрации, немного отличающейся
от средней за фильтроцикл, то такая обменная
емкость ионита будет называться емкостью "до
проскока". Значение рабочей и "до проскока"
обменных емкостей ионитов достаточно близки и
их можно принимать равными друг другу.
17. Регенерация
• 8 – 10% р-ром NaCl ( max =26%)• KCa + NaCl = KNa + CaCl 2
Регенерация делится на 4 этапа:
• 1.Обратная промывка 10 мин
• 2. Медленная промывка р-ром NaCl 50 мин.
• 3. Прямая промывка 10 мин.
• 4. Заполнение
Для регенерации 1 л натриевого катионита надо
160г сухой соли NaCl .


















 Промышленность
Промышленность








