Похожие презентации:
Карбоновые кислоты
1.
КАРБО́НОВЫЕ КИСЛО́ТЫ —КЛАСС ОРГАНИЧЕСКИХ
СОЕДИНЕНИЙ, МОЛЕКУЛЫ
КОТОРЫХ СОДЕРЖАТ ОДНУ
ИЛИ НЕСКОЛЬКО
ФУНКЦИОНАЛЬНЫХ
КАРБОКСИЛЬНЫХ ГРУПП COOH.
2.
КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТПо типу углеводородного
радикала
По числу карбоксильных
групп
предельные
одноосновные
непредельные
двухосновные
ароматические
многоосновные
3.
ОБЩАЯ ФОРМУЛА ОДНООСНОВНЫХКИСЛОТ ПРЕДЕЛЬНОГО РЯДА
СnH2n+1COOН
где n может быть равно
нулю.
4.
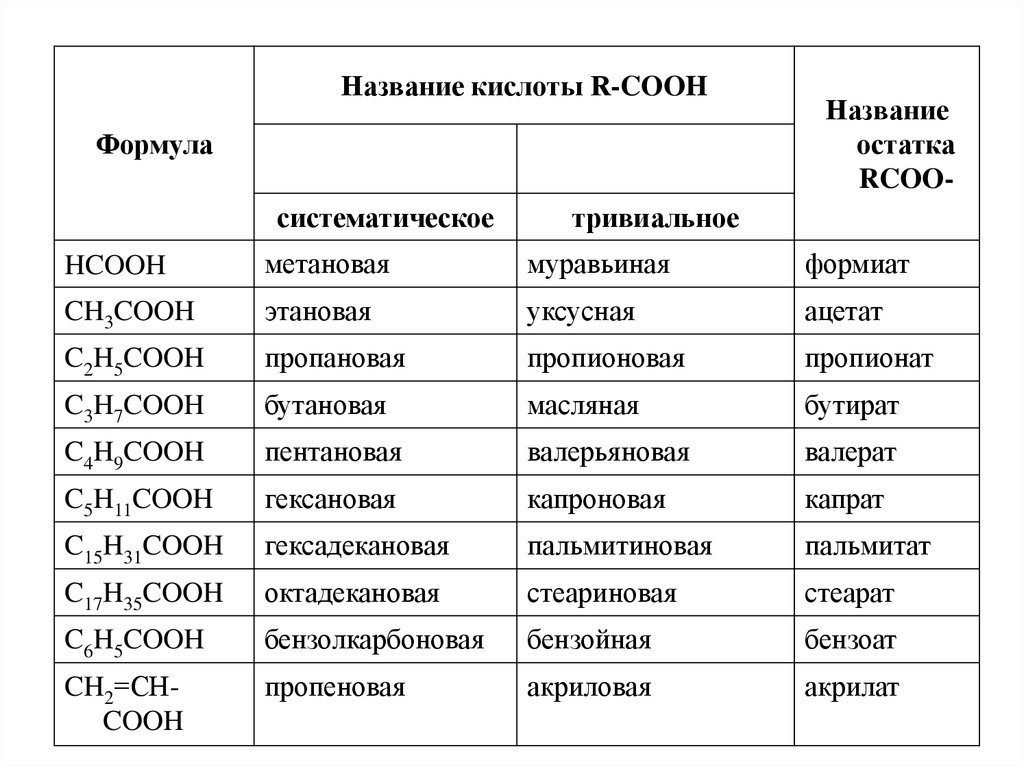
Название кислоты R-COOHФормула
систематическое
Название
остатка
RCOO-
тривиальное
HCOOH
метановая
муравьиная
формиат
CH3COOH
этановая
уксусная
ацетат
C2H5COOH
пропановая
пропионовая
пропионат
C3H7COOH
бутановая
масляная
бутират
C4H9COOH
пентановая
валерьяновая
валерат
C5H11COOH
гексановая
капроновая
капрат
C15H31COOH
гексадекановая
пальмитиновая
пальмитат
C17H35COOH
октадекановая
стеариновая
стеарат
C6H5COOH
бензолкарбоновая
бензойная
бензоат
CH2=СHCOOH
пропеновая
акриловая
акрилат
5.
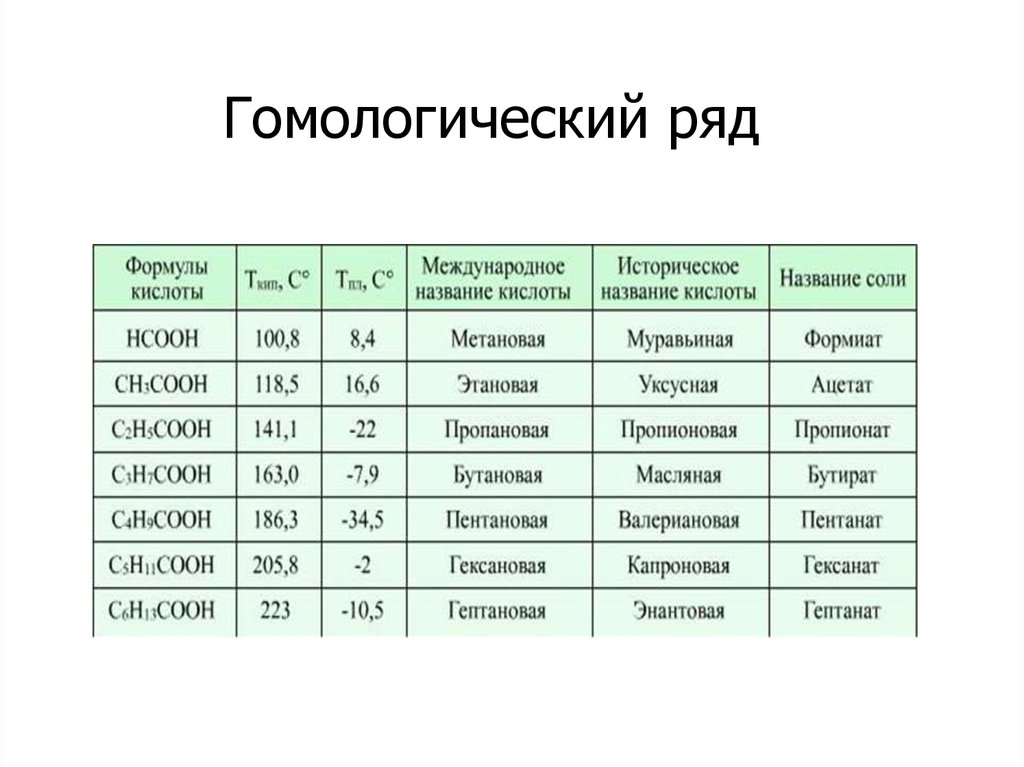
Физические свойстваНизшие карбоновые кислоты — жидкости
с острым запахом, хорошо растворимые в
воде. С повышением относительной
молекулярной массы растворимость
кислот в воде уменьшается, а температура
кипения повышается. Высшие кислоты,
начиная с пеларгоновой (н-нонановой)
СН3-(СН2)7-СООН, — твердые вещества,
без запаха, нерастворимые в воде.
Низшие карбоновые кислоты в безводном
виде и в виде концентрированных
растворов раздражают кожу и вызывают
ожоги, особенно муравьиная кислота и
уксусная кислота.
6.
Характерные химические реакцииНаиболее важные химические свойства,
характерные для большинства карбоновых
кислот:
1) Карбоновые кислоты при реакции с
металлами или их осно́вными гидроксидами
дают соли соответствующих металлов:
Также карбоновые кислоты могут вытеснять
более слабую кислоту из её соли, например:
(потом разлагается на углекислый газ и воду)
2) Карбоновые кислоты в присутствии кислого
катализатора реагируют со спиртами, образуя
сложные эфиры (реакция этерификации):
CH3COOH + СН3СН2ОН = CH3COOCH2СН3 +
H2O
7.
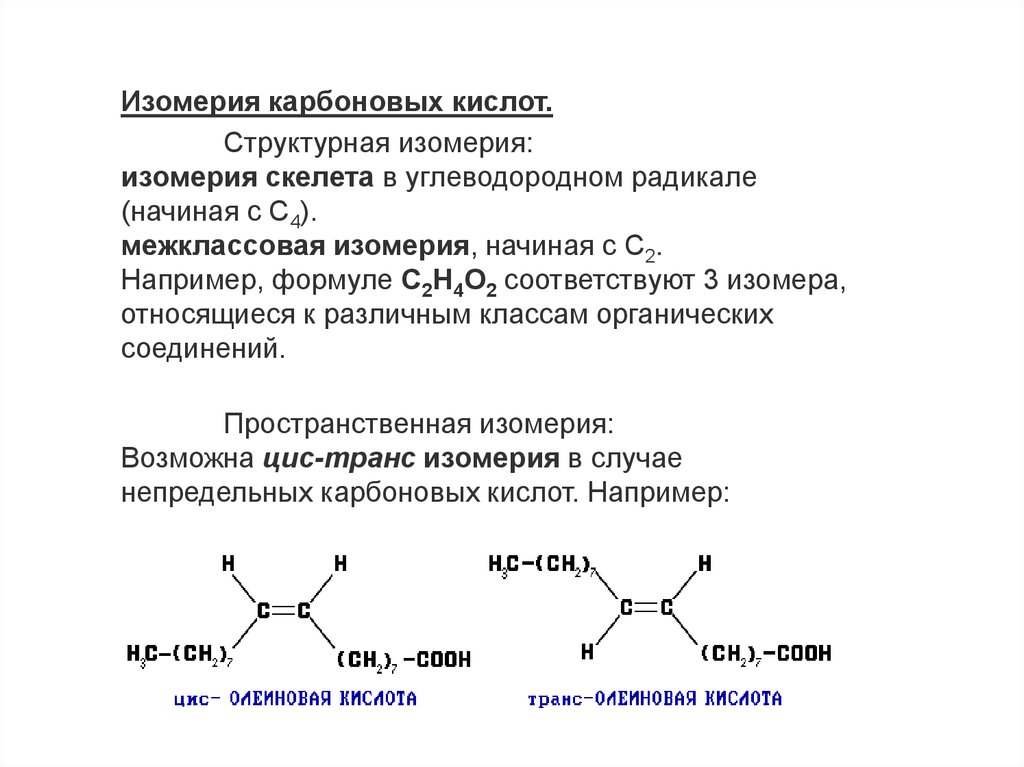
Изомерия карбоновых кислот.Cтруктурная изомерия:
изомерия скелета в углеводородном радикале
(начиная с C4).
межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 3 изомера,
относящиеся к различным классам органических
соединений.
Пространственная изомерия:
Возможна цис-транс изомерия в случае
непредельных карбоновых кислот. Например:






 Химия
Химия








