Похожие презентации:
Карбоновые кислоты. Классификация карбоновых кислот
1.
Карбоновые кислоты2.
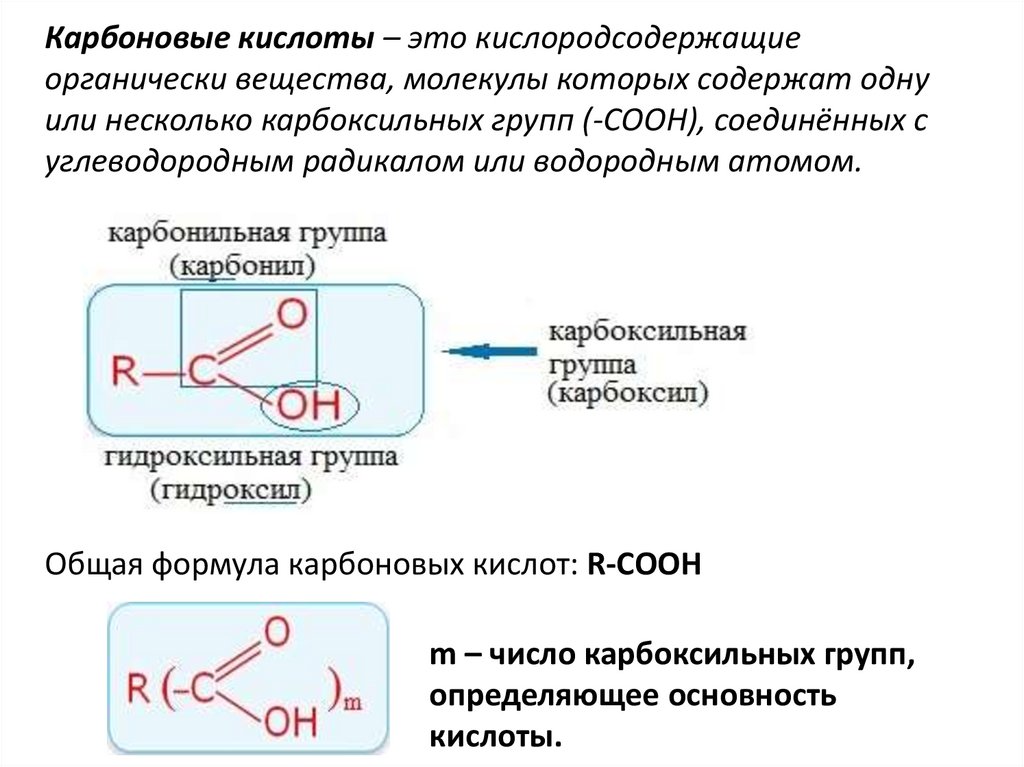
Карбоновые кислоты – это кислородсодержащиеорганически вещества, молекулы которых содержат одну
или несколько карбоксильных групп (-СOOH), соединённых с
углеводородным радикалом или водородным атомом.
Общая формула карбоновых кислот: R-СООН
m – число карбоксильных групп,
определяющее основность
кислоты.
3.
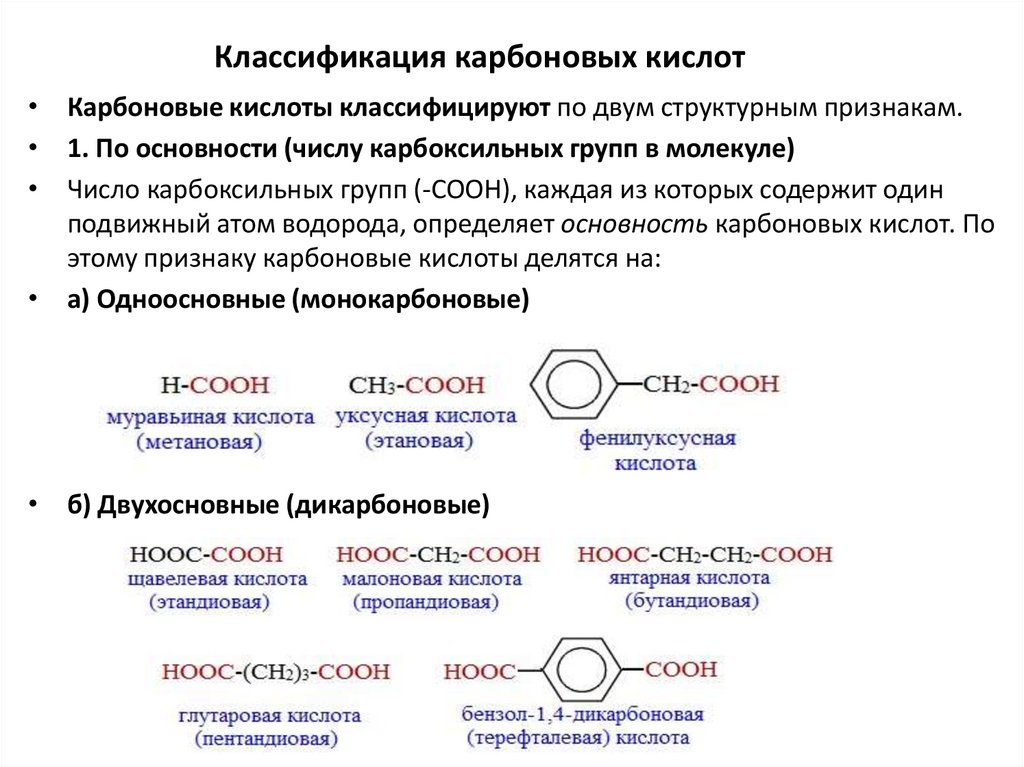
Классификация карбоновых кислот• Карбоновые кислоты классифицируют по двум структурным признакам.
• 1. По основности (числу карбоксильных групп в молекуле)
• Число карбоксильных групп (-СООН), каждая из которых содержит один
подвижный атом водорода, определяет основность карбоновых кислот. По
этому признаку карбоновые кислоты делятся на:
• а) Одноосновные (монокарбоновые)
• б) Двухосновные (дикарбоновые)
4.
• в) Многоосновные (трехосновные (трикарбоновые) ит.д.)
2. По строению углеводородного радикала
По природе углеводородного радикала карбоновые кислоты
подразделяются на:
а) Алифатические
— предельные (насыщенные)
5.
— непредельные (ненасыщенные)Алифатические (от греч. – жир) карбоновые кислоты с числом
атомов углерода больше 6 называют также жирными кислотами,
поскольку в виде сложных эфиров они входят в состав природных
жиров и масел.
6.
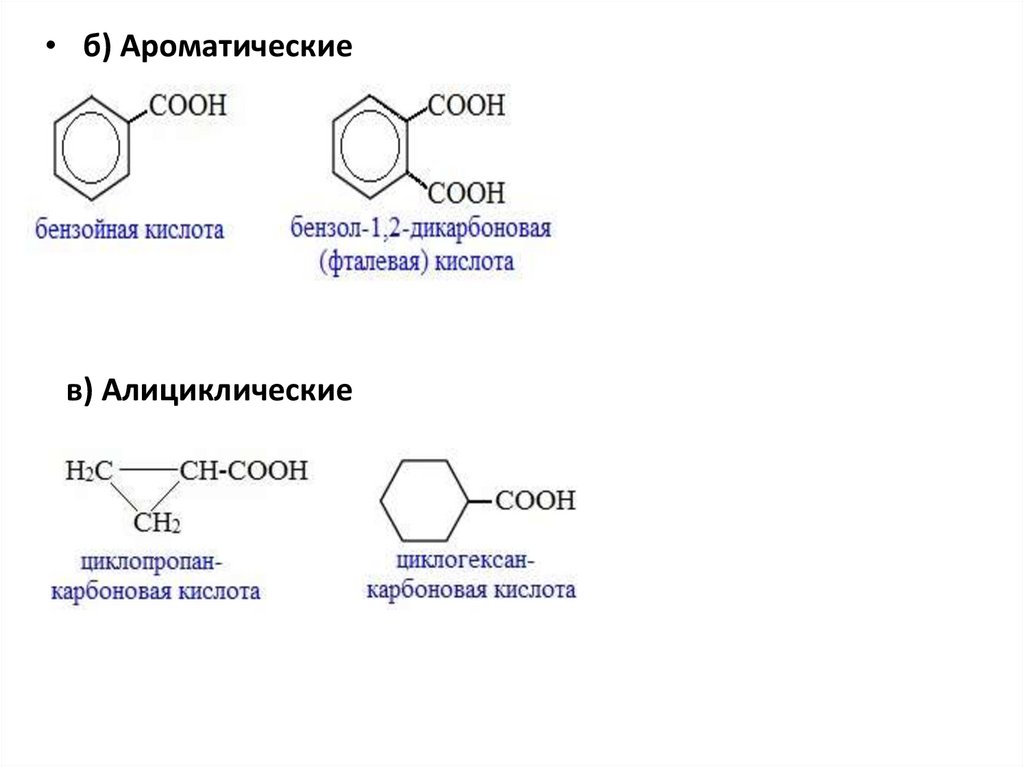
• б) Ароматическиев) Алициклические
7.
Предельные одноосновные карбоновые кислоты• Предельные одноосновные карбоновые кислоты – это
производные алканов, в молекулах которых один атом
водорода замещен на карбоксильную группу.
• Общая формула: СnН2nО2
Исключение составляет муравьиная кислота, в молекуле которой карбоксильная
группа связана не с углеводородным радикалом, а с атомом водорода.
Интересно знать!
Некоторые из карбоновых кислот получаются и расходуются в процессах
обмена веществ в очень внушительных количествах. Так, например, в
течение суток в организме человека образуется до 400 г уксусной
кислоты, что хватило бы для получения 8 л обычного уксуса.
8.
9.
Номенклатура карбоновых кислот• По систематической (заместительной) номенклатуре
IUPAC названия карбоновых кислот образуют из названий
соответствующих углеводородов с добавлением суффикса овая и слова кислота
Правила составления названий карбоновых кислот по систематической
(заместительной) номенклатуре ИЮПАК
За основу выбирают самую длинную углеводородную цепь, содержащую
карбоксильную группу.
Нумерацию главной углеродной цепи начинают с атома углерода
карбоксильной группы.
Указывают положение заместителей и их названия, первым из них
указывается наиболее простой. Несколько одинаковых заместителей
указывают с помощью приставки -ди, -три, -тетра и т. д.
К названию соответствующего алкана прибавляют суффикс -овая и
слово кислота.
10.
11.
• По систематической номенклатуре названия непредельныхкислот образуются от названия соответствующего алкена
(алкина, диена), добавляя к нему суффикса –овая и цифрой
указывают положение двойной связи. Нумерацию углеродной
цепи начинают с атома углерода карбоксильной группы.
• Названия многоосновных кислот производят от названия
соответствующего углеводорода с добавлением суффиксов
«диовая», -триовая и т.д. и слова «кислота»:
12.
• Для органических кислот широко используют тривиальныеназвания, которые обычно отражают природный источник, где
были впервые обнаружены эти соединения (H-COOH —
муравьиная кислота, CH3-COOH — уксусная кислота,
CH3-CH2-CH2-COOH – масляная).
• Положение заместителей по отношению к карбоксильной
группе в тривиальных названиях обозначают греческими
буквами, начиная с атома углерода, соседнего с
карбоксильной группой: α, β, γ и др.:
13.
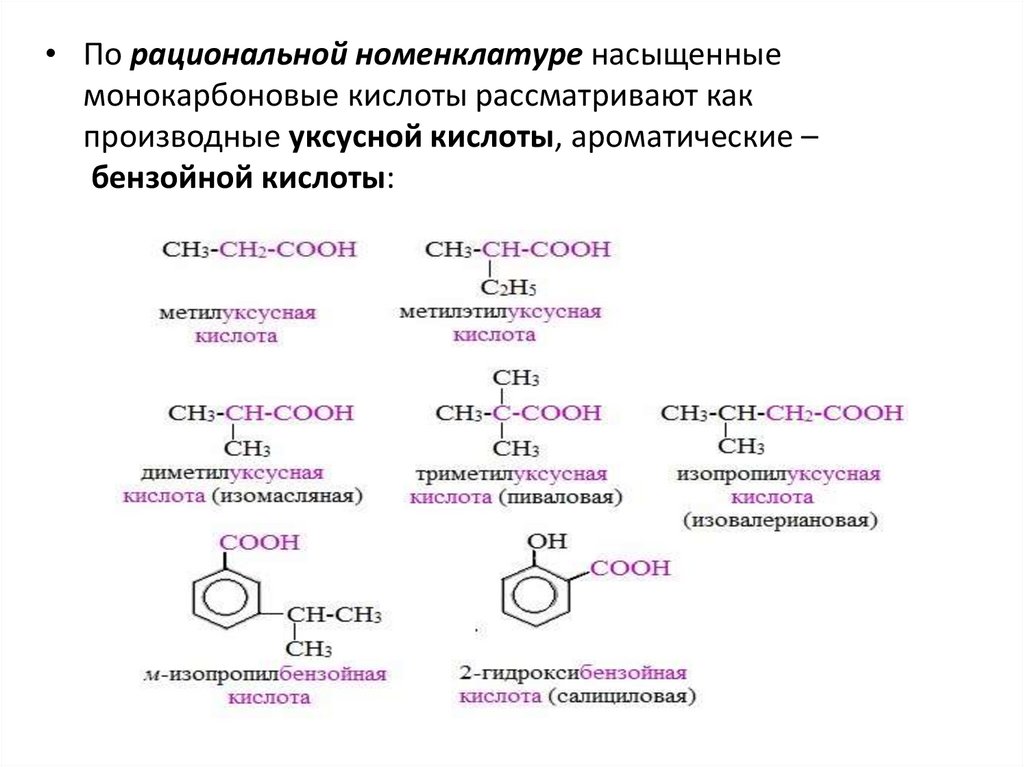
• По рациональной номенклатуре насыщенныемонокарбоновые кислоты рассматривают как
производные уксусной кислоты, ароматические –
бензойной кислоты:
14.
• Примеры названия карбоновых кислот15.
Изомерия карбоновых кислот• 1. Структурная изомерия
а) Изомерия углеродного скелета (начиная с
C4)
• Изомерия углеродного скелета начинается с
бутановой кислоты С3Н7СООН, которая
существует в виде двух изомеров:
16.
• б) Межклассовая изомерия (начиная с C2)Например, формуле C2H4O2 соответствуют 4 изомера,
относящиеся к различным классам органических соединений:
17.
• в) Изомерия положения кратной связи• Этот вид изомерии характерен для непредельных
карбоновых кислот. Например, кротоновая кислота имеет
три изомера:
18.
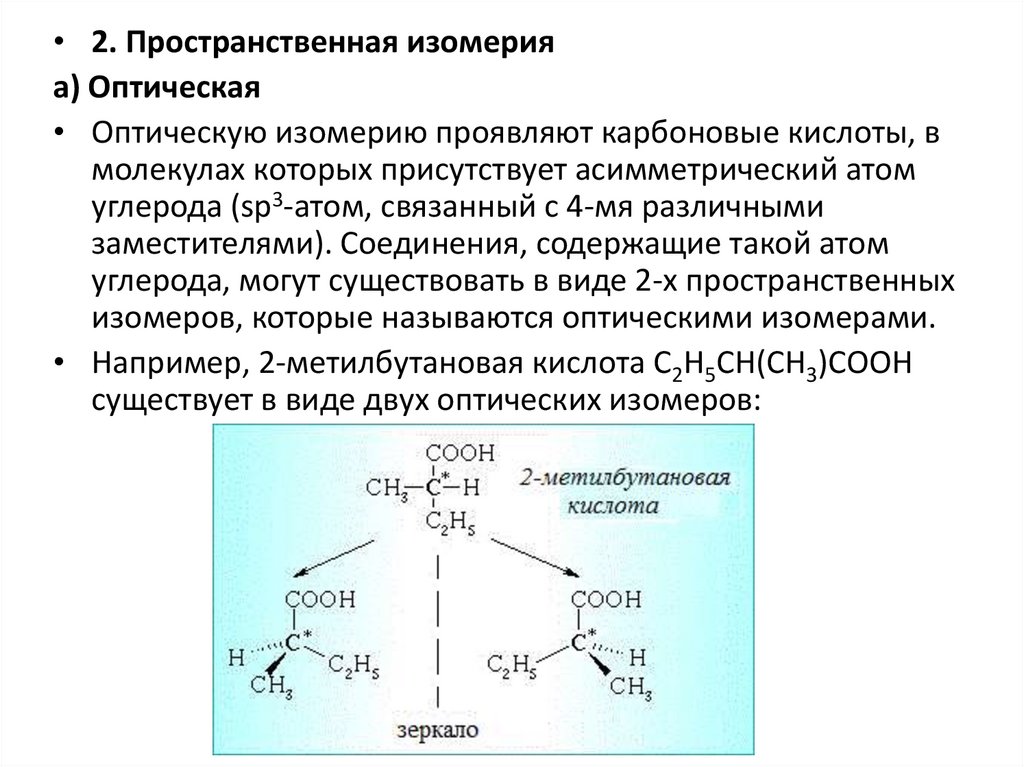
• 2. Пространственная изомерияа) Оптическая
• Оптическую изомерию проявляют карбоновые кислоты, в
молекулах которых присутствует асимметрический атом
углерода (sp3-атом, связанный с 4-мя различными
заместителями). Соединения, содержащие такой атом
углерода, могут существовать в виде 2-х пространственных
изомеров, которые называются оптическими изомерами.
• Например, 2-метилбутановая кислота С2Н5СН(СН3)СООН
существует в виде двух оптических изомеров:
19.
• б) Цис- транс – изомерия (геометрическая изомерия)• Этот вид изомерии характерен для непредельных
карбоновых кислот. Так, для олеиновой кислоты С17Н33СООН
существует два геометрических изомера:
20.
Строение карбоксильной группы• Карбоксильная группа (карбоксил,
карбоксигруппа) –СООН состоит из двух
функциональных групп – карбоксильной
группы (карбонила) >C=O и гидроксильно
й группы (гидроксила) -OH, взаимно
влияющих друг на друга.
21.
• В карбонильной группе электронная плотность смещена к атомукислорода в силу его высокой электроотрицательности. Вследствие
этого на карбонильном атоме углерода возникает частичный
положительный заряд.
• Атом углерода стремится компенсировать положительный заряд и
притягивает к себе неподеленную пару электронов атома кислорода
гидроксильной группы.
• В свою очередь, атом кислорода оттягивает на себя электронную
плотность по связи О-Н от атома водорода гидроксогруппы.
• Вследствие этого связь между атомами кислорода и водорода в
гидроксильной группе становится более полярной и атом водорода
приобретает повышенную подвижность, что существенно упрощает
его отрыв в виде протона (Н+).
22.
• Кислотные свойства карбоновых кислот обусловленысмещением электронной плотности к карбонильному
атому кислорода и вызванную этим сильную поляризацию
связи О-Н (по сравнению со спиртами и фенолами), в
результате чего облегчается отрыв атома водорода в виде
протона.
• Карбоновые кислоты диссоциируют с образованием
ионов водорода Н+:
Для карбоновых кислот, в отличие от альдегидов, не
характерны реакции присоединения по двойной связи
>С=О, за счет уменьшения положительного заряда на
карбонильном атоме углерода атомом кислорода
гидроксогруппы.
23.
Физические свойства• Низшие насыщенные карбоновые кислоты (С1-С3)
при обычных условиях представляют собой
легкоподвижные жидкости, обладающие
характерным острым запахом. Например, этановая
(уксусная) кислота имеет характерный «уксусный»
запах.
• Кислоты состава С4-С9 – вязкие маслянистые
жидкости с неприятным запахом, напоминающим
запах пота, плохо растворимые в воде
(разветвленные кислоты до С13 — жидкости).
Высшие карбоновые кислоты (с С10) — твердые
вещества, без запаха, нерастворимые в воде.
24.
• Алифатические карбоновые кислоты с количеством атомов углеродаболее 10 относят к высшим жирным кислотам (ВЖК), так как
подавляющее большинство из них могут быть выделены из жиров
животного или растительного происхождения.
• Ненасыщенные кислоты при комнатной температуре – жидкости. Все
дикарбоновые и ароматические кислоты при комнатной температуре
– кристаллические вещества.
• Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в
любых соотношениях. С увеличением молекулярной массы кислот
растворимость в воде уменьшается. Высшие карбоновые кислоты,
например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН –
бесцветные твердые вещества, не растворимые в воде.
• Монокарбоновые кислоты хорошо растворяются также во многих
органических растворителях.
25.
• Температуры кипения и плавления кислотзначительно выше температур кипения и
плавления спиртов и альдегидов с тем же
количеством атомов углерода.
• Карбоновые кислоты имеют аномально
высокие температуры кипения из-за наличия
межмолекулярных водородных связей.
Водородная связь, образуемая водородом
гидроксильной группы одной молекулы с
карбонильным кислородом другой, более
прочная, чем в спиртах.
26.
• В твердом и жидком состоянии молекулынасыщенных монокарбоновых кислот
димеризуются в результате образования
между ними водородных связей в
устойчивые циклические димеры:
27.
Растворимость карбоновыхкислот в воде несколько выше,
чем у спиртов, так как и с водой
кислоты образуют более
прочные водородные связи.
В водных растворах кислоты
образуют линейные димеры:
28.
• Муравьиная кислота НСООН – бесцветнаяжидкость с резким запахом, кипит при
1010С. Растворяется в воде в любых
количествах. Муравьиная кислота
содержится в выделениях муравьев, в
крапиве, и хвое ели. Вызывает ожоги на
коже. Ожог крапивой – это результат
раздражающего действия муравьиной
кислоты.
29.
• Уксусная кислота СН3СООН при обычной температуре –бесцветная жидкость, кислая на вкус, с резким запахом.
Температура кипения 100%-й уксусной кислоты – 1180C.
Безводная уксусная кислота застывает при температуре
ниже + 16,80С, образуя красивые кристаллы, похожие на
лед, поэтому ее называют ледяной уксусной кислотой. В
кристаллах между молекулами уксусной кислоты
образуются особенно прочные водородные связи.
• 3-9% водный раствор кислоты известен под названием
столового уксуса, который применяется как приправа к
пище. 70-80% уксусная кислота называется уксусной
эссенцией.
• Уксусная кислота смешивается во всех отношениях с
водой, спиртом, эфиром, бензолом. Ледяная уксусная
кислота хороший растворитель многих органических
веществ. Концентрированные растворы уксусной кислоты
при попадании на кожу вызывают ожоги.
30.
31.
• Пальмитиновая и стеариновая кислоты — твердыевещества, белого цвета, жирные на ощупь,
нерастворимы в воде, умеренно растворимы в
спирте, эфире, хлороформе и других органических
растворителях.
• Простейшая ароматическая кислота —
бензойная C6H5COOH (т. пл. 122,40С) — легко
возгоняется, т.е. переходит в газообразное
состояние, минуя жидкое. При охлаждении её пары
сублимирутся в кристаллы. Это свойство
используется для очистки вещества от примесей. В
холодной воде растворяется плохо. Хорошо
растворяется в спирте и эфире.
«Возгонка бензойной кислоты»
32.
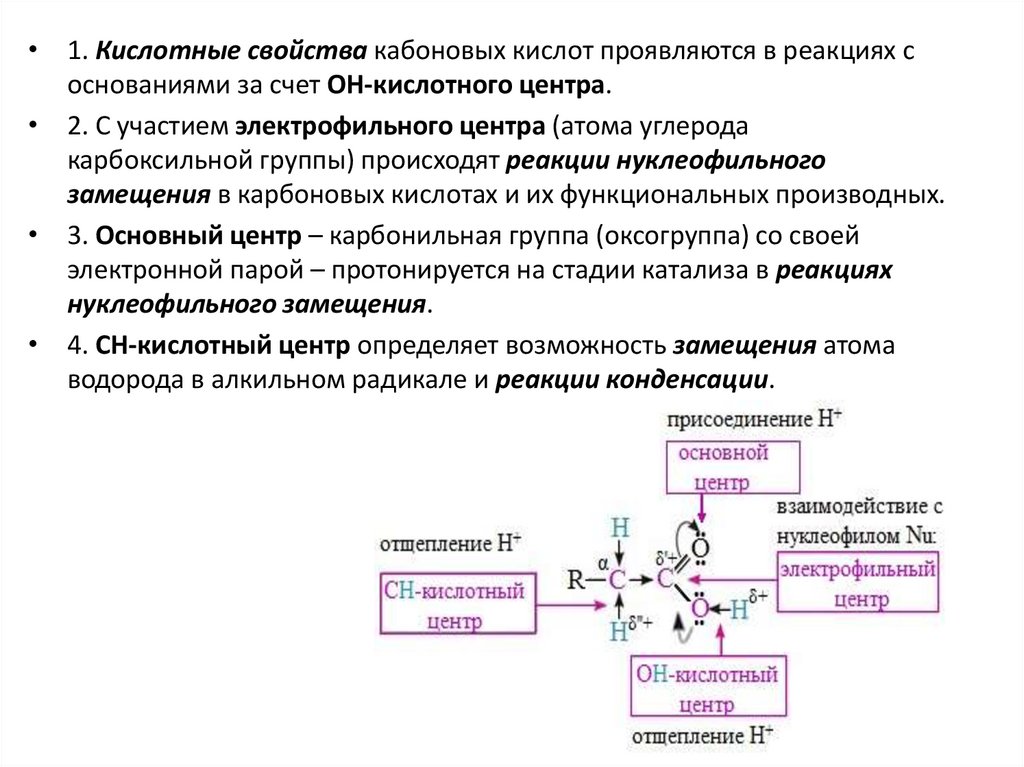
• 1. Кислотные свойства кабоновых кислот проявляются в реакциях соснованиями за счет ОН-кислотного центра.
• 2. С участием электрофильного центра (атома углерода
карбоксильной группы) происходят реакции нуклеофильного
замещения в карбоновых кислотах и их функциональных производных.
• 3. Основный центр – карбонильная группа (оксогруппа) со своей
электронной парой – протонируется на стадии катализа в реакциях
нуклеофильного замещения.
• 4. СН-кислотный центр определяет возможность замещения атома
водорода в алкильном радикале и реакции конденсации.
33.
• Карбоновые кислоты вступают в реакции сразличными веществами и образуют
разнообразные соединения, среди которых
большое значение имеют функциональные
производные, т.е. соединения, полученные в
результате реакций по карбоксильной группе.
34.
I. Реакции с разрывом связи О-Н• Кислотные свойства карбоновых кислот обусловлены
подвижностью атома водорода карбоксильной группы и
их способностью отщеплять его в виде протона)
• Предельные монокарбоновые кислоты обладают всеми
свойствами обычных кислот.
• Карбоновые кислоты изменяют окраску индикаторов.
35.
1. Диссоциация• В водных растворах монокарбоновые кислоты ведут себя
как одноосновные кислоты: они диссоциируют с
образованием протона (Н+) и кислотного остатка
(карбоксилат-иона):
Уравнение реакции, учитывающее участие молекулы воды:
36.
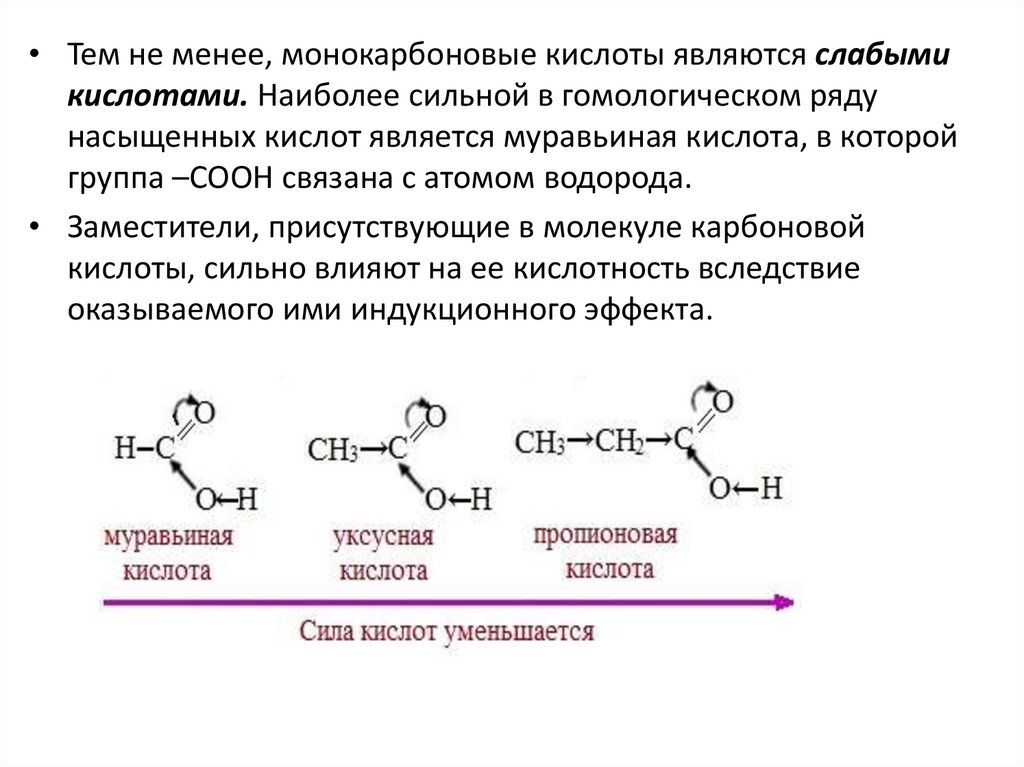
• Тем не менее, монокарбоновые кислоты являются слабымикислотами. Наиболее сильной в гомологическом ряду
насыщенных кислот является муравьиная кислота, в которой
группа –СООН связана с атомом водорода.
• Заместители, присутствующие в молекуле карбоновой
кислоты, сильно влияют на ее кислотность вследствие
оказываемого ими индукционного эффекта.
37.
• Такие заместители, как хлор или фенильный радикал,оттягивают на себя электронную плотность и,
следовательно, вызывают отрицательный индукционный
эффект (— I). Оттягивание электронной плотности от
карбоксильного атома водорода приводит к повышению
кислотности карбоновой кислоты.
Карбоновые кислоты – слабые электролиты. Равновесие процесса диссоциации
сильно смещено влево, об этом свидетельствует тот факт, что даже
сильноразбавленные водные растворы кислот имеют резкий запах.
38.
2. Образование солейКарбоновые кислоты проявляют все свойства минеральных кислот.
Карбоновые кислоты при взаимодействии с активными металлами,
основными оксидами, основаниями и солями слабых кислот образую
соли.
а) взаимодействие с активными металлами
39.
• б) взаимодействие c основаниями (реакциянейтрализации)
• в) взаимодействие с основными и амофтерными оксидами
г) взаимодействие с солями более слабых кислот
40.
• д) взаимодействие с аммиаком или гидроксидом аммонияНазвания солей составляют из названий остатка RCOO–
(карбоксилат-иона) и металла. Например, CH3COONa – ацетат
натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат
калия и т.п.
Отличие карбоновых кислот от минеральных заключается в
возможности образования ряда функциональных
производных.
Качественная реакция на ацетат-ион СН3СОО—
! Запах уксусной кислоты.
41.
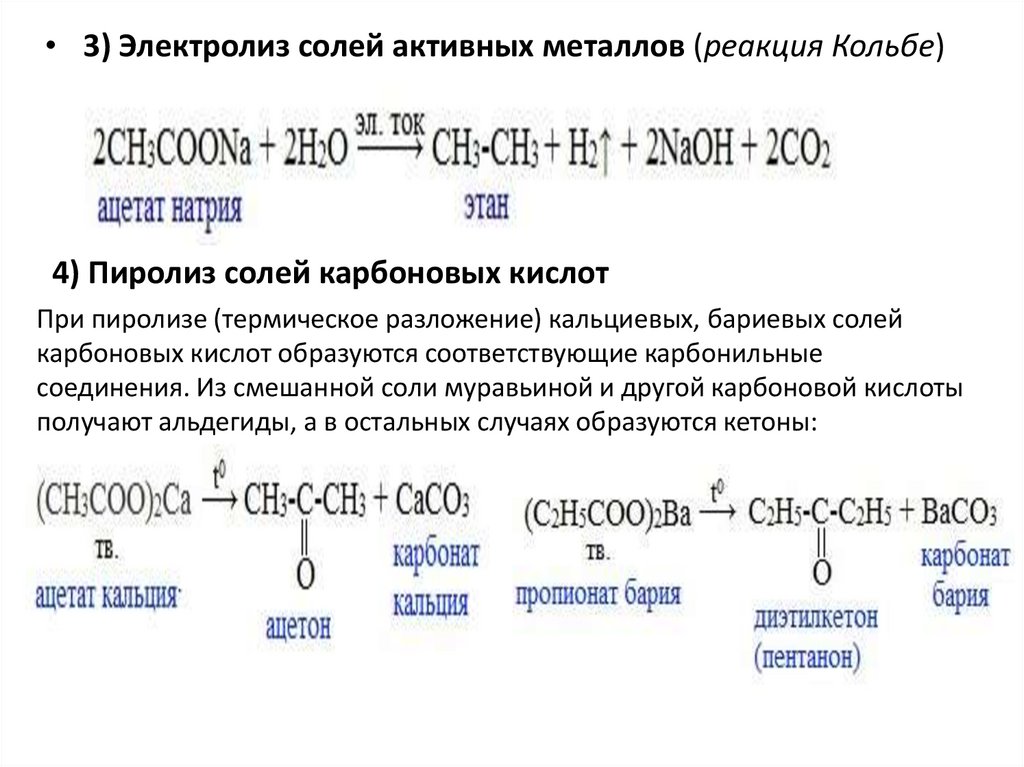
• 3) Электролиз солей активных металлов (реакция Кольбе)4) Пиролиз солей карбоновых кислот
При пиролизе (термическое разложение) кальциевых, бариевых солей
карбоновых кислот образуются соответствующие карбонильные
соединения. Из смешанной соли муравьиной и другой карбоновой кислоты
получают альдегиды, а в остальных случаях образуются кетоны:
42.
5) Декарбоксилирование солей щелочных металлов(реакция Дюма)
• В процессе сплавления солей карбоновых кислот с
твердой щелочью происходит расщепление
углеродной связи и образуются алканы с числом
атомов углерода на один меньше, чем у исходной
кислоты:
43.
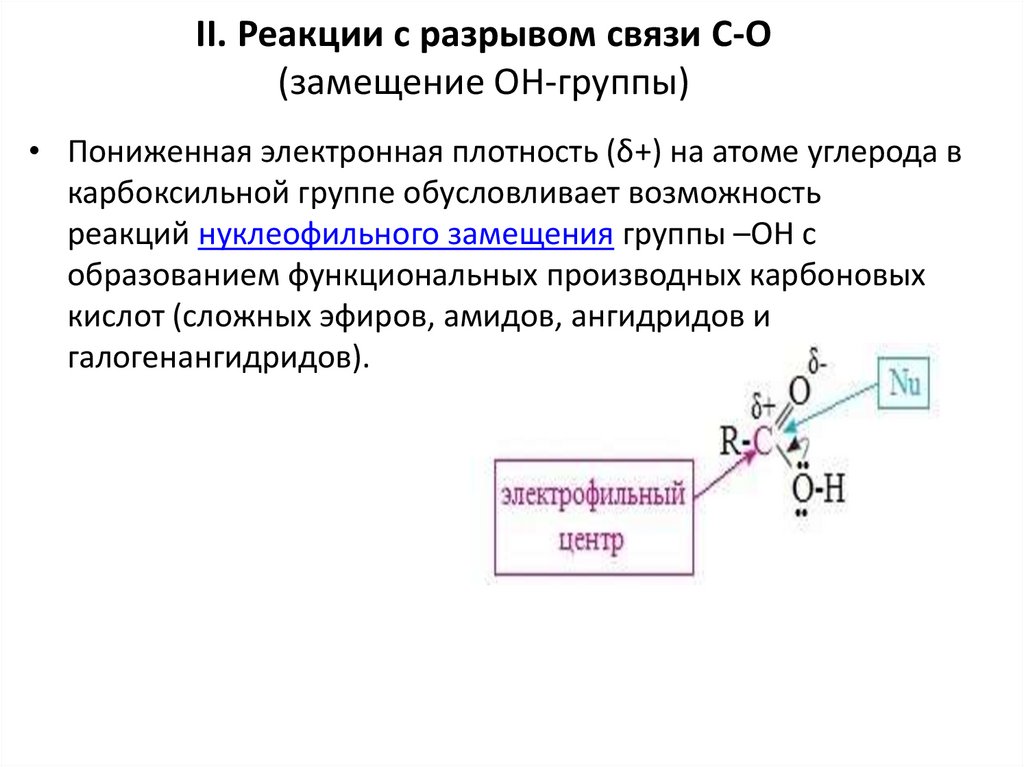
II. Реакции с разрывом связи C-О(замещение ОН-группы)
• Пониженная электронная плотность (δ+) на атоме углерода в
карбоксильной группе обусловливает возможность
реакций нуклеофильного замещения группы –ОН с
образованием функциональных производных карбоновых
кислот (сложных эфиров, амидов, ангидридов и
галогенангидридов).
44.
• 1. Взаимодействие со спиртами с образованием сложныхэфиров (реакция этерификации)
• Карбоновые кислоты при нагревании в присутствии
кислотного катализатора реагируют со спиртами, образуя
сложные эфиры:
45.
• Взаимодействие с аммиаком с образованиемамидов
• Амиды получают из карбоновых кислот и
аммиака через стадию образования аммониевой
соли, которую затем нагревают:
46.
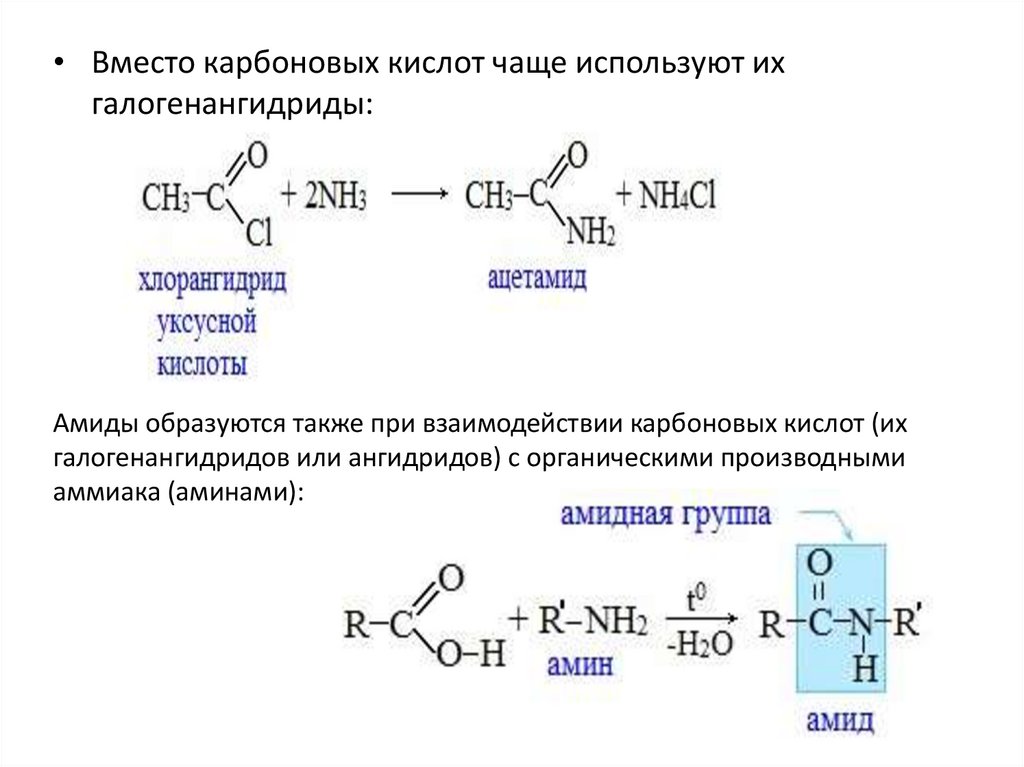
• Вместо карбоновых кислот чаще используют ихгалогенангидриды:
Амиды образуются также при взаимодействии карбоновых кислот (их
галогенангидридов или ангидридов) с органическими производными
аммиака (аминами):
47.
• 3. Взаимодействие с галогенидами фосфора илитионилхлоридом с образованием галогенангидридов
карбоновых кислот
• Наибольшее значение имеют хлорангидриды. Хлорирующие
реагенты –галогениды фосфора PCl3, PCl5, тионилхлорид SOCl2.
48.
• . Образование ангидридовкислот (межмолекулярная дегидратация)
Ангидриды кислот образуются в результате межмолекулярной
дегидратации кислот при их нагревании в присутствии оксида фосфора (V) в
качестве водоотнимающего средства.
Вещества, которые образуются при отщеплении воды от органических
кислот, называются ангидридами.
49.
• Смешанные ангидриды карбоновых кислот можнополучить при взаимодействии хлорангидрида одной
кислоты с безводной солью другой карбоновой кислоты:
Муравьиная кислота не образует ангидрида. Дегидратация ее приводит к
образованию оксида углерода (II)
50.
III. Реакции с разрывом связи C-Н у ɑ-углеродногоатома (реакции с участием радикала)
1. Реакции замещения (с галогенами)
• Атомы водорода у ɑ-углеродного атома более подвижны,
чем другие атомы водорода в радикале кислоты и могут
замещаться на атомы галогена с образование ɑгалогенкарбоновых кислот.
• Карбоновые кислоты взаимодействуют с галогенами в
присутствии красного фосфора (реакция Геля-ФольгардаЗелинского):
51.
2-Хлорпропионовая кислота – промежуточный продукт для полученияаминокислот. Действием на 2-хлорпропионовую кислоту аммиака
получают 2-аминопропионовую кислоту (аланин):
52.
• При пропускании хлора через кипящую уксусную кислоту вприсутствии красного фосфора образуется кристаллическое
вещество – хлоруксусная кислота:
53.
IV. Реакции окисления (горение)В отличие от альдегидов, карбоновые кислоты достаточно
устойчивы к действию даже такого сильного окислителя, как
перманганат калия. Исключение составляет муравьиная
кислота, которая проявляет восстановительные свойства
благодаря наличию альдегидной группы.
54.
V. Реакции каталитического восстановления• Карбоновые кислоты с трудом восстанавливаются
каталитическим гидрированием, однако при
взаимодействии с алюмогидридом лития (LiAlH4) или
дибораном (В2Н6) восстановление осуществляется
достаточно энергично:
55.
• Особенности строения и свойства муравьиной кислоты- Муравьиная (метановая) кислота НСООН по своему строению и
свойствам отличается от остальных членов гомологического ряда
предельных монокарбоновых кислот.
В отличие от других карбоновых кислот в молекуле муравьиной
кислоты функциональная карбоксильная группа связана не с
углеводородным радикалом, а с атомом водорода. Поэтому
муравьиная кислота является более сильной кислотой по
сравнению с другими членами своего гомологического ряда.
- Все предельные карбоновые кислоты устойчивы к действия
концентрированной серной и азотной кислот. Но муравьиная
кислота при нагревании с концентрированной серной кислотой
разлагается на воду и монооксид углерода (угарный газ).
56.
• 1. Разложение при нагреванииПри нагревании с концентрированной H2SO4 муравьиная кислота
разлагается на оксид углерода (II) и воду (Данную реакцию
используют в лаборатории для получения чистого оксида
углерода (II))
• Молекула муравьиной кислоты, в отличие от других
карбоновых кислот, наряду с карбоксильной группой содержит
в своей структуре и альдегидную группу.
57.
• Поэтому муравьиная кислота вступает в реакции,характерные как для кислот, так и для альдегидов. Как и
альдегиды, НСООН проявляет восстановительные
свойства. Проявляя свойства альдегида, муравьиная
кислота легко окисляется до угольной кислоты:
2. Окисление перманганатом калия
58.
• 3. Реакция «серебряного зеркала»Муравьиная кислота окисляется аммиачным раствором Ag2О
и гидроксидом меди (II) Cu (OH)2, т.е. дает качественные
реакции на альдегидную группу!
или в упрощенном виде
4. Окисление гидроксидом меди (II)
59.
• 5. Окисление хлором, хлоридом ртутиФормиаты щелочных металлов при сплавлении образуют
соли щавелевой кислоты — оксалаты:
60.
61.
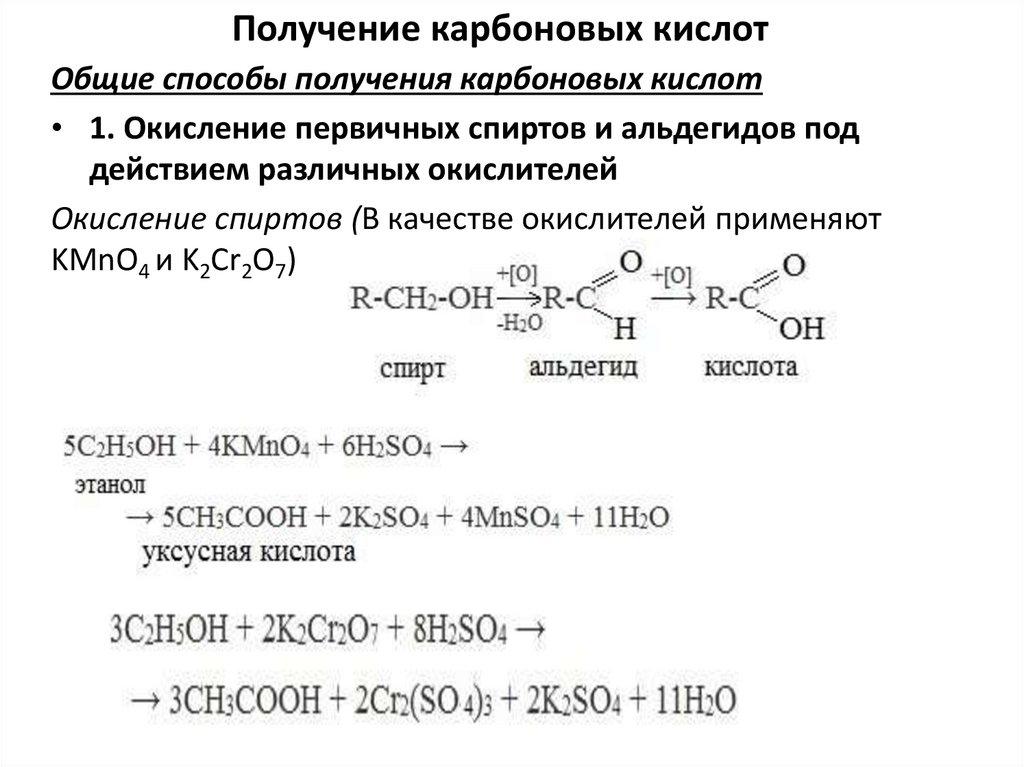
Получение карбоновых кислотОбщие способы получения карбоновых кислот
• 1. Окисление первичных спиртов и альдегидов под
действием различных окислителей
Окисление спиртов (В качестве окислителей применяют
KMnO4 и K2Cr2O7)
62.
• Окисление альдегидовДля окисления альдегидов используются те же
реагенты, что и для спиртов.
А также для них характерны реакции «серебряного зеркала» и окисление
гидроксидом меди (II) – качественные реакции альдегидов:
При окислении перманганатом калия
происходит обесцвечивание фиолетоворозового раствора.
При окислении дихроматом калия — цвет
меняется с оранжевого на зеленый.
63.
• 2. Гидролиз галогензамещенных углеводородов,содержащих три атома галогена у одного атома углерода
В результате реакции образуются спирты, содержащие три
группы ОН у одного атома углерода. Такие спирты
неустойчивы и отщепляют воду с образованием карбоновой
кислоты:
3. Использование реактива Гриньяра (по схеме)
64.
• 4. Получение карбоновых кислот из цианидов (нитрилов)• Этот способ позволяет наращивать углеродную цепь при
получении исходного цианида.
Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил,
метилцианид) при нагревании гидролизуется с образованием ацетата
аммония:
65.
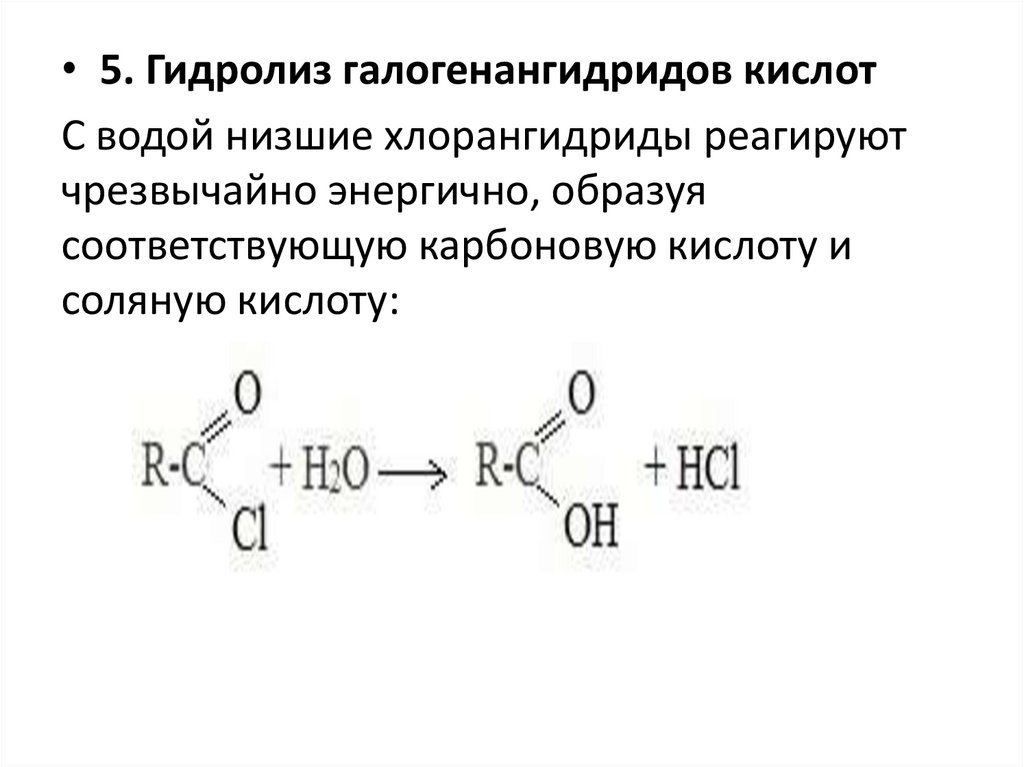
• 5. Гидролиз галогенангидридов кислотС водой низшие хлорангидриды реагируют
чрезвычайно энергично, образуя
соответствующую карбоновую кислоту и
соляную кислоту:
66.
В промышленности:• 1. Выделяют из природных продуктов
(жиров, восков, эфирных и растительных масел)
• 2. Окисление алканов кислородом воздуха ( в
присутствии катализаторов – солей марганца или при
нагревании под давлением)
Обычно образуется смесь кислот. При окислении бутана
единственным продуктом является уксусная кислота:
67.
• 3. Окисление алкенов и алкиновПри жестком окислении алкенов кипящим раствором
KMnO4 в кислой среде происходит полный разрыв двойной
связи:
68.
• При жестком окислении (нагревание, концентрированныерастворы, кислая среда) происходит расщепление
углеродного скелета молекулы алкина по тройной связи и
образуются карбоновые кислоты:
4. Окисление гомологов бензола (получение бензойной
кислоты)
69.
• В лаборатории• 1. Гидролиз сложных эфиров
При кислотном гидролизе получают карбоновые кислоты и
спирты (реакция обратная этерификации):
2. Из солей карбоновых кислот
3. Гидролиз ангидридов кислот
При легком нагревании с водой ангидриды образуют
соответствующие карбоновые кислоты:
4. Щелочной гидролиз галоген производных карбоновых
кислот
70.
Специфические способы получения важнейших кислотСпособы получения НСООН
• 1. Взаимодействие оксида углерода (II) с гидроксидом
натрия
Муравьиную кислоту получают нагреванием под давлением
гидроксида натрия и оксида углерода (II) под давлением и
обработкой полученного формиата натрия серной кислотой:
2. Каталитическое окисление метана
3. Декарбоксилирование щавелевой кислоты
Муравьиную кислоту можно получить при нагревании
щавелевой кислоты:
71.
Способы получения СН3СООНПолучение уксусной кислоты для химических целей
• 1. Синтез из ацетилена
Данный способ получения уксусной кислоты основан на
окислении уксусного альдегида, который в свою очередь
получают из ацетилена по реакции Кучерова (ацетилен получают
из очень доступного сырья — метана):
2. Каталитическое окисление бутана
Большое значение имеет способ получения уксусной кислоты,
основанный на окислении бутана кислородом воздуха:
72.
• 3. Каталитическое карбонилирование метанолаПолучение уксусной кислоты для пищевых целей
4. Уксуснокислое брожение этанола
Уксусную кислоту для пищевых целей получают
уксуснокислым брожением жидкостей, содержащих спирт
(вино. пиво):




























































 Химия
Химия








