Похожие презентации:
ДВС-синдром. ТЭЛА
1. ДВС синдром. ТЭЛА
2. Определение
Синдром диссеминированного внутрисосудистогосвертывания (ДВС-синдром, коагулопатия
потребления, дефибринация, тромбогемор-рагический
синдром, внутрисосудистое микросвертывание и
др.) называется динамический патологический процесс
дезорганизации системы гемостаза, приводящий при
спонтанном своем течении к тяжелому повреждению и
гибели органов и тканей организма в результате либо
необратимого тромбообразования и блокады
микроциркуляторного русла, либо смертельного
кровотечения.
3.
ДВС-синдром (диссеминированноевнутрисосудистое
свёртывание, коагулопатия
потребления,
тромбогеморрагический
синдром) — нарушенная
свёртываемость крови по
причине массивного
освобождения из тканей
тромбопластических
веществ.
4. Определение
ДВС - синдром неспецифичен и универсален,поскольку возникает при самых разнообразных
заболеваниях.
В основе лежит интенсивная или длительная
активация коагуляционного потенциала крови,
которая приводит к истощению и срыву
противосвертывающих механизмов, в первую очередь
антитромбина III и протеина С.
Вследствие этого происходит свертывание крови
преимущественно в зоне микроциркуляции,
активирование фибринолиза, системы моно- нуклеарных
фагоцитов, калликреин-кининовой системы, изменением
гемодинамики, рН крови.
5. Причины ДВС-синдрома
ДВС-синдром складывается из признаков основнойформы патологии, вызвавшей его развитие, а также из
клинических и лабораторных проявлений самого
синдрома.
Первичная ранняя диагностика основана на выявлении
тех воздействий и видов патологии, при которых
развитие ДВС-синдрома неизбежно либо
высоковероятно.
К ним в первую очередь относятся все виды шока.
Выраженность ДВС-синдрома обычно соответствует
тяжести и длительности шокового состояния, глубине
характерных для него циркуляторных расстройств.
6. Причины ДВС-синдрома
Вторая частая причина возникновения ДВС-синдрома(около 50% всех случаев) — гнойно-септические
процессы, бактериемии, септицемии.
Об этих разновидностях ДВС-синдрома следует думать
при развитии у больных тромбогеморрагий на фоне
повышенной температуры тела, ознобов, потливости,
признаков поражений органов инфекционного генеза
(особенно с абсцедированием), в том числе и тяжелых
форм кишечной токсикоинфекции (понос, рвота,
дегидратация и др.) в сочетании с лейкоцитозом или
лейкопенией со сдвигом лейкоцитарной формулы влево,
токсигенной зернистостью лейкоцитов и нарушениями
свертываемости крови.
7. Причины ДВС-синдрома
К ДВС ведут все острые гемолитические анемии, втом числе обусловленные трансфузиями несовместимой
по группам АВО или резус фактору крови,
инфицированной крови и гемопрепаратов с истекшим
сроком хранения.
К развитию ДВС-синдрома ведут и анафилактические
реакции на гемопрепараты, кровезаменители и
лекарственные средства.
8. Причины ДВС-синдрома
К развитию ДВС-синдрома ведут и чрезмерномассивные (по 5 л и более) трансфузии
совместимой консервированной крови
(так называемый синдром массивных
трансфузий).
ДВС-синдром развивается также при всех
острых отравлениях, вызывающих шок,
гемолиз и внутрисосудистое свертывание
крови, в том числе при отравлениях ядами
змей, содержащими коагулирующие кровь
ферменты — токсины гадюковых и
щитомордников.
9. Причины ДВС-синдрома
В акушерской практике острый ДВС-синдром можетвозникнуть при предлежании и ранней отслойки
плаценты, при раннем отхождении околоплодных вод,
амниотической эмболии, внутриутробной гибели плода.
ДВС-синдромом нередко осложняются деструктивные
процессы в органах (инфаркт миокарда, мозговой
инсульт, острая дистрофия печени, геморрагический и
деструктивный панкреатит), ожоги кожи и химические
ожоги пищевода и желудка.
10.
11. Действия тромбина и их результат:
• образование фибрина — снижение активностифакторов I, II;
• агрегация тромбоцитов — снижение
количества тромбоцитов;
• активация факторов V, VIII — снижение
концентрации факторов V, VIII;
• активация фактора ХIII — снижение
концентрации фактора XIII;
• активация системы протеина С/протеина S —
снижение их концентрации;
• активация фибринолитической системы.
12. Действия плазмина и их результат:
• деградация фибрина — значительноеповышение продуктов деградации фибрина;
• деградация фибриногена — снижение
концентрации фактора I;
• протеолиз фактов V и VIII — снижение их
содержания;
• протеолиз фактора Виллебрандта, XIII, XI —
снижение их содержания;
• протеолиз фактора XIII — снижение его
концентрации;
• изменения в гликопротеидах тромбоцитарной
мембраны.
13.
Образование тромбина на ранних стадиях ДВСспособствует появлению больших растворимых
комплексов фибрин- фибриноген и образованию
фибриновых микротромбов, вызывающих
обструкцию микроциркуляторного русла и ПОН.
При замедленном течении крови через разветвления
мелких сосудов происходит её «расслоение» на плазму и
эритроциты, заполняющие разные капилляры.
Без плазмы эритроциты теряют способность к
передвижению и скапливаются в виде медленно
циркулирующих, а затем нециркулирующих
образований.
Затем происходит их стаз, агрегация, лизис и
высвобождение кровяного тромбопластина.
Поступление в кровоток тромбопластина запускает
процесс внутрисосудистого свёртывания крови.
Выпадающие при этом нити фибрина опутывают глыбки
эритроцитов, образуя «сладжи» — комочки, оседающие
в капиллярах и ещё больше нарушающие однородность
структуры крови.
14. Клиническая картина ДВС синдрома
Основные клинические проявления ДВСсиндрома — тромбозы, приводящие кнарушению микроциркуляции и
возникновению ПОН и геморрагического
синдрома. ДВС-синдром характеризуется
стадийностью развития.
Стадии (фазы) ДВС-синдрома:
• I стадия — гиперкоагуляция;
• II стадия — коагулопатия потребления;
• III стадия — гипокоагуляция.
15.
В течении ДВС-синдрома выделяютнесколько фаз:
Фаза гиперкоагуляции и гиперагрегации тромбоцитов
Переходная фаза – наблюдается тенденция к
гипокоагуляции по одним тестам и гиперкоагуляция по
другим
Фаза гипокоагуляции и активация фибрнолиза
(геморрагическая фаза)
Восстановительная фаза (при неблагоприятном течении –
фаза тяжелых осложнений и летального исхода)
16. Фазы ДВС-синдрома
: I фаза — гиперкоагуляция. Потеряфакторов свертывающей системы в
процессе обильного кровотечения
приводит к удлинению времени
образования сгустка и его ретракции,
удлинению времени капиллярного
кровотечения. Лабораторные
показатели: уменьшение времени
свертывания крови, тромбинового
времени, положительный этаноловый
тест.
17.
II фаза — гипокоагуляция. При геморрагическом шокев фазе спазма венул и артериол (клинические
проявления: дегидратация, бледные и холодные
кожные покровы, признаки острой почечной
недостаточности) в капиллярах развивается
расслоение плазмы и форменных элементов —
“сладж”-феномен. Агрегация форменных элементов,
обволакивание их фибрином сопровождаются
потреблением факторов свертывания крови и
активацией фибринолиза. Лабораторные показатели:
умеренная тромбоцитопения (до 120 × 109/л),
тромбиновое время 60 с и больше, резко
положительный этаноловый тест.
18.
III фаза — потребления с активациейместного фибринолиза.
Афибриногенемия в сочетании с
выраженной активацией фибринолиза.
При этой фазе рыхлые сгустки крови в
месте кровотечения быстро (в течение
15-20 мин) лизируются на 50 %.
Лабораторные показатели: увеличение
времени свертывания крови,
тромбинового времени, уменьшение
тромбоцитов до 100 × 109/л, быстрый
лизис сгустка.
19.
IV фаза — генерализованныйфибринолиз. Капиллярная кровь не
свертывается, отмечаются
паренхиматозное кровотечение,
петехиальные высыпания на коже и
внутренних органах, гематурия,
выпот в синовиальные полости и
терминальные изменения в органах и
системах.
20. Клиническая картина ДВС синдрома
ДВС-синдром классифицируется не толькопо стадийности (фазности) развития, но и по
скорости развития геморрагических проявлений.
Различают следующие формы ДВС-синдрома:
молниеносная, острая, подострая и
хроническая.
21. Клиническая картина ДВС синдрома
Молниеносная форма чаще всего встречается притакой патологии, как ТЭЛА, эмболия ОВ, тромбоз
брыжеечной артерии.
Острая форма развивается при шоке любого
происхождения, массивной кровопотере и стремительных
травматичных родах, эмболии ОВ, эклампсии, разрыве
матки.
Подострая форма непродолжительная (несколько часов
или минут). Она либо переходит в хроническую, либо
реализуется в острую форму. Для подострой формы ДВСсиндрома характерно наличие высокой АГ (180/120 мм
рт.ст. и выше), олигурии или анурии, геморрагий
(петехии), неврологических проявлений (головная боль,
нарушение зрения, боли в эпигастральной области) и
болей в правом подреберье в результате напряжения
капсулы печени.
22. Нарушение микроциркуляции в органах с их дисфункцией и дистрофией
Чрезвычайно часто таким органом являютсялегкие, в сосуды которых из венозной системы
заносится огромное количество микросгустков
фибрина, агрегатов клеток крови и продуктов
протеолиза. В результате развивается острая
легочно-циркуляторная недостаточность одышка, цианоз, снижение насыщения крови
кислородом, а затем повышение углекислого газа
в артериальной крови; появляются
интерстициальный отек, инфаркты легкого часто
с развитием респираторного дистресс-синдрома.
23. Острая почечная недостаточность
Острая почечнаянедостаточность
Второе место по частоте органное поражение при
ДВС-синдроме.
Она проявляется в виде снижения количества
выделяемой мочи вплоть до полной анурии (отсутствия
мочеотделения), выделением с мочой белка,
эритроцитов.
При этом нарушается водно-электролитный баланс, а
также кислотно-основное равновесие в организме, в
сыворотке крови отмечается нарастание уровня
креатинина, а впоследствии -остаточного азота и
мочевины.
В целом данный синдром не отличается от других видов
острой почечной недостаточности.
24. Главные клинические проявления ДВС синдрома
• тромботические явления;• геморрагический синдром;
• микроциркуляторные нарушения;
• ПОН;
• анемия;
• нестабильная гемодинамика;
• шок и формирование шоковых
органов.
25. Диагностика ДВС синдрома
Лабораторные исследованияСтадия гиперкоагуляции:
• время свёртывания крови ↓;
• АЧТВ ↓;
• Ht ↑ (40 и ≥);
• фибриноген ↑;
• время рекальцификации плазмы ↑ (более 45”);
• тромбиновое время ↑ (более 10”);
• АЧТВ ↓ (менее 45”);
• ±продукты деградации фибрина (более 10 мг%);
• ±растворимые комплексы мономеров фибрина;
• ± тесты: этаноловый, протаминсульфатный.
26. Диагностика ДВС синдрома
Лабораторные исследованияСтадия коагулопатии потребления:
• тромбоциты↓;
• фибриноген ↓;
• антитромбин III ↓;
• гипопротеинемия, гипоальбуминемия;
• продукты деградации фибрина ↑;
• АЧТВ ↑ (≥65”);
• время рекальцификации плазмы ↑;
• протромбиновое и тромбиновое время ↑;
• время свёртывания крови, время кровотечения и Ht
могут оставаться либо укороченными, либо в пределах
верхней или нижней границы нормы.
27. Диагностика ДВС синдрома
Лабораторные исследованияСтадия гипокоагуляции:
• время кровотечения↑, время свертывания крови ↑;
• ↑фибринолитической активности и протеолиза;
• фибриноген ↓;
• Hb ↓, Ht ↓;
• эритроциты ↓;
• плазменные факторы IV, VIII, I, II, V, XIII ↓;
• активность антитромбина III ↓;
• плазминоген ↓;
• повышенная кровоточивость, отсутствие сгустков или
быстрое их растворение.
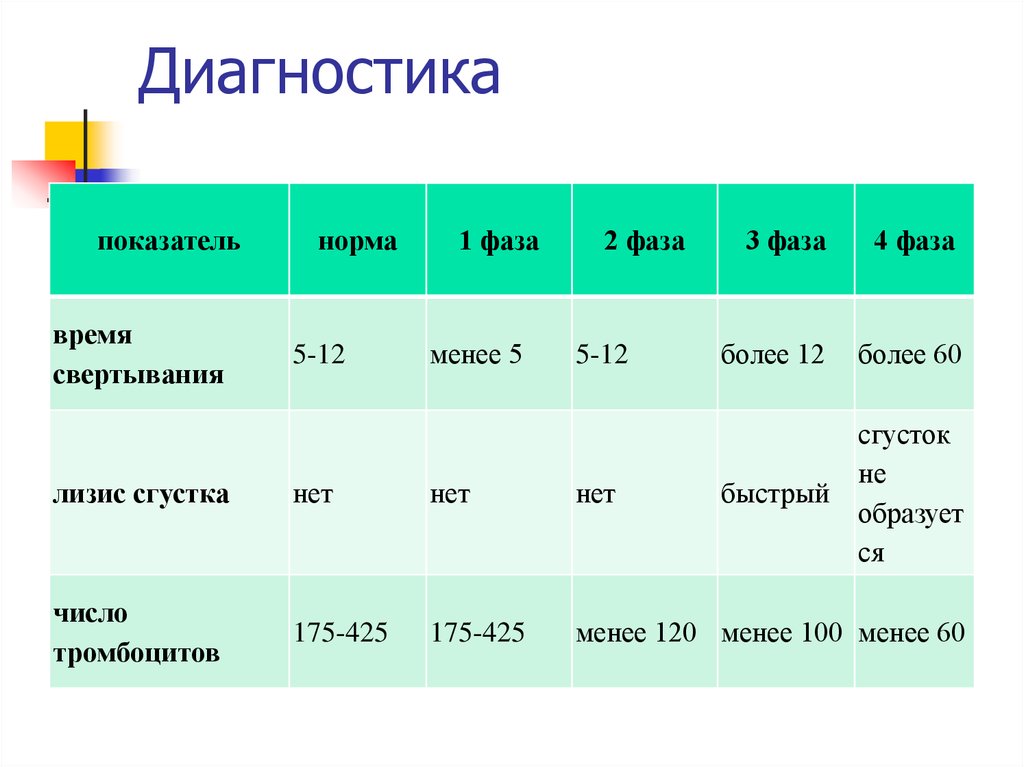
28. Диагностика
показательвремя
свертывания
норма
5-12
1 фаза
менее 5
2 фаза
5-12
3 фаза
4 фаза
более 12
более 60
быстрый
сгусток
не
образует
ся
лизис сгустка
нет
нет
нет
число
тромбоцитов
175-425
175-425
менее 120 менее 100 менее 60
29. Лечение ДВС-синдрома:
Летальность при острых формах составляет30%.
В первую очередь при лечении синдрома
диссеминированного внутрисосудистого
свертывания ведется интенсивная борьба с
патологическими процессами,
вызывающими и усугубляющими ДВСсиндром.
30. Лечение ДВС-синдрома:
Динамический контроль за содержаниемтромбоцитов в крови приобретает при ДВСсиндроме, в том числе и в процессе его лечения
гепарином, исключительно важное значение.
Гепарин часто неэффективен из-за позднего его
назначения в период, когда образование фибрина и
агрегация тромбоцитов с их отложением в
микроциркуляторном русле в основном уже завершились,
а также вследствие значительного дефицита
антитромбина III и высокого содержания в крови белков
острой фазы, блокирующих гепарин, либо из-за
образования аномальных форм тромбина.
31. Лечение ДВС-синдрома:
При гепаринотерапии следует придерживатьсяследующих основных правил. Нужно применять гепарин
возможно раньше – в фазе гиперкоагуляции в дозах 20
000-40 000 ЕД/сут, а во второй (переходной) фазе - в
дозах, не превышающих 20 000 ЕД/сут.
В эти периоды гепарин используется для «прикрытия»
базисной терапии свежезамороженной плазмой.
В стадии гипокоагуляции и кровотечений гепарин
используют лишь в малых дозах для «прикрытия»
трансфузионной терапии (по 2500 ЕД перед
переливаниями крови и плазмы). В несколько больших
дозах его можно применять в сочетании с контрикалом и
другими антипротеазами.
32. Лечение ДВС-синдрома:
Если ДВС-синдром вызван сильнымикровотечениями, в лечение включают
антиферменты (контрикал, гордокс).
При развитии третьей стадии синдрома
диссеминированного внутрисосудистого свертывания,
при присоединении к данному патологическому
состоянию обильных кровотечений, несвертываемости
крови, выраженной гипокоагуляции, а также если
клиническая картина осложняется кровотечениями из
язв желудочно-кишечного тракта (кровавая рвота,
дегтеобразный стул), сильными маточными
кровотечениями, гепарин категорически
противопоказан.
33. Лечение ДВС-синдрома:
Трансфузионная терапия составляет основу лечениясиндрома диссеминированного внутрисосудистого
свертывания, что обеспечивает коррекцию нарушений
гемостаза; возмещение объема жидкости в циркуляции и
восстановление центрального венозного давления,
нарушенных вследствие шока и (или) кровопотери;
замещение клеток крови -эритроцитов и тромбоцитов.
Некоторые из вышеуказанных целей достигаются
массивными переливаниями плазмы, содержащей
все компоненты системы свертывания крови и других
плазменных ферментных систем и обладающей
антипротеазной активностью, в том числе и большим
количеством антитромбина III.
34. Тромбоэмболия легочной артерии (ТЭЛА)
35. Тромбоэмболия легочной артерии (ТЭЛА)
внезапная закупорка ветвей или ствола легочнойартерии тромбом (эмболом), образовавшимся в правом
желудочке или предсердии сердца, венозном русле
большого круга кровообращения и принесенным с током
крови.
В результате ТЭЛА прекращается кровоток по
легочной артерии. Развитие ТЭЛА происходит часто
стремительно и может привести к гибели больного.
От ТЭЛА умирает 0,1% населения земного шара
ежегодно. Среди причин смерти населения от
сердечно-сосудистой заболеваний ТЭЛА стоит на третьем
месте.
36. Причины развития ТЭЛА
Наиболее частыми причинами развития ТЭЛАслужат:
тромбоз глубоких вен (ТГВ) голени (в 70 – 90%
случаев), часто сопровождающийся тромбофлебитом.
Может иметь место тромбоз одновременно глубоких и
поверхностных вен голени
тромбоз нижней полой вены и ее притоков
сердечно-сосудистые заболевания,
предрасполагающие к появлению тромбов и эмболий в
легочной артерии (ИБС, активная фаза ревматизма с
наличием митрального стеноза и мерцательной
аритмии, гипертоническая болезнь, инфекционный
эндокардит, кардиомиопатии и
неревматические миокардиты)
37. Причины развития ТЭЛА
септический генерализованный процессонкологические заболевания (чаще рак
поджелудочной железы, желудка, легких)
тромбофилия (повышенное внутрисосудистое
тромбообразование при нарушении системы
регуляции гемостаза)
антифосфолипидный синдром —
образование антител к фосфолипидам
тромбоцитов, клеток эндотелия и нервной
ткани (аутоиммунные реакции); проявляется
повышенной склонностью к тромбозам
различных локализаций.
38. Факторы риска тромбозов вен и ТЭЛА - это:
Факторы рискатромбозов вен и ТЭЛА это:
длительное состояние обездвиженности
(постельный режим, частые и продолжительные
авиаперелеты, поездки, парез конечностей),
прием большого количества диуретиков
(массовая потеря воды приводит к дегидратации,
повышению гематокрита и вязкости крови);
злокачественные новообразования
39. Факторы риска тромбозов вен и ТЭЛА - это:
Факторы рискатромбозов вен и ТЭЛА это:
длительный прием некоторых лекарственных препаратов
(оральные контрацептивы, заместительная
гормональная терапия) повышает свертываемость
крови;
варикозная болезнь (при варикозном расширении вен
нижних конечностей создаются условия для застоя
венозной крови и образования тромбов);
нарушения обмена веществ, гемостаза
(гиперлипидпротеинемия, ожирение, сахарный диабет,
тромбофилия);
хирургические операции и внутрисосудистые
инвазивные процедуры (например, центральный катетер
в крупной вене);
40. Классификация ТЭЛА по объему поражения легочных артерий (ESC, 2000)
Объем пораженияПризнаки
Явления шока или гипотонии – относительное
снижение артериального давления на 40 мм
Массивная ТЭЛА
рт. ст. в течение 15 минут и более, не
(обструкция > 50%
связанное с развитие аритмии, гиповолемии,
сосудистого русла легких)
сепсиса. Кроме того, характерны одышка,
диффузный цианоз, возможны обмороки.
Субмассивная ТЭЛА
Явления правожелудочковой недостаточности,
(обструкция < 50%
подтвержденные Эхо КГ. Артериальной
сосудистого русла легких)
гипотензии нет.
Немассивная ТЭЛА
Гемодинамика стабильна, признаков
правожелудочковой недостаточности
клинически и при Эхо КГ нет.
41. Классификация ТЭЛА по варианту течения
Вариант теченияПризнаки
Молниеносное (14%),
острое (12,8%)
Внезапное начало, боль за грудиной, одышка
падение АД, признаки острого легочного
сердца.
Подострое (31,4%)
Прогрессирующая дыхательная и
правожелудочковая недостаточность,
признаки инфарктной пневмонии,
кровохарканье.
Рецидивирующее (41,8%)
Повторные эпизоды одышки, обмороки,
признаки пневмонии.
42. Сроки развития
Что касается сроков развития заболевания,молниеносная форма развивается в
течение нескольких минут и часов.
Острой ТЭЛА считается на протяжении 3
суток, подострой – в течение 30 суток с
момента эпизода эмболии.
Хроническая посттромбоэмболическая
легочная гипертензия развивается по
прошествии 1 месяца от эмболического
поражения легочных артерий.
43. Диагностика ТЭЛА
В диагностике ТЭЛА главная задача – установитьместонахождение тромбов в легочных сосудах,
оценить степень поражения и выраженность
нарушений гемодинамики, выявить источник
тромбоэмболии для предупреждения рецидивов.
Сложность диагностики ТЭЛА диктует необходимость
нахождения таких пациентов в специально
оборудованных сосудистых отделениях, владеющих
максимально широкими возможностями для проведения
специальных исследований и лечения.
44. Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
тщательный сбор анамнеза, оценку факторов рискаТГВ/ТЭЛА и клинической симптоматики
общий и биохимический анализы крови, мочи,
исследование газового состава крови, коагулограмму и
исследование Д-димера в плазме крови (метод
диагностики венозных тромбов)
ЭКГ в динамике (для исключения инфаркта
миокарда, перикардита, сердечной недостаточности)
рентгенографию легких (для
исключения пневмоторакса, первичной пневмонии,
опухолей, переломов ребер, плеврита)
45. Всем пациентам с подозрением на ТЭЛА проводят следующие обследования:
эхокардиографию (для выявления повышенногодавления в легочной артерии, перегрузок правых
отделов сердца, тромбов в полостях сердца)
сцинтиграфию легких (нарушение перфузии крови
через легочную ткань говорит об уменьшении или
отсутствии кровотока вследствие ТЭЛА)
ангиопульмонографию (для точного определения
локализации и размеров тромба)
УЗДГ вен нижних конечностей,
контрастную флебографию (для выявления источника
тромбоэмболии)
46. Лечение ТЭЛА
Приблизительно 10% пациентов погибает в первые часыи сутки после эпизода массивной ТЭЛА, в течение года
умирает порядка 25% и в течение 3 лет – уже 35%
больных.
Успех лечения острой массивной ТЭЛА зависит от
решения таких задач, как:
устранение угрозы гибели больного от острой
сердечно-легочной недостаточности;
нормализация (улучшение) перфузии легких и
предотвращение тяжелой хронической постэмболической
легочной гипертензии;
профилактика рецидива тромбоэмболии легочной
артерии.
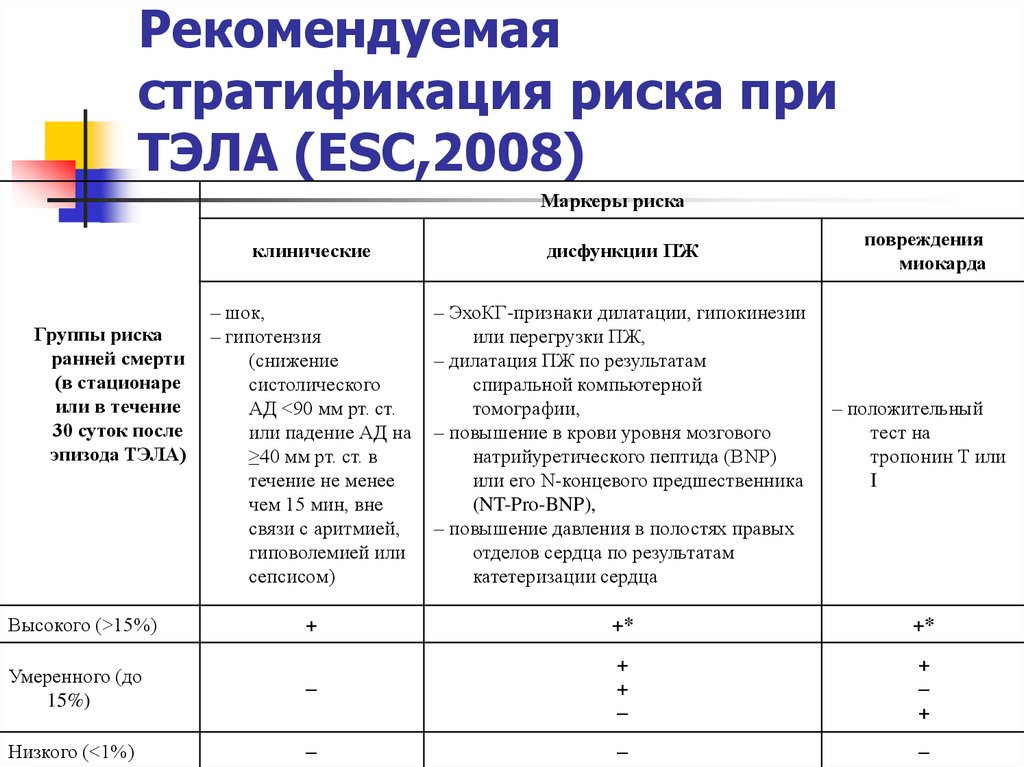
47. Рекомендуемая стратификация риска при ТЭЛА (ESC,2008)
Маркеры рискаповреждения
миокарда
клинические
дисфункции ПЖ
– шок,
– гипотензия
(снижение
систолического
АД <90 мм рт. ст.
или падение АД на
≥40 мм рт. ст. в
течение не менее
чем 15 мин, вне
связи с аритмией,
гиповолемией или
сепсисом)
– ЭхоКГ-признаки дилатации, гипокинезии
или перегрузки ПЖ,
– дилатация ПЖ по результатам
спиральной компьютерной
томографии,
– повышение в крови уровня мозгового
натрийуретического пептида (BNP)
или его N-концевого предшественника
(NT-Pro-BNP),
– повышение давления в полостях правых
отделов сердца по результатам
катетеризации сердца
– положительный
тест на
тропонин Т или
I
+
+*
+*
Умеренного (до
15%)
–
+
+
–
+
–
+
Низкого (<1%)
–
–
–
Группы риска
ранней смерти
(в стационаре
или в течение
30 суток после
эпизода ТЭЛА)
Высокого (>15%)
48. Лечение ТЭЛА
Согласно рекомендациям ESC стратегия лечениясущественно зависит от степени риска ранней смерти и
включает:
антикоагулянтную терапию нефракционированным
гепарином;
вазопрессивные препараты для устранения системной
гипотензии и профилактики дальнейшего прогрессирования
правожелудочковой недостаточности; у пациентов с
низким сердечным выбросом и нормальным АД могут быть
использованы добутамин и допамин;
оксигенотерапию;
тромболитическую терапию (ТЛТ) у пациентов
высокого риска, сопровождающейся кардиогенным шоком
и/или артериальной гипотензией;
хирургическую эмболэктомию или чрескожную
катетерную эмболэктомию или фрагментацию
тромбоэмбола если тромболизис абсолютно
противопоказан или оказался неэффективным.
49. Схемы применения.
Начинают с внутривенного болюсноговведения нефракционированного
гепарина в дозе 80 ЕД/кг, затем переходят
на постоянную внутривенную инфузию
со скоростью 18 ЕД/кг/ч.
В дальнейшем дозу НФГ подбирают с учетом
АЧТВ, которое должно быстро увеличиться –
в 1,5-2,5 раза по сравнению с контролем
– и поддерживаться на этом уровне.
50. Также используются различные схемы подкожного введения антикоагулятнов:
ДалтепаринПодкожно 100 МЕ/кг 2 раза в сутки.
Подкожно 200 МЕ/кг (максимально 18 000 ME) 1 раз в сутки.
Надропарин
Подкожно 86 МЕ/кг 2 раза в сутки.
Подкожно 172 МЕ/кг (максимально 17 100 ME) 1 раз в сутки.
Эноксапарин
Подкожно 100 ME (1 мг)/кг 2 раза в сутки.
Подкожно 150 ME (1,5 мг)/кг 1 раз в сутки.
Фондапаринукс
Подкожно 5 мг 1 раз в сутки при массе тела 50 кг; 7,5 мг 1 раз в
сутки при массе тела 50-100 кг; 10 мг 1 раз в сутки при массе тела
более 100 кг.
51. Тромболитическая терапия.
Тромболитическая терапия приводит к быстромувосстановлению кровотока в пораженном сосуде и оказывает
благоприятное влияние на показатели гемодинамики. Применение
тромболитических препаратов хорошо зарекомендовало себя при
лечении острого эпизода легочной тромбоэмболии, когда с момента
появления первых симптомов до начала терапии прошло менее 2
недель.
В настоящее время в клинической практике при лечении ТЭЛА
используют две группы тромболитических препаратов:
I – не обладающие сродством к фибрину (стрептокиназа,
урокиназа, анизоилированный плазминоген–стрептокиназный
активаторный комплекс), создающие системный фибринолиз;
II – обладающие сродством к фибрину тромба (тканевой
активатор плазминогена, альтеплаза, проурокиназа), которые
«работают» только на тромбе, за счет наличия Sh радикала,
афинного к фибрину.
52. Оперативное лечение
Рентгено-эндоваскулярные методы.Эндоваскулярная механическая дезобструкция
легочной артерии применяется как
самостоятельный метод, так и в дополнение к
тромболитической терапии.
Помимо гемодинамической разгрузки правых
отделов сердца при массивной ТЭЛА,
фрагментация эмбола может существенно
повысить эффективность тромболизиса
вследствие увеличения суммарной площади
поверхности получающихся фрагментов.
53. Оперативное лечение
Продолжают совершенствоваться методыфрагментации и дисперсии тромбов с помощью
обычных сердечных катетеров или специально
разработанных ротационных или других
устройств. Предложено несколько концепций
подобных эндоваскулярных вмешательств,
включая:
фрагментацию и катетерную аспирацию
эмбола с помощью стандартного
диагностического или баллонного катетера;
ротационную дезобструкцию легочной
артерии с помощью модернизированного
катетера pigtail, предложенного Schmitz-Rode.
54. Простая фрагментация тромбоэмбола
возможна только при «мягком» тромбоэмболе и взначительном проценте случаев приводит к окклюзии
дистального легочного артериального русла.
Неадекватное восстановление проходимости легочных
артерий, в свою очередь, ведет к относительно
быстрому развитию посттромбоэмболической
легочной гипертензии.
Кроме того, катетеры следует использовать только при
поражении основных артерий, так как фрагментация
тромба в менее крупных ветвях обычно не приносит
пользы и может сопровождаться повреждением стенки
сосуда и ее перфорацией.
55. При ротационной дезобструкции
после селективной катетеризации легочной артерии,проводник проводится сквозь эмбол.
Затем катетер Schmitz-Rode перемещается по проводнику
от дистальной части эмбола к проксимальной с
одновременным вращением вокруг своей оси. Вращение
катетера осуществляется вручную, со скоростью 1-3
оборота в секунду.
Предшествующая и контрольная ангиопульмонография
также выполняются с помощью этого катетера, к тому же,
он позволяет одновременно с фрагментацией проводить
локальный тромболизис. Для этого в дистальной части
катетера имеются 6 стандартных отверстий для введения
контрастного препарата и/или тромболитика.
Эффективность процедуры составляет порядка 70%. При
этом, каких либо серьезных осложнений, связанных с
процедурой отмечено не было.
56. Хирургические методы лечения.
В тех случаях, когда выполнениетромболитической терапии или
эндоваскулярной дезобструкции
легочной артерий неэффективно или
невозможно, при острой массивной
ТЭЛА высокого риска ранней смерти
возможно выполнение
«открытой» тромбэмболэктомии.






















































 Медицина
Медицина








