Похожие презентации:
Поверхностные явления. Адсорбция
1. Поверхностные явления. Адсорбция
12.
1. Особенности поверхностногоПоверхностное натяжение
слоя
вещества.
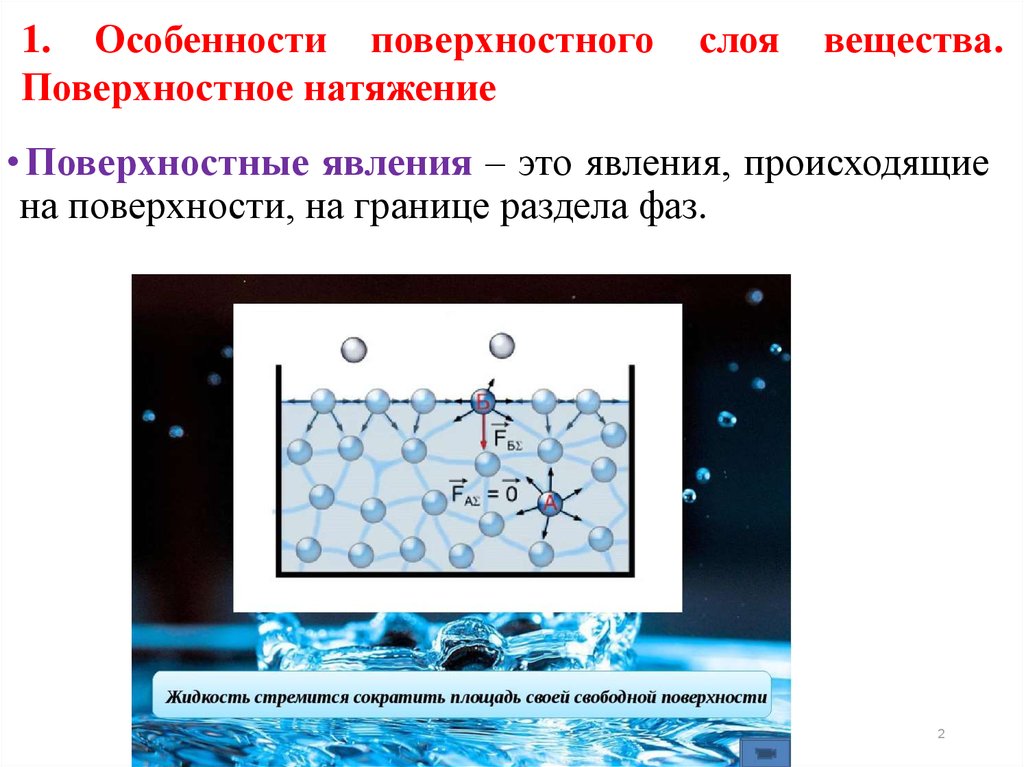
• Поверхностные явления – это явления, происходящие
на поверхности, на границе раздела фаз.
2
3.
34.
Молекулы поверхностного слоя обладают некоторымизбытком энергии по сравнению со внутренними, что
позволяет им удерживаться на поверхности, т.е.
противостоять внутреннему давлению. Эта энергия
называется
свободной
поверхностной
энергией
(поверхностной энергией Гиббса (G)). Поверхностная
энергия зависит от природы вещества, площади
поверхности, температуры.
Свободная
энергия
молекул
поверхности
площадью 1 м2 называется
удельной
поверхностной
энергией
или
поверхностным
натяжением (σ).
4
5.
Увеличение поверхности сопровождается ростомповерхностной энергии, поэтому жидкость стремится к
уменьшению своей поверхности (стремится к форме
шара).
Другое определение σ:
Поверхностное натяжение –
это сила, стягивающая
гипотетическую пленку на
поверхности жидкости и
противодействующая ее
растяжению
5
6.
Из определения следует:G = σ∙s
σ = [Дж/м2=Н∙м/м2= Н/м] – поверхностное
натяжение;
s – площадь поверхности, м2.
6
7.
Поверхностное натяжение измеряют следующимиспособами:
измерение
веса
отрывающейся
капли
(сталагмометрия);
- измерение силы, необходимой для отрыва тела от
поверхности;
измерение
давления,
необходимого
для
продавливания пузырьков газа или жидкости в
испытуемую жидкость и др.
7
8.
89.
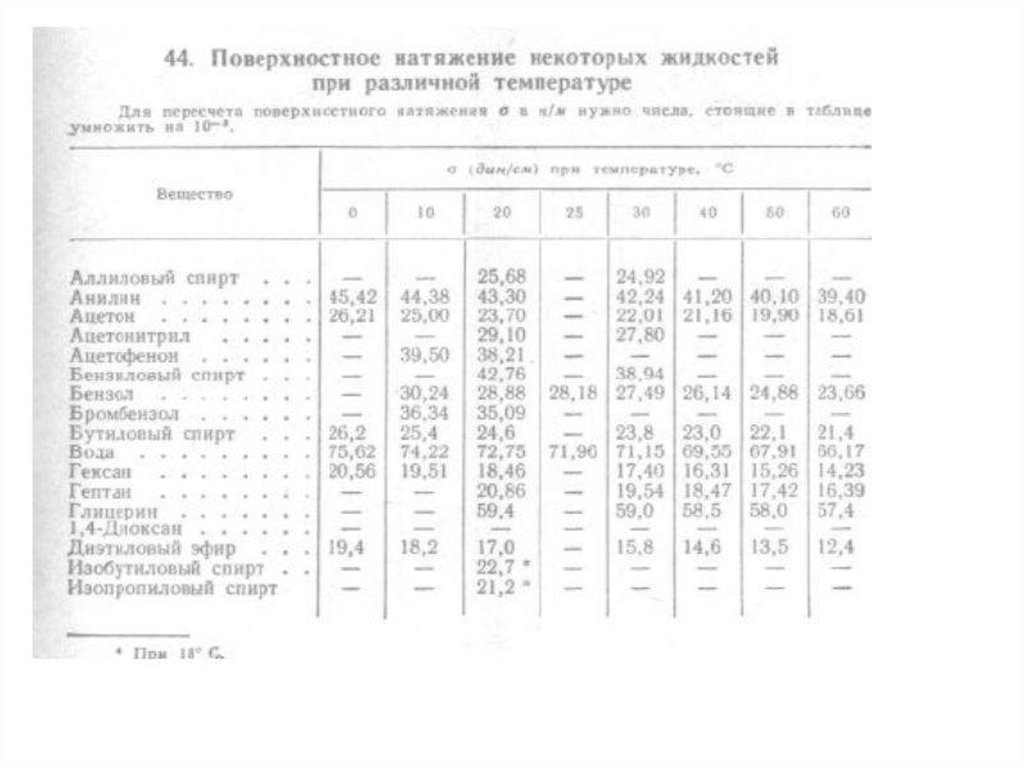
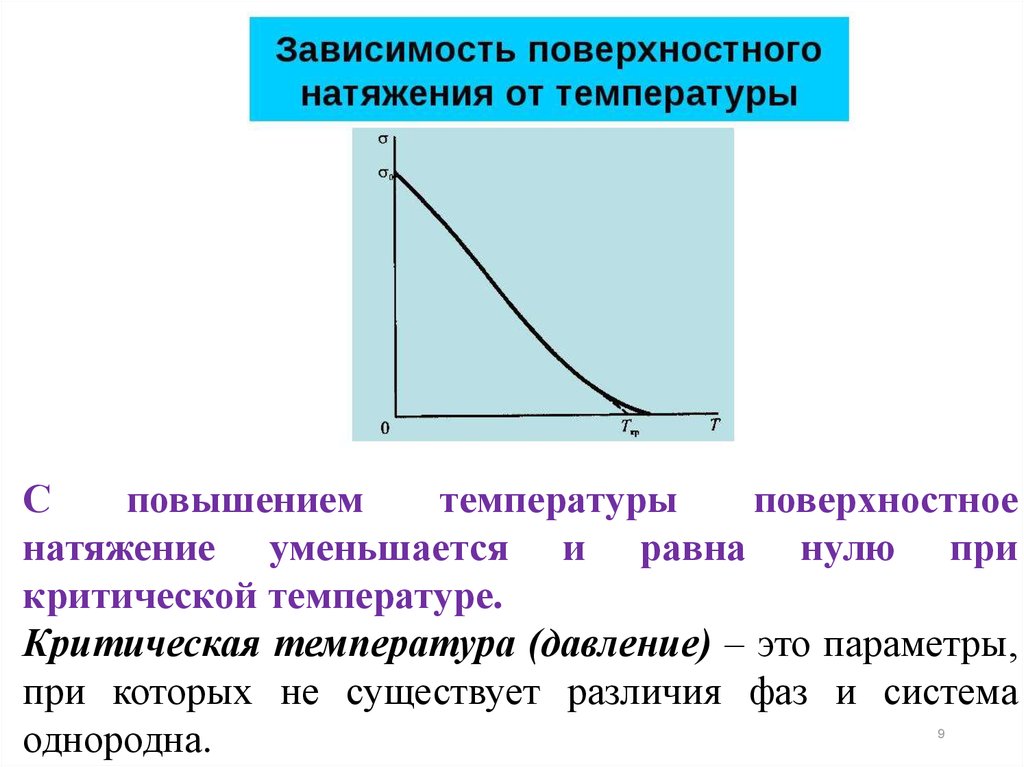
Сповышением
температуры
поверхностное
натяжение уменьшается и равна нулю при
критической температуре.
Критическая температура (давление) – это параметры,
при которых не существует различия фаз и система
однородна.
9
10.
2. Адсорбция. Основные понятия и определения.Виды адсорбции и их применение
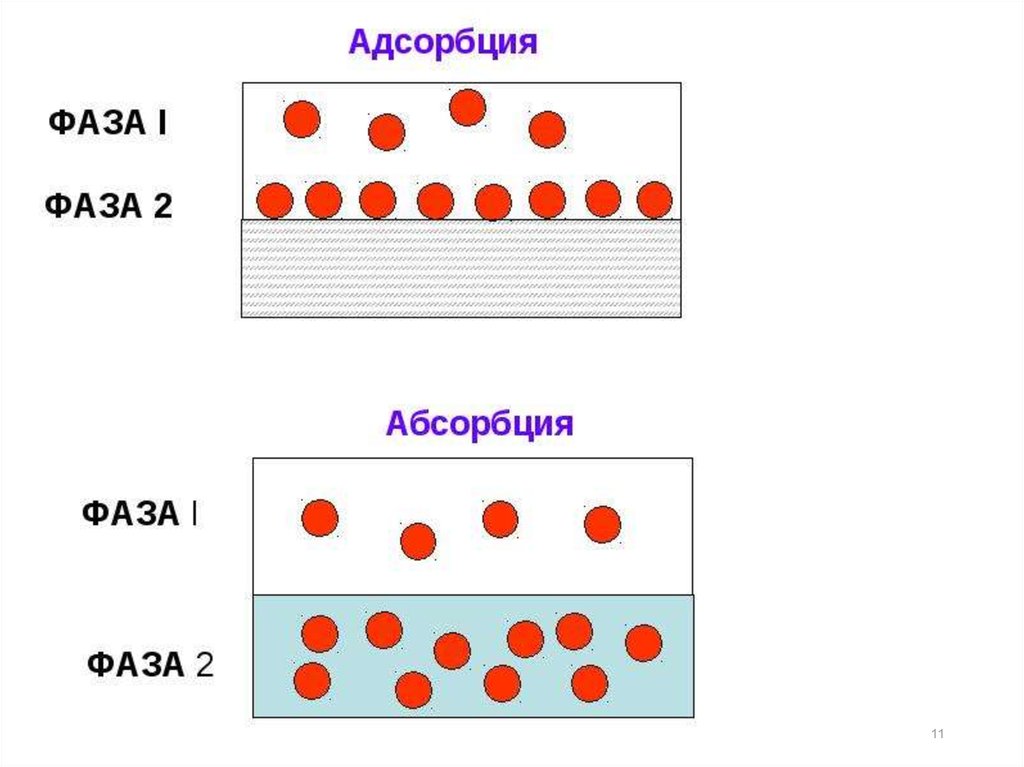
Адсорбция
(Г)
–
это
самопроизвольное
концентрирование вещества на поверхности какоголибо тела.
Адсорбция зависит от природы вещества,
температуры и концентрации вещества в объеме.
10
11.
1112.
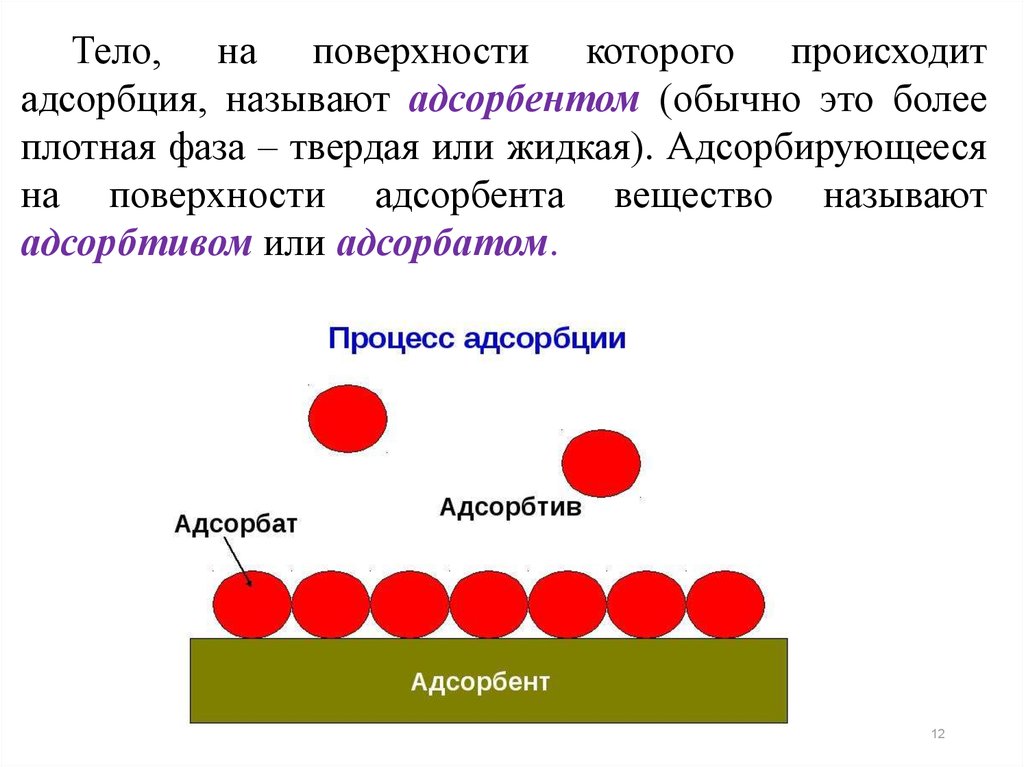
Тело, на поверхности которого происходитадсорбция, называют адсорбентом (обычно это более
плотная фаза – твердая или жидкая). Адсорбирующееся
на поверхности адсорбента вещество называют
адсорбтивом или адсорбатом.
12
13.
Измеряютадсорбцию
как
количество
адсорбата, отнесенное к единице площади или
массы адсорбента
Г (гамма) = кмоль/м2; кмоль/кг;
кг/кг
кг/м2;
13
14.
Из второго закона термодинамики следует, адсорбцияпротекает самопроизвольно в случае, если адсорбция
приводит к уменьшению свободной поверхностной
энергии:
∆G < 0
или ∆G = ∆ (σs) < 0
Данное условие выполняется
поверхностного натяжения ∆ σ < 0
при
уменьшении
Вывод:
адсорбция
возможна
и
протекает
самопроизвольно, если данный процесс идет с
уменьшением свободной поверхностной энергии, что
достигается за счет уменьшения величины
поверхностного натяжения
14
15.
Термодинамический смысл процесса адсорбции:Вблизи поверхности твердого тела или жидкости в
следствии наличия свободно поверхностной энергии
образуется некоторое энергетическое поле, под
действием которого происходит «связывание» частиц
адсорбтива.
Вследствие концентрирования частиц адсорбтива на
поверхности раздела фаз происходит уменьшение
свободной поверхностной энергии.
15
16.
В зависимости от агрегатных состоянийадсорбента и адсорбтива различают следующие
виды адсорбции:
- адсорбция газа на твердых адсорбентах;
- адсорбция растворенных веществ на границе
твердое тело–жидкость и жидкость–жидкость;
- адсорбция на границе жидкий раствор–газ.
16
17.
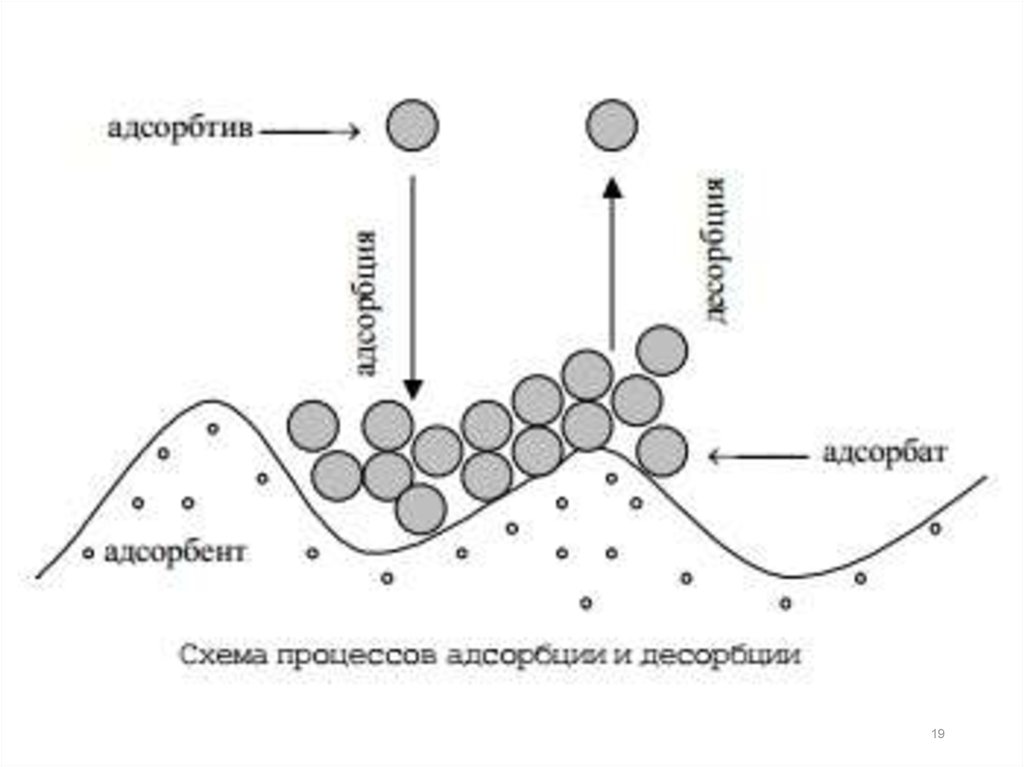
Если процесс перехода вещества из объема фазык поверхности сопровождается снижением
величины σ, то вещество будет самопроизвольно
переходить из объема фазы на границу раздела:
∆σ<0
Г > 0 – адсорбция положительная
Если процесс перехода вещества из объема фазы к
поверхности сопровождается увеличением
величины σ, то вещество будет самопроизвольно
переходить с поверхности вглубь.
Это отрицательная адсорбция или десорбция:
∆σ>0
Г < 0 – адсорбция отрицательная (десорбция)
17
18.
Если растворенное вещество не изменяет σадсорбция Г=0 и вещество равномерно
распределено между поверхностным слоем и
объемом.
∆σ<0
Г= 0
18
19.
1920.
При адсорбции одновременно протекают какфизические,
так
и
химические
взаимодействия.
В
зависимости
от
преобладающего процесса:
1. Физическая адсорбция
2. Химическая адсорбция (хемосорбция)
20
21.
2122.
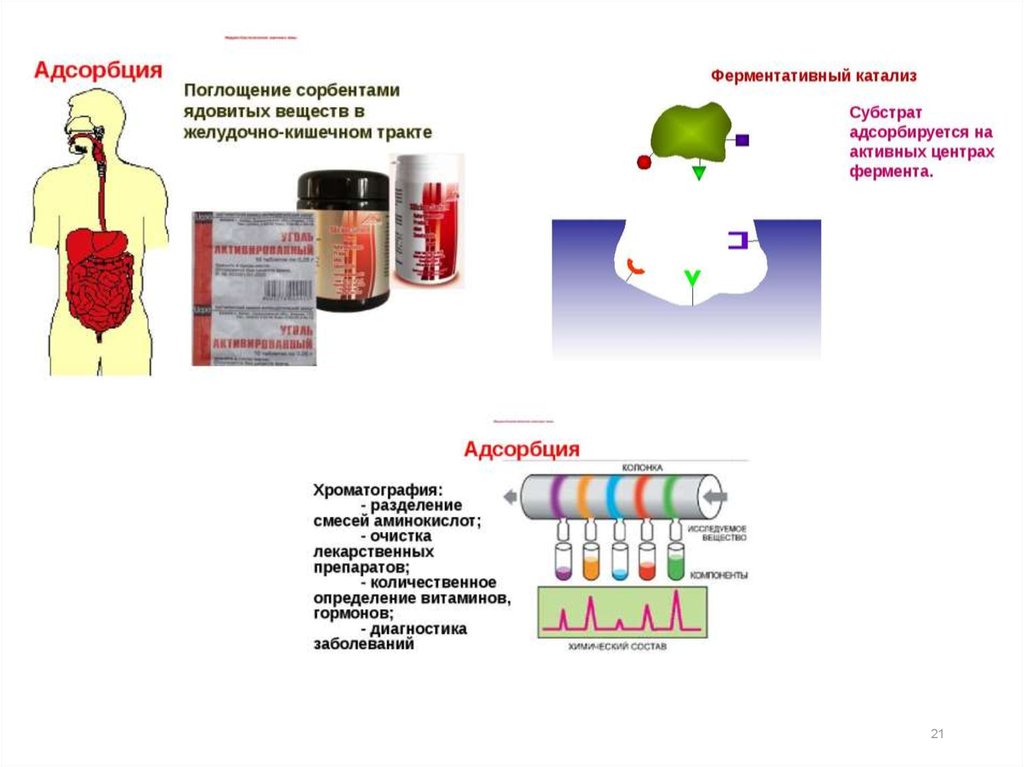
Применение адсорбции:1)для очистки газовых промышленных выбросов от вредных
примесей (SO2, SH2 и др.). Например, для очистки от SO2 в
качестве адсорбента применяют активированный уголь,
цеолиты. Процесс проводят в адсорбционных колоннах,
заполненных адсорбентом;
2)очистка воды (фильтры);
3)адсорбция сопровождает любые гетерогенные химические
реакции, в том числе гетерогенный катализ;
4)в лабораторной практике для разделения и анализа смесей
(хроматография);
5)в природных процессах. Например, при дыхании кислород
адсорбируется на поверхности легких. Углекислый газ
адсорбируется на поверхности листа;
6)иммобилизация ферментов;
7)в быту (мытье рук, стирка).
22
23.
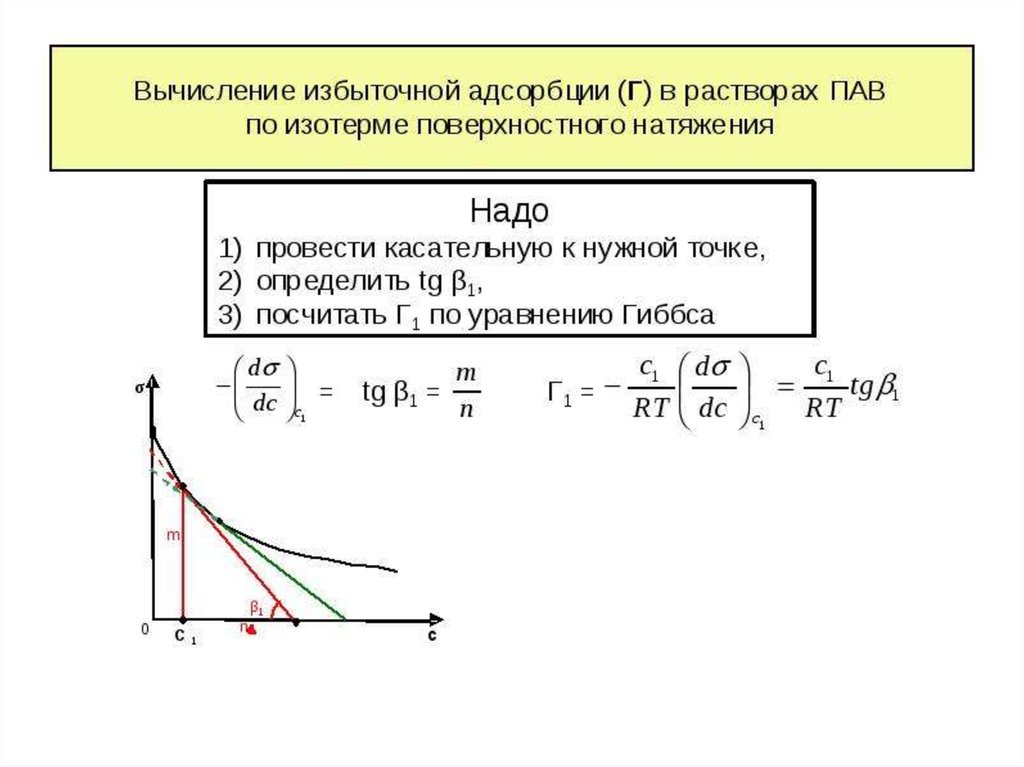
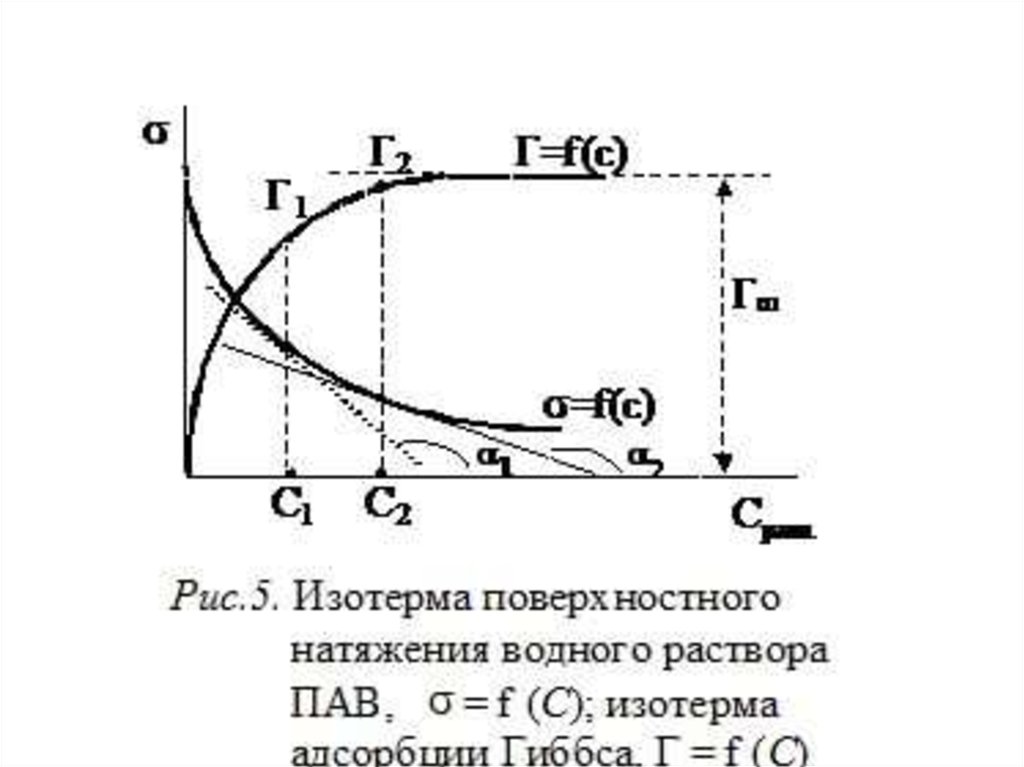
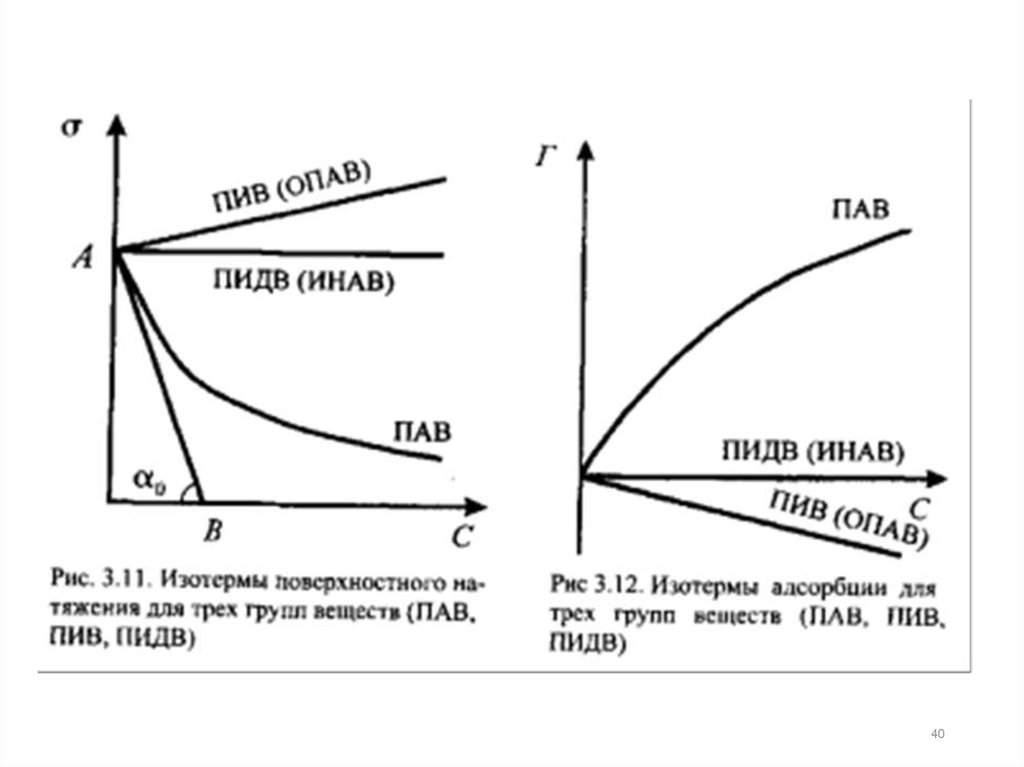
3. Адсорбция на границе раствор-газПроцесс адсорбции на границе описывается
уравнение изотермы адсорбции Гиббса:
С – равновесная концентрация адсорбтива в
объеме фазы, граничащей с адсорбирующей
поверхностью, моль/ м3;
σ – поверхностное натяжение, Н/м;
R – универсальная газовая постоянная
23
24.
Из уравнения следует, чтоесли:
<0
>0
(с повышением
концентрации σ
понижается),
то Г>0 – адсорбция
идет
(с повышением
концентрации σ
увеличивается),
то Г<0 – десорбция
Чем выше температура, тем меньше
адсорбция.
24
25.
Значение производной dσ/dC, взятой с обратнымзнаком называется, поверхностной
активностью (g):
g = - dσ/dC
Поверхностная активность является важнейшей
адсорбционной характеристикой вещества,
определяющей их свойства и области
применения.
25
26.
2727.
2828.
4. Классификация веществ по поверхностнойактивности. Правило Дюкло-Траубе
Поверхностно-активные вещества – это
вещества, добавление которых к жидкости
уменьшает ее поверхностное натяжение. ПАВ
самопроизвольно концентрируются на границе
раздела фаз
<0
g>0
Г>0
Например: Спирты, жирные кислоты, сложные эфиры,
липиды, белки, мыла
29
29.
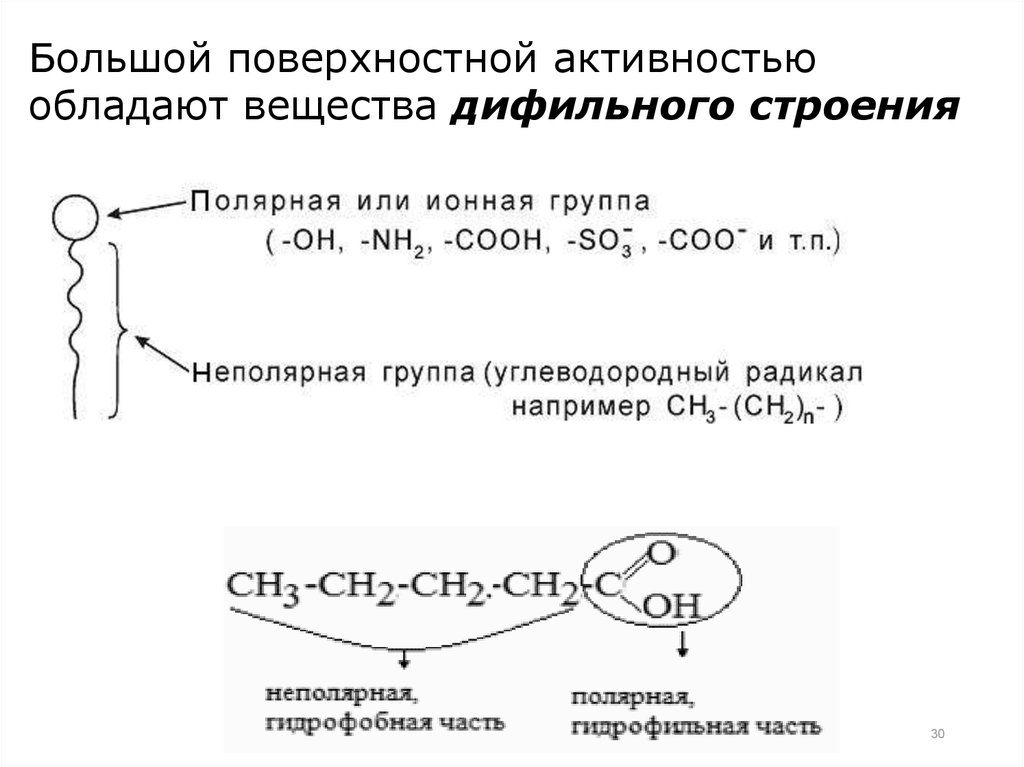
Большой поверхностной активностьюобладают вещества дифильного строения
30
30.
3131.
3232.
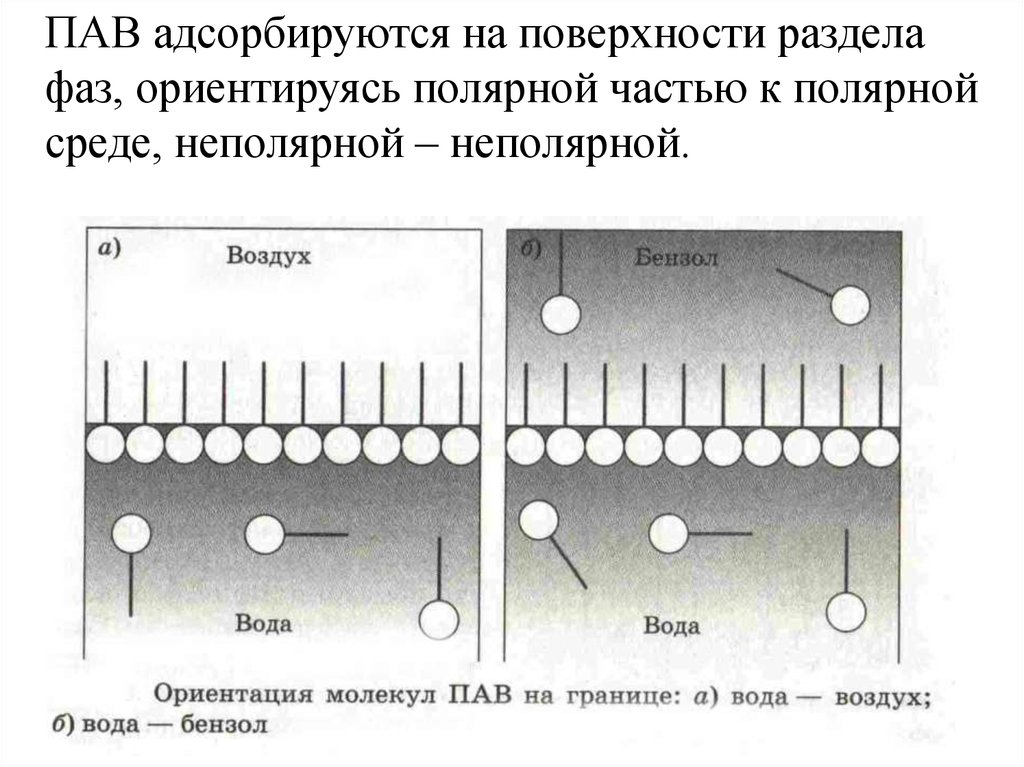
ПАВ адсорбируются на поверхности разделафаз, ориентируясь полярной частью к полярной
среде, неполярной – неполярной.
33
33.
3434.
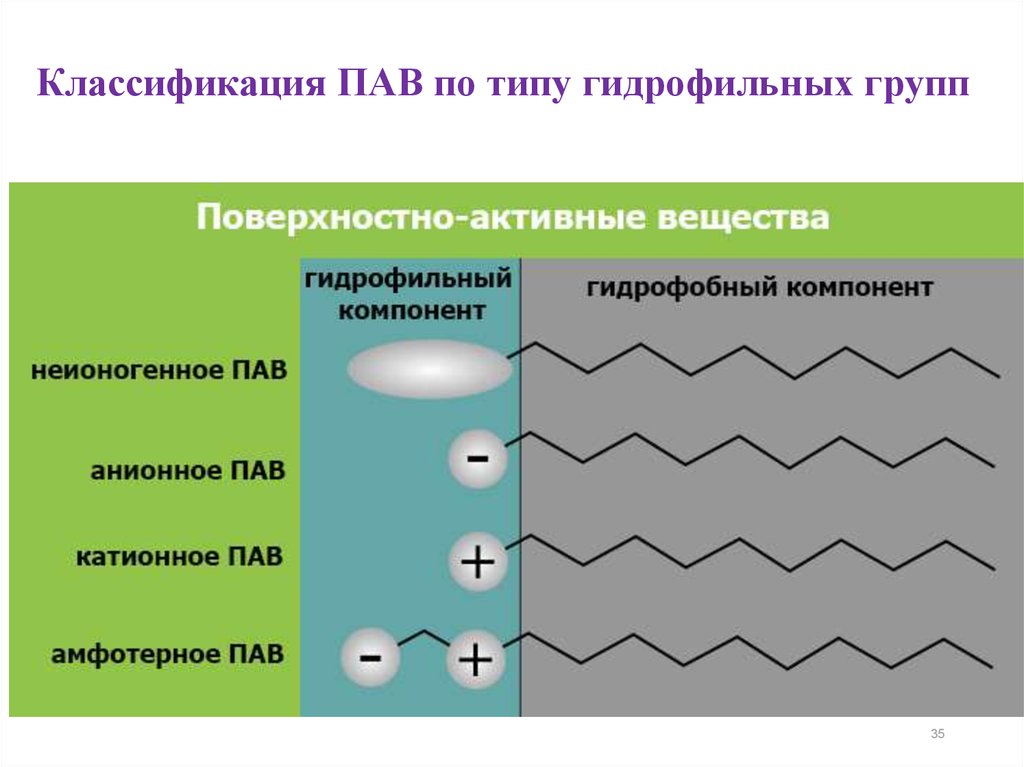
Классификация ПАВ по типу гидрофильных групп35
35.
-Потипу
гидрофильных
групп различают неионные (неионогенн
ые) и ионные (ионогенные) ПАВ.
Неионогеные существуют в растворе в
виде
недиссоциированных
молекул
(например,
спирты,
сложные
эфиры,
липиды).
Ионогенные диссоциируют в растворе на
ионы, одни их которых собственно и
обладают поверхностной активностью, а
другие - нет. В зависимости от знака заряда
поверхностно-активного иона ПАВ делят
на
катион-активные,
анионактивные и амфотерные.
36
36.
Анионактивные ПАВ: карбоновые кислотыи их соли (мыла), алкилсульфаты,
алкилсульфонаты, алкиларилсульфонаты,
фенолы и др.
Катионактивные ПАВ: производные
алкиламинов, первичных, вторичных и
третичных.
Амфотерные ПАВ: аминокислоты, белки. К
катионактивным ПАВ относятся и многие
алкалоиды
37
37.
Поверхностно-инактивные вещества – этовещества, добавление которых к жидкости
увеличивает ее поверхностное натяжение. ПАВ
самопроизвольно переходят в глубь раствора
>0
g<0
Г<0
Например: Неорганические кислоты, основания, соли,
глицерин, аминокислоты
38
38.
Поверхностно-неактивные вещества – этовещества, добавление которых к жидкости не
изменяет ее поверхностное натяжение. ПАВ
равномерно распределено в растворе и у раздела
фаз.
=0
g=0
Г=0
Например: Сахароза
39
39.
4040.
При экспериментальном изучении адсорбции на границежидкость-газ Дюкло и Траубе установили следующую
зависимость:
поверхностная активность в гомологическом
ряду
карбоновых
кислот,
аминов,
спиртов
возрастает в 3,2 раза при переходе к каждому
следующему гомологу.
Или:
увеличение углеводородной части молекулы ПАВ
на одно звено – СН2- повышает поверхностную
активность в 3,2 раза.
41
41.
Правило выполняется при следующих условиях:1)при комнатной температуре;
2)при малых концентрациях ПАВ (при больших
концентрациях достигается значение предельной
адсорбции,
одинаковой
для
всех
членов
гомологического ряда);
3)только для полярных растворителей (в случае
неполярных правило становится обратным, т.к.
увеличение углеводородной цепи приводит к
увеличению растворимости, что способствует уходу в
глубь раствора).
42
42.
Адсорбция газов и жидкостей на поверхноститвердого тела
Теория мономолекулярной адсорбции
Ленгмюра.
В 1915 году И. Ленгмюр предложил теорию
мономолекулярной адсорбции. Уравнение
изотермы адсорбции Ленгмюра справедливо для
широкого интервала концентраций и для границ
раздела ж–г, ж–ж, т–г, т–ж.
43
43.
Основные положение теории Ленгмюра:1). Поверхность адсорбента ограничена. Адсорбция вещества
происходит не на всей поверхности, а только на активных центрах.
Такими центрами могут служить отдельные атомы или группы атомов,
выступающих над поверхностью адсорбента.
2). Каждый активный центр удерживает только одну молекулу.
3). Когда все активные центры заняты и поверхность адсорбента
покрыта слоем толщиной в одну молекулу (мономолекулярный слой),
наступает адсорбционное равновесие и дальнейшее увеличение
адсорбции невозможно.
4). Процесс адсорбции имеет динамический характер. При равновесии
скорость адсорбции и десорбции одинакова. Адсорбированные
молекулы остаются некоторое время связанными с активными
центрами, а затем покидают поверхность (десорбируются) и их место
занимают другие молекулы Время пребывания молекулы на активном
центре зависит от температуры.
5).
Адсорбированные
на
активных
центрах
молекулы
не
взаимодействуют друг с другом.
44
44.
Уравнение изотермы мономолекулярнойадсорбции Ленгмюра имеет вид:
где А и А∞ - соответственно величина адсорбции газа или
пара при данном и предельном заполнении монослоя
К – константа адсорбционного равновесия
р – равновесное давление газа или пара.
45
45.
Уравнение Лэнгмюра для адсорбции израстворов:
где Г – Гиббсовская адсорбция при концентрации
С;
Г∞– максимальная или предельная адсорбция,
соответствующая образованию монослоя,
С – равновесная концентрация вещества в
растворе.
Уравнение Лэнгмюра применяют при очень
низких или высоких давлениях (концентрациях)
46
46.
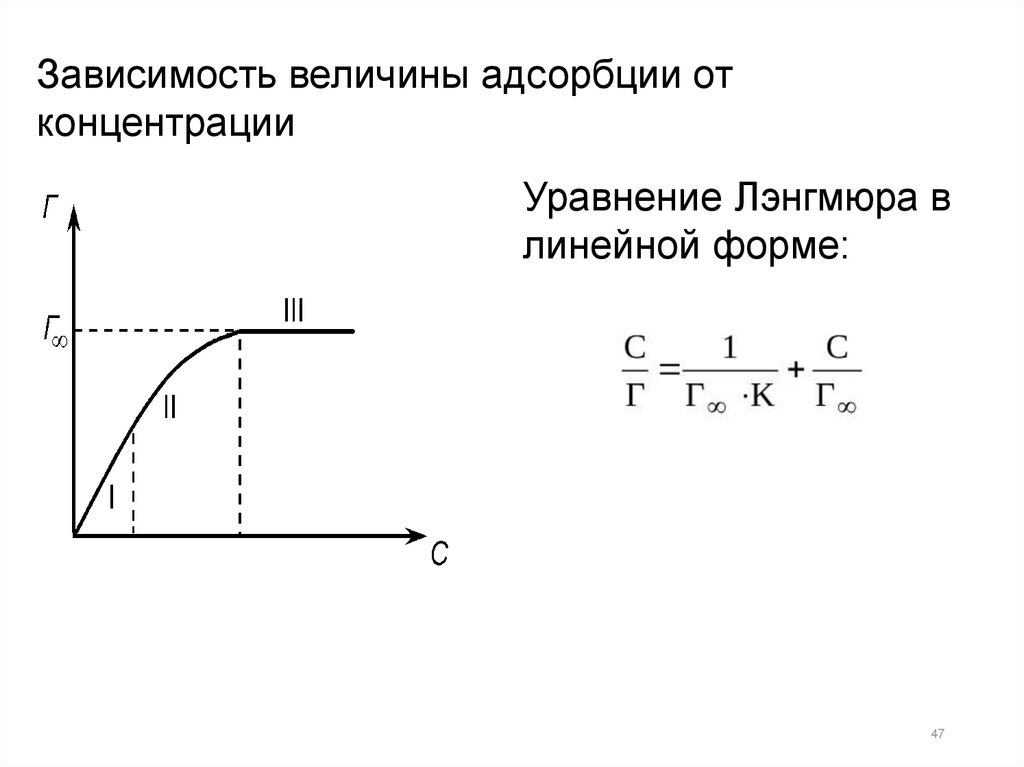
Зависимость величины адсорбции отконцентрации
Уравнение Лэнгмюра в
линейной форме:
47
47.
В координатах С/Г — С получаем прямую, и изграфика находим величины Г∞ и К
48
48.
Уравнением ФрейндлихаАдсорбция из растворов может быть описана уравнением
Фрейндлиха, которое в данном случае имеет вид
где х – количество адсорбировавшегося адсорбтива, ммоль;
m – масса адсорбента, г;
С – равновесная концентрация адсорбтива (растворенного
вещества), ммоль/л;
К, 1/n – константы, характерные для данного процесса
адсорбции; определяют экспериментально.
Уравнение применяют при средних концентрациях
49
49.
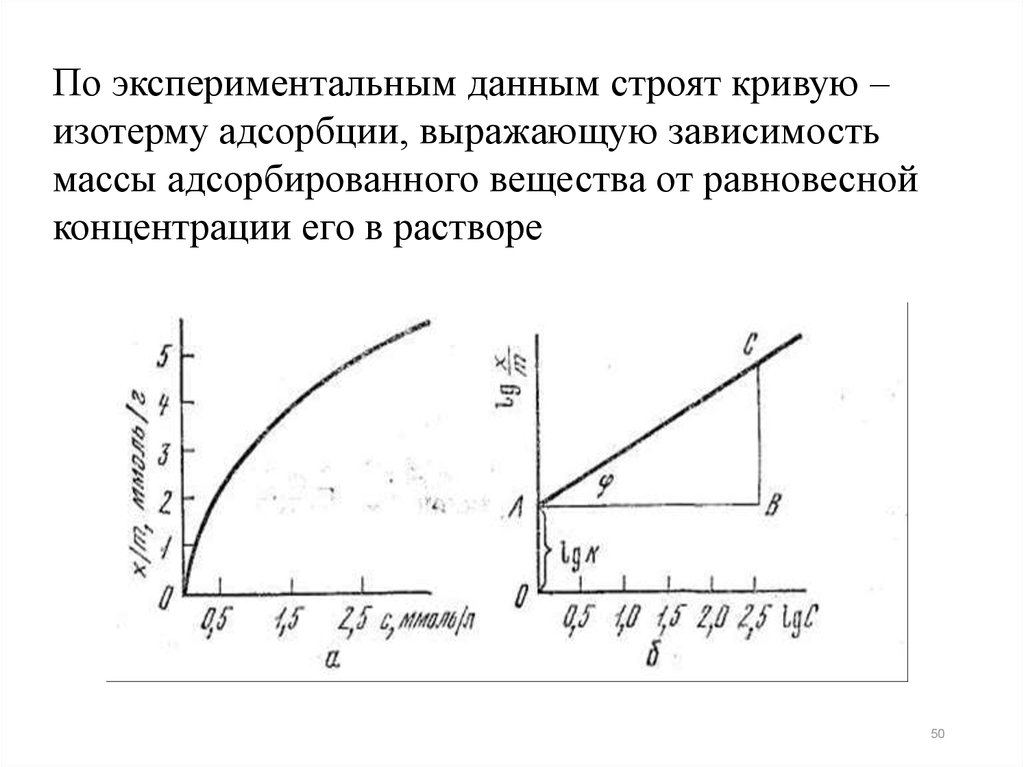
По экспериментальным данным строят кривую –изотерму адсорбции, выражающую зависимость
массы адсорбированного вещества от равновесной
концентрации его в растворе
50
50.
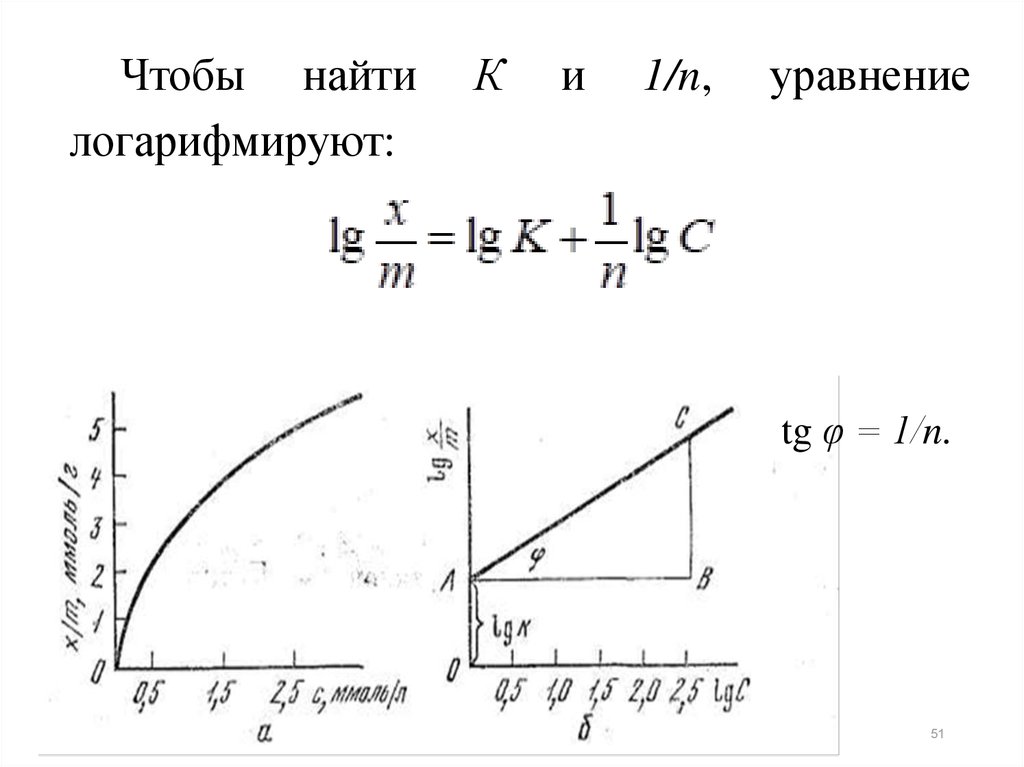
Чтобы найтилогарифмируют:
К
и
1/n,
уравнение
tg φ = 1/n.
51
51.
Полимолекулярная адсорбция (теория БЭТ).Основные положения.
52
52.
Адсорбция из растворов электролитовАдсорбция из водных растворов электролитов происходит,
как правило, таким образом, что на твердом адсорбента из
раствора адсорбируются преимущественно ионы одного
вида. Преимущественная адсорбция из раствора или
аниона, или катиона определяется природой адсорбента и
ионов.
Механизм
адсорбции
ионов
из растворов
электролитов может быть различным; выделяют обменную и
специфическую адсорбцию ионов.
53
53.
Обменная адсорбция представляет собой процесс обменаионов между раствором и твердой фазой, при котором
твердая фаза поглощает из раствора ионы какого-либо знака
(катионы либо анионы) и вместо них выделяет в раствор
эквивалентное число других ионов того же знака. Для
данного
адсорбента
к
обмену
способны
только
определенные
ионы;
обменная
адсорбция
обычно
необратима.
54
54.
При специфической адсорбции адсорбция на поверхности твердой фазыионов какого-либо вида не сопровождается выделением в раствор
эквивалентного числа других ионов того же знака; твердая фаза при этом
приобретает электрический заряд. Это приводит к тому, что вблизи
поверхности под действием сил электростатического притяжения
группируется эквивалентное число ионов с противоположным зарядом, т.е.
образуется
двойной
электрический
слой.
Взаимодействие
концентрирующихся на поверхности зарядов приводит к понижению
поверхностной энергии системы.
Для случая специфической адсорбции электролита Песковым и Фаянсом
было сформулировано следующее эмпирическое правило (правило
Пескова – Фаянса):
На поверхности кристаллического твердого тела из
раствора электролита специфически адсорбируется
ион, который способен достраивать его
кристаллическую решетку или может образовывать с
одним из ионов, входящим в состав кристалла,
малорастворимое соединение.
55
55.
Пример. Рассмотрим адсорбцию ионов раствора КIна поверхности кристалла AgI. На поверхности
кристаллов иодида серебра в определенном порядке
расположены ионы Аg+ и I–. Иодид-ионы, которые
могут образовать с ионами-серебра, находящимися в
кристаллической решетке, малорастворимое
соединение, адсорбируются на поверхности
создавая на ней избыток отрицательных зарядов.
Ионы калия не адсорбируются, так как они не
образуют с ионами иода нерастворимое соединение,
но под действием электростатического притяжения
они располагаются вблизи поверхности. Иодидионы, сорбированные поверхностью, и ионы калия,
находящиеся в жидкой фазе, образуют двойной
электрический слой.
56
56.
5757.
Если кристаллы AgI находятся в контакте сраствором AgNO3, то на поверхности кристаллов
будут адсорбироваться ионы Ag+, ионы NO3остаются в жидкой фазе.
Таким образом, на поверхности кристаллического
твердого тела из раствора адсорбируются тот
ион, который входит в состав кристаллической
решетки или может образовывать с одним из
ионов решетки малорастворимое соединение.
58
58.
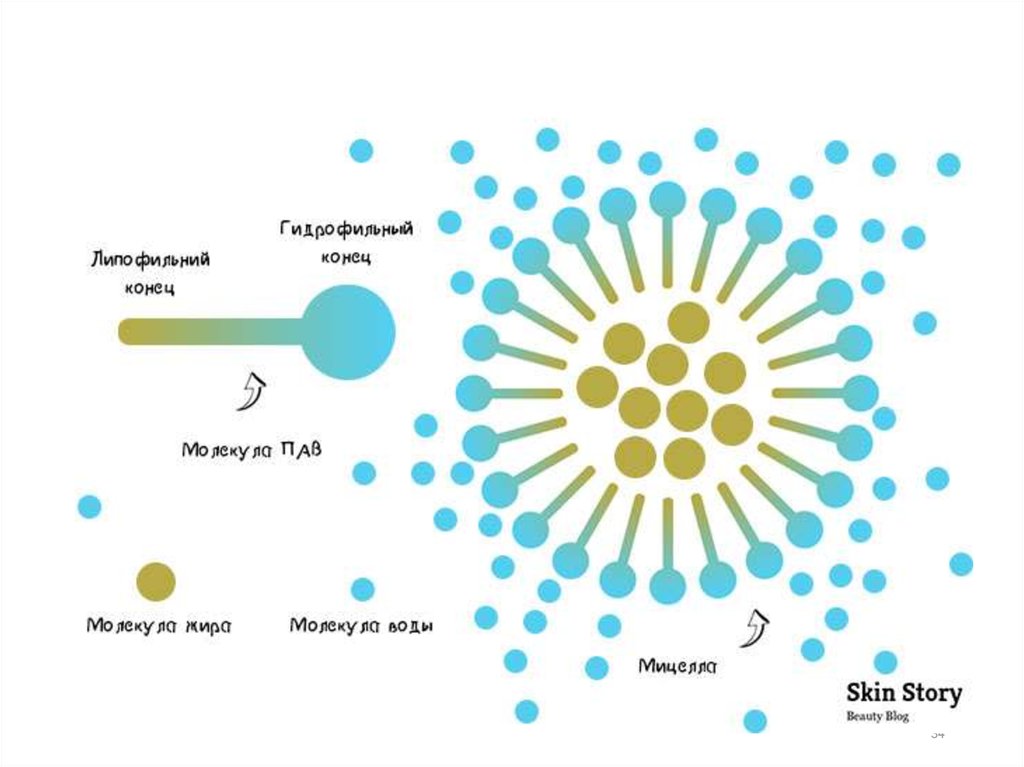
Мицеллообразование в растворах ПАВПод мицеллой (МЦ) ПАВ понимают ассоциат дифильных
молекул, лиофильные группы которых обращены к
растворителю, а лиофобные группы соединяются друг с
другом, образуя ядро мицеллами.
Число молекул в мицелле n – число агрегации (она
чаще в пределах n= 20-100), а сумма молекулярных масс
молекул в мицелле определяет молярную массу мицеллы.
МЦ, образующиеся в водном
растворе, называются прямыми,
а в неполярной – обратными.
59
59.
Критическая концентрациямицеллообразования (ККМ) — концентрация
поверхностно-активного вещества в растворе, при
которой образуются устойчивые мицеллы.
60
60.
Растворы МЦобразующих ПАВ делятна 2 группы:
1) гомогенные при С< СККМ
2) микрогетерогенные при С> СККМ
61
61.
При увеличении концентрации СПАВ мицеллы проходят рядравновесных состояний, различающихся по n, размеру и
форме МЦ. МЦ стремятся принять цилиндрическую,
палочкообразную, пластинчатую форму
Строение мицелл: а) – сферические (мицелла Гартли); б) дискообразные; в) - цилиндрические; г) - обращенные мицеллы
62
62.
6363.
При ↑ концентрации СПАВ, превышающую ККМ в10-50 раз в системе, ↓ подвижность мицелл и ↑ их
сцепление, молекулы принимают цепочечную
ориентацию, при этом образуется сетка –
возникает структура (гель) с определенными
механическими свойствами: пластичностью,
прочностью, тиксотропией.
При дальнейшем удалении дисперсионной среды
гель переходит в твердую макрофазу – кристалл
со слоистым строением.
64
64.
Мицеллы ионогенных ПАВ обычнозаряжены, их заряд зависит от
кислотно-основных свойств
функциональных групп ПАВ и других
факторов.
При этом возможны
электрофоретическая подвижность.
Положительно заряженные мицеллы
движутся к катоду и наоборот
65
65.
Явление растворения веществ в МЦПАВназывается солюбилизацией.
В водных МЦ ПАВ солюбилизируются вещества,
нерастворимые в воде: С6Н6, органические
красители, жиры и т.д.). В органических МЦ
растворах солбилизируются молекулы воды.
Вещество, солюбилизируемое раствором ПАВ
называется солюбилизатом, а МЦ ПАВ –
солюбилизатором.
66
66.
Способы включения в водных растворах солюбилизата :1) неполярные углеводороды внедряется в ядра МЦ;
2) полярные органические вещества встраиваются в МЦ
между молекулами ПАВ так, чтобы их полярные группы
были обращены в воду, а липофильные части молекул
ориентированы параллельно радикалам ПАВ;
3) иногда солюбилизат закрепляется на поверхности МЦ.
67
67.
Применение явления солюбилизации:получении фармацевтических препаратов,
пищевых продуктов;
солюбилизация – важнейший фактор моющего
действия ПАВ, звено процесса обмена веществ.
68

















































 Химия
Химия








