Похожие презентации:
Строение вещества
1. СТРОЕНИЕ ВЕЩЕСТВА
2. Задание 1. Электрические свойства и строение молекул
В таблице для t = 20°C приведены значения показателя преломления nD иплотности ρ раствора вещества А в веществе В с массовой долей
растворенного вещества равной ω(A), и поляризация РA,∞ бесконечно
разбавленного раствора вещества А в неполярном растворителе.
На основании данных таблицы, привлекая в необходимых случаях информацию
из справочника [КС], определите:
а) удельную рефракцию раствора rA,B (м3/кг и см3/г);
б) удельную рефракцию чистого вещества В rB (м3/кг и см3/г), используя
справочные данные о его показателе преломления и плотности [КС];
в) удельную рефракцию вещества А rA (м3/кг и смЗ/г) на основании правила
аддитивности, исходя из количественного состава раствора ωA, значений
удельной рефракции раствора rA,B и чистого вещества B rB;
г) молярную рефракцию вещества А (м3/моль и см3/моль), пользуясь значениями
его молярной массы и удельной рефракции;
д) молярную рефракцию вещества А (м3/моль и см3/моль) по правилу
аддитивности, исходя из предположений о возможном существовании у
молекулы вещества A ИЗОМЕРОВ на основании справочных значений
атомных рефракций и инкрементов рефракций связей [КС], а затем
подтвердите или опровергните структуру молекулы вещества А;
е) момент электрического диполя вещества А (Кл∙м и Д) и сопоставьте его со
справочными данными [КС]. приведите графические формулы всех
возможных изомеров
3. Исходные данные
• показатель преломления nD = 1,3481• плотность ρ = 1,0562 г/мл
• Массовая доля ω = 12 % вещества А
(CHOHCOOH)2 в веществе В (H2O) при 293 К
• поляризация при бесконечном разведении
вещества (CHOHCOOH)2 в неполярном
растворе Р = 250.491∙10-6 м3/моль
4.
• Удельную рефракцию H2O вычислим на основаниипоказателя преломления и плотности из справочника по
формуле
n 2 1
1.3332 1
6 м3 / кг
rB 2
206,3
10
(n 2) ρ (1.3332 2) 0.99707 103 кг / м 3
• Используя свойство аддитивности удельной рефракции
r р ра ω A rA ω B rB ω A rA (1 ω A ) rB
n 2 1
1.34812 1
r р ра 2
2
3
3
(n 2) ρ (1.3481 2) 1.0562 10 кг / м
0.2262
6 м 3 / кг
202.7
10
3
3
0.8895 10 кг / м
5.
• Определим удельную рефракцию вещества А (м3/кг исм3/г), используя массовую долю:
rA
rр ра (1 ω A ) rB
A
0.2027 0.2063 (1 0.12)
0,1763 см 3 / г
0.12
• Зная удельную рефракцию и молярные массы веществ А и
B, вычислим значения молярной рефракции (см3/моль)
МА = М[(CHOHCOOH)2] = (12+1+16+1 +12+16+16+1)∙ 2 = 150 г/моль
МB= М[H2O] = 1∙2+1+16∙1 = 18 г/моль
R A rA M A 0.1763 150 26,445 см 3 / моль
RB rB M B 0.2027 18 3,6486 см 3 / моль
6.
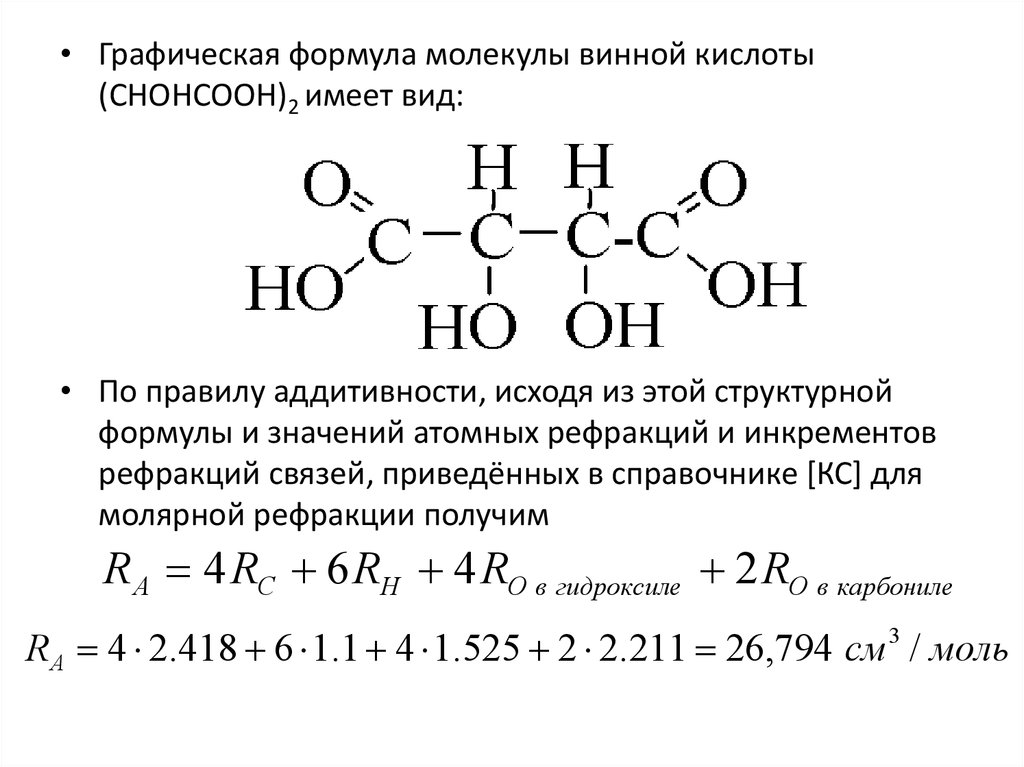
• Графическая формула молекулы винной кислоты(CHOHCOOH)2 имеет вид:
• По правилу аддитивности, исходя из этой структурной
формулы и значений атомных рефракций и инкрементов
рефракций связей, приведённых в справочнике [КС] для
молярной рефракции получим
R A 4 RC 6 RH 4 RO в гидроксиле 2 RO в карбониле
R A 4 2.418 6 1.1 4 1.525 2 2.211 26,794 см 3 / моль
7.
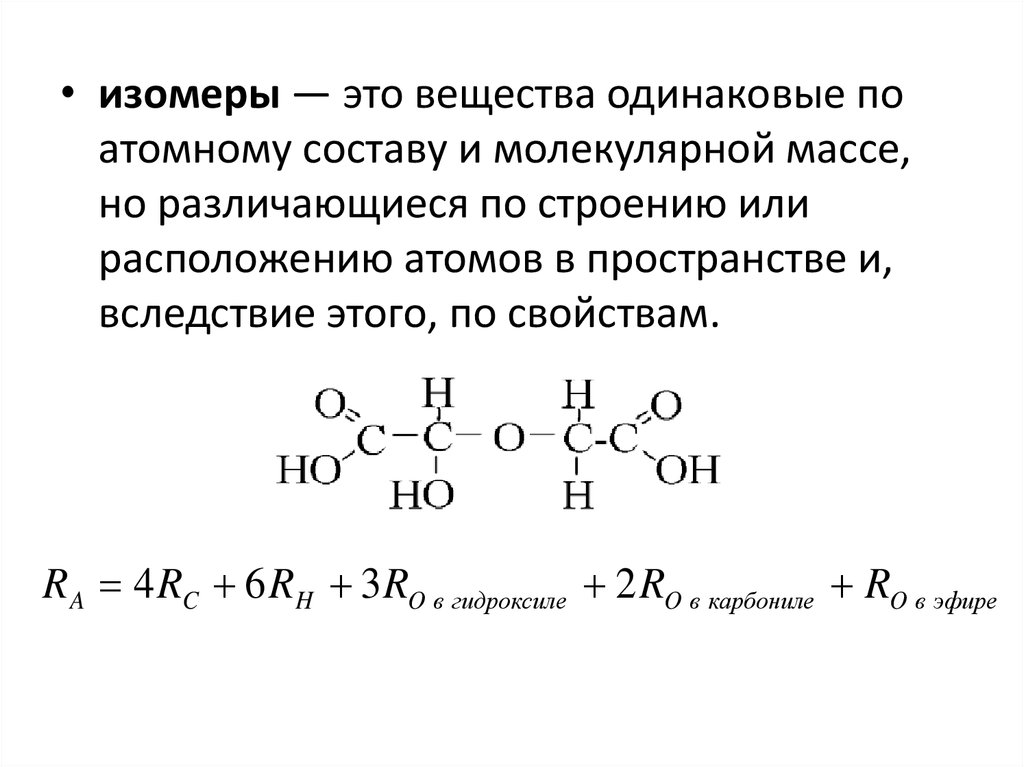
• изомеры — это вещества одинаковые поатомному составу и молекулярной массе,
но различающиеся по строению или
расположению атомов в пространстве и,
вследствие этого, по свойствам.
R A 4 RC 6 RH 3 RO в гидроксиле 2 RO в карбониле RO в эфире
8.
• Момент электрического диполя вещества А в дебаяхвычисляется по формуле:
μ o 0.0128 ( P RA ) T
• Следует обратить внимание, что коэффициент 0,0128 в
этой формуле получен путем объединения физических
постоянных таким образом, что расчет по формуле даёт
величину момента электрического диполя в дебаях при
подстановке величин поляризации и рефракции в
см3/моль :
μ o 0.0128 (250 .491 26 .794 ) 293 3,28 Д
• Справочное значение момент электрического диполя по
справочнику совпадает с рассчитанным.
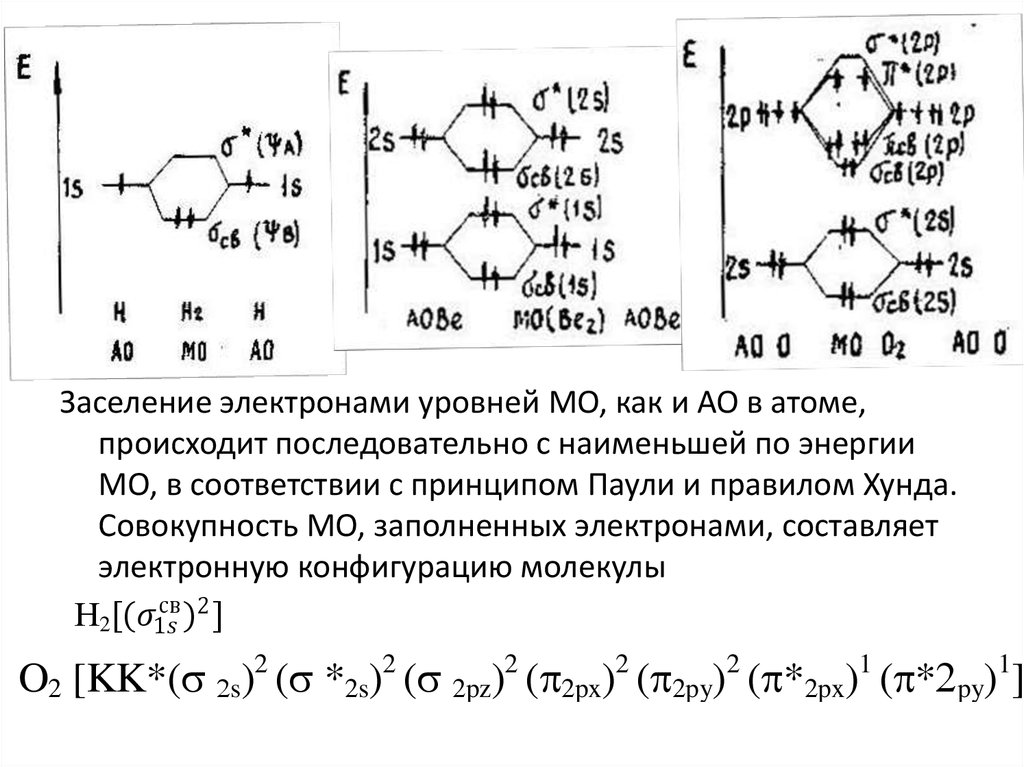
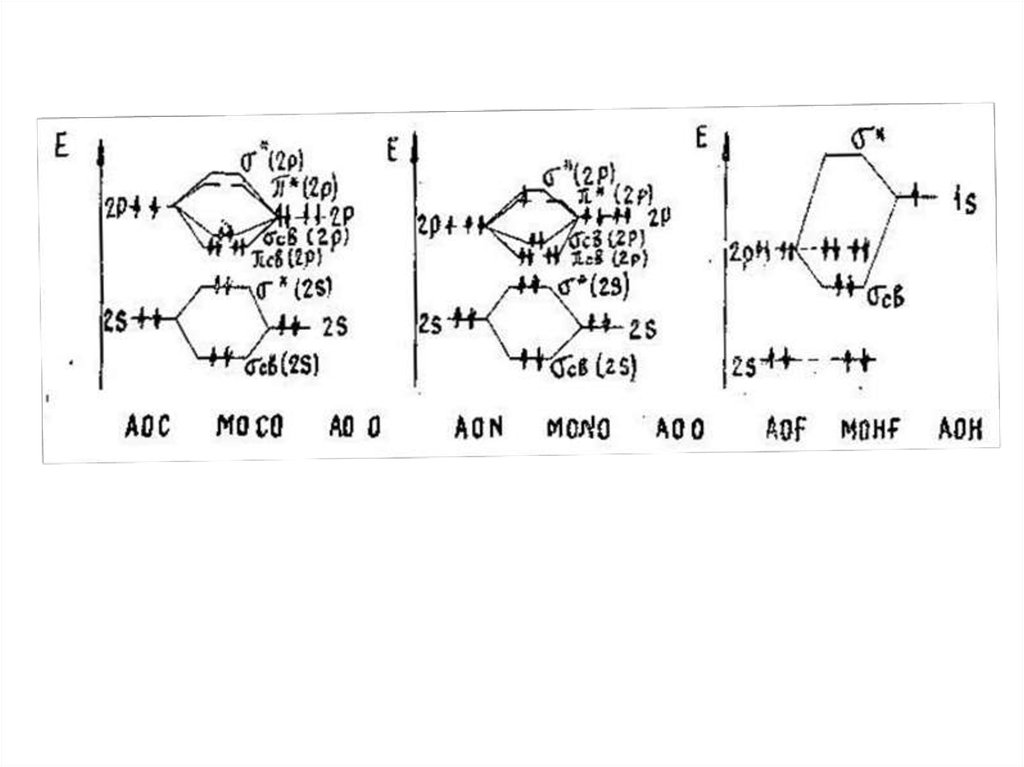
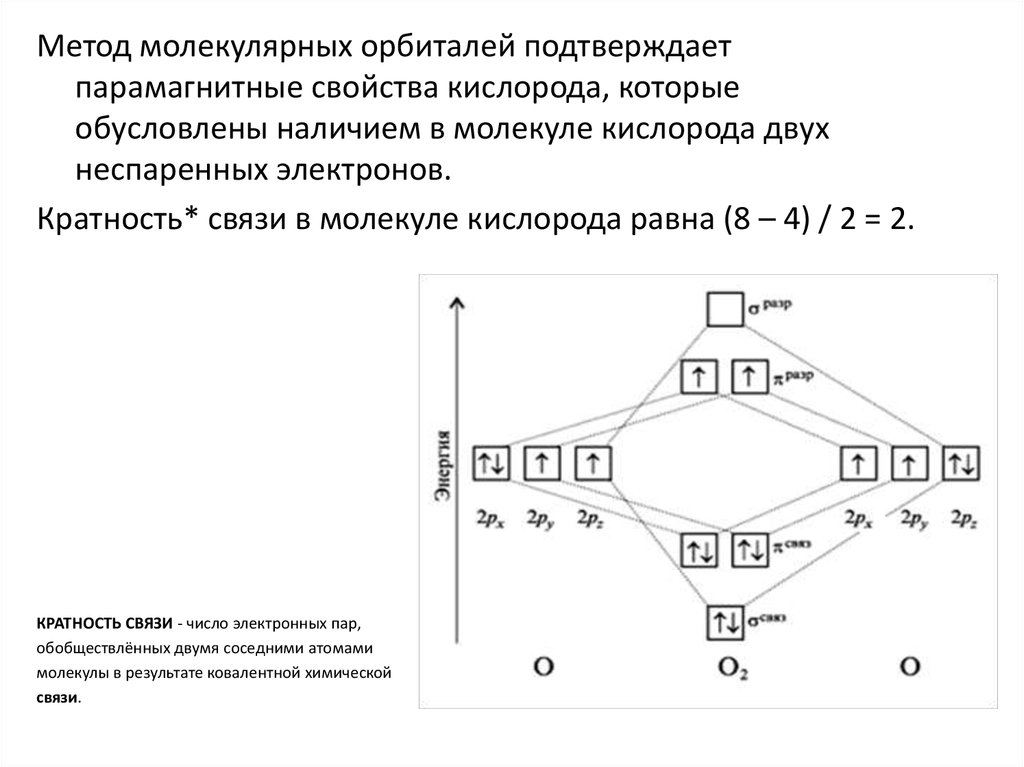
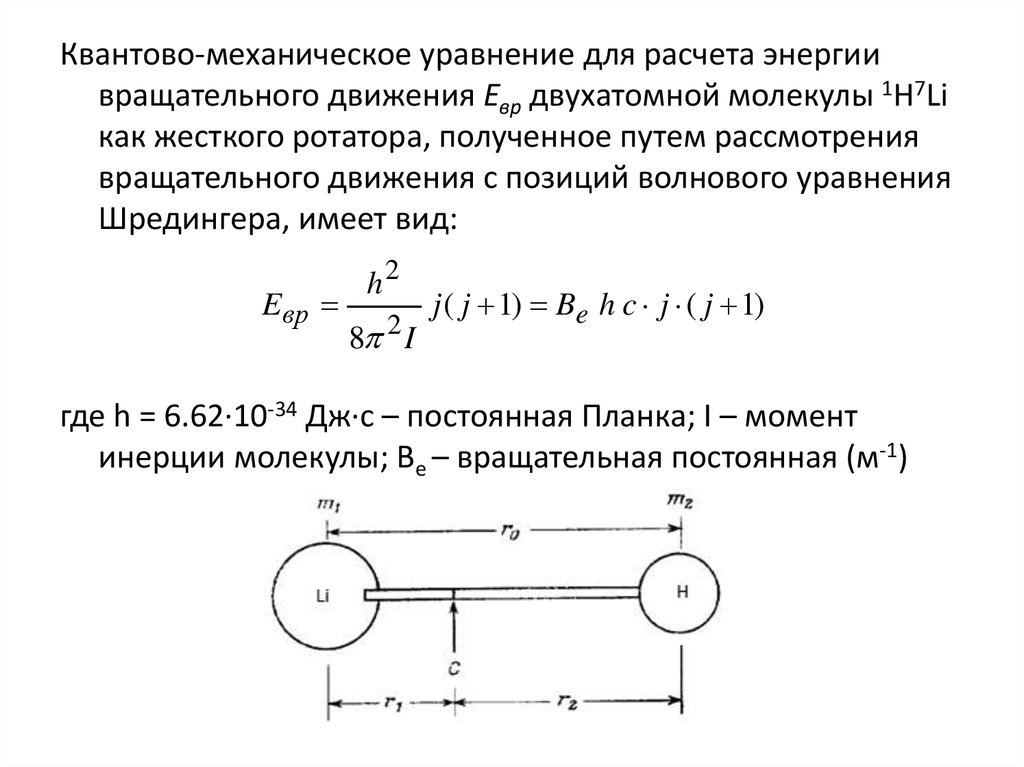
9. Задание 2. Химическая связь
• Запишите электронные конфигурации: 1) атомов A и B; 2)молекулы А–В (за основу примите энергетические уровни –
молекулярные орбитали гомоядерных молекул)
• Нарисуйте схематически энергетическую диаграмму молекулы
А–В и распределите электроны на энергетических уровнях.
• Установите, обладает ли: 1) вещество АВ диамагнитными или
парамагнитными свойствами 2) молекула А–В электрическим
диполем.
• Как изменится: 1) энергия связи, если молекулу AB перевести в
состояние иона AB+; 2) равновесное межъядерное расстояние,
если молекулу AB перевести в состояние иона AB+; 3) энергия
связи, если молекулу AB перевести в состояние иона AB-; 4)
равновесное межъядерное расстояние, если молекулу AB
перевести в состояние иона AB-.
10.
1897 г Вехерт и Томсон – открытие электрона и расчет егомассы ( 9,11.10-31 кг)
1902 г Томсон предложил теорию строения атома, согласно
которой атомы представляют собой сферы, имеющие
диаметр порядка нескольких ангстремов (1Å = 10-10 м),
заполненные положительно заряженным веществом. В
это вещество вкраплены электроны в таком количестве,
чтобы атом в целом был электронейтральным (модель
«пудинга с изюмом»).
1909 г Милликен – определение заряда 1,6.10-19 Кл
1911 г Э.Резерфорд предложил модель атома в виде
положительно заряженного ядра малого объема, в
котором сконцентрирована фактически вся масса, и
электронов, вращающихся вокруг этого ядра по орбитам
на различных расстояниях от него. Расположение
электронов и ядер напоминало картину планет в
солнечной системе, в результате модель получила
название «планетарной».
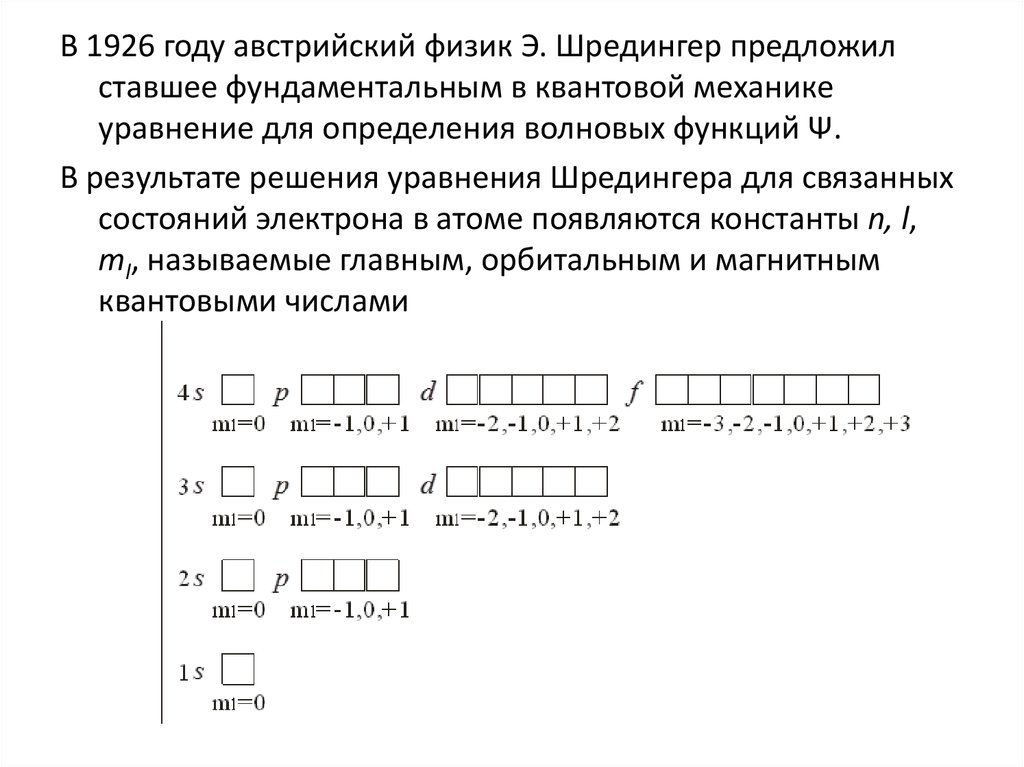
11.
1913 г Бор высказал утверждение, что в изолированном атомеэлектрон движется вокруг ядра, находящегося в центре
атома, по стационарным орбитам, не излучая и не поглощая
энергии.
Устойчивыми (разрешенными) для электрона будут только
такие орбиты, на которых момент импульса электрона
принимает значения, являющиеся строго кратными числу
h/2π, где h – постоянная Планка (6,63∙10-34 Дж∙с).
В случае плоских круговых орбит условие квантования Бора
выглядит следующим образом:
ℎ






















 Химия
Химия








