Похожие презентации:
Строение вещества. Строение атома
1. Строение вещества
Часть 1.СТРОЕНИЕ АТОМА
2.
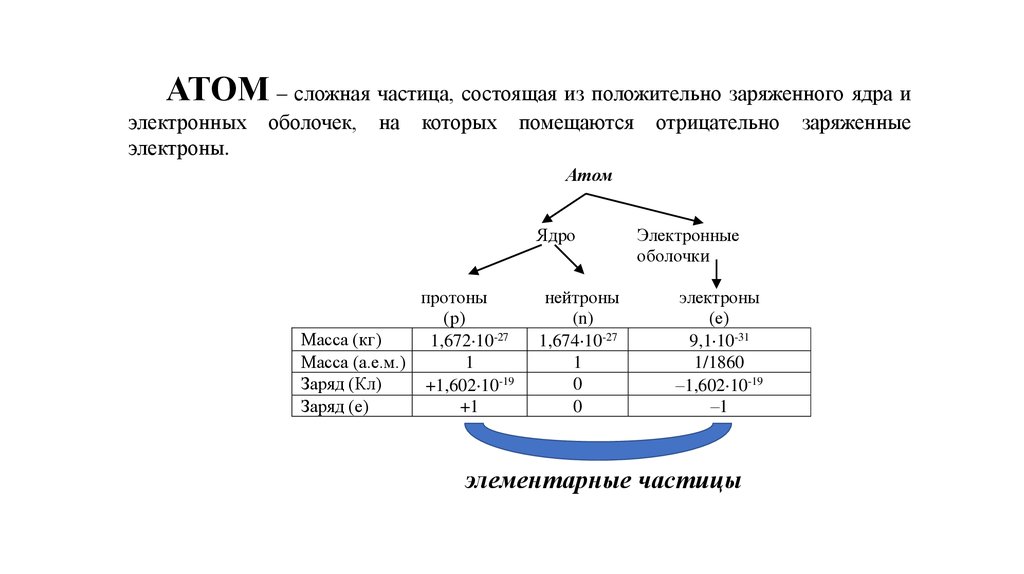
АТОМ – сложная частица, состоящая из положительно заряженного ядра иэлектронных
электроны.
оболочек,
на
которых
помещаются
отрицательно
Атом
Ядро
протоны
(р)
Масса (кг)
1,672 10-27
Масса (а.е.м.)
1
Заряд (Кл)
+1,602 10-19
Заряд (е)
+1
нейтроны
(n)
1,674 10-27
1
0
0
Электронные
оболочки
электроны
(е)
9,1 10-31
1/1860
–1,602 10-19
–1
элементарные частицы
заряженные
3.
Символы химических элементов представляются обычно в виде:a X c
b
где
X – символ элемента;
a – массовое число (сумма числа протонов и нейтронов);
b – порядковый номер элемента (число протонов);
с – заряд иона.
Изотопы – атомы одного
химического элемента, имеющие
одинаковое число протонов, но разные
массовые числа (число нейтронов).
35
17
Cl
37
17
Cl
( 17 p + 18 n )
( 17 p + 20 n )
4.
Протоны и нейтроны объединяются в компактное ядро за счет ядерных сил,возникновение которых приводит к дефекту массы (масса ядра всегда несколько
меньше суммы масс протонов и нейтронов). Дефект массы определяет устойчивость
атомного ядра и энергию связи нуклонов (протонов и нейтронов) в ядре.
Элементы с порядковыми номерами Z = 84 – 92 имеют только неустойчивые изотопы.
Самопроизвольное разложение атомных ядер неустойчивых изотопов носит
название «радиоактивность», а реакции, которые протекают в этих случаях –
ядерные реакции.
Примеры ядерных реакций.
U
234
92
Th He
230
90
4
2
232
138
86
92 U 56 Ba 36 Kr 8n
72
34
Se e As
72
33
выделение -частиц
выделение нейтронов
(нейтрино) – электронный захват
5.
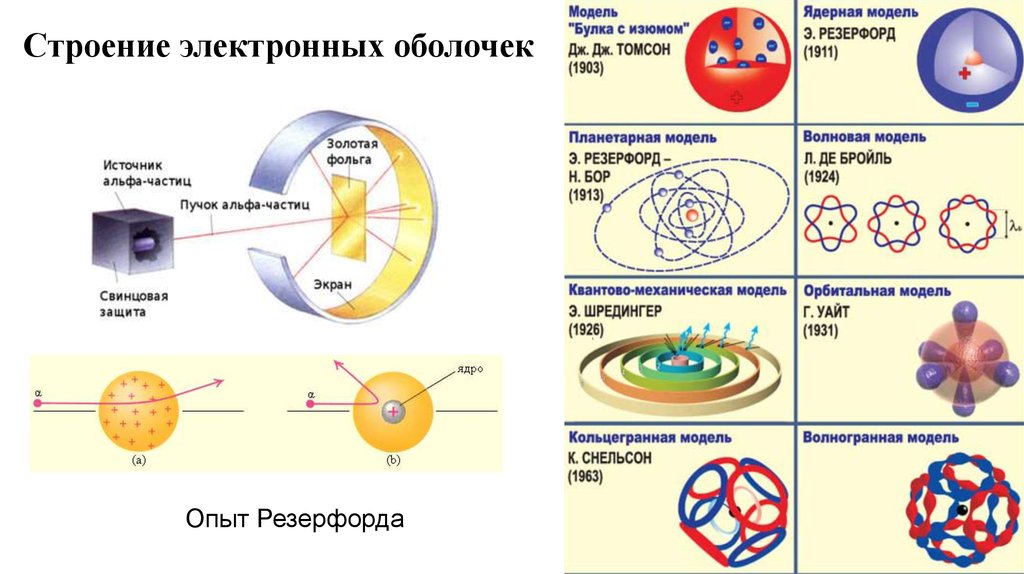
Строение электронных оболочекОпыт Резерфорда
6.
Корпускулярно-волновой дуализм электрона (электрон обладаетодновременно свойствами частицы и волны).
h
mv
– длина волны частицы;
m – масса частицы;
v – скорость ее движения;
h – постоянная Планка (h = 6,62 10-34 Дж с).
(уравнение Луи де Бройля)
х рх h
х – координата электрона
р – составляющая импульса
вдоль этой координаты
(принцип неопределенности Гейзенберга)
7.
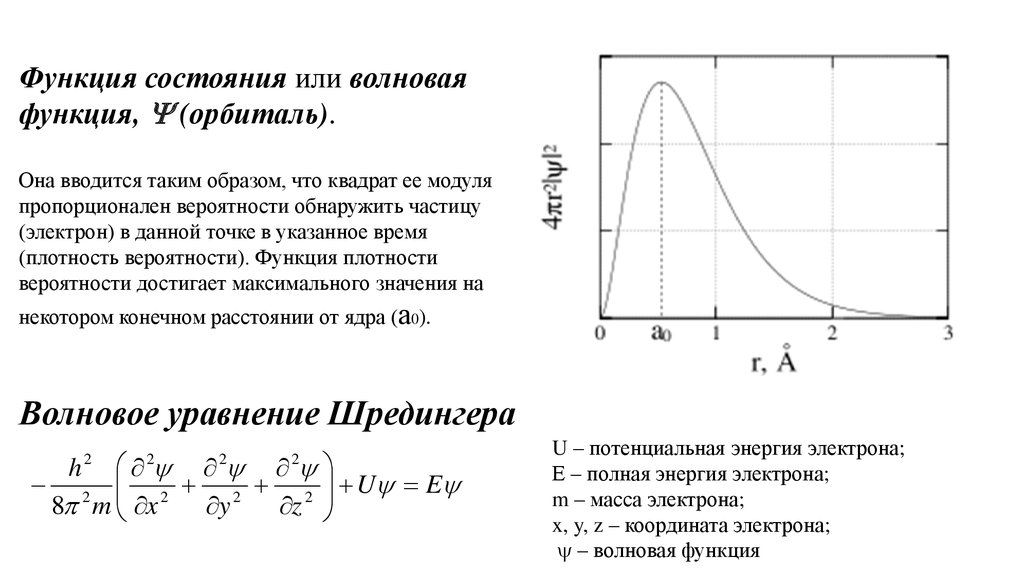
Функция состояния или волноваяфункция, (орбиталь).
Она вводится таким образом, что квадрат ее модуля
пропорционален вероятности обнаружить частицу
(электрон) в данной точке в указанное время
(плотность вероятности). Функция плотности
вероятности достигает максимального значения на
некотором конечном расстоянии от ядра (а0).
Волновое уравнение Шредингера
2 2 2 2 U E
8 m x
y
z
h
2
2
2
2
U – потенциальная энергия электрона;
Е – полная энергия электрона;
m – масса электрона;
x, y, z – координата электрона;
– волновая функция
8.
Решение уравнения Шредингера содержит набор квантовых чисел,характеризующих поведение электрона в атоме.
n – главное квантовое число, оно определяет общий запас энергии
электрона, т.е. энергетический уровень.
n = 1,2,3…
l
– орбитальное квантовое число, определяет форму электронной
орбитали (энергетический подуровень).
l = 0,1,2…(n-1).
ml – магнитное квантовое число, характеризует проекцию магнитного момента
электрона на внешнее магнитное поле, то есть ориентацию электронной
орбитали в пространстве.
ml = l; (l-1); (l-2)…0.
ms – спиновое квантовое число, определяет собственный момент вращения
электрона.
ms = ½.
9.
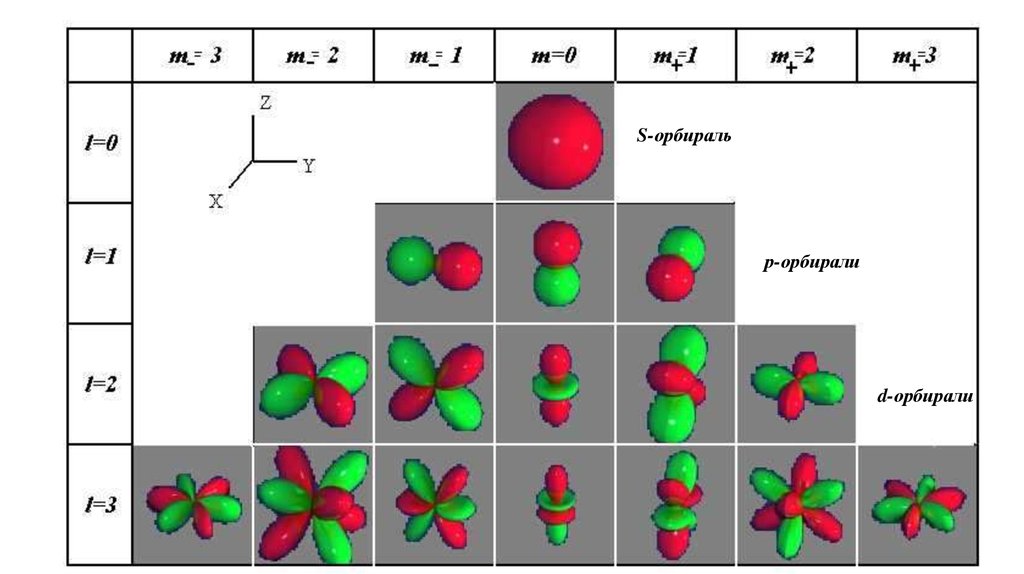
S-орбиральр-орбирали
d-орбирали
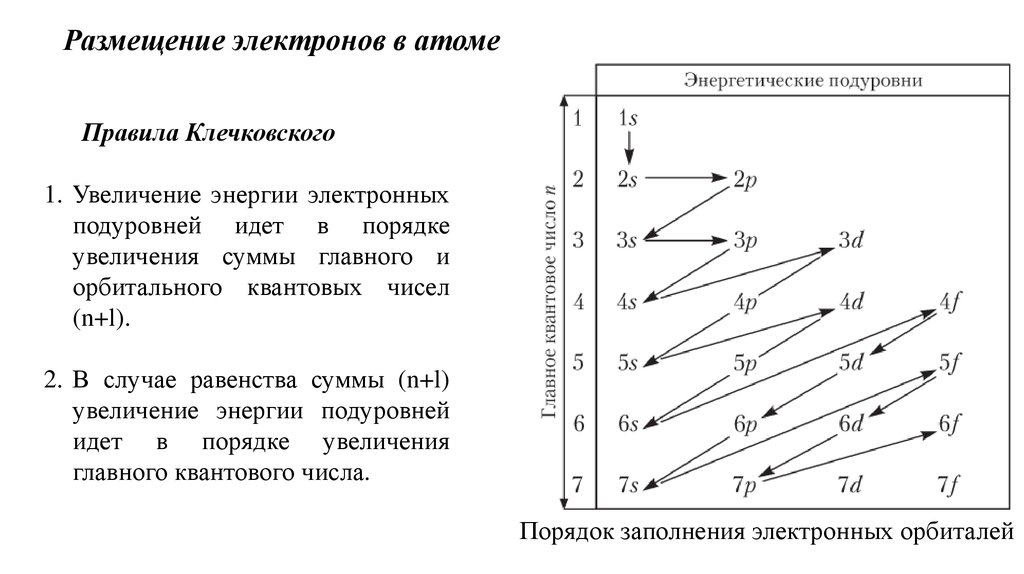
10. Порядок заполнения электронных орбиталей
Размещение электронов в атомеПравила Клечковского
1. Увеличение энергии электронных
подуровней идет в порядке
увеличения суммы главного и
орбитального квантовых чисел
(n+l).
2. В случае равенства суммы (n+l)
увеличение энергии подуровней
идет в порядке увеличения
главного квантового числа.
Порядок заполнения электронных орбиталей
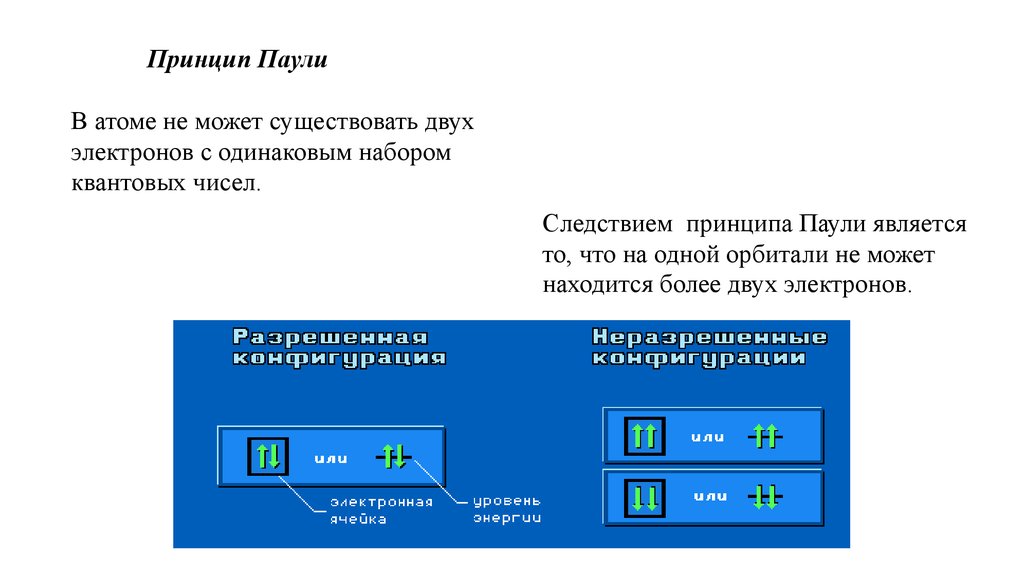
11.
Принцип ПаулиВ атоме не может существовать двух
электронов с одинаковым набором
квантовых чисел.
Следствием принципа Паули является
то, что на одной орбитали не может
находится более двух электронов.
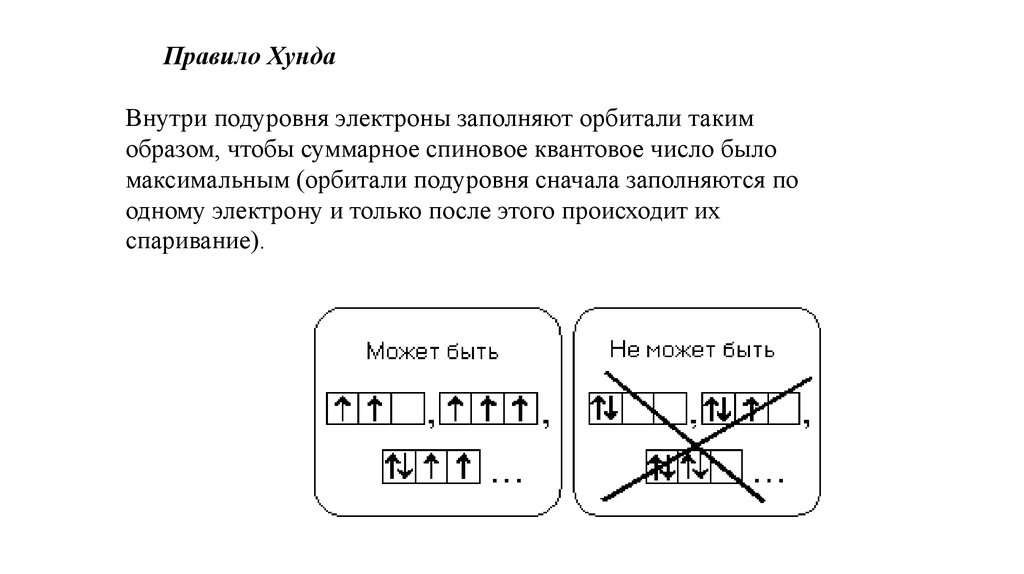
12.
Правило ХундаВнутри подуровня электроны заполняют орбитали таким
образом, чтобы суммарное спиновое квантовое число было
максимальным (орбитали подуровня сначала заполняются по
одному электрону и только после этого происходит их
спаривание).
13.
14. Электронные формулы атомов и ионов: Число электронов в нейтральном атоме равно порядковому номеру элемента в Периодической
системе2
2
6
1
2p
2
6
11Na:
1s 2s 2p 3s
1s
2s
22Ti:
2
2
6
3s
2
2
1s 2s 2p 3s 3p 4s 3d
1s
2s
2p
3s
3p
4s
3d
15.
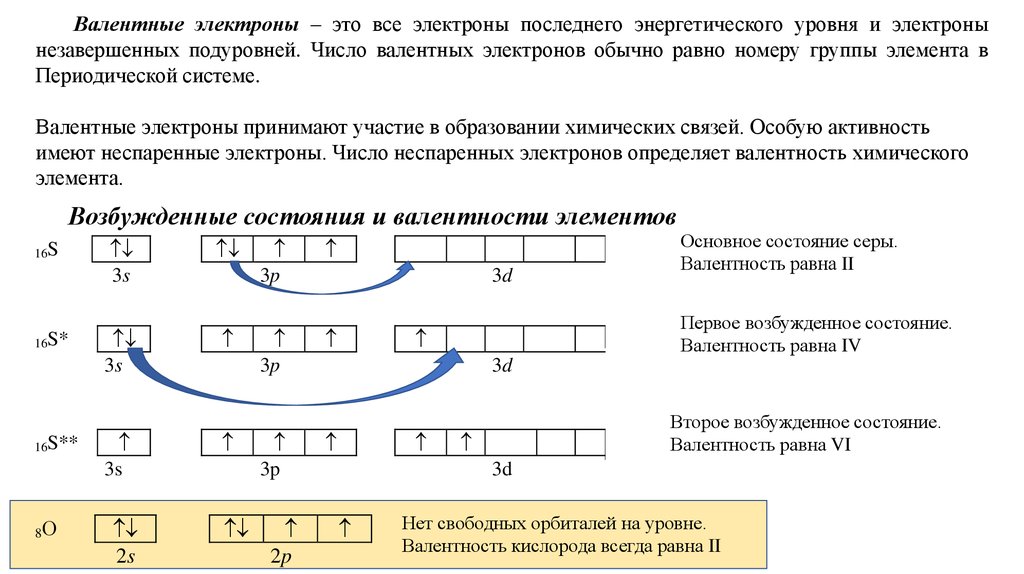
Валентные электроны – это все электроны последнего энергетического уровня и электронынезавершенных подуровней. Число валентных электронов обычно равно номеру группы элемента в
Периодической системе.
Валентные электроны принимают участие в образовании химических связей. Особую активность
имеют неспаренные электроны. Число неспаренных электронов определяет валентность химического
элемента.
Возбужденные состояния и валентности элементов
16S
16S*
16S**
8О
3s
3s
3s
2s
3p
3p
3p
2p
3d
Основное состояние серы.
Валентность равна II
Первое возбужденное состояние.
Валентность равна IV
3d
Второе возбужденное состояние.
Валентность равна VI
3d
Нет свободных орбиталей на уровне.
Валентность кислорода всегда равна II
16. Строение вещества
Часть 2.СТРОЕНИЕ МОЛЕКУЛ
(ХИМИЧЕСКАЯ СВЯЗЬ)
Строение
вещества
17.
Химическая связь возникает при взаимодействии атомов, обусловливающемобразование химически устойчивой двух- или многоатомной системы (молекулы,
кристалла и др.). Образование химической связи связано с общим понижением
энергии системы взаимодействующих частиц.
Энергия связи – это количество энергии, выделяющейся при образовании
химической связи. Обычно ее выражают в килождоулях на 1 моль
образовавшегося вещества.
Длина связи – это расстояние между ядрами атомов в молекуле. Длины связей
обусловлены размерами реагирующих атомов и степенью перекрывания их
электронных облаков.
18.
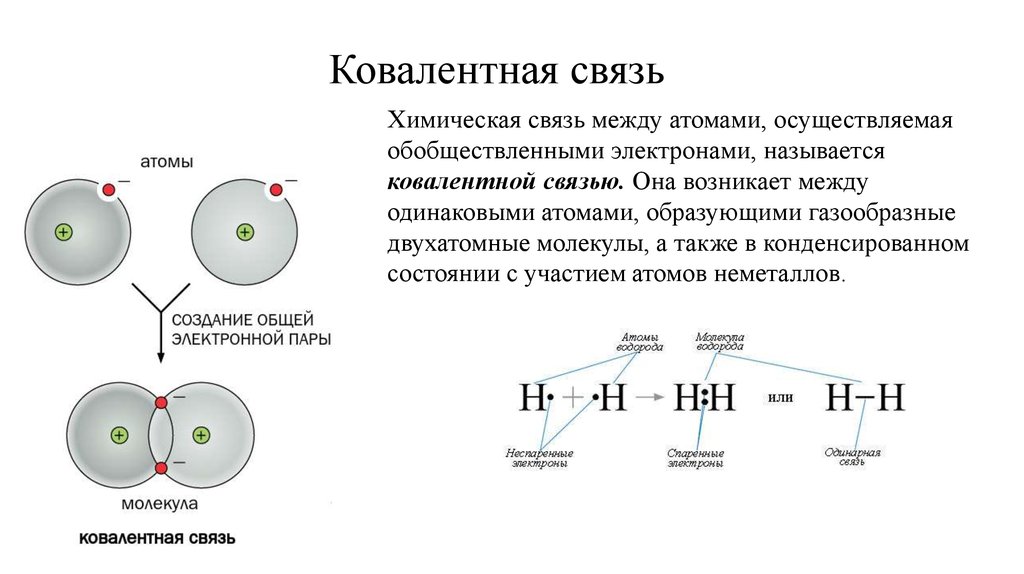
Ковалентная связьХимическая связь между атомами, осуществляемая
обобществленными электронами, называется
ковалентной связью. Она возникает между
одинаковыми атомами, образующими газообразные
двухатомные молекулы, а также в конденсированном
состоянии с участием атомов неметаллов.
19.
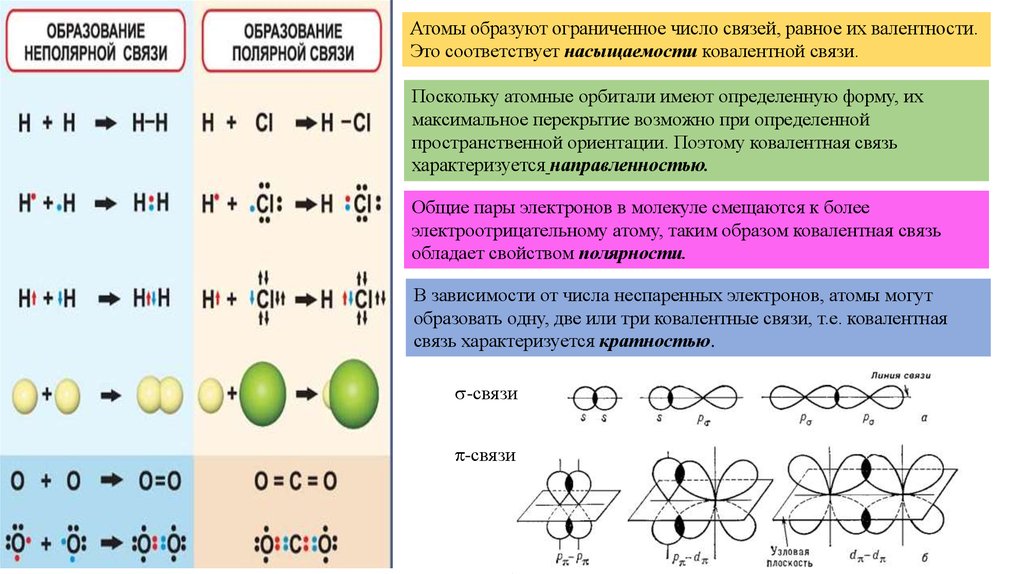
Атомы образуют ограниченное число связей, равное их валентности.Это соответствует насыщаемости ковалентной связи.
Поскольку атомные орбитали имеют определенную форму, их
максимальное перекрытие возможно при определенной
пространственной ориентации. Поэтому ковалентная связь
характеризуется направленностью.
Общие пары электронов в молекуле смещаются к более
электроотрицательному атому, таким образом ковалентная связь
обладает свойством полярности.
В зависимости от числа неспаренных электронов, атомы могут
образовать одну, две или три ковалентные связи, т.е. ковалентная
связь характеризуется кратностью.
-связи
-связи
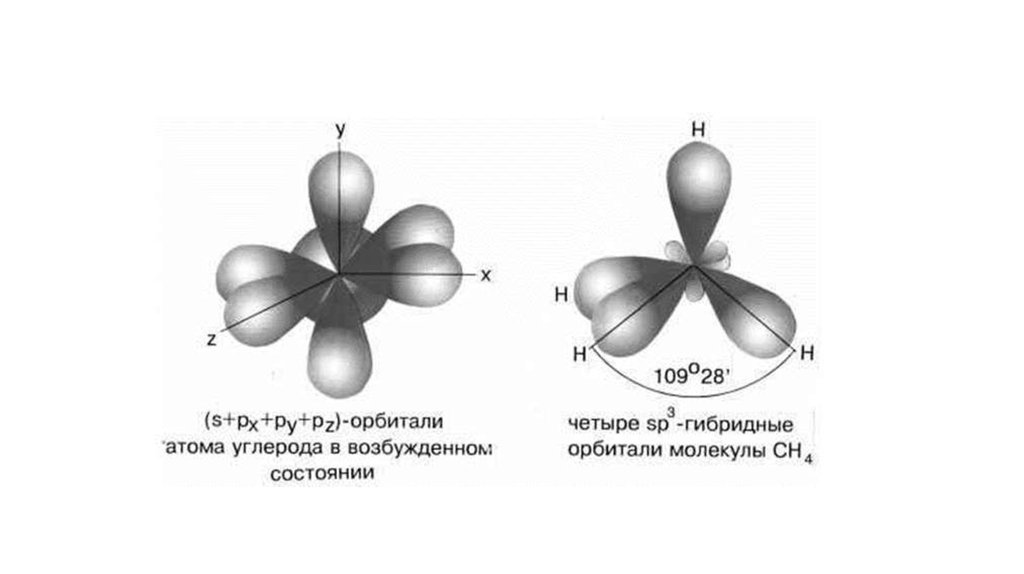
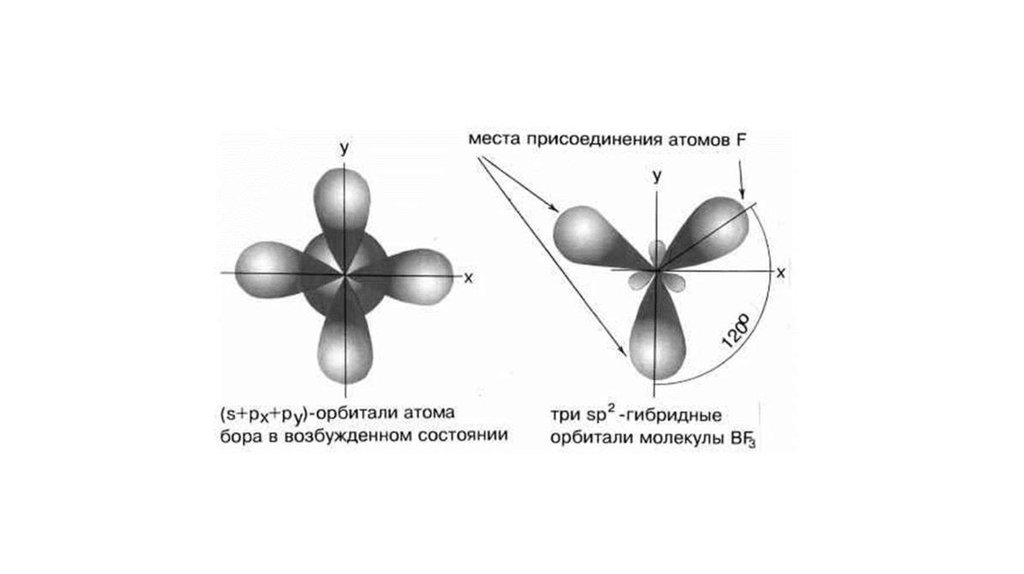
20.
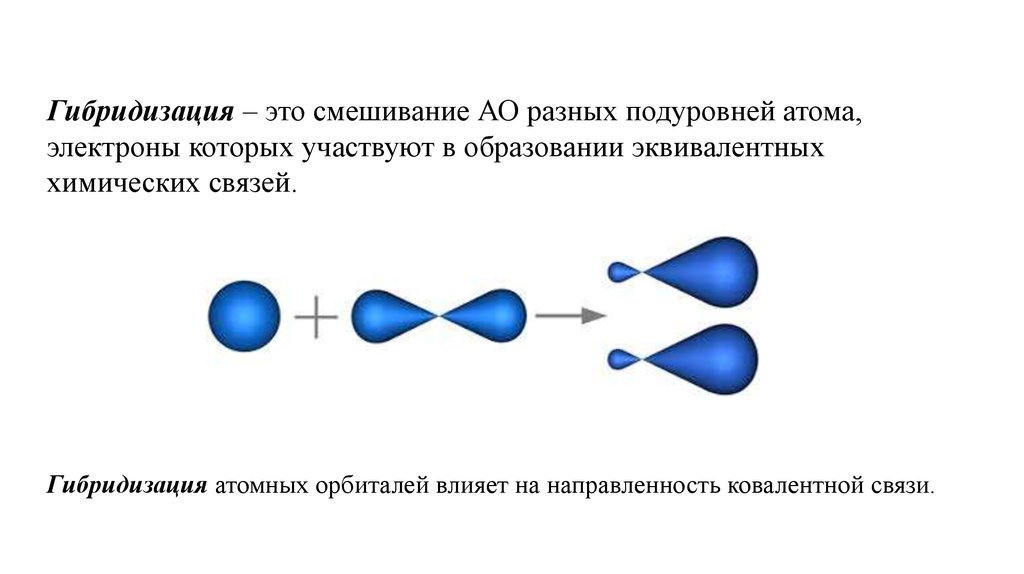
Гибридизация – это смешивание АО разных подуровней атома,электроны которых участвуют в образовании эквивалентных
химических связей.
Гибридизация атомных орбиталей влияет на направленность ковалентной связи.
21.
22.
23.
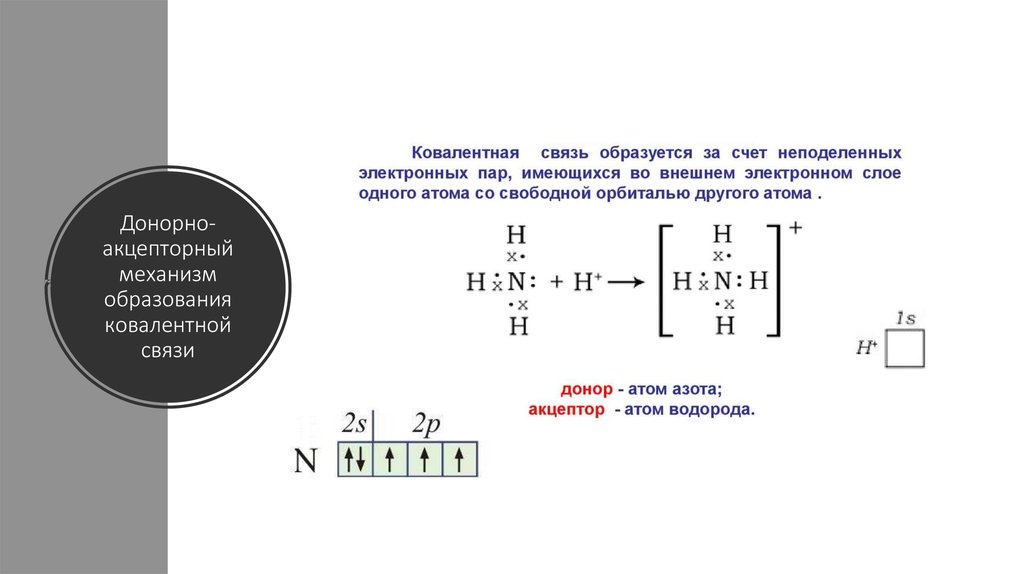
24. Донорно-акцепторный механизм образования ковалентной связи
Донорноакцепторныймеханизм
образования
ковалентной
связи
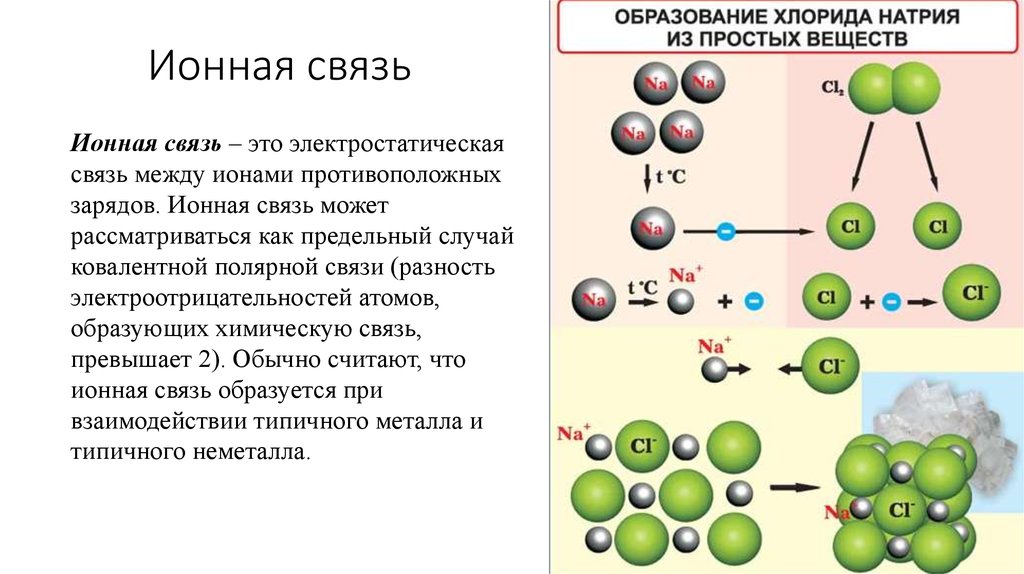
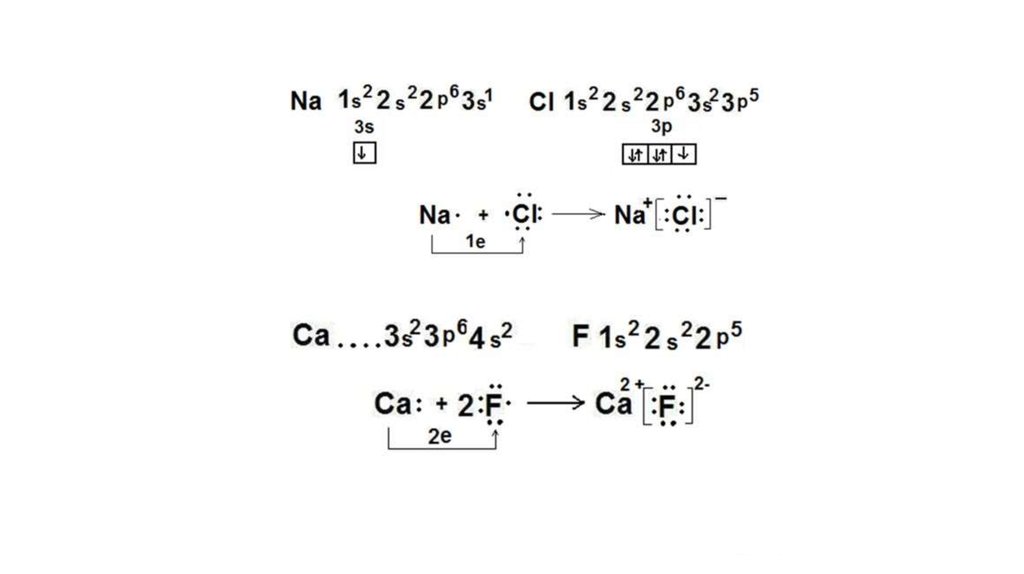
25. Ионная связь
Ионная связь – это электростатическаясвязь между ионами противоположных
зарядов. Ионная связь может
рассматриваться как предельный случай
ковалентной полярной связи (разность
электроотрицательностей атомов,
образующих химическую связь,
превышает 2). Обычно считают, что
ионная связь образуется при
взаимодействии типичного металла и
типичного неметалла.
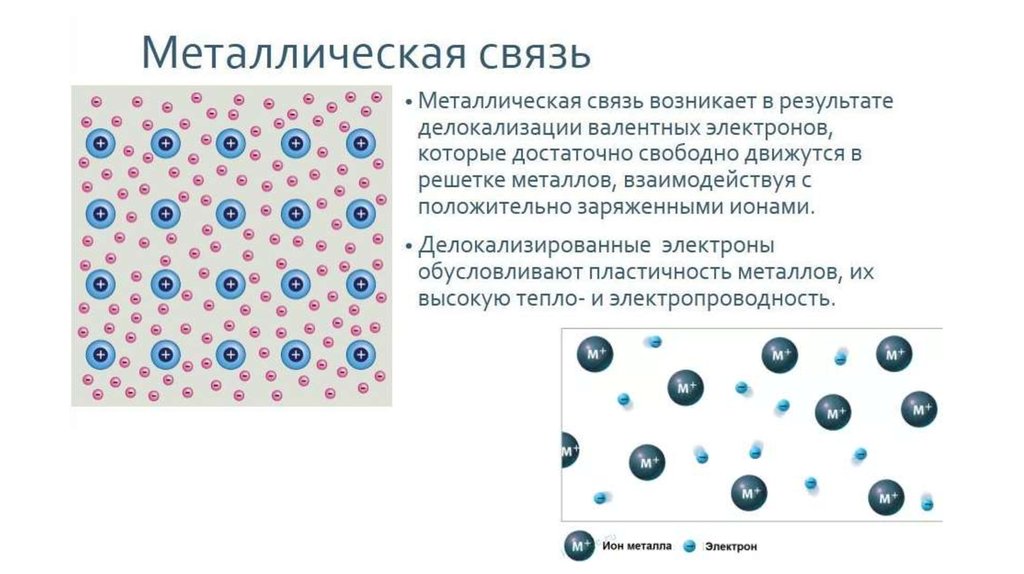
26.
27.
28.
29. Строение вещества
Часть 3.Конденсированное состояние
(взаимодействие молекул)
Строение
вещества
30.
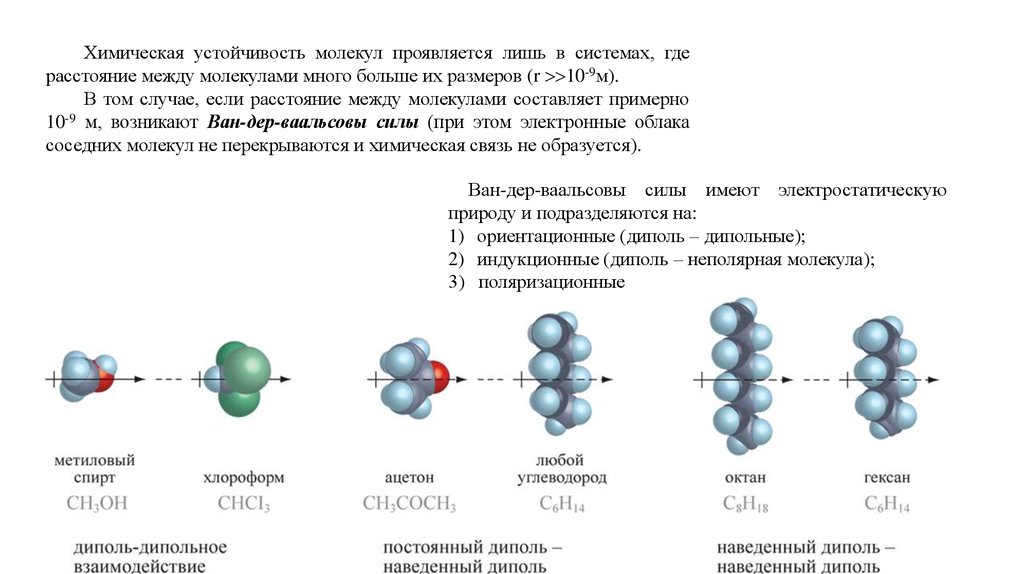
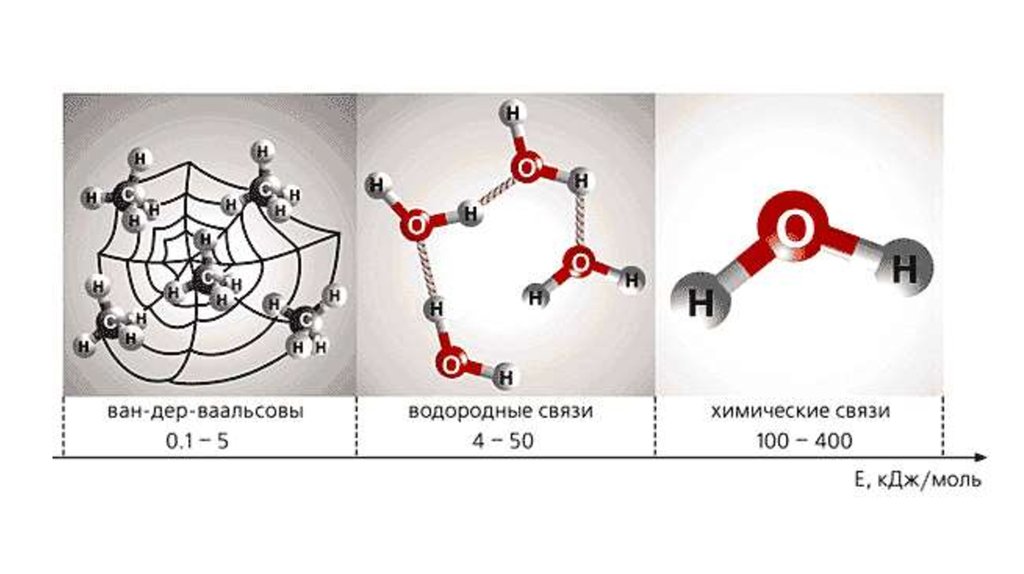
Химическая устойчивость молекул проявляется лишь в системах, гдерасстояние между молекулами много больше их размеров (r 10-9м).
В том случае, если расстояние между молекулами составляет примерно
10-9 м, возникают Ван-дер-ваальсовы силы (при этом электронные облака
соседних молекул не перекрываются и химическая связь не образуется).
Ван-дер-ваальсовы силы имеют электростатическую
природу и подразделяются на:
1) ориентационные (диполь – дипольные);
2) индукционные (диполь – неполярная молекула);
3) поляризационные












 Химия
Химия








