Похожие презентации:
Насыщенные углеводороды. (Тема 1.1)
1.
Т Е М А 1 .1 :Н АСЫ Щ ЕН Н Ы Е
УГЛЕВ О Д О Р О Д Ы
Учебны е вопросы :
1. Ал ка н ы
–
ациклические
у гл е в о д о р о д ы , и х
го м о л о ги ч е с к и й
ряд,
общ ая ф орм ула, изом ерия, сы рьевая база. Особенность строени я
м олекулы
алканов
(п е р в и ч н ы й ,
вторичны й,
третичны й
атом ы
у гл е р о д а , э н е р ги я , д л и н а , п о л я р н о с т ь , п о л я р и з у е м о с т ь х и м и ч е с к и х
с в я з е й ).
2 . Н о м е н к л а т у р а а л к а н о в , х а р а к т е р и с т и к а и х ф и з и к о -х и м и ч е с к и х и
пож ароопасны х свойств.
3.Алкилы
–
од новалентны е
остатки
алканов.
Понятие
алкилов,
образование их названий.
4 . Ф и з и ч е с к и е с в о й с т в а п р е д е л ь н ы х у гл е в о д о р о д о в .
1
2.
Ациклические насы щ енны е(п р е д е л ь н ы е ) у гл е в о д о р о д ы
(п а р а ф и н ы ,
алканы )
Н а и б о ле е п р о сты м и о р га н и ч е ск и м и со е ди н е н и я м и
я в ля ю тся
то ль к о
из
в е щ е ств а ,
а то м о в
м олекулы
угле р о да
и
к о то р ы х
водорода
постр оен ы
и
к о то р ы е
п о это м у б ы ли н а зв а н ы угле в о до р о да м и .
У гле в о до р о ды ш и р о к о р а сп р о стр а н е н ы
находят
очень
больш ое
и
природе и
разнообразное
п р а к ти ч е ск о е п р и м е н е н и е .
2
3.
Значение углеводородов заключается еще и втом, что все остальные, более сложные по
составу органические вещества являются
производными этих простейших соединений и
могут быть выведены из этих углеводородов
заменой атомов водорода в их молекулах на
другие атомы или атомные группы. В свою
очередь все другие вещества путем химических
реакций
могут
быть
превращены
в
углеводороды.
Углеводороды служат остовом, основой всех
прочих органических веществ.
3
4.
У гле в о до р о ды ,а то м ы
в
образую т
назы ваю т
м оле кулах
к о то р ы х
о тк р ы ты е ,
н е за м к н уты е
ациклическим и
угле в о до р о д а м и
ж и р н о го
ненасы щ енны е
Н асы щ енны е
м ало
цепи,
угле в о до р о да м и ,
ряда.
И х
подразделяю т
д в а к л а с с а : н а с ы щ е н н ы е (п р е д е л ь н ы е )
и
угле р о д н ы е
или
на
угле в о д о р о ды
(н е п р е д е л ь н ы е ) у г л е в о д о р о д ы .
угле в о дор о ды
реакционноспособны
названы параф инам и
и
в
обы чны х
п о то м у
б ы ли
услови ях
та к
же
( о т л а т и н с к и х с л о в p a r u m a ff in is
– и м е ю щ и й м а л о с р о д с тв а ).
4
5.
К классу насыщенных углеводородовотносят
такие
углеводороды,
в
молекулах которых углеродные атомы
соединены друг с другом простыми
(одинарными)
связями,
а
все
валентности углеродных атомов, не
участвующие
в
их
взаимном
соединении,
образуют
связи
с
атомами водорода.
Насыщенные углеводороды наиболее
богаты водородом по сравнению с
углеводородами других классов.
5
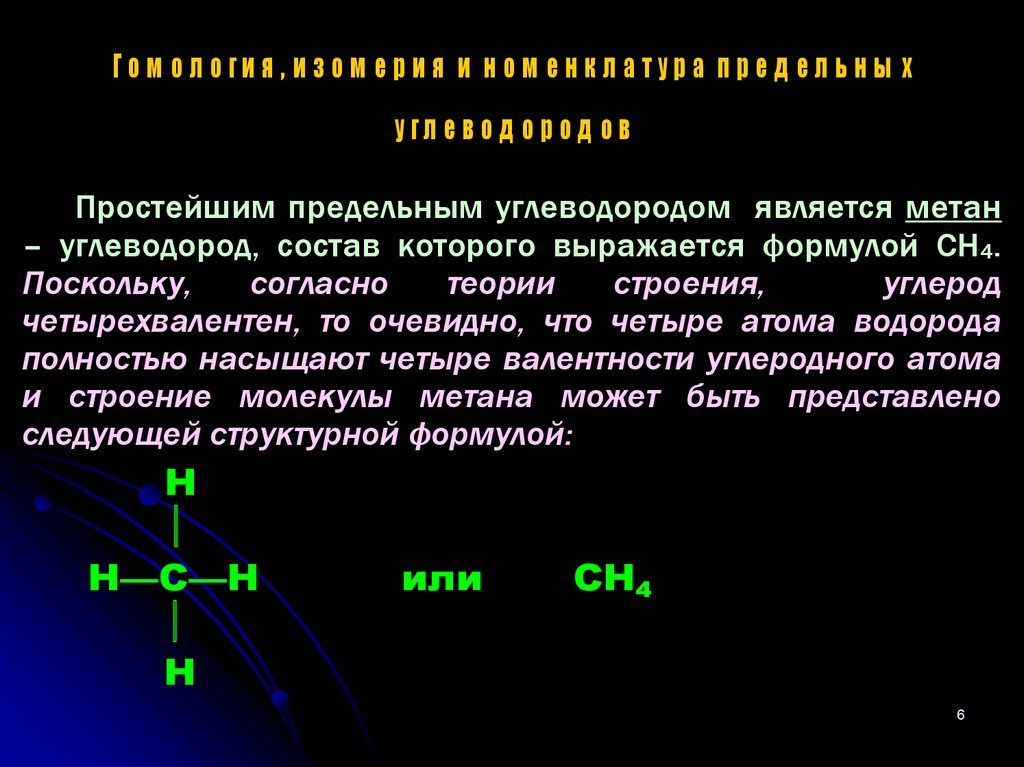
6.
Го м о л о ги я , и з о м е р и я и н о м е н к л а ту р а п р е д е л ь н ы ху гл е в о д о р о д о в
Простейшим предельным углеводородом является метан
– углеводород, состав которого выражается формулой CH4.
Поскольку,
согласно
теории
строения,
углерод
четырехвалентен, то очевидно, что четыре атома водорода
полностью насыщают четыре валентности углеродного атома
и строение молекулы метана может быть представлено
следующей структурной формулой:
Н
Н—С—Н
Н
или
СН4
6
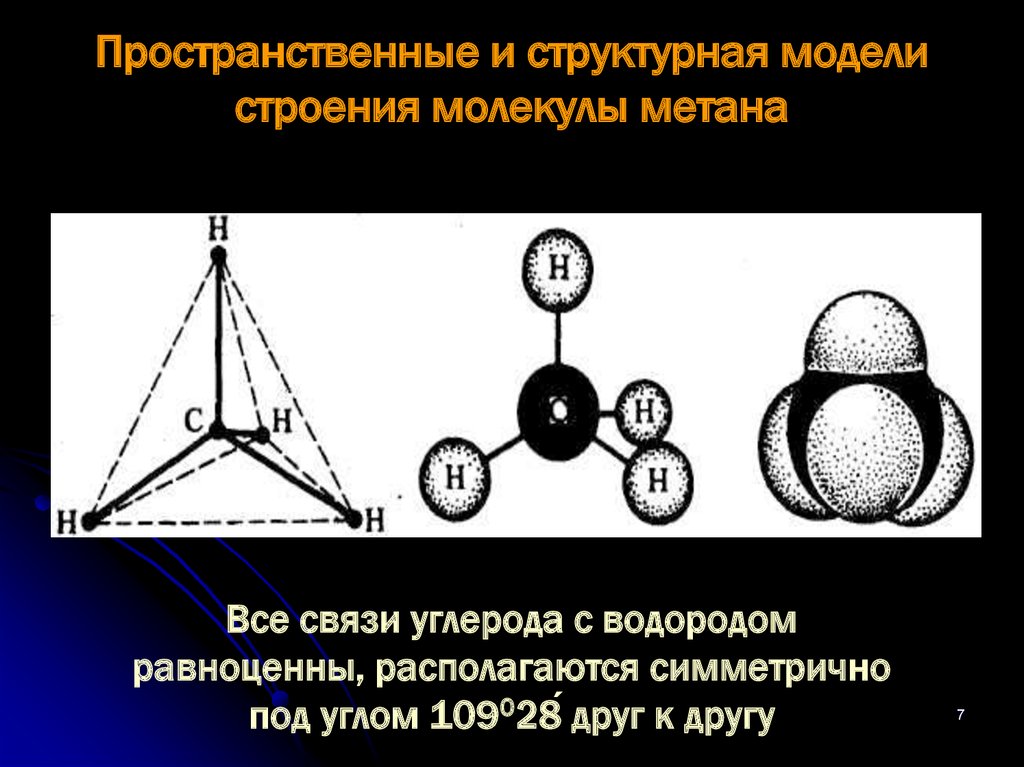
7. Пространственные и структурная модели строения молекулы метана
Все связи углерода с водородомравноценны, располагаются симметрично
под углом 109028́ друг к другу
7
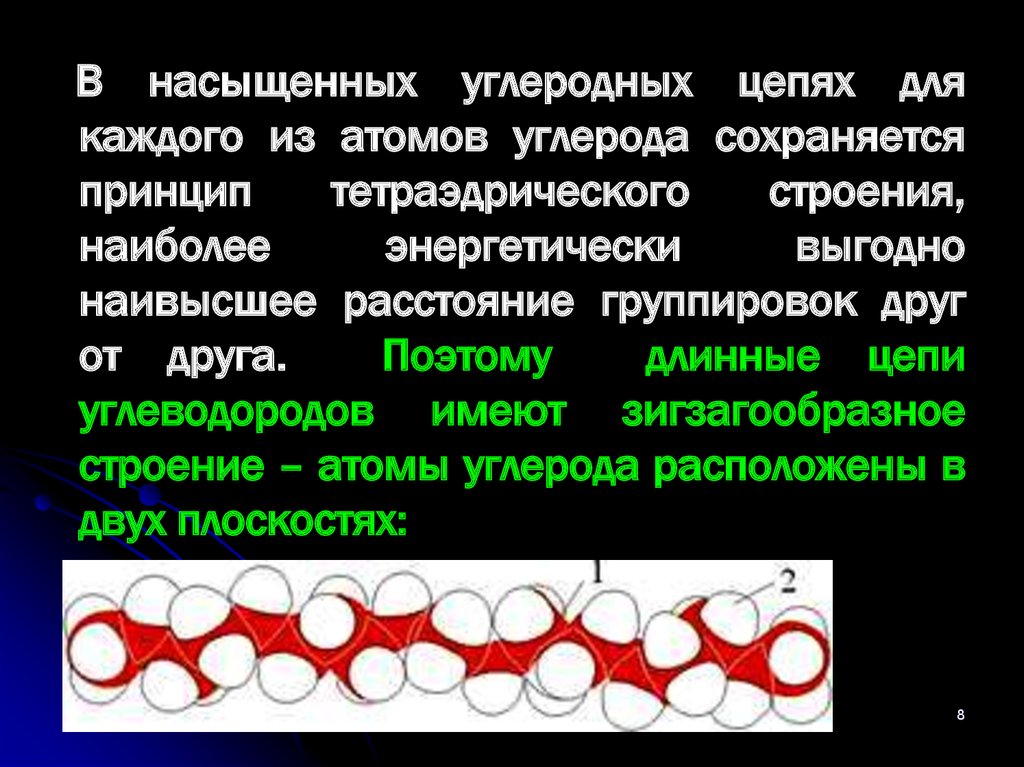
8.
В насыщенных углеродных цепях длякаждого из атомов углерода сохраняется
принцип
тетраэдрического
строения,
наиболее
энергетически
выгодно
наивысшее расстояние группировок друг
от друга.
Поэтому
длинные цепи
углеводородов имеют зигзагообразное
строение – атомы углерода расположены в
двух плоскостях:
8
9.
Е сли от м о ле кулы м е та н а C Hо тн я ть
один
а том
4
к а к и м -л и б о п у т е м
водорода,
то
п о луч и тся
у г л е в о д о р о д н ы й о с т а то к (р а н е е и х н а з ы в а л и т а к ж е и
радикалам и)
C H 3—
,
та к
назы ваем ы й
м е ти л,
в
к о то р о м о дн а в а ле н тн о сть угле р о д а н е н а сы щ е н н а .
Т а к о го р о д а угле в о д о р о дн ы е о ста тк и п р и м н о ги х
хи м и ч е ск и х п р е в р а щ е н и я х о р га н и ч е ск и х в е щ е ств в
неизм енном
др угую
и,
виде переходят из одн ой м олекулы
как
правило,
в
свободном
виде
в
не
сущ е ств ую т.
9
10. Углеводород Радикал
УглеводородCH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
метан
этан
пропан
бутан
пентан
гексан
гептан
октан
нонан
декан
Радикал
- CH3
- C2H5
- C3H7
- C4H9
- C5H11
- C6H13
- C7H15
- C8H17
- C9H19
- C10H21
метил
этил
пропил
бутил
пентил
гексил
гептил
октил
нонил
декил
10
11.
В момент образования они соединяются либо сдругими атомами или группами, либо друг с другом.
При соединении друг с другом двух метильных
остатков образуется следующий по сложности после
метана углеводород, имеющий состав C2H6 – так
называемый этан. Структурная формула его имеет
следующий вид:
H H
этан H—C C—H
H H
Структурная формула этана, так же и метана,
представляет собой проекцию его модели на плоскость.
11
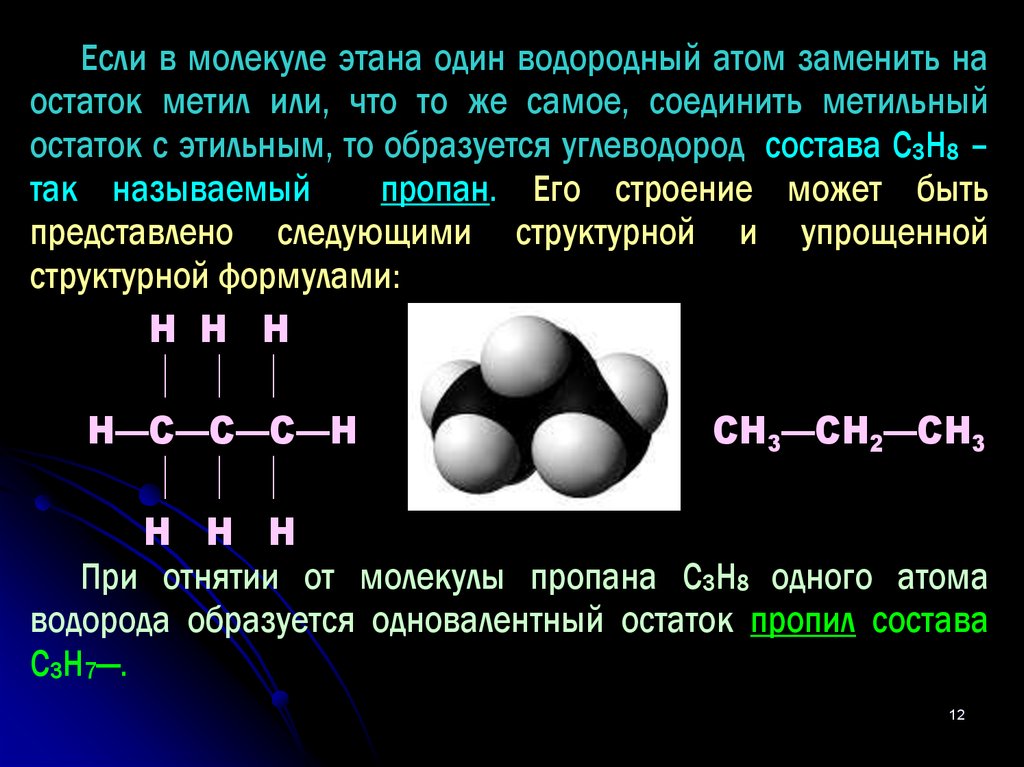
12.
Если в молекуле этана один водородный атом заменить наостаток метил или, что то же самое, соединить метильный
остаток с этильным, то образуется углеводород состава С3Н8 –
так называемый
пропан. Его строение может быть
представлено следующими структурной и упрощенной
структурной формулами:
Н Н Н
Н—С—С—С—Н
или
СН3—СН2—СН3
Н Н Н
При отнятии от молекулы пропана С3Н8 одного атома
водорода образуется одновалентный остаток пропил состава
С3Н7—.
12
13.
Явлениеряд один
метанаатом
Замещая
в гомологии.
молекулахГомологический
углеводородов
водород метильной группой, каждый раз получаем
более сложный углеводород,
отличающийся по
составу от предыдущего на группу СН2. Если
расположить
выведенные
таким
образом
углеводороды в порядке возрастания числа
углеродных атомов, то они образуют следующий ряд:
СН4, С2Н6, С3Н8, С4Н10, С5Н12, С6Н14, С7Н16, С8Н18, С9Н20
и т.д: гомологический ряд метана, или предельных
(насыщенных) углеводородов.
Соотношение атомов водорода и углерода во всех
образующих этот ряд соединениях одинаково и
может быть выражено общей формулой СnH2n+2, где n
– число атомов углерода. Все эти вещества подобно
метану являются предельными, насыщенными
углеводородами.
13
14.
Такой ряд соединений , располож енны хв п о р я д к е в о зр а с та н и я ч и сла угл е р о д н ы х
а то м о в , в к о то р о м
член
ряда
о тли ч а е тся
п р е д ы д ущ е го
со ста в
каж ды й последую щ ий
к а ж д о го
на
по
с о ста в у
гр уп п у
члена
СН
го м о ло ги ч е ск и м
,
причем
ха р а к те р и зуе тся
определенны м
со о тн о ш е н и е м
2
от
п о сто я н н ы м
а то м о в ,
рядом ,
назы ваю т
а
в е щ е с тв а ,
о б р а зую щ и е е го - го м о ло га м и ; гр уп п у С Н
назы ваю т
со ста в а .
го м о ло ги ч е ск о й
2
р а зн о с ть ю
14
15.
Члены гомологического ряда обладают сходнымхимическим строением, для них характерна
некоторая общность физических и химических
свойств и в то же время свойства их постепенно
изменяются
в ряду по мере
изменения
количественного состава.
Открытие гомологии позволило выделить из
огромного
количества
органических
соединений определенные ряды веществ, что
значительно облегчило изучение их свойств.
Развитие
представлений
о
гомологии
позволило предсказать и открыть многие
ранее неизвестные члены гомологических
рядов.
15
16.
Изомерия насыщенных углеводородовИз этана С2Н6 заменой 1 водорода на метильный радикал
может быть выведен пропан – углеводород состава С3Н8,
которому соответствует одновалентный радикал пропил
состава С3Н7:
С Н3—С Н2—С Н3
В пропане не все углеродные атомы одинаковы по своему
положению в молекуле. Каждый из двух атомов углерода,
обозначенных буквой , затратил только по одной валентной
связи на соединение с другим углеродным атомом. Такие
атомы углерода называют первичными углеродными
атомами.
Углеродный атом, обозначенный буквой ,
затратил
на
соединение
с
другими
углеродными атомами две валентные связи и
поэтому называется вторичным углеродным
атомом.
17.
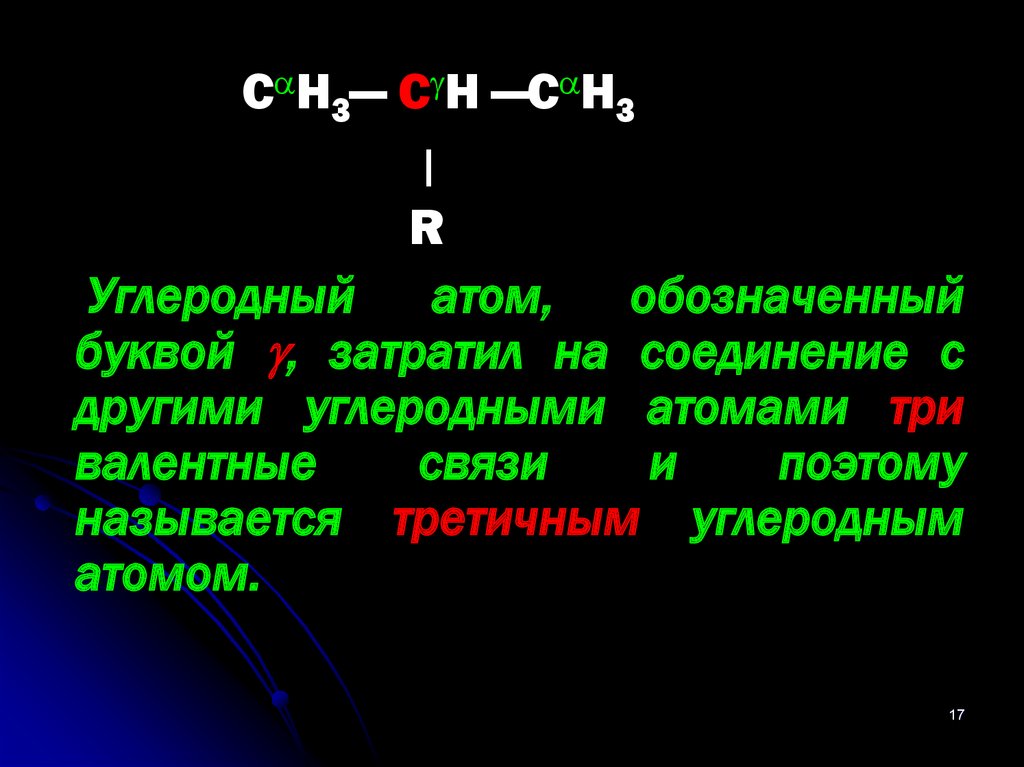
С Н3— С Н —С Н3ן
R
Углеродный атом, обозначенный
буквой , затратил на соединение с
другими углеродными атомами три
валентные
связи
и
поэтому
называется третичным углеродным
атомом.
17
18.
Первичные углеродные атомы входятсостав метильных групп, вторичный –
состав группы СН2 .
в
в
Первичные углеродные атомы в молекуле пропана
равноценны между собой, так как они связаны с одним и
тем же вторичным углеродным атомом. Следовательно,
равноценны и все атомы водорода, связанные с обоими
первичными углеродными атомами, но они отличаются
по положению от атомов водорода, соединенных с
вторичным углеродом.
18
19.
При отнятии атома водорода от молекулы пропана могутобразоваться два остатка состава С3Н7 : один при отнятии
водорода от каждого из первичных углеродных атомов; его
называют первичным пропилом, или просто пропилом;
второй – при отнятии водорода от вторичного углеродного
атома; его называют вторичным пропилом, или
изопропилом:
СН3—СН2—СН2
СН3—СН—СН3
пропил
вторичный пропил (изопропил)
19
20.
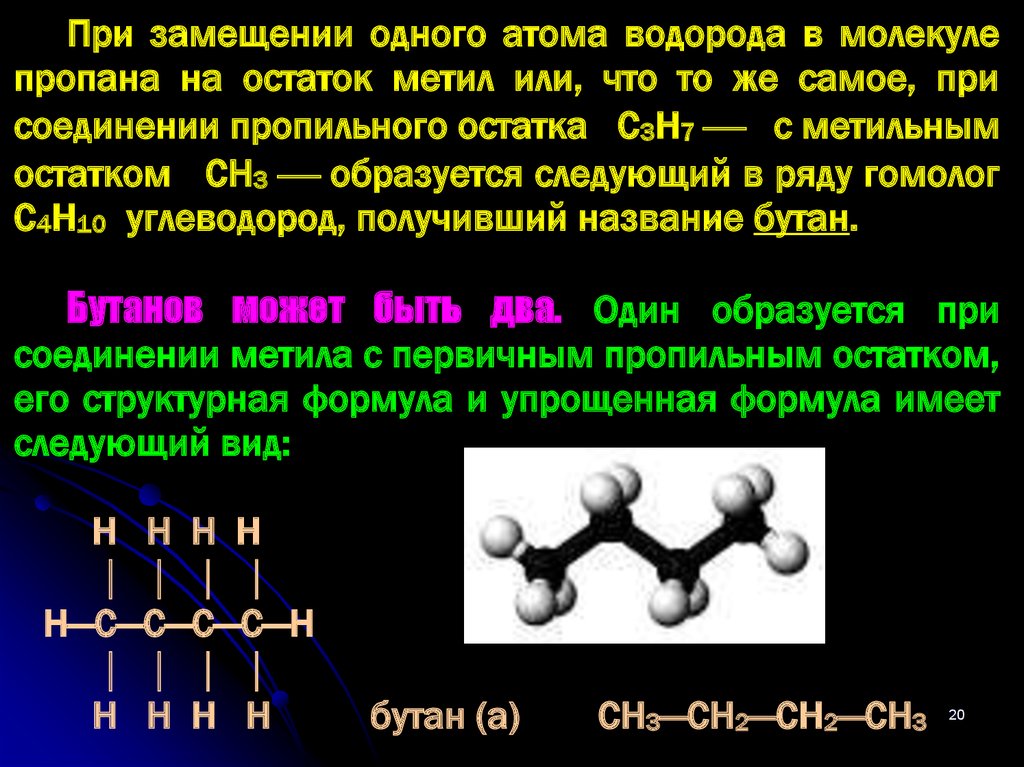
При замещении одного атома водорода в молекулепропана на остаток метил или, что то же самое, при
соединении пропильного остатка С3Н7 с метильным
остатком СН3 образуется следующий в ряду гомолог
С4Н10 углеводород, получивший название бутан.
Бутанов может быть два. Один образуется при
соединении метила с первичным пропильным остатком,
его структурная формула и упрощенная формула имеет
следующий вид:
Н Н Н Н
Н—С—С—С—С—Н
Н Н Н Н
бутан (а)
СН3—СН2—СН2—СН3
20
21.
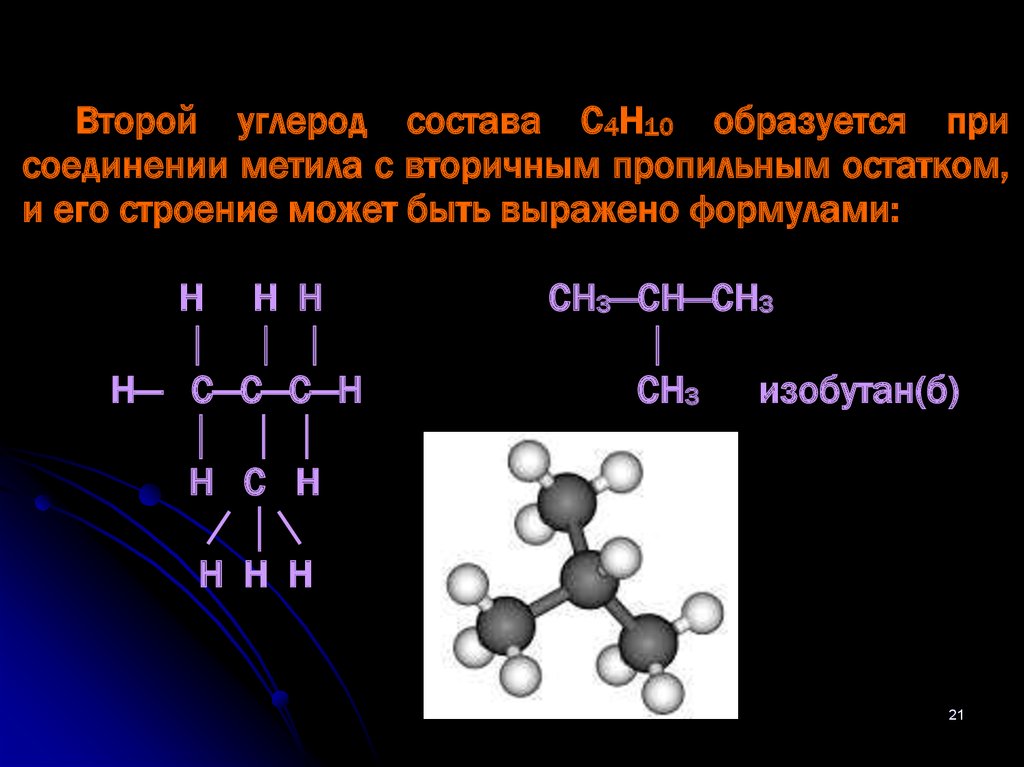
Второй углерод состава С4Н10 образуется присоединении метила с вторичным пропильным остатком,
и его строение может быть выражено формулами:
Н Н Н
Н— С—С—С—H
Н С Н
Н Н Н
СН3—СН—СН3
СН3
изобутан(б)
21
22.
В ещ ества и м ею т од и наковы йчеты ре
атом а
цепь, во
у гл е р о д а
втором
образую т
и м ее тся
а то м о в , а о д и н у гл е р о д
цепь
нер азветвленную
из
трех
у гл е р о д н ы х
(м е т и л ь н а я гр у п п а ) о б р а з у е т
б о к о в о е о т в е т в л е н и е (б о к о в у ю
являю тся
состав, но в од ном
пред ельны м и
ц е п ь ). О б а о е д и н е н и я
у гл е в о д о р о д а м и , а т о м ы
у г-
л ерод а в ни х четы рехв ал ентны , и все и х вал ентны е
связи
насы щ ены .
свой ствам : оба
ленной
цепью
Они
га з ы ,
отли чаю тся
но
кипит
у гл е в о д о р о д
при
р а з в е т в л е н н о й ц е п ь ю – п р и - 1 1 ,7
Вы вед енны е
по
у гл е в о д о р о д ы
- 0 ,5
о
о
С,
ф изическим
с
неразветв-
у гл е в о д о р о д с
С.
отли чаю тся
послед о-
вательны м поряд ком взаи м ной связи атом ов и , сл ед овательно, являю тся и зом ерам и .
22
23.
Изомеры с неразветвленной цепью углеродных атомовназываются нормальными соединениями; в частности,
предельные углеводороды, у которых углеродные атомы
образуют единую цепь, называются нормальными
углеводородами
или
сокращенно
н-углеводородами.
Изомеры с разветвленной цепью углеродных атомов
называются
соединениями
изостроения
или
изосоединениями (в частности, изоуглеводородами). Поэтому
один из углеводородов С4Н10 (а) представляет собой н-бутан
(или просто бутан), а второй (б) – изобутан.
Изомерные насыщенные углеводороды различаются
лишь строением своих углеродных цепей. Поэтому изомерию
насыщенных углеводородов обычно называют изомерией
углеродного скелета или изомерией цепи. В других
классах соединений встречаются иные, более
сложны виды изомерии.
23
24.
Число атомов углерода вмолекуле:
Число изомеров:
1-3
4
5
6
7
8
9
10
11
12
13
1
2
3
5
9
18
35
75
159
355
803
24
25.
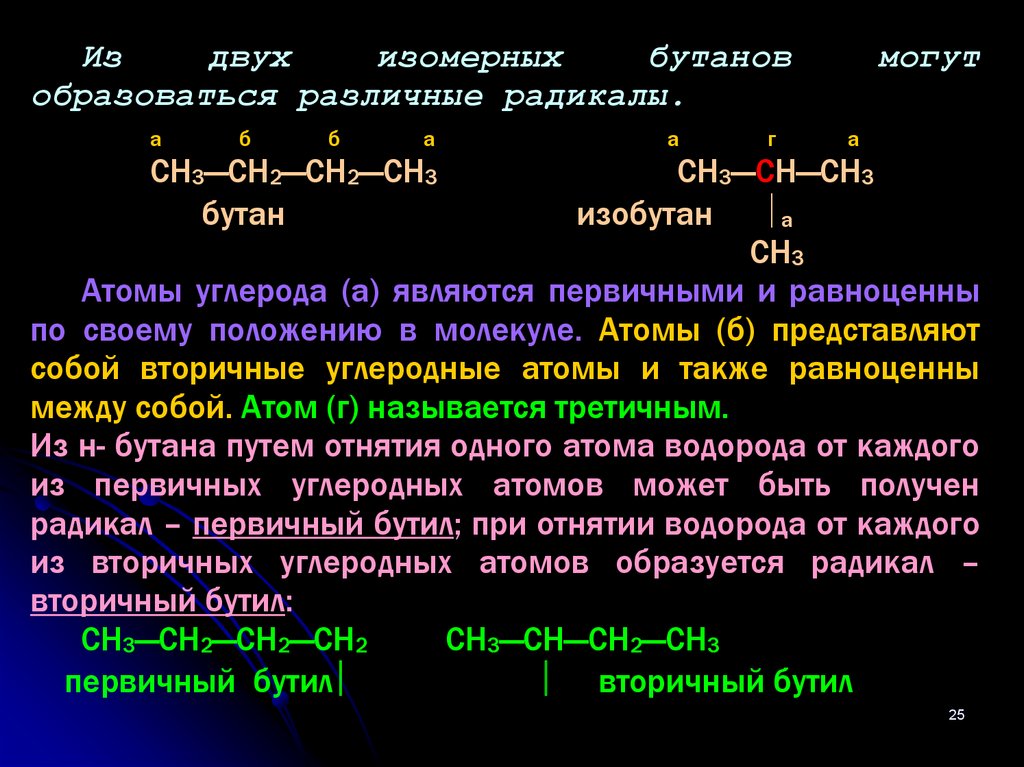
Издвух
изомерных
бутанов
образоваться различные радикалы.
а
б
б
а
а
г
могут
а
СН3—СН2—СН2—СН3
бутан
СН3—СН—СН3
изобутан
а
СН3
Атомы углерода (а) являются первичными и равноценны
по своему положению в молекуле. Атомы (б) представляют
собой вторичные углеродные атомы и также равноценны
между собой. Атом (г) называется третичным.
Из н- бутана путем отнятия одного атома водорода от каждого
из первичных углеродных атомов может быть получен
радикал – первичный бутил; при отнятии водорода от каждого
из вторичных углеродных атомов образуется радикал –
вторичный бутил:
СН3—СН2—СН2—СН2
СН3—СН—СН2—СН3
первичный бутил
вторичный бутил
25
26.
Вмолекуле
изобутана
атом
(г)
–
третичный, т.к. на соединение с другими
углеродными атомами затрачено три его
валентные связи.
Все первичные углеродные атомы равноценны между
собой, поскольку они соединены с одним и тем же третичным
углеродом. Поэтому при отнятии атома водорода от каждого
из первичных углеродов изобутана образуется радикал
первичный изобутил (или просто изобутил), а при отнятии
водорода от третичного углеродного атома – третичный
изобутил:
СН3—СН—СН2—
(а)
СН3—С—CH3 (б)
CH3
CH3
(а)– первичный изобутил, (б) – третичный изобутил.
Таким образом, возможны четыре бутильных остатка
26
состава С4Н9—.
27.
Номенклатура насыщенных углеводородовМ е та н , э та н , п р о п а н , б ута н – э то тр и в и а льн ы е н а зв а н и я
первы х
ч е ты р е х
п р е дста в и те ле й
го м о ло ги ч е ск о го
ряда
угле в о до р о д о в . Д ля н и х ха р а к те р н о о б щ е е р о до в о е н а з в а н и е
– а н . О н о со хр а н я е тся и в н а зв а н и я х в ы сш и х п р е де льн ы х
угле в о д о р о д о в . Угл е в о д о р о д а м р я д а м е та н а д а н о е щ е о б щ е е
наим енование – алканы .
Начиная
с С 5Н
12,
н а зв а н и я п р е де льн ы х угле в о д о р о до в
уж е я в ля ю тся си сте м а ти ч е ск и м и , и х о б р а зую т и з гр е ч е ск о го
ч и сли те льн о го ,
к о то р ы м
обозначаю т
чи сло
угле р о дн ы х
а то м о в в да н н о й м о ле к уле , и и з р о до в о го о к о н ч а н и я – а н .
Так
угле в о до р о д
со ста в а С 6Н
14
со ста в а
С 5Н
12
н а зы в а е тся
п е н та н о м ,
– г е к с а н о м и т .д .
27
28.
Б олееслож ен
и зо стр о е н и я .
два,
Пентанов
гексанов
т.д.,
атомов
причем
в
вопрос
о
н о м е н к ла тур е
изостроения
–
четыре,
с
возрастанием
молекуле
число
гептанов
угле в о до р о до в
существует
–
числа
восемь,
и
углеродных
изоуглеводоров
резко
повышается.
Н аиболее
удобна
и
р а сп р о стр а н е н а
м еж дуна родн ая
за м е сти те льн а я н о м е н к ла тур а , п р и н я та я п р а в и ла м и И Ю П А К
(IU P A C ).
П р о сты е угле в о до р о ды и зо стр о е н и я н а зы в а ю т и п о с та р о й
р а ц и о н а льн о й н о м е н к ла тур е , хо тя п о н е й н е в о зм о ж н о то ч н о
н а зы в а ть сло ж н ы е угле в о до р о ды .
28
29.
Международная заместительнаяПо заместительной
номенклатуреноменклатура
углеводороды
изостроения рассматриваются как производные
нормальных углеводородов, в цепи которых атомы
водорода замещены простыми углеводородными
радикалами, образующими боковые цепи.
В формуле предельного углеводорода,
который требуется назвать, выбирают основу,
т.е.
самую
длинную
(главную)
цепь
углеродных атомов. Затем эти атомы
последовательно нумеруют, начиная с того конца
главной цепи, к которому ближе боковое
ответвление.
29
30.
Вназвании
номера
углеродных
находятся
этих
соединения
боковые
атомов,
радикалы,
радикалов
нормального
цифрами
и,
указывают
при
которых
затем
названия
наконец,
углеводорода,
c
название
самой
длинной
цепи.
Гексан ы
(1)
и
(2 )
по
зам ести тел ьн ой
н ом ен кл атуре
н азы ваю т:
1
2
3
4
5
С Н 3— С Н — С Н 2— С Н 2— С Н 3
СН3
1
2
3
4
5
С Н 3— С Н 2— С Н — С Н 2— С Н 3
(1)
2 -м е т и л п е н т а н
СН3
(2 )
3 -м е т и л п е н т а н
30
31.
Еслив
ковых
пишут
углеводороде
радикалов,
номера
которых
всех
названии
углеродных
одинаковые
прописью
тем
в
указывают
уже
их
несколько
(через
атомов
радикалы
число
одинаковых
запятые)
цепи,
находятся,
этих
бо-
радикалов,
при
потом
а
за-
название.
Т а к , г е к с а н ы (3 ) и (4 ) н а з ы в а ю т :
1
2
3
С Н 3— С Н — С Н — С Н
СН
СН
4
3
3
СН
(3 )
1
3
2
3
4
С Н 3— С — С Н 2— С Н
3
2 ,3 -д и м е т и л б у т а н
3
(4 )
СН
3
2 ,2 -д и м е т и л б у т а н
31
32.
Самую длинную углеродную цепь выбирают инумеруют так, чтобы вне ее остались наиболее
простые остатки, а цифры в названии, указывающие
положение остатки, были бы наименьшими. Если
на равных расстояниях от концов цепи
имеется с одной стороны один, а с
другой два таких же боковых остатка,
нумерацию начинают со стороны двух
остатков
(со
стороны
наибольшего
разветвления
цепи).
Если
в
равных
положениях от концов цепи находятся различные по
сложности боковые остатки, начало нумерации ведут
со стороны простейшего.
32
33.
Вобщ ем
полож ение,
п о то м
названии
число
и
угле в о д о р о д а
наим енование
следую щ ие по
вначале
указы ваю т
п р о с те й ш и х
о с та тк о в ,
с л о ж н о с т и , т .е . с н а ч а л а м е т и л ь н ы х ,
з а т е м э т и л ь н ы х , п р о п и л ь н ы х , б у т и л ь н ы х и т .п .
О дин
и з д е к а н о в (С
10Н 22)
и зо стр о е н и я :
СН
5
4
3
3
С Н 3— С Н — С Н — С Н 2— С Н
3
2
C H 3— C — C H
3
1
2 ,2 ,4 -т р и м е т и л -3 -э т и л п е н т а н
CH
3
33
34.
В сложном разветвленном остатке, не имеющемустановленных тривиальных названий, тоже выбирают и
нумеруют самую длинную цепь и дают ей название
соответствующего нормального остатка; при этом
началом цепи и обозначенным цифрой 1 должен быть
углерод, тот, который связан с главной цепью сложного
углеводорода.
Например, для остатков С5Н11 –
1
2
3
4
—СН—СН2—СН2—СН3
СН3
1-метилбутил
1
2
3
—СН—СН2—СН3
СН2—СН3
1-этилпропил
1
2
3
—СН—СН—СН3
СН3 СН3
1,2-диметилпропил
34
35.
В общем названии сложного углеводорода названиетаких остатков заключается в скобки; перед скобкой
ставят цифру, обозначающую положение этого остатка в
главной цепи. Например:
СН3
СН2—СН3
1
2
3
4
5
6 7
8
9 10
СН3—СН—СН2—СН2—СН—СН—СН—СН2—СН2—СН3
СН3—СН—СН2 СН—СН—СН3
СН3
СН3 СН3
2-метил- 7-этил- 5-изобутил- 6-(1,2-диметилпропил) декан.
35
36.
По рациональнойноменклатуре
соединения рассматривают
Рациональная
номенклатура
как производные простейшего члена данного гомологического
ряда; в
частности,
насыщенные
углеводороды
рассматриваются
как
производные
метана,
водородные
атомы
которого
заменены
углеводородными остатками (число последних,
естественно, не может быть
больше четырех). В
формуле соединения, которое требуется назвать, за основу
берут какой-нибудь углеродный атом (обычно тот, вокруг
которого сгруппировано наибольшее число наиболее простых
остатков), принимая его за углерод молекулы метана.
Название составляют из наименований соединенных с этим
углеродным атомом остатков (радикалов), а в конце ставят
слово метан. При этом количество одинаковых радикалов
обозначают с помощью греческих числительных.
36
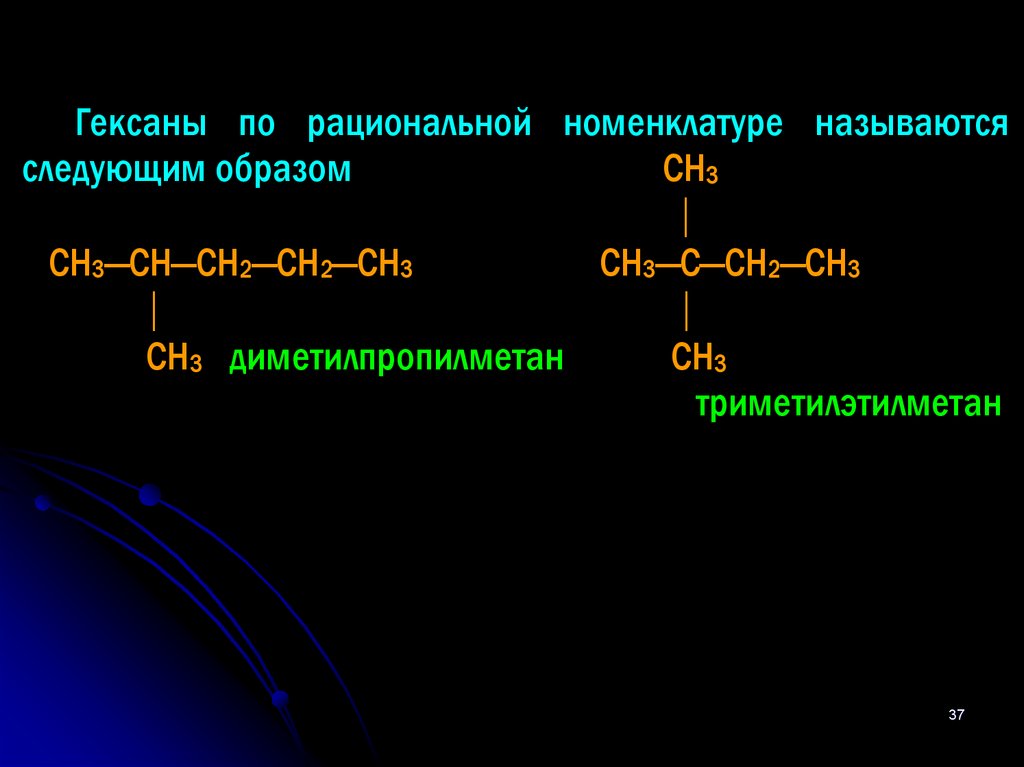
37.
Гексаны по рациональной номенклатуре называютсяследующим образом
СН3
СН3—СН—СН2—СН2—СН3
СН3—С—СН2—СН3
СН3 диметилпропилметан
СН3
триметилэтилметан
37
38.
Насыщенныеуглеводороды
–
бесФизические свойства насыщеных углеводородов
цветные вещества, практически не
растворимые в воде, с плотностью
меньше 1. В зависимости от состава
они представляют собой газообразные, жидкие или твердые вещества.
При этом температура кипения, температура плавления и плотность отдельных членов в гомологических рядах повышается по мере возрастания
числа углеродных атомов в молекулах.
38
39.
Температуры кипения и плавления углеводородовзависят и от их строения. Нормальные углеводороды
кипят выше, чем углеводороды изостроения. С другой
стороны, самую высокую температуру плавления имеет
тот изомер, цепь которого наиболее разветвлена
Пентан
2-метил
Бутан
(изопен
тан)
2,2диметил
- пропан
(неопен
тан)
С5Н12
С5Н12
С5Н12
СН3—СН2—СН2—СН2—СН3
Ткип., оС
Тпл., оС
36,07
-129,8
27,9
-159,9
9,5
-16,6
СН3—СН—СН2—СН3
СН3
СН3
СН3—С—СН3
СН3
39
40.
Метан, этан, пропан и бутан при обычных условияхпредставляют собой газы; они почти не имеют
запаха.
Запах бытовому газу придают
меркаптаны (R-SH)
Пентан и следующие за ним углеводороды (вплоть до
С16Н14) – жидкости с характерным "бензиновым"
запахом и различной, постепенно снижающейся
летучестью.
Высшие насыщенные углеводороды – твердые
нелетучие вещества, не имеющие запаха.
40
41.
Низшиеалканы
обладают
сильнейшим
наркотическим действием, увеличивающимся
с длиной цепи. Гексан и его изомеры
вызывают острые отравления при вдыхании
паров клея, где являются растворителями.
Гептан и нонан - яды наркозного действия.
Высшие алканы могут вызывать раздражение
кожи.
Пожарная опасность алканов уменьшается с
ростом цепи и, соответственно, летучести
паров.
Газообразные алканы с воздухом образуют
взрывоопасные смеси.
41
































 Химия
Химия








