Похожие презентации:
Насыщенные (предельные) углеводороды. Алканы (парафины)
1.
Насыщенные (предельные) углеводородыАлканы (парафины)
2.
Алканами или предельными углеводородаминазываются соединения, в молекулах которых каждый
углеродный атом затрачивает на соединение с
соседним углеродом одну валентность, остальные
валентности насыщены атомами водорода, поэтому
данный класс соединений называется насыщенным
или предельным.
СnH2n+2 – общая формула
3.
Реакции определения качественного составапредельных углеводородов
t
1. С18Н38
+ 55CuO
парафин
= 18 CO2 + 19H2O + 55 Cu
2. CuSO4 +
5H2O
3. Ca(OH)2
+ CO2 =
безводный
сульфат меди
(белого цвета)
= CuSO4
5H2O
медный купорос
(синего цвета)
CaCO3
+ H2O
Предельные углеводороды состоят из
углерода С и водорода Н
4.
5.
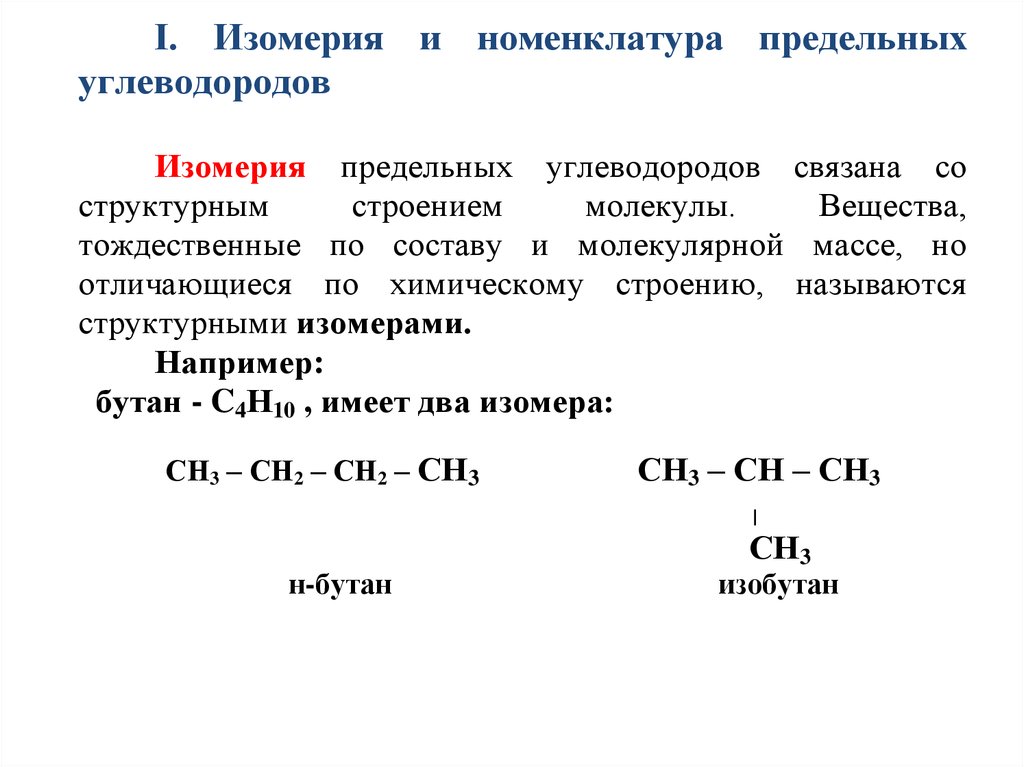
Ι. Изомерия и номенклатура предельныхуглеводородов
Изомерия предельных углеводородов связана со
структурным
строением
молекулы.
Вещества,
тождественные по составу и молекулярной массе, но
отличающиеся по химическому строению, называются
структурными изомерами.
Например:
бутан - C4Н10 , имеет два изомера:
СН3 – СН2 – СН2 – СН3
СН3 – СН – СН3
|
н-бутан
СН3
изобутан
6.
Существует 3 основных вида номенклатур:1. Эмпирическая (тривиальная) номенклатура – это
историческое название соединений.
2. Рациональная номенклатура. По рациональной
номенклатуре за основу принимается родоначальник
гомологического ряда, а все соединения этого ряда
рассматриваются как его замещенные.
3. Систематическая международная номенклатура
ΙUРАС – международный союз чистой и прикладной
химии.
7.
Первые члены гомологического ряда имеют тривиальныеназвания
H
|
H–C–H
|
H
СH3 – CH3
СН3 – СН2 – СН3
CH4 - метан
С2Н6 – этан
С3Н8 – пропан
СН3 – СН2 – СН2 – СН3 С4Н10 – бутан
Далее названия образуются из греческих и латинских
числительных добавлением суффикса – ан:
С5Н12 – пентан, С6Н14 – гексан , С7Н16 – гептан, С8Н18 - октан, С9Н20 нонан, С10Н22 – декан и т.д.
8.
Рациональная номенклатура учитывает строениеназываемого соединения. За основу принимается
первый
член
гомологического
ряда
(метан)
и
соединение рассматривается как производное метана
с
последовательным
радикалов
(от
перечислением
простого
к
сложному
введённых
или
по
алфавиту). Для этого необходимо знать названия
радикалов – алкилов
9.
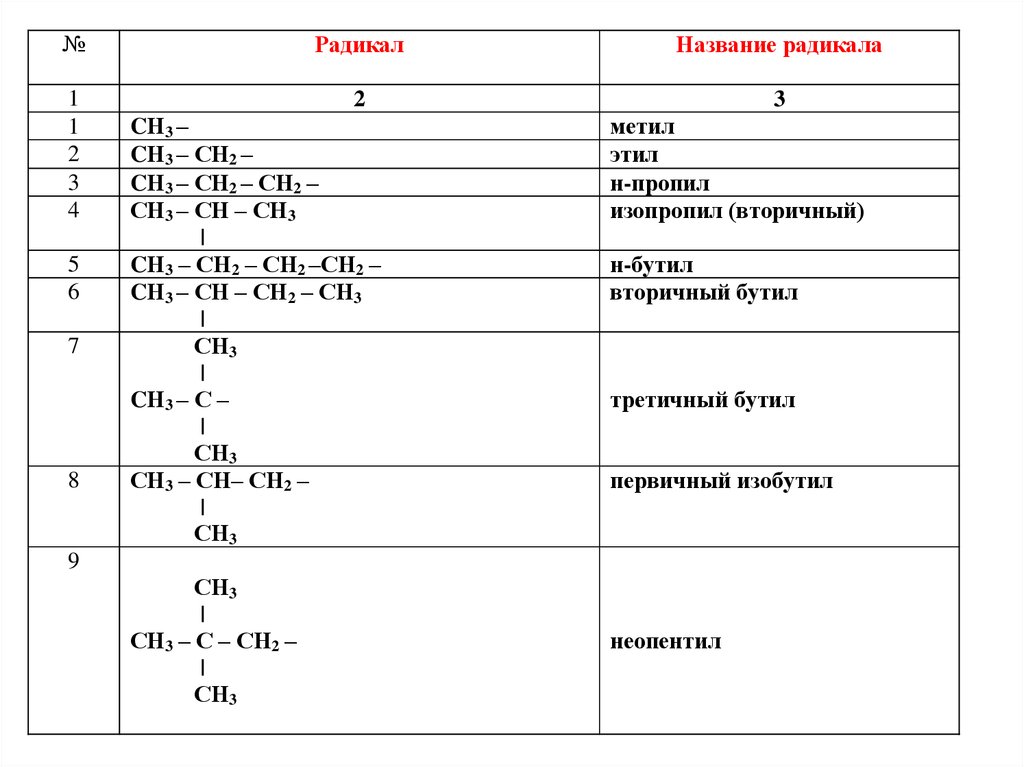
№Радикал
Название радикала
1
1
2
3
4
2
3
5
6
7
8
CН3 –
CН3 – СН2 –
CН3 – СН2 – СН2 –
СН3 – СН – СН3
|
CН3 – СН2 – СН2 –СН2 –
CН3 – СН – СН2 – СН3
|
СН3
|
CН3 – С –
|
СН3
СН3 – СН– СН2 –
|
СН3
метил
этил
н-пропил
изопропил (вторичный)
н-бутил
вторичный бутил
третичный бутил
первичный изобутил
9
СН3
|
СН3 – С – СН2 –
|
СН3
неопентил
10.
Если свободная валентность в радикалепринадлежит атому углерода, имеющему только
одну непосредственную связь с углеродными
атомами, то радикал называется первичным. При
наличии двух таких связей радикал называется
вторичным, трёх – третичным.
11.
Например:1) CН3 – СН – СН3
|
СН3
а) изобутан (эмпирическая номенклатура);
б) триметилметан (рациональная номенклатура).
2) CН3 – СН – СН2 – СН3
|
CН3
а) изопентан (эмпирическая номенклатура);
б) диметилэтилметан (рациональная номенклатура).
12.
Систематическая номенклатура IUPACПравила наименования по номенклатуре IUPAC следующие:
1. В качестве основы выбирается самая длинная цепь атомов
углерода, и
считается, что соединение образуется из этой
структуры при замене атомов водорода на различные алкильные
группы.
2.Основную углеродную цепь нумеруют арабскими цифрами
так, чтобы цифры, указывающие положение боковых цепей, были
наименьшими.
3. Если одна и та же алкильная группа встречается более
одного раза, то перед ней ставят приставку ди-, три-, тетра- и т.д.,
чтобы указать число этих групп, и обозначают арабскими цифрами
(локантами) положение каждой группы.
4.При наличии нескольких различных алкильных групп их
перечисляют либо в порядке увеличения сложности, либо в
алфавитном порядке.
13.
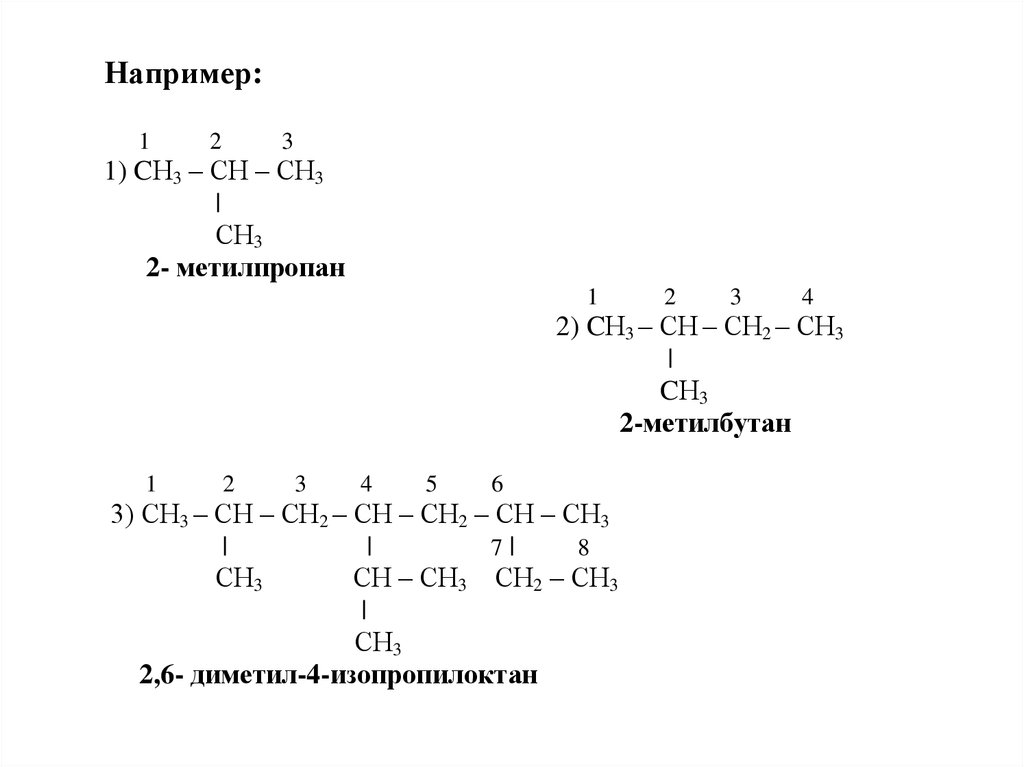
Например:1
2
3
1) CН3 – СН – СН3
|
СН3
2- метилпропан
1
2
3
4
2) CН3 – СН – СН2 – СН3
|
CН3
2-метилбутан
1
2
3
4
5
6
3) СН3 – СН – СН2 – СН – СН2 – СН – СН3
|
|
7|
8
СН3
СН – СН3 СН2 – СН3
|
СН3
2,6- диметил-4-изопропилоктан
14.
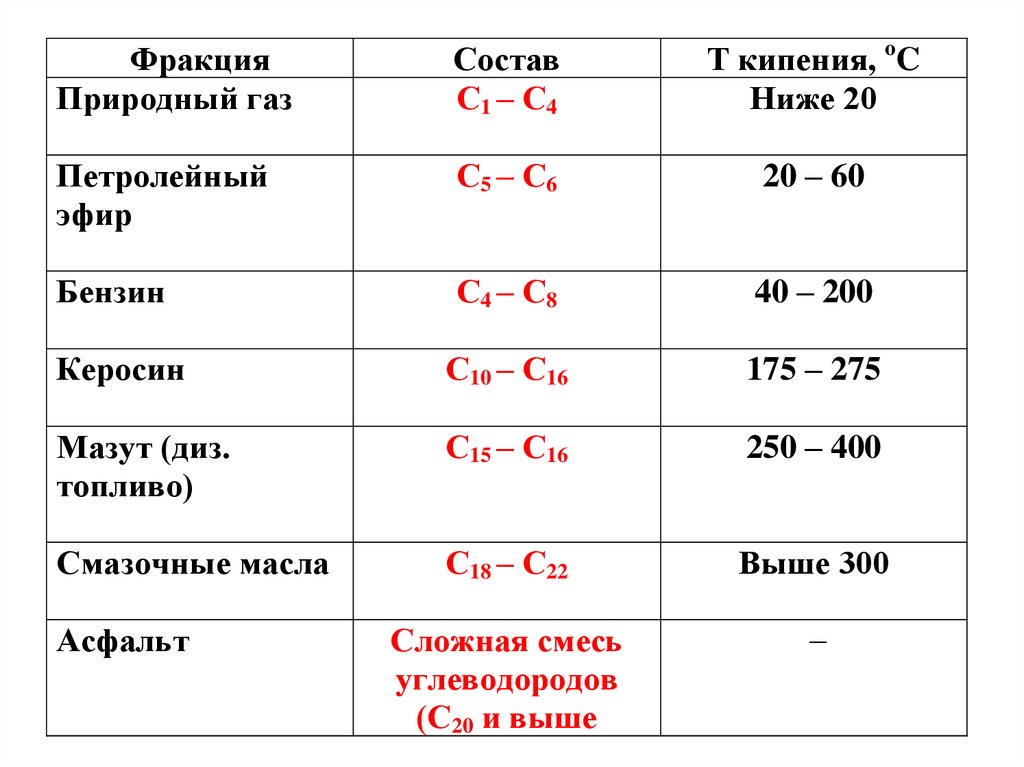
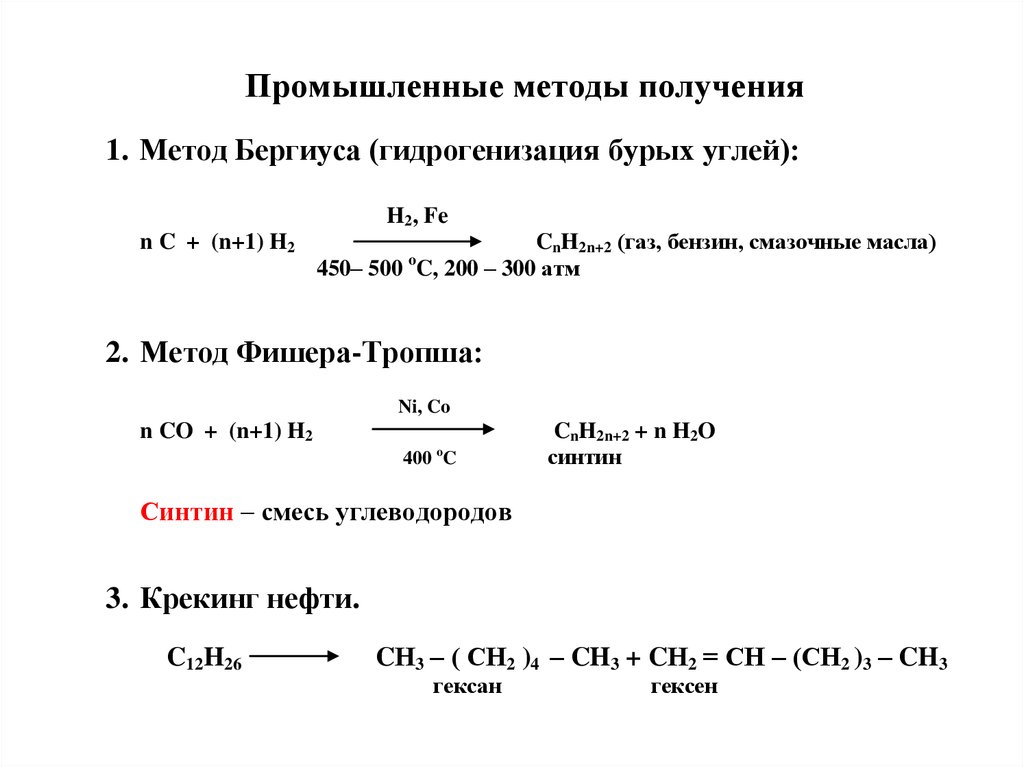
ΙΙ. Способы получения алканов15.
Природными источниками алканов являютсянефть и природный газ.
Природный газ на 75 – 85% состоит из метана.
Перегонка нефти позволяет получить смеси
насыщенных углеводородов с различной длиной
цепи:
16.
ФракцияПриродный газ
Состав
С1 – С4
Т кипения, oC
Ниже 20
Петролейный
эфир
С5 – С6
20 – 60
Бензин
С4 – С8
40 – 200
Керосин
С10 – С16
175 – 275
Мазут (диз.
топливо)
С15 – С16
250 – 400
Смазочные масла
С18 – С22
Выше 300
Сложная смесь
углеводородов
(С20 и выше
–
Асфальт
17.
Промышленные методы получения1. Метод Бергиуса (гидрогенизация бурых углей):
H2, Fe
n C + (n+1) H2
CnH2n+2 (газ, бензин, смазочные масла)
450– 500 C, 200 – 300 атм
o
2. Метод Фишера-Тропша:
Ni, Co
n CO + (n+1) H2
o
400 C
CnH2n+2 + n H2O
синтин
Синтин – смесь углеводородов
3. Крекинг нефти.
C12H26
CН3 – ( СН2 )4 – CH3 + CН2 = СН – (СН2 )3 – CH3
гексан
гексен
18.
Лабораторные методы получения1. Реакция Вюрца – это взаимодействие галогенозамещённых
алканов со щелочными металлами (K, Na, Li):
2 R – X + 2 Na
R – R + 2 NaX
где Х =Нal, а R – алкильный радикал
Пример:
2 CH3 – CH2 – CH2 – Cl + 2Na
хлористый пропил
2 СH3 – Br + 2 Na
бромистый метил
CH3 – CH2 – CH2 – CH2 – CH2 – CH3 + 2 NaCl
гексан
CH3 – CH3 + 2 NaBr
этан
19.
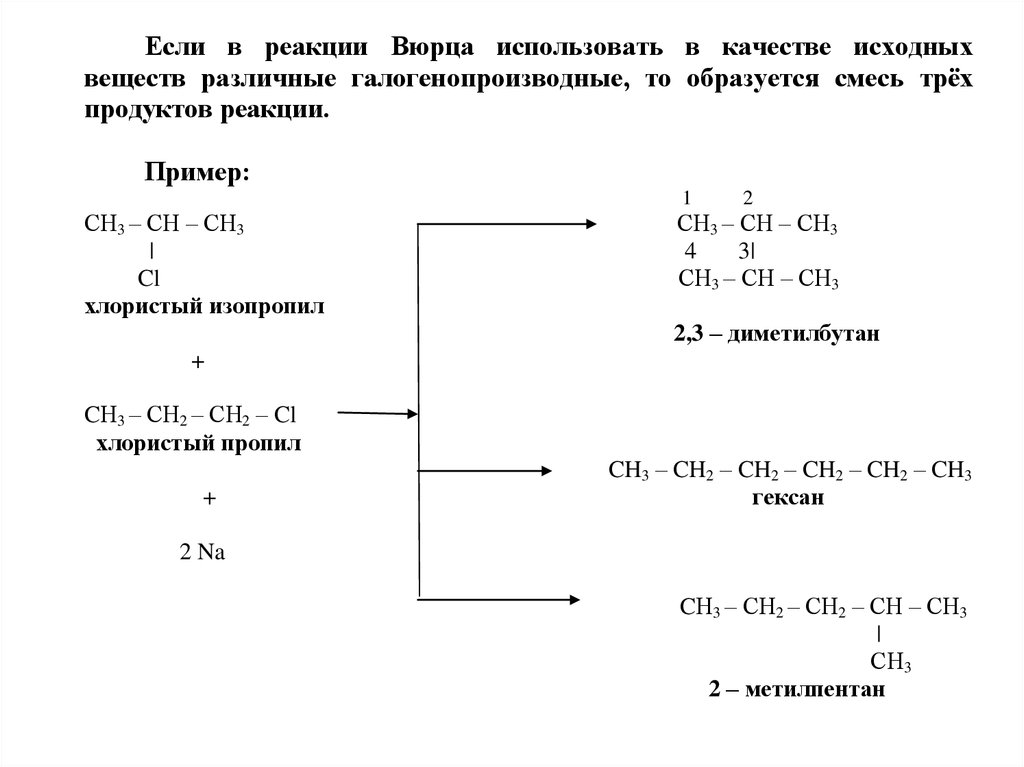
Если в реакции Вюрца использовать в качестве исходныхвеществ различные галогенопроизводные, то образуется смесь трёх
продуктов реакции.
Пример:
1
СН3 – СН – СН3
|
Cl
хлористый изопропил
2
СН3 – СН – СН3
4
3|
СН3 – СН – СН3
2,3 – диметилбутан
+
CН3 – СН2 – СН2 – Cl
хлористый пропил
+
CH3 – CH2 – CH2 – CH2 – CH2 – CH3
гексан
2 Na
CН3 – СН2 – СН2 – СН – СН3
|
СН3
2 – метилпентан
20.
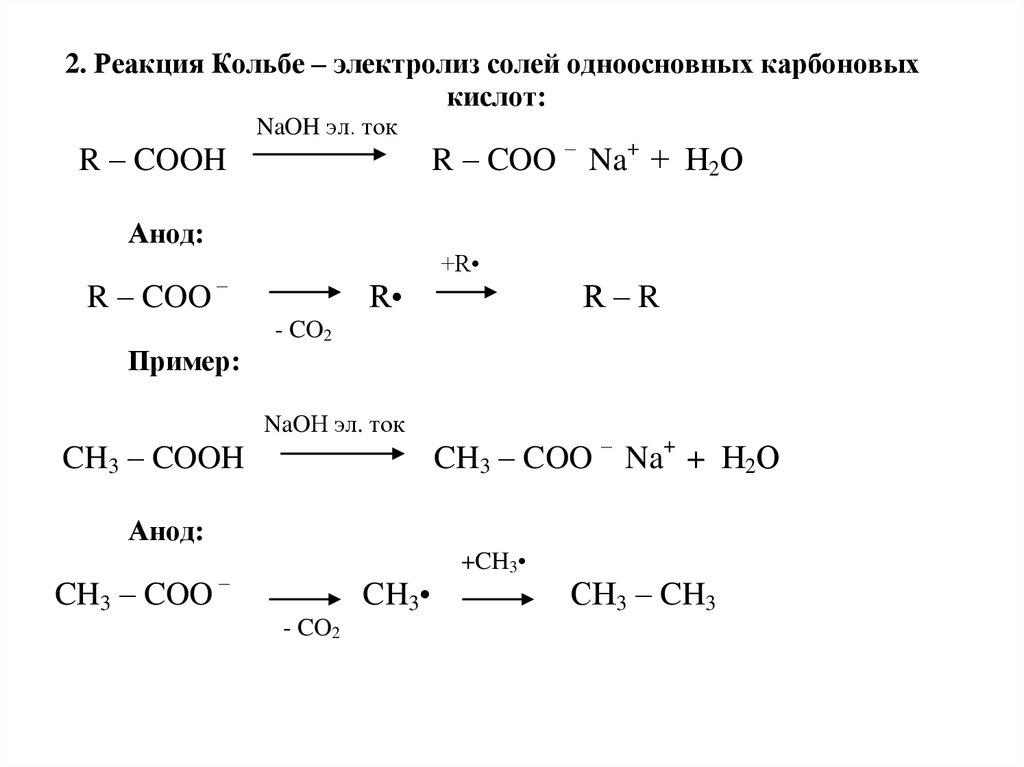
2 2. Реакция Кольбе – электролиз солей одноосновных карбоновыхкислот:
NaOH эл. ток
R – COOH
R – COO – Na+ + Н2О
Анод:
+R
R – COO –
R
R–R
- CO2
Пример:
NaOН эл. ток
CH3 – COOH
CH3 – COO – Na+ + Н2О
Анод:
CH3 – COO –
CH3
- CO2
+CH3
CH3 – CH3
21.
3. Декарбоксилирование солей карбоновых кислот:300 – 400ОС
R – COONa + NaOH
R – H + Na2CO3
Пример:
300 – 400ОС
CH3 – СН2 – СН2 – COONa + NaOH
бутират натрия
CH3 – СН2 – СН3 + Na2CO3
Ca(OH)2
СН3 – С = О
+
NaOH
CH4
+ Na2CO3
ONa
ацетат натрия
метан
NaOH + Ca(OH)2 - натронная известь
22.
23.
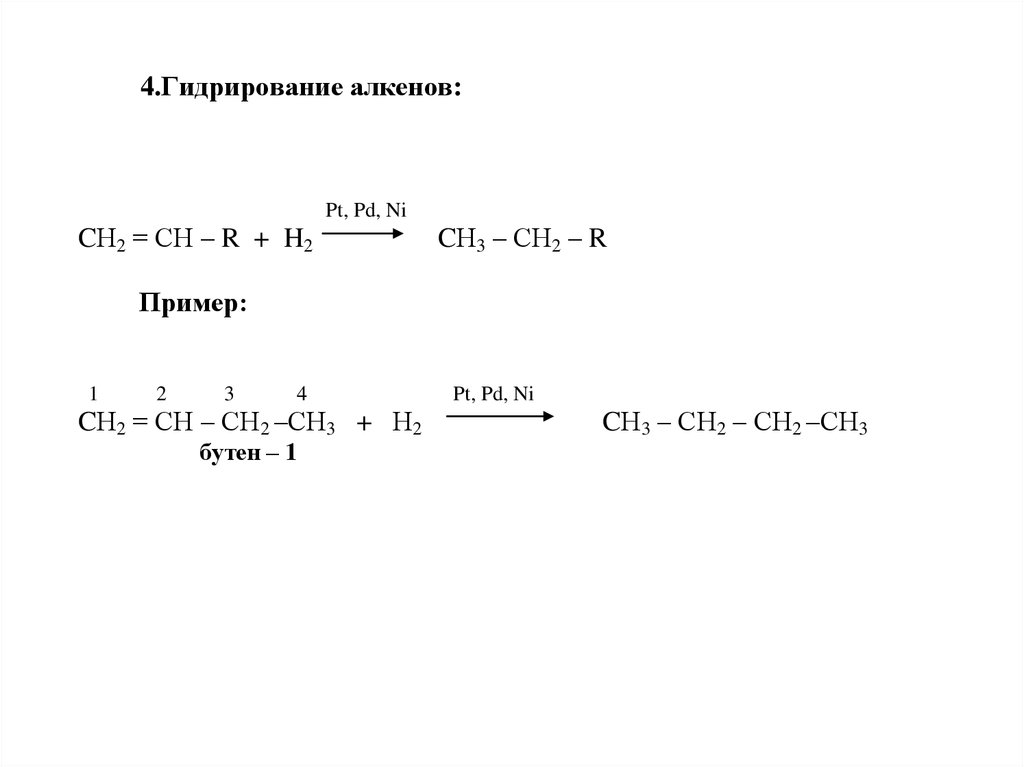
4.Гидрирование алкенов:Pt, Pd, Ni
CН2 = СН – R + H2
CН3 – СН2 – R
Пример:
1
2
3
4
CН2 = СН – СН2 –СН3 + Н2
бутен – 1
Pt, Pd, Ni
CН3 – СН2 – СН2 –СН3
24.
5. Восстановление галоидных алкилов:[H]
R – Br
R–H
+ HBr
Пример:
[H]
CH3 – СН2 – СН2 – Br
CH3 – СН2 – СН3 + HBr
бромистый пропил
6. Разложение реактива
подвижный атом водорода:
Гриньяра
эфир
R – Br + Mg
R – MgBr
соединениями,
H2O
R–H
+
содержащими
MgOHBr
Пример:
эфир
CH3 – СН2 – Br + Mg
CH3 – СН2 – MgBr
H2O
бромистый этил магний
CH3 – СН3 + MgOHBr
25.
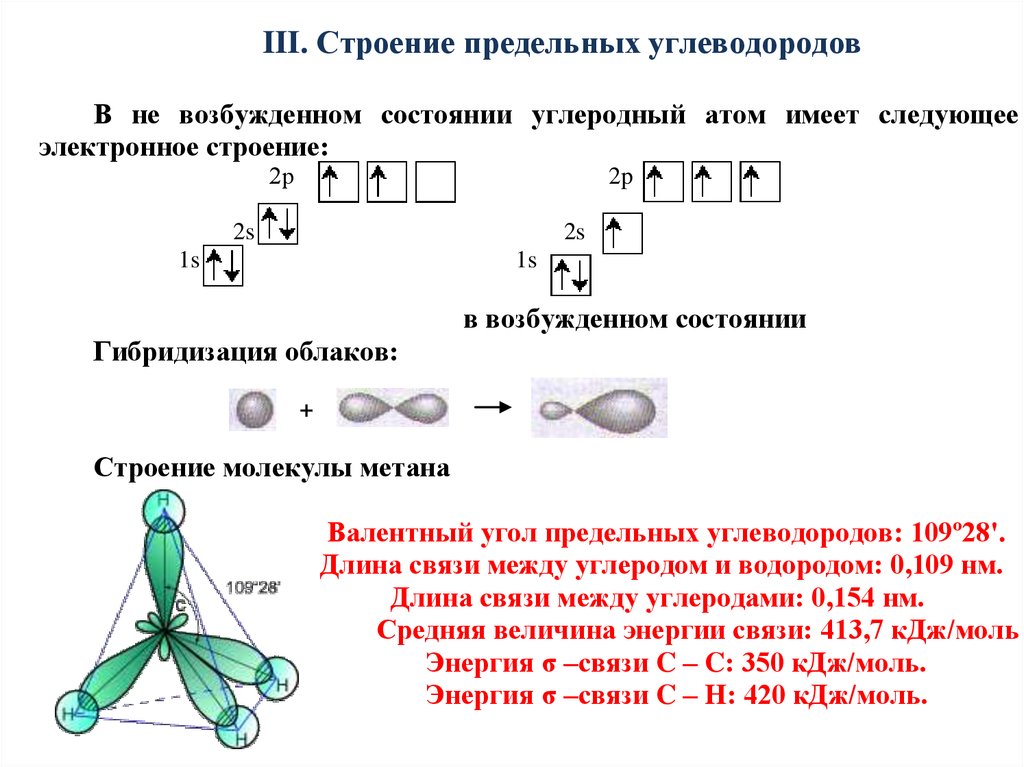
III. Строение предельных углеводородовВ не возбужденном состоянии углеродный атом имеет следующее
электронное строение:
2р
2p
2s
2s
1s
1s
в возбужденном состоянии
Гибридизация облаков:
+
Строение молекулы метана
Валентный угол предельных углеводородов: 109º28'.
Длина связи между углеродом и водородом: 0,109 нм.
Длина связи между углеродами: 0,154 нм.
Средняя величина энергии связи: 413,7 кДж/моль.
Энергия σ –связи C – C: 350 кДж/моль.
Энергия σ –связи C – H: 420 кДж/моль.
26.
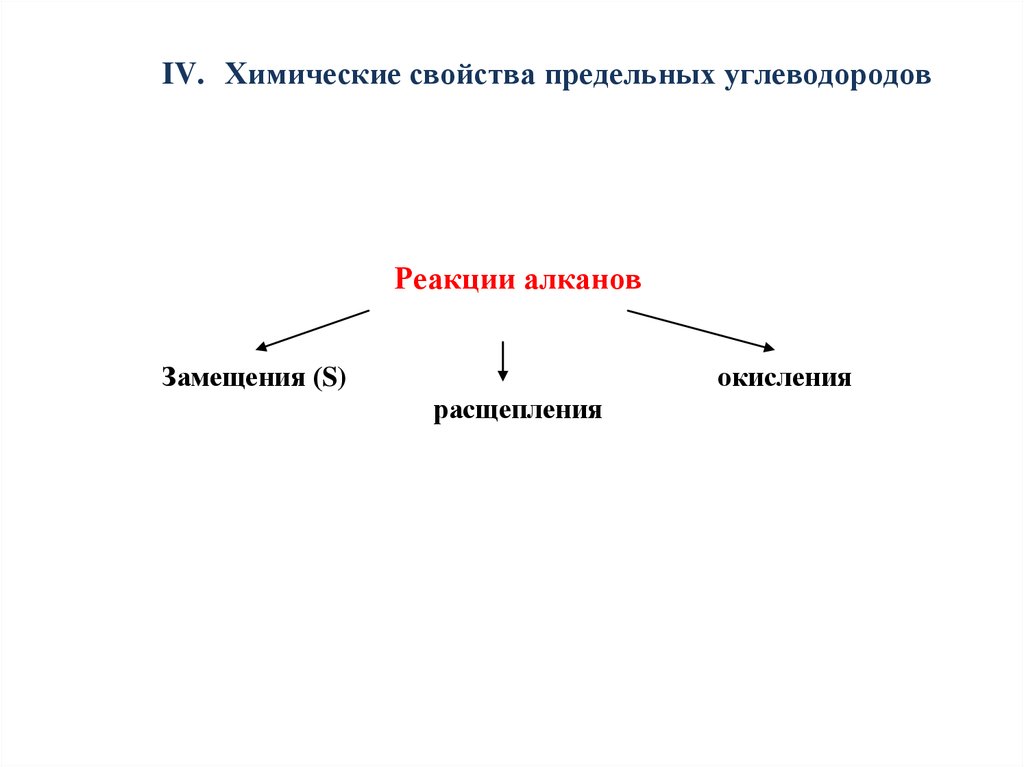
IV. Химические свойства предельных углеводородовРеакции алканов
Замещения (S)
окисления
расщепления
27.
1. Реакции замещенияК реакциям замещения относятся реакции
нитрования, сульфогалогенирования, сульфоокисления.
галогенирования,
1) Галогенирование – реакция замещения атома водорода на галоген .
Основным условием протекания реакции является УФ – излучение
или температура (250о – 400оС) (инициирование).
По реакционной способности галогены располагаются в следующем порядке:
Сl2 > Br2 > I2
CH4 + Cl2
CH3Cl + HCl
Механизм реакции галогенирования:
Стадия 1 – зарождение цепи (инициирование):
Cl2
2 Cl
Стадия 2 – рост цепи:
СН 4 + Cl
CH3• + НCl
CH3• + Cl2
CH3Cl + Cl
Стадия 3 - обрыв цепи:
Cl• + Cl
Cl2
CH3• + Cl
CH3Cl
CH3• + CH3
CH3 – CH3
28.
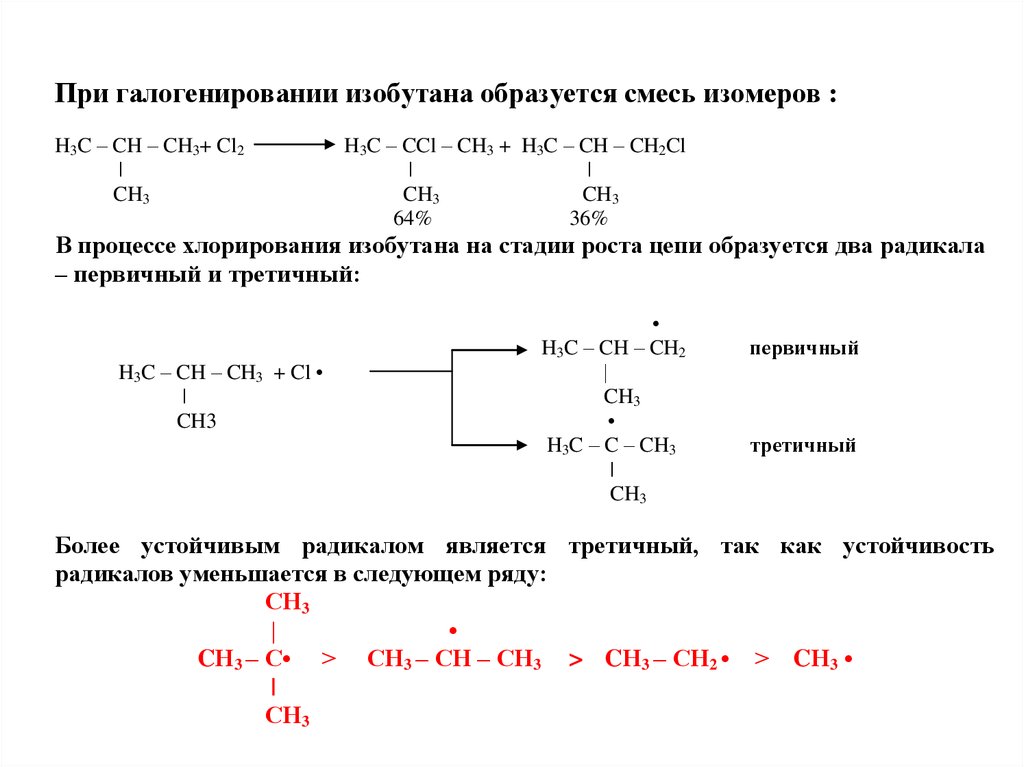
При галогенировании изобутана образуется смесь изомеров :H3C – CH – CH3+ Cl2
|
CH3
H3C – CCl – CH3 + H3C – CH – CH2Cl
|
|
CH3
CH3
64%
36%
В процессе хлорирования изобутана на стадии роста цепи образуется два радикала
– первичный и третичный:
H3C – CH – CH3 + Cl
|
CH3
H3C – CH – CH2
|
CH3
H3C – C – CH3
|
CH3
первичный
третичный
Более устойчивым радикалом является третичный, так как устойчивость
радикалов уменьшается в следующем ряду:
СН3
|
CН3 – С• > СН3 – СН – СН3 > CН3 – СН2 • > CН3
|
СН3
29.
2)Сульфирование
Предельные углеводороды при нормальной
температуре с кислотами не реагируют. Если нагреть
предельные углеводороды с H2SO4 (конц), произойдет
окисление. Поэтому сульфокислоты из предельных
углеводородов можно получить при помощи реакции
сульфохлорирования.
30.
3) СульфохлорированиеЗамещение водорода у третичного углеродного атома не
происходит (объем сульфогруппы больше, чем объём галогена).
Замещение происходит легче у вторичного углеродного атома, а
затем у первичного.
O
||
R – S – Cl + HCl
||
O
R – H + SO2 + Cl2
алкансульфохлорид
4
H3C – CH – CH2 – СН3 + SO2 + Cl2
|
CH3
3
2
1
H3C – CН – CH – СН3 + HCl
|
|
CH3 SO2Cl
3-метилбутансульфохлорид-2
31.
Механизм реакции:а)
Cl2
2Cl
б) R – H + Cl
в)
R• + HCl
R • + SO2
O
||
г) R – S
||
O
+
Cl2
O
||
R – S
||
O
O
||
R – S – Cl + Cl
||
O
32.
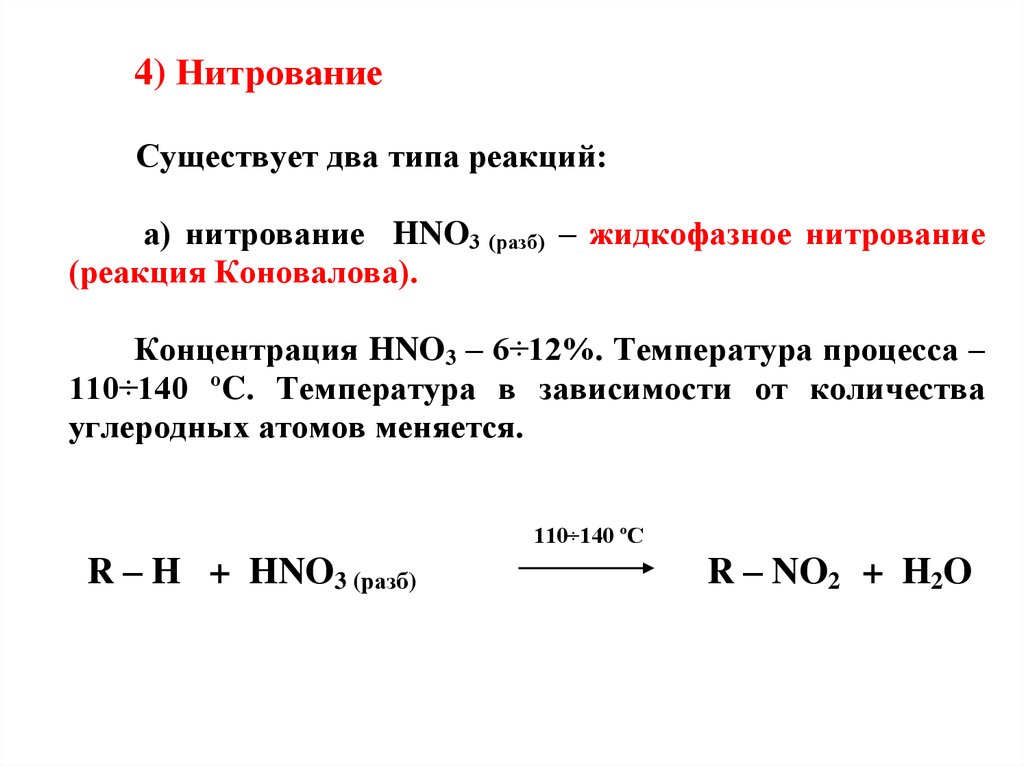
4) НитрованиеСуществует два типа реакций:
а) нитрование HNO3 (разб) – жидкофазное нитрование
(реакция Коновалова).
Концентрация HNO3 – 6÷12%. Температура процесса –
110÷140 ºC. Температура в зависимости от количества
углеродных атомов меняется.
110÷140 ºC
R – H + HNO3 (разб)
R – NO2 + H2O
33.
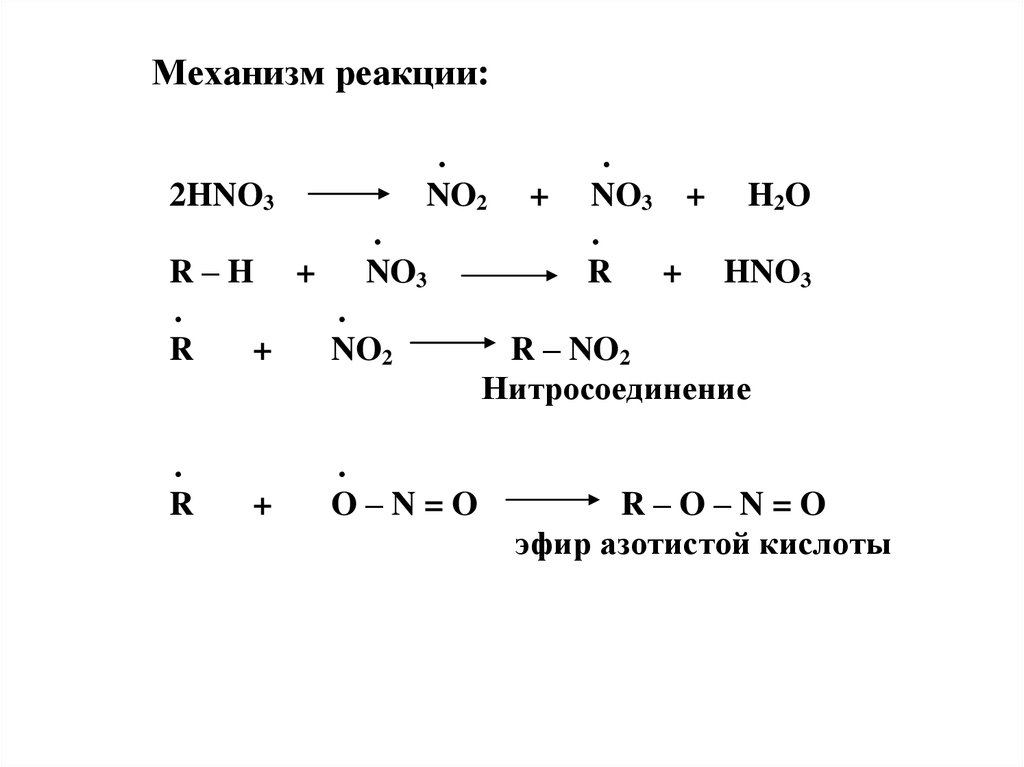
Механизм реакции:2HNO3
R–H
R
R
NO2
+
NO3
+
NO2
+
O–N=O
+
NO3
+
H 2O
R
+
HNO3
R – NO2
Нитросоединение
R–O–N=O
эфир азотистой кислоты
34.
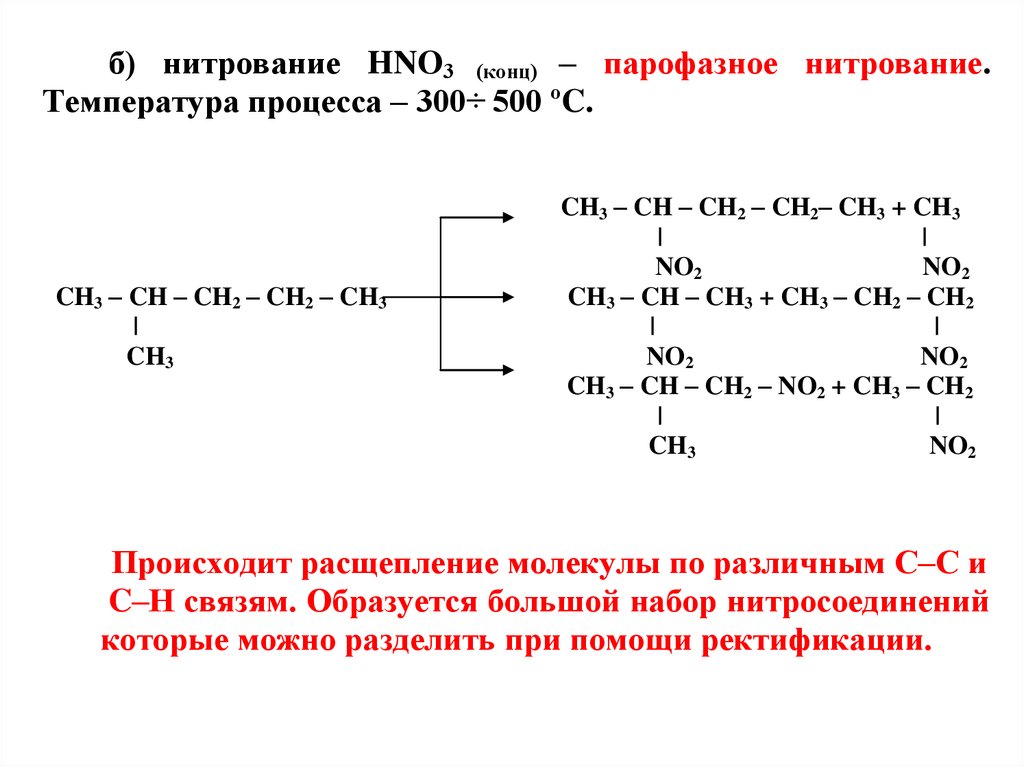
б) нитрование HNO3 (конц) – парофазное нитрование.Температура процесса – 300÷ 500 ºC.
CH3 – CH – CH2 – CH2 – CH3
|
CH3
CH3 – CH – CH2 – CH2– CH3 + CH3
|
|
NO2
NO2
CH3 – CH – CH3 + CH3 – CH2 – CH2
|
|
NO2
NO2
CH3 – CH – CH2 – NO2 + CH3 – CH2
|
|
CH3
NO2
Происходит расщепление молекулы по различным C–C и
C–H связям. Образуется большой набор нитросоединений,
которые можно разделить при помощи ректификации.
35.
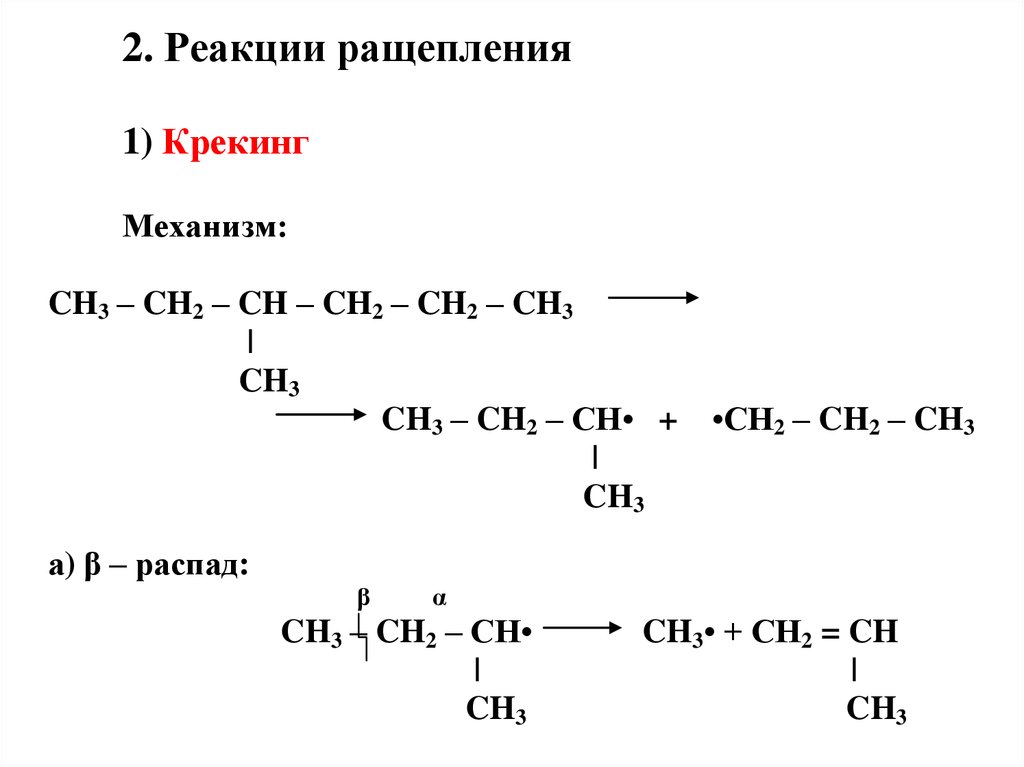
2. Реакции ращепления1) Крекинг
Механизм:
CH3 – CH2 – CH – CH2 – CH2 – CH3
|
CH3
CH3 – CH2 – CH• +
|
CH3
•CH2 – CH2 – CH3
а) β – распад:
β
α
CH3 – CH2 – CH
|
CH3
CH3• + CH2 = CH
|
CH3
36.
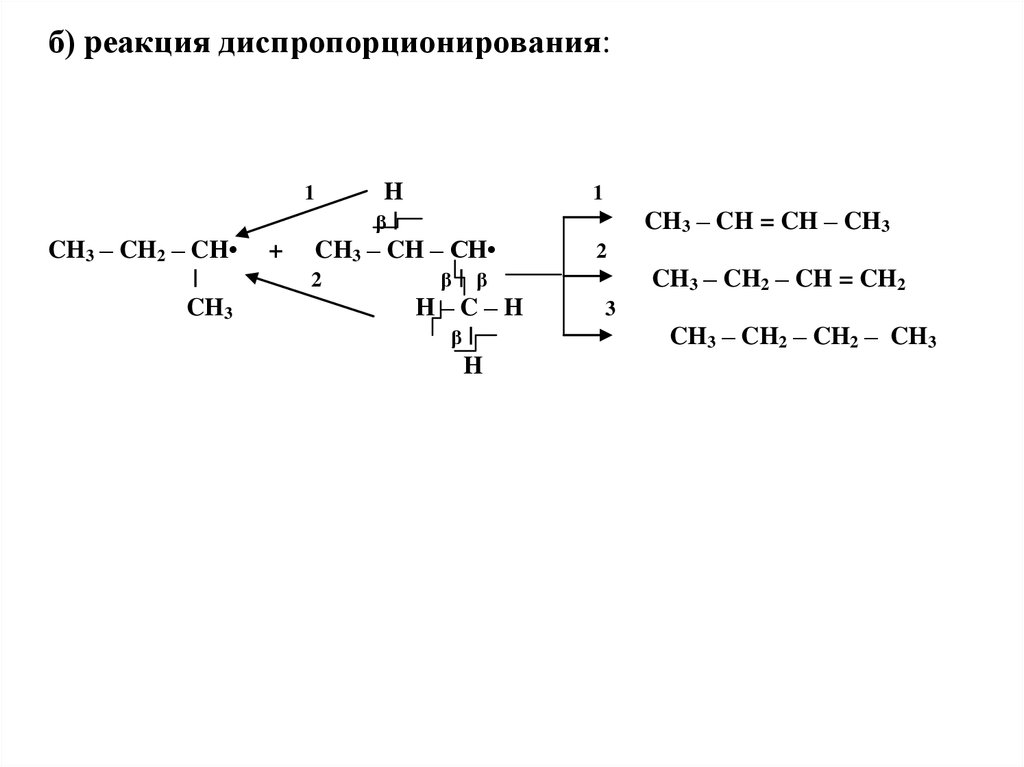
б) pеакция диспропорционирования:H
β|
CH3 – CН – CH
2
β| β
Н–C–H
β|
H
1
CH3 – CH2 – CH
|
CH3
+
1
CH3 – CH = CH – CH3
2
CH3 – CH2 – CH = CH2
3
CH3 – CH2 – CH2 – CH3
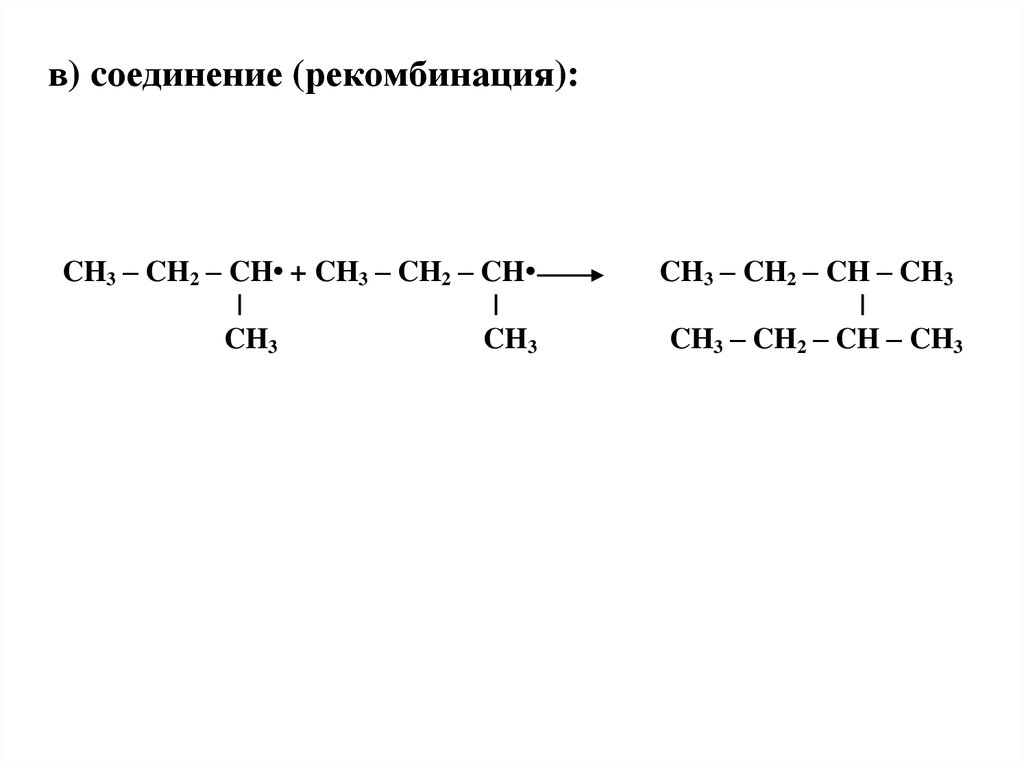
37.
в) cоединение (рекомбинация):CH3 – CH2 – CH• + CH3 – CH2 – CH
|
|
CH3
CH3
CH3 – CH2 – CH – CH3
|
CH3 – CH2 – CH – CH3
38.
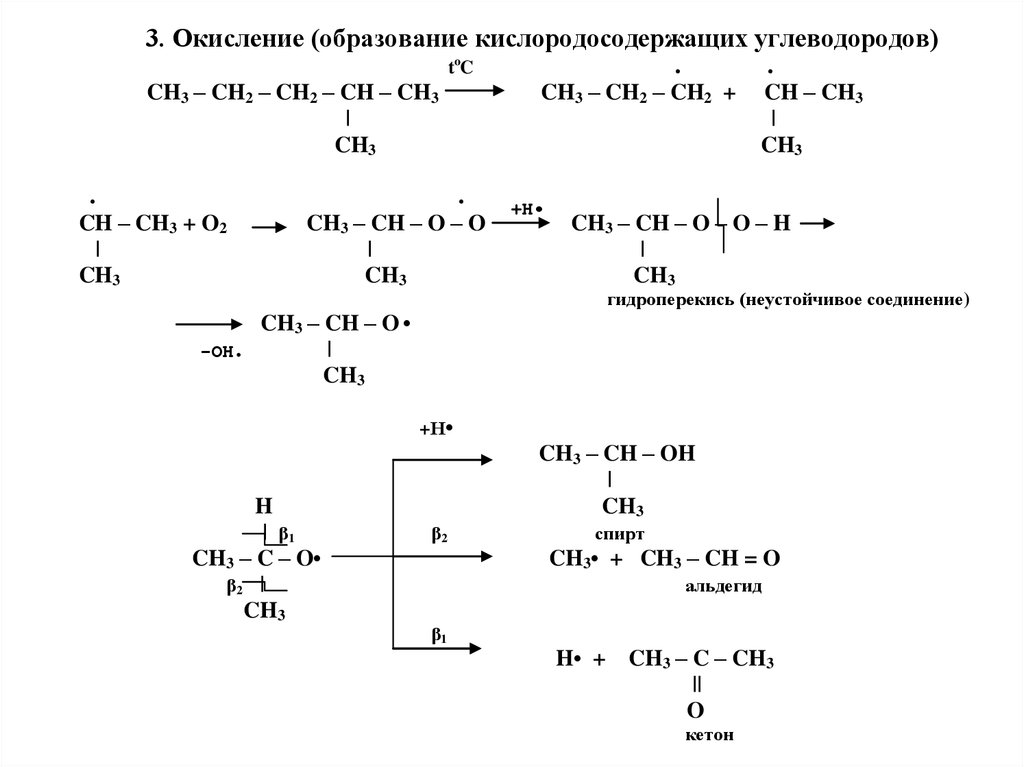
3. Окисление (образование кислородосодержащих углеводородов)toC
CH3 – CH2 – CH2 – CH – CH3
|
CH3
CH – CH3 + O2
|
CH3
CH3 – CH2 – CH2 +
CH3 – CH – O – O
|
CH3
+H
CH – CH3
|
CH3
CH3 – CH – O – O – H
|
CH3
гидроперекись (неустойчивое соединение)
CH3 – CH – O
|
-OH .
CH3
+Н
H
| β1
CH3 – C – O
β2 |
CH3
CH3 – CH – OH
|
CH3
β2
спирт
CH3• + CH3 – CH = O
альдегид
β1
H• +
CH3 – C – CH3
||
O
кетон
39.
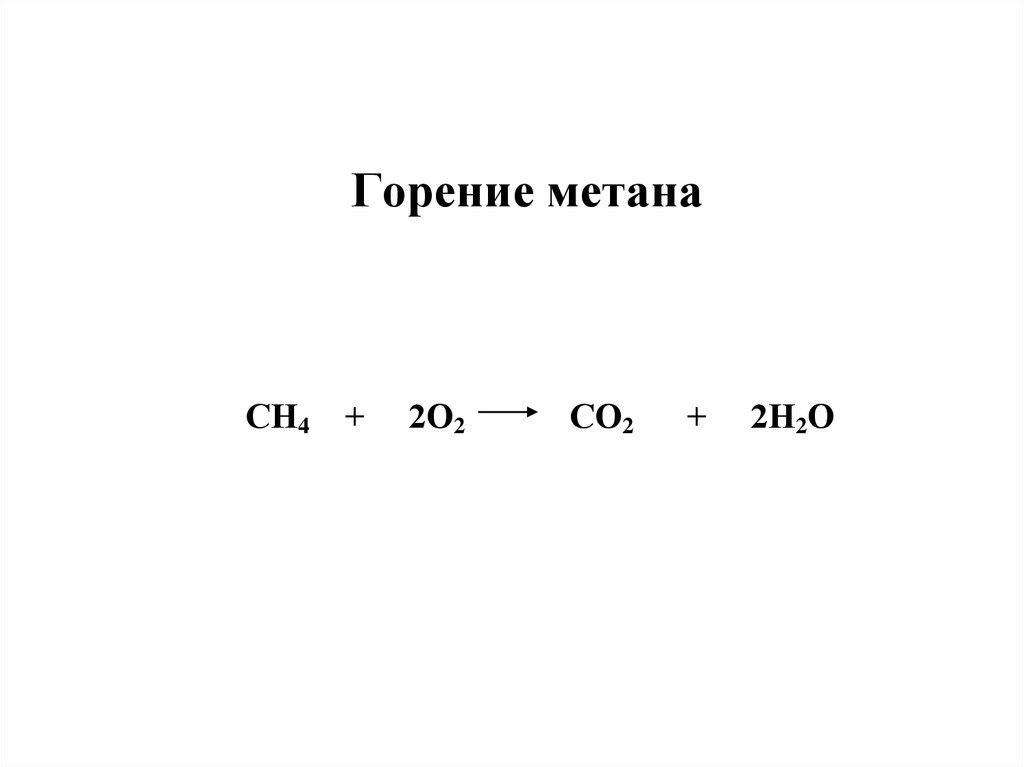
Горение метанаСН4 +
2О2
СО2
+
2Н2О
40.
41.
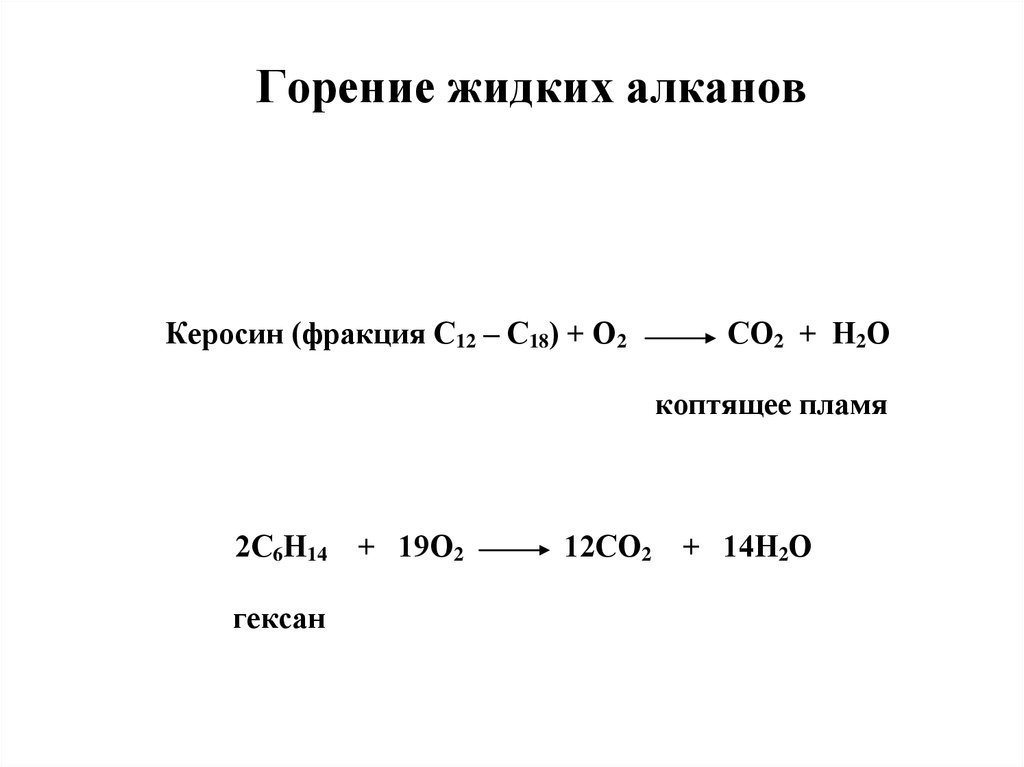
Горение жидких алкановКеросин (фракция С12 – С18) + О2
СО2 + Н2О
коптящее пламя
2С6Н14
гексан
+ 19О2
12СО2
+ 14Н2О
42.
43.
Горение твёрдых алкановС17Н36
+ 26О2
17СО2
+ 18Н2О
























 Химия
Химия








