Похожие презентации:
Механизмы нарушения работы митохондрий
1. Свободные радикалы и болезни человека
Биофизические основыпатологии клетки
Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
2.
Механизмы нарушения работымитохондрий
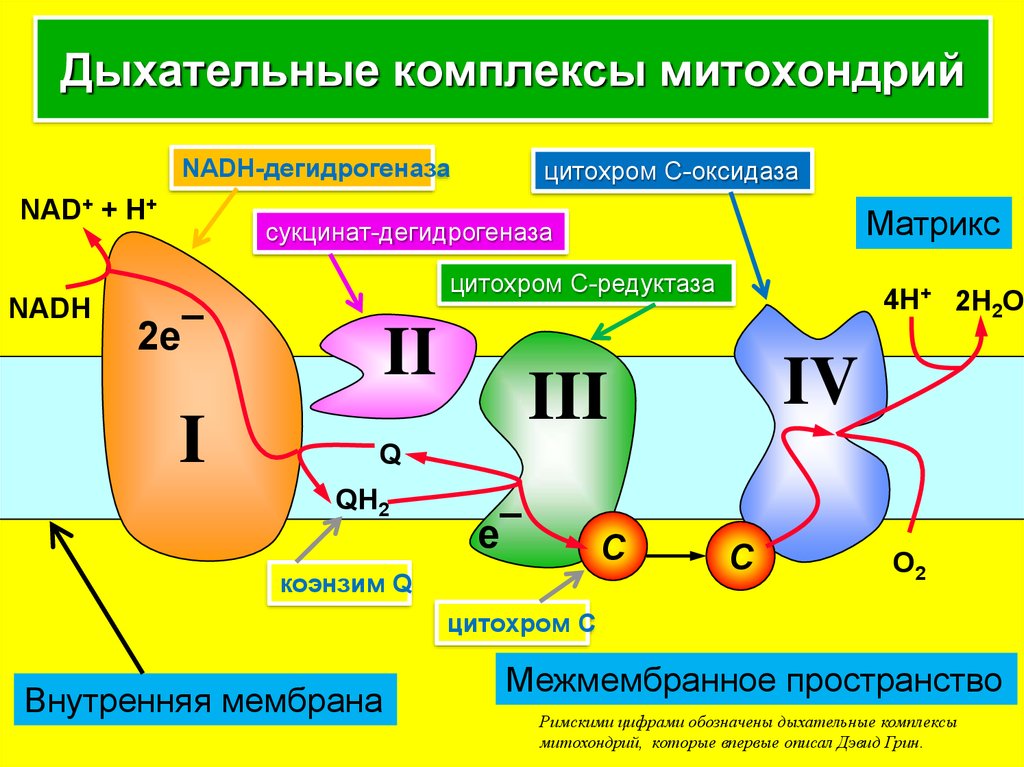
3. Дыхательные комплексы митохондрий
цитохром С-оксидазаNADH-дегидрогеназа
NAD+ + H+
Матрикс
сукцинат-дегидрогеназа
цитохром С-редуктаза
NADH
2e¯
I
II
4H+ 2H2O
IV
III
Q
QH2
e¯
C
коэнзим Q
C
O2
цитохром С
Внутренняя мембрана
Межмембранное пространство
Римскими цифрами обозначены дыхательные комплексы
митохондрий, которые впервые описал Дэвид Грин.
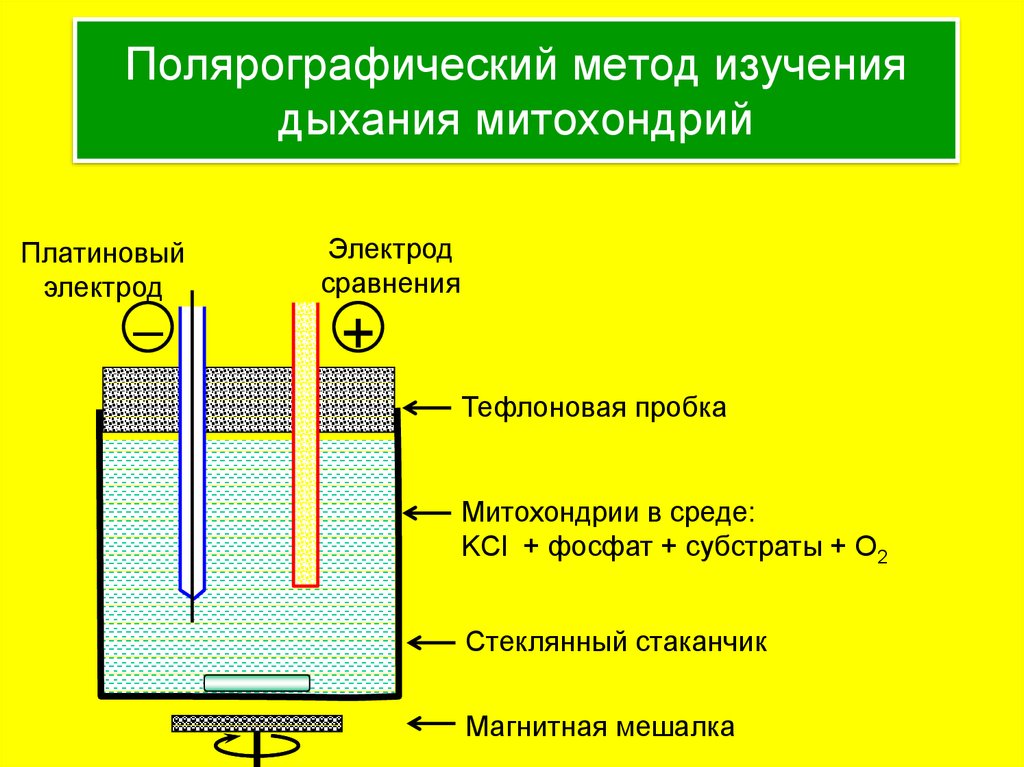
4. Полярографический метод изучения дыхания митохондрий
Платиновыйэлектрод
–
Электрод
сравнения
+
Тефлоновая пробка
Митохондрии в среде:
KCl + фосфат + субстраты + O2
Стеклянный стаканчик
Магнитная мешалка
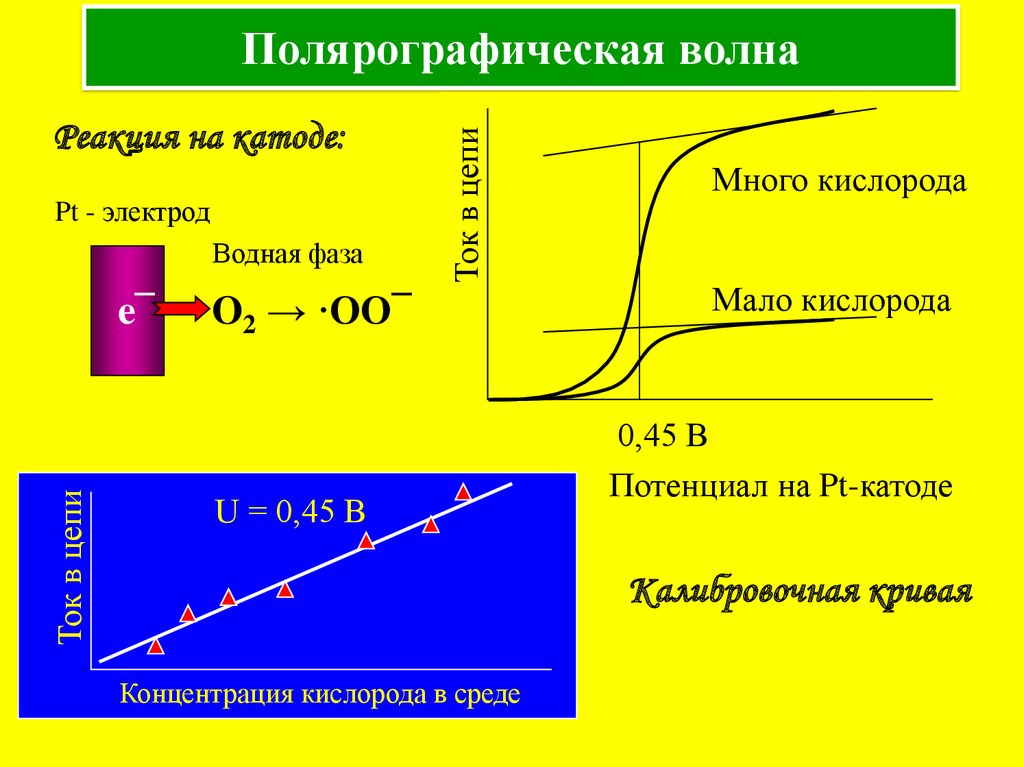
5. Полярографическая волна
Реакция на катоде:Pt - электрод
Водная фаза
Ток в цепи
e¯
Ток в цепи
Полярографическая волна
O2 → ·OO¯
U = 0,45 В
Много кислорода
Мало кислорода
0,45 В
Потенциал на Pt-катоде
Калибровочная кривая
Концентрация кислорода в среде
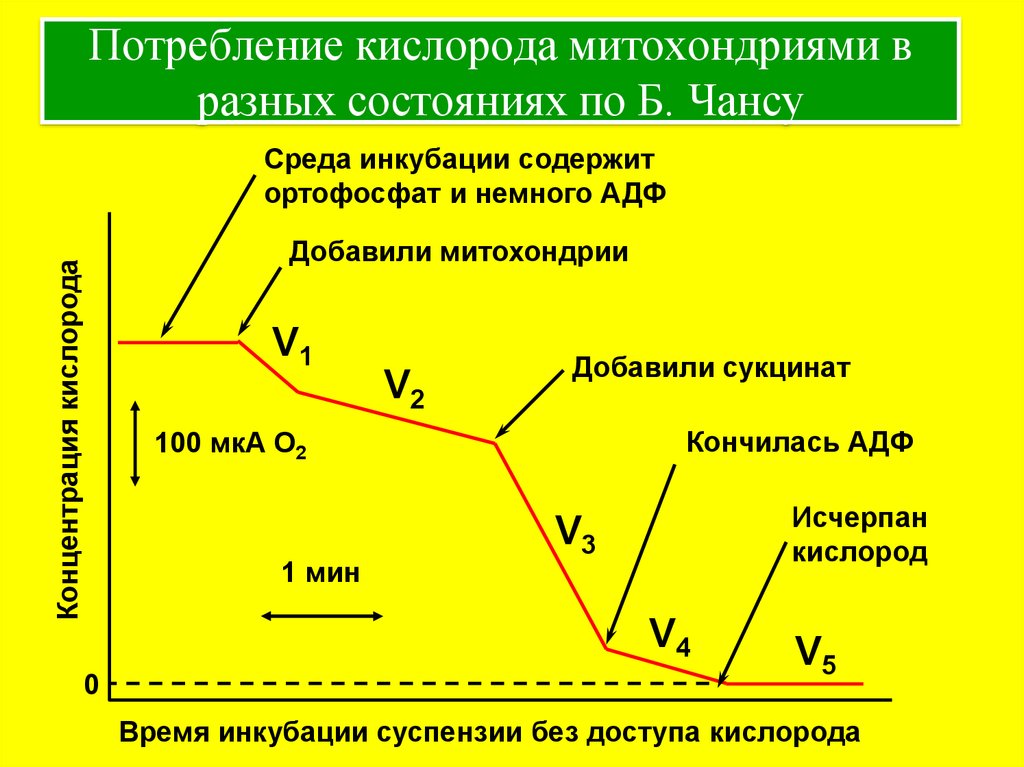
6. Потребление кислорода митохондриями в разных состояниях по Б. Чансу
Среда инкубации содержитортофосфат и немного АДФ
Концентрация кислорода
Добавили митохондрии
V1
V2
Добавили сукцинат
Кончилась АДФ
100 мкА О2
1 мин
Исчерпан
кислород
V3
V4
0
V5
Время инкубации суспензии без доступа кислорода
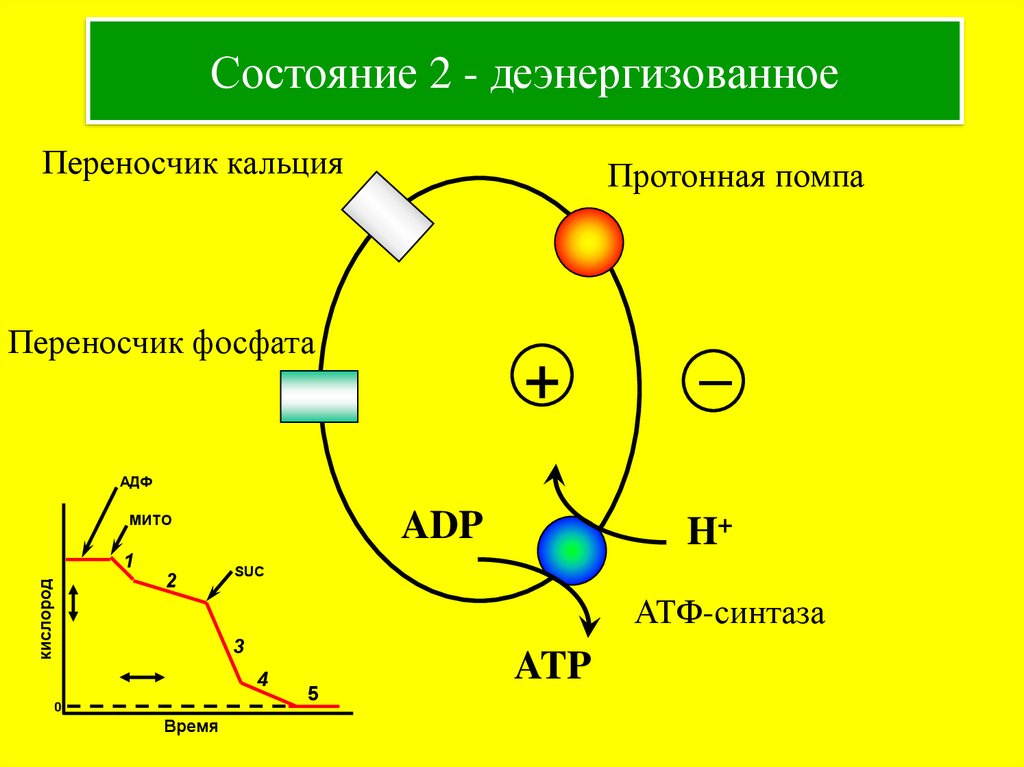
7. Состояние 2 - деэнергизованное
Переносчик кальцияПротонная помпа
Переносчик фосфата
+
–
АДФ
ADP
МИТО
кислород
1
2
H+
SUC
АТФ-синтаза
3
4
0
Время
5
ATP
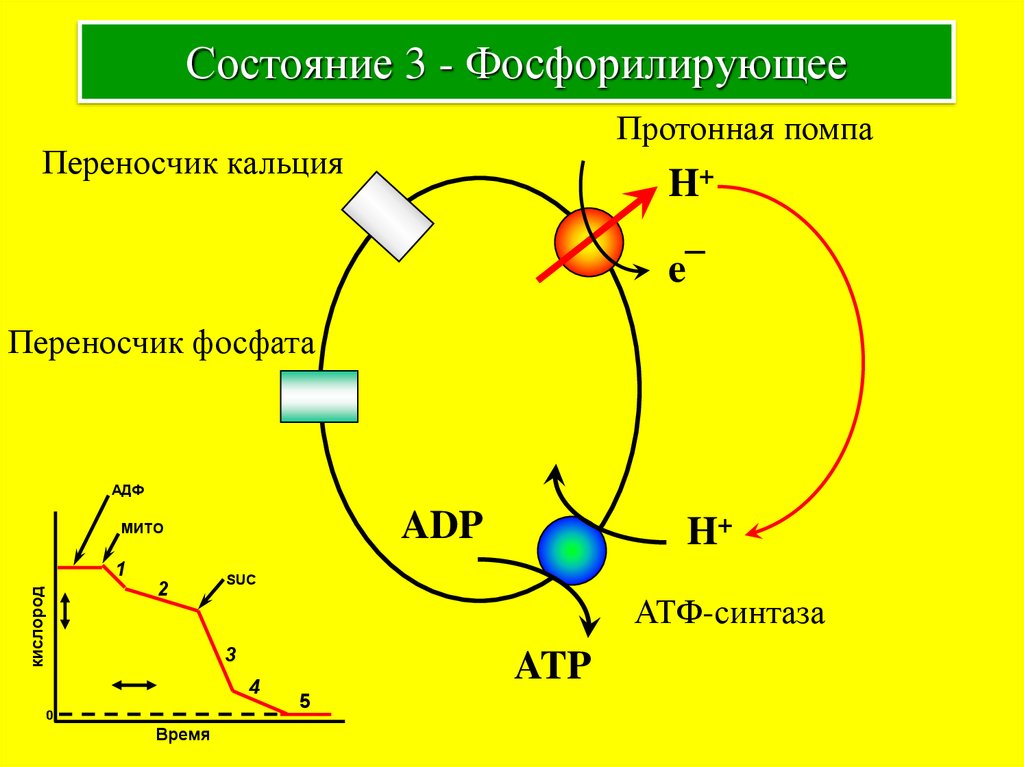
8. Состояние 3 - Фосфорилирующее
Протонная помпаПереносчик кальция
H+
e¯
Переносчик фосфата
АДФ
ADP
МИТО
кислород
1
2
SUC
АТФ-синтаза
3
4
0
Время
H+
ATP
5
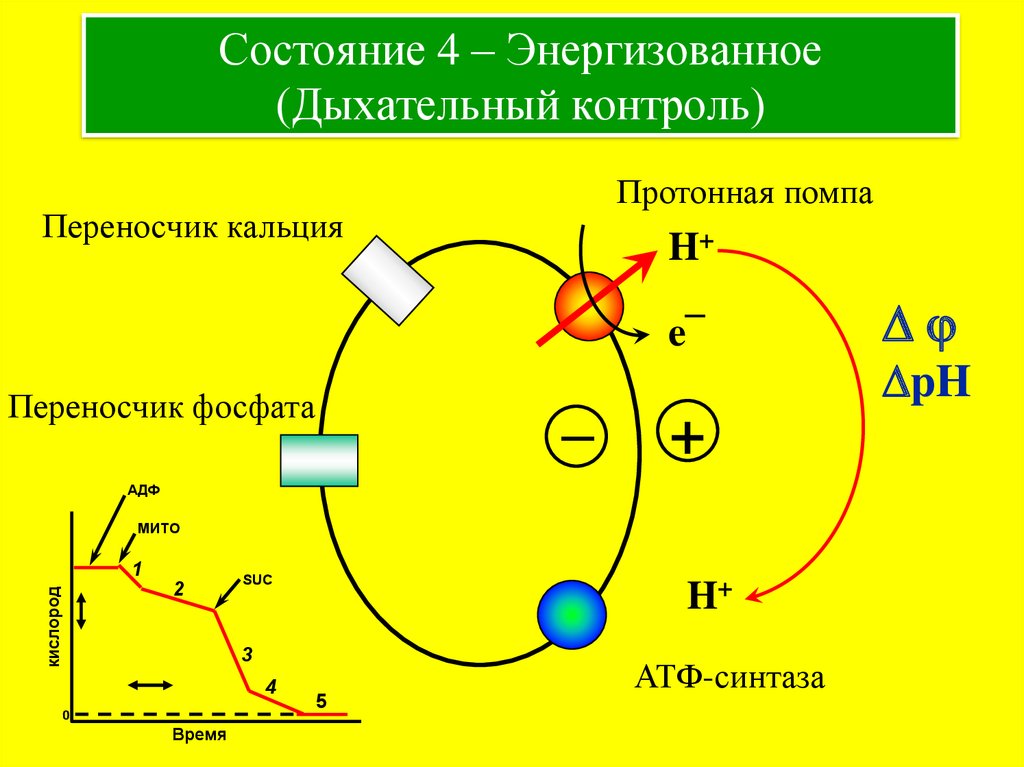
9. Состояние 4 – Энергизованное (Дыхательный контроль)
Протонная помпаПереносчик кальция
H+
e¯
Переносчик фосфата
–
+
АДФ
МИТО
кислород
1
2
SUC
H+
3
4
0
Время
5
АТФ-синтаза
Dj
DpH
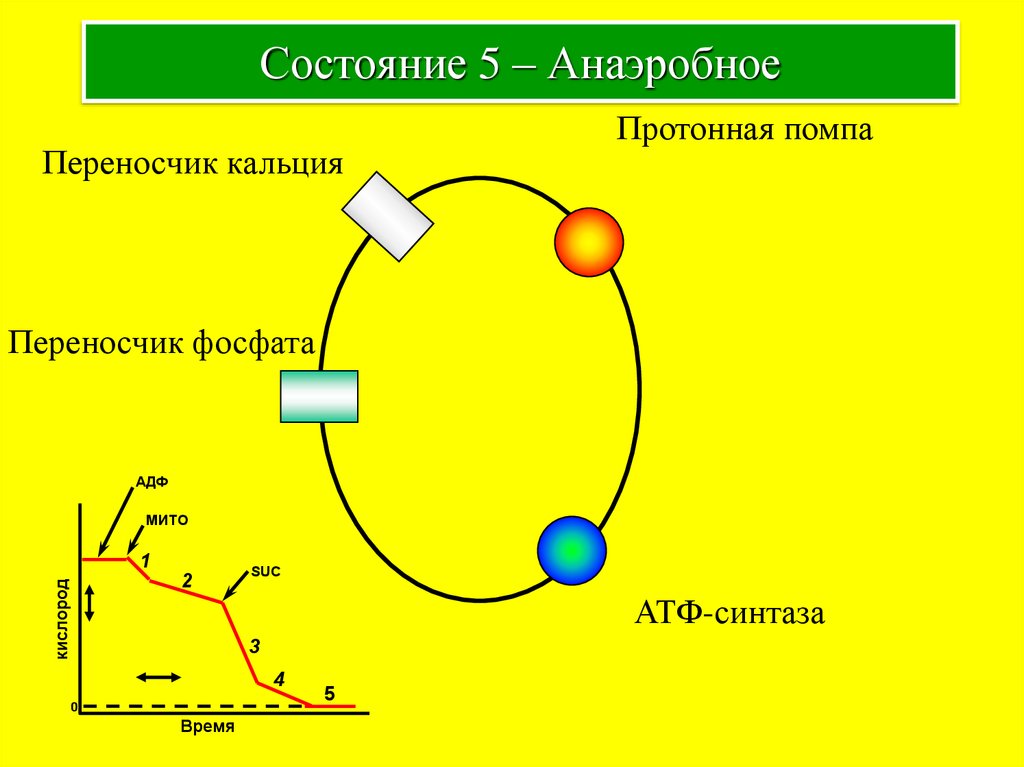
10. Состояние 5 – Анаэробное
Переносчик кальцияПротонная помпа
Переносчик фосфата
АДФ
МИТО
кислород
1
2
SUC
АТФ-синтаза
3
4
0
Время
5
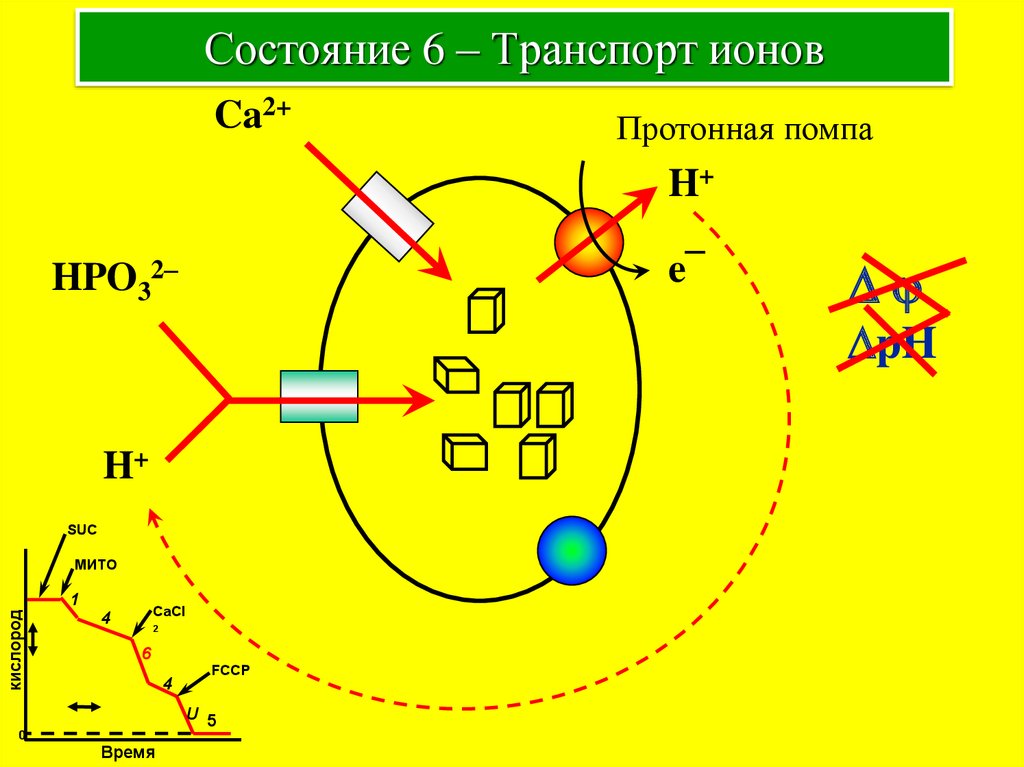
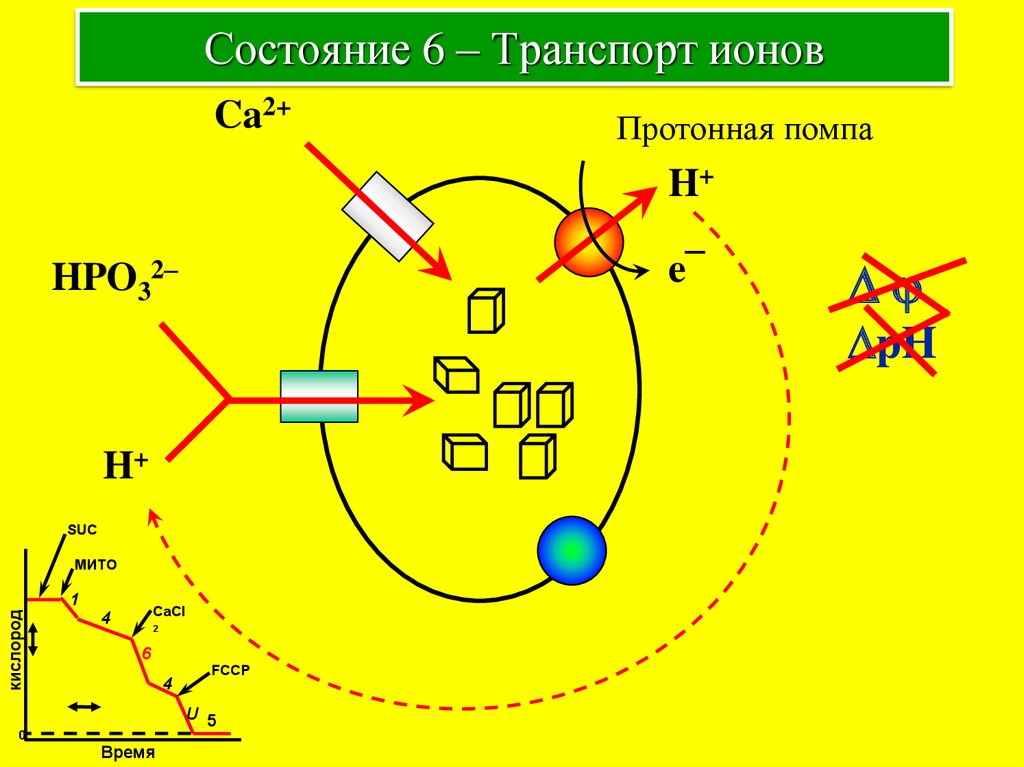
11. Состояние 6 – Транспорт ионов
Ca2+Протонная помпа
H+
e¯
HPO32–
Dj
DpH
H+
SUC
МИТО
кислород
1
CaCl
4
2
6
4
FCCP
U 5
0
Время
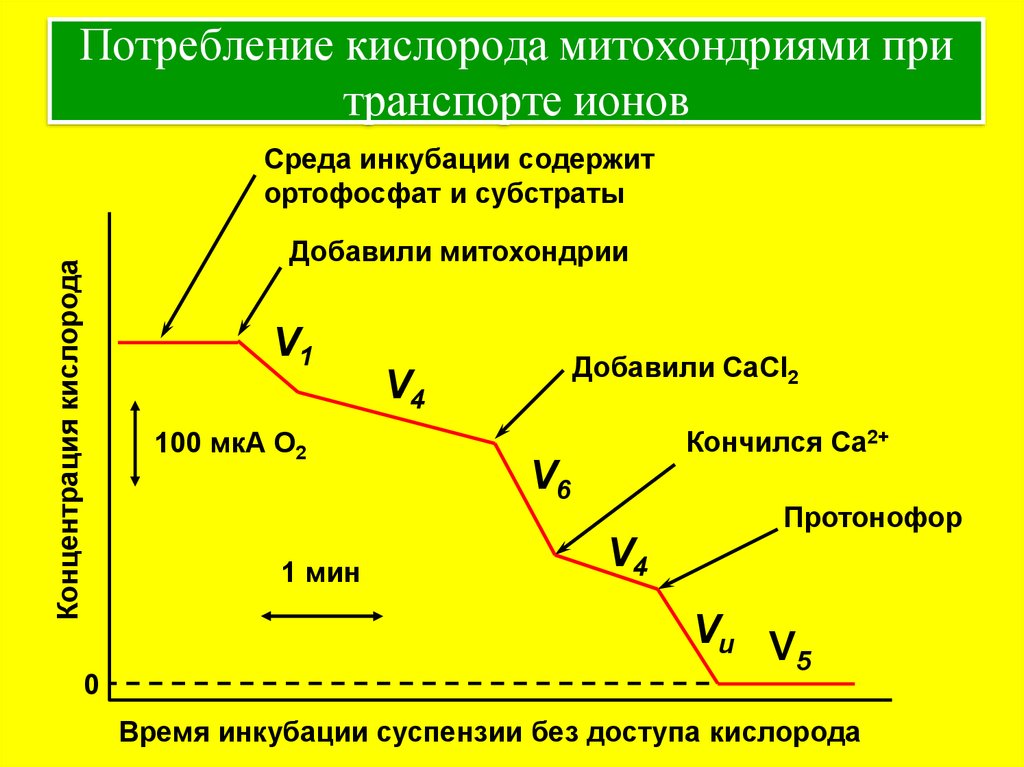
12. Потребление кислорода митохондриями при транспорте ионов
Среда инкубации содержитортофосфат и субстраты
Концентрация кислорода
Добавили митохондрии
V1
100 мкА О2
1 мин
0
Добавили CaCl2
V4
Кончился Ca2+
V6
Протонофор
V4
Vu V
5
Время инкубации суспензии без доступа кислорода
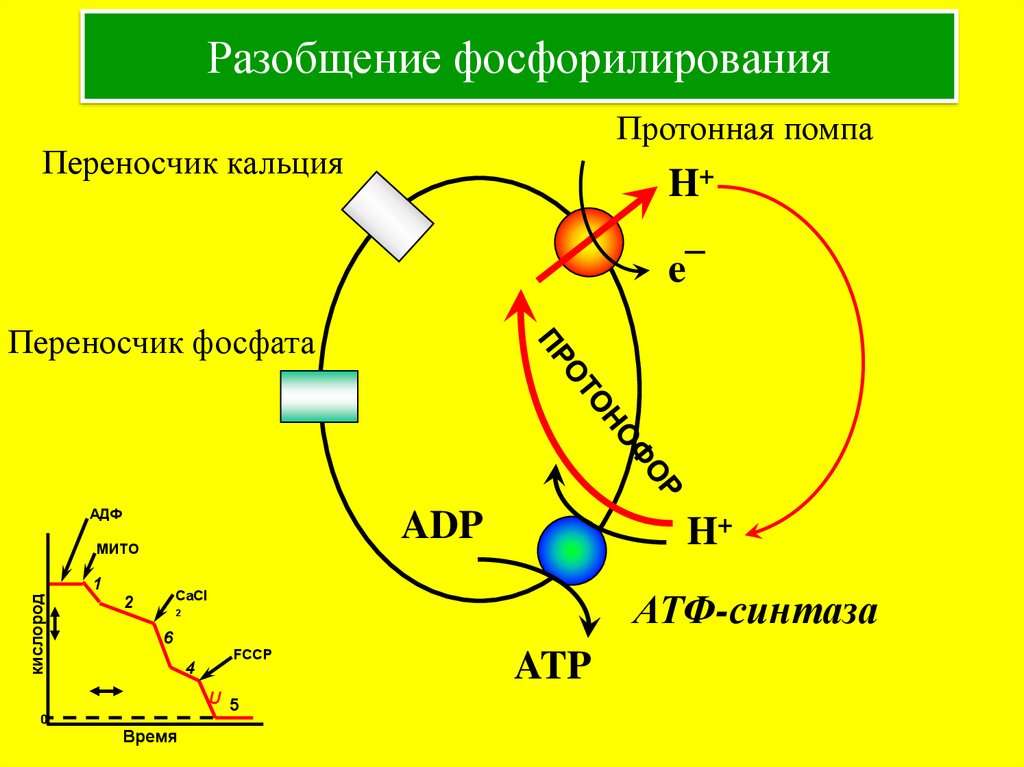
13. Разобщение фосфорилирования
Протонная помпаПереносчик кальция
H+
e¯
Переносчик фосфата
АДФ
ADP
МИТО
кислород
1
H+
АТФ-синтаза
CaCl
2
2
6
4
FCCP
U 5
0
Время
ATP
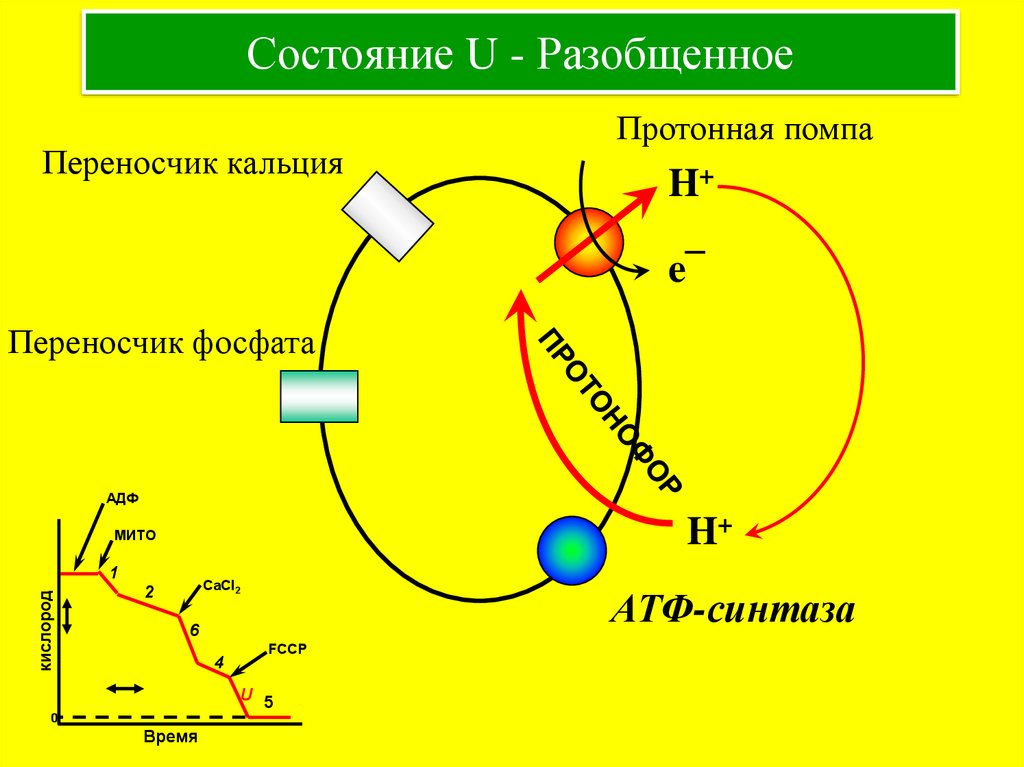
14. Состояние U - Разобщенное
Переносчик кальцияПротонная помпа
H+
e¯
Переносчик фосфата
АДФ
H+
МИТО
кислород
1
CaCl2
2
АТФ-синтаза
6
4
FCCP
U 5
0
Время
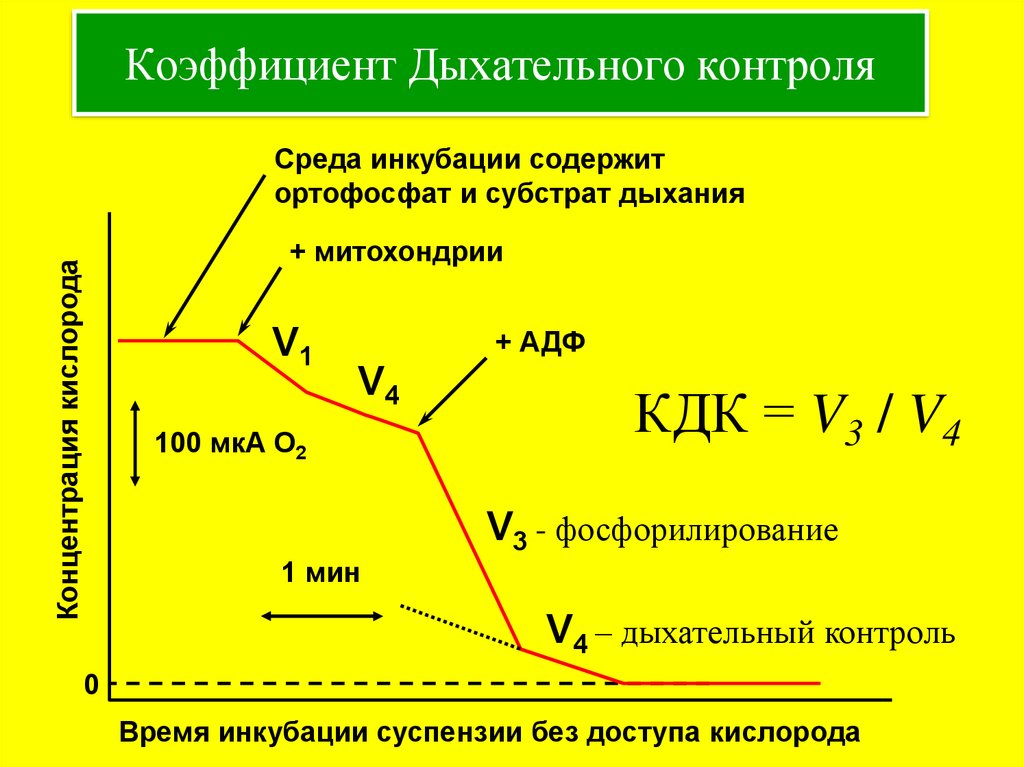
15. Коэффициент Дыхательного контроля
Среда инкубации содержитортофосфат и субстрат дыхания
Концентрация кислорода
+ митохондрии
V1
+ АДФ
V4
100 мкА О2
КДК = V3 / V4
V3 - фосфорилирование
1 мин
V4 – дыхательный контроль
0
Время инкубации суспензии без доступа кислорода
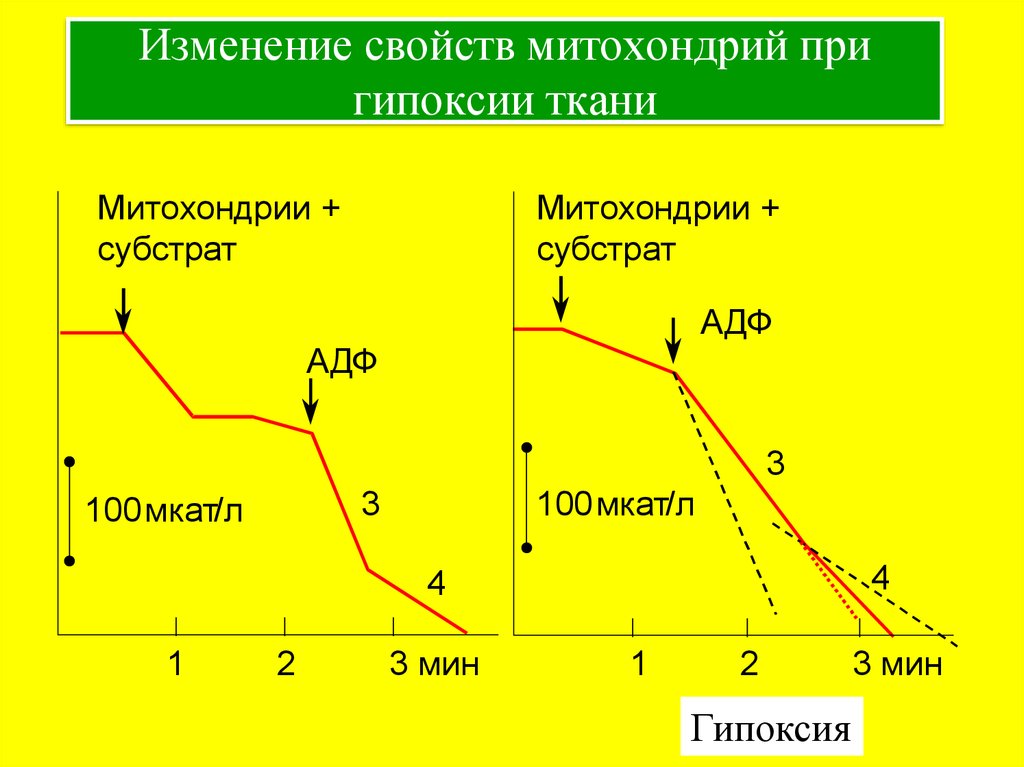
16. Изменение свойств митохондрий при гипоксии ткани
Митохондрии +субстрат
Митохондрии +
субстрат
АДФ
АДФ
3
100 мкат/л
100 мкат/л
3
4
4
1
2
3 мин
1
2
Гипоксия
3 мин
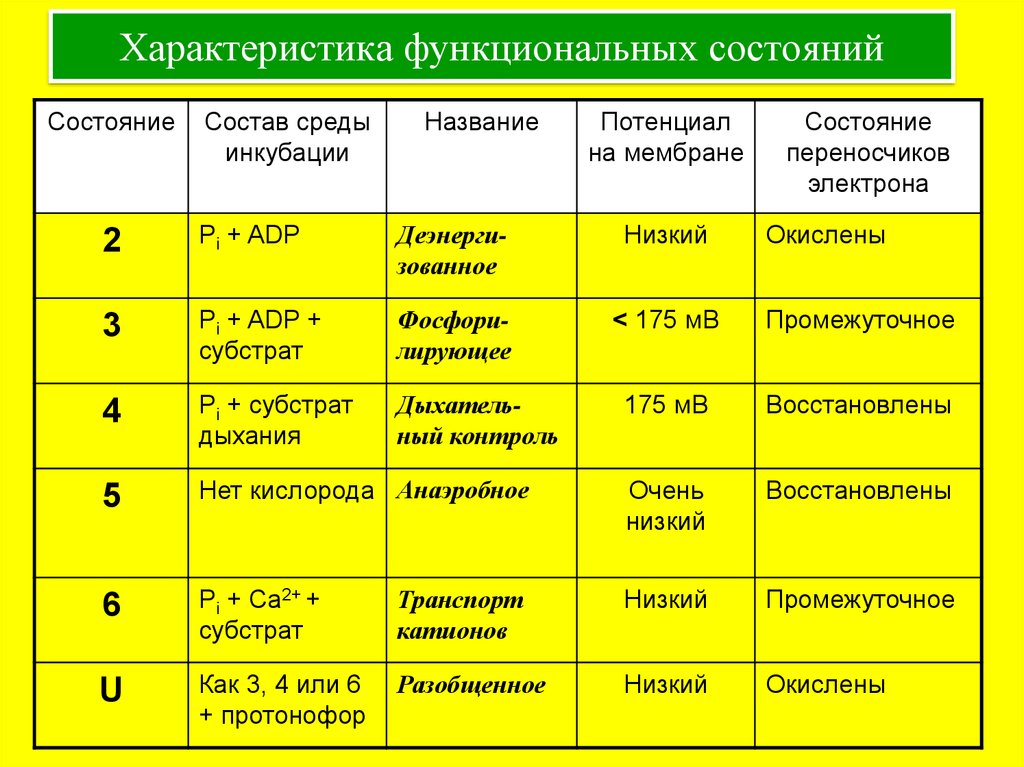
17. Характеристика функциональных состояний
СостояниеСостав среды
инкубации
Название
Потенциал
на мембране
Состояние
переносчиков
электрона
2
Pi + ADP
Деэнергизованное
Низкий
Окислены
3
Pi + ADP +
субстрат
Фосфорилирующее
< 175 мВ
Промежуточное
4
Pi + субстрат
дыхания
Дыхательный контроль
175 мВ
Восстановлены
5
Нет кислорода Анаэробное
Очень
низкий
Восстановлены
6
Pi + Ca2+ +
субстрат
Транспорт
катионов
Низкий
Промежуточное
U
Как 3, 4 или 6
+ протонофор
Разобщенное
Низкий
Окислены
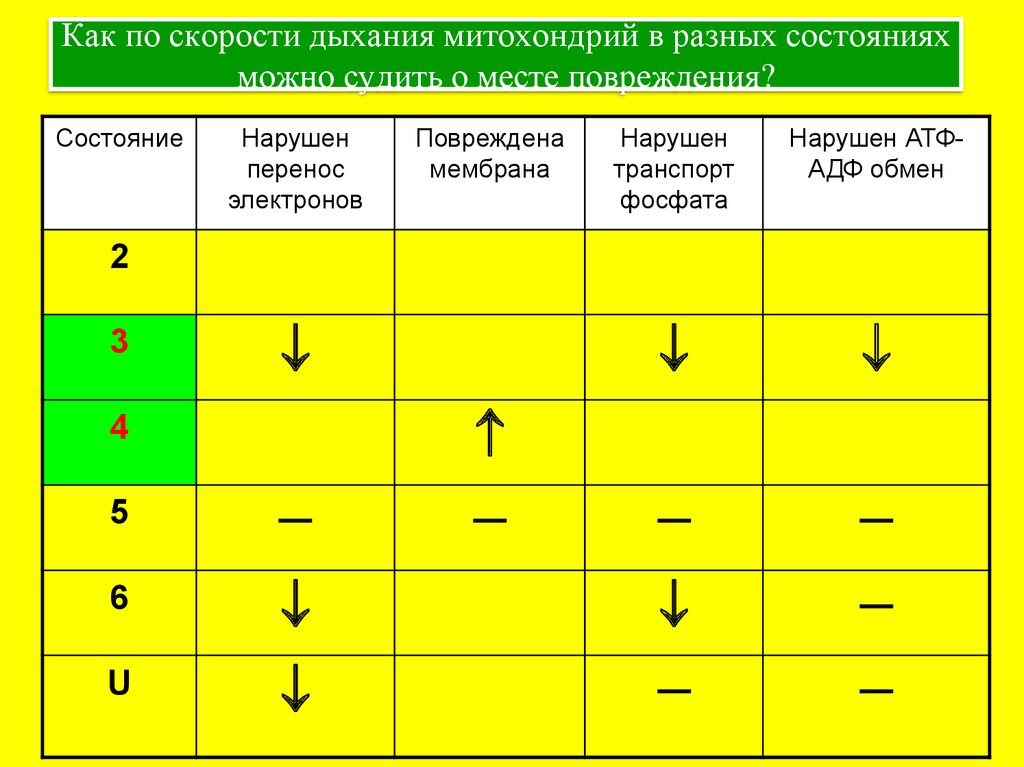
18. Как по скорости дыхания митохондрий в разных состояниях можно судить о месте повреждения?
СостояниеНарушен
перенос
электронов
Повреждена
мембрана
Нарушен
транспорт
фосфата
Нарушен АТФАДФ обмен
─
─
2
3
4
5
─
─
6
─
U
─
─
19.
Нарушение структуры и функциймитохондрий:
1.
2.
3.
4.
Снижение потребления кислорода
…
…
…
20.
Снижение кальций-аккумулирующейспособности:
21. Состояние 6 – Транспорт ионов
Ca2+Протонная помпа
H+
e¯
HPO32–
Dj
DpH
H+
SUC
МИТО
кислород
1
CaCl
4
2
6
4
FCCP
U 5
0
Время
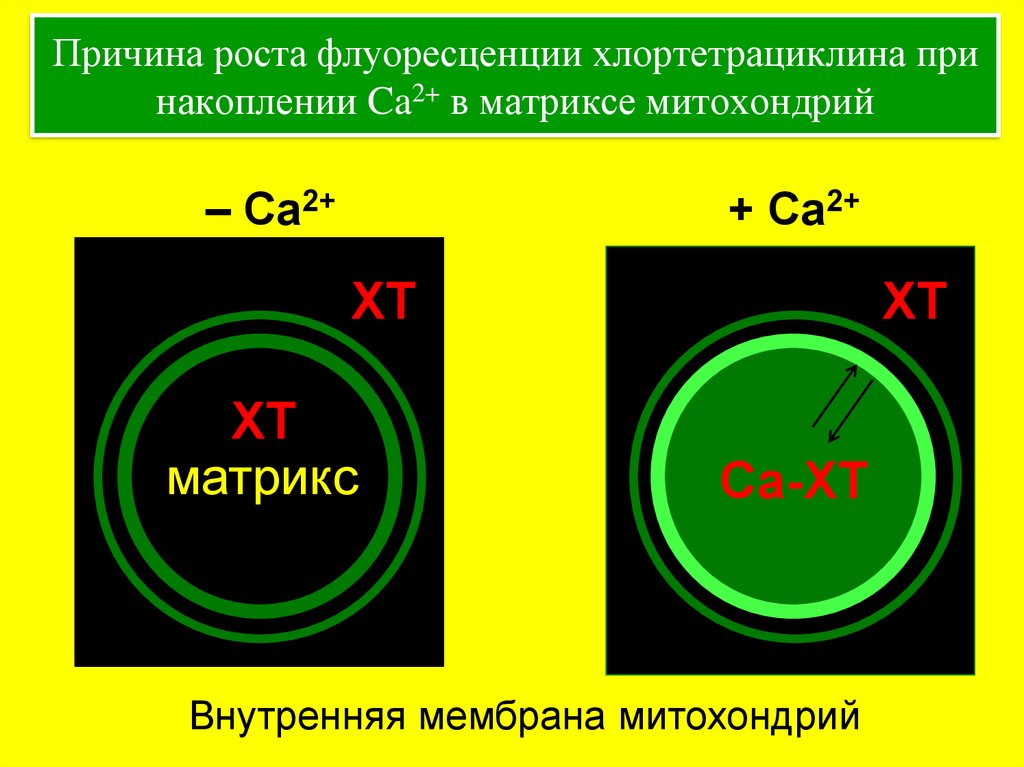
22. Причина роста флуоресценции хлортетрациклина при накоплении Ca2+ в матриксе митохондрий
– Ca2++ Ca2+
ХТ
ХТ
матрикс
ХТ
Са-ХТ
Внутренняя мембрана митохондрий
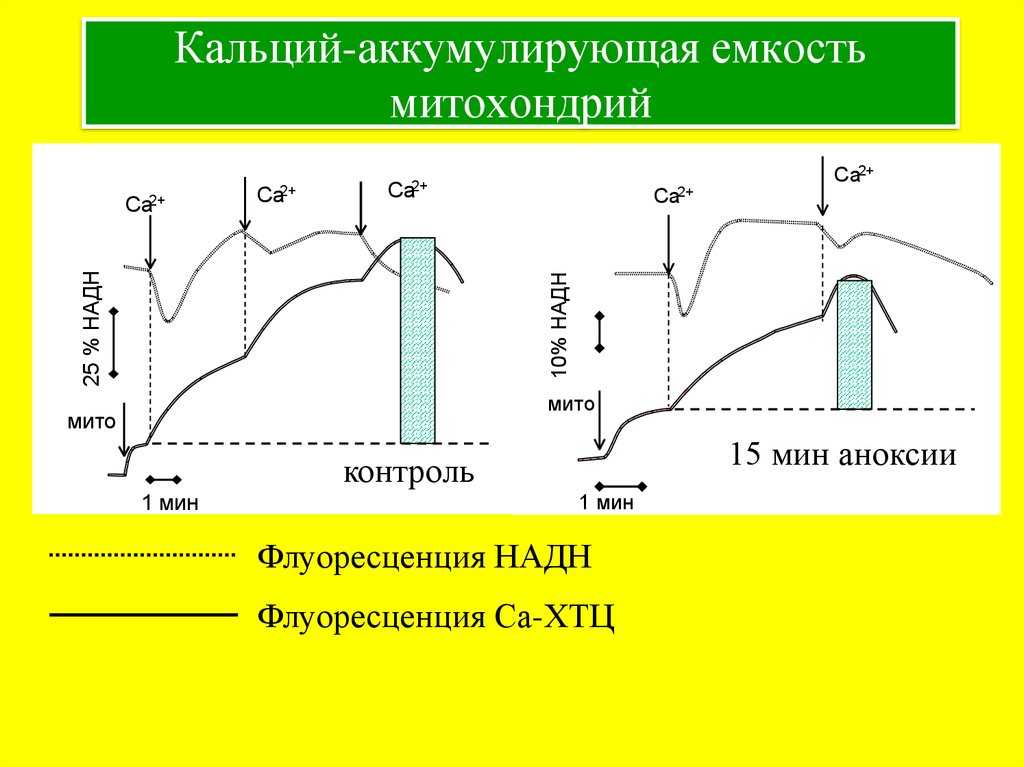
23. Кальций-аккумулирующая емкость митохондрий
Ca2+Ca2+
Ca2+
10% НАДН
25 % НАДН
Ca2+
Ca2+
мито
мито
15 мин аноксии
контроль
1 мин
1 мин
Флуоресценция НАДН
Флуоресценция Са-ХТЦ
24.
Нарушение структуры и функциймитохондрий:
1. Снижение потребления кислорода
2. Снижение кальций-аккумулирующей
способности
3. …
4. …
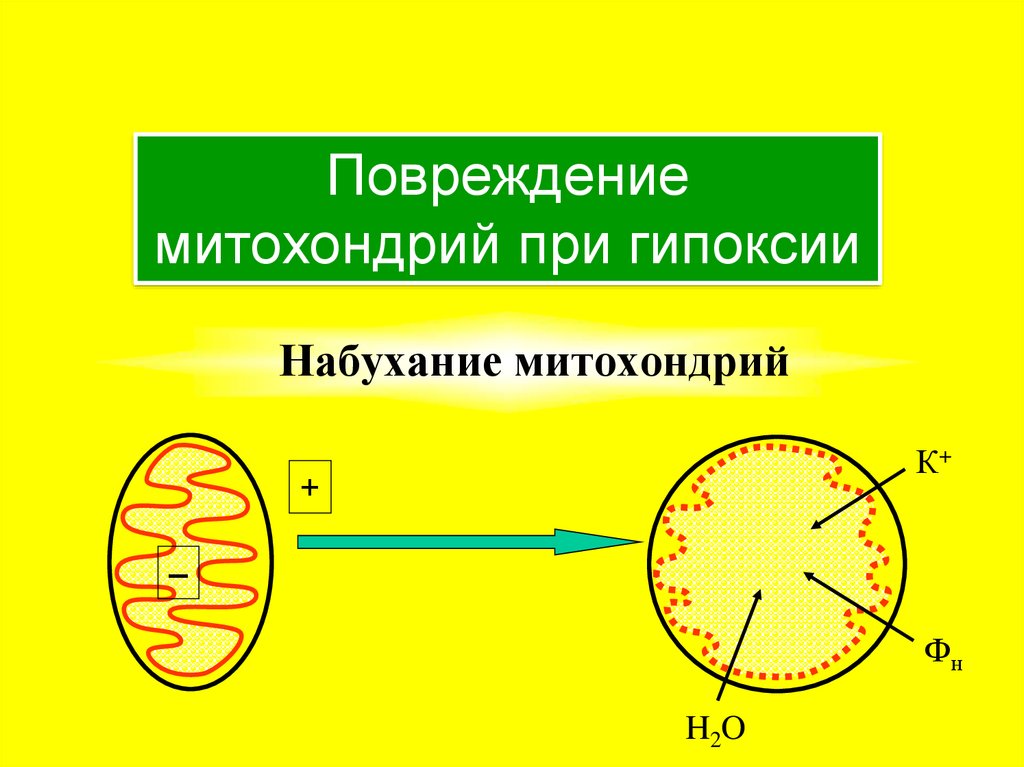
25. Набухание митохондрий
Повреждениемитохондрий при гипоксии
Набухание митохондрий
К+
+
–
Фн
H2O
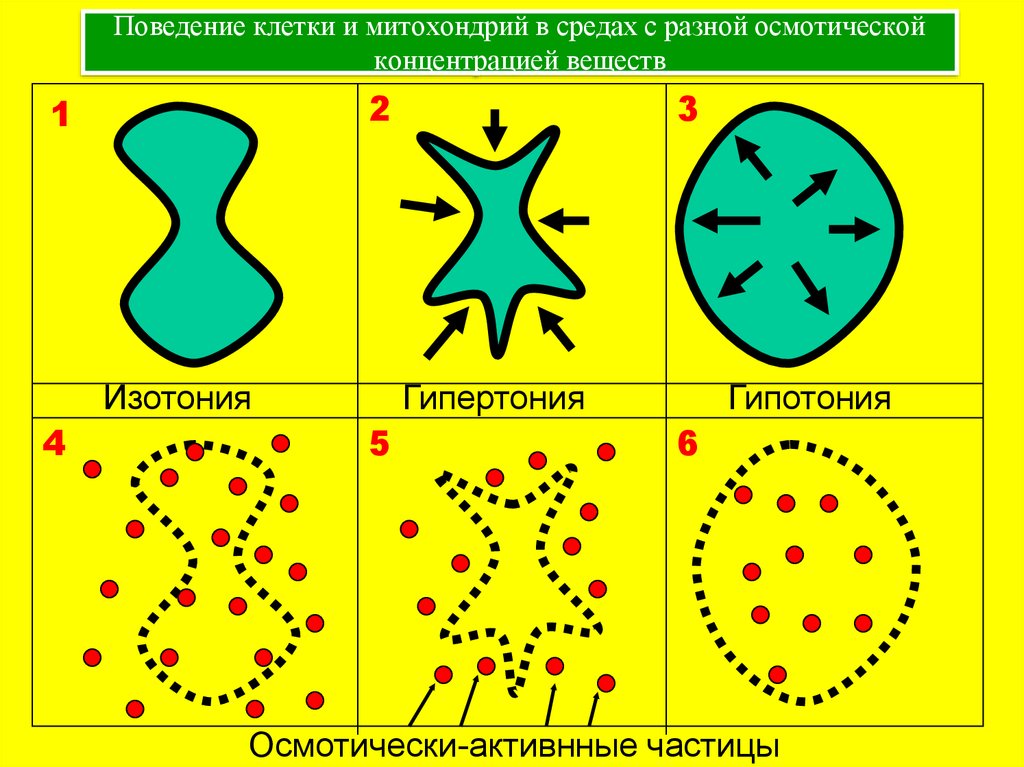
26. Поведение клетки и митохондрий в средах с разной осмотической концентрацией веществ
21
Изотония
4
3
Гипертония
5
Гипотония
6
Осмотически-активнные частицы
27. Типы набухания митохондрий:
А. ПассивноеБ. Активное
1. Спонтанное набухание
S-swelling
2. При действии валиномицина
V-swelling
3. При действии детергентов
D-swelling
4. При пероксидации липидов
P-swelling
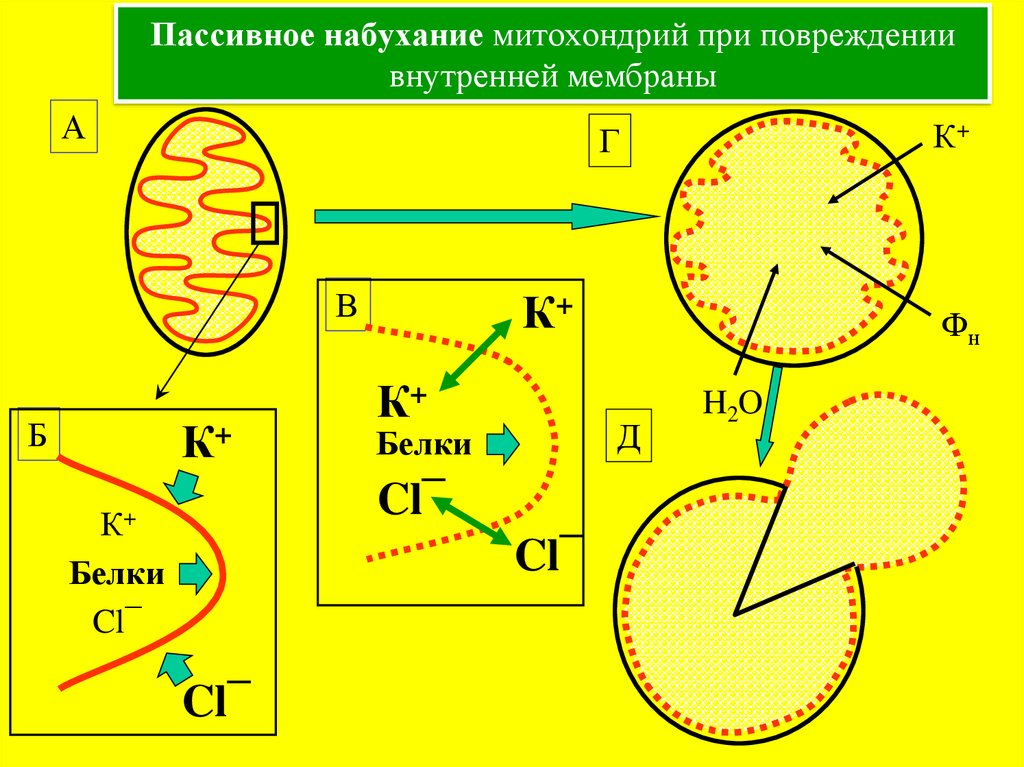
28. Пассивное набухание митохондрий при повреждении внутренней мембраны
АК+
Г
В
Б
К+
К+
К+
Д
Белки
Cl¯
К+
Cl¯
Белки
Cl¯
Cl¯
Фн
H2O
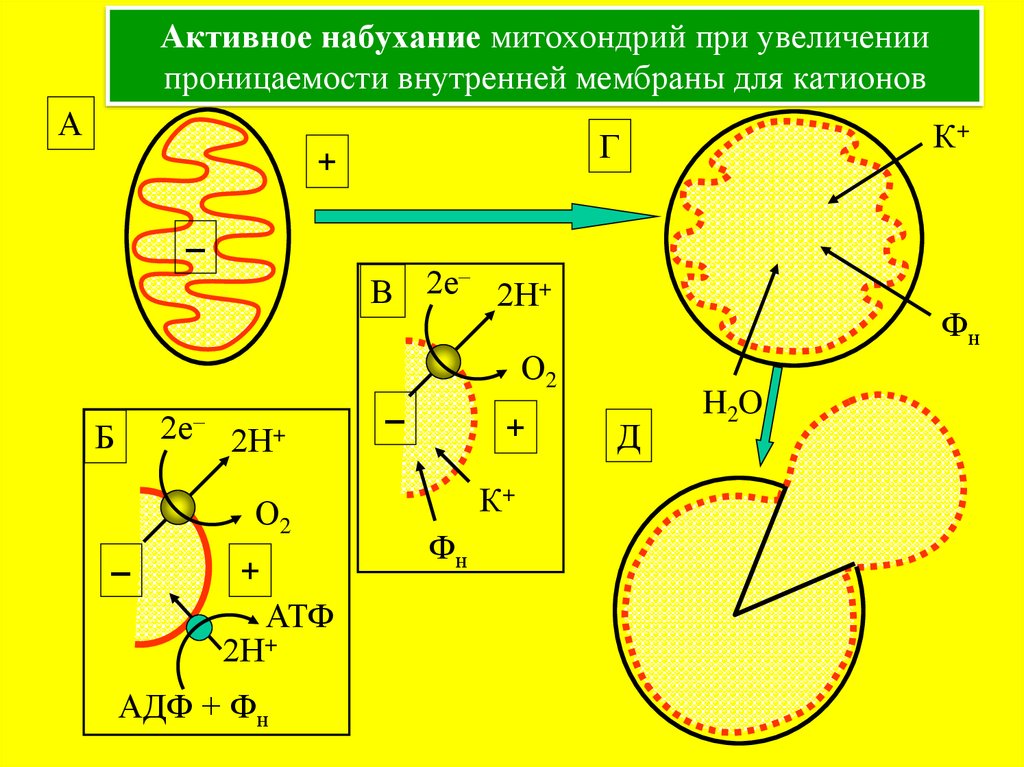
29. Активное набухание митохондрий при увеличении проницаемости внутренней мембраны для катионов
А+
–
–
2е
В
2Н+
Фн
О2
2е–
Б
2Н+
О2
–
К+
Г
+
АТФ
2Н+
АДФ + Фн
–
+
К+
Фн
Д
H2O
30.
Нарушение структуры и функциймитохондрий:
1. Снижение потребления кислорода
2. Снижение кальций-аккумулирующей
способности
3. Увеличение проницаемости внутренней
мембраны
4. Набухание митохондрий
31.
Моделирование гипоксическогоповреждения
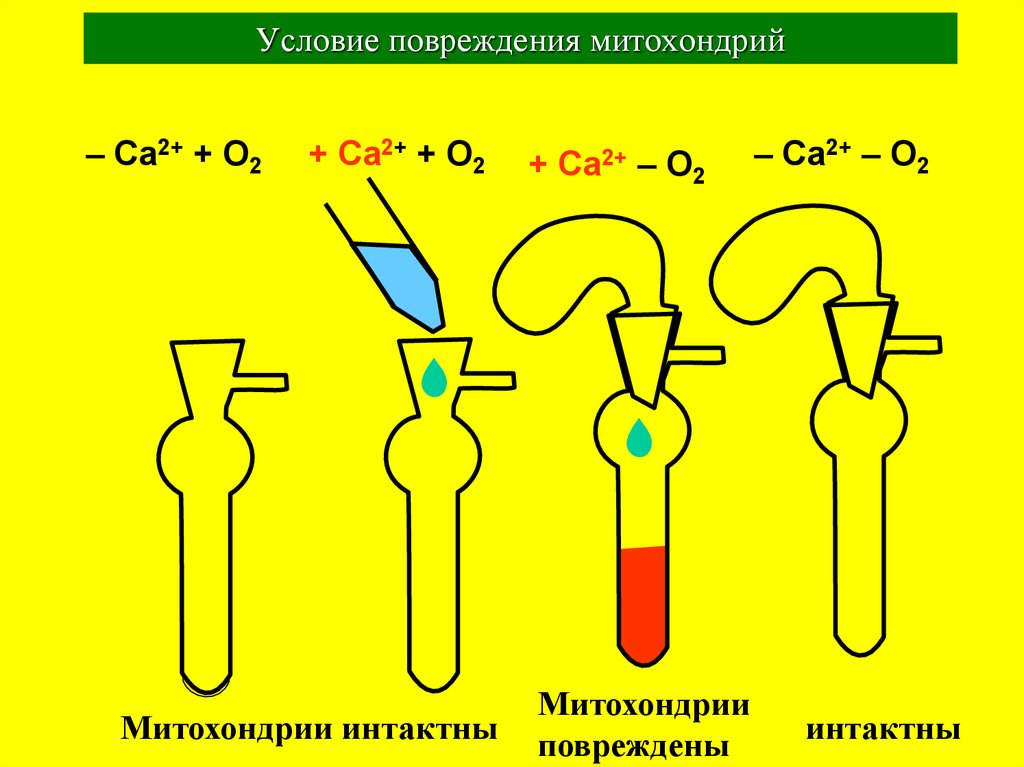
32. Условие повреждения митохондрий
– Ca2+ + O2+ Ca2+ + O2
Митохондрии интактны
+
Ca2+
– O2
Митохондрии
повреждены
– Ca2+ – O2
интактны
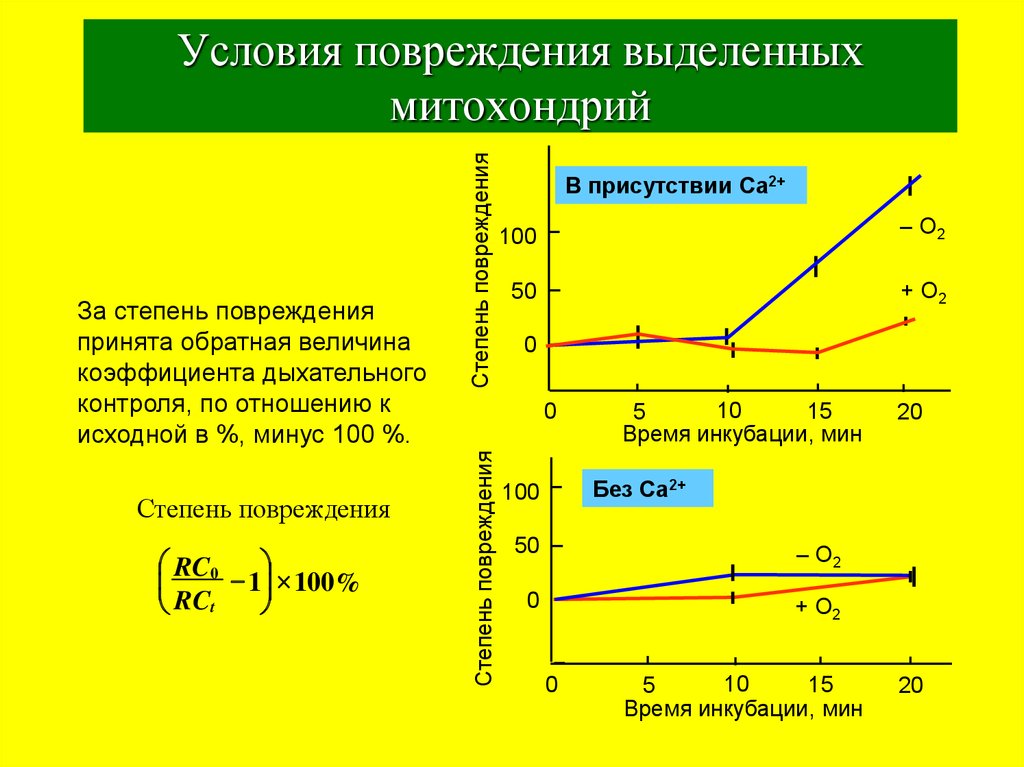
33. Условия повреждения выделенных митохондрий
Степень поврежденияRC0
- 1 100%
RCt
В присутствии Ca2+
100
– O2
50
+ O2
0
0
Степень повреждения
За степень повреждения
принята обратная величина
коэффициента дыхательного
контроля, по отношению к
исходной в %, минус 100 %.
Степень повреждения
Условия повреждения выделенных
митохондрий
10
15
5
Время инкубации, мин
20
Без Ca2+
100
50
– O2
0
+ O2
0
10
15
5
Время инкубации, мин
20
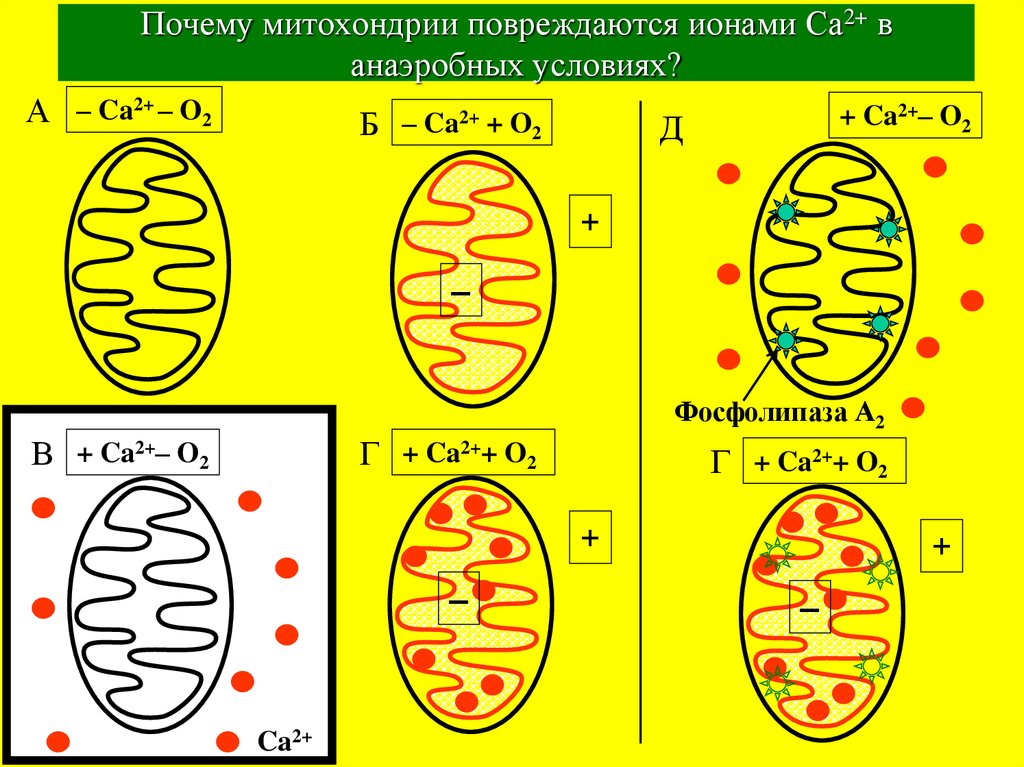
34. Почему митохондрии повреждаются ионами Са2+ в анаэробных условиях?
А – Ca2+ – O2Б – Ca2+ + O2
+ Ca2+– O2
Д
+
–
Фосфолипаза А2
В + Ca2+– O2
Г + Ca2++ O2
Г + Ca2++ O2
+
–
Ca2+
+
–
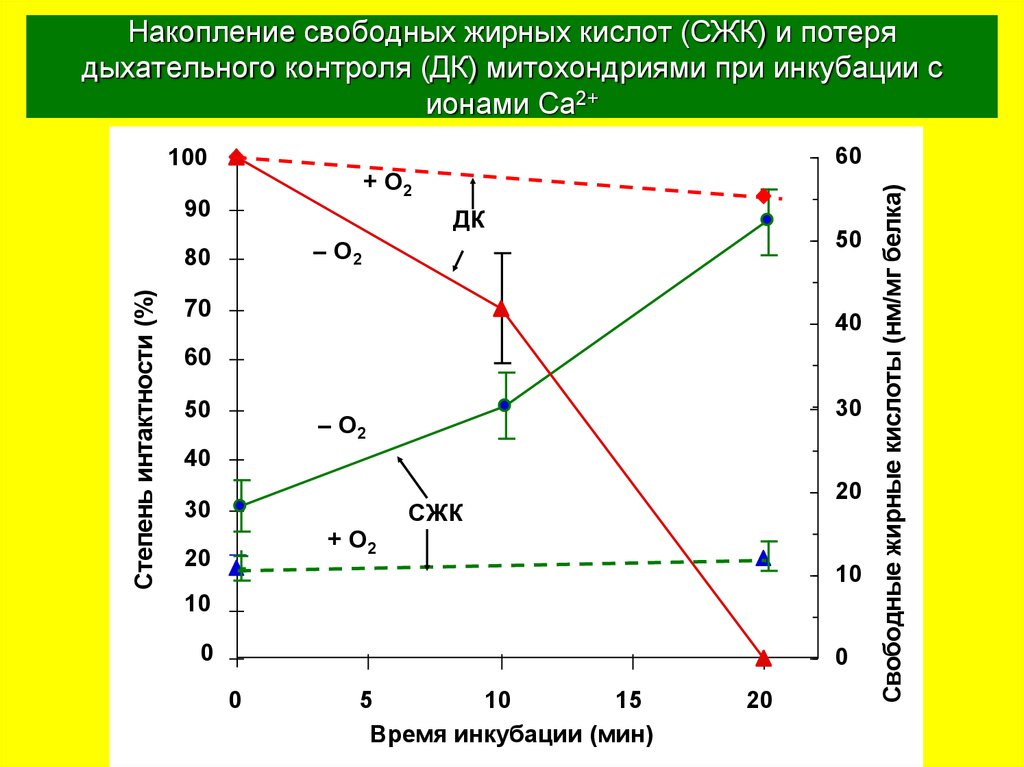
35. Накопление свободных жирных кислот (СЖК) и потеря дыхательного контроля (ДК) митохондриями при инкубации с ионами Ca2+
+ O290
ДК
Степень интактности (%)
50
– O2
80
70
40
60
50
30
– O2
40
20
СЖК
30
+ O2
20
10
10
0
0
0
5
10
15
Время инкубации (мин)
20
Свободные жирные кислоты (нм/мг белка)
60
100
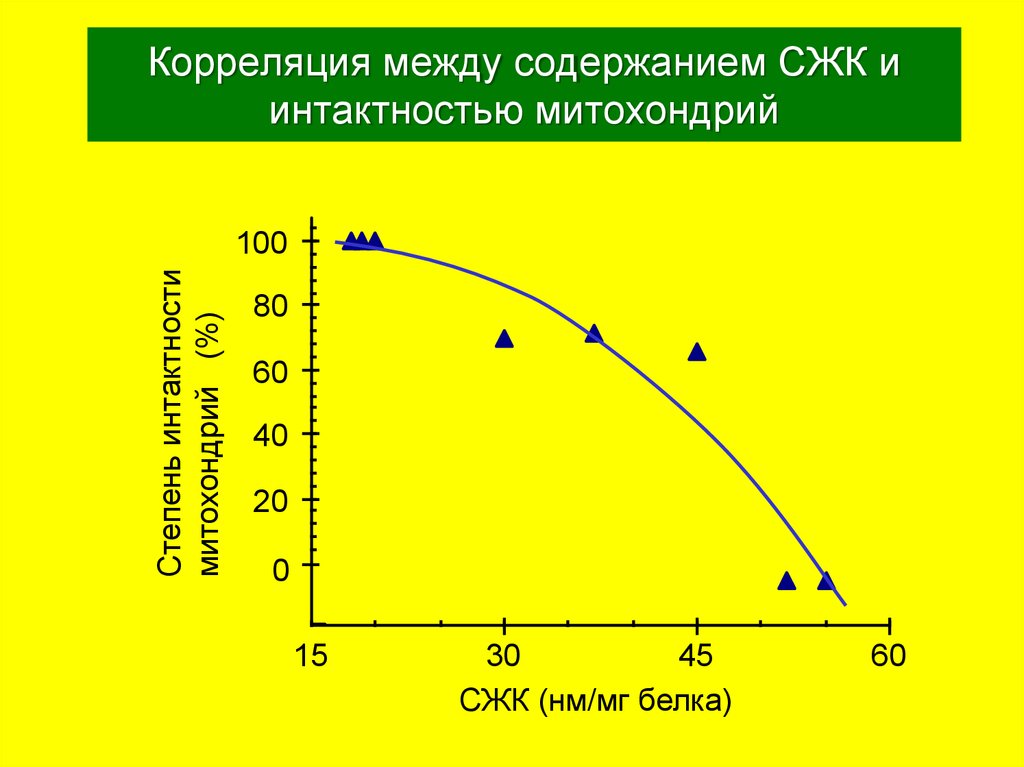
36. Корреляция между содержанием СЖК и интактностью митохондрий
Степень интактностимитохондрий (%)
100
80
60
40
20
0
15
30
45
СЖК (нм/мг белка)
60
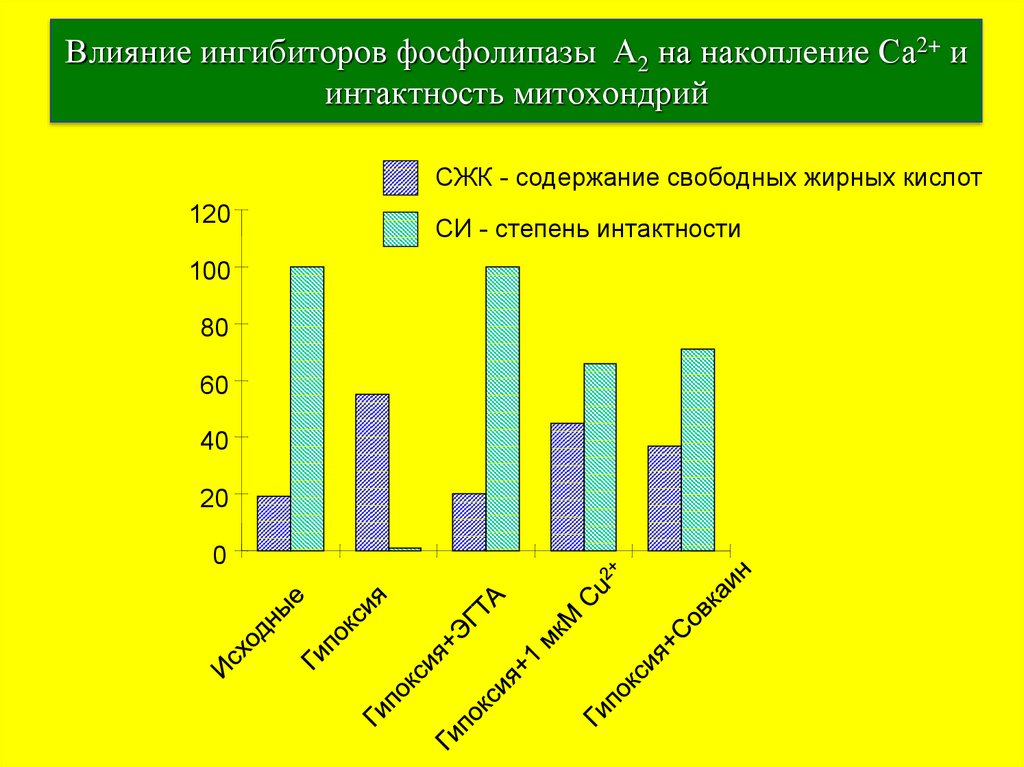
37. Влияние ингибиторов фосфолипазы А2 на накопление Ca2+ и интактность митохондрий
СЖК - содержание свободных жирных кислот120
100
80
60
40
20
0
СИ - степень интактности
38. Порочный круг клеточной патологии
Увеличение внутриклеточного содержания кальция и нарушениебиоэнергетических функций митохондрий являются общими признаками
для клеток, поврежденных в результате действия самых различных
неблагоприятных факторов. Эти два события – не простое следствие
других изменений в поврежденных клетках: они лежат в основе
нарушения функций поврежденных клеток и могут рассматриваться как
главные звенья в цепи событий, приводящих к развитию
неспецифической реакции клеток на повреждение.
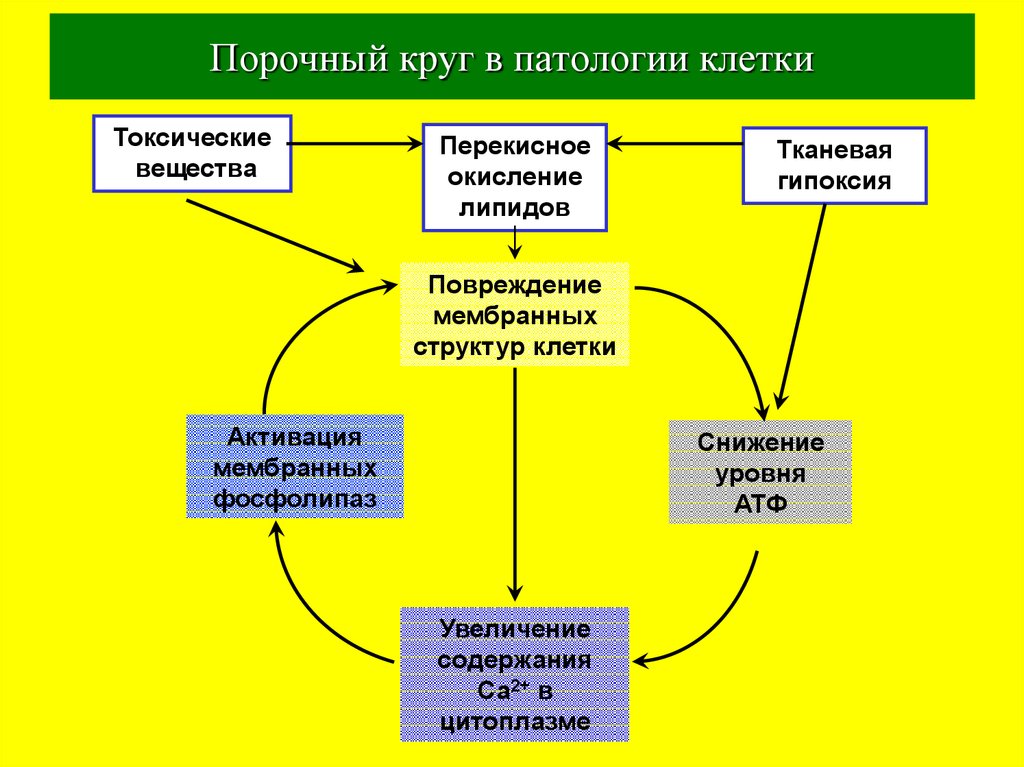
39. Порочный круг в патологии клетки
Токсическиевещества
Перекисное
окисление
липидов
Тканевая
гипоксия
Повреждение
мембранных
структур клетки
Активация
мембранных
фосфолипаз
Снижение
уровня
АТФ
Увеличение
содержания
Са2+ в
цитоплазме









 Биология
Биология