Похожие презентации:
Иммуноглобулины. Антитела
1. иммуноглобулины
2.
Одной из форм реагирования иммунной системы вответ на внедрение в организм антигена является
биосинтез
антител
—
белков,
специфически
реагирующих с антигенами. Антитела, также как и
фагоцитоз, — это одна из наиболее филогенетически
древних форм иммунной защиты. Антительный
ответ обнаруживается уже у некоторых видов рыб
3.
Антитела относятсяк γ-глобулиновой фракции
белков сыворотки крови. На долю γ-глобулинов
приходится
15-25
%
белкового
содержания
сыворотки крови, что составляет примерно 10-20
г/л.
Поэтому
антитела
получили
название
иммуноглобулинов, и их обозначают символом Ig.
4.
Антитела – это γ-глобулины, вырабатываемые вответ
на
введение
специфически
участвовать
антигена,
связываться
во
многих
с
способные
антигеном
и
иммунологических
реакциях.
Антитела синтезируются В-лимфоцитами и их
потомками – плазматическими клетками.
5.
Иммуноглобулины существуютв циркулирующей форме,
в
виде
рецепторных
иммунокомпетентных клетках
молекул
на
миеломных белков.
Циркулирующие антитела подразделяются
сывороточные и секреторные.
на
К антителам могут быть также отнесены белки
Бенс-Джонса, которые являются фрагментами
молекулы Ig (его легкая цепь) и синтезируются в
избытке при миеломной болезни.
6.
Иммуноглобулины являются гликопротеидами.Мономеры иммуноглобулинов состоят из двух
тяжелых (Н-цепи) и двух легких (L-цепи)
полипептидных цепей, связанных дисульфидной
связью.
Между тяжелыми цепями также есть дисульфидная
связь. Это так называемый «шарнирный участок».
Такой тип межпептидного соединения придает
структуре молекулы динамичность — он позволяет
легко менять конформацию в зависимости от
окружающих условий и состояния.
7.
Легкие цепи бывают 2 типов: κ и λ (каппа илямбда).
Тяжелых цепей известно 5 типов: α, γ, μ, ε и δ
(альфа, гамма, мю, эпсилон и дельта), — которые
имеют также и внутреннее подразделение. Среди
многообразия цепей α-типа выделяют αl- и α2подтипы, а μ-цепей— μ1- и μ2-. Для γ-цепи
известны 4 подтипа: γl-, γ2-, γ3- и γ4-.
8.
Папаин расщепляет молекулу иммуноглобулинана
два
одинаковых
антигенсвязывающих
фрагмента— Fab (Fragment antigen binding) и Fc
(Fragment cristallizable).
Антигенсвязывающий участок (активный центр
антител)
Fab-фрагмента
иммуноглобулина,
образован гипервариабельными участками Н- и
L-цепей; он связывает эпитопы антигена. В
активном
центре
имеются
специфичные
комплементарные участки к определенным
антигенным эпитопам. Fc-фрагмент связывает
комплемент (при образовании комплекса антигенантитело), взаимодействует с мембранами клеток и
участвует в переносе IgG через плаценту.
9.
Компактныеструктуры
антител,
скрепленные
дисульфидной
связью
называются доменами. Так, в IgG различают:
вариабельные V-домены легких (VL) и тяжелых
(VH) цепей, расположенные в N-концевой части
Fab-фрагмента;
С-домены константных участков легких цепей
(CL);
С-домены константных участков тяжелых цепей
(CHI, CH2, СНЗ).
В
СН2-домене
комплементсвязывающий участок.
находится
10.
В зависимости от особенностей молекулярногостроения
тяжелой
цепи
(т.
е.
наличия
изотопических,
или
групповых
антигенных
детерминант) различают 5 классов, или изотипов
Ig.
Молекулы, содержащие тяжелую цепь α-типа,
относят к изотипу А (сокращенно IgA);
IgD обладает δ -цепью,
IgE— ε-цепью,
IgG— γ-цепью
IgM — μ-цепью.
Соответственно особенностям строения подтипов
тяжелых цепей различают и подклассы Ig.
11.
12.
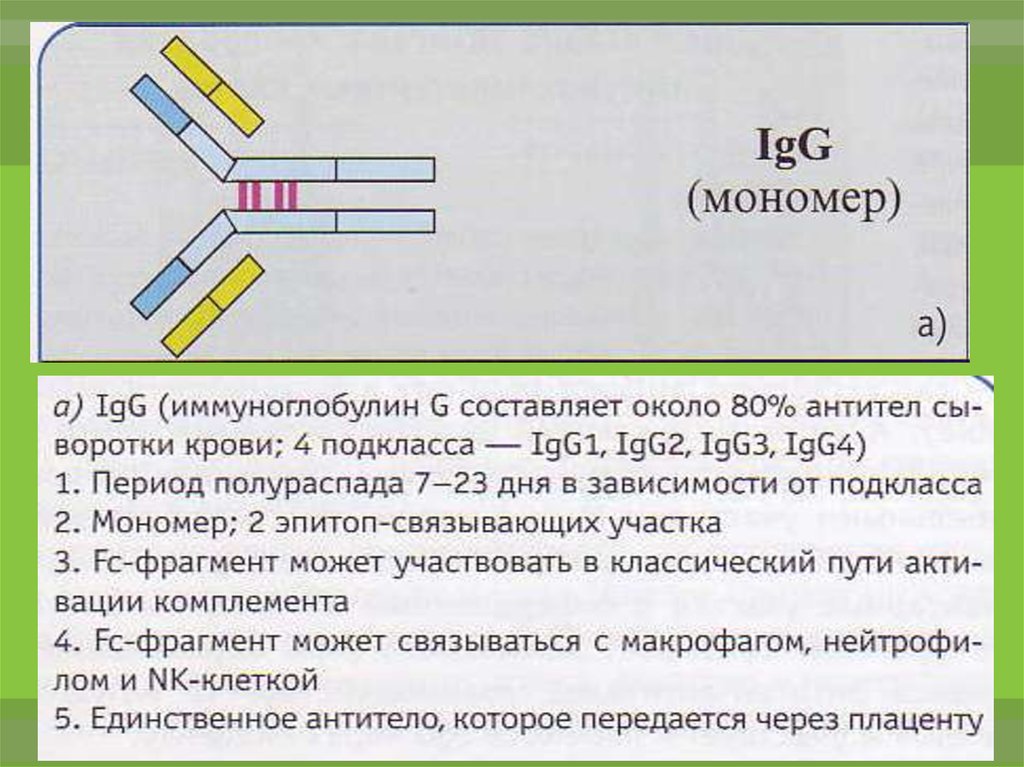
IgG обеспечиваетнейтрализацию,
опсонизацию и маркирование антигена
осуществляет запуск комплементопосредованного
цитолиза
антителозависимой
цитотоксичности.
И
клеточно-опосредованной
13.
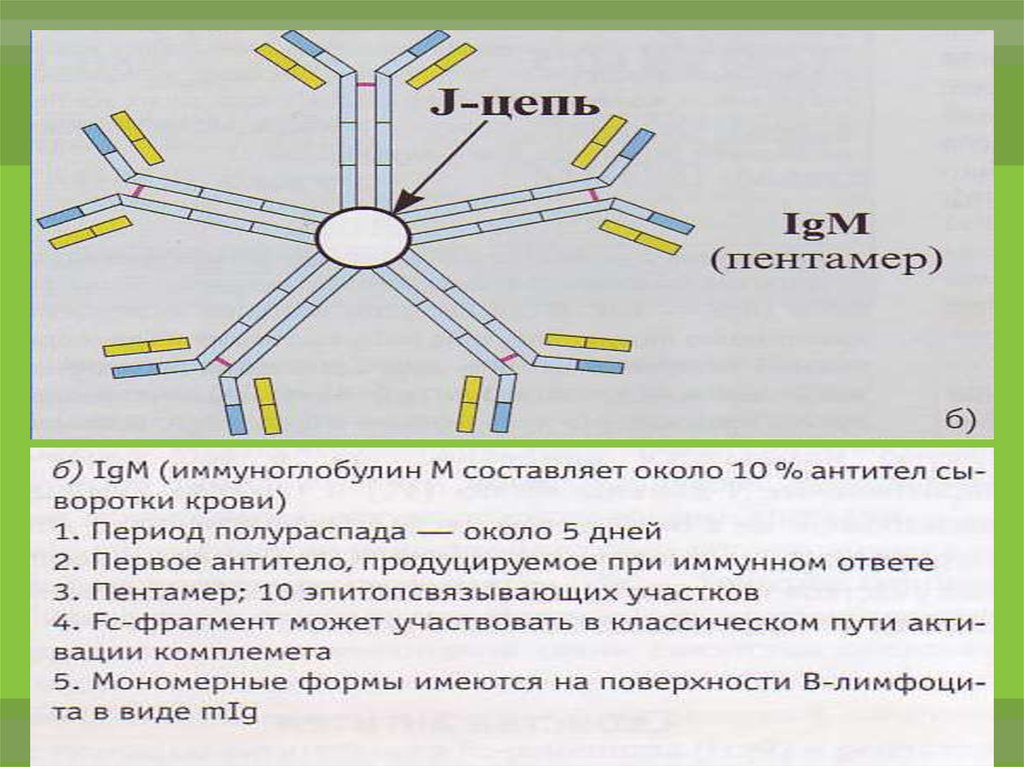
14.
IgM не проходит через плаценту. Обнаружениеспецифических антител изотипа М в сыворотке
крови
новорожденного
указывает
на
бывшую
внутриутробную инфекцию или дефект плаценты.
IgM обеспечивает нейтрализацию, опсонизацию и
маркирование
антигена,
осуществляет
комплемент-опосредованного
антителозависимой
цитотоксичности.
цитолиза
запуск
и
клеточноопосредованной
15.
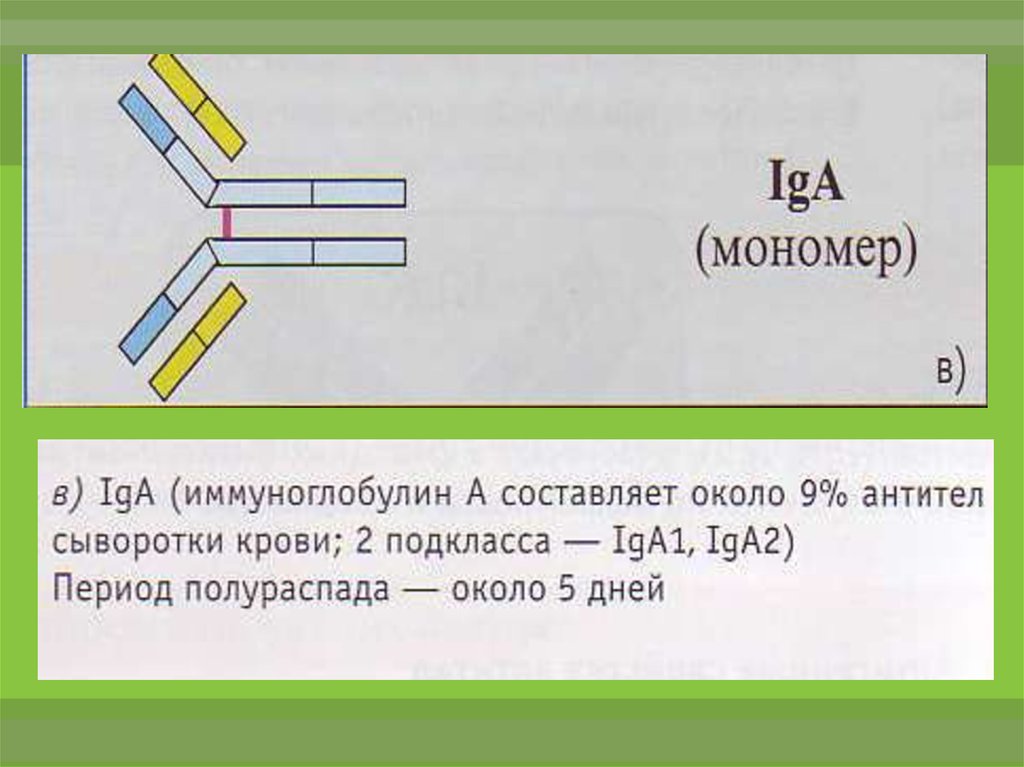
16.
Различают подтипы А1 и А2 IgA. Синтезируетсязрелыми В-лимфоцитами (Вα) и плазматическими
клетками. Хорошо определяется в сыворотке
крови на пике первичного и при вторичном
иммунном ответе.
Обладает высокой аффинностью. Может быть
неполным антителом. Не связывает комплемент.
Не проходит через плацентарный барьер.
IgA обеспечивает нейтрализацию, опсонизацию и
маркирование антигена, осуществляет запуск
антителозависимой
клеточно-опосредованной
цитотоксичности.
17.
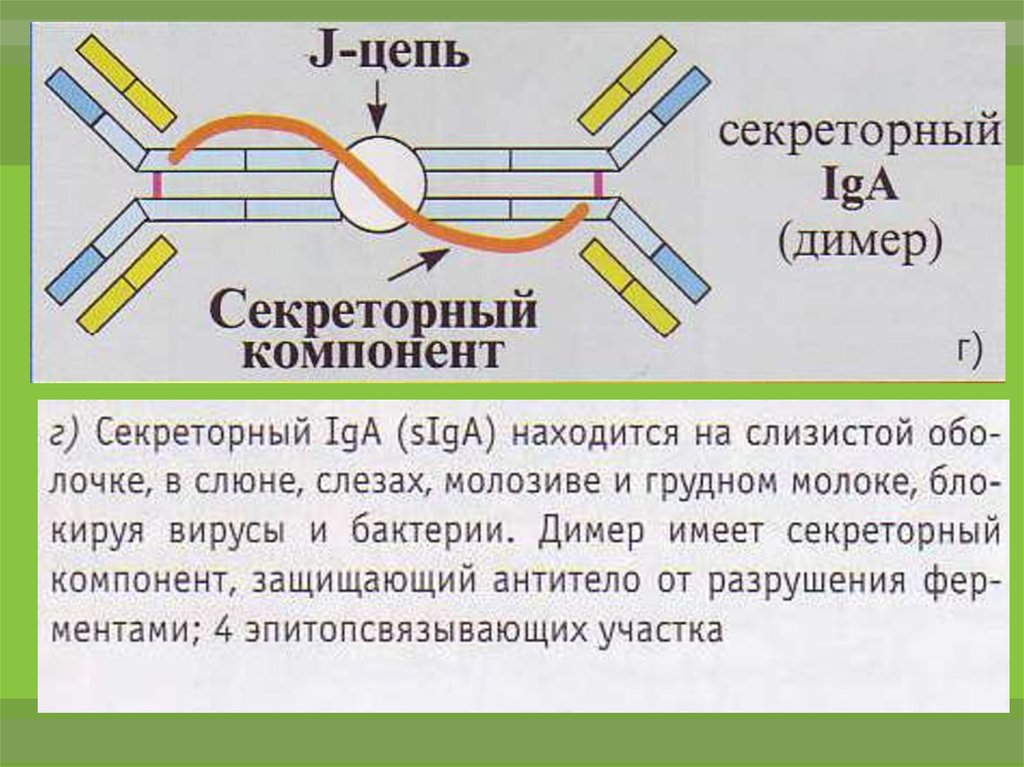
18.
Секреторная форма IgA — основной факторспецифического гуморального местного иммунитета
слизистых оболочек желудочно-кишечного тракта,
мочеполовой системы и респираторного тракта.
Благодаря S-цепи он устойчив к действию протеаз.
IgA не
активирует
комплемент,
но
эффективно
связывается с антигенами и нейтрализует их. Он
препятствует адгезии микробов на эпителиальных
клетках
и
слизистых.
генерализации
инфекции
в
пределах
19.
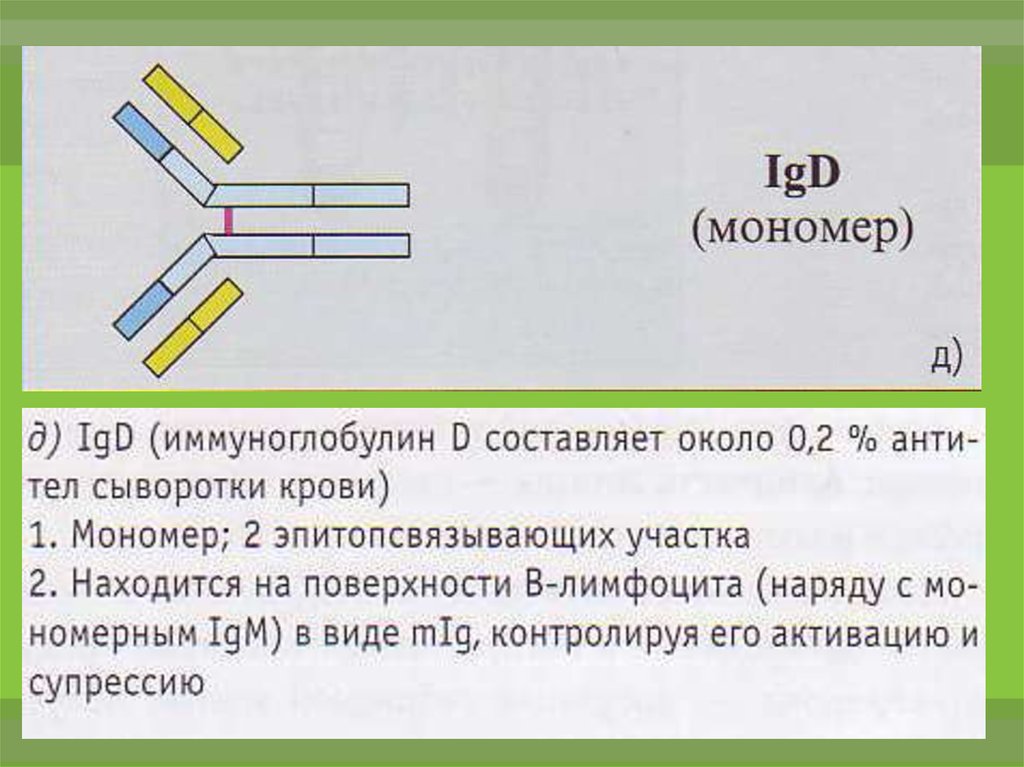
20.
IgD не связывает комплемент. Не проходитчерез
плацентарный
рецептором
лимфоцитов.
барьер.
предшественников
Является
В-
21.
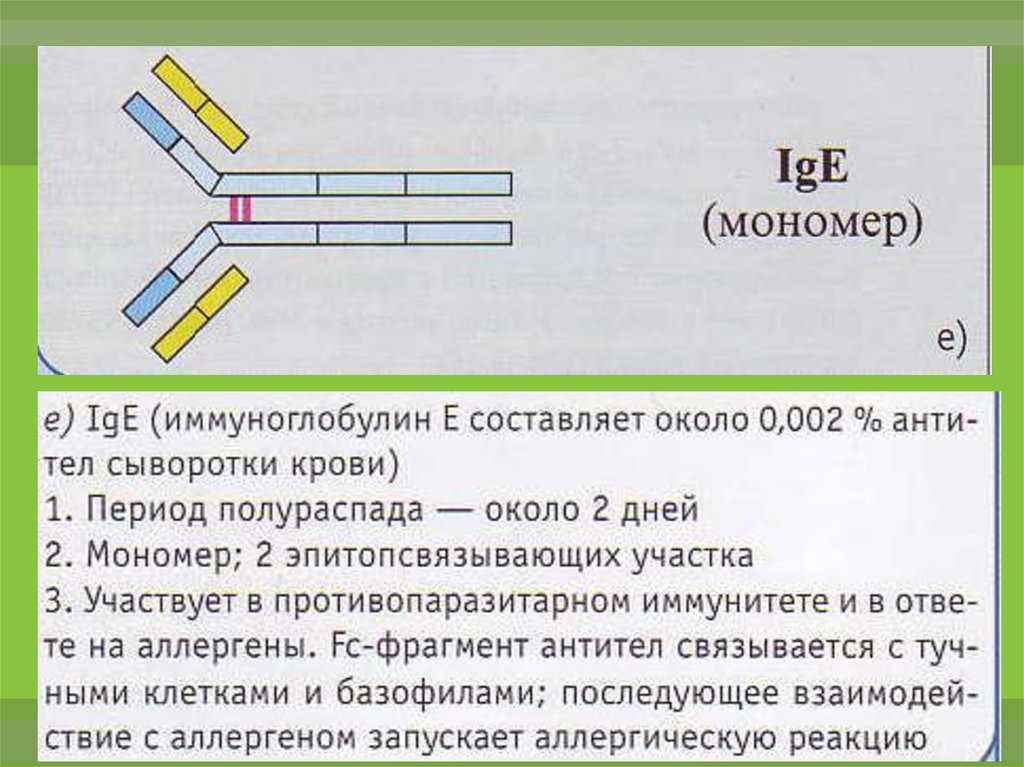
22.
IgЕ синтезируется зрелыми В-лимфоцитами (Вε)и плазматическими клетками преимущественно в
лимфоидной ткани бронхолегочного дерева и
ЖКТ.
Не связывает комплемент.
Не проходит через плацентарный барьер.
Обладает выраженной цитофильностью —
тропностью к тучным клеткам и базофилам.
Участвует в развитии гиперчувствительности
немедленного типа — реакция I типа
23. Рецепторные иммуноглобулины.
Рецепторные, или мембраные Ig, локализуются нацитоплазматической
мембране
В-лимфоцитов.
Выполняют
функции
антигенспецифических
рецепторов.
Рецепторные Ig имеют те же изотип
специфичность,
что
и
синтезируемые
межклеточную среду антитела.
и
в
Структурное отличие от секретируемых антител
заключается в особом, дополнительном М-пептиде,
благодаря которому молекула рецепторного Ig
фиксируется в цитоплазматической мембране
иммунокомпетентной клетки.
24. Антигенность антител
Иммуноглобулин, как и всякий белок, обладаетантигеностью и выраженной иммуногенностью.
В молекуле Ig различают 4 типа атигенных
детерминант:
видовые,
изотипические,
идиотипические,
аллотипические.
25.
Видовые антигенные детерминанты характерныдля Ig всех особей данного вида (например,
кролика, собаки, человека). Они определяются
строением легкой и тяжелой цепи. По этим
детерминантам можно идентифицировать видовую
принадлежность антител.
26.
Изотипическиеантигенные
являются групповыми.
детерминанты
Они локализуются в тяжелой цепи
и служат для дифференцировки семейства Ig на 5
изотипов (классов) и множество подклассов
27.
Аллотипическиеантигенные
детерминанты
являются индивидуальными, т. е. присущими
конкретному организму.
Они располагаются
полипептидных цепях.
в
легкой
и
тяжелой
На
основании
строения
аллотипических
детерминант можно различать особи внутри одного
вида.
28.
Идиотипическиеантигеннные
детерминанты
отражают
особенности
строения
антигенсвязывающего центра самой молекулы Ig. Они
образованы V-доменами легкой и тяжелой цепи
молекулы
Ig.
Обнаружение
идиотипических
антигенных детерминант послужило основанием для
создания теории «идиотип-антиидиотипической»
регуляции биосинтеза антител.
29. Механизм взаимодействия антитела с антигеном
В процессе взаимодействия с антигеном принимаетучастие не вся молекула Ig, а лишь ее ограниченный
участок — антигенсвязывающий центр, или
паратоп, который локализован в Fab-фрагменте
молекулы Ig.
Co своей стороны, антитело взаимодействует не со
всей молекулой антигена сразу, а лишь с ее антигенной
детерминантой.
30.
Антителаотличает
специфичность
взаимодействия, т. е. способность связываться со
строго определенной антигенной детерминантой.
Наиболее доступные для взаимодействия эпитопы
располагаются на поверхности молекулы антигена.
31.
Связь антигена с антителом осуществляется за счетслабых взаимодействий (Ван-дер-ваальсовы силы,
водородные
связи,
электростатические
взаимодействия) в пределах антигенсвязывающего
центра.
Такая связь отличается неустойчивостью —
образовавшийся иммунный комплекс (ИК) может
легко диссоциировать на составляющие его
компоненты.
Поэтому взаимодействие антигена и антитела может
быть представлено в виде уравнения:
[AГ] + [AT]
[ИК].
32.
Продолжительность существования иммунногокомплекса определяется целым рядом факторов.
При этом важное значение имеют особенности
антитела, антигена и условия, в которых происходит
их взаимодействие.
К особенностям антитела следует отнести его
аффинность и авидность.
33.
Аффинность—
сила
специфического
взаимодействия антитела с антигеном (или энергия
их связи). Эта характеристика зависит от степени
стерического, или пространственного, соответствия
(комплементарности)
структуры
антигенсвязывающего
центра
и
антигенной
детерминанты.
Чем выше их комплементарность, т. е. чем больше
они подходят друг другу, тем больше образуется
межмолекулярных связей и тем выше будет
устойчивость
и
продолжительность
жизни
образовавшегося иммунного комплекса.
34.
Структурныенесоответствия
антигенсвязывающего
центра
и
антигенной
детерминанты
существенно
снижают
число
образующихся связей и прочность взаимодействия
антитела с антигеном.
Иммунный
комплекс,
образованный
низкоаффинными
антителами,
чрезвычайно
неустойчив, имеет малую продолжительность
существования и быстро распадается на исходные
компоненты.
35.
Под термином «авидность» понимаютпрочность связывания антитела и антигена. Эта
характеристика определяется аффинностью Ig и
числом антигенсвязывающих центров.
При равной степени аффинности наибольшей
авидностью обладают антитела класса М, так
как они имеют 10 антигенсвязывающих
центров.
36.
Особенности антигена также влияютна эффективность его взаимодействия с
антителом. Важное значение имеют
стерическая
(пространственная)
доступность антигенной детерминанты
для
антигенсвязывающего
центра
молекулы Ig и число эпитопов в составе
молекулы антигена.
37.
Эффективность взаимодействия антитела сантигеном существенно зависит от условий, в
которых происходит реакция, и прежде всего от рН
среды, осмотической плотности, солевого состава
и температуры среды. Оптимальными для реакции
антиген—антитело
являются
физиологические
условия внутренней среды макроорганизма: близкая
к нейтральной реакция среды, присутствие фосфат-,
карбонат-, хлорид- и ацетат-ионов, осмолярность
физиологического раствора (концентрация раствора
0,15 М), а также температура (36—37 °С).
































 Медицина
Медицина








