Похожие презентации:
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
1. Лекция № 2. Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений.
2.
Типы реакций и реагентовРеакционная способность вещества способность его вступать в ту или иную
химическую реакцию и реагировать с меньшей или
большей скоростью.
3.
Реакционный центр - атом или группа атомов,непосредственно участвующие в данной
реакции.
4.
Типы реагентов и характер изменениясвязей в субстрате.
1.
Радикальные реагенты (R - radical)
- свободные атомы или частицы с
неспаренным электроном
5.
2. Электрофильные реагенты(электрофилы) , Е+ или Е (electrophile)
- частицы, образующие новую ковалентную
связь за счет электронной пары реакционного
партнера.
+ заряженные
частицы
δ
, SO3
!
Акцепторы
электронов
электронейтральные
частицы с дробным + зарядом
6.
3.Кислотные реагенты (кислоты)
- нейтральные молекулы (CH3COOH, HCl)
либо положительно заряженные частицы
(NH4+, H3O+), способные быть донором
протона для реакционного партнера.
7.
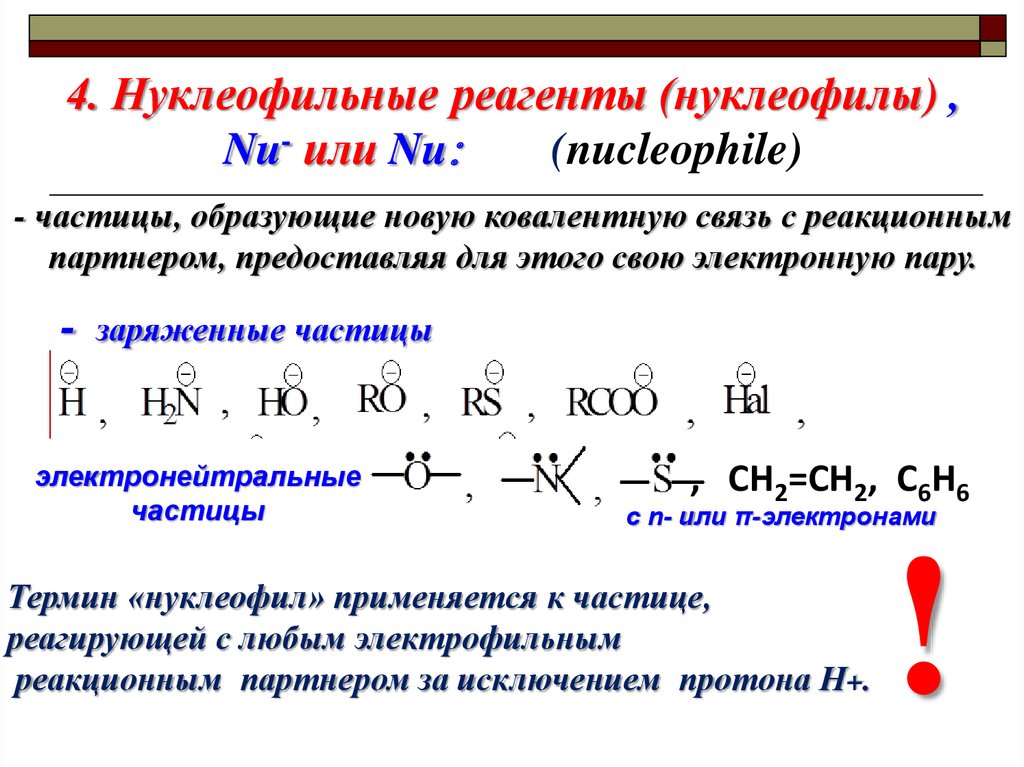
4. Нуклеофильные реагенты (нуклеофилы) ,Nu- или Nu
(nucleophile)
- частицы, образующие новую ковалентную связь с реакционным
партнером, предоставляя для этого свою электронную пару.
-
заряженные частицы
электронейтральные
частицы
, CH2=CH2, C6H6
с n- или π-электронами
Термин «нуклеофил» применяется к частице,
реагирующей с любым электрофильным
реакционным партнером за исключением протона Н+.
!
8.
5. Основные реагенты (основания),B- или B: (base)
- отрицательно заряженные частицы (НО- ,
RO-) или нейтральные молекулы (:NH3, H2O:),
способные оторвать протон от кислотного
реакционного центра.
9.
6. Окислители, [O]- нейтральные молекулы или ионы
(O2, Fe3+, органические окислители),
принимающие электроны или атомы Н от
органического субстрата.
10.
7. Восстановители , [H]- нейтральные молекулы или ионы (H2,
Fe2+, H-, органические восстановители),
отдающие электроны или атомы водорода
органическому субстрату.
11.
Типы реакций в соответствии с характером разрывасвязи в субстрате и природой реагента:
1. Радикальные (гомолитические)
реакции ( R)
һν
субстрат
промежуточные частицы
гомолиз
R
12.
2.Ионные (гетеролитические)
реакции
субстрат
гетеролиз
Промежуточные частицы R+ и R-
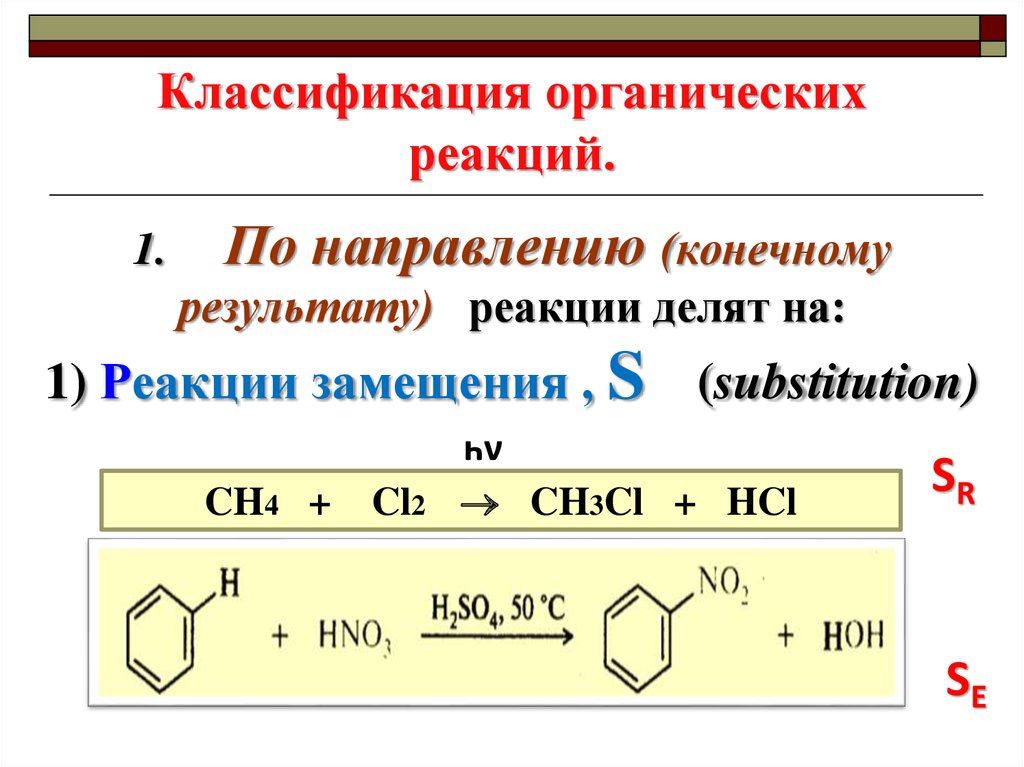
13. Классификация органических реакций.
1.По направлению (конечному
результату) реакции делят на:
1) Реакции замещения , S
CH4 +
Cl2
(substitution)
һν
CH3Cl + HCl
SR
SE
14.
2.Реакции присоединения, Ad (А)
(аddition присоединение):
CH2=CH2 +
Br2 CH2Br CH2Br
AE
ОН-
H2C=O +
HCN H2C(CN)OH
AN
15.
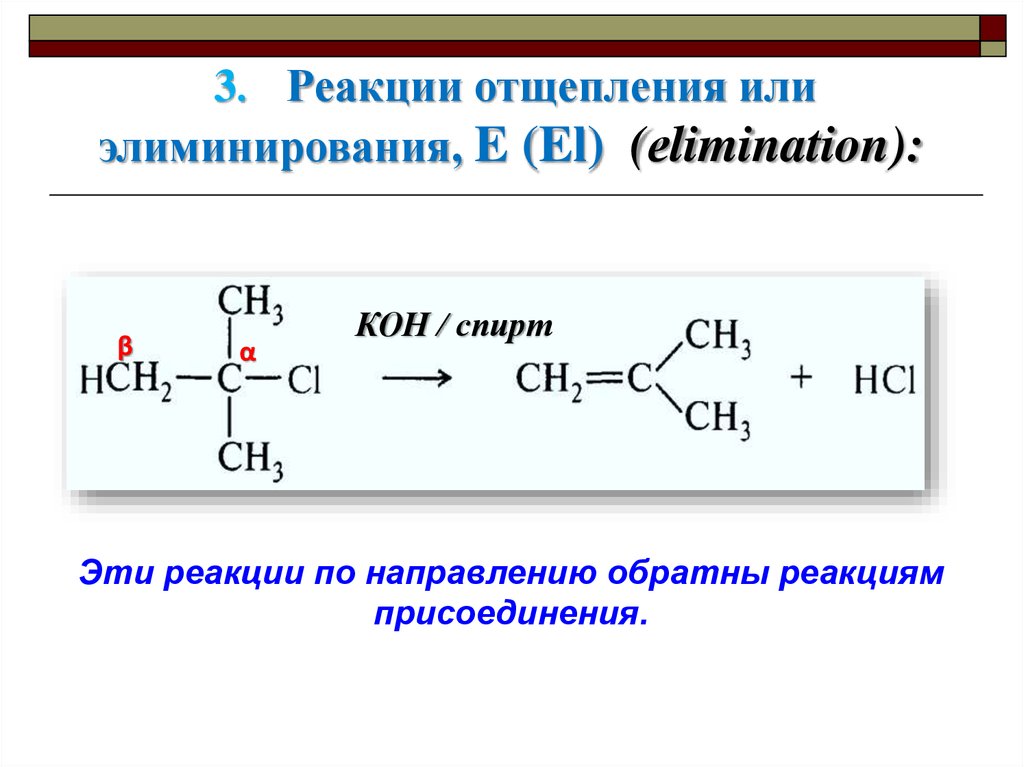
3. Реакции отщепления илиэлиминирования, E (El) (еlimination):
β
α
КОН / спирт
Эти реакции по направлению обратны реакциям
присоединения.
16.
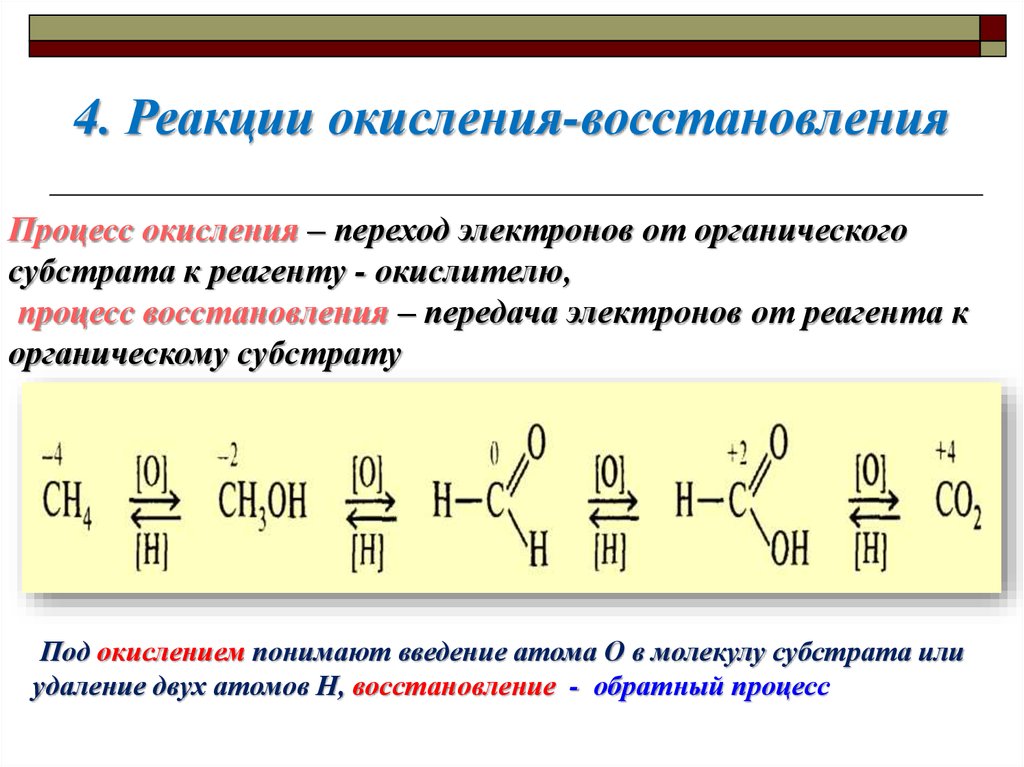
4. Реакции окисления-восстановленияПроцесс окисления – переход электронов от органического
субстрата к реагенту - окислителю,
процесс восстановления – передача электронов от реагента к
органическому субстрату
Под окислением понимают введение атома О в молекулу субстрата или
удаление двух атомов Н, восстановление - обратный процесс
17.
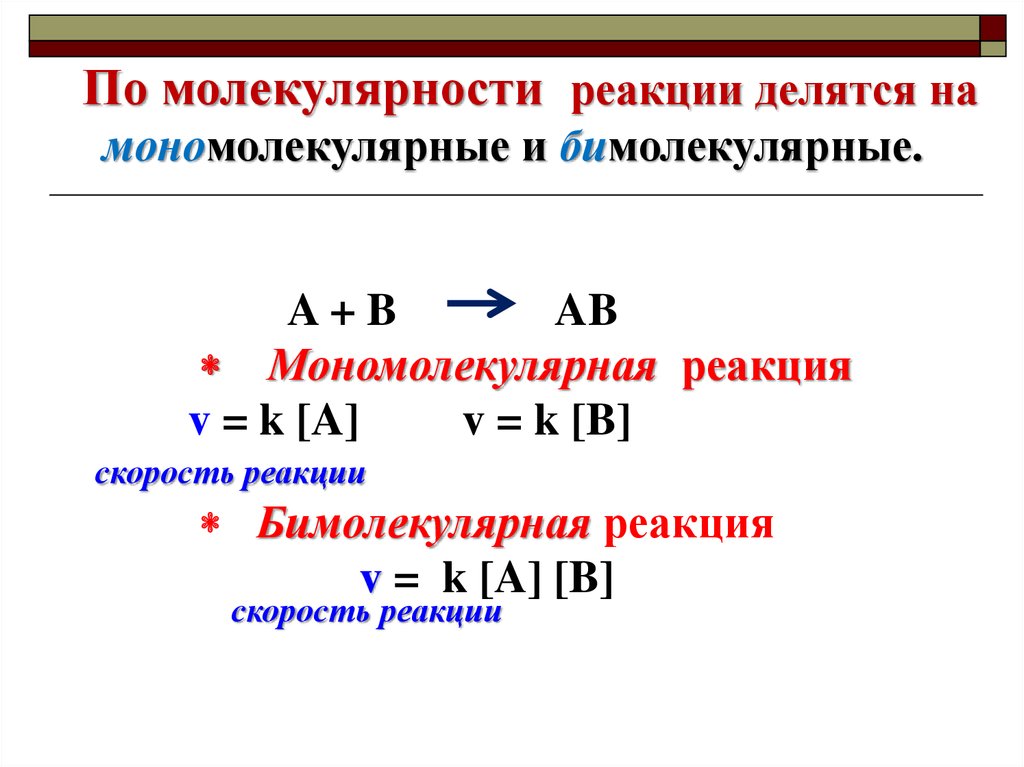
По молекулярности реакции делятся намономолекулярные и бимолекулярные.
A+B
AB
Мономолекулярная реакция
v = k [A]
v = k [B]
скорость реакции
Бимолекулярная реакция
v = k [A] [B]
скорость реакции
18.
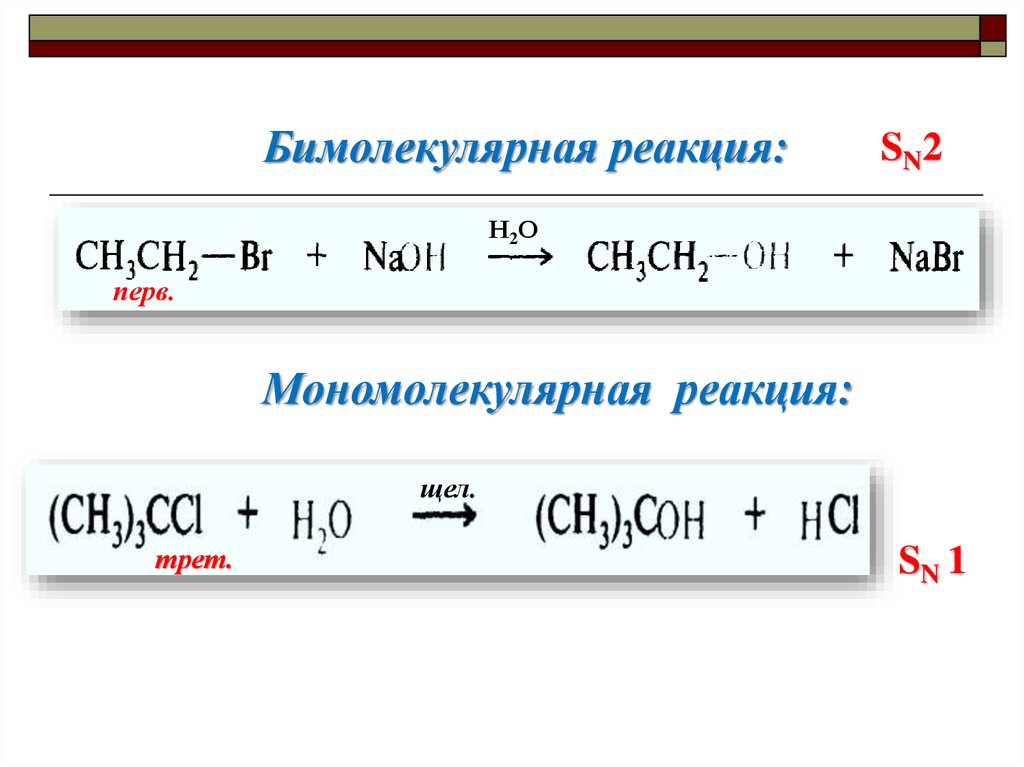
Бимолекулярная реакция:SN2
Н2О
перв.
Мономолекулярная реакция:
щел.
трет.
SN 1
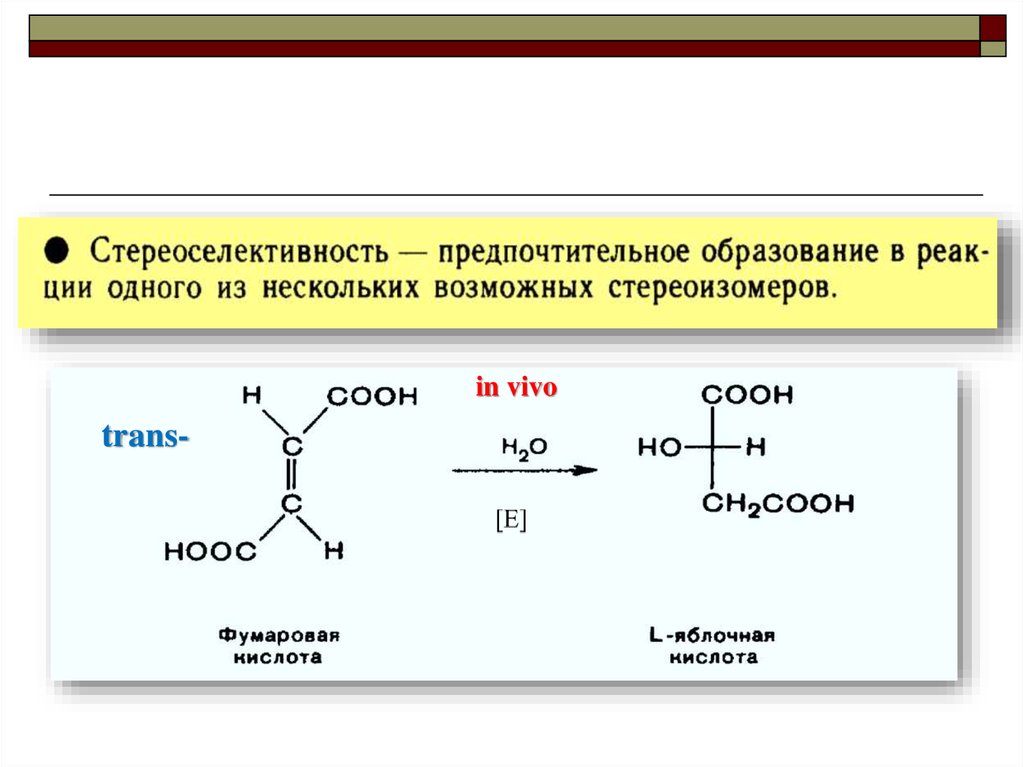
19. Селективность ( избирательность) химических превращений.
22
20.
21.
in vivotrans-
22.
Факторы, определяющие реакционнуюспособность
Карб(o)катионы - замещенные атомы углерода,
имеющие вакантную (незаполненную) орбиталь.
sp2
CH3+
плоское строение
23.
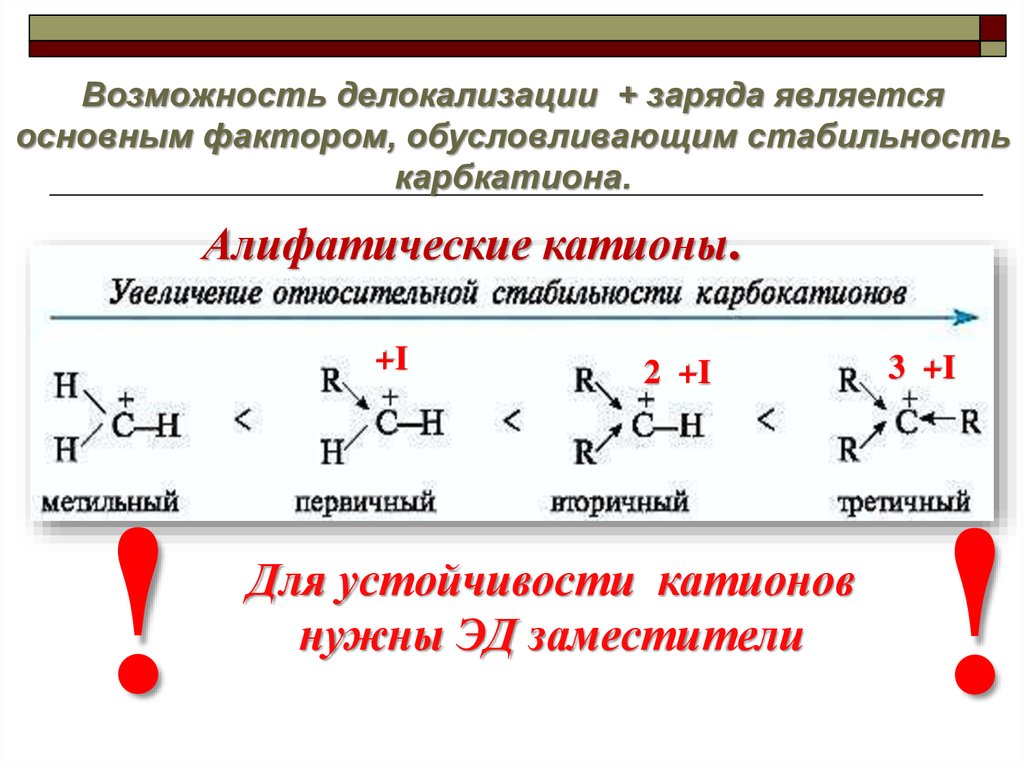
Возможность делокализации + заряда являетсяосновным фактором, обусловливающим стабильность
карбкатиона.
Алифатические катионы.
+I
!
2 +I
Для устойчивости катионов
нужны ЭД заместители
3 +I
!
24.
Аллильный катионСH2=CH CH2
CH2 CH=CH2 или
CH2
CH
CH2
Возможность делокализации заряда увеличивается, когда +
заряженный атом С находится в сопряжении с двойной связью
;
25.
Бензильный катионCH2
CH2
CH2
CH2
CH2
или
.
сопряжение вакантной орбитали атома углерода с
π-электронами ароматического кольца
26.
C spCH2=CH+
Винильный катион
C6H5+
Фенильный катион
C sp
27. Ряд устойчивости катионов:
Бензильный, аллильный > третичный >вторичный > первичный > метильный >
винильный > фенильный
увеличение
стабильности R+
28.
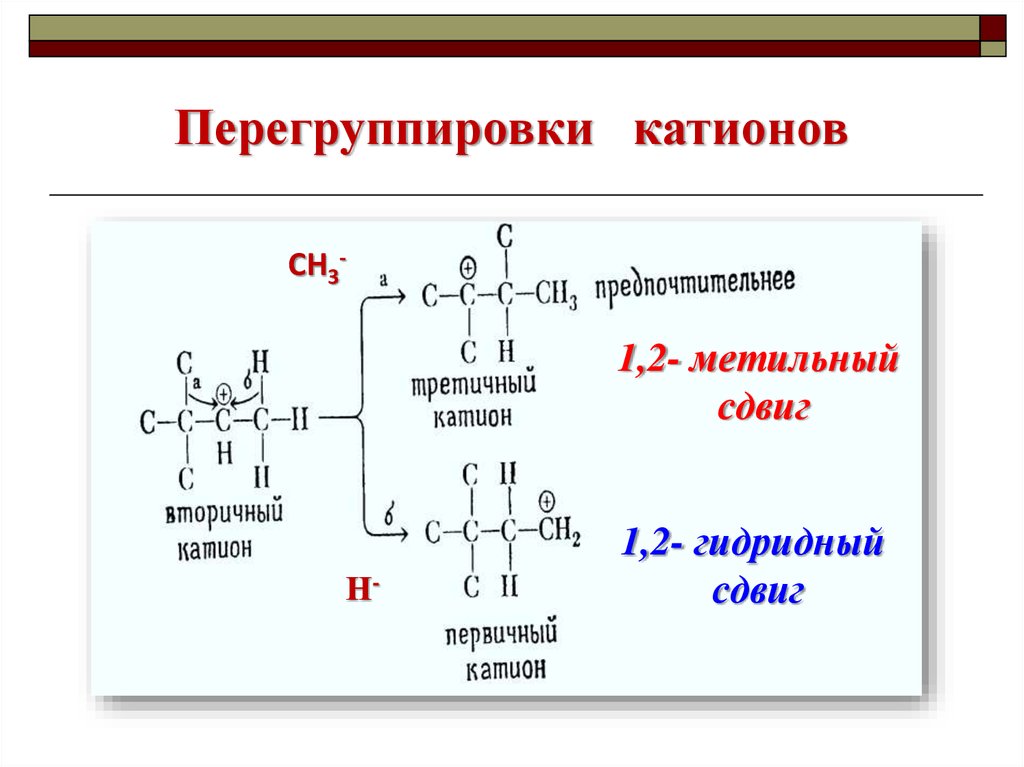
Перегруппировки катионовСН3-
1,2- метильный
сдвиг
Н-
1,2- гидридный
сдвиг
29.
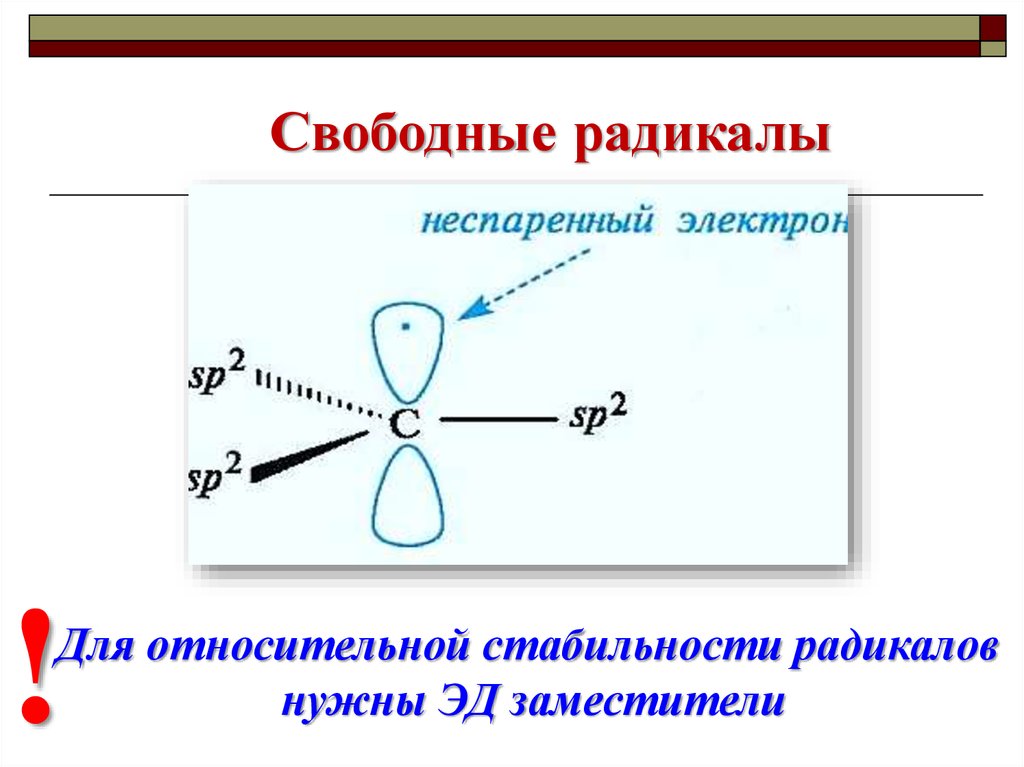
Свободные радикалы!
Для относительной стабильности радикалов
нужны ЭД заместители
30.
Алифатические радикалы3 +I
2 +I
31.
32.
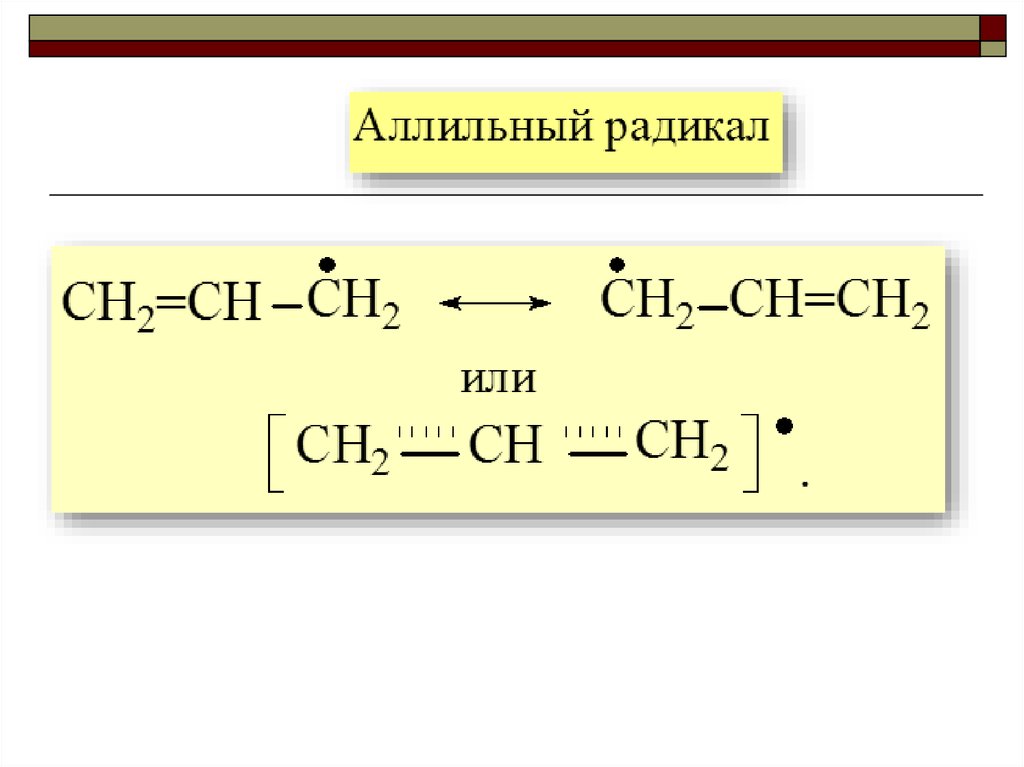
CH2CH2
CH2
CH2
CH2
или
Бензильный радикал
33.
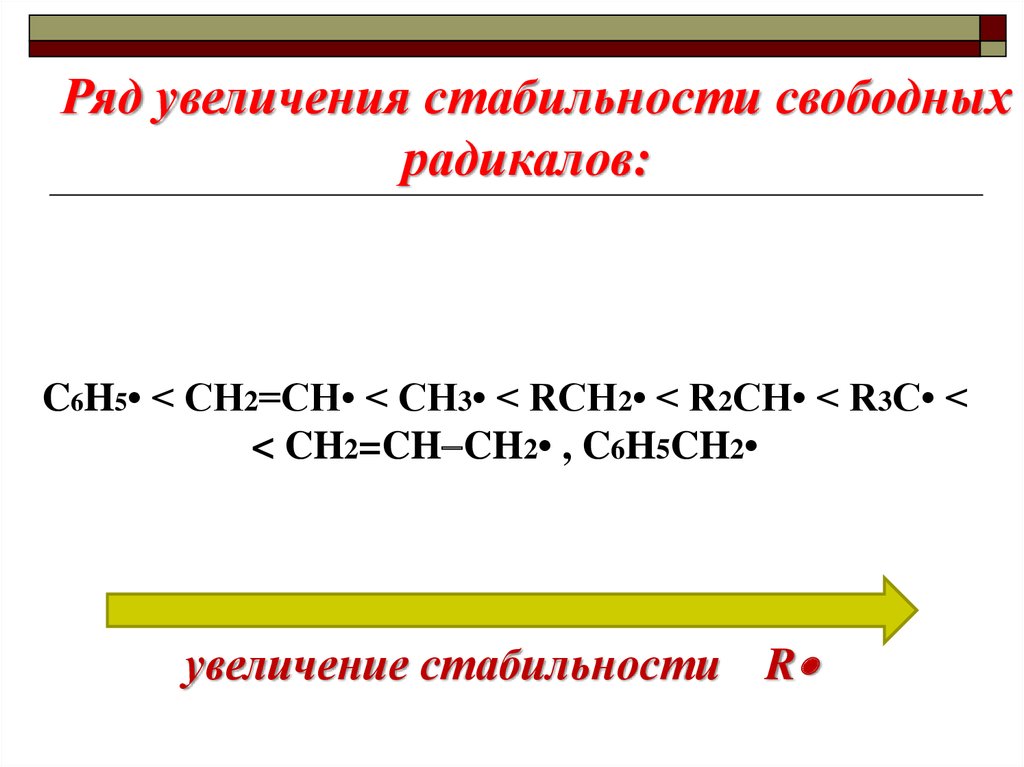
Ряд увеличения стабильности свободныхрадикалов:
C6H5• < CH2=CH• < CH3• < RCH2• < R2CH• < R3C• <
< CH2=CH CH2• , C6H5CH2
увеличение стабильности R
34.
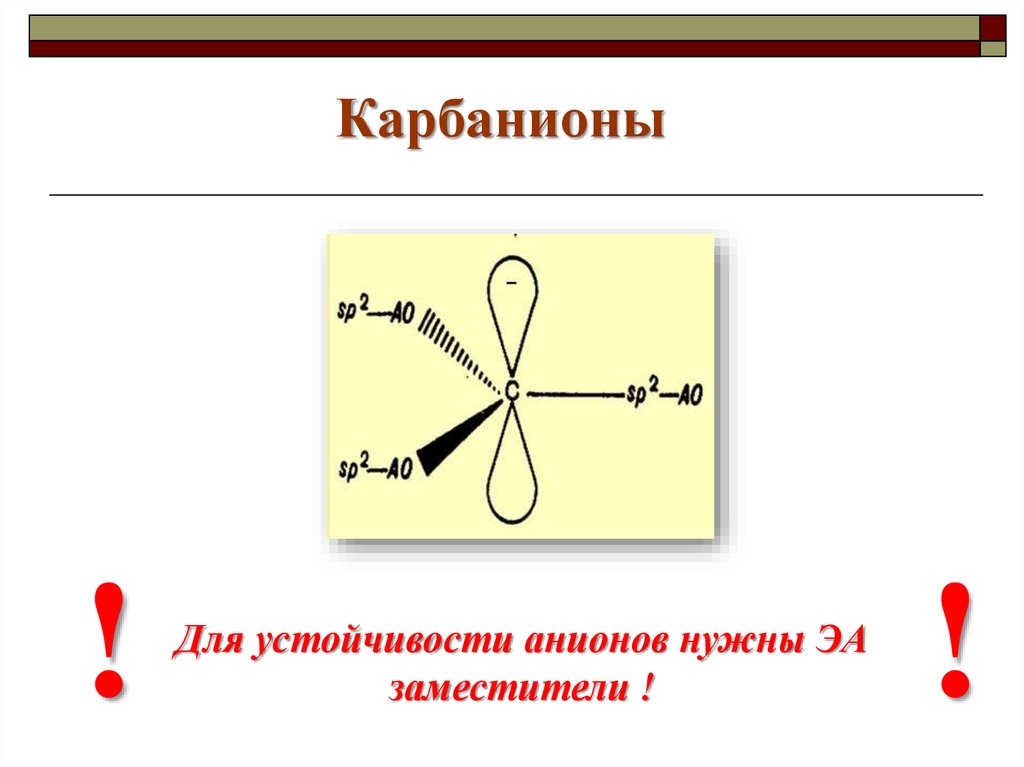
Карбанионы!
Для устойчивости анионов нужны ЭА
заместители !
!
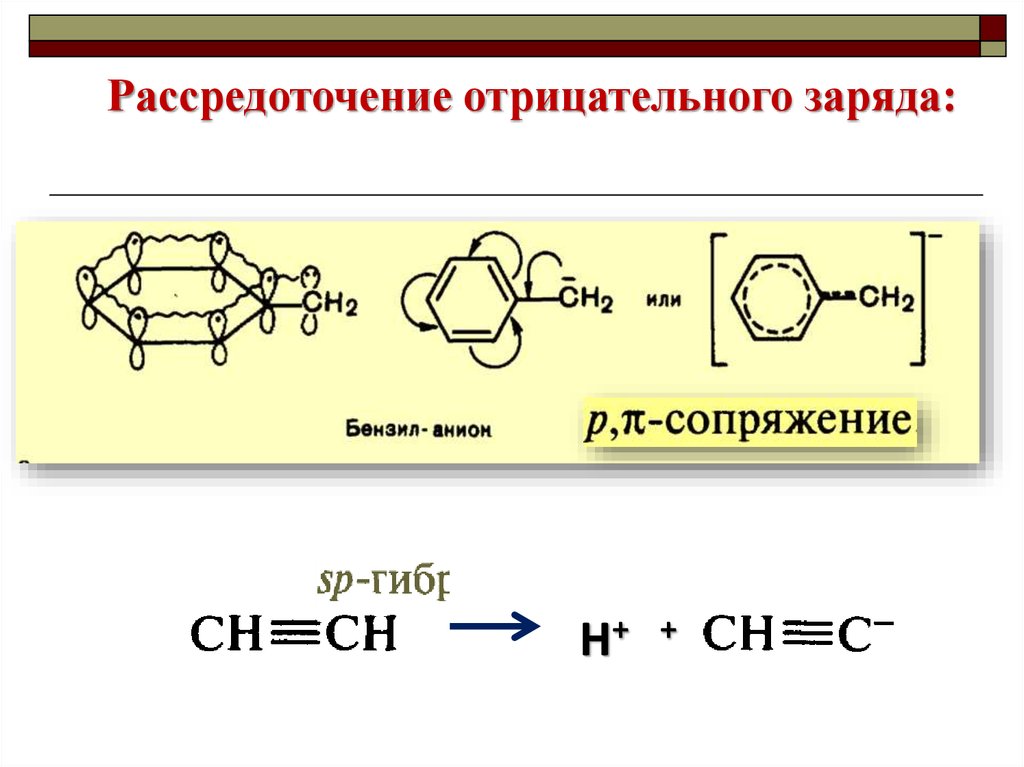
35.
Рассредоточение отрицательного заряда:Н+
+
36.
Алифатические анионы+I
-
2 +I
-
-
увеличение стабильности R-
3 +I
-
37. Ряд устойчивости анионов:
Бензильный, аллильный > ацетиленовый >метильный > первичный> вторичный >
третичный
увеличение стабильности RДля относительной стабильности анионов
нужны
ЭА заместители
!
38. КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
39.
Теория Брёнстеда-Лоури.(1923)
Датский физико-химик
Йоханнес Николаус
Брёнстед, 1879-1947
Английский химик
Томас Мартин Лоури,
1874-1936
40.
Кислоты Брёнстеда (протонные кислоты)- это нейтральные молекулы или ионы,
способные отдавать протон (доноры протонов).
сопряженная кислотно-основная пара
перенос Н+
сопряженные
Кислотность
в 1012 раз
в 1021 раз
41.
Органические кислоты классифицируют поприроде кислотного центра:
42.
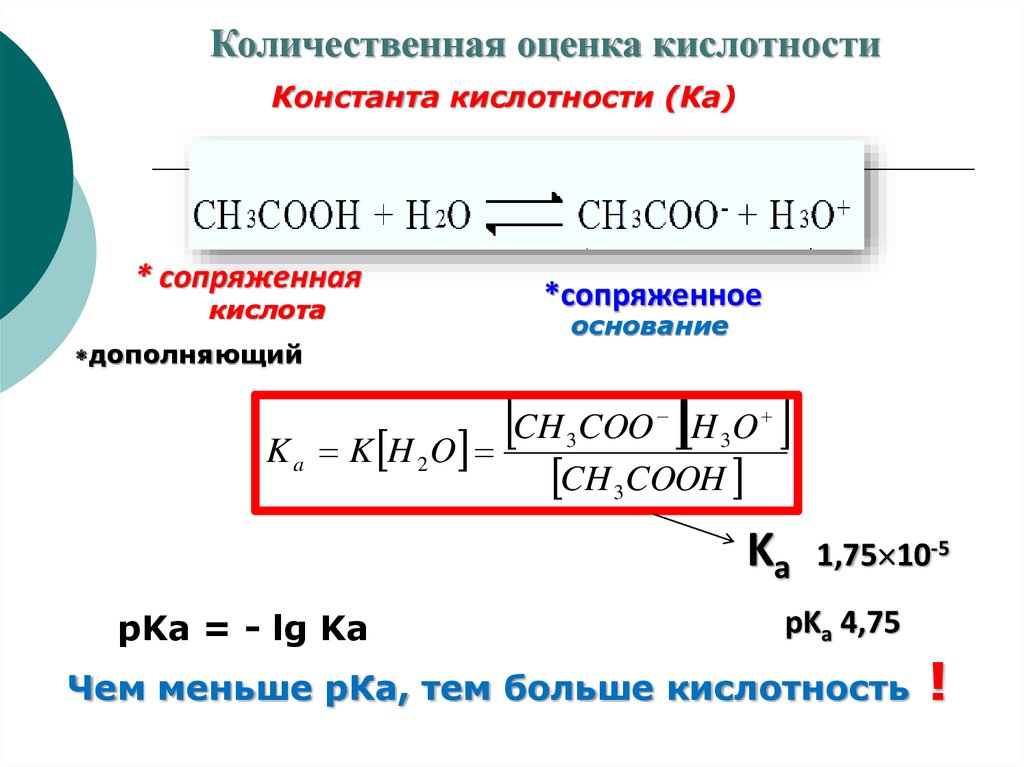
Количественная оценка кислотностиКонстанта кислотности (Ка)
* сопряженная
*сопряженное
кислота
основание
дополняющий
CH COO H O
K H O
Ka
3
2
3
CH 3COOH
Ka
pKa = - lg Ka
1,75 10-5
pKa 4,75
Чем меньше рКа, тем больше кислотность
!
43.
Прогнозирование кислотных свойствСтабильность аниона определяется степенью
делокализации в нем отрицательного заряда.
1. Природа
атома в кислотном центре
электроотрицательность
способность удерживать - заряд
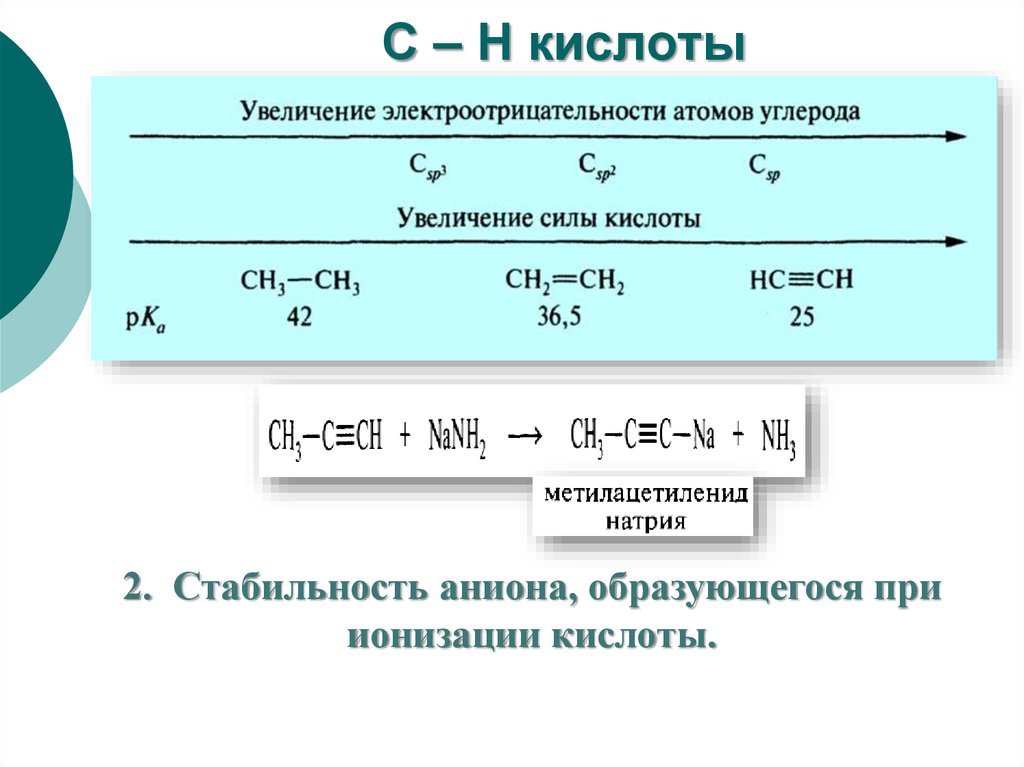
44. С – Н кислоты
2. Стабильность аниона, образующегося приионизации кислоты.
45.
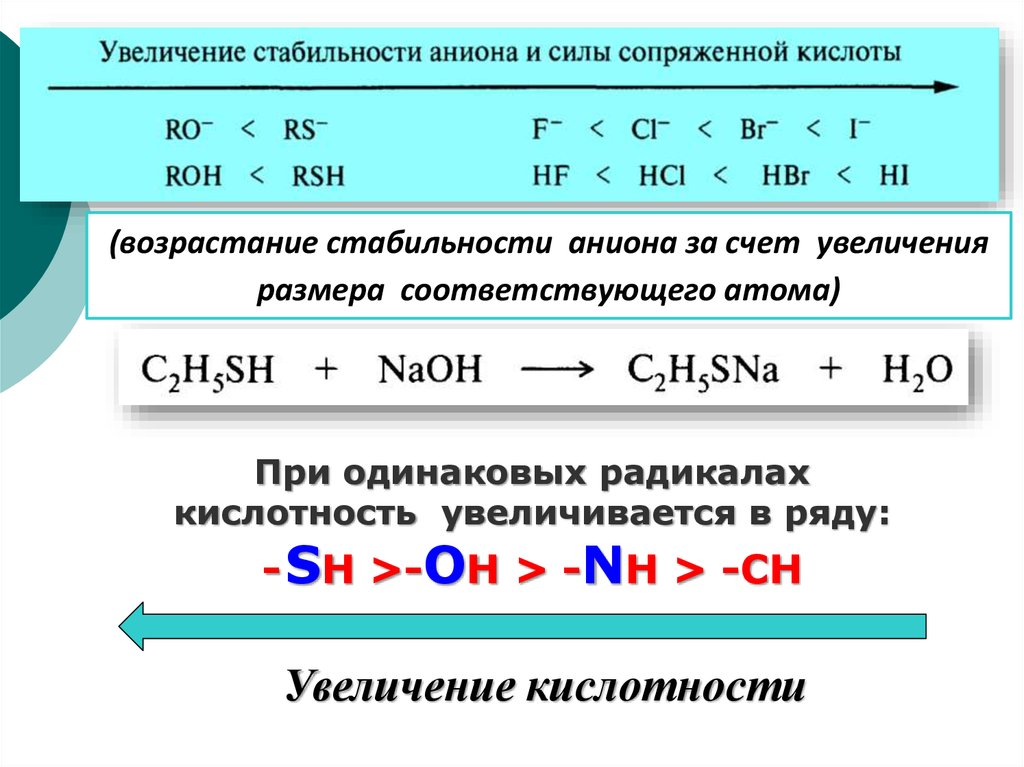
(возрастание стабильности аниона за счет увеличенияразмера соответствующего атома)
При одинаковых радикалах
кислотность увеличивается в ряду:
- SH >-OH > -NH > -CH
Увеличение кислотности
46.
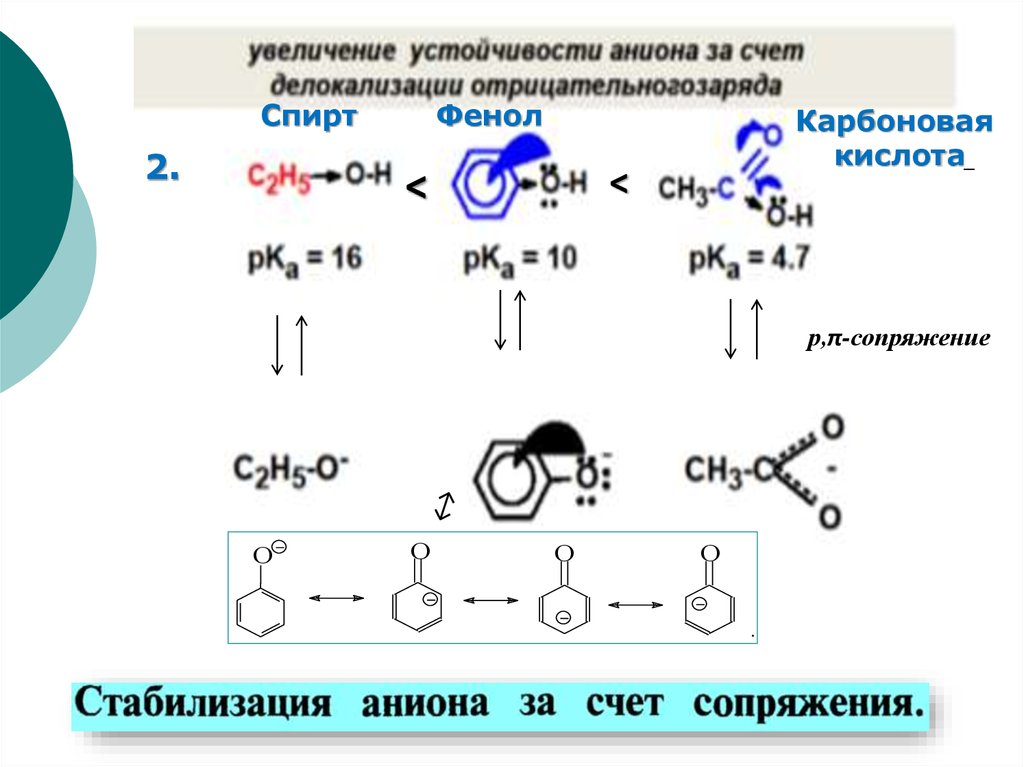
Спирт2.
Фенол
Карбоновая
кислота
<
<
р,π-сопряжение
O
O
O
O
.
47.
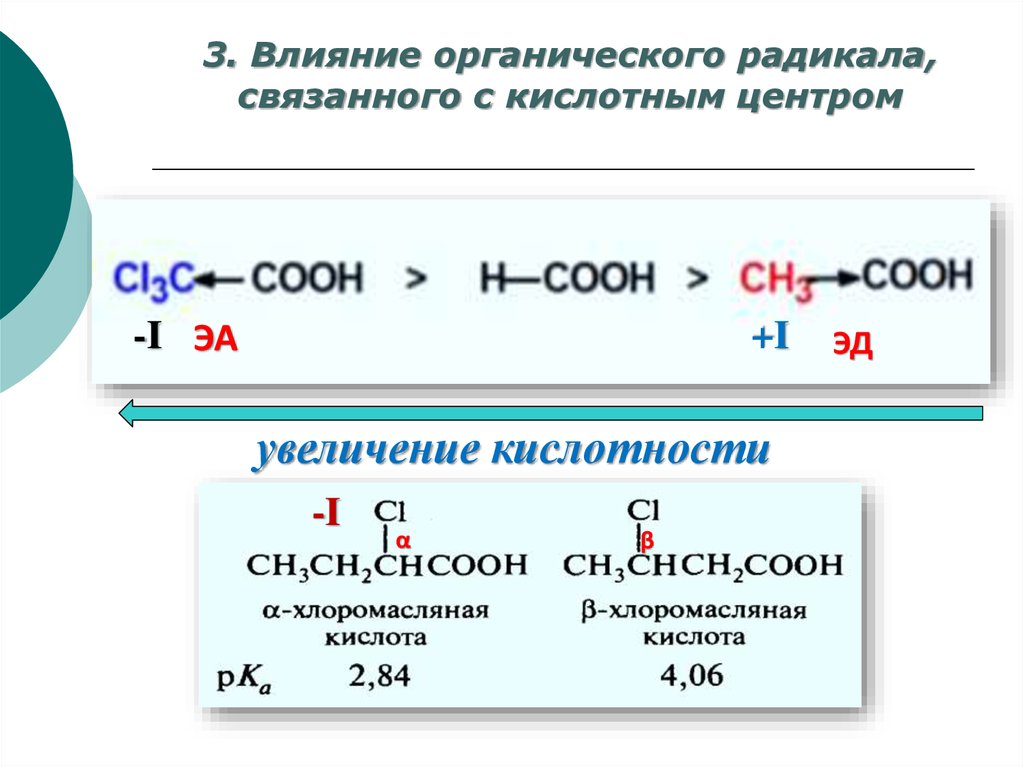
3. Влияние органического радикала,связанного с кислотным центром
-I ЭА
+I
увеличение кислотности
-I
α
β
ЭД
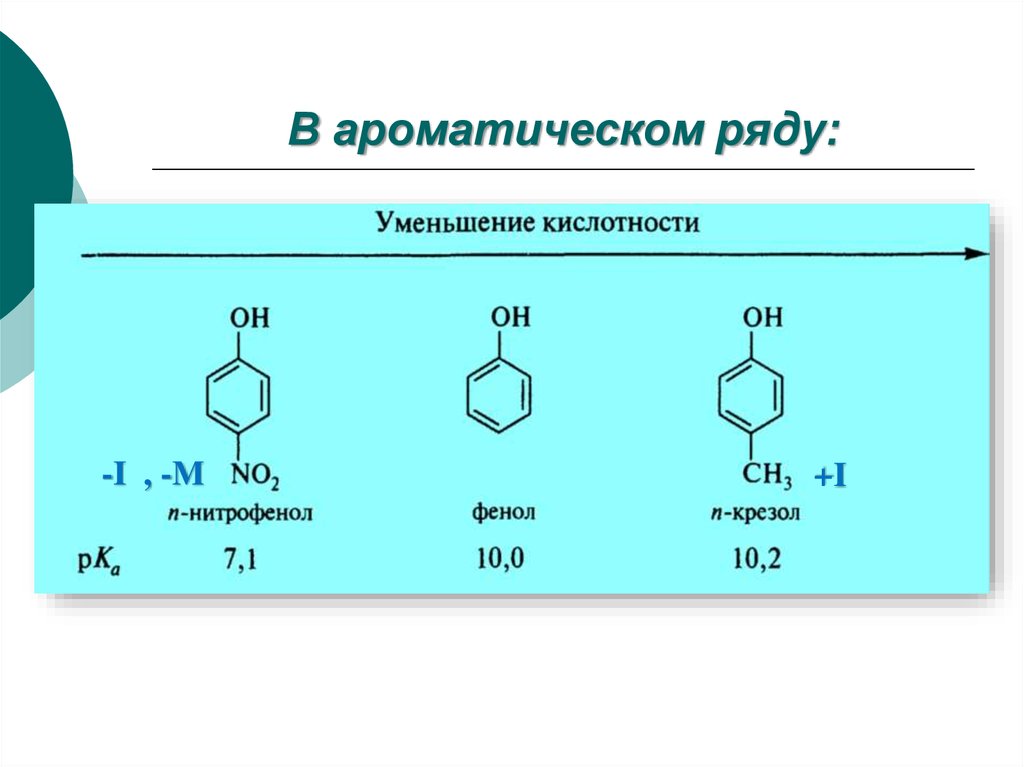
48. В ароматическом ряду:
-I , -M+I
49.
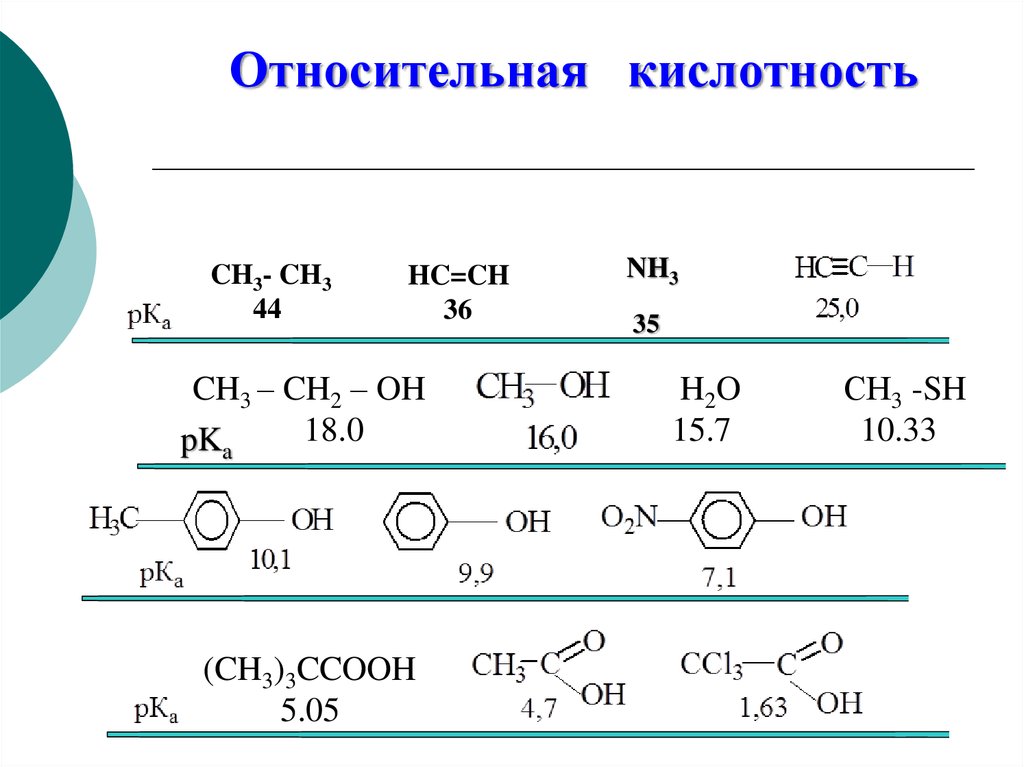
Относительная кислотностьCH3- CH3
44
HC=CH
36
CH3 – CH2 – OH
18.0
pKa
(CH3)3CCOOH
5.05
NH3
35
H2O
15.7
СН3 -SH
10.33
50.
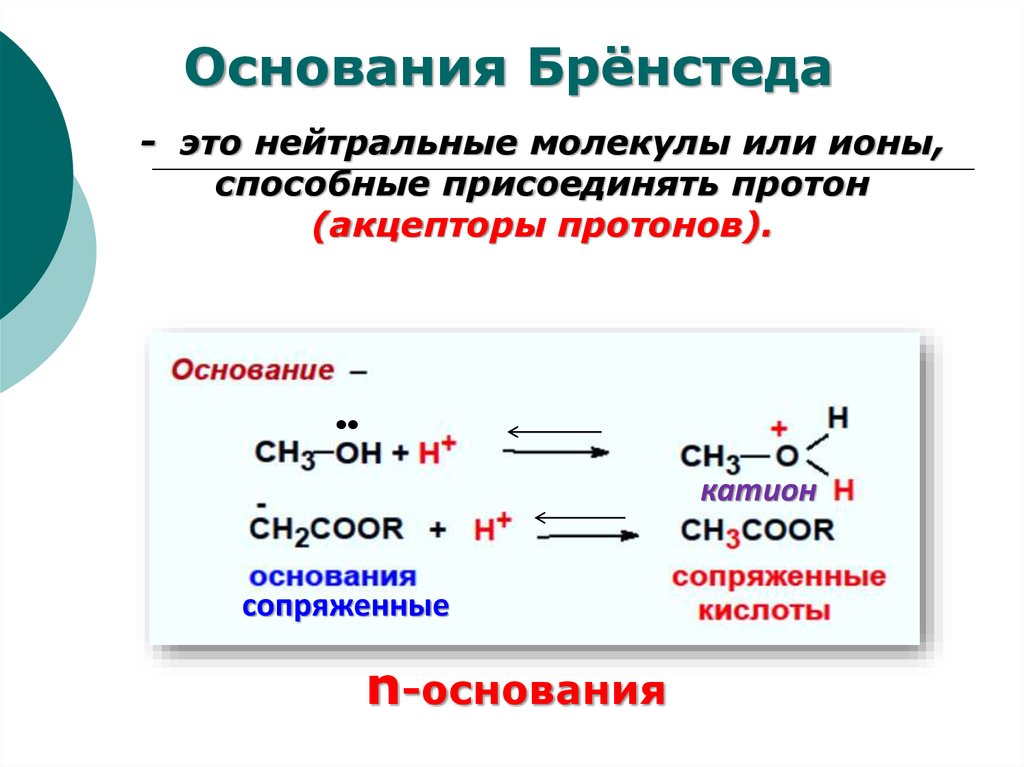
Основания Брёнстеда- это нейтральные молекулы или ионы,
способные присоединять протон
(акцепторы протонов).
катион
сопряженные
n-основания
51.
-основанияCH2=CH2 +
H
H
CH2=CH2 .
52.
n-основания1. Аммониевые основания
(центр основности азот)
RNH2
RNHR' RN(R')R'' RCH=NH
RC N
Азометины
Нитрилы
Амины
53.
2. Оксониевые основания(центр основности кислород)
..
O sp3
ROH
Спирты
..
R'
R >C=O
Кетоны
Основание тем более основно, чем более
сконцентрирован заряд
..
..
ROR'
Простые эфиры
..
R >C=O
Hal
Галогенангидриды
RCH=O
Альдегиды
..
R>C=O
H2N
Амиды
sp2
..
R >C=O
X
Производные кислот
54.
3. Сульфониевые основания(центр основности сера) :
55.
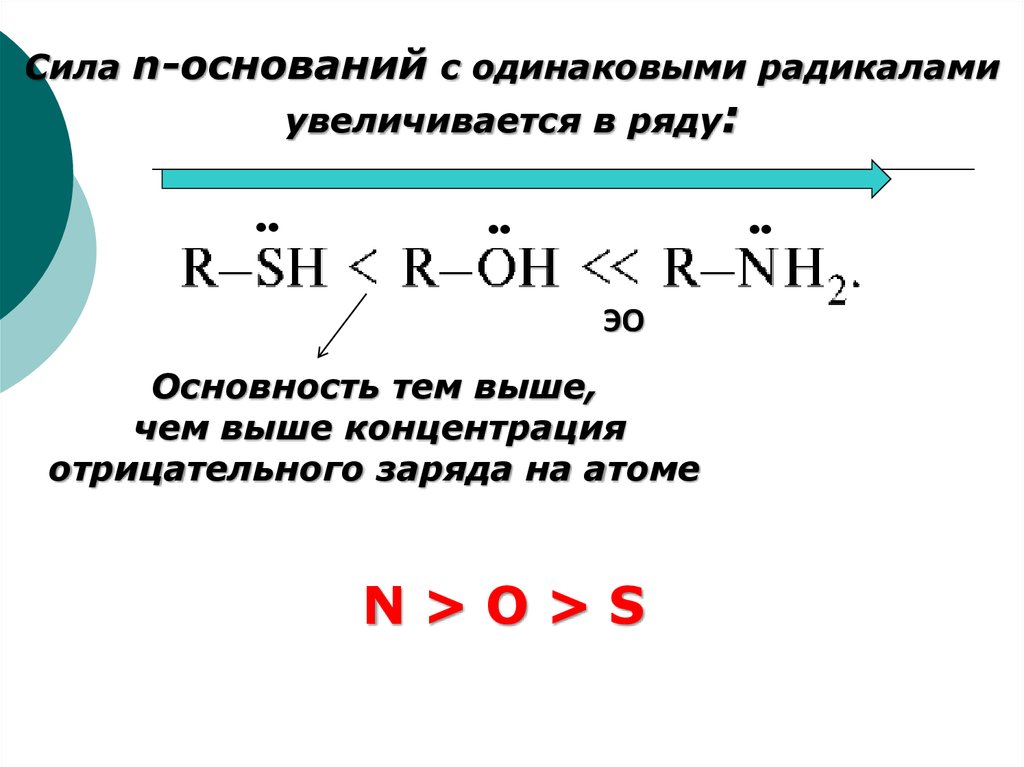
Сила n-оснований с одинаковыми радикаламиувеличивается в ряду:
ЭО
Основность тем выше,
чем выше концентрация
отрицательного заряда на атоме
N>O>S
56.
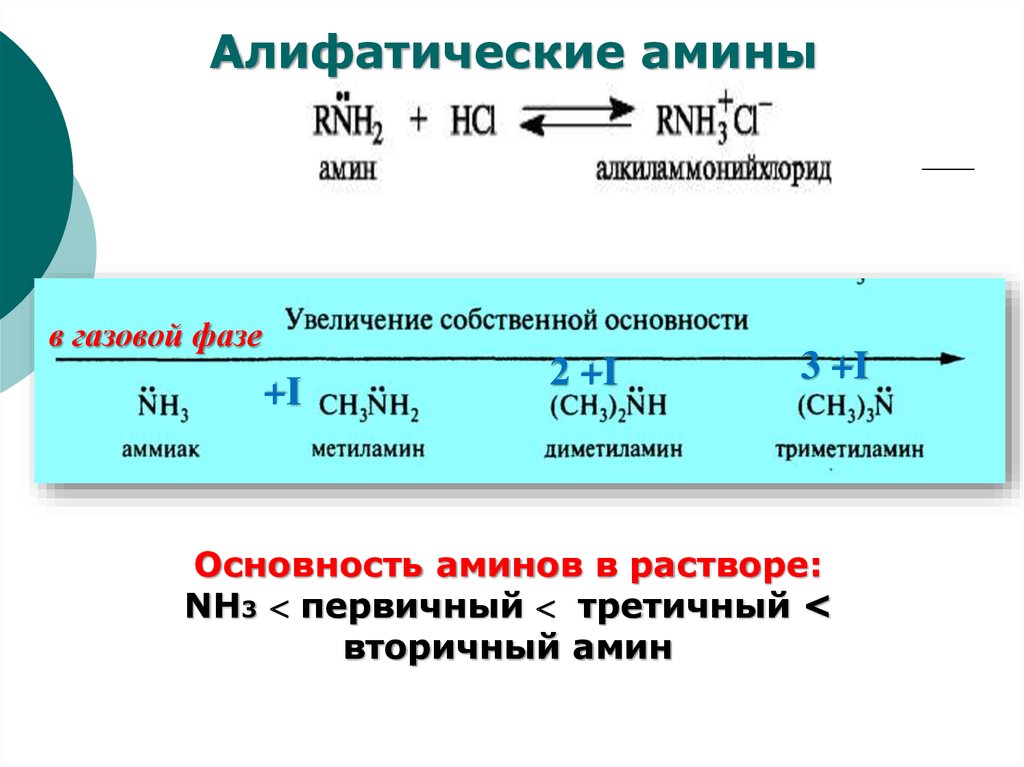
Алифатические аминыв газовой фазе
+I
2 +I
3 +I
Основность аминов в растворе:
NH3 первичный третичный <
вторичный амин
57.
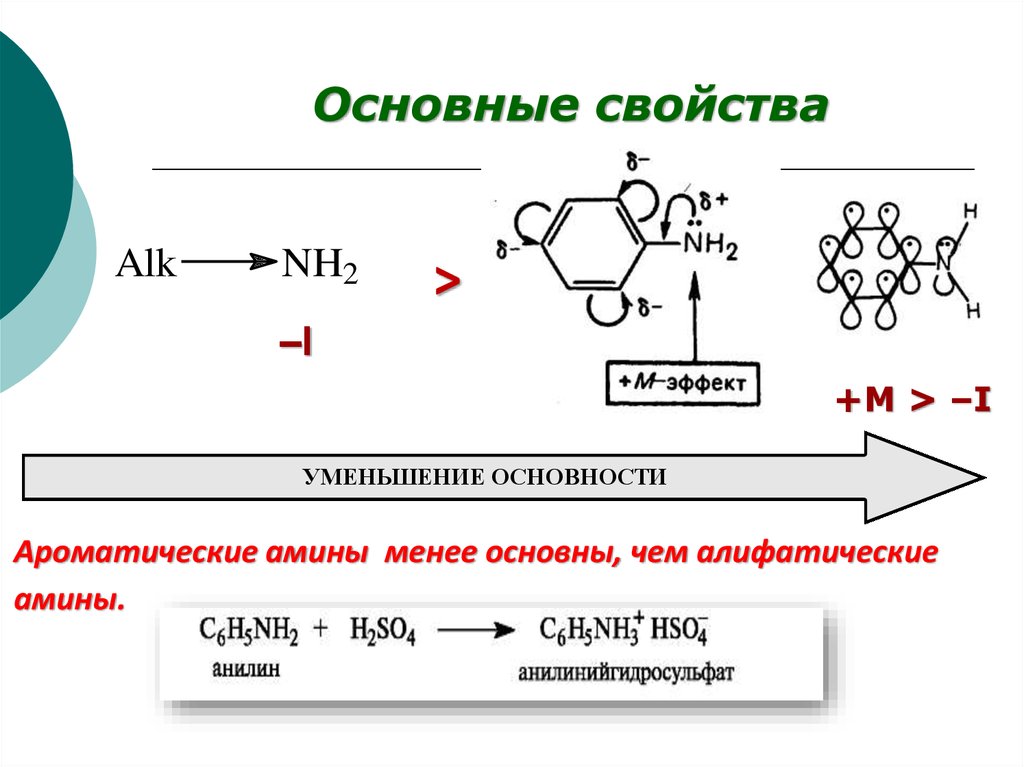
Основные свойстваAlk
NH2
>
–I
+M > –I
УМЕНЬШЕНИЕ ОСНОВНОСТИ
Ароматические амины менее основны, чем алифатические
амины.
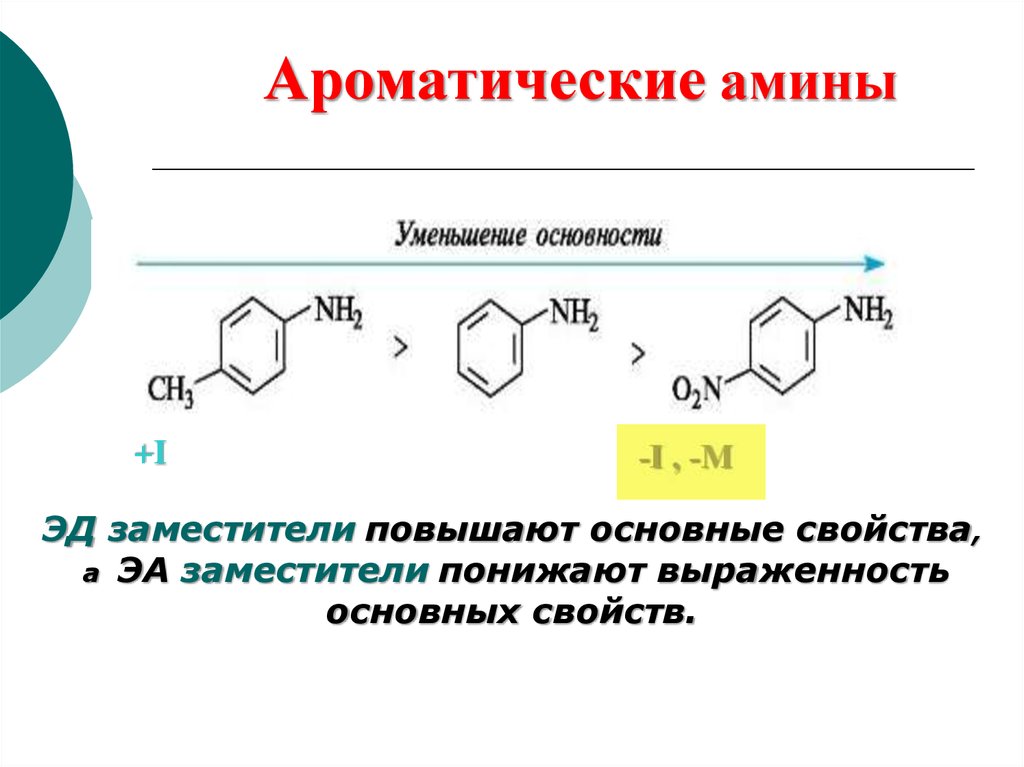
58.
Ароматические амины+I
ЭД заместители повышают основные свойства,
а ЭА заместители понижают выраженность
основных свойств.
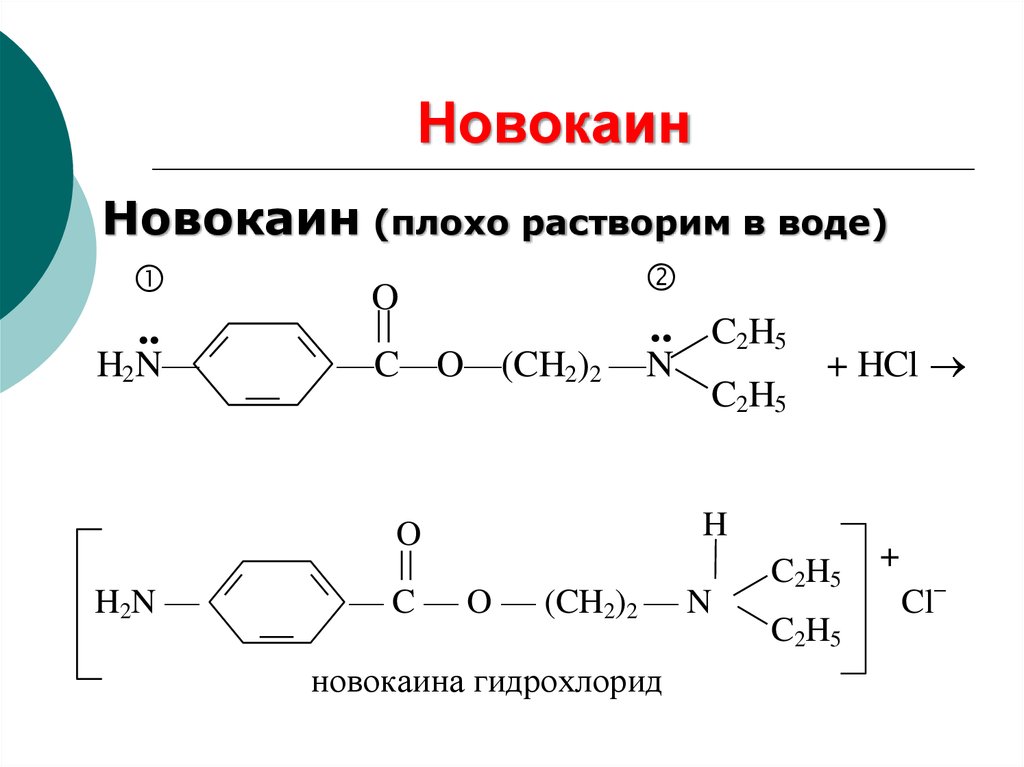
59. Новокаин
Новокаин (плохо растворим в воде)..
H2N—
O
.. C2H5
—C—O—(CH2)2 —N
O
H2N —
C2H5
H
— C — O — (CH2)2 — N
новокаина гидрохлорид
+ HCl
C2H5
C2H5
+
Cl
60.
МазьИнъекционный раствор
61.
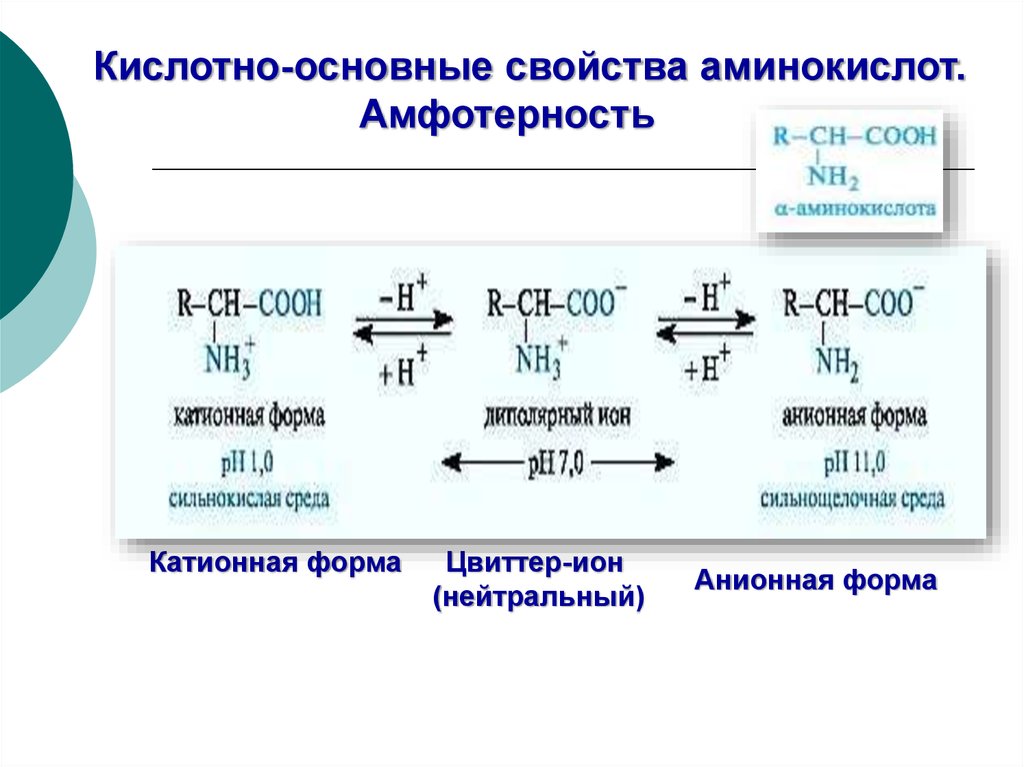
Кислотно-основные свойства аминокислот.Амфотерность
Катионная форма
Цвиттер-ион
(нейтральный)
Анионная форма
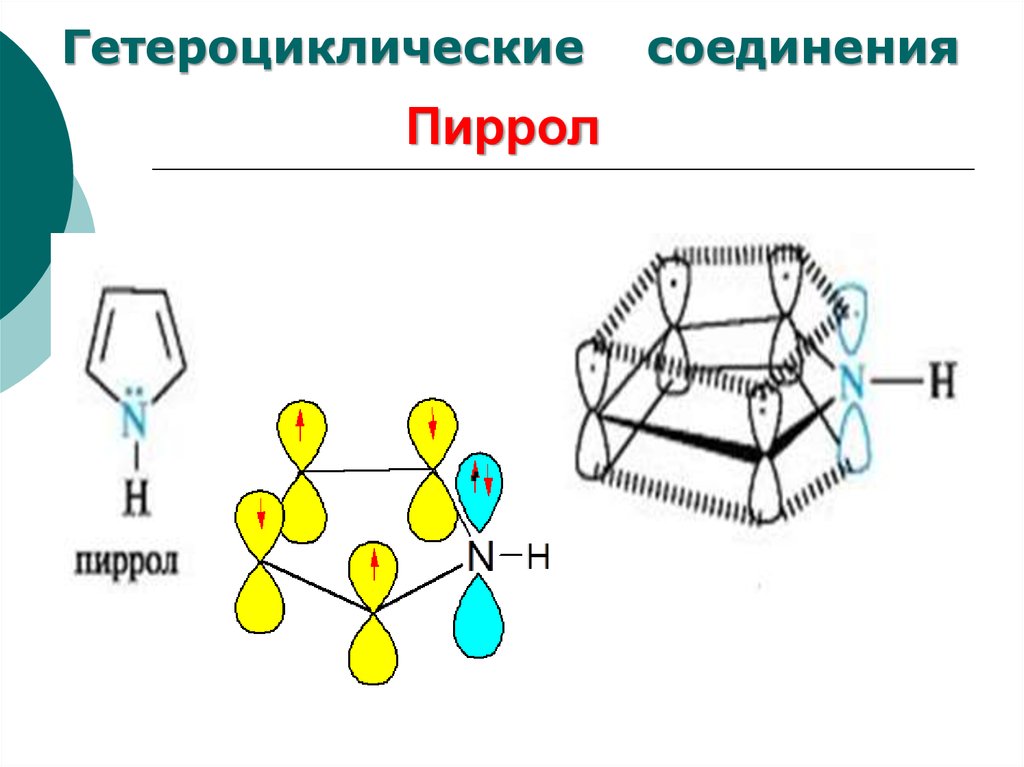
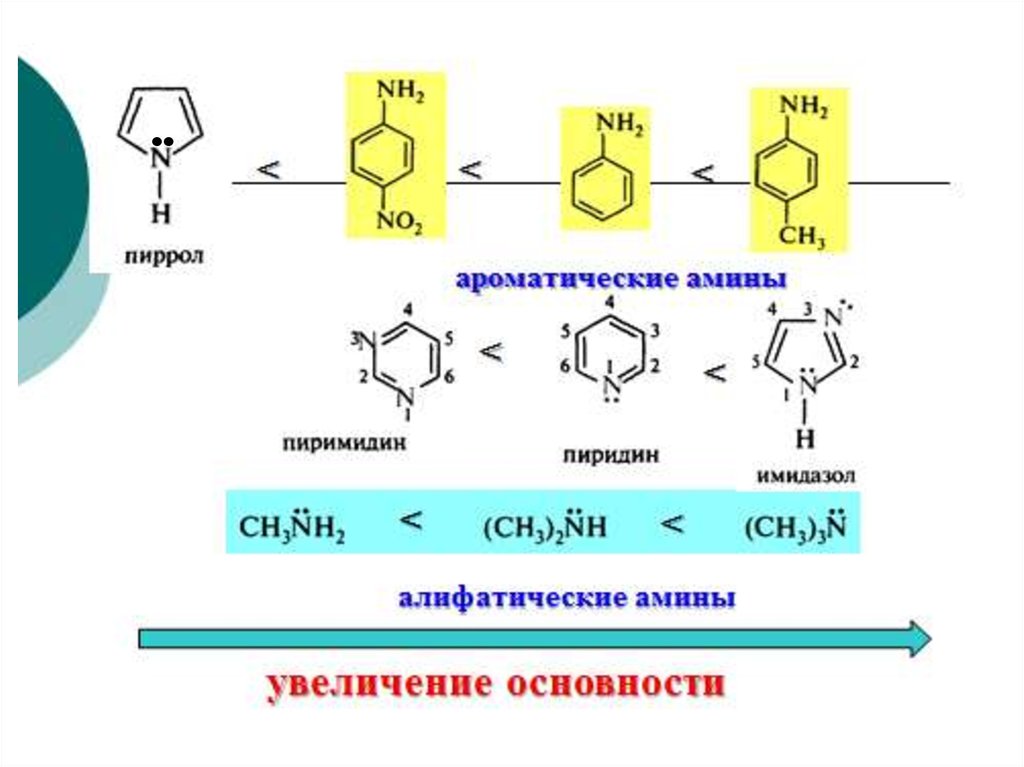
62. Пиррол
ГетероциклическиеПиррол
соединения
63. Кислотно – основные свойства
1. Пиррол практически лишен основных свойств2. Кислотность
pKa=16,5
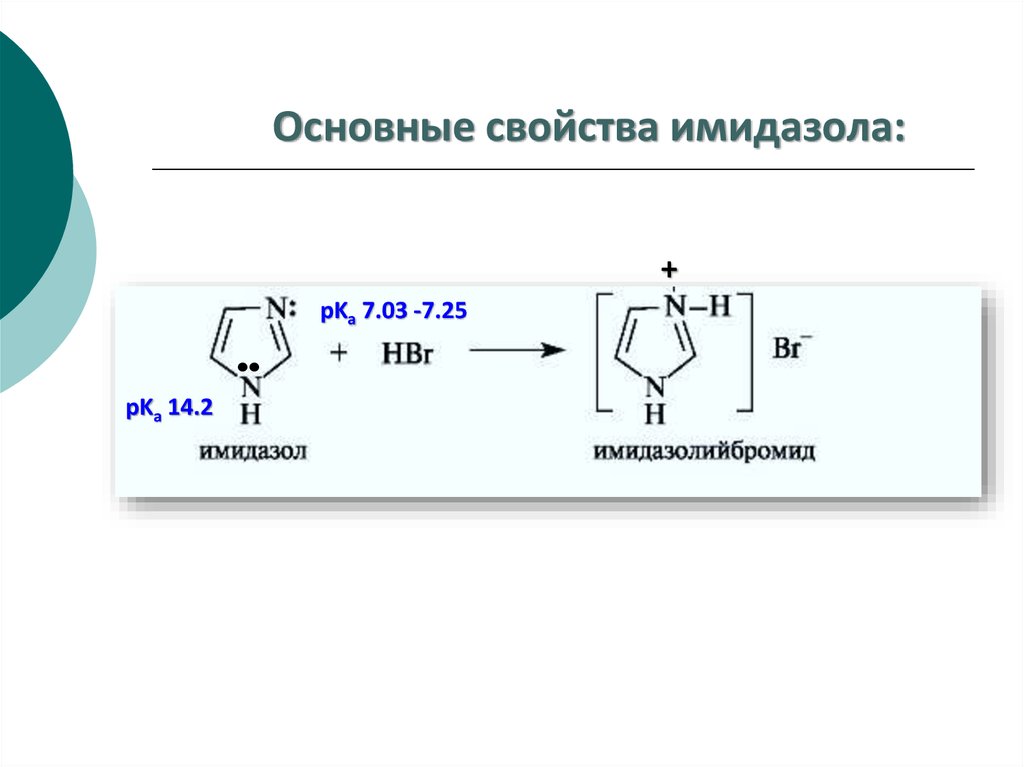
64.
Имидазоламфотерное
соединение
65.
Основные свойства имидазола:+
pKa 7.03 -7.25
pKa 14.2
66. Гетероциклические соединения
H..
H
H
N
H
N
H
Пиридин
H
H
N
H
..
.
N
H
Пиримидин
N
N
67.
Основные свойства пиридина:pKb 8.70
pKb 2.8
68.
69.
70.
71.
72.
Новокаинамид73.
74.
75.
Теория Льюиса (1923)ЛЬЮИС (Lewis),
Джилберт Ньютон
1875 г. –1946 г.
кислота это акцептор пары электронов,
основание это донор электронной пары.
CH3J
CH3 J
CH3 + J
Кислотно-основный комплекс
.
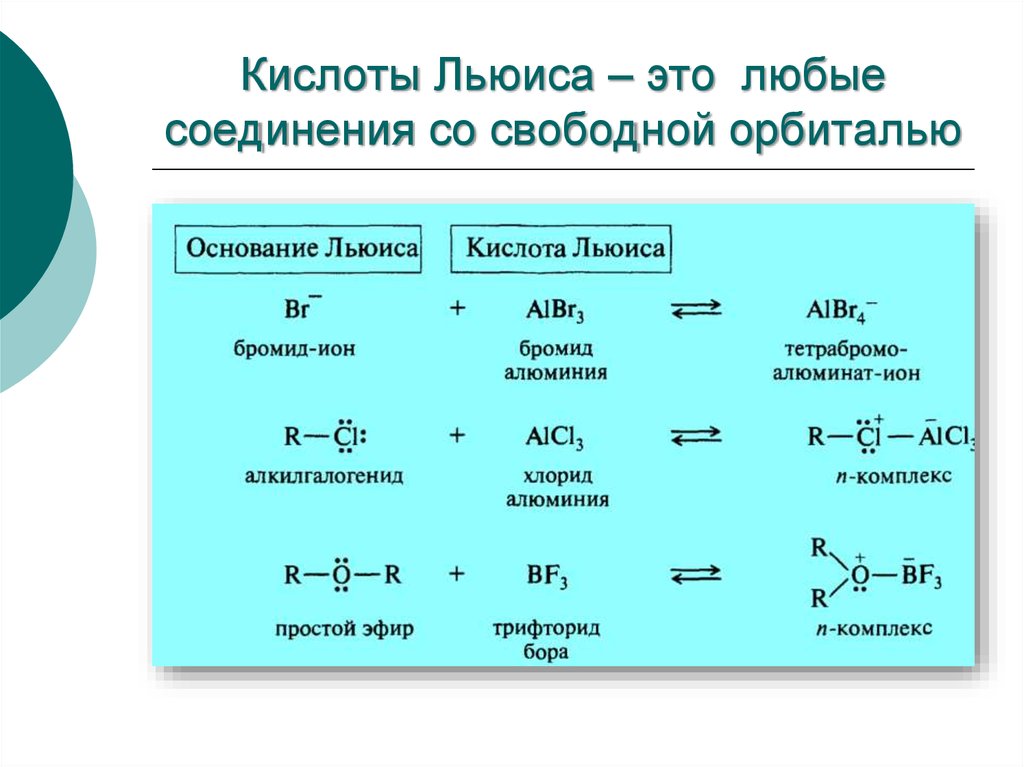
76. Кислоты Льюиса – это любые соединения со свободной орбиталью
77.
Теория ЛьюисаКислоты Льюиса
Атом, молекула,
катион, обладающие
вакантной орбиталью
BF3, AlCl3, FeCl3,
FeBr3, ZnCl2,
H+, CH3+
Электрофилы
Основания
Льюиса
Атом, молекула,
анион, обладающие
отрицательным
зарядом или
неподелённой
электронной парой
J , RO , HO , RS ,
C=C , C H R, RNH ,
6 5
2
ROH, ROR' , RSH,
RSR'
Нуклеофилы












































 Химия
Химия








