Похожие презентации:
Строение органических соединений. Кислотно-основные свойства органических соединений
1.
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙИССЛЕДОВАТЕЛЬСКИЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ им. Н.И.ПИРОГОВА
Органическая и физическая химия
Курс лекций для студентов медико-биологического
факультета, направление «Биофизика»
Лекция 1
1. Строение органических соединений
2. Кислотно-основные свойства органических
соединений
Лекции читает ст.преподаватель Гузеева Татьяна Владимировна
1
2.
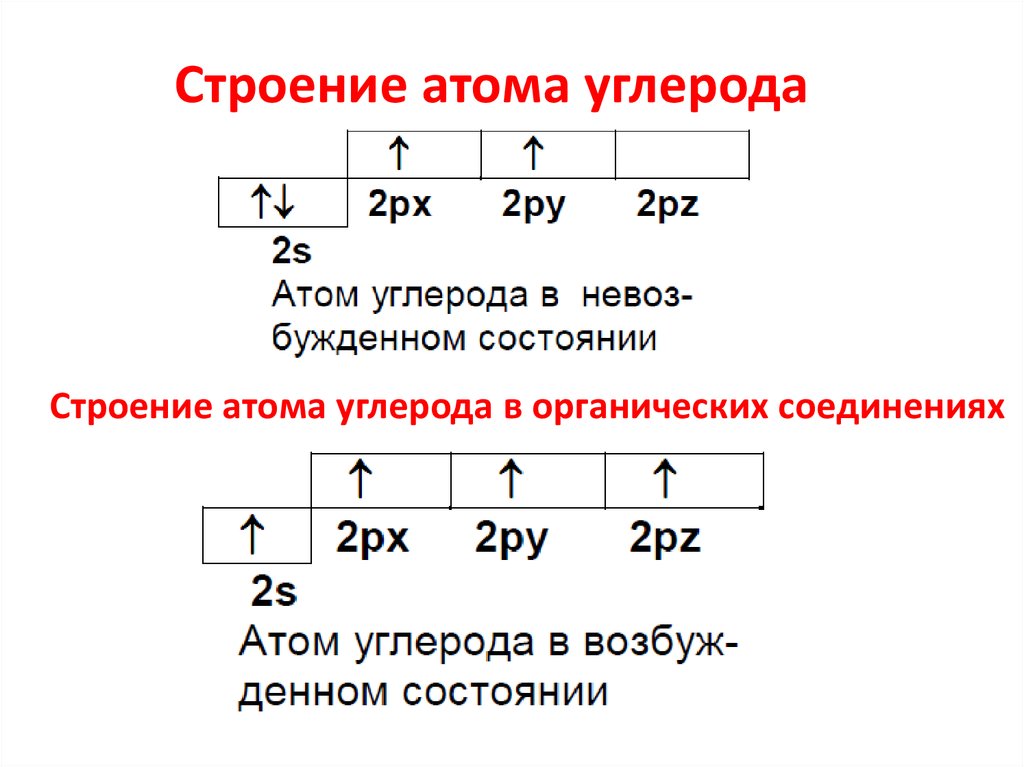
Строение атома углеродаСтроение атома углерода в органических соединениях
3.
Электронное строение органических соединенийАтомные орбитали элементов второго периода
s
px
py
pz
Электронная орбиталь — область пространства, в которой
вероятность нахождения данного электрона наиболее велика
(90 %)
4.
Гибридизация — гипотетический процесс смешениянескольких атомных орбиталей различной формы и
близкой энергии с образованием такого же числа новых
гибридных
орбиталей,
расположение
которых
в
пространстве соответствует геометрии молекулы. Для
элементов 2-го периода гибридные орбитали имеют
одинаковую форму и энергию.
sp-гибридизация
p
+ =
sp
180°
линейный фрагмент
5.
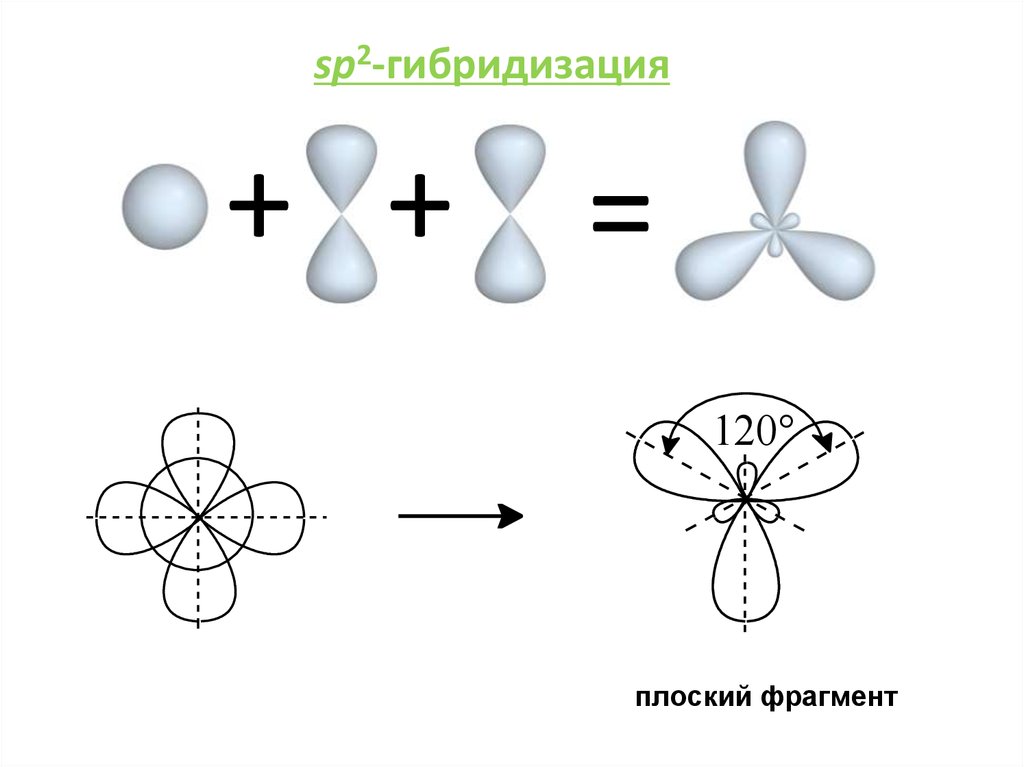
sp2-гибридизация+ + =
120°
плоский фрагмент
6.
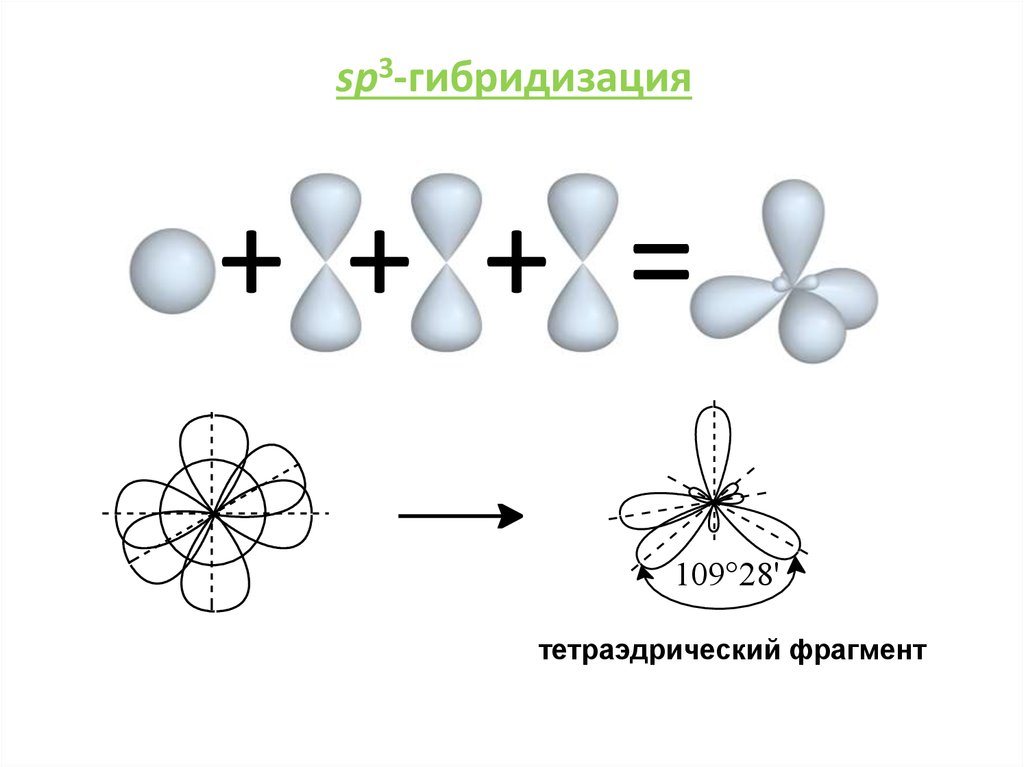
sp3-гибридизация+ + + =
109°28'
тетраэдрический фрагмент
7.
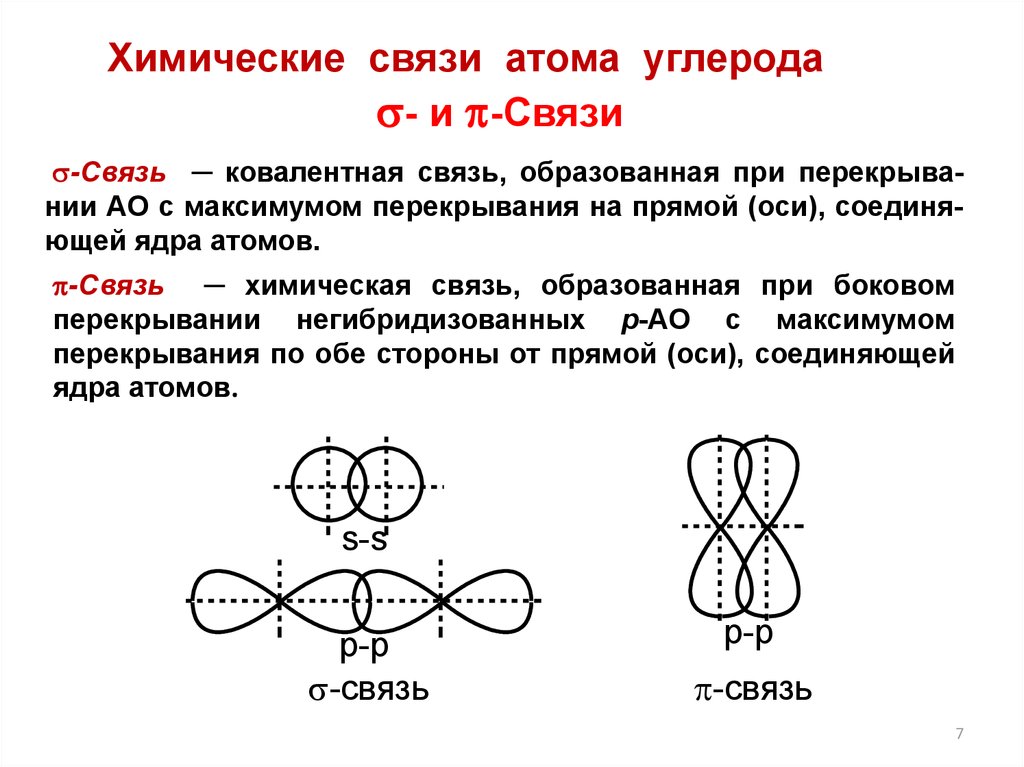
Химические связи атома углерода- и -Связи
-Связь ─ ковалентная связь, образованная при перекрывании АО с максимумом перекрывания на прямой (оси), соединяющей ядра атомов.
-Связь ─ химическая связь, образованная при боковом
перекрывании негибридизованных р-АО с максимумом
перекрывания по обе стороны от прямой (оси), соединяющей
ядра атомов.
s-s
p-p
-связь
p-p
-связь
7
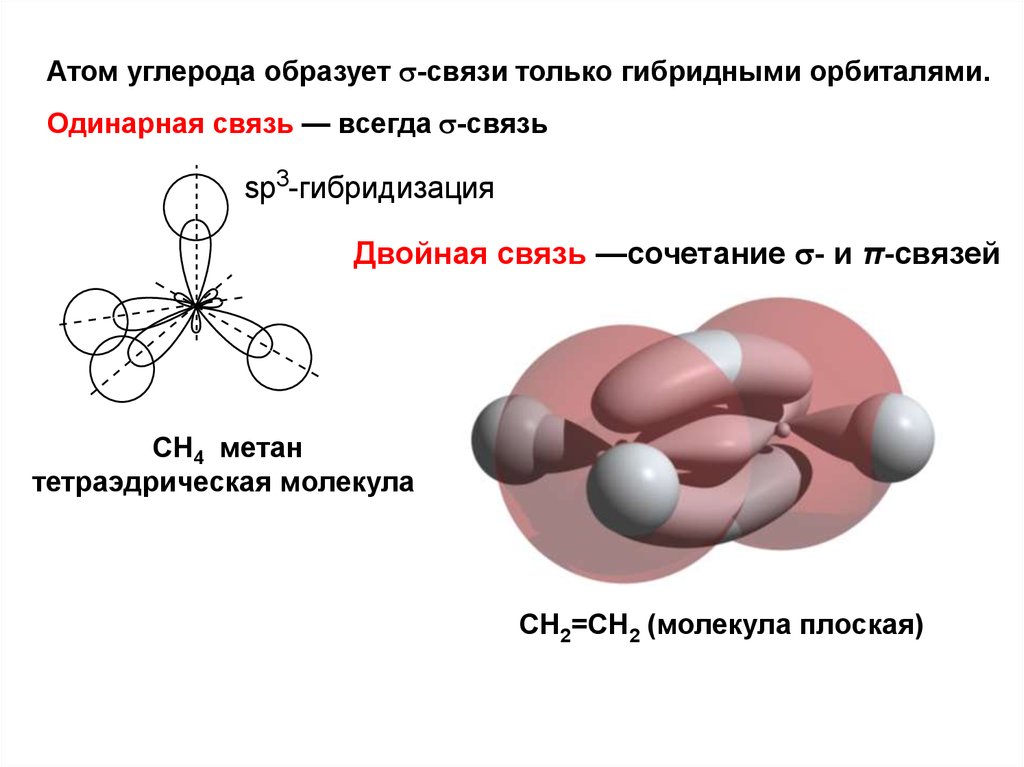
8.
Атом углерода образует -связи только гибридными орбиталями.Одинарная связь — всегда -связь
sp3-гибридизация
Двойная связь —сочетание - и π-связей
СН4 метан
тетраэдрическая молекула
СН2=СН2 (молекула плоская)
9.
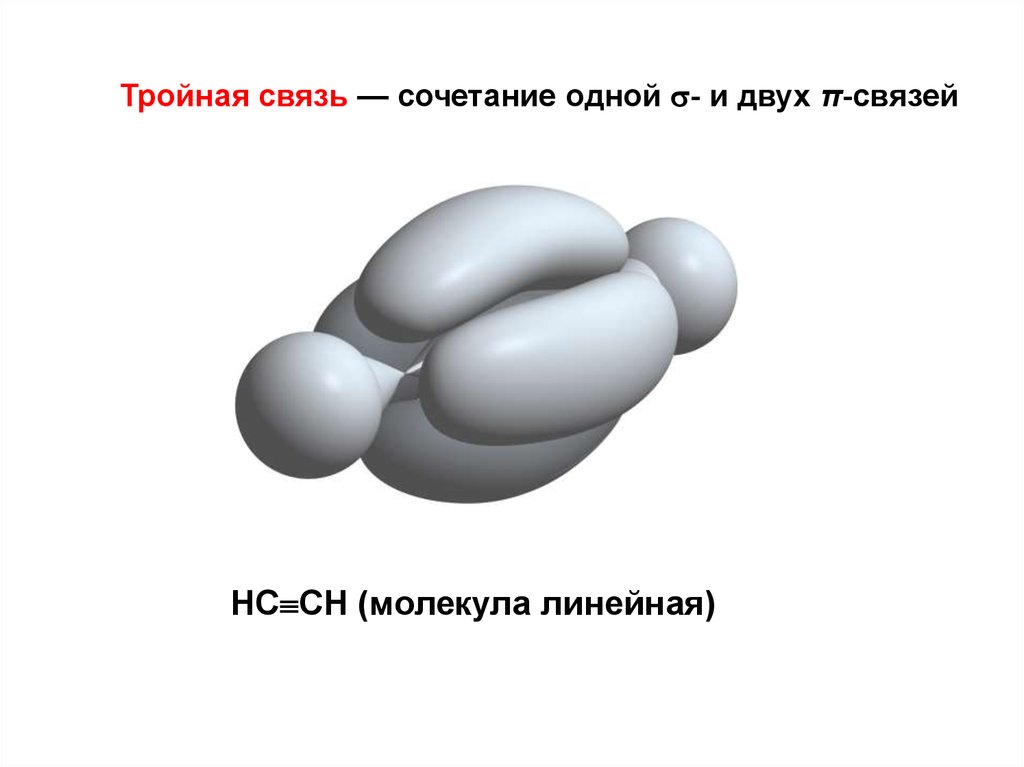
Тройная связь — сочетание одной - и двух π-связейНС СН (молекула линейная)
10.
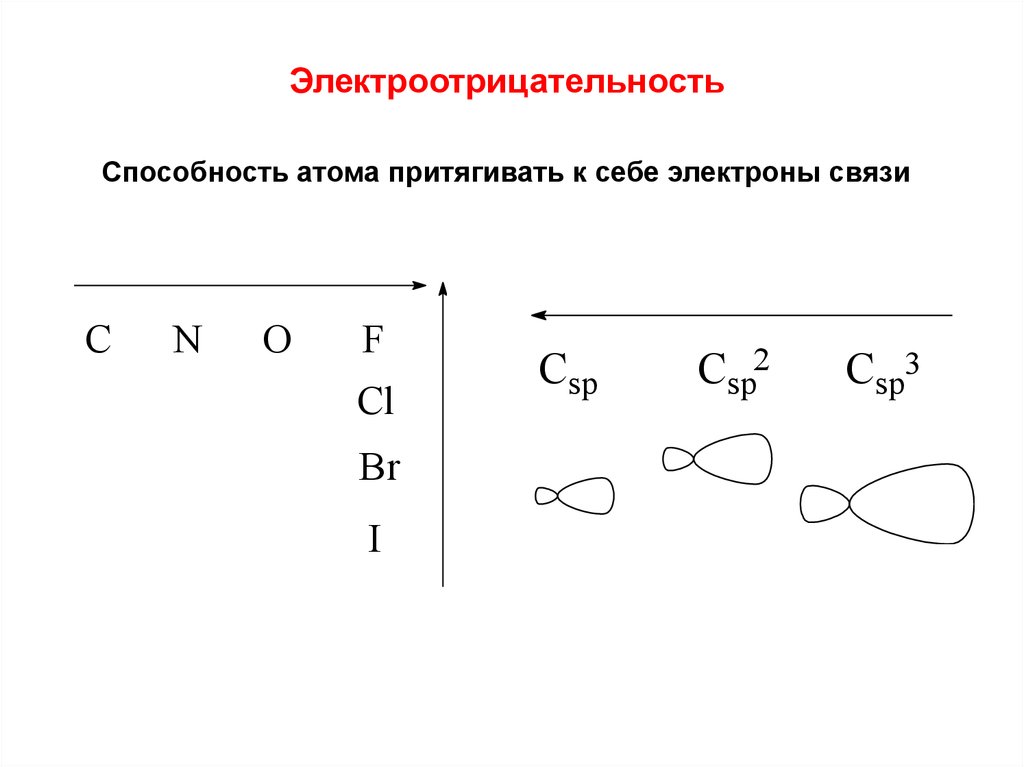
ЭлектроотрицательностьСпособность атома притягивать к себе электроны связи
С
N
O
F
Cl
Br
I
Csp
Csp2
Csp3
11.
шкала электроотрицательности ПолингаLi < H < S = Csp3 < I < Br = Csp2 < Cl = N < Csp < O < F
1 2.2 2.5
2.6
2.8
3.0
3.2 3.5 4
СН3 SH
СН3 СН3
неполярные связи
СН3
Н
СН3 I
СН3
CH = CH2
малополярные связи
СН3
F
СН3
OH
C O
C C H
сильнополярные связи
О
Н
12.
Водородные связи—
особый вид межмолекулярного взаимодействия, которое
осуществляется по донорно-акцепторному механизму и имеет
в значительной степени ковалентный характер.
Водородная связь — слабая химическая связь между атомами Н,
ковалентно связанными с атомами элементов с высокой ЭО, и
другими атомами с достаточно высокой ЭО, обладающими
неподеленной парой электронов.
X
H +... Y
(Е ≈ 10‒40 кДж/моль)
Водородные связи – сильнейший тип межмолекулярных сил
12
13.
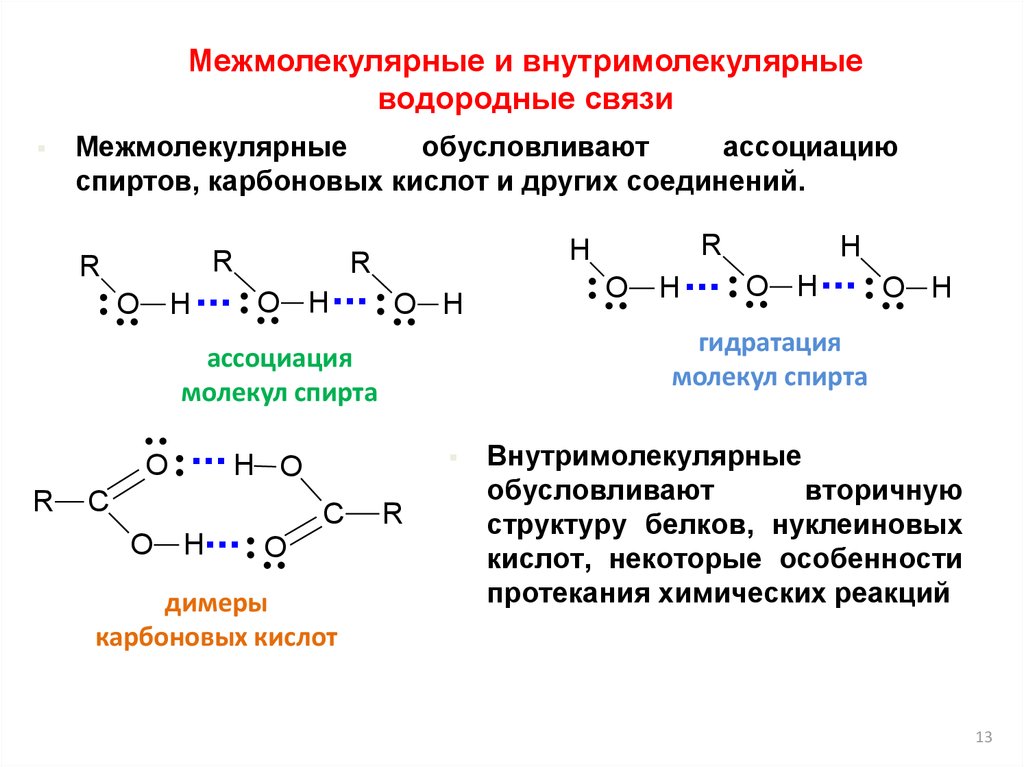
Межмолекулярные и внутримолекулярныеводородные связи
Межмолекулярные
обусловливают
ассоциацию
спиртов, карбоновых кислот и других соединений.
R
R
H ...
O
H
R
O
H ...
O H
R
C
... H
O
O H... O
C
димеры
карбоновых кислот
H
O H ... O H ... O H
гидратация
молекул спирта
ассоциация
молекул спирта
O
R
R
Внутримолекулярные
обусловливают
вторичную
структуру белков, нуклеиновых
кислот, некоторые особенности
протекания химических реакций
13
14.
Делокализованные химические связиДелокализованная связь
—
ковалентная связь,
электронная плотность которой рассредоточена между
несколькими (более чем двумя) атомами.
Ее молекулярные орбитали охватывают более двух атомов.
Делокализация электронной плотности ведет к более
равномерному распределению электронной плотности в
молекуле, что понижает ее энергию и повышает стабильность
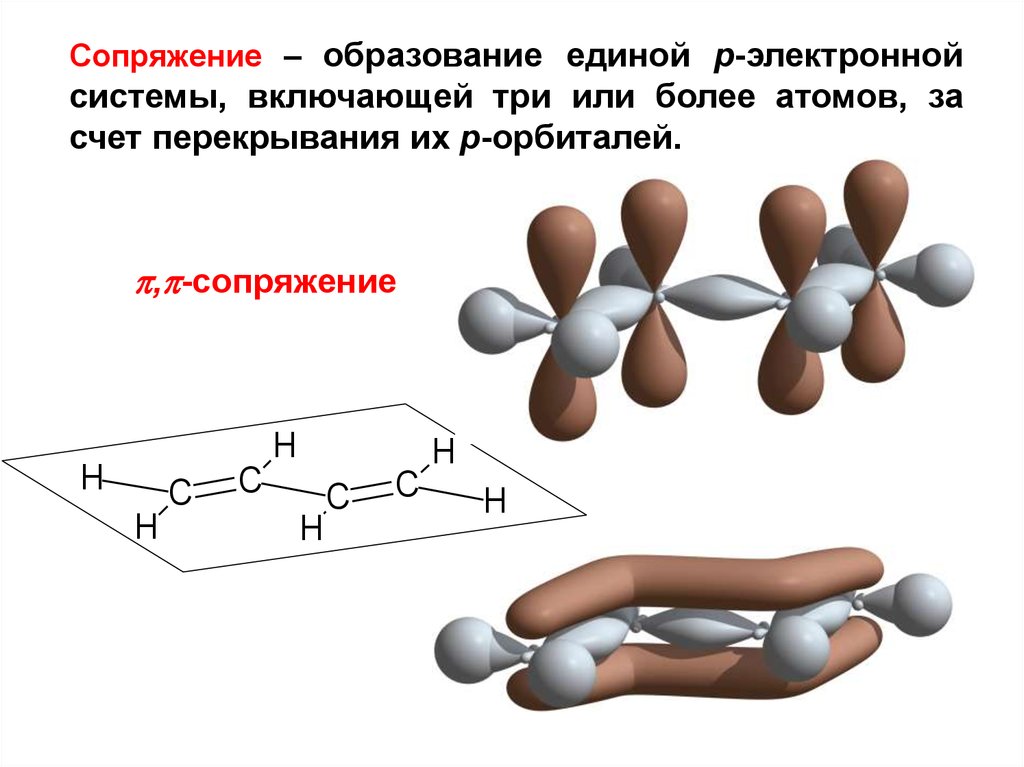
15.
Сопряжение – образование единой р-электроннойсистемы, включающей три или более атомов, за
счет перекрывания их p-орбиталей.
, -сопряжение
H
H
C
H
H
C
H
C
C
H
16.
p, -cопряжениеH
H
C
C
H
O
H
C
H
H
-каротин
Сопряженная система, включающая 22 р-электрона
17.
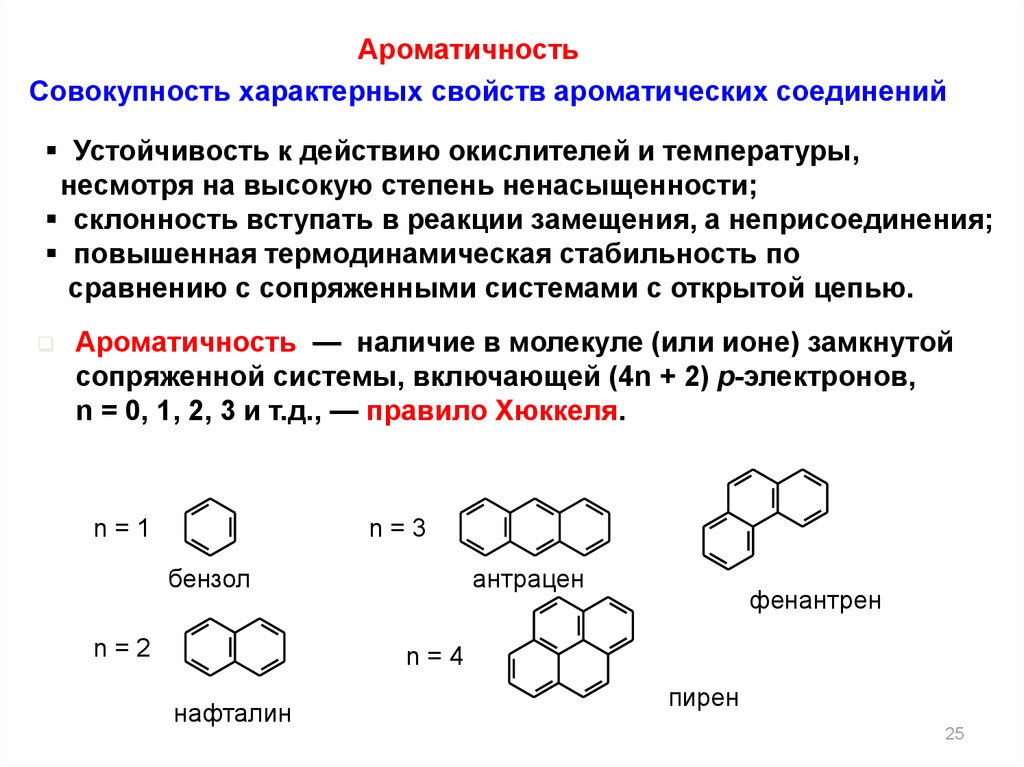
АроматичностьСовокупность характерных свойств ароматических соединений
Устойчивость к действию окислителей и температуры,
несмотря на высокую степень ненасыщенности;
склонность вступать в реакции замещения, а неприсоединения;
повышенная термодинамическая стабильность по
сравнению с сопряженными системами с открытой цепью.
Ароматичность — наличие в молекуле (или ионе) замкнутой
сопряженной системы, включающей (4n + 2) p-электронов,
n = 0, 1, 2, 3 и т.д., — правило Хюккеля.
n=1
n=3
бензол
n=2
антрацен
фенантрен
n=4
нафталин
пирен
25
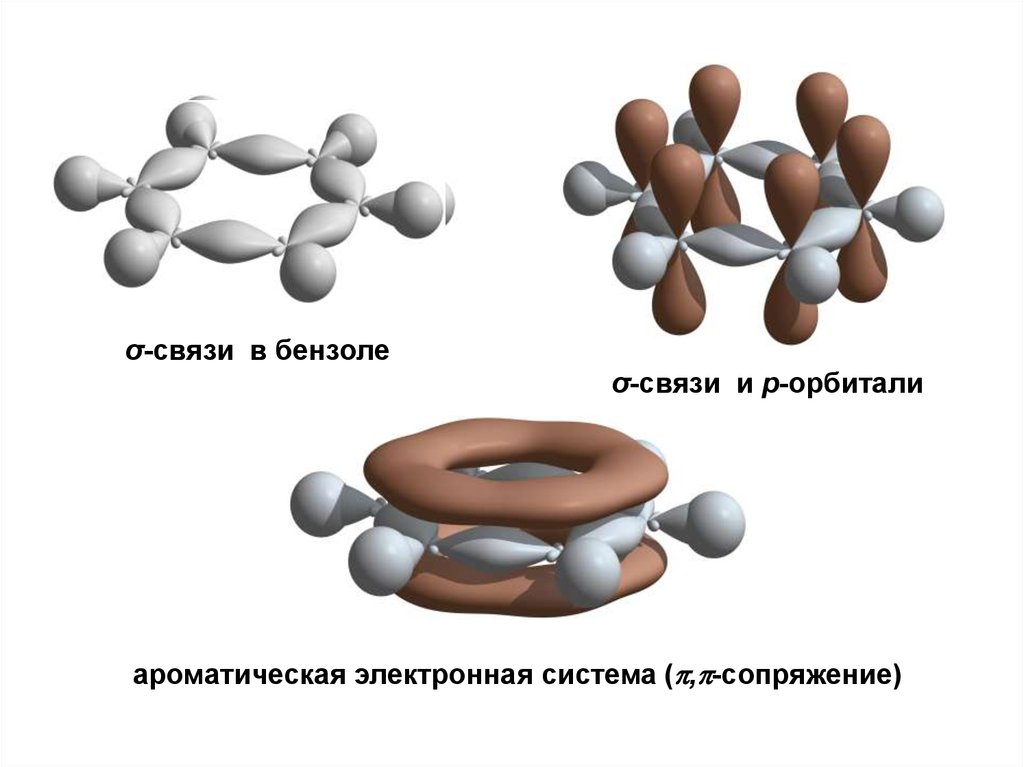
18.
σ-связи в бензолеσ-связи и р-орбитали
ароматическая электронная система ( , -сопряжение)
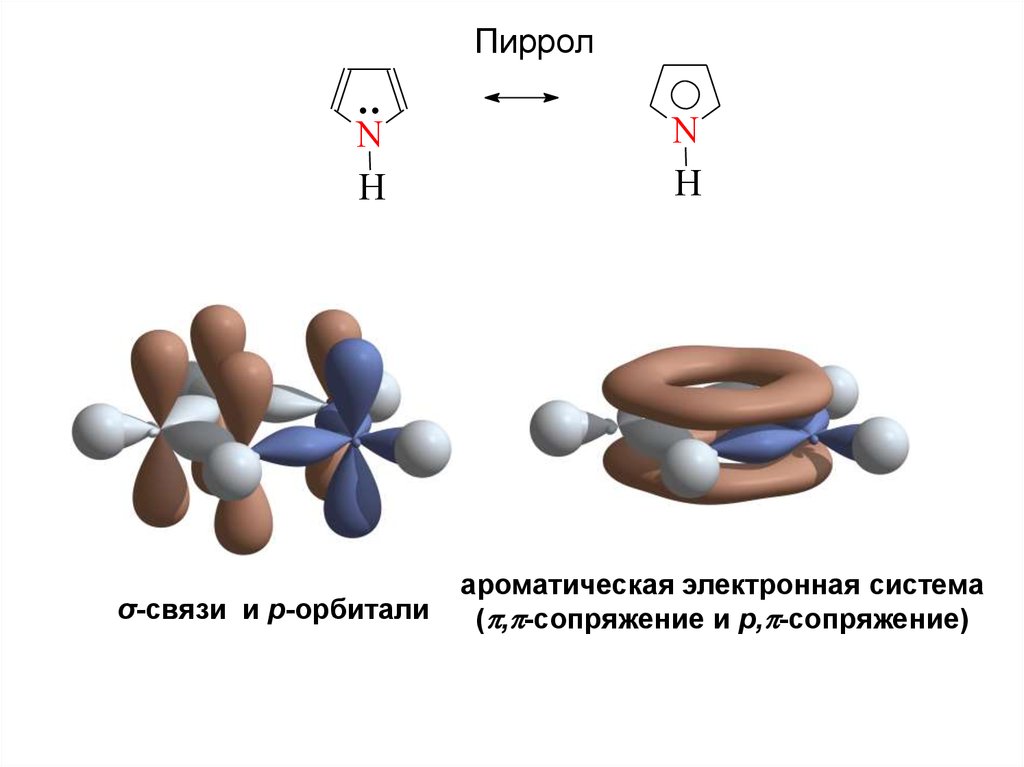
19.
ПирролN
H
σ-связи и р-орбитали
N
H
ароматическая электронная система
( , -сопряжение и p, -cопряжение)
20.
Небензоидные ароматические системыЦиклопропенил-катион
Н
Циклопентадиенид-анион
Тропилий-катион
Азулен
21.
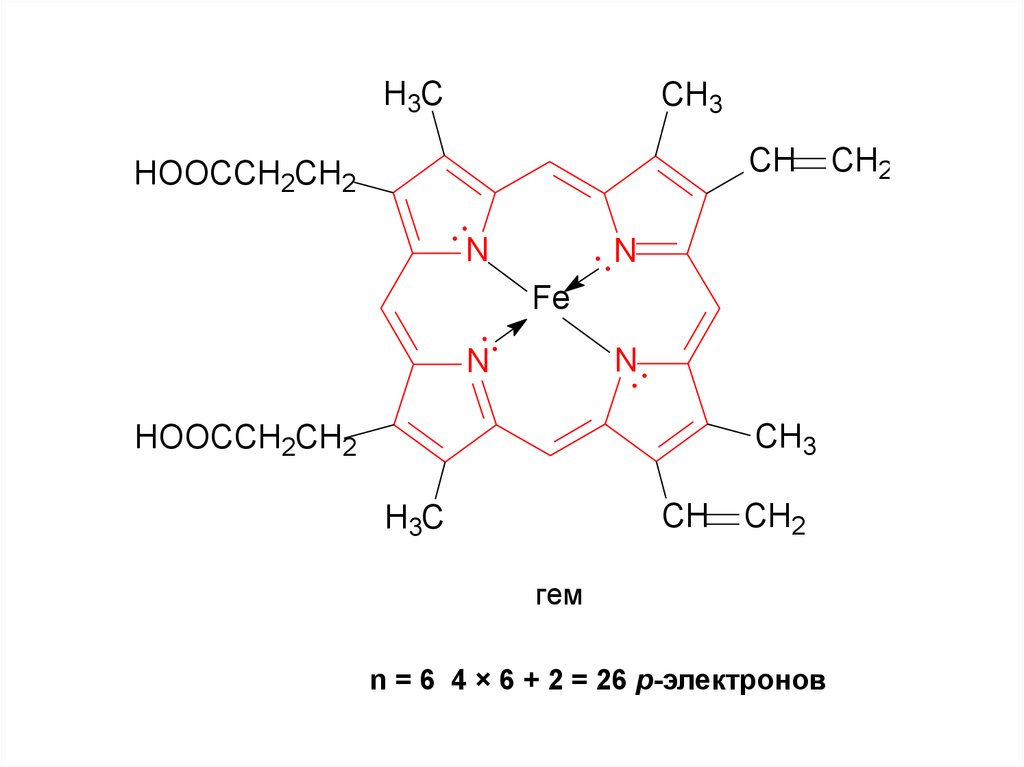
H3CCH3
CH
HOOCCH2CH2
N
N
Fe
N
N
CH3
HOOCCH2CH2
CH
H3C
CH2
гем
n = 6 4 × 6 + 2 = 26 p-электронов
CH2
22.
электронные эффекты заместителей(по сравнению с атомом водорода)
1. Индуктивный эффект (I) - передача электронного влияния
заместителя по цепи -связей
+I эффект:
Н
Н
С
СН2
СН2
+ICH
3
O
R
+I O-
Н
-I эффект:
F
F
F
C
CH2 CH2
-I CF
3
+
NH3
R
-I NH +
3
23.
2. Мезомерный эффект (М) - передача электронноговлияния заместителя по цепи сопряжения
+M эффект
СН3 О СН СН2
+M
CH3O
NH2
+M
NH2
-M эффект
О
СН2 СН С
Н
О
-М
СНО
-МСООН
С
ОН
24.
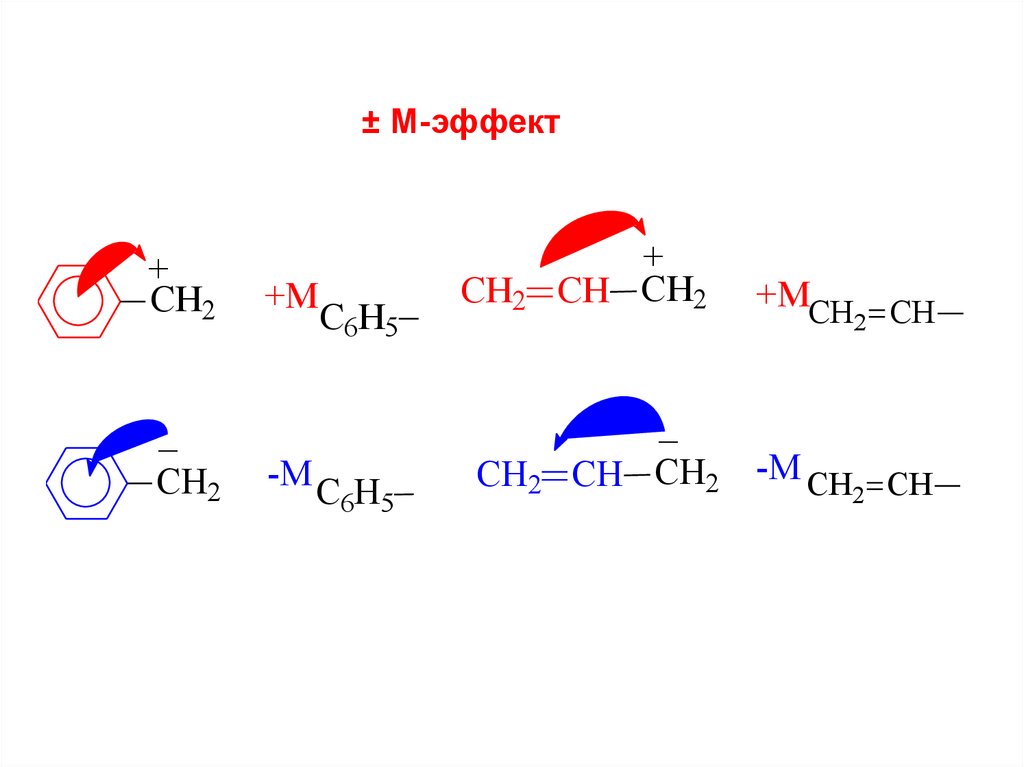
± М-эффект+
СН2
_
СН2
+М
-М
С6Н5
С6Н5
СН2
СН2
+
СН СН2
+МСН СН
2
_
СН СН2 -М СН2 СН
25.
Пространственное строение органическихсоединений. Стереоизомерия
Пространственное строение молекулы – взаимное
расположение атомов и атомных групп в пространстве
Стереохимические формулы
СН3
С
Н
ОН
Сl
химическая связь лежит в плоскости чертежа
химическая связь уходит за плоскость назад
химическая связь выходит из плоскости вперед
26.
Конформации – формы молекулы, возникающие привращении одной части молекулы относительно другой
вокруг σ-связи
этан
заслоненные
заторможенные
27.
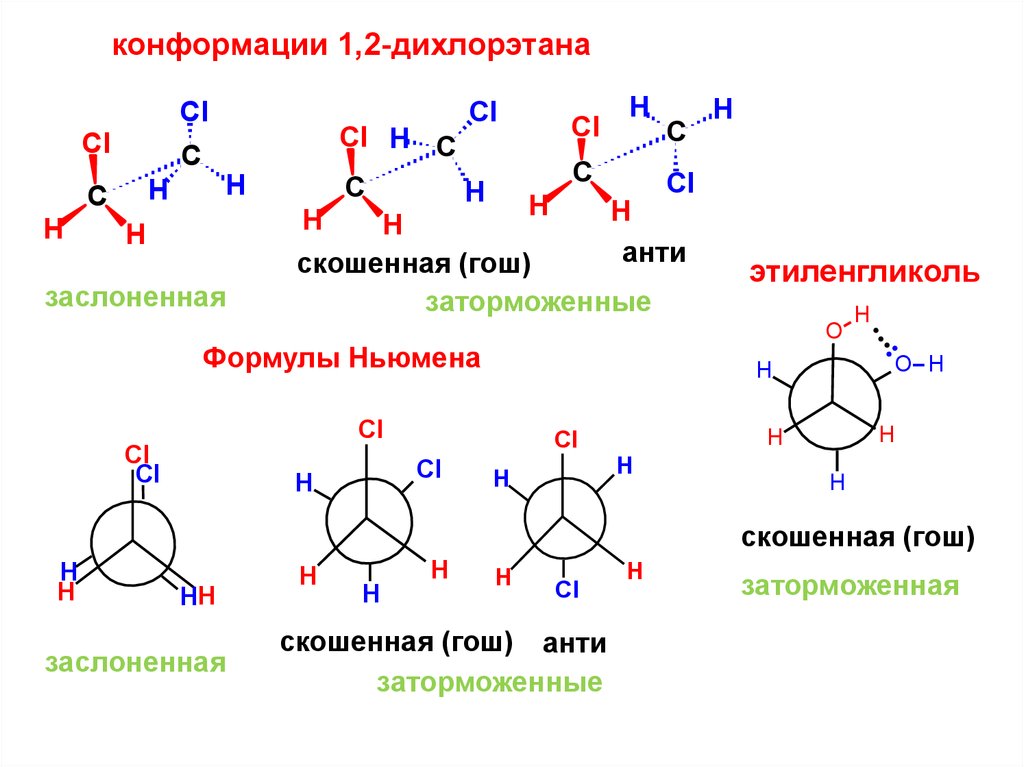
конформации 1,2-дихлорэтанаCl
Cl
С
H
H
H
С
Cl
H
заслоненная
Cl
H
С
Cl H С
С
Cl
С
H
H
H
H
H
анти
скошенная (гош)
заторможенные
Cl
Cl
H
H
H
H
H
O H
H
Cl
H
этиленгликоль
O
Формулы Ньюмена
Cl
Cl
H
H
скошенная (гош)
H
H
HH
заслоненная
H
H
H
H
Cl
скошенная (гош) анти
заторможенные
H
заторможенная
28.
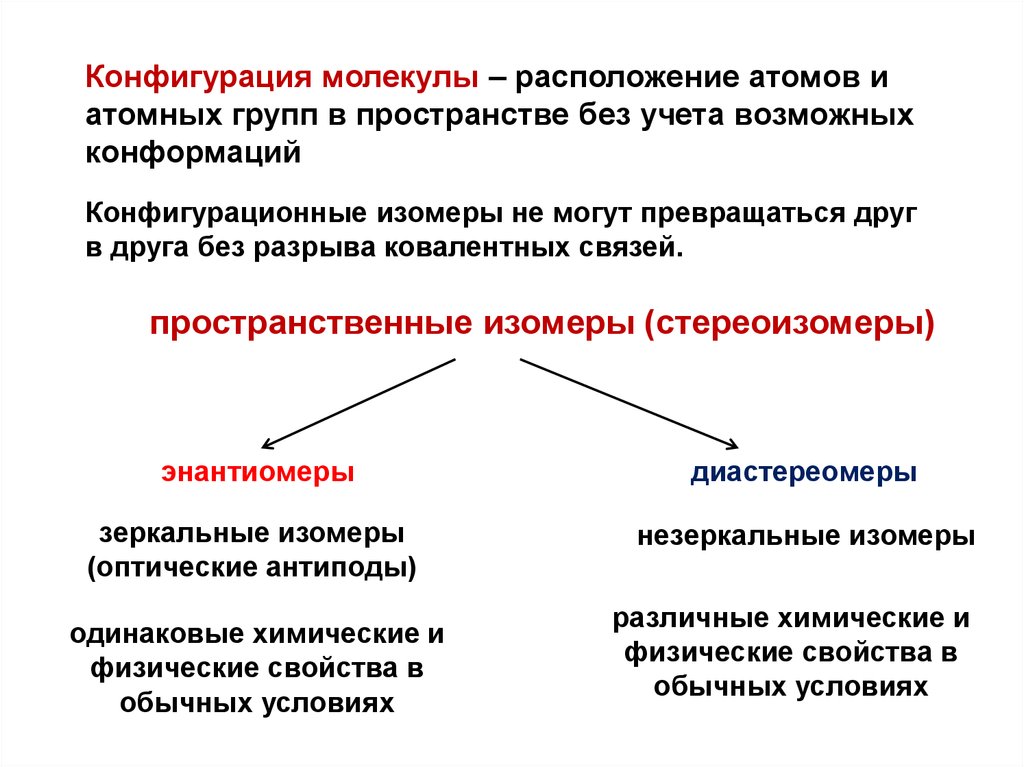
Конфигурация молекулы – расположение атомов иатомных групп в пространстве без учета возможных
конформаций
Конфигурационные изомеры не могут превращаться друг
в друга без разрыва ковалентных связей.
пространственные изомеры (стереоизомеры)
энантиомеры
диастереомеры
зеркальные изомеры
(оптические антиподы)
незеркальные изомеры
одинаковые химические и
физические свойства в
обычных условиях
различные химические и
физические свойства в
обычных условиях
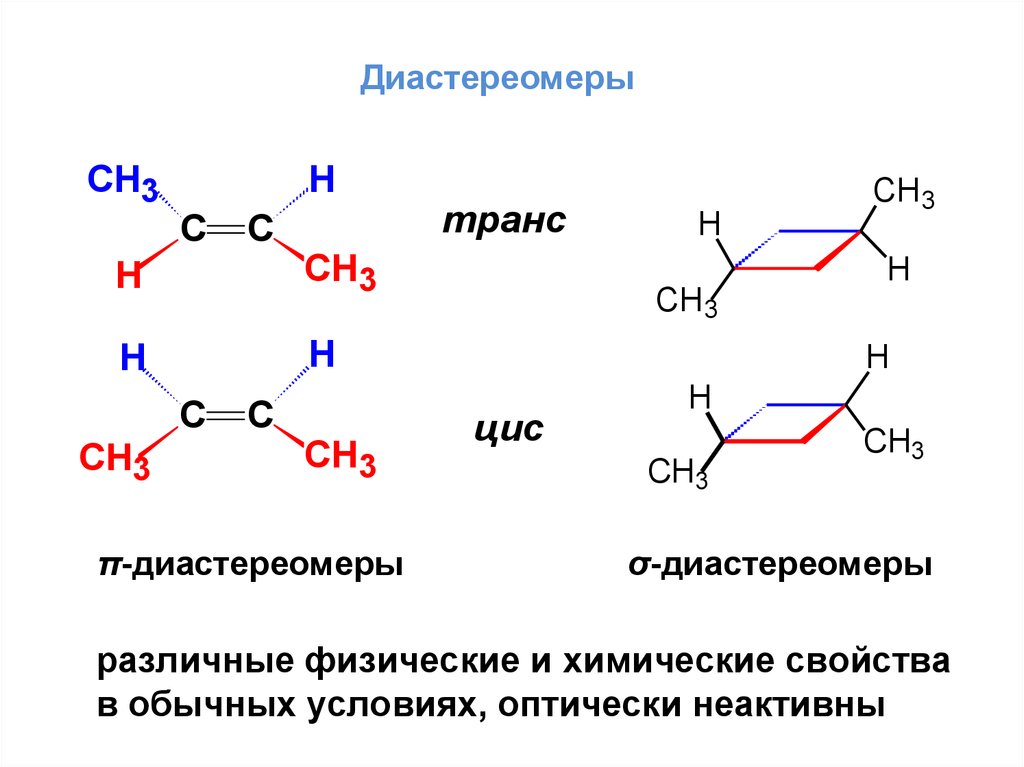
29.
ДиастереомерыСН3
Н
С
С
Н
СН3
Н
Н
С
СН3
С
СН3
π-диастереомеры
транс
H
CH3
CH3
H
H
цис
H
CH3
CH3
σ-диастереомеры
различные физические и химические свойства
в обычных условиях, оптически неактивны
30.
Хиральность – свойство объекта не совпадать сосвоим зеркальным отражением
Асимметрический атом углерода
– атом углерода, связанный с
четырьмя различными
заместителями
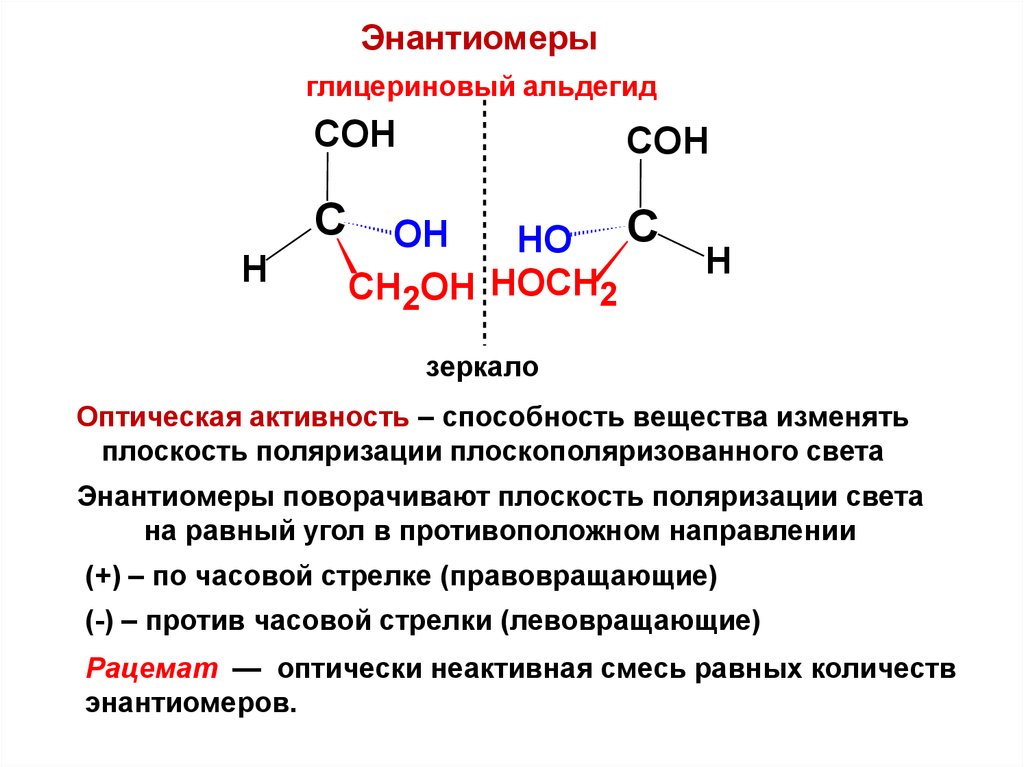
31.
Энантиомерыглицериновый альдегид
СОН
С
Н
СОН
ОН
НО С
СН2ОН НОСН2
Н
зеркало
Оптическая активность – способность вещества изменять
плоскость поляризации плоскополяризованного света
Энантиомеры поворачивают плоскость поляризации света
на равный угол в противоположном направлении
(+) – по часовой стрелке (правовращающие)
(-) – против часовой стрелки (левовращающие)
Рацемат — оптически неактивная смесь равных количеств
энантиомеров.
32.
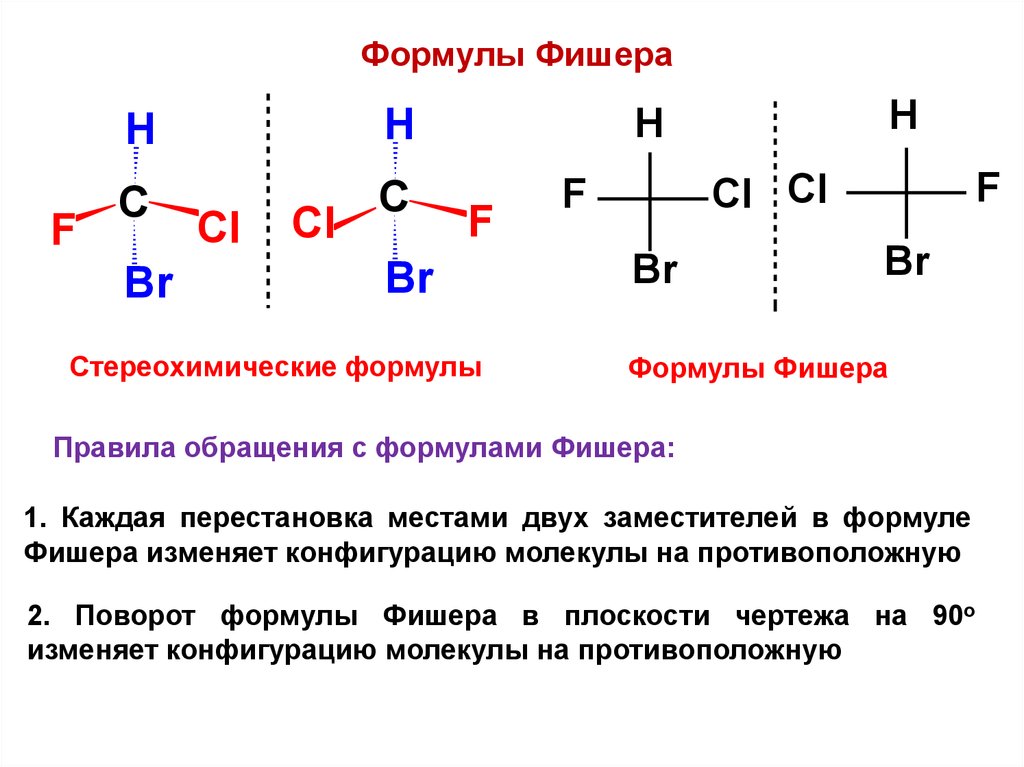
Формулы ФишераF
Н
Н
С
С
Br
Сl
Сl
Н
Н
F
Br
Стереохимические формулы
F
Сl Сl
F
Br
Br
Формулы Фишера
Правила обращения с формулами Фишера:
1. Каждая перестановка местами двух заместителей в формуле
Фишера изменяет конфигурацию молекулы на противоположную
2. Поворот формулы Фишера в плоскости чертежа на 90о
изменяет конфигурацию молекулы на противоположную
33.
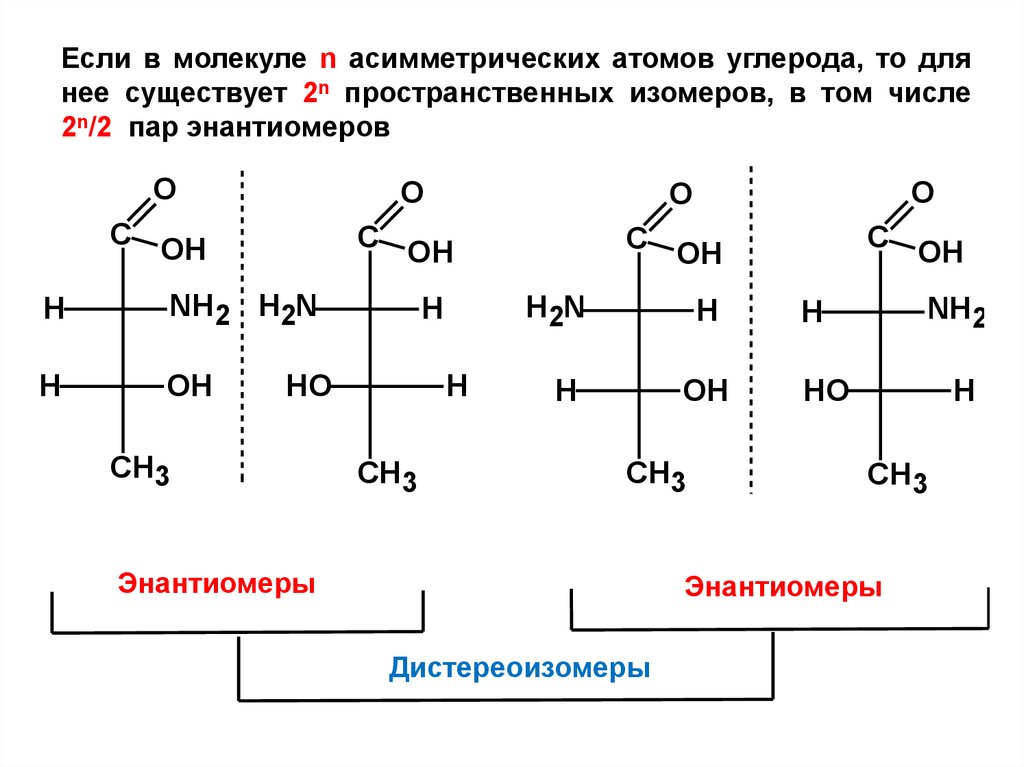
Если в молекуле n асимметрических атомов углерода, то длянее существует 2n пространственных изомеров, в том числе
2n/2 пар энантиомеров
O
O
O
O
С ОН
С ОН
С ОН
С ОН
H
NH2 Н2N
H
OH
НO
СН3
Н2N
H
H
СН3
H
H
OH
СН3
Энантиомеры
NH2
H
НO
H
СН3
Энантиомеры
Дистереоизомеры
34.
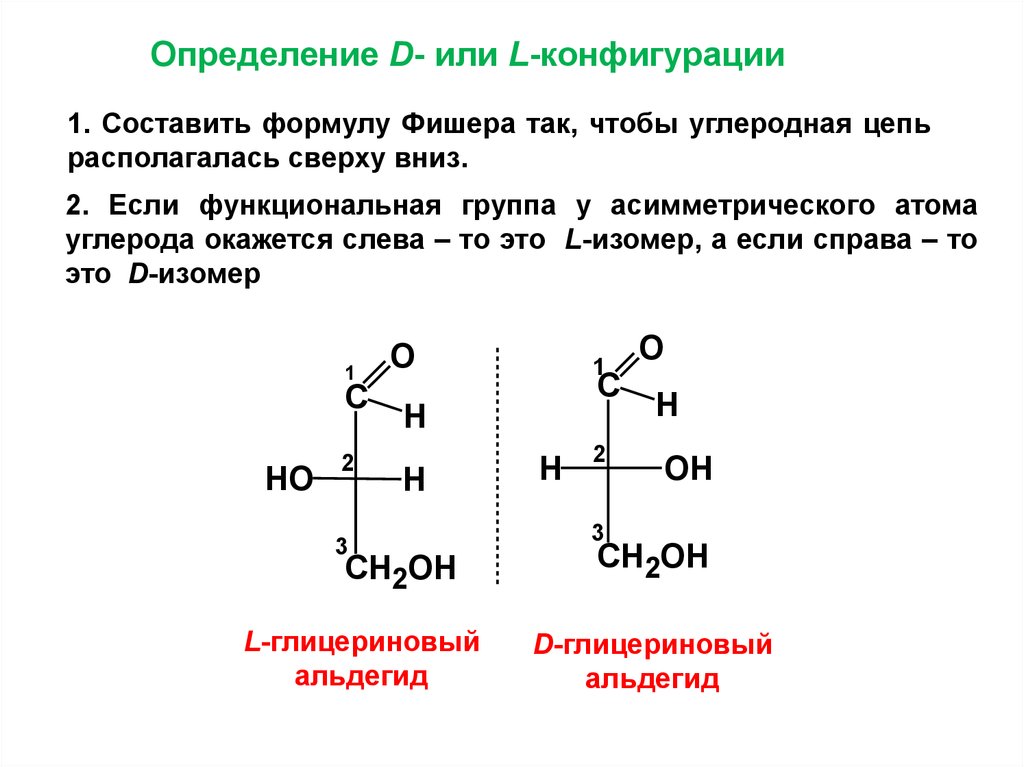
Определение D- или L-конфигурации1. Составить формулу Фишера так, чтобы углеродная цепь
располагалась сверху вниз.
2. Если функциональная группа у асимметрического атома
углерода окажется слева – то это L-изомер, а если справа – то
это D-изомер
1
С
НО
2
О
1
С
Н
Н
3
СН2ОН
L-глицериновый
альдегид
Н
2
О
Н
ОН
3
СН2ОН
D-глицериновый
альдегид
35.
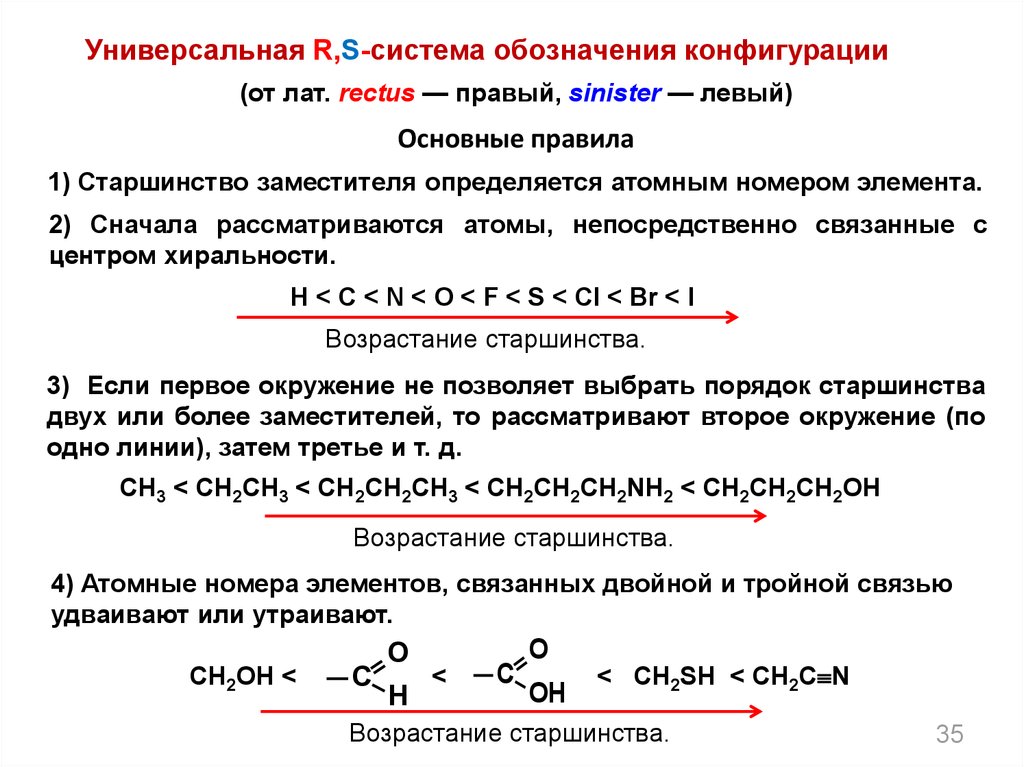
Универсальная R,S-система обозначения конфигурации(от лат. rectus — правый, sinister — левый)
Основные правила
1) Старшинство заместителя определяется атомным номером элемента.
2) Сначала рассматриваются атомы, непосредственно связанные с
центром хиральности.
H < C < N < O < F < S < Cl < Br < I
Возрастание старшинства.
3) Если первое окружение не позволяет выбрать порядок старшинства
двух или более заместителей, то рассматривают второе окружение (по
одно линии), затем третье и т. д.
CH3 < CH2CH3 < CH2CH2CH3 < CH2CH2CH2NH2 < CH2CH2CH2OH
Возрастание старшинства.
4) Атомные номера элементов, связанных двойной и тройной связью
удваивают или утраивают.
CH2OH <
С
O
H
<
С
O
OH
< CH2SH < CH2C N
Возрастание старшинства.
35
36.
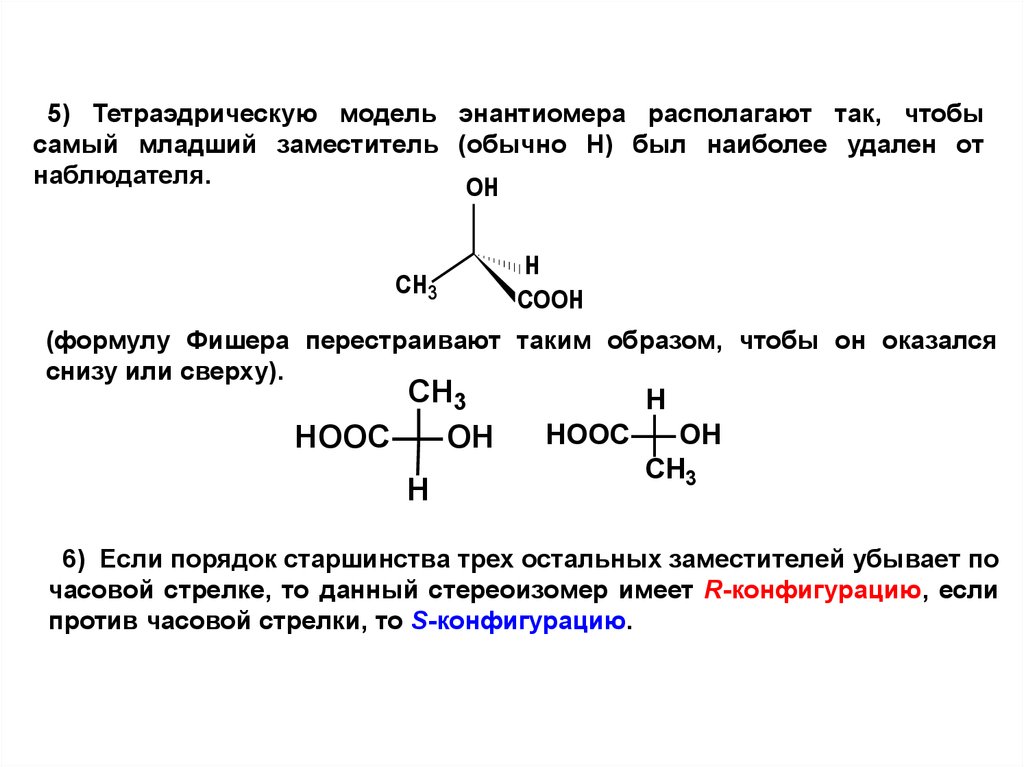
5) Тетраэдрическую модель энантиомера располагают так, чтобысамый младший заместитель (обычно Н) был наиболее удален от
наблюдателя.
OH
CH3
H
COOH
(формулу Фишера перестраивают таким образом, чтобы он оказался
снизу или сверху).
CH3
HOOC
OH
H
H
HOOC
OH
CH3
6) Если порядок старшинства трех остальных заместителей убывает по
часовой стрелке, то данный стереоизомер имеет R-конфигурацию, если
против часовой стрелки, то S-конфигурацию.
37.
Пример: Определение конфигурации по R,S-системеэнантиомеров молочной кислоты и аланина
Молочная кислота СH3*CH(OH)COOH
наблюдатель
OH
OH
H
CH3
COOH
CH3
COOH
падение старшинства по часовой стрелке
(R)-конфигурация
Аланин СH3*CH(NH2)COOH
NH2
H
HOOC
наблюдатель
CH3
NH2
HOOC
CH3
падение старшинства против часовой стрелки
(S)-конфигурация
37
38.
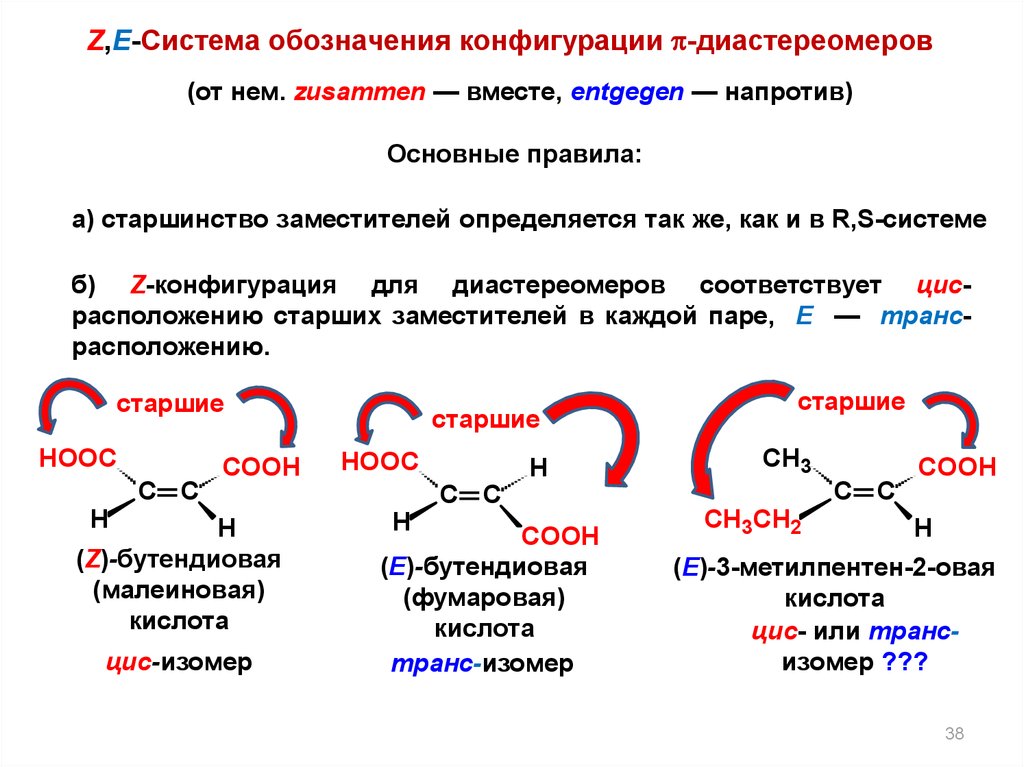
Z,E-Система обозначения конфигурации -диастереомеров(от нем. zusammen — вместе, entgegen — напротив)
Основные правила:
а) старшинство заместителей определяется так же, как и в R,S-системе
б) Z-конфигурация для диастереомеров соответствует цисрасположению старших заместителей в каждой паре, E — трансрасположению.
старшие
HOOC
C C
COOH
H
H
(Z)-бутендиовая
(малеиновая)
кислота
цис-изомер
старшие
HOOC
H
старшие
CH3
C C
C C
H
COOH
(E)-бутендиовая
(фумаровая)
кислота
транс-изомер
COOH
CH3CH2
H
(E)-3-метилпентен-2-овая
кислота
цис- или трансизомер ???
38
39.
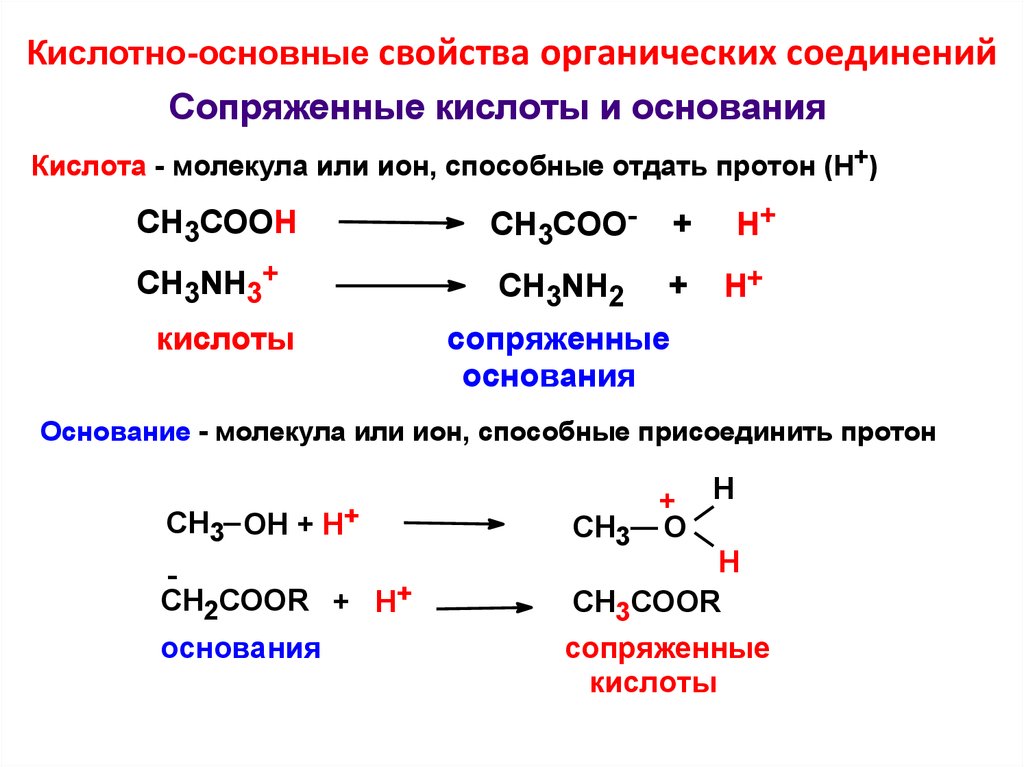
Кислотно-основные свойства органических соединенийСопряженные кислоты и основания
Кислота - молекула или ион, способные отдать протон (Н+)
СН3СООН
СН3СОО-
+
CH3NH3+
CH3NH2
+
кислоты
Н+
H+
сопряженные
основания
Основание - молекула или ион, способные присоединить протон
СН3 ОН + Н+
CH2COOR + H+
основания
+ H
СН3 O
H
CH3COOR
сопряженные
кислоты
40.
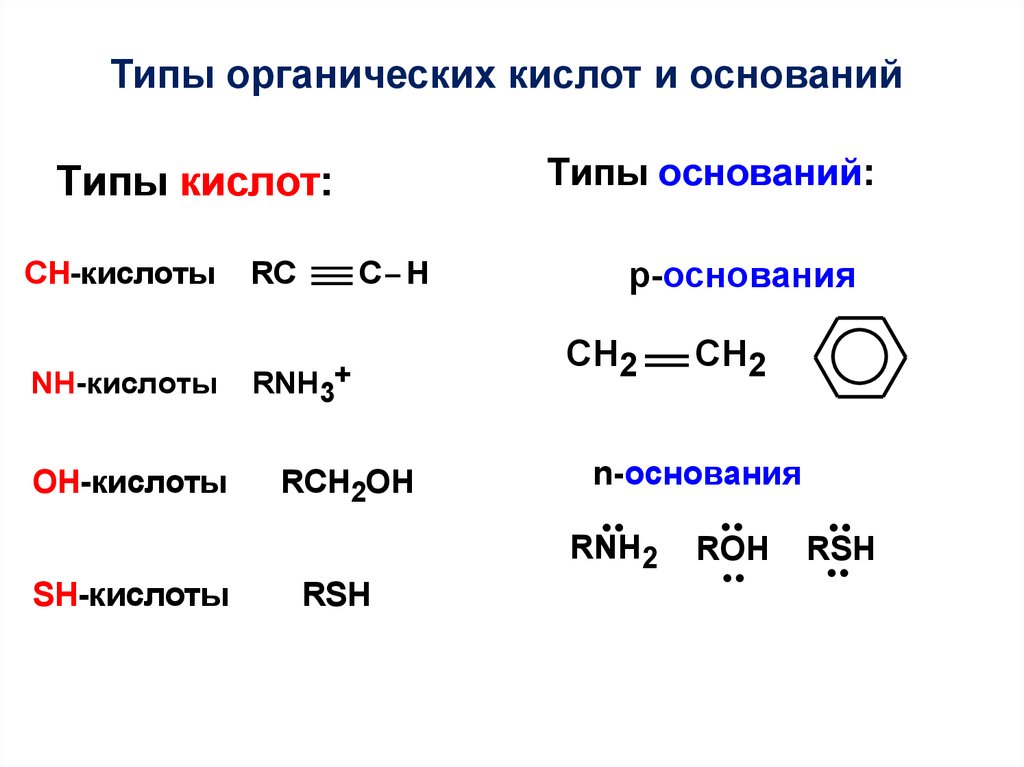
Типы органических кислот и основанийТипы оснований:
Типы кислот:
СН-кислоты
RC
NH-кислоты
RNH3+
OH-кислоты
C H
RCH2OH
p-основания
СН2
n-основания
RNH2
SH-кислоты
RSH
СН2
ROH
RSH
41.
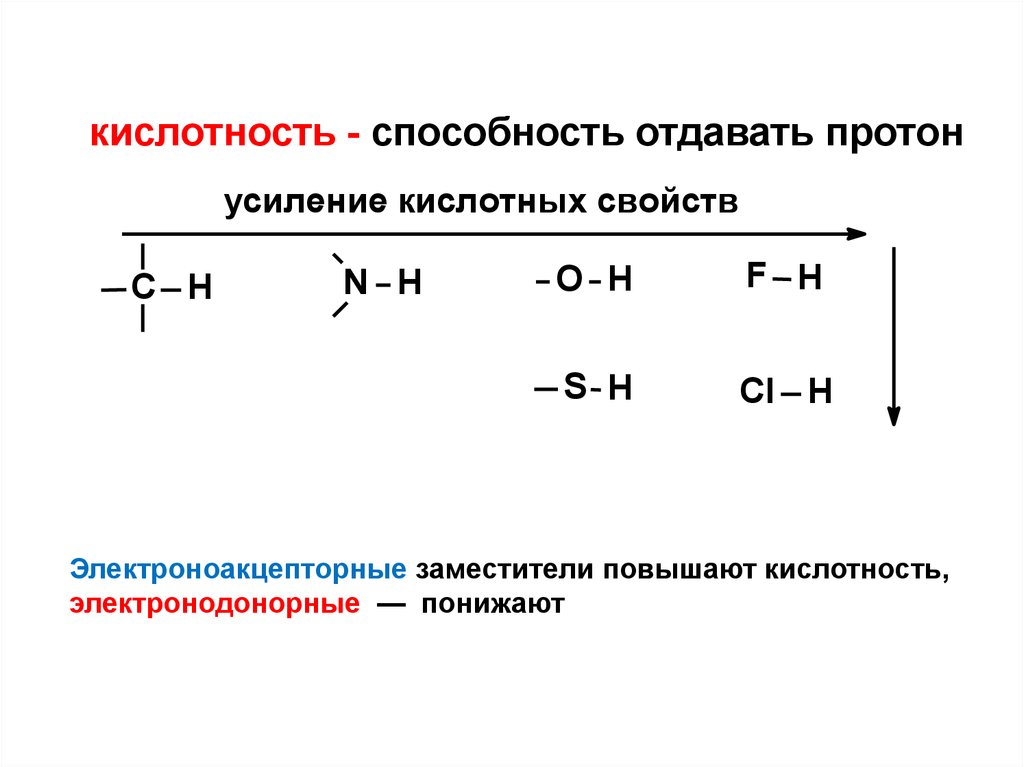
кислотность - способность отдавать протонусиление кислотных свойств
C H
N H
O H
F H
S H
Cl H
Электроноакцепторные заместители повышают кислотность,
электронодонорные — понижают
42.
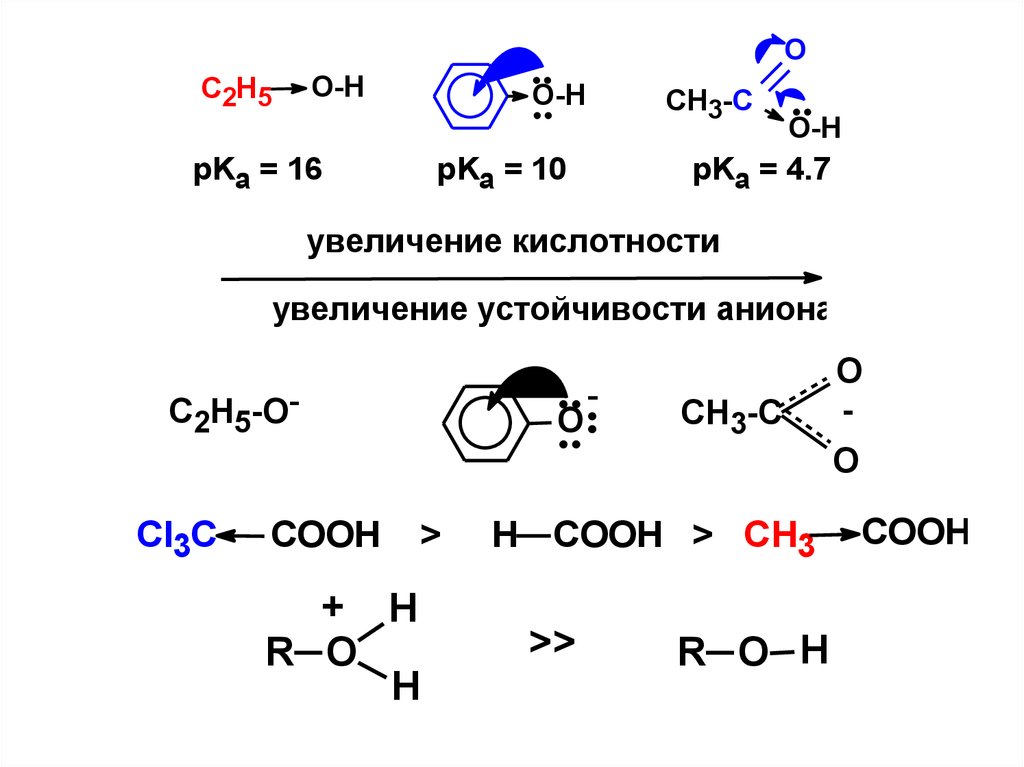
OC2H5
O-H
O-H
pKa = 16
CH3-C
pKa = 10
O-H
pKa = 4.7
увеличение кислотности
увеличение устойчивости аниона
С2Н5-О-
Cl3C
COOH
О
>
+ H
R O
H
-
СН3-С
H COOH > CH3
>>
R O H
О
О
COOH
43.
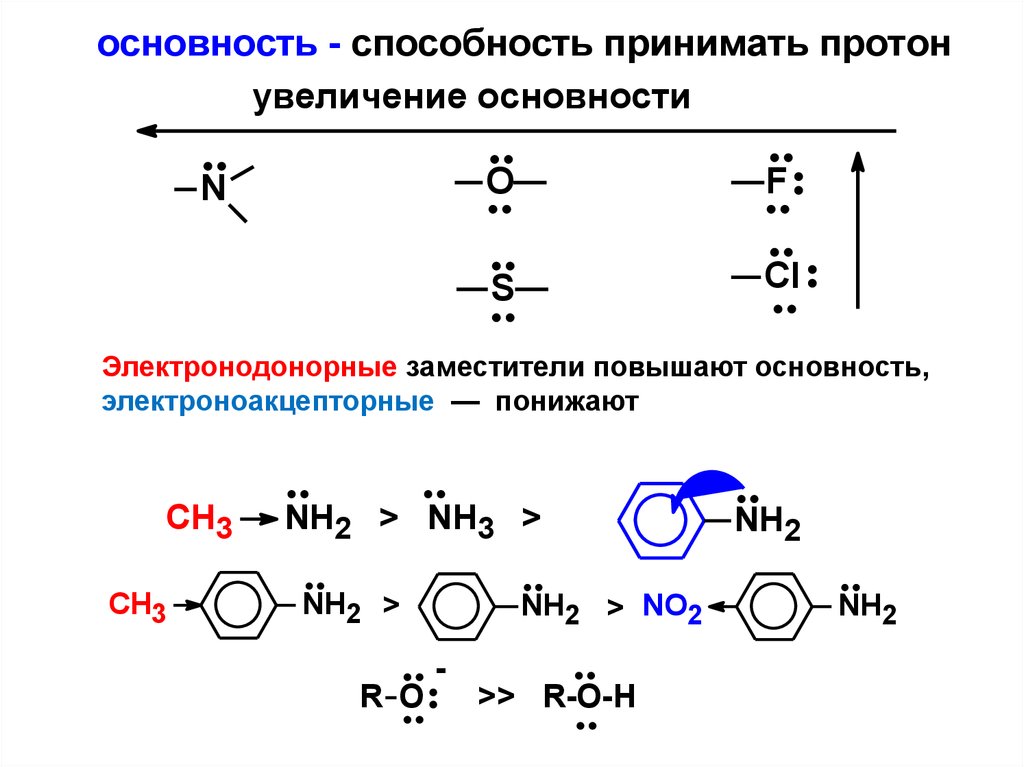
основность - способность принимать протонувеличение основности
N
O
F
S
Cl
Электронодонорные заместители повышают основность,
электроноакцепторные — понижают
CH3
CH3
NH2 > NH3 >
NH2 >
R O
NH2 > NO2
-
>> R-O-H
NH2
NH2
44.
Кислоты и основания по Льюису(перенос пары электронов)
Кислоты Льюиса — акцепторы пары электронов ─
частицы с
вакантной орбиталью, способные дополнить свою электронную
оболочку парой электронов: H+, Ag+, BF3, AlCl3, SO3, R3C+.
Основания Льюиса — доноры пары электронов ─ тождественны
основаниям Брёнстеда; пара электронов может быть неподеленной парой
(n-основания) или принадлежать -связи ( -основания).
Взаимодействие n-оснований Льюиса с кислотами Льюиса
n-Основания
(CH3)3N
(C2H5)2O
R Br
Кислоты
+
+
+
n-Комплексы
BF3
+
(CH3)3N
AlCl3
+
(C2H5)2O
FeBr3
BF3
AlCl3
+
R Br FeBr3
40















 Биология
Биология Химия
Химия








